Tom 10 • Numer 1 • Czerwiec 2023

KOMITET REDAKCYJNY
Redaktor naczelny:
Redaktor naczelny:dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego: prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:dr hab. n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:dr hab. n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst, Republika Południowej Afryki (Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga, Dania (Copenhagen, Denmark)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Zakład Histologii i Biologii Rozwoju Wydział Nauk o Zdrowiu Pomorski Uniwersytet Medyczny w Szczecinie 71-210 Szczecin ul. Żołnierska 48 tel. 91 48 00 917, 91 48 00 908 e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Waldemar Jachimczak
Małgorzata Piasecka
Kamil Gill
Korekta języka polskiego:
Małgorzata Piasecka
Kamil Gill
Korekta języka angielskiego:Joanna Ingielewicz
Małgorzata Piasecka
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI CONTENTS
O czasopiśmie / About Journal 4 Artykuły poglądowe / Review Monika Frączek, Maciej Kurpisz Infekcja i szczepionka przeciw SARS-CoV-2 – wpływ na zdrowie reprodukcyjne i układ płciowy męski SARS-CoV-2 infection and vaccination – influence on reproductive health and male genital tract 6 Marika Freus, Agnieszka Kolasa Finasteryd a płodność męska oraz jego międzypokoleniowe konsekwencje – przegląd literatury Finasteride and male fertility and its transgenerational consequences – a literature review 24 Instrukcje dla autorów / Instructions for authors 38
O CZASOPIŚMIEABOUT THE JOURNAL
Wersja elektroniczna czasopisma jest wersją pierwotną. Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.The electronic version of the journal is a original version. Access to scientific information published in the journal is free and unlimited (Open Access).
Zaburzenia męskiego układu płciowego dotyczą osób w różnym wieku i w większości przypadków prowadzą do niepłodności, która nabrała już rangi choroby cywili-zacyjnej. Najczęściej identyfikowanymi nieprawidłowo-ściami są hipogonadyzm, zaburzenia seksualne, wady rozwojowe narządów płciowych, nowotwory jąder i pro-staty. Ze względu na specyficzne i coraz bardziej zanie-czyszczone środowisko antropogeniczne dotyczą one głównie społeczeństw rozwiniętych, w tym również Polski, i stanowią istotny oraz narastający problem medyczny, społeczny, demograficzny, a także zdrowia publicznego. Nauka, która zajmuje się fizjologią i zabu-rzeniami męskiego układu płciowego w aspekcie nauk podstawowych i klinicznych, to andrologia. Ponieważ jest to młoda dziedzina nauki, jeszcze do niedawna nie-zadowalający stan wiedzy ograniczał możliwości diagno-styki oraz leczenia zaburzeń męskiego układu płciowego. Jednak w ostatnich latach obserwuje się niezwykle dyna-miczny rozwój andrologii, szczególnie molekularnej, spo-wodowany wprowadzeniem nowych metod badawczych z zakresu biochemii, biologii i genetyki molekularnej. Andrologia staje się dziedziną interdyscyplinarną integru-jącą wiedzę z różnych dyscyplin medycznych i naukowych. Informacje związane z tymi zagadnieniami z trudem docierają do lekarzy i osób zainteresowanych w naszym kraju, ponieważ jest niewiele literatury w języku polskim, a wykłady wygłaszane podczas konferencji nie zawsze wyczerpująco wyjaśniają wątpliwości dotyczące m.in. postępowania diagnostycznego, terapeutycznego, reko-mendacji czy też proponowanych algorytmów. Stąd też potrzeba stworzenia czasopisma prezentującego wiedzę andrologiczną lekarzom różnych specjalności, diagno-stom laboratoryjnym i przedstawicielom nauk podstawo-wych. Czasopismo „Postępy Andrologii Online” powstało z inicjatywy Polskiego Towarzystwa Andrologicznego, które zainteresowane jest integracją środowiska osób zajmujących się różnymi aspektami męskiego układu płciowego, uzupełnieniem i poszerzeniem ich wiedzy, a także poprawą opieki zdrowotnej nad mężczyznami w naszym kraju.Celem czasopisma jest: 1) dostarczenie istotnych informacji na temat fizjologii i patologii męskiego układu płciowego, 2) propagowanie praktycznej wiedzy andro-logicznej kierowanej do szerokich kręgów odbiorców, 3) wymiana poglądów i opinii na temat zagadnień kli-nicznych oraz wyników badań doświadczalnych oraz 4) przekazywanie informacji dotyczących konferencji i kursów o tematyce andrologicznej. Proponowana tematyka czasopisma to: 1) andrologia kliniczna z uwzględnieniem etiopatogenezy, diagno-styki i leczenia m.in. zaburzeń rozwojowych, niepłod-ności i procesów starzenia mężczyzn, 2) nowatorskie metody diagnostyczne, 3) andrologia doświadczalna rozwijająca się w oparciu o nauki podstawowe oraz 4) inne interdyscyplinarne tematy związane z dzie-dziną andrologii. Czasopismo kierowane jest do lekarzy specjalności bezpośrednio lub pośrednio związanych z andrologią, m.in. urologów, endokrynologów, ginekologów, pedia-trów, ale także do lekarzy rodzinnych spotykających się z coraz częstszym problemem niepłodności partnerskiej i problemami starzejących się mężczyzn. Ponadto naszą intencją jest zdobycie zainteresowania diagnostów labo-ratoryjnych odgrywających istotną rolę w prawidłowym postępowaniu terapeutycznym opartym na szerokim panelu testów i badań, których wdrożenie wciąż wymaga odpowiednich i wyczerpujących szkoleń z diagnostyki andrologicznej, w tym seminologicznej. Mamy nadzieję, że nasze czasopismo wzbudzi również zainteresowanie biologów zajmujących się czynnością męskiego układu płciowego w ramach nauk podstawowych, a także lekarzy weterynarii oraz innych osób, które znajdą informacje poszerzające ich wiedzę i kształtujące opinię z zakresu szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac orygi-nalnych, kazuistycznych i krótkich komunikatów, jak również prac poglądowych, opracowanych w konden-sacyjnej, dydaktycznej i przystępnej formie. W pracach tych autorzy powinni przedstawiać aktualny stan wiedzy światowej oraz swoje opinie. Chcemy, aby czasopismo spełniało rolę informatora i przewodnika w dziedzinie andrologii oraz stanowiło forum dyskusyjne. Ponadto, zapraszamy do publikowania artykułów będących tłumaczeniem publikacji ukazujących się w języku angiel-skim, które przedstawiają istotne postępy w andrologii. http://www.postepyandrologii.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska -Hilczer
viceprzewodnicząca
Polskiego Towarzystwa Andrologicznego
Disorders of the male reproductive system relate to people of different ages and in most cases lead to infer-tility, which has already acquired a rank of a disease associated with the progress of civilization. The most frequently identified irregularities are hypogonadism, sexual dysfunction, genital malformations, testicular or prostate cancer. Due to the specific and increasingly pol-luted anthropogenic environment they concern mainly developed societies, including Poland, and are an impor-tant and growing medical, social, demographic and public health problem. A science that deals with the physiology and with disorders of the male reproductive system in terms of the basic and clinical science is andrology. As this is a young field of science, until recently an unsatis-factory state of knowledge limited the possibilities of the diagnostics and treatment of the disorders of the male reproductive system. However, in recent years there has been a very dynamic development of andrology, espe-cially in the molecular aspect, due to the introduction of new methods of research in the field of biochemistry, biology and molecular genetics. Andrology is becoming an interdisciplinary field which integrates knowledge from various medical and scientific disciplines. Information related to these issues reach doctors and interested people in our country with difficulty, because there is few publi-cations in Polish. Lectures given during conferences also do not always fully explain the doubts concerning diag-nostic and therapeutic proceedings, recommendations or proposed algorithms. Hence, the need for a journal presenting the knowledge of andrology to the doctors of various specialties, laboratory diagnosticians and repre-sentatives of the basic science. The journal „Progress in Andrology Online” is an initiative of the Polish Society of Andrology, which is interested in the integration of people involved in different aspects of the male repro-ductive system, supplement and broadening their knowl-edge, as well as the improvement of health care for men in our country.The aim of the journal is: 1) to provide relevant information about the physiology and pathology of the male reproductive system, 2) the promotion of practical andrological knowledge directed to broad audiences, 3) to exchange views and opinions on issues of clinical and experimental results, and 4) to provide information on conferences and courses on the subject of andrology. The proposed themes of the journal are: 1) clinical andrology including etiopathogenesis, diagnostics and treatment of developmental disorders, infertility and men’s aging, 2) innovative diagnostic methods, 3) experi-mental andrology developing on the basis of the basic sciences and 4) other interdisciplinary topics related to the field of andrology.The journal is directed to physicians with specialty directly or indirectly related to andrology, including urologists, endocrinologists, gynecologists, pediatri-cians, but also to family doctors facing the increasingly common problem of couple infertility and problems of aging men. Moreover, our intention is to get the interest of laboratory diagnosticians playing an important role in keeping the correct therapeutic proceedings, based on a broad panel of tests and studies. Their implementa-tion still requires proper and comprehensive training in andrological diagnostics, including seminological one.We hope that our magazine will also raise the interest of biologists dealing with the functions of the male repro-ductive system in the framework of basic sciences, as well as veterinarians and others who will find informa-tion expanding their knowledge and shaping opinion in the range of broad sciences of andrology. We encourage you to publish original papers, case reports and short announcements, as well as review papers, worked out in the concentrated, didactic and accessible form. In these articles authors should present the current state of the global knowledge as well as their own opinions. We want the journal to act as an informer and a guide in the field of andrology and become a forum for discussion. In addi-tion, we invite you to publish articles that are transla-tions of publications appearing in the English language, which present significant progress in andrology.
Małgorzata Piasecka
Editor in chief
Jolanta Słowikowska -Hilczer
Presidentof Polish Society of Andrology
INFEKCJA I SZCZEPIONKA PRZECIW SARS-COV-2 – WPŁYW NA ZDROWIE REPRODUKCYJNE I UKŁAD PŁCIOWY MĘSKI
Monika Frączek *, Maciej Kurpisz *
Instytut Genetyki Człowieka Polskiej Akademii Nauk
*Autorzy do korespondencji: Monika Frączek, Maciej Kurpisz, Instytut Genetyki Człowieka Polskiej Akademii Nauk,
ul. Strzeszyńska 32, 60-479 Poznań
tel. +48 61 65 79 231 (M.F.), +48 61 65 79 202 (M.K.)
e-mail: monika.fraczek@igcz.poznan.pl; maciej.kurpisz@igcz.poznan.pl
Otrzymano/received: 27.04.2023 r. Zaakceptowano/accepted: 22.08.2023 r.
DOI: 10.26404/PAO_2353-8791.2023.01
Monika Frączek – dr hab. n. med., absolwentka Oddziału Analityki Medycznej Akademii Medycznej
im. Karola Marcinkowskiego w Poznaniu. Od 2018 r. profesor w Instytucie Genetyki Człowieka
Polskiej Akademii Nauk w Poznaniu. Pierwszy autor i współautor 55 publikacji naukowych o zasięgu
międzynarodowym (ponad 1180 cytowań). Kierownik i wykonawca w 11 projektach badawczych
dotyczących biochemicznego, immunologicznego i molekularnego podłoża niepłodności męskiej,
uwarunkowanej wpływem, zarówno czynników środowiskowych, jak i genetycznych. Laureatka
nagród za oryginalne prace badawcze przyznane przez Amerykańskie Towarzystwo Andrologiczne
i Europejskie Towarzystwo Immunologii Rozrodu. Członek Zarządu Głównego Towarzystwa Biologii Rozrodu,
członek Polskiego Towarzystwa Andrologicznego, Międzynarodowego Towarzystwa Andrologicznego, Polskiego
Towarzystwa Immunologii Doświadczalnej i Klinicznej, Grupy F1000, Krajowej Izby Diagnostów Laboratoryjnych.
Ekspert w Programie Międzylaboratoryjnej Kontroli Jakości Badania Nasienia SpermControl. Organizator wielu
wydarzeń popularnonaukowych propagujących wiedzę z zakresu biologii plemnika.
Monika Frączek – PhD, DSc, graduated from Laboratory Medicine at the Poznan University of Medical Sciences.
Since 2018, professor at the Institute of Human Genetics, Polish Academy of Sciences in Poznan, Poland. The first
author and co-author of 55 international scientific publications (over 1180 citations). Principal investigator or inve-
stigator in 11 research grant projects on the biochemical, immunological and molecular basis of various types of
male infertility caused by both environmental and genetic factors. Awarded by the American Society of Andrology
and European Society of Reproductive Immunology for original research. Member of the Main Board of the Society
for Reproductive Biology, member of the Polish Society of Andrology, International Society of Andrology, Polish
Society of Experimental and Clinical Immunology, F1000 Group, National Chamber of Laboratory Diagnosticians.
Expert in the SpermControl Interlaboratory Semen Test Quality Control Program. Organizer of many creative
events promoting popular science education in the field of sperm biology
STRESZCZENIE
Ponad trzy lata pandemii COVID-19 przyniosły dużą liczbę prac klinicznych, potwierdzających możliwy udział infekcji COVID-19
w etiologii zaburzeń płodności. Jakkolwiek badania wskazują na zwiększony tropizm wirusa SARS-CoV-2 do układu płciowego męskiego,
w szczególności do gonady męskiej, nadal nie jest znana jednoznaczna odpowiedź na pytanie, czy obserwowane pogorszenie jakości
nasienia u mężczyzn, zwłaszcza w pierwszych trzech miesiącach po przebyciu infekcji COVID-19, jest bezpośrednią konsekwencją
aktywnego zakażenia komórek męskiego układu płciowego przez wirus SARS-CoV-2 czy pośrednim efektem uogólnionego i lokalnego,
procesu zapalnego, będącego odpowiedzią organizmu na czynnik infekcyjny. Niniejszy artykuł jest pierwszym obszernym opracowa-
niem przekrojowym w piśmiennictwie polskim, który podsumowuje aktualną wiedzę naukową, popartą doświadczeniem klinicznym,
na temat potencjalnych mechanizmów patogenetycznych samej infekcji, a także wpływu następstw szczepień przeciw COVID-19
na zdrowie reprodukcyjne mężczyzn. Autorzy są świadomi potrzeby dalszych wnikliwych badań naukowych i długofalowych obser-
wacji klinicznych na ostateczne wnioski dotyczące wpływu infekcji COVID-19 na rozrodczość.
Słowa kluczowe: SARS-CoV-2, układ płciowy męski, szczepionka przeciw SARS-CoV-2
SKRÓTY
ACE2 – enzym konwertujący angiotensynę 2 (ang. angiotensin converting enzyme type 2); ADAM17 – białko zawierające domenę dezinte-
gryny i metaloproteinazy 17 (ang. a disintegrin and metalloproteinase 17); ANPEP – aminopeptydaza alanylowa typu N (ang. alanyl aminopep-
tidase N); ASA – przeciwciała przeciwplemnikowe (ang. antisperm antibodies); CD147 – basigina (ang. basigin); COVID-19 – choroba koro-
nawirusowa 2019 (ang. coronavirus deasese 2019); CRP – białko C-reaktywne (ang. C-reactive protein); DPP-4 – peptydaza dipeptydylowa 4
(ang. dipeptidyl peptidase-4); E – białko osłonki (ang. envelope protein); FSH – hormon folikulotropowy (ang. follicle-stimulating hormone);
GRP78 – białko regulowane glukozą 78 (ang. glucose-regulated protein); HIV – ludzki wirus niedoboru odporności (ang. human immunodefi-
ciency virus); HPG – oś podwzgórze–przysadka–jądro (ang. hypothalamic–pituitary–gonadal axis); HR – powtórzenia heptadowe (ang. heptad
repeats); IFN-γ – interferon gamma (ang. interferon gamma); IL – interleukina (ang. interleukin); LH – hormon luteinizujący (ang. luteinizing
hormone); M – białko błonowe (ang. membrane protein); MAR – mieszany test antyglobulinowy (ang. mixed antiglobulin reaction); MCP-1 –
chemotaktyczne białko monocytów 1 (ang. monocyte chemoattractant protein 1); MERS-CoV – koronawirus bliskowschodniego zespołu
ostrej niewydolności oddechowej (ang. Middle East severe acute respiratory syndrome – coronavirus); N – białko nukleokapsydu (ang. nucle-
ocapsid); PET/CT – pozytronowa tomografia emisyjna sprzężona z tomografią komputerową (ang. positron emission tomography/computed
tomography); RAAS – układ renina–angiotensyna–aldosteron (ang. renin–angiotensin–aldosterone system); RT-PCR – reakcja łańcuchowa
polimerazy w czasie rzeczywistym (ang. real time polymerase chain reaction); S – białko kolca (ang. spike protein); SARS-CoV – koronawirus
zespołu ostrej niewydolności oddechowej (ang. severe acute respiratory syndrome – coronavirus); SARS-CoV-2 – koronawirus zespołu ostrej
niewydolności oddechowej 2 (ang. severe acute respiratory syndrome – coronavirus-2); scRNA-seq – sekwencjonowanie pojedynczych komórek
(ang. single-cell RNA sequencing); SHGB – globulina wiążąca hormony płciowe (ang. sex hormone binding globulin); T – testosteron (ang. testo-
sterone); TEM – transmisyjny mikroskop elektronowy (ang. transmission electron microscopy); TGF-β1 – transformujący czynnik wzrostu
beta 1 (ang. transforming growth factor beta 1); TMPRSS – podrodzina białek przezbłonowych proteazy serynowej (ang. transmembrane pro-
tease serine subfamily); TMPRSS2 – przezbłonowa proteaza serynowa 2 (ang. transmembrane protease, serine 2); TMPRSS4 – przezbłonowa
proteaza serynowa 4 (ang. transmembrane protease, serine 4); TMPRSS11D – przezbłonowa proteaza serynowa 11D (ang. transmembrane
protease, serine 11D); TMPRSS13 – przezbłonowa proteaza serynowa 13 (ang. transmembrane protease, serine 13); TNF-α – czynnik wzrostu
nowotworów alfa (ang. tumor necrosis factor alpha)
Wirus SARS-CoV-2 – pochodzenie,
budowa, mechanizm zakażenia
Niedawno odkryty koronawirus zespołu ostrej nie-
wydolności oddechowej 2 (SARS-Cov-2, ang. severe
acute respiratory syndrome – coronavirus-2), wywołujący
chorobę koronawirusową 2019 (COVID-19, ang. coro-
navirus deasese 2019), jest siódmym odzwierzęcym
koronawirusem, który może infekować człowieka, jed-
nocześnie trzecim, który może przenosić się bezpo-
średnio z człowieka na człowieka i wywoływać ciężkie
objawy ze strony układu oddechowego
(Helmy i wsp.,2020)
. Od momentu wykrycia pierwszego przypadku
COVID-19 w grudniu 2019 roku, w Wuhan we wschod-
nich Chinach do chwili obecnej, liczba osób, u których
potwierdzono infekcję wirusem SARS-CoV-2 przekro-
czyła na świecie 763 mln
novel-coronavirus-2019
(https://www.who.int/emer-
gencies/diseases/novel-coronavirus-2019; data wejścia:
25.04.2023 r.). Wirus SARS-CoV-2 jest retrowirusem
i należy do rodzaju Betacoronavirus i podobnie jak inne
koronawirusy z tej grupy jest wirusem otoczkowym,
ma kształt kulisty lub owalny o średnicy od 80–120 nm.
Nowy koronawirus jest zbliżony genetycznie do koro-
nawirusa zespołu ostrej niewydolności oddechowej
(SARS-CoV, ang. severe acute respiratory syndrome – coro-
navirus) oraz koronawirusa bliskowschodniego zespołu
ostrej niewydolności oddechowej (MERS-CoV, ang. Middle
East severe acute respiratory syndrome – coronavirus), koro-
nawirusów, które były odpowiedzialne, odpowiednio
za epidemię SARS w latach 2002–2003 i epidemię MERS
w 2012 roku
(Gralinski i Menachery, 2020)
(Gralinski i Menachery, 2020). Genom wirusa
SARS-CoV-2 stanowi jednoniciowy RNA o silnej dodat-
niej polarności i charakteryzuje się wysoką zmiennością
sekwencji. Strukturę wirionu tworzą cztery główne białka
tj. ufosforylowane białko nukleokapsydu (N, ang. nucle-
ocapsid) oraz trzy glikoproteiny budujące otoczkę wirusa,
które stanowią białko błonowe (M, ang. membrane), białko
osłonki (E, ang. envelope) oraz białko powierzchniowe
w kształcie kolców (S, ang. spike). Oprócz białek struk-
turalnych genom wirusa SARS-CoV-2 koduje również
16 białek niestrukturalnych, zaangażowanych w proces
replikacji i 7 białek pomocniczych, które ułatwiają inte-
rakcje wirusa z komórką gospodarza
(Kuczyńska i wsp.,
2021).
(Kuczyńska i wsp.,
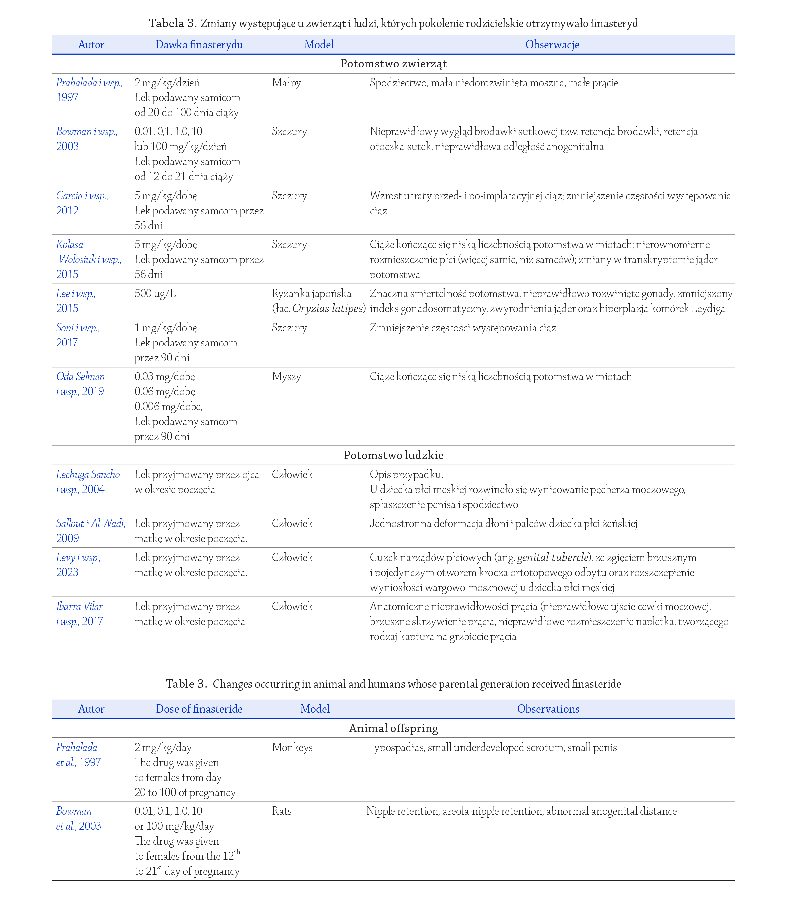
2021). Kluczową rolę w mechanizmie zakażenia odgrywa
białko kolca S otoczki wirusa SARS-CoV-2, którego pod-
jednostka S1 wykazuje powinowactwo do ludzkiego
białka receptorowego, enzymu konwertującego angioten-
synę 2 (ACE2, ang. angiotensin converting enzyme type 2).
Większość badaczy uważa, że do wewnątrzkomórkowej
fuzji osłonki wirusa SARS-CoV-2, niezbędna jest akty-
wacja podjednostki S2 białka kolca na drodze cięcia
enzymatycznego przy udziale receptora przezbłonowej
proteazy serynowej 2 (TMPRSS2, ang. transmembrane
protease, serine 2)
(Hoffmann i wsp., 2020); (Rycina 1).
(Hoffmann i wsp., 2020); (Rycina 1).
Badania eksperymentalne wykazały, że rolę receptorów
dla wirusa SARS-CoV-2 mogą pełnić także białka tj. basi-
gina (CD147; ang. basigin), białko regulowane glukozą 78
(GRP78; ang. glucose-regulated protein) i białko zawierające
domenę dezintegryny i metaloproteinazy 17 (ADAM17;
ang. a disintegrin and metalloproteinase 17)
(Aguiar i wsp.,2020).
(Aguiar i wsp.,2020).
Natomiast do białek aktywujących białko kolca S
i umożliwiających replikację wirusa należą również inne
białka podrodziny TMPRSS tj. TMPRSS4, TMPRSS11D,
TMPRSS13, a także katepsyny i furyna
(Kishimoto
i wsp., 2021) (Rycina 1).
(Kishimoto
i wsp., 2021) (Rycina 1). W organizmie ludzkim, recep-
tory ACE2 i TMPRSS2 naturalnie występują w wielu
tkankach i narządach, choć poziom ich ekspresji wyka-
zuje znaczne zróżnicowanie. Receptor ACE2 reprezento-
wany jest najliczniej w pneumocytach II rzędu płuc (83%
komórek) i enterocytach jelita cienkiego (30% komórek).
Jego wysoką ekspresję wykazano także w sercu (śród-
błonek tętnic wieńcowych, kardiomiocyty, fibroblasty,
adipocyty nasierdziowe) oraz w nerkach (rąbek szczo-
teczkowy kanalików bliższych, kłębuszek nerkowy,
pętla Henlego, kanaliki dalsze i zbiorcze)
(Wang i wsp.,
2020).
(Wang i wsp.,
2020). Z kolei receptor TMPRSS2 jest silnie reprezento-
wanym białkiem powierzchniowym komórek śródbłonka
w drogach oddechowych, pokarmowych, moczowo-płcio-
wych oraz w gruczole krokowym
(Chen i wsp., 2010).
(Chen i wsp., 2010).
Taka szeroka dystrybucja receptorów ACE2 i TMPRSS2
stwarza wysokie ryzyko wniknięcia wirusa SARS-CoV-2
do wielu tkanek i narządów, co wpływa na dynamikę
przebiegu infekcji i może odpowiadać za różnorod-
ność objawów i wielopostaciowość choroby COVID-19.
Chociaż nie ma jednoznacznych dowodów, że płeć może
wpływać na przebieg infekcji SARS-CoV-2, z obserwacji
klinicznych wynika, że u mężczyzn infekcja częściej przy-
biera postać ciężką. Przyczyną tego zjawiska mogą być
różnice na poziomie genetycznym, epigenetycznym, hor-
monalnym i metabolicznym. Wiadomo, że mężczyźni
zazwyczaj wykazują wyższą ekspresję TMPRSS2 niż
kobiety, co związane jest z faktem, że transkrypcja tego
receptora jest regulowana przez receptor androgenowy
(Hoffmann i wsp., 2020).
(Hoffmann i wsp., 2020). Z kolei gen kodujący receptor
ACE2 podlega regulacji hormonalnej (ochronna rola
estrogenów). Dodatkowo, wzrost ekspresji ACE2 czę-
ściej występuje w chorobach współistniejących tj. nadci-
śnienie, nowotwory czy otyłość
(Breidenbach i wsp., 2020).
(Breidenbach i wsp., 2020).
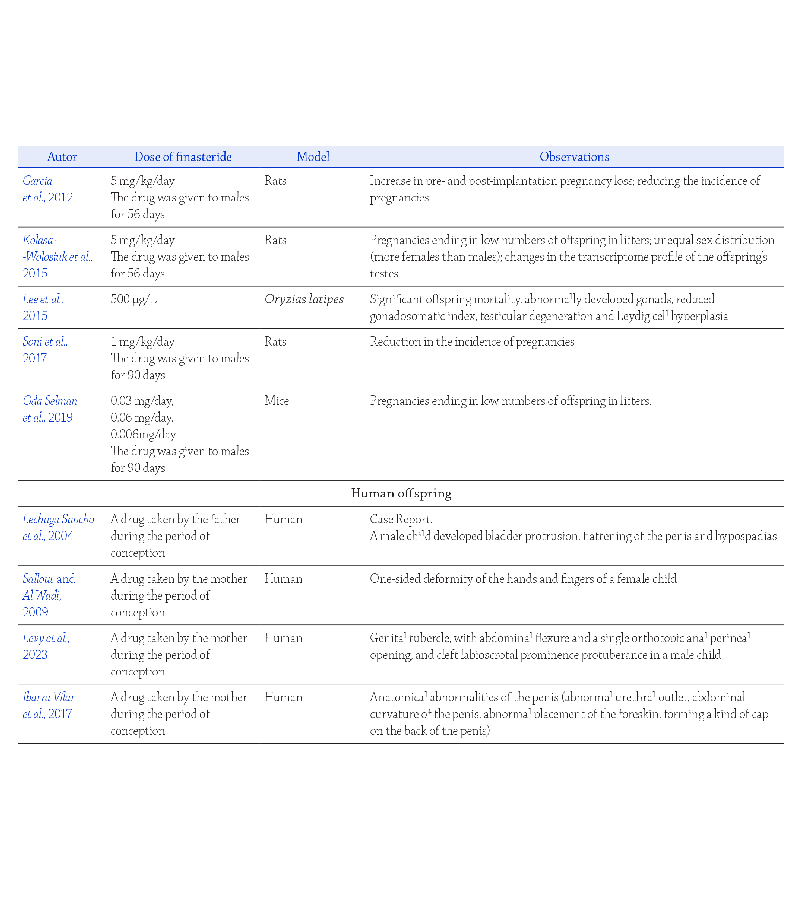
Receptory ACE2 i TMPRSS2
w układzie płciowym męskim
Obecność obu receptorów odgrywających kluczową
rolę w mechanizmie zakażenia SARS-CoV-2, ACE2
i TMPRSS2, potwierdzono w układzie płciowym męskim
(Rycina 2). W przypadku gonady męskiej, dane mole-
kularne dotyczące poziomu ekspresji poszczególnych
receptorów w różnych typach komórek gonady i/lub ich
ko-ekspresji w tych samych komórkach tego narządu
są niejednoznaczne. Przeprowadzona przez
Pan i wsp.
(2020)Pan i wsp.
(2020) oraz
Stanley i wsp. (2000)
Stanley i wsp. (2000) analiza transkryptomu
na poziomie pojedynczej komórki (scRNA-seq, ang.
single-cell RNA sequencing) w jądrach zdrowych młodych
mężczyzn wykazała względnie niską ekspresję receptora
ACE2 i TMPRSS2 i słabą ko-ekspresję obu tych recep-
torów, w różnych komórkach gonady. Z kolei analiza
bioinformatyczna baz danych Gene Expression Omnibus
Gene Expression Omnibus
i Sequence Read
Archive (https://www.ncbi.nlm.nih.gov/sra/)
Sequence Read
, dotyczą-
cych scRNA-seq w komórkach gonad trzech mężczyzn
w wieku reprodukcyjnym wykazała, że receptor ACE2
ulega silnej ekspresji przede wszystkim w komórkach
somatycznych Leydiga i Sertolego oraz w spermatogo-
niach, podczas gdy spermatocyty i spermatydy charak-
teryzują się niską ekspresją tego receptora
a href="http://www.ncbi.nlm.nih.gov/pubmed/32283711" target="_blank"> (Wang
i Xu, 2020).
(Wang i Xu,
2020). Z kolei, najwyższą ekspresję receptora TMPRSS2
wykazano w komórkach germinalnych, w szczególności
w okrągłych i wydłużonych spermatydach oraz w sper-
matogoniach. Uwagę zwraca obserwowana przez autorów
ko-ekspresja obu receptorów na powierzchni pierwotnych
komórek płciowych oraz wydłużonych spermatyd
(Wang
i Xu, 2020).
(Wang
i Xu, 2020). Inna analiza danych scRNA-seq gonad męż-
czyzn zdrowych oraz z azoospermią obstrukcyjną prze-
prowadzona przez
Liu i wsp. (2020)
Liu i wsp. (2020) potwierdziła wysoką
ekspresję ACE2 i niską ekspresję TMPRSS2 w komór-
kach Sertolego, ale wykazała wysoką ekspresję TMPRSS2
i niską ekspresję ACE2 w spermatogoniach. Co więcej,
przeprowadzone analizy ekspresji ACE2 w komórkach
gonady męskiej na poziomie mRNA wskazują na wyższą
ekspresję tego receptora u mężczyzn niepłodnych w sto-
sunku do mężczyzn płodnych, a także na zależność
poziomu ekspresji receptora ACE2 w komórkach jąder
od wieku mężczyzn, wykazując stopniowy jego wzrost
wraz z osiągnięciem dojrzałości płciowej, z apogeum około
30. r.ż., i dalszy spadek ekspresji tego receptora, z bardzo
niskimi poziomami około 60. r.ż.
(Shen i wsp., 2020; Verma
i wsp., 2020).
(Shen i wsp., 2020; Verma
i wsp., 2020).
(Shen i wsp., 2020; Verma
i wsp., 2020). Odkrycia te z jednej strony potwierdzają,
że receptor ACE2 odgrywa rolę w fizjologii płodności
męskiej, z drugiej strony wskazują, że gonada męska
jest narządem wysokiego ryzyka podatnym na infekcję
SARS-CoV-2, zwłaszcza u mężczyzn w wieku repro-
dukcyjnym, jakkolwiek nadal nie mamy pełnej wiedzy
na temat częstotliwości występowania ko-ekspresji
receptorów ACE2 i TMPRSS2 w poszczególnych komór-
kach gonady męskiej, co determinuje wnikanie wirusa
SARS-CoV-2 do komórek gospodarza
(Patel i wsp., 2021).
(Patel i wsp., 2021).
W układzie płciowym męskim ekspresję receptorów
ACE2 i/lub TMPRSS2 potwierdzano również w najądrzu
oraz gruczołach dodatkowych, pęcherzykach nasiennych
i gruczole krokowym
(Massarotti i wsp., 2021) (Rycina 2).
(Massarotti i wsp., 2021) (Rycina 2).
Wyniki analizy bioinformatycznej bazy danych Human
(https://proteinatlas.org)
Protein Atlas (https://proteinatlas.org) sugerują niski
poziom ekspresji receptora ACE2 w komórkach gru-
czołowych pęcherzyków nasiennych oraz bardzo niski
poziom ekspresji tego receptora w komórkach nabłonko-
wych przewodu najądrza i nabłonku komórek gruczoło-
wych prostaty, w przeciwieństwie do ekspresji receptora
TMPRSS2, którego najniższy poziom wykazano w nają-
drzu, wyższy w pęcherzykach nasiennych i najwyższy
w gruczole krokowym
(Patel i wsp., 2021).
(Patel i wsp., 2021). Co więcej, prze-
prowadzona przez
Song i wsp. (2020)
Song i wsp. (2020) analiza scRNA-seq
komórek gruczołu krokowego od zdrowych mężczyzn,
wykazała obecność receptora ACE2 w 0,32%, receptora
TMPRSS2 w 18,65% i ko-ekspresję obu receptorów w <1%
komórek nabłonka gruczołowego tego narządu. Warto
w tym miejscu nadmienić, że ekspresję receptora TMPRSS2
potwierdzono również w prostasomach, organellach
komórkowych produkowanych przez komórki nabłon-
kowe gruczołu krokowego i wydzielanych do nasienia
w trakcie ejakulacji, gdzie pełnią wiele ważnych funkcji
w procesie zapłodnienia (m.in. warunkują prawidłową
ruchliwość ejakulowanych pewników). Ponadto, udoku-
mentowano silną ekspresję TMPRSS2 w komórkach raka
prostaty
Chen i wsp., 2010).
(Chen i wsp., 2010). Biorąc pod uwagę powyższe
dane nie możemy wykluczyć, że gruczoł krokowy może
być potencjalnym miejscem zakażenia SARS-CoV-2
w męskim układzie płciowym. Kontrowersje dotyczące
układu receptorowego dla wirusa SARS-CoV-2 zostaną
omówione w dalszej części pracy, w rozdziale dotyczącym
wpływu szczepionek skierowanych przeciw COVID-19.
Ostatnie badania po raz pierwszy potwierdziły eks-
presję ACE2 na powierzchni ludzkich ejakulowanych
plemników na poziomie białka
(Ramal-Sanchez i wsp.,
2022).
(Ramal-Sanchez i wsp.,
2022). Co więcej, przeprowadzone badania immunoloka-
lizacji ACE2 w mikroskopie elektronowym ujawniły obec-
ność białka ACE2 o pełnej długości (805 aminokwasów)
oraz jego krótkiej izoformy (459 aminokwasów), które
wykazują specyficzne powinowactwo do poszczególnych
regionów plemnika. Wykazano zwiększoną lokalizację
białka ACE2 w rejonie równikowym główki plemnika
i wzrost ekspresji krótkiej izoformy tej proteazy w rejonie
wstawki
(Ramal-Sanchez i wsp., 2022).
(Ramal-Sanchez i wsp., 2022). Należy podkreślić,
że oprócz ACE2 gamety męskie posiadają na powierzchni
cały repertuar enzymów i receptorów kaskady sygna-
łowej angiotensyny oraz dodatkowo szeregu proteaz tj.
TMPRSS2, TMPRSS11B, TMPRSS12 czy furyna, które
pełnią ważną rolę w utrzymaniu żywotności ludzkich
plemników i ich zdolności do zapłodnienia
(Aitken, 2021).
(Aitken, 2021).
Obecność obu kluczowych receptorów dla SARS-CoV-2
na powierzchni ejakulowanych plemników nie jest
wystarczającym dowodem, by uznać gametę męską
za komórkę wektorową, zdolną do przenoszenia choroby
COVID-19 drogą płciową, niemniej nie można takiej moż-
liwości wykluczyć. Rola systemu renina–angiotensyna
oraz białek z rodziny TMPRSS w biologii plemników
z pewnością wymaga dalszych badań.
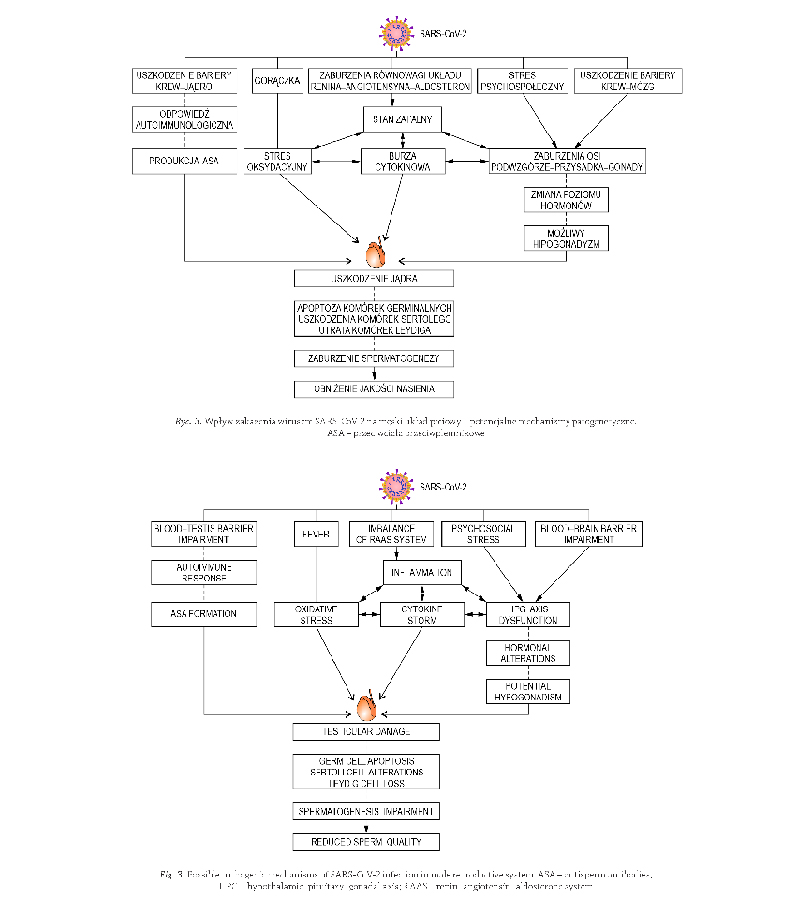
SARS-CoV-2 w układzie płciowym męskim
Powszechna dystrybucja na powierzchni wielu komórek
gonady męskiej i gruczołów dodatkowych kluczowych
receptorów wykorzystywanych przez wirusa SARS-CoV-2
do zakażenia, jest głównym czynnikiem warunkującym
jego tropizm do układu płciowego męskiego, co może
mieć poważne konsekwencje dla zdrowia reprodukcyj-
nego. O możliwości uszkodzenia gonad męskich przez
SARS-CoV donoszono w 2006 r. Badania
Xu i wsp. (2006)
Xu i wsp. (2006)
potwierdziły występowanie patologicznych zmian
w jądrach pobranych od sześciu pacjentów, którzy zmarli
na SARS, a obrazy histologiczne jednoznacznie wska-
zywały na występowanie zmian zapalnych tj. pogru-
bienie błony podstawnej kanalików plemnikotwórczych,
zwłóknienie okołokanalikowe, przekrwienie jąder, utrata
komórek germinalnych i liczne nacieki leukocytarne.
Istnieją doniesienia, w których wskazywano, że nie-
którzy mężczyźni z infekcją SARS-CoV-2, zwłaszcza
o umiarkowanym i ciężkim przebiegu, zgłaszali ból
jądra lub skarżyli się na uczucie dyskomfortu w mosznie
o różnym nasileniu
(Kim i wsp., 2020;
(Kim i wsp., 2020;
La Marca i wsp.,2020;
La Marca i wsp.,2020;
Bridwell i wsp., 2021).
Bridwell i wsp., 2021).
W dużym retrospektywnym
badaniu kohortowym Chen i wsp. (2021a)
Chen i wsp. (2021a)
u 142 pacjentów,
u których uzyskano pozytywny wynik testu łańcuchowej
reakcji polimerazy w czasie rzeczywistym (RT-PCR, ang.
real time polymerase chain reaction) na obecność COVID-19
w drogach oddechowych, wykonali badania ultrasono-
graficzne moszny w momencie postawienia diagnozy.
U 22,5% badanych pacjentów z infekcją SARS-CoV-2
potwierdzono zwiększoną przepuszczalność błony bia-
ławej i zwiększony przepływ naczyniowy, co wskazuje
na objawy typowe dla zapalenia jąder i/lub najądrza.
Nadal jest jednak nieznana odpowiedź na pytanie,
czy prawdopodobieństwo pojawienia się lokalnych
objawów klinicznych u pacjentów z infekcją SARS-CoV-2
zwiększa się wraz ze wzrostem miana wirusa w teście
potwierdzającym zakażenie. Ponadto, nie można także
wykluczyć rozwinięcia się stanu zapalnego jąder dopiero
po przebyciu zakażenia SARS-CoV-2 (zwłaszcza w infek-
cjach podostrych i/lub latentnych).
Pojedyncze doniesienia potwierdziły możliwą obec-
ność nukleokapsydu SARS-CoV-2 w gonadzie męskiej.
Poma i wsp. (2022)
Poma i wsp. (2022)
przeprowadzili analizę pośmiertną
tkanek endokrynnych, w tym gonady męskiej, od 29
chorych mężczyzn z ciężkim przebiegiem COVID-19.
Genom SARS-CoV-2 wykryto w 10/16 (62%) próbek
tkanki tłuszczowej, w cytoplazmie lipocytów otaczającej
krople lipidowe, 6/9 (67%) próbek jąder, w cytoplazmie
komórek kanalików nasiennych i 9/25 (36%) próbek tar-
czycy, w cytoplazmie komórek nabłonkowych wyścieła-
jących pęcherzyki tarczycy. We wszystkich przypadkach
obecność wirusa w badanych tkankach potwierdzono
zarówno na poziomie molekularnym, jak i barwieniem
immunohistochemicznym
Poma i wsp. (2022)
(Poma i wsp., 2022). W innym
badaniu pośmiertnym, przeprowadzonym dla pięciooso-
bowej grupy pacjentów z infekcją SARS-CoV-2, u wszyst-
kich mężczyzn wykazano obecność wirusa w badaniu
immunohistochemicznym z zastosowaniem przeciwciała
skierowanego przeciwko podjednostce S1 białka kolca,
ale tylko w dwóch przypadkach potwierdzono obecność
genomu wirusa SARS-CoV-2 metodą RT-PCR. Co więcej,
badania ultrastrukturalne w transmisyjnym mikroskopie
elektronowym (TEM, ang. transmission electron micro-
scopy) ujawniły obecność cząsteczek podobnych do wirusa
SARS-CoV-2 w przestrzeni śródmiąższowej gonad
u wszystkich badanych mężczyzn
(Ma i wsp., 2021b).
(Ma i wsp., 2021b).
Badania histopatologiczne gonady męskiej przepro-
wadzone pośmiertnie u pacjentów ze średnio nasilonym
i ciężkim przebiegiem COVID-19 często ujawniały obec-
ność zmian związanych z uszkodzeniem procesu sperma-
togenezy i kanalików nasiennych, charakterystycznych
dla ostrego zapalenia jądra, które obejmowały między
innymi obrzęk, zwłóknienie okołokanalikowe, wakuoli-
zację komórek Sertolego i utratę komórek germinalnych
(Rycina 3). Co więcej, zmianom tym często towarzyszyła
zwiększona akumulacja niedojrzałych spermatocytów
(obok plemników) w świetle przewodu najądrza
Li i wsp.,
2020b;
(Flaifel i wsp., 2021).
(Li i wsp.,
2020b; Flaifel i wsp., 2021). W niektórych przypadkach
obserwowano także wieloogniskowe mikrozakrzepy
w układzie naczyniowym jądra, co może sugerować,
że zmiany zapalne obserwowane w jądrach u mężczyzn
z ciężką infekcją SARS-CoV-2 mogą być dodatkowo
efektem niedotlenienia
(Flaifel i wsp., 2021).
(Flaifel i wsp., 2021).
( Yang i wsp.(2020) ).
Yang i wsp.(2020)
w jądrach wszystkich 12 pacjentów, którzy zmarli
z powodu powikłań po COVID-19, zaobserwowali obni-
żoną liczbę komórek Leydiga w porównaniu do grupy kon-
trolnej, z towarzyszącym obrzękiem komórek Sertolego.
Należy jednak podkreślić, że w żadnym z powyższych
badań nie potwierdzono obecności aktywnego wirusa
SARS-CoV-2 w zmienionych zapalnie gonadach, co suge-
ruje, że mogą być one efektem zmian degeneracyjnych
związanych z toczącym się ogólnoustrojowym bądź
lokalnym procesem zapalnym (Rycina 3).
Powyższe badania jednoznacznie wskazują na wysoki
tropizm wirusa SARS-CoV-2 do narządów męskiego
układu płciowego. Na obecnym etapie badań nie można
wykluczyć, że wirus SARS-CoV-2, podobnie jak inne
wirusy RNA tj. wirus świnki, ludzki wirus niedoboru
odporności (HIV, ang. human immunodeficiency virus) czy
wirus Zika, może pokonać barierę krew–jądro, zachować
swoje zdolności replikacyjne i bezpośrednio infekować
komórki gonady męskiej, prowadząc w dłuższym okresie
czasie nawet do zahamowania ich rozwoju (Rycina 3).
Ostatnie wyniki badań obrazowych, przeprowadzonych
na makakach rezus, z wykorzystaniem pozytronowej
tomografii emisyjnej sprzężonej z tomografią kom-
puterową (PET/CT, ang. positron emission tomography/
computed tomography), wskazują na cztery anatomiczne
miejsca lokalizacji wirusa SARS-CoV-2 w męskim ukła-
dzie płciowym, w jądrze, powrózku nasiennym, gruczole
krokowym i prąciu
(Madden i wsp., 2022)
(Madden i wsp., 2022) (Rycina 2).
SARS-CoV-2 w nasieniu
Od początku pandemii COVID-19 opublikowano
wiele prac klinicznych dotyczących obecności wirusa
SARS-CoV-2 w nasieniu u pacjentów ze zdiagnozowanym
COVID-19. Większość badań przeprowadzonych przez
niezależne zespoły autorów nie potwierdziła obecności
wirusa SARS-CoV-2 w nasieniu, zarówno w próbkach
pobranych w ostrej fazie infekcji
(Holtmann i wsp., 2020;
Kayaaslan i wsp., 2020;
Pan i wsp., 2020;
Burke i wsp.,2021;
Scroppo i wsp., 2021)
(Holtmann i wsp., 2020;
Kayaaslan i wsp., 2020;
Pan i wsp., 2020;
Burke i wsp.,2021;
Scroppo i wsp., 2021)
jak i w próbkach pobranych
od ozdrowieńców
(Guo i wsp., 2020;
Ma i wsp., 2021b;
Temiz i wsp., 2021;
Ruan i wsp., 2021;
Donders i wsp., 2022).
(Guo i wsp., 2020;
Ma i wsp., 2021b;
Temiz i wsp., 2021;
Ruan i wsp., 2021;
Donders i wsp., 2022).
Tylko w dwóch pracach wykryto obecność RNA wirusa
SARS-CoV-2 w ejakulacie metodą RT-PCR. W badaniu
opublikowanym na początku pandemii przez grupę
naukowców z Chin, wirusa SARS-CoV-2 zidentyfikowano
w 6/38 próbek nasienia od pacjentów z rozpoznaniem
COVID-19, w tym 4/15 próbek od pacjentów w ostrej
fazie infekcji i 2/23 próbki od pacjentów, którzy wyzdro-
wieli
(Li i wsp., 2020a).
(Li i wsp., 2020a). Jakkolwiek, autorzy podali w pracy
niepełne informacje w odniesieniu do metody pobierania
nasienia do badań i czułości zastosowanego testu mole-
kularnego. Z kolei grupa
Gacci i wsp., 2021).
Gacci i wsp. (2021) potwierdziła
obecność RNA wirusa SARS-CoV-2 w nasieniu u 1/43
ozdrowieńców, w próbce pobranej w 21. dniu po wyka-
zaniu ujemnego wyniku testu RT-PCR w wymazie z noso-
gardzieli. Co ciekawe, autorzy wykazali również obecność
genomu wirusa w innych płynach ustrojowych badanych
pacjentów tj. ślina (1/43) oraz mocz (1/43)
Gacci i wsp., 2021).
(Gacci i wsp.,
2021). Badano również obecność SARS-CoV-2 w wydzie-
linie gruczołu krokowego oraz w moczu po masażu
gruczołu krokowego, ale w żadnym z tych płynów nie
potwierdzono obecności aktywnych cząstek wirusa
(Zhang i wsp., 2020;
Gacci i wsp., 2021).
(Zhang i wsp., 2020;
Gacci i wsp., 2021).
Powyższe badania
wskazują, że u mężczyzn wyleczonych z infekcji ryzyko
przeniesienia SARS-CoV-2 drogą kontaktów seksualnych
wydaje się nieistotne, a główną drogą transmisji wirusa
pozostaje droga kropelkowa. Zaleca się jednak zachowanie
ostrożności przy obróbce nasienia do procedur rozrodu
wspomaganego czy kriokonserwacji. Aby zminimalizować
ryzyko kontaminacji, proponuje się badanie przesiewowe
próbek na obecność materiału genetycznego SARS-CoV-2,
przy udziale wystandaryzowanych protokołów RT-PCR
dedykowanych do nasienia
(Chabrolles i wsp., 2022).
(Chabrolles i wsp., 2022).
Infekcja SARS-CoV-2
a hormony steroidowe
Inna istotna kwestia związana z negatywnym wpływem
infekcji SARS-CoV-2 na zdrowie reprodukcyjne i układ
płciowy męski dotyczy sekrecji i funkcji hormonów
steroidowych. Wyniki wielu badań retrospektywnych
wskazują, że mężczyźni z infekcją wirusową ujawniają
obniżone obwodowe stężenie testosteronu (T, ang. testo-
sterone) i wahania stężeń gonadotropin tj. hormonu lute-
inizującego (LH, ang. luteinizing hormone) oraz hormonu
folikulotropowego (FSH, ang. follicle-stimulating hormone)
Ma i wsp., 2021a;
Schroeder i wsp., 2021;
Cinislioglu i wsp.,2022).
(Ma i wsp., 2021a;
Schroeder i wsp., 2021;
Cinislioglu i wsp.,2022).
W niektórych badaniach niski poziom testosteronu
u mężczyzn wiązał się ze wzrostem stężenia estradiolu
w surowicy krwi
(Schroeder i wsp., 2021;
(Salonia i wsp.,2022.).
(Schroeder i wsp., 2021;
Salonia i wsp.,2022).
Taka zależność nie była obserwowana w grupie
kobiet z infekcją SARS-CoV-2
(Schroeder i wsp., 2021).
(Schroeder i wsp., 2021).
Wykazywano również podwyższone stężenia globu-
liny wiążącej hormony płciowe (SHGB, ang. sex hormone
binding globulin) u mężczyzn z COVID-19, co wiązało się
ze zmniejszeniem aktywnej wolnej frakcji T
(Schroederi wsp., 2021).
(Schroederi wsp., 2021).
W innym dużym retrospektywnym badaniu
kohortowym,
Ma i wsp. (2021a)
Ma i wsp. (2021a)
zbadali profil hormo-
nalny u mężczyzn w wieku reprodukcyjnym, w tym u 119
mężczyzn z COVID-19 i 273 mężczyzn, którzy nie mieli
infekcji SARS-CoV-2. Analiza porównawcza nie wykazała
różnic statystycznie istotnych dla stężeń T, FSH i estra-
diolu pomiędzy badanymi grupami, natomiast zaobser-
wowano statystycznie znamienne podwyższenie obwodo-
wego stężenia LH oraz obniżenie współczynników T/LH
i FSH/LH u chorych z infekcją COVID-19 w porównaniu
do grupy kontrolnej. W innym badaniu, przeprowadzonym
u 41 mężczyzn po około 1–2 miesiącach po wyleczeniu
COVID-19, stężenia T, LH, FSH u większości pacjentów
mieściły się w zakresie referencyjnym, natomiast zano-
towano statystycznie istotne podwyższenie poziomu
prolaktyny w porównaniu z grupą kontrolną
(Guo i wsp.,2021).
(Guo i wsp.,2021).
W piśmiennictwie dostępne są również nieliczne
badania retrospektywne, w których porównywano wyniki
stężeń hormonów płciowych u tych samych mężczyzn
sprzed i po infekcji SARS-CoV-2.
Koç i Keseroğlu (2021)
Koç i Keseroğlu (2021) dla
8-osobowej grupy badanej uzyskali wyniki wskazujące
na istotną redukcję stężenia T po wyleczeniu infekcji, bez
statystycznych znamienności dla stężeń hormonów gona-
dotropowych. Z kolei, w badaniach przeprowadzonych
na grupie 81 mężczyzn obserwowano obniżenie stężenia
T u ozdrowieńców z łagodnym i umiarkowanym prze-
biegiem COVID-19, ale bez znamienności statystycznej
w porównaniu do wartości sprzed infekcji. Autorzy pod-
kreślali jednak, że z grupy badawczej wykluczono męż-
czyzn z ciężkimi objawami zakażenia. Dla pozostałych
badanych hormonów, LH, TSH i prolaktyny również nie
uzyskano różnic statystycznie istotnych w ich stężeniach
(Salar i wsp., 2023).
dla
(Salar i wsp., 2023).
Pomimo rozbieżności wynikających z faktu przepro-
wadzenia badań w różnych populacjach (wiek, stopień
nasilenia objawów COVID-19, czas pobrania próbki
do badań od wyleczenia infekcji) i zastosowania nie-
pełnych profili hormonalnych, powyższe dane wska-
zują, że mężczyźni chorujący na infekcję SARS-CoV-2
są narażeni na rozwinięcie hipogonadyzmu związanego
z obniżeniem stężenia T w surowicy krwi (Rycina 3).
Wyniki badań
Schroeder i wsp. (2021)
Schroeder i wsp. (2021) oraz
Koç i Keseroğlu (2021)
Salonia i wsp.(2022)
przeprowadzone w grupach mężczyzn hospita-
lizowanych w związku z ciężkim przebiegiem infekcji
SARS-CoV-2 wskazały, że u 15–25% pacjentów niedobór
T wiązał się jednocześnie z podwyższeniem stężeń LH,
co wskazuje na upośledzenie czynności jąder, związanej
z zaburzeniami steroidogenezy w komórkach Leydiga
i rozwój hipogonadyzmu hipergonadotropowego, nato-
miast 75–85% pacjentów z niedoborami T ujawniało
zmienne (niskie lub norma) stężenia gonadotropin,
co wskazuje na zaburzenia funkcji układu podwzgórze–
przysadka i rozwój hipogonadyzmu hipogonadotropo-
wego. O zmianach wstecznych, zachodzących w gonadach
mężczyzn chorujących na COVID-19 o ciężkim przebiegu
donosiły zarówno wyniki badań pośmiertnych (patrz.
podrozdział „SARS-CoV-2 w układzie płciowym męskim”)
(Yang i wsp., 2020)
(Yang i wsp., 2020)
oraz wyniki nielicznych badań kli-
nicznych, w których około 30% mężczyzn po przechoro-
waniu COVID-19 ujawniało obniżenie stężenia inhibiny B
poniżej wartości referencyjnych
(Guo i wsp., 2021).
(Guo i wsp., 2021).
Istnieją
również dowody na to, że wirus SARS-CoV-2 przenika
barierę krew–mózg, atakuje ośrodkowy układ nerwowy
i powoduje zapalenie mózgu
(Wierzba-Bobrowicz i wsp.,2021)
(Wierzba-Bobrowicz i wsp.,2021)
(Rycina 3). Badania z wykorzystaniem technik
obrazowania struktury i funkcji mózgu potwierdzały
także możliwość występowania zmian patologicznych
w obrębie podwzgórza oraz powiększenia przysadki
mózgowej u osób z infekcją SARS-CoV-2
(Pascual-Goñii wsp., 2020).
(Pascual-Goñii wsp., 2020).
Interpretując powyższe doniesienia należy
podkreślić, że wahania stężeń androgenów zwykle
towarzyszą stanom zapalnym/infekcjom, w związku
z nasileniem ogólnoustrojowej reakcji zapalnej, zabu-
rzeniami termoregulacji i wzrostem poziomu cytokin
zapalnych, które biorą udział w modulowaniu funkcjo-
nalnej osi podwzgórze–przysadka–jądro (HPG, ang. hypo-
thalamic–pituitary–gonadal axis)
(Mohamad i wsp., 2019;
Selvaraj i wsp., 2021)
(Mohamad i wsp., 2019;
Selvaraj i wsp., 2021)
(Rycina 3). Potwierdzają to również
wyniki badań przeprowadzonych u mężczyzn z infekcją
SARS-CoV-2, u których stężenie całkowitego i/lub
wolnego T czy wartość współczynnika T/LH negatywnie
korelowano z biochemicznymi markerami zapalnymi
tj. liczbą leukocytów czy poziomem białka C-reaktywnego
(CRP, ang. C-reactive protein)
Ma i wsp., 2021a;
Selvaraj i wsp., 2021)
(Ma i wsp., 2021a;
Rastrellii wsp., 2021)
, a stężenie estradiolu pozytywnie korelowano
z poziomem interferonu gamma (IFN-γ, ang. interferon
gamma)
(Schroeder i wsp., 2021).
(Schroeder i wsp., 2021).
Wielu badaczy podkreśla,
iż zaburzenia metabolizmu hormonów steroidowych
mogą stanowić cechę charakterystyczną u krytycznie
chorych pacjentów płci męskiej z COVID-19. Mężczyźni
z najniższym stężeniem całkowitego czy wolnego T
w surowicy krwi znacznie częściej wymagali opieki
na oddziałach intensywnej terapii i mieli niższy wskaźnik
przeżycia
Rastrelli i wsp., 2021;
Schroeder i wsp., 2021).
(Rastrelli i wsp., 2021;
Schroeder i wsp., 2021).
Obserwowana zmienność w stężeniu hormonów płcio-
wych u wielu mężczyzn z infekcją COVID-19 powinna być
również rozpatrywana jako efekt silnego stresu psycho-
społecznego, jakim jest sama choroba
(Dutta i Sengupta,2021)
(Dutta i Sengupta,2021)
(Rycina 3). Przeprowadzona przez
Temiz i wsp.(2020)
Temiz i wsp.(2020)
analiza porównawcza poziomów T, LH i FSH przed
i po zastosowaniu leczenia COVID-19 wykazała, że niskie
stężenia tych hormonów wracały po leczeniu do poziomów
wartości referencyjnych. Autorzy sugerują, że obserwowane
zaburzenia hormonalne towarzyszą ostrej fazie infekcji
i są wynikiem stresu spowodowanego chorobą. Podobnie
Guo i wsp. (2021)
Guo i wsp. (2021)
już po około 3 miesiącach od zakoń-
czenia leczenia szpitalnego obserwowali stabilizację
profilu hormonalnego. Inne wnioski wyciągnęli Salonia
i wsp. (2022), którzy monitorowali stężenie T przez 7 mie-
sięcy w grupie 121 mężczyzn po wyleczeniu zakażenia
SARS-CoV-2, u których infekcja wiązała się ze znacznym
obniżeniem stężenia T. Chociaż u większości pacjentów
stężenie T wzrastało w czasie, to ponad 50% mężczyzn,
którzy wyzdrowieli z choroby, po 7 miesiącach obserwacji
nadal ujawniało niskie stężenie T obserwowane w zespo-
łach hipogonadyzmu. Co więcej, aż w 10% przypadków
stężenie T jeszcze bardziej obniżało się, a prawdopodobień-
stwo normalizacji stężenia T było niższe przy dodatkowym
obciążeniu chorobami współistniejącymi. W kolejnym
badaniu, ta sama grupa autorów potwierdziła dalszy
wzrostowy trend stężenia T u mężczyzn po 12 miesiącach
(Salonia i wsp., 2023).
obserwacji po wyleczeniu infekcji
(Salonia i wsp., 2023).
Podsumowując, do zaburzeń gospodarki hormonalnej
wywołanej lub nasilonej przez infekcję SARS-CoV-2 może
dojść na każdym z pięter osi HPG, a duże ryzyko rozwoju
hipogonadyzmu u mężczyzn po przebyciu zakażenia
może wpływać negatywnie nie tylko na płodność, ale
także na zdrowie seksualne. W tym kontekście, istnieje
pilna potrzeba prospektywnych, randomizowanych i kon-
trolowanych badań, monitorujących poziom hormonów
płciowych w populacji męskiej po zakończonej pandemii.
Wpływ SARS-CoV-2 na parametry
standardowej oceny seminologicznej
plemników
Wyniki wielu prac retrospektywnych, w których porów-
nywano parametry plemników mężczyzn po przecho-
rowaniu COVID-19 i mężczyzn bez infekcji, wskazują
na możliwy udział infekcji SARS-CoV-2 w etiologii zabu-
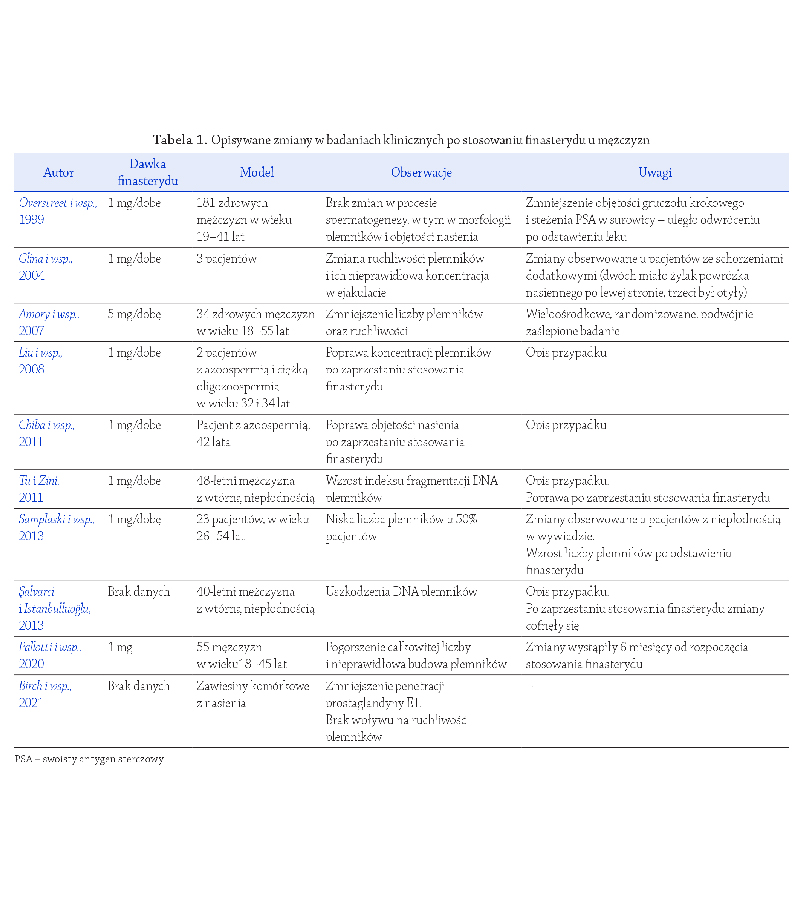
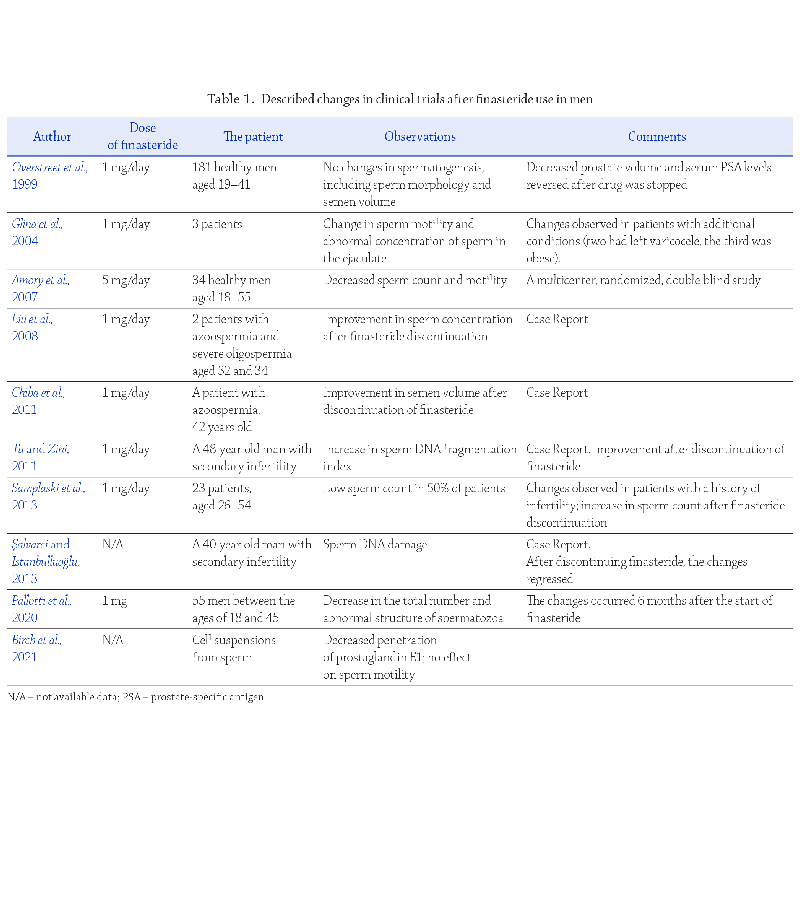
rzeń jakości nasienia (Tabela 1). Osłabienie co najmniej
jednego z konwencjonalnych parametrów plemników
obserwowano u około 50–70% ozdrowieńców, a para-
metrem, który najczęściej ulegał zaburzeniu była liczba
plemników w ejakulacie
(Holtmann i wsp., 2020;).
(Li i wsp.,2020b;).
(Guo i wsp., 2021; ).
(Ruan i wsp., 2021).
(Holtmann i wsp., 2020;
Li i wsp.,2020b;
Guo i wsp., 2021;
Ruan i wsp., 2021). U około
25–35% przypadków, znamiennej redukcji liczby plem-
ników towarzyszyło istotne osłabienie ruchu plemników
(Guo i wsp., 2021; ).
(Ruan i wsp., 2021).
(Guo i wsp., 2021;
Ruan i wsp., 2021)
. Z kolei w dużym
badaniu kohortowym przeprowadzonym na grupie 118
mężczyzn wyleczonych z zakażenia, aż w 67% ejakulatów
zaburzenia dotyczyły morfologii plemników, 44% męż-
czyzn miało astenozoospermię, a 25% oligozoospermię
(Donders i wsp., 2022).
(Donders i wsp., 2022).
Nie brakuje również danych kli-
nicznych, które wskazują na ciężkie nieprawidłowości
w standardowym badaniu nasienia po przechorowaniu
COVID-19. W badaniu
Gacci i wsp. (2021)
Gacci i wsp. (2021)
przeprowadzona
analiza nasienia po 24–43 dniach od uzyskania nega-
tywnego wyniku testu na COVID-19 wykazała aż osiem
przypadków azoospermii i trzy przypadki ciężkiej oligo-
zoospermii. Co więcej, obserwowany wzrost przypadków
braku plemników w ejakulacie po przebyciu infekcji
SARS-CoV-2 autorzy skorelowali ze stopniem nasilenia
jej objawów
Gacci i wsp. (2021)
(Gacci i wsp., 2021).
Dodatkowo, w ejakula-
tach osób zakażonych wirusem SARS-CoV-2 częściej
obserwowano redukcję odsetka plemników żywych
Gacci i wsp. (2021)
(Gaccii wsp., 2021;
Piroozmanesh i wsp., 2021) oraz wzrost liczby
leukocytów
Gacci i wsp. (2021)
(Gacci i wsp., 2021).
Prace kliniczne, w których porównywano parametry
plemników u tych samych mężczyzn przed i po infekcji
SARS-CoV-2 także sugerują, że wirus SARS-CoV-2
odgrywa rolę przy powstawaniu nieprawidłowości w eja-
kulowanych gametach męskich (Tabela 1). Co ciekawe,
badania te wskazują na osłabienie ruchu postępowego
i całkowitego plemników, jako najczęściej występujące
zaburzenie w ocenie standardowej
Erbay i wsp., 2021;
Koç i Keseroğlu, 2021;
Pazir i wsp., 2021).
(Erbay i wsp., 2021;
Koç i Keseroğlu, 2021;
Pazir i wsp., 2021).
W kilku badaniach
odnotowano także istotne obniżenie parametru objętości
nasienia po infekcji, w szczególności przy umiarkowanym
i ciężkim nasileniu objawów zakażenia
Erbay i wsp., 2021;
Koç i Keseroğlu, 2021;
(Erbay i wsp., 2021;
Koç i Keseroğlu, 2021),
przy jednoczesnym spadku koncen-
tracji i całkowitej liczby plemników
Erbay i wsp., 2021;
(Erbay i wsp., 2021).
W piśmiennictwie naukowym nie brakuje również badań
retrospektywnych, w których analiza porównawcza para-
metrów seminologicznych przed i po infekcji nie wyka-
zała istotnego wpływu na jakość nasienia
Gul i wsp.,2021;
Ma i wsp., 2021a;
Stigliani i wsp., 2023;
(Gul i wsp.,2021;
Ma i wsp., 2021a;
Stigliani i wsp., 2023).
W wyja-
śnieniu przyczyn powyższych różnic należy uwzględnić
kilka czynników. Po pierwsze, zwraca uwagę duża różno-
rodność w liczebności porównywanych grup pacjentów
w poszczególnych badaniach (od kilku do kilkudziesięciu
osób), co może wpływać na moc przeprowadzonych analiz
statystycznych. Po drugie, nie we wszystkich badaniach
uwzględniano czas trwania infekcji i stopień nasilenia
jej objawów. Po trzecie, próbki nasienia pozyskiwano
do badań w różnym czasie od potwierdzenia infekcji
SARS-CoV-2 pozytywnym wynikiem testu molekular-
nego, co w dużym stopniu determinowało interpretację
uzyskanych wyników.
Biorąc pod uwagę fakt, że przyczyną obniżenia jakości
nasienia mogą być epizody gorączki, w niektórych bada-
niach porównywano wartości parametrów seminologicz-
nych u pacjentów z infekcją SARS-CoV-2 przebiegającą
z gorączką i bez gorączki. Większość badań, w których
zastosowano dodatkowy podział na podgrupy ze względu
na towarzyszącą podwyższoną temperaturę ciała nie
wykazywało istotnych różnic statystycznych, co suge-
ruje, że gorączka jest jednym z wielu czynników odpo-
wiedzialnych za obniżenie jakości nasienia po infekcji
COVID-19
Erbay i wsp., 2021;
Pazir i wsp., 2021;
Stigliani i wsp., 2023;
(Erbay i wsp., 2021; Pazir i wsp., 2021; Stigliani
i wsp., 2023) (Rycina 3). Należy w tym miejscu podkre-
ślić, że powyższe analizy zastały przeprowadzone na
bardzo małych grupach badanych.
Obecny stan wiedzy nie dostarcza jednoznacznej
odpowiedzi na kluczowe pytania dotyczące kwestii, jak
długo po przechorowaniu infekcji SARS-CoV-2 para-
metry nasienia utrzymują się na obniżonym poziomie,
a także który z parametrów seminologicznych wymaga
dłuższego czasu, by wrócić do wartości wyjściowych.
Guo i wsp. (2021)
Guo i wsp. (2021)
analizowali parametry seminologiczne
w dwóch punktach czasowych, po dwóch i trzech mie-
siącach od wyleczenia z infekcji, uzyskując istotną
poprawę koncentracji i brak istotnej poprawy dla para-
metru ruchliwości plemników. W innym badaniu, analiza
porównawcza standardowych parametrów plemników
analizowanych po 14 i 120 dniach od potwierdzenia zaka-
żenia wirusem SARS-CoV-2 wykazała, że ruchliwość była
parametrem, który u wszystkich pacjentów ulegał zna-
czącej poprawie w monitorowanym przedziale czasowym,
natomiast nie u wszystkich badanych mężczyzn para-
metr morfologii plemników osiągał wartość uznawaną
za prawidłową
(Falahieh i wsp., 2021).
(Falahieh i wsp., 2021).
Interesujące
wyniki opublikowali
Donders i wsp. (2022)
Donders i wsp. (2022), którzy
u 118 mężczyzn monitorowali parametry plemników
w trzech punktach czasowych: poniżej jednego miesiąca,
od jednego do dwóch miesięcy i powyżej dwóch mie-
sięcy (maksymalnie do sześciu miesięcy) od wyleczenia
infekcji. W badaniu tym, koncentracja, ruch postępowy
i liczba plemników ruchliwych należały do parametrów,
które najszybciej ulegały normalizacji, w przeciwieństwie
do parametru morfologii, który tylko w pojedynczych
przypadkach ulegał poprawie w badanym przedziale
czasowym. Nadal jednak po ponad dwóch miesiącach
od wyleczenia infekcji, około 6% mężczyzn nie speł-
niało kryteriów dla wartości prawidłowych koncentracji
plemników, 27% dla odsetka plemników z ruchem postę-
powym i 3% dla odsetka komórek ruchliwych
(Dondersi wsp., 2022).
(Donders i wsp., 2022).
Podsumowując, analiza opublikowanych
danych klinicznych dotyczących monitorowania zmian
parametrów nasienia po infekcji SARS-CoV-2 wskazuje,
że zaburzenia liczby i jakości ejakulowanych plemników
związane z zakażeniem są zazwyczaj przejściowe i średnio
w ciągu 3–4 miesięcy od wyleczenia standardowe para-
metry nasienia wracają do tak zwanych wartości refe-
rencyjnych. Jednocześnie badania sugerują, że stan
wyjściowy jakości nasienia przed infekcją oraz stopień
nasilenia objawów choroby mogą być kwestią kluczową
dla skrócenia bądź wydłużenia czasu potrzebnego na nor-
malizację parametrów seminologicznych.
Wpływ infekcji SARS-CoV-2 na parametry
niekonwencjonalne nasienia
Nieprawidłowości parametrów rozszerzonej diagno-
styki seminologicznej, obserwowane u pacjentów,
którzy chorowali na COVID-19 wskazują na udział
stresu oksydacyjnego i procesów śmierci komórkowej
jako potencjalnych mechanizmów odpowiedzialnych
za rozwój subpłodności/niepłodności u mężczyzn, zwią-
zanej z infekcją SARS-CoV-2 (Rycina 3). Potwierdzają
to badania retrospektywne, w których obserwowano jed-
noczesny wzrost fragmentacji DNA plemników i zabu-
rzenia równowagi pro- i antyoksydacyjnej w nasieniu tj.
obniżenie całkowitego potencjału antyoksydacyjnego,
wzrost stężenia markera peroksydacji lipidów czy wzrost
poziomu reaktywnych form tlenu w nasieniu mężczyzn
po infekcji, w porównaniu do mężczyzn, którzy nie cho-
rowali na COVID-19
(Falahieh i wsp., 2021;).
( Piroozmanesh i wsp., 2021;).
(Shcherbitskaia i wsp., 2022).
(Falahieh i wsp., 2021;
Piroozmanesh i wsp., 2021;
Shcherbitskaia i wsp., 2022).
Co więcej, te same
badania wskazywały na stopniową normalizację zarówno
poziomu uszkodzeń plemnikowego DNA jak i lokalnego
stresu oksydacyjnego u pacjentów po infekcji COVID-19
(Falahieh i wsp., 2021;).
(Shcherbitskaia i wsp., 2022).
(Falahieh i wsp., 2021;
Shcherbitskaia i wsp., 2022).
Warto
w tym miejscu zaznaczyć, że wobec dużej liczby czyn-
ników, zarówno endo- jak i egzogennych, prowadzących
do stresu oksydacyjnego w nasieniu i zaburzeń integral-
ności chromatyny plemników, parametry te nie są specy-
ficznym markerem infekcji SARS-CoV-2 i należą do nie-
zależnych biomarkerów diagnostyki seminologicznej
niepłodności męskiej.
Postuluje się, że zaangażowanie wirusa SARS-CoV-2
w indukcję zarówno ogólnoustrojowej jak i lokalnej odpo-
wiedzi immunologicznej i/lub autoimmunologicznej
może być ważną przyczyną obniżenia jakości nasienia.
Silnie skorelowano poziom przeciwciał anty-SARS-CoV-2
w klasie IgG skierowanych przeciwko białku S wirusa
w surowicy krwi z redukcją parametrów seminologicz-
nych
(Donders i wsp., 2022).
(Donders i wsp., 2022).
Z kolei badania pośmiertne
przeprowadzone na gonadach od pacjentów z infekcją
SARS-CoV-2 ujawniały zwiększoną infiltrację limfocytów
T i makrofagów oraz dystrybucję przeciwciał klasy IgG
w tkance interstycjalnej gonad od mężczyzn z infekcją
SARS-CoV-2, prawdopodobnie jako efekt rozszczelnienia
bariery krew-jądro
(Li i wsp., 2020b).
(Li i wsp., 2020b). Autorzy obserwowali
również podwyższone stężenia niektórych chemokin
i cytokin prozapalnych tj. interleukiny-6 (IL-6, ang. inter-
leukin-6), czynnika wzrostu nowotworów alfa (TNF-α,
ang. tumor necrosis factor alpha) czy chemotaktycznego
białka monocytów 1 (MCP-1, ang. monocyte chemoattrac-
tant protein 1) w nasieniu pacjentów z COVID-19
(Li i wsp., 2020b).
(Li i wsp.,
2020b). W innym badaniu, u 76% ozdrowieńców obserwo-
wano podwyższone poziomy IL-8 w nasieniu, zwłaszcza
u mężczyzn z ciężkim przebiegiem choroby. Dodatkowo,
patologiczne poziomy tej chemokiny korelowano z inten-
sywnością stosowanej tlenoterapii i wyższą częstością
występowania azo- i kryptozoospermii w ejakulacie
(Gacci i wsp., 2021).
(Gacci i wsp., 2021). Wskazuje się także na zwiększoną
tendencję do immunizacji nasienia u pacjentów po prze-
byciu infekcji SARS-CoV-2, o czym świadczą częściej
obserwowane podwyższone poziomy (>10%) przeciwciał
przeciwplemnikowych (ASA, ang. antisperm antibodies),
zwłaszcza w klasie IgA w mieszanym teście antyglobuli-
nowym (MAR, ang. mixed antiglobulin reaction)
(Donders i wsp., 2022).
(Donders i wsp., 2022). Obserwacje te z pewnością wymagają moni-
torowania, gdyż w dłuższej perspektywie mogą stwarzać
ryzyko przewlekłego uszkodzenia jąder, a nawet rozwoju
autoimmunologicznego zapalenia gonad.
Kontrowersje dotyczące
układu receptorowego dla SARS-CoV-2
w kontekście szczepionek
skierowanych przeciw jego antygenom
Jakkolwiek nie gasną kontrowersje dotyczące ekspresji
podstawowych receptorów dla wirusa SARS-CoV-2 (ACE2,
podrodzina TMPRSS), również w układzie płciowym
męskim, podstawowe dane donoszą o raczej niskim
niebezpieczeństwie infekcji nasienia (ok. 6,9%) w sto-
sunku do bardziej awidnych struktur komórkowych jakim
jest gonada męska (8,3%)
(Chen i wsp., 2021b).
(Chen i wsp., 2021b). Ostatnio
podnosi się zwłaszcza rolę katepsyn L i B w inwazyjności
wirusa SARS-CoV-2 wobec męskiego układu płciowego,
jakkolwiek to nie te grupy receptorów będą stanowić
o długofalowych skutkach infekcji wirusem SARS-CoV-2.
Utrzymywanie się stanu zapalnego w sytuacji przewlekłej
to główne niebezpieczeństwo dla świata po COVID-19.
Odpowiedzialne za nie będą głównie białka recepto-
rowe, aminopeptydaza alanylowa typu N (ANPEP, ang.
alanyl aminopeptidase N) czy peptydaza dipeptydylowa 4
(DPP-4, ang. dipeptidyl peptidase-4). Wysoka ekspresja
ANPEP (wspomagana stanem zapalnym), poprzez mecha-
nizm epigenetyczny powodujący zmianę ekspresji genów
w gruczole krokowym oraz jego najbliższym otoczeniu,
będzie skutkowała utrwalaniem zagrożenia nowotwo-
rowego wobec tego narządu. W szerszej perspektywie,
zaobserwowano również podwyższoną ekspresję ANPEP
w mikrośrodowisku sprzyjającym chorobie Parkinsona,
co sugeruje, że choroby neurodegeneracyjne również
mogą być konsekwencją przebytej infekcji COVID-19.
Wymienione choroby cywilizacyjne, ze względu na swoje
rozpowszechnienie, już w tej chwili budzą przerażenie
środowiska medycznego – to prawdopodobny scenariusz
odległych konsekwencji pandemii, które dodatkowo mogą
być pobudzane przez zbyt liczne (chociaż powszechnie
proponowane) dozowanie tzw. dawek przypominających
szczepień przeciw COVID-19. Warto w tym miejscu przy-
pomnieć, że szczepionka zawierająca peptyd (lub mRNA
dla tego peptydu) pozyskiwana jest z białka S wirusa,
odpowiedzialnego za inicjowanie kontaktu pomiędzy
ligandem wirusowym a receptorem i w łagodnej formie
może prowadzić do miernie nasilonych odczynów zapal-
nych podobnych do COVID-19. Jednak zbyt częste ini-
cjowanie tych stanów zapalnych może przekształcić się
w podłoże sprzyjające w prostej linii do zainicjowania
lub współinicjowania wspomnianych chorób cywiliza-
cyjnych. Podawanie szczepionki w trakcie współistnie-
jącej infekcji SARS-CoV-2 nie jest obojętne dla układu
odpornościowego, a zwłaszcza dla rozwinięcia możli-
wych reakcji krzyżowych (przy wystąpieniu homologii
„lustrzanego odbicia” białka receptorowego z niektórymi
narządami). I tak na przykład możliwość krzyżowych
reakcji pomiędzy terminalnymi (N i C) powtórzeniami
heptadowymi (HR, ang. heptad repeats) białka S wirusa
SARS-CoV-2 a syncytynami czyli białkami biorącymi
udział w procesie placentacji była podnoszona przez lobby
antyszczepionkowe
(Bosch i wsp., 2004).
(Bosch i wsp., 2004). Niemniej okazało
się, że homologia tych białek była zbyt mała, aby takie
potencjalne reakcje mogły się wytworzyć. Zapobiegając
panice, należało przywołać pewne kanony rozrządzające
układem odpornościowym, dla którego już dawno udo-
wodniono, że jeżeli dwa porównywane białka dzieli mniej
niż 35% homologii (np. HR białka S wirusa i syncytyna)
na przestrzeni ponad 80 reszt aminokwasowych, to nie
ma możliwości, aby uzyskane z tych białek okta- czy też
nonapeptydy (wchodzące do rowka antygenu układu zgod-
ności tkankowej) mogły spowodować reakcję krzyżową.
Z kolei w odniesieniu do wczesnych form zarodka
wytwarzającego cyto- czy syncytiotrofoblast, w I fazie
rozwoju ciąży, zaakcentowano także rolę basiginy
(CD147), która jest odpowiedzialna za indukcję meta-
loproteinaz w macierzy zewnątrzkomórkowej, a jedno-
cześnie pełni rolę fakultatywnego receptora dla wirusa
SARS-CoV-2 (Rycina 1). Biorąc pod uwagę fakt, że basi-
gina ulega ekspresji na ludzkiej blastocyście czy też tro-
fektodermie, równoległe podanie szczepionki, będącej
w zasadzie białkiem konformacji kolca S, mogłoby
nasilić ekspresję tego receptora i zagrozić przeżyciu
wczesnego zarodka. W tabeli 2 przedstawiono roz-
maite możliwości współwystępowania receptorów dla
SARS-CoV-2 w warunkach wczesnej fazy rozwojowej
ciąży na komórkach cyto- oraz syncytiotrofoblastu.
W tej sytuacji, zdumienie może budzić opublikowane
oświadczenie producenta szczepionki Pfizer, który jako
jedyny i w każdych warunkach rekomendował stoso-
wanie szczepionki, także dla kobiet w ciąży (nie roz-
różniając nawet trymestru)
(Ory i wsp., 2021).
(Ory i wsp., 2021). Refleksja
dotycząca podawania szczepionek, nawet o najnowszej
technologii, przyszła jednak wkrótce potem, prawdo-
podobnie w wyniku zaobserwowanych licznych poro-
nień przy podawanych szczepionkach u kobiet w ciąży
(Chen i wsp., 2021b).
(Chen i wsp., 2021b). Światowa Organizacja Zdrowia oraz
Komitet Szczepionek i Immunizacji Wielkiej Brytanii
wyraziły wielką rezerwę wobec tendencji szczepienia
kobiet w pierwszym trymestrze ciąży. Dalszą refleksję
powinien budzić fakt, że jakkolwiek receptory podrodziny
TMPRSS dla wirusa SARS-CoV-2 mają niską ekspresję
w miometrium macicy, jajnikach, jajowodach czy gruczole
piersiowym, to zarówno uprzednio wymieniony receptor
enzymatyczny jak i obydwie katepsyny B i L, wyrażają
zwiększoną ekspresję we wczesnej do około połowy fazy
wydzielniczej cyklu menstruacyjnego u kobiet, dlatego
powinno się unikać szczepienia w tym właśnie okresie.
Z punktu widzenia systemowego, bardzo poważnie
powinna być traktowana zmienna i najmniej przewidy-
walna ekspresja receptora DPP-4 łożyska naczyniowego,
która występuje na komórkach nabłonkowych
i śródbłonka naczyniowego, powodując nie tylko gwał-
towne reakcje w postaci burzy cytokinowej, ale również
falę zaburzeń zakrzepowo-zatorowych (ze względu
na swoje krytyczne rozmieszczenie), objawiających się
zawałem serca i/lub udarem w ośrodkowym układzie
nerwowym, w następstwie choroby COVID-19. Jak
wynika z literatury przedmiotu i szerokich obserwacji
wyniesionych z dotąd podawanych szczepionek, u nie-
których osób epizody zakrzepowo-zatorowe wystąpiły
także po przyjęciu szczepionek, zaś prawie u wszystkich
(obserwacje własne) doszło do podwyższonego poziomu
krążących cytokin – przesiękających do przedziału roz-
rodczego obu płci, w zależności od predyspozycji indy-
widualnych czy chorób współistniejących, a w dłuższej
perspektywie – utrzymujących się stanów zapalnych,
predysponujących do rozwoju późniejszych chorób
somatycznych, nie wykluczając stanów nowotworowych
Konstantinides, 2021;
(Schultheiss i wsp., 2021;).
(Elkin i wsp.,
2023).
(Konstantinides, 2021; Schultheiss i wsp., 2021; Elkin i wsp.,
2023). Niebezpieczeństwo to wzrasta wraz z liczbą dawek
przypominających, których podawanie bezwzględnie
powinno być nadzorowane w tzw. grupach zagrożonych
lub wypełniających czynniki ryzyka (np. wiek).
Rola cytokin w obrazie choroby COVID-19
oraz w następstwie szczepionek
skierowanych przeciw antygenom
SARS-2-CoV-2
Najbardziej spektakularny, statystycznie znamienny
i szeroko potwierdzony wzrost cytokin dotyczył che-
mokiny IL-8, zarówno systemowo (krążącej we krwi)
jak i przesiękającej do męskiego układu płciowego (badana
w nasieniu). Poziom IL-8 w plazmie nasiennej różni-
cował pacjentów przechodzących chorobę COVID-19,
również tych zaopatrywanych w sposób kwalifikowany
przez personel lekarski, wobec pacjentów hospitalizo-
wanych na oddziałach intensywnej opieki medycznej
(Gacci i wsp., 2021).
(Gacci i wsp., 2021). Ta wysoka aktywność IL-8 jako czyn-
nika chemotaktycznego per se nie stanowiła istotnego
zagrożenia, poza dramatycznym sygnałem wobec eska-
lacji reakcji prozapalnej i uruchomienia aktywności leu-
kocytów, które następnie wzbudzały zagrażające życiu
poziomy cytokin IL-17, TNF-α oraz IL-6, a w mniejszym
stopniu IFN-γ, którego poziom w aspekcie pierwotnie
reagującego ramienia immunologicznego odpowiedzi
wrodzonej był w istocie czynnikiem dobroczynnym
dla uruchomienia szybkiego oporu przeciw czynnikowi
infekcyjnemu. Wysoki poziom cytokin wraz z urucho-
mieniem nieprzyjaznej kaskady czynników pro-koagu-
lacyjnych oraz apoptozy (przyspieszonej śmierci komór-
kowej) były w istocie najpoważniejszymi czynnikami
zagrażającemu życiu, w tym niewydolności oddechowej
i przyspieszonego włóknienia płuc. W aspekcie układu
płciowego męskiego należy wskazać na rolę cytokin
w rozkojarzeniu i zwiększeniu przepuszczalności bariery
krew–jądro, a w jej następstwie wtargnięciu czynników
układu odpornościowego na teren narządu uprzywile-
jowanego immunologicznie, jakim jest gonada męska.
Dalszą konsekwencją wymienionej kaskady było obni-
żenie spermatogenezy i steroidogenezy
(Gacci i wsp., 2021).
(Gacci i wsp.,
2021). Jakkolwiek ponad wszelką wątpliwość udowod-
niono, że przyjęte do bezpiecznego obiegu szczepionki
nie powodowały (i nadal nie powodują) obniżenia jakości
nasienia w odniesieniu do ich podstawowych parametrów
tj. koncentracji, ruchliwości i morfologii, to jednak indu-
kują one poziom systemowych, krążących (i prawdopo-
dobnie przesiękających do układu rozrodczego obu płci)
cytokin, znanych z literatury jako niesprzyjające zdrowiu
reprodukcyjnemu (zwłaszcza w aspekcie roli TNF-α)
(du Fosse i wsp., 2019)
(du Fosse i wsp., 2019). Nasze pionierskie badania własne
już wcześniej wskazywały na rolę czynnika męskiego
w nawracających poronieniach
(Havrylyuk i wsp., 2015)
(Havrylyuk i wsp., 2015)
dokumentując m. in. wysokie stężenia szeregu cytokin
tj. transformujący czynnik wzrostu beta 1 (TGF-β1,
ang. transforming growth factor beta 1), IL-18 czy IL-1β,
zarówno w idiopatycznej niepłodności jak i u partnerów
kobiet roniących (TGF-β1). Te obserwacje zdobyły rozgłos
i stały się podstawą dla wielu dalszych badań opisu-
jących podwyższony poziom cytokin u męskich part-
nerów kobiet z nawracającymi poronieniami
(du Fosse i wsp., 2019)
(du Fosse
i wsp., 2021). Panel badanych prozapalnych cytokin obej-
mował IL-1α, IL-1β, IL-6, IL-8, IL-12, IL-18 czy TNF-α.
Zwłaszcza ta ostatnia cytokina prozapalna jawi się jako
szczególnie interesująca, albowiem uniemożliwia ona
wczesny rozwój zarodkowy według obowiązującej hipo-
tezy „immunodewiacji” Wegmanna i silnie oddziałująca
pro-apoptotycznie. W tym aspekcie, wysokie poziomy
TNF-α obserwowane po kursie zakończonych trzech
szczepionek muszą się kojarzyć z analogicznym niebez-
pieczeństwem dla indukowania wczesnych poronień,
zarówno występując po stronie żeńskiej jak i męskiej.
Cytokina prozapalna TNF-α dodatkowo obniża poziom
antyoksydantów w nasieniu, umożliwiając w ten sposób
niebezpieczne przesunięcie potencjału redoks nasienia
w kierunku umożliwienia reakcji zapalnej i z tym zwią-
zanej sekrecji wolnych rodników tlenowych
(Sanocka i wsp., 2003).
(Sanocka i wsp., 2003). Według nieopublikowanych obserwacji
własnych, poziom TNF-α u mężczyzn szczepionych
przeciw SARS-2-CoV-2 (zarówno szczepionkami mRNA
jak i antygenowymi) może dochodzić do stężenia kil-
kunastu tysięcy pg/mL, przy poziomie fizjologicznym
nie przekraczającym 1370 pg/mL. Nie wchodząc zbyt
głęboko w hipotezę Johna Aitkena, która sugeruje poja-
wienie się uprzywilejowanego toru mutacji wykluczającej
odnowę spermatogonialną (na co nie ma jednoznacz-
nych dowodów), albowiem plemniki poddane oksyda-
cyjnemu działaniu mogą ujawniać zmiany (mutacje) de
novo w jądrowym DNA, co w konsekwencji może prowa-
dzić do zwiększonej częstości pojawienia się w populacji
ludzkiej chorób genetycznych dziedziczonych w sposób
dominujący (np. zespół Marfana). Ponadto, oksydacyjne
działanie może dotyczyć tzw. miejsc „gorących” (ang. hot
spots) w chromosomach, które są szczególnie podatne
na czynniki mutagenne, co powoduje zwiększony odsetek
dzieci autystycznych z chorobą dwubiegunową czy schi-
zofrenią
(Aitken i wsp., 2020)
(Aitken i wsp., 2020) (Rycina 4). Przystępując
obecnie do prokreacji, należy przyjąć, że jest to okres
szczególnych wymagań dla obu stron, a ewentualne
skutki szczepień i/lub szczepień powiązanych z prze-
byciem COVID-19 mogą wymagać terapii przygoto-
wawczej. Obniżenie cytokin prozapalnych uzyskuje się
zwykle terapią immunosupresyjną (wyzwanie dla jej sto-
sowania w warunkach epidemicznych) lub też w przy-
padku nadmiernego ryzyka – przy pomocy leczenia bio-
logicznego (dosyć kosztownego) z użyciem swoistych
przeciwciał skierowanych przeciwko TNF-α i/lub IL-6.
Monitorowanie poziomu cytokin jest absolutnie w tych
przypadkach wskazane ze względu na czynniki ryzyka
(obniżenie odporności) czy koszty (w perspektywie)
terapii swoistej. Zatem brak bezpośredniego wpływu
szczepionek na jakość gamet męskich w ejakulacie nie
może być przewodnim argumentem dla ich neutralności
wobec szeroko pojętego zdrowia reprodukcyjnego, które
ma znacznie szerszy wymiar, niż to, czym zwykle kie-
rujemy się pomagając niepłodnym parom w osiągnięciu
ich marzeń o posiadaniu potomstwa. Społeczną i rodzi-
cielską troską winno być albowiem także lub przede
wszystkim, powoływanie do życia pokoleń zdrowych
zarówno somatycznie jak i psychicznie.