Tom 9 • Numer 2 • Grudzień 2022

KOMITET REDAKCYJNY
Redaktor naczelny:
Redaktor naczelny:dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego: prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:dr hab. n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:dr hab. n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst, Republika Południowej Afryki (Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga, Dania (Copenhagen, Denmark)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Zakład Histologii i Biologii Rozwoju Wydział Nauk o Zdrowiu Pomorski Uniwersytet Medyczny w Szczecinie 71-210 Szczecin ul. Żołnierska 48 tel. 91 48 00 917, 91 48 00 908 e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Waldemar Jachimczak
Małgorzata Piasecka
Kamil Gill
Korekta języka polskiego:
Małgorzata Piasecka
Kamil Gill
Korekta języka angielskiego:Joanna Ingielewicz
Małgorzata Piasecka
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI
O czasopiśmie / About Journal 4
Artykuły poglądowe / Review
Weronika Ratajczak
Mikrobiota jelitowa, choroby zapalne jelit a choroby gruczołu krokowego
Intestinal microbiota, inflammatory bowel diseases and prostate diseases 6
Adam Łukaszuk, Mariusz Łukaszuk, Gulam Bahadur
Treatment-induced bone loss in prostate cancer patients: an insight
into the gonadal control of bone remodelling 18
Instrukcje dla autorów / Instructions for authors 26
Recenzenci prac opublikowanych w 2022 r. / Reviewers in 2022 30
O CZASOPIŚMIE
Wersja elektroniczna czasopisma jest wersją pierwotną. Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open
Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.
The electronic version of the journal is a original version. Access to scientific information published in the journal is free and
unlimited (Open Access).
O CZASOPIŚMIE
Wersja elektroniczna czasopisma jest wersją pierwotną. Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open
Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.
The electronic version of the journal is a original version. Access to scientific information published in the journal is free and
unlimited (Open Access).
Zaburzenia męskiego układu płciowego dotyczą osób
w różnym wieku i w większości przypadków prowadzą
do niepłodności, która nabrała już rangi choroby cywilizacyjnej. Najczęściej identyfikowanymi nieprawidłowościami są hipogonadyzm, zaburzenia seksualne, wady
rozwojowe narządów płciowych, nowotwory jąder i prostaty. Ze względu na specyficzne i coraz bardziej zanieczyszczone środowisko antropogeniczne dotyczą one
głównie społeczeństw rozwiniętych, w tym również
Polski, i stanowią istotny oraz narastający problem
medyczny, społeczny, demograficzny, a także zdrowia
publicznego. Nauka, która zajmuje się fizjologią i zaburzeniami męskiego układu płciowego w aspekcie nauk
podstawowych i klinicznych, to andrologia. Ponieważ
jest to młoda dziedzina nauki, jeszcze do niedawna niezadowalający stan wiedzy ograniczał możliwości diagnostyki oraz leczenia zaburzeń męskiego układu płciowego.
Jednak w ostatnich latach obserwuje się niezwykle dynamiczny rozwój andrologii, szczególnie molekularnej, spowodowany wprowadzeniem nowych metod badawczych
z zakresu biochemii, biologii i genetyki molekularnej.
Andrologia staje się dziedziną interdyscyplinarną integrującą wiedzę z różnych dyscyplin medycznych i naukowych.
Informacje związane z tymi zagadnieniami z trudem
docierają do lekarzy i osób zainteresowanych w naszym
kraju, ponieważ jest niewiele literatury w języku polskim,
a wykłady wygłaszane podczas konferencji nie zawsze
wyczerpująco wyjaśniają wątpliwości dotyczące m.in.
postępowania diagnostycznego, terapeutycznego, rekomendacji czy też proponowanych algorytmów. Stąd też
potrzeba stworzenia czasopisma prezentującego wiedzę
andrologiczną lekarzom różnych specjalności, diagnostom laboratoryjnym i przedstawicielom nauk podstawowych. Czasopismo „Postępy Andrologii Online” powstało
z inicjatywy Polskiego Towarzystwa Andrologicznego,
które zainteresowane jest integracją środowiska osób
zajmujących się różnymi aspektami męskiego układu
płciowego, uzupełnieniem i poszerzeniem ich wiedzy,
a także poprawą opieki zdrowotnej nad mężczyznami
w naszym kraju.
Celem czasopisma jest: 1) dostarczenie istotnych
informacji na temat fizjologii i patologii męskiego układu
płciowego, 2) propagowanie praktycznej wiedzy andrologicznej kierowanej do szerokich kręgów odbiorców,
3) wymiana poglądów i opinii na temat zagadnień klinicznych oraz wyników badań doświadczalnych oraz
4) przekazywanie informacji dotyczących konferencji
i kursów o tematyce andrologicznej.
Proponowana tematyka czasopisma to: 1) andrologia
kliniczna z uwzględnieniem etiopatogenezy, diagnostyki i leczenia m.in. zaburzeń rozwojowych, niepłodności i procesów starzenia mężczyzn, 2) nowatorskie
metody diagnostyczne, 3) andrologia doświadczalna
rozwijająca się w oparciu o nauki podstawowe oraz
4) inne interdyscyplinarne tematy związane z dziedziną andrologii.
Czasopismo kierowane jest do lekarzy specjalności
bezpośrednio lub pośrednio związanych z andrologią,
m.in. urologów, endokrynologów, ginekologów, pediatrów, ale także do lekarzy rodzinnych spotykających się
z coraz częstszym problemem niepłodności partnerskiej
i problemami starzejących się mężczyzn. Ponadto naszą
intencją jest zdobycie zainteresowania diagnostów laboratoryjnych odgrywających istotną rolę w prawidłowym
postępowaniu terapeutycznym opartym na szerokim
panelu testów i badań, których wdrożenie wciąż wymaga
odpowiednich i wyczerpujących szkoleń z diagnostyki
andrologicznej, w tym seminologicznej. Mamy nadzieję,
że nasze czasopismo wzbudzi również zainteresowanie
biologów zajmujących się czynnością męskiego układu
płciowego w ramach nauk podstawowych, a także lekarzy
weterynarii oraz innych osób, które znajdą informacje
poszerzające ich wiedzę i kształtujące opinię z zakresu
szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac oryginalnych, kazuistycznych i krótkich komunikatów, jak
również prac poglądowych, opracowanych w kondensacyjnej, dydaktycznej i przystępnej formie. W pracach
tych autorzy powinni przedstawiać aktualny stan wiedzy
światowej oraz swoje opinie. Chcemy, aby czasopismo
spełniało rolę informatora i przewodnika w dziedzinie
andrologii oraz stanowiło forum dyskusyjne. Ponadto,
zapraszamy do publikowania artykułów będących
tłumaczeniem publikacji ukazujących się w języku angielskim, które przedstawiają istotne postępy w andrologii.
http://www.postepyandrologii.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska-Hilczer
wiceprzewodnicząca
Polskiego Towarzystwa Andrologicznego
MIKROBIOTA JELITOWA, CHOROBY ZAPALNE JELIT A CHOROBY GRUCZOŁU KROKOWEGO
Weronika Ratajczak
Katedra i Zakład Diagnostyki Funkcjonalnej i Medycyny Medycyny Fizykalnej,
Wydział Nauk o Zdrowiu, Pomorski Uniwersytet Medyczny w Szczecinie
Autor do korespondencji/corresponding author: Weronika Ratajczak, Katedra i Zakład Diagnostyki Funkcjonalnej
i Medycyny Medycyny Fizykalnej, Wydział Nauk o Zdrowiu, Pomorski Uniwersytet Medyczny w Szczecinie
ul. Żołnierska 54, 71-210 Szczecin
tel. +48 91 480 09 48, e-mail: weronika.ratajczak@pum.edu.pl
Otrzymano/received: 18.02.2023 r. Zaakceptowano/accepted: 22.03.2023 r.
DOI: 10.26404/PAO_2353-8791.2022.05
Weronika Ratajczak – dr n. med., mikrobiolog, absolwentka Uniwersytetu Szczecińskiego. Od 2023 r.
adiunkt w Katedrze i Zakładzie Diagnostyki Funkcjonalnej i Medycyny Fizykalnej Pomorskiego
Uniwersytetu Medycznego w Szczecinie. Współautorka prac naukowych i doniesień zjazdowych
prezentowanych na sympozjach krajowych i międzynarodowych. Członek Polskiego Towarzystwa
Andrologicznego, Polskiego Towarzystwa Histochemików i Cytochemików, Polskiego Towarzystwa
Immunologii Doświadczalnej i Klinicznej. Wykonawca projektów naukowych. Od 2022 r. współpracuje z Międzynarodowym Instytutem Nauk o Zdrowiu (ILSI) z siedzibą w Brukseli. Laureatka
Nagrody Polskiego Towarzystwa Andrologicznego im. Prof. Bokińca w 2022 r.
Weronika Ratajczak – PhD, microbiologist, graduate of the University of Szczecin. From 2023, assistant professor
at the Department of Functional Diagnostics and Physical Medicine, Pomeranian Medical University in Szczecin.
Co-author of scientific papers and congress reports presented at national and international scientific symposiums.
Member of the Polish Society of Andrology, Polish Society of Histochemistry and Cytochemistry, Polish Society
of Experimental and Clinical Immunology. Researcher of scientific projects. Since 2022, she has been cooperating
with the International Life Sciences Institute (ILSI) in Brussels. Winner Polish Society of Andrology Award of
Prof. Bokiniec for young scientists in 2022.
STRESZCZENIE
Istnieje coraz więcej dowodów potwierdzających wzajemne oddziaływanie między mikrobiomem jelitowym, a stanem zdrowia i rozwijającymi się chorobami. Symbiotyczny związek między mikrobiomem jelitowym, a gospodarzem jest kluczowy dla zachowania zdrowia
i dobrego samopoczucia. Zaburzenie równowagi symbiotycznej, nazywane również dysbiozą, może prowadzić do rozwinięcia się chorób
o podłożu zapalnym. Choroby te mogą być związane bezpośrednio z jelitami – zapalne choroby jelit, choroba Crohn’a, wrzodziejące
zapalenie jelita grubego, czy zespół nieszczelnego jelita. Zakłócenie równowagi mikrobioty jelitowej powoduje m.in. rozprzestrzenianie
się bakterii patogennych zasiedlających jelita, rozregulowuje działanie układu immunologicznego, co prowadzi do silnej odpowiedzi
zapalnej, a także zmniejszenie ilości korzystnych dla zdrowia metabolitów, m.in krótkołańcuchowych kwasów tłuszczowych wytwarzanych z udziałem bakterii jelitowych. Wynikiem przewlekłej odpowiedzi zapalnej w jelitach jest rozwój chorób zapalnych nie tylko
w miejscu występowania stanu zapalnego. Ostatnie badania wskazują na udział mikrobioty jelitowej w patogenezie chorób neurodegeneracyjnych, metabolicznych, chorób układu krążenia, czy procesów nowotworowych. Istnieją również badania wskazują na to,
że status mikrobioty jelitowej, poszczególne gatunki bakterii oraz ich metabolity mają również udział w rozwoju chorób prostaty. Chociaż
mechanizm ten nie został w pełni poznany, wydaje się, że jednym z czynników jest inicjacja stanu zapalnego w gruczole krokowym.
Słowa kluczowe: microbiota jelitowa, zapalenie jelita, gruczoł krokowy
Skróty / Abbreviations
ATT – doustne terapie antyandrogenowe (ang. oral androgen receptor axis-targeted therapies); BPH – łagodny rozrost prostaty (ang. benign
prostatic hyperplasia); CD – choroba Crohn’a (ang. Crohn’s disease); CRPC – rak prostaty oporny na kastrację chemiczną (ang. castration-
-resistant prostate cancer); CZ – strefa centralna (ang. central zone); DAMP – wzorce molekularne związane z uszkodzeniami komórkowymi
(ang. damage associated molecular patterns); GALT – tkanka limfatyczna związana z jelitami (ang. gut-associated lymphoid tissue); GF – sterylny, jałowy (ang. germ free); HAMP – sygnały powstające w wyniku zakłóceń procesów molekularnych homeostazy komórkowej (ang.
homeostasis-altering molecular processes); HSPC – nowotwór prostaty wrażliwy na hormonoterapię (ang. hormone-sensitive prostate cancer);
IBD – zapalna choroba jelit (ang. inflammatory bowel disease); IBS – zespół jelita drażliwego (ang. irritable bowel sndrome); JAM – łącznikowa
cząsteczka adhezyjna (ang. tight junctions); LRG1 – bogata w leucynę 1 glikoproteina α-2 (ang. leucine rich alpha 2 – glycoprotein 1); LPS –
lipopolisacharyd (ang. lipopolysaccharides); MALT – tkanka limfatyczna związana z błoną śluzową (ang. mucosa-associated lymphoid tissue);
MAMP – wzorce molekularna związane z mikroorganizmami (ang. microorganism-associated molecular patterns); MZ – strefa obwodowa
(ang. marginal zone); NIH – Narodowe Instytuty Zdrowia (ang. National Institutes of Health); NLR – receptory NOD-podobne (ang. NOD-like
receptors); OTU – operacyjne jednostki taksonomiczne (ang. operational taxonomic units); PAMP – wzorce molekularne związane z patogenami
(ang. pathogen associated molecular patterns); PCa – rak prostaty (ang. prostatic cancer); PSA – antygen specyficzny dla gruczołu krokowego
(ang. prostate-specific antigen); PRR – receptory rozpoznające wzorce (ang. pattern recognition receptors); SCFA – krótkołańcuchowe kwasy
tłuszczowe (ang. short-chain fatty acids); TGF-β – transformujący czynnik wzrostu β (ang. transforming growth factor-β); TJ – połączenia
ścisłe (ang. tight junctions); TLR – receptory Toll-podobne (ang. Toll-like receptors); TNF-α – czynnik martwicy nowotworów α (ang. tumor
necrosis factor-α); TZ – strefa przejściowa (ang. transitional zone); UC – wrzodziejące zapalenie jelita grubego (ang. ulcerative colitis)
Choroby prostaty
Prostata jest gruczołem męskiego układu moczowo-płciowego, znajdującym się poniżej pęcherza moczowego, który
otacza cewkę moczową. Anatomicznie w budowie gruczołu wyróżnia się dwa płaty (prawy i lewy płat) połączone więziną. Każdy z płatów jest podzielony na trzy
strefy: środkową, przejściową i obwodową (model zaproponowany przez McNeal’a)
(McNeal 1981;)
(Holmes i wsp., 2012)
(McNeal 1981;
Holmes i wsp., 2012). Centralna (środkowa) strefa gruczołu (CZ, ang.
central zone) otacza przewody wytryskowe i przebiega
poniżej podstawy pęcherza moczowego. Przejściowa
strefa (TZ, ang. transitional zone) otacza bliższy odcinek
cewki moczowej, natomiast obwodowa strefa (MZ, ang.
marginal zone) stanowi jej górną, boczną oraz tylną część.
U zdrowego mężczyzny strefa przejściowa składa się
w 5–10% tkanki gruczołowej, strefa centralna stanowi
20–25% masy gruczołu, a część obwodowa to 70%
tkanki tego gruczołu. W przypadku wystąpienia czynników inicjujących zrąb strefy przejściowej i gruczoły
cewkowe podlegają rozrostowi i są miejscem gdzie rozwija
się łagodny rozrost prostaty (BPH, ang. benign prostatic
hyperplasia), natomiast strefa obwodowa to najczęstsze
miejsce rozwoju zmian o charakterze nowotworowym
(Verze i wsp., 2016).
(Verze i wsp., 2016).
W literaturze dostępnych jest wiele prac mówiących
o stanie zapalnym prostaty, jako wspólnym mianowniku
dla rozwoju chorób gruczołu krokowego
(Sciarra i wsp.,
2007;).
(Schenk i wsp., 2010;).
(de Nunzio i wsp., 2011;).
(Nickel
2015;).
(Gandaglia i wsp., 2017;).
(Cai i wsp., 2019;).
(Lloyd i wsp.,
2019;).
(Wang i wsp., 2022).
(Sciarra i wsp.,
2007; Schenk i wsp., 2010; de Nunzio i wsp., 2011; Nickel
2015; Gandaglia i wsp., 2017; Cai i wsp., 2019; Lloyd i wsp.,
2019; Wang i wsp., 2022). Wyniki badań epidemiologicznych, histopatologicznych oraz badania laboratoryjne
wskazują również, że stan zapalny jest niezwykle kluczowym elementem w patogenezie i progresji BPH i raka
prostaty (PCa, ang. prostatic cancer). Okazuje się, że przewlekły i utrzymujący się na niskim poziomie stan zapalny
gruczołu jest zaangażowany w patogenezę i progresję
obydwu jednostek chorobowych. Badania te wskazują
też, że stan zapalny gruczołu krokowego powinien być
szczególną i nową dziedziną badań podstawowych i klinicznych u pacjentów z BPH oraz PCa
(de Nunzio i wsp.,
2011).
(de Nunzio i wsp.,
2011). Przewlekły stan zapalny wynikający z narażenia
na czynniki patogenne oraz środowiskowe jest przyczyną
chorób nowotworowych m.in. żołądka, wątroby, czy jelita
grubego. W gruczole krokowym, przewlekły stan zapalny
jest inicjowany przez wiele bodźców – tych dobrze
znanych (m.in. bakteryjne i wirusowe zakażenia przenoszone drogą płciową), jak i nieznane czynniki wpływające na wystąpienie zapalenia, a które mają działanie
prozapalne w mikrośrodowisku gruczołu krokowego.
Stan zapalny jest diagnozowany na trzecim miejscu,
zaraz po BPH i PCa, w przeciwieństwie do pozostałych
chorób gruczołu, może dotykać mężczyzn w każdej grupie
wiekowej. Obecnie stan zapalny został sklasyfikowany
przez amerykańskie Narodowowe Instytuty Zdrowia
(NIH, ang. National Institutes of Health) w czterech kategoriach, w zależności od czynnika wywołującego oraz
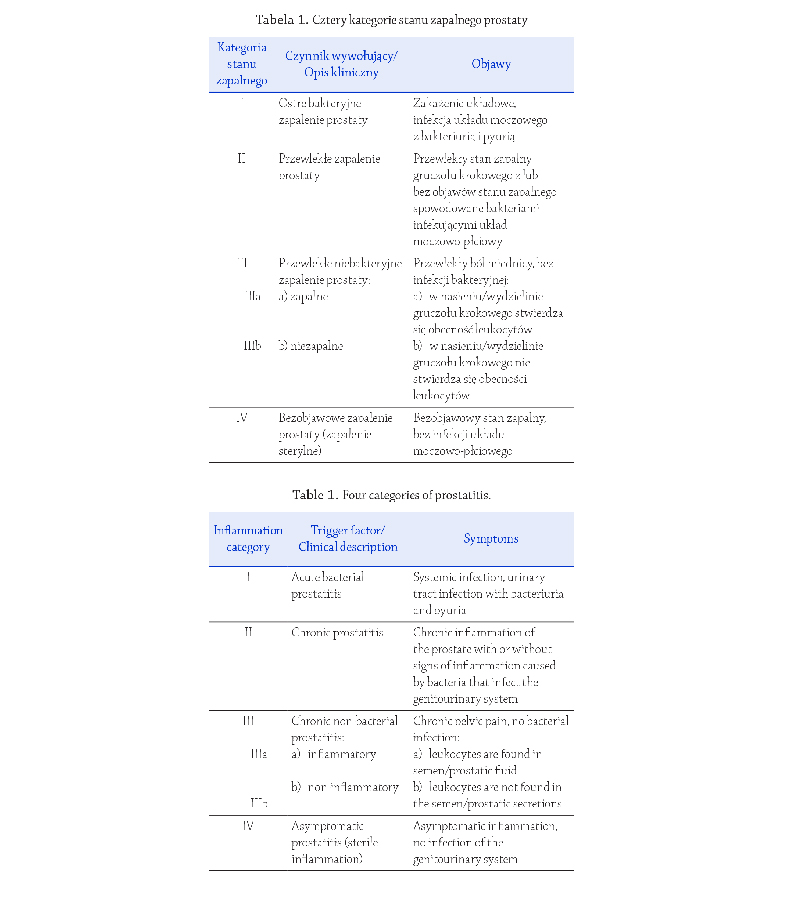
objawów klinicznych (Tabela 1)
(Nickel 2003;).
(Nickel 2011;).
(Khan i wsp., 2017;).
(Magri i wsp., 2019).
(Nickel 2003; Nickel 2011;
Khan i wsp., 2017; Magri i wsp., 2019).
Zapalenie prostaty może być także wynikiem i częścią
ogólnoustrojowego stanu zapalnego, spowodowanego
np. otyłością i występowaniem u mężczyzn zespołu
metabolicznego. Jego składowe wpływają na utrzymywanie się na niskim poziomie przewlekłego zapalenia,
a tym samym są związane z obecnością ogólnoustrojowych markerów stanu zapalnego (m.in. leptyny, IL-6,
czynnik martwicy nowotworów α [TNF-α, ang. tumor
necrosis factor-α]), co może przyczyniać się do rozwoju
procesów rozrostowych i nowotworowych w prostacie
(Hsing i wsp., 2007).
(Hsing i wsp., 2007).
W ostatniej dekadzie coraz więcej badań dotyczy
wpływu mikrobioty jelitowej na różne jednostki chorobowe. Jak dotąd potwierdzono jej związek z chorobami
jelit, zespołem metabolicznym, otyłością, chorobami
wątroby, rakiem jelita grubego, zaburzeniami ze spektrum autyzmu oraz chorobami neurodegeneracyjnymi
(Gérard, 2016; ).
(Ding i wsp., 2017;).
(Cheng i wsp., 2020; ).
(Wang
i wsp., 2020;).
(Vuotto i wsp., 2020;).
( Wang i wsp., 2021;).
(Wei
i wsp., 2021).
(Gérard, 2016; Ding i wsp., 2017; Cheng i wsp., 2020; Wang
i wsp., 2020; Vuotto i wsp., 2020; Wang i wsp., 2021; Wei
i wsp., 2021).
Mikrobiota jelitowa, stan eubiozy
Obecnie istnieje pogląd, że mikrobiota jelitowa odgrywa
jedną z ważniejszych ról w utrzymaniu zdrowia człowieka. Szacuje się, że w przewodzie pokarmowym znajduje się 4 × 1013 bakterii, co obejmuje tysiące różnych
gatunków oddziałujących na ludzki organizm w sposób
bezpośredni, jak i pośredni
(Sender i wsp., 2016).(Sender i wsp., 2016). Skład
mikrobioty jelitowej kształtuje się już od momentu urodzenia dziecka, a wpływają na to m.in.: sposób narodzin dziecka oraz rodzaj podawanego pokarmu
(Nagpal
i wsp., 2017).
(Nagpal
i wsp., 2017). Mikrobiota jelitowa zdrowych noworodków
zmienia się od pierwszego dnia przyjścia na świat,
do trzeciego roku życia dziecka. Początkowo, w składzie
mikrobioty jelitowej przeważają fakultatywne bakterie
anaerobowe z grupy Enterobacteriaceae, oraz bakterie
rodzajów Enterococcus i Staphylococcus. Wraz z dorastaniem dziecka, wprowadzaniem nowych produktów spożywczych oraz w wyniku ekspozycji na czynniki środowiskowe, skład tego ekosystemu zmienia się i w wieku
trzech lat, mikroflora jelitowa jest reprezentowana przez
obligatoryjne anaeroby, głównie Clostridium (C.) leptum,
C. coccidoides, Bifidobacterium oraz bakterie Bacteroides
fragilis
(Nagpal i wsp., 2017).
(Nagpal i wsp., 2017).
Dzięki metodom głębokiego sekwencjonowania
bakteryjnego materiału genetycznego z próbek kału
ustalono, jakie bakterie, niezależnie od indywidualnych cech, przeszłych chorób, diety i czynników środowiskowych, zasiedlają jelita. Z badań dostępnych
w literaturze wynika, że każda osoba ma swój stabilny
bakteryjny metagenom – wspólny genom mikroorganizmów środowiska jelitowego, który dostarcza informacji
na temat różnorodności mikrobiologicznej i ekologii tego
konkretnego środowiska. Zróżnicowana, ale zrównoważona mikrobioty jelitowej określana jest stanem eubiozy,
w którym przeważają korzystne gatunki mikrobioty należące głównie do dwóch rodzajów bakterii Bacteroidetes
i Firmicutes
(Maynard i wsp., 2012;).
(Iebba i wsp., 2016).
(Maynard i wsp., 2012; Iebba i wsp., 2016).
Poszczególne metagenomy (w tym głównie bakterie z bakterii z rodzaju Bacteroidetes i Firmicutes) mogą nieznacznie
odbiegać od tych wspólnych dla całej populacji. Obecność
tak specyficznego i stabilnego mikrobiomu zapewnia
sprawne funkcjonowanie całego ekosystemu jelitowego,
podlegając modyfikacjom przez całe dorosłe życie
((Qin i wsp., 2010).).
(Qin i wsp., 2010). W stanie eubiozy utrzymywana jest homeostaza immunologiczna błony śluzowej jelit i tkanki limfatycznej związanej z jelitami (GALT, ang. gut-associated
lymphoid tissue). Dzieje się tak, ponieważ wzorce molekularne związane z mikroorganizmami (MAMP, ang.
microorganism-associated molecular patterns) stymulują
wydzielanie cytokin uczestniczących w różnicowaniu
komórek dendrytycznych i makrofagów, co powoduje
aktywację komórek Treg. Ich aktywność przejawia się
w wydzielaniu IL-10, zaangażowanej w rozwój środowiska przeciwzapalnego. Dodatkowo, transformujący
czynnik wzrostu β (TGF-β, ang. transforming growth
factor-β), również wydzielany przez limfocyty Treg, stymuluje komórki plazmatyczne do wydzielania immunoglobuliny typu A. Ponadto stwierdzono, że jelitowa równowaga pomiędzy bakteriami Bacteroidetes i Firmicutes nie
jest cechą zdefiniowaną dla indywidualnego mikrobiomu
jelitowego. Mimo to, każdy posiada swoją osobistą równowagę pomiędzy Bacteroidetes, a zmienną grupą bakterii Firmicutes
(Claesson i wsp., 2011;).
(Lloyd-Price i wsp., 2017).
(Claesson i wsp., 2011; Lloyd-Price i wsp., 2017). Skład mikrobioty jelitowej człowieka ma wpływ
na utrzymanie zdrowia, ale bierze się również pod uwagę
jego rolę w wielu stanach patologicznych
(Holmes i wsp.,
2012).
(Holmes i wsp.,
2012). Mikrobiota wpływa na zdrowie gospodarza
poprzez składniki mikrobiologiczne, takie jak polisacharyd A
(Mazmanian i wsp., 2008).
(Mazmanian i wsp., 2008), metabolity bakteryjne: peptydy formylowe
(Bufe i wsp., 2015).
(Bufe i wsp., 2015), D-gliceroβ-D-manno heptoza-1,7 bosforanu
(Gaudet i wsp., 2015).
(Gaudet i wsp., 2015)
oraz metabolity pochodzące ze składników odżywczych
wytwarzane z udziałem bakterii: witamin, aminokwasów,
metabolitów będących ligandem dla receptora arylowo-
-węglowodorowego
(Jin i wsp., 2014;).
(Natividad i wsp.,
2018).
(Jin i wsp., 2014; Natividad i wsp.,
2018), poliaminy
(Hesterberg i wsp., 2018).
(Hesterberg i wsp., 2018) oraz krótkołańcuchowe kwasy tłuszczowe
(Gill i wsp., 2018).
(Gill i wsp., 2018).
Dysbioza jelitowa
Profilowanie mikrobiomu zdrowych osób pozwoliło
na uzyskanie danych charakteryzujących mikrobiotę
poszczególnych narządów, w tym prawidłową mikrobiotę
jelitową. Wyjaśniono, że międzyosobnicze różnice mikrobiomu ludzkiego są specyficzne, istotne funkcjonalnie
i spersonalizowane. Dodatkowo zauważono, że bakterie
z rodzaju Bacteroides dominują u osób, u których różnorodność bakterii z rodzaju Firmicutes jest mała
(Human
Microbiome Project Consortium, 2012).
(Human
Microbiome Project Consortium, 2012).
Szkodliwe zaburzenie złożonego systemu mikrobiomu, brak równowagi między mikroorganizmami
naturalnie kolonizującymi gospodarza oraz ich nieprawidłowe funkcjonowanie nazywa się dysbiozą. Zaburzenie
to może mieć długotrwałe implikacje składowe i funkcjonalne dla mikrobioty i gospodarza oraz może być
ważnym czynnikiem w patogenezie lub przewlekłości
niektórych chorób
(Sommer i wsp., 2017).
(Sommer i wsp., 2017). W makroorganizmach zamieszkałych przez mikroorganizmy
taka sytuacja wyzwala odpowiedź immunologiczną,
wpływa na metabolizm gospodarza i może przyczynić
się do rozwoju chorób o podłożu zapalnym
(Lee i wsp.,
2017;).
(Miyoshi i wsp., 2017;).
(Slingerland i wsp., 2017;).
(Zechner
2017;).
Saltzman i wsp., 2018).
(Lee i wsp.,
2017; Miyoshi i wsp., 2017; Slingerland i wsp., 2017; Zechner
2017; Saltzman i wsp., 2018). Dysbiozę charakteryzuje się również poprzez zmniejszenie różnorodności
(bogactwa) gatunków m.in. bakterii zasiedlających daną
niszę w organizmie. Taka różnorodność komensalnych
mikroorganizmów kształtuje się już od momentu narodzin
(Nagpal i wsp., 2017).
(Nagpal i wsp., 2017), a ponadto może być modulowana w zależności od nawyków żywieniowych
(Cotillard
i wsp., 2013).
(Cotillard
i wsp., 2013), ale również w wyniku otyłości i związanych z tym zmian metabolicznych w organizmie, czy
w wyniku przyjmowania leków
(Le Chatelier i wsp., 2013)..
(Le Chatelier i wsp., 2013).
Równowaga organizmów tworzących ekosystem zasiedlający jelita może jednak zostać zachwiana w wyniku
przyjmowania nie tylko antybiotyków o szerokim spektrum działania, ale również leków przeciwwirusowych
oraz przeciwgrzybiczych. Zmiany w składzie mikrobioty
jelita ludzkiego mogą być również związane z przyjmowaniem leków niebędących antybiotykami – inhibitorów
(Le Chatelier i wsp., 2013)..
(Le Chatelier i wsp., 2013).
pompy protonowej, niesteroidowych leków przeciwzapalnych, leków przeciwpsychotycznych oraz leków przeciwcukrzycowych – metforminy
(Maier i wsp., 2018).
(Maier i wsp., 2018).
Na modulowanie mikroflory jelitowej wpływa również
stosowana dieta, długotrwały stres oraz oddziaływanie
niekorzystnych czynników środowiskowych m.in. bisfenoluA
(Malaisé i wsp., 2017).
(Malaisé i wsp., 2017).
Obecnie można wyróżnić kilka typów dysbiozy
wynikającej z udziału różnych grup mikroorganizmów
i oddziaływania między nimi. Jednym z przykładów jest
obecność patobiontów – symbiotycznych mikroorganizmów, które w normalnych okolicznościach nie wpływają
na zdrowie gospodarza i nie wywołują reakcji zapalnej.
Jednak w określonych warunkach (wywołanych przez
środowisko) mogą potencjalnie powodować rozregulowany stan zapalny prowadzący do choroby
(Chow i wsp.,
2011).
(Chow i wsp.,
2011). Ponadto patobionty są zdolne do ekspansji podczas
epizodów stanu zapalnego i mogą zaostrzać proces chorobowy. Przykładem jest Clostridium difficile, Clostridium
perfringens, Fusobacterium nucleatum lub enterotoksyczny
szczep Bacteroidetes fragilis występują w zdrowym ludzkim
mikrobiomie jelitowym
(Maier i wsp., 2018).
(Maier i wsp., 2018), ale w niektórych przypadkach są uważane za czynniki patologiczne
(Fukugaiti i wsp., 2015;).
(Purcell i wsp., 2017;).
(Tajkarimi i wsp.,
2017;).
(Komiya i wsp., 2018).
(Fukugaiti i wsp., 2015; Purcell i wsp., 2017; Tajkarimi i wsp.,
2017; Komiya i wsp., 2018). Dodatkowym czynnikiem
występowania dysbiozy jest utrata bakterii komensalnych m.in. w wyniku eliminacji komórek bakteryjnych,
bądź hamowania ich namnażania
(Korem i wsp., 2015).
(Korem i wsp., 2015).
W badaniach na modelu mysim dowiedziono,
że dodatkowym czynnikiem wpływającym na stan
mikrobioty jelitowej jest jej starzenie się, co może przyczyniać się do wystąpienia układowego stanu zapalnego,
związanego właśnie ze starzeniem się organizmu (inflammaging)
(Fransen i wsp., 2017).
(Fransen i wsp., 2017). Przeprowadzone badania
sugerują, że „stara” mikrobiota jelitowa, przeszczepiona
myszom jałowym (GF, ang. germ free) powoduje u nich
wzmożoną produkcje TNF-α, którego przewlekłe wydzielanie może wpływać niekorzystnie na procesy metaboliczne, insulinooporność, a także uczestniczyć w zmianach zapalnych w ścianach tętnic. Stwierdzono również,
że „starzejąca się” mikrobiota jelitowa jest dużo większym źródłem prozapalnych czynników bakteryjnych
m.in. bakteryjnego lipopolisachatydu (LPS, ang. lipopolysaccharides), uwalnianych do krwioobiegu, niż mikrobiota młodych zwierząt. Stwierdzono również, że wraz
z wiekiem bakterie z rodziny Firmicutes przeważają nad
Bacteroidetes
(Kim i wsp., 2016;).
(Fransen i wsp., 2017).
(Kim i wsp., 2016; Fransen i wsp., 2017).
Badanie populacyjne na ludziach
(Claesson i wsp.,
2011).
(Claesson i wsp.,
2011) wykazało, że typ mikrobioty jelitowej dominujący u osób starzejących się to Bacteroidetes. U osób młodszych bardziej powszechnie występują bakterie z rodzaju
Firmicutes, które mogą się różnić u poszczególnych osób.
Inne badanie dostarczyło dowodów na indywidualne
różnice w mikrobiocie jelitowej między starzejącymi się
dorosłymi, w zależności od ich stanu zdrowia. Skład
mikrobioty jelitowej osób otrzymujących długoterminową opiekę stacjonarną koreluje z podwyższonym
poziomem markerów stanu zapalnego (IL-6, IL-8,
białka C-reaktywnego i TNF-α) oraz stanem odżywienia
(Claesson i wsp., 2012).
(Claesson i wsp., 2012). Analiza próbek kału przeprowadzona w tym badaniu ujawniła różnice w stężeniach
krótkołańcuchowych kwasów tłuszczowych (SCFA,
ang. short-chain fatty acids). Na podstawie sekwencjonowania metagenomowego oceniono częstotliwość
występowania genów drobnoustrojów odpowiedzialnych za wytwarzanie SCFA. Dowiedziono, że u pacjentów
długo hospitalizowanych znacznie rzadziej występują
geny kodujące enzymy zaangażowane w produkcję
maślanu i octanu niż u osób niehospitalizowanych. Dane
te pokazują, że SCFA należą do ważnych metabolitów
i znacząco wpływają na stan zdrowia
(Claesson i wsp., 2012).
(Claesson i wsp.,
2012). Dodatkowo w badaniu przeprowadzonym przez
(Kato i wsp. (2017)).
Kato i wsp. (2017), stwierdzono, że zmiany w składzie
populacji Bifidobacterium zasiedlającej jelita człowieka
są związane z wiekiem i różnią się między etapami życia.
Wraz ze starzeniem następuje spadek Bifidobacterium
breve i wzrost Bifidobacterium dentium
(Kato i wsp. (2017)).
(Kato i wsp., 2017).
Ostatnie badania wskazują również na udział mikroflory
jelitowej człowieka w starzeniu biologicznym. Proces starzenia się człowieka charakteryzuje się postępującym
zmniejszeniem funkcji narządów i spadkiem aktywności
fizycznej
(Maffei i wsp., 2017).
(Maffei i wsp., 2017). Klinicznie proces starzenia
związany jest z wieloma objawami, w tym: utratą masy
ciała, sarkopenią, pogorszeniem funkcji poznawczych
i niskim poziomem aktywności – razem objawy te wskazują na występowanie zespołu osłabienia, który jest związany z wiekiem „biologicznym”, a nie „chronologicznym”.
Badanie próbek kału wykazało, że bogactwo populacji
drobnoustrojów koreluje z kruchością (słabością) osób
starszych
(Maffei i wsp., 2017).
Maffei i wsp., 2017).
Do tej pory nie zostało jednoznacznie potwierdzone,
czy dysbioza jelitowa jest wynikiem czy przyczyną licznych chorób immunologicznych
((Penders i wsp., 2007;).
(Ni i wsp., 2017;).
(Nishida i wsp., 2018).
(Penders i wsp., 2007;
Ni i wsp., 2017; Nishida i wsp., 2018) oraz zaburzeń metabolicznych
(Org i wsp., 2017).
(Org i wsp., 2017). Zaburzenia składu i funkcjonowania mikroflory jelitowej towarzyszą wielu chorobom
zapalnym, np. zespole jelita drażliwego (IBS, ang. irritable
bowel sndrome), zapalnej chorobie jelit (IBD, ang. inflammatory bowel disease), w tym, przy chorobie Crohn’a (CD, ang.
Crohn’s disease), miażdżycy, atopowemu zapaleniu skóry,
łuszczycy, astmie, stwardnieniu rozsianemu i toczniowi
rumieniowatemu układowemu
(Slingerland i wsp., 2017).
(Slingerland i wsp., 2017).
Badanie populacyjne na ludziach (u mężczyzn w wieku
45–70 lat)
(Org i wsp., 2017).
(Org i wsp., 2017) wykazało związek między
mikroflorą jelitową a poziomem metabolitów w surowicy
(kwasów tłuszczowych, aminokwasów, lipidów i glukozy),
co może być związane z zaburzeniami metabolicznymi
w stanie przedcukrzycowym, rozwoju otyłości, insulinooporności i chorobach sercowo-naczyniowych u osób
starszych.
Ponadto wskazano również, że metabolity bakteryjne – SCFA mogą odgrywać ważną rolę w procesie starzenia. Według
(Riaz Rajoka i wsp. (2018)).
Riaz Rajoka i wsp. (2018) istnieje związek
między mikroflorą jelitową a chorobami związanymi
ze starzeniem się. Ponadto zmiana składu mikroflory jelitowej wpływa na wytwarzanie SCFA (głównie maślanu),
które mają właściwości przeciwzapalne, a obniżenie ich
poziomu może zwiększać stan zapalny u osób starszych
(Riaz Rajoka i wsp. (2018)).
(Riaz Rajoka i wsp., 2018).
Oprócz wzorców molekularnych związanych z mikroorganizmami (MAMP, ang. microorganism-associated
molecular patterns), które są wyrażane przez składniki
rezydentnej mikroflory, a także patogeny rozpoznawane
przez receptory rozpoznające wzorce (PRR, ang. pattern
recognition receptors), na mikroflorę jelitową gospodarza
i układ odpornościowy wpływają również metabolity
drobnoustrojów. W procesie beztlenowej fermentacji
węglowodanów z żywności – SCFA, które modulują
mechanizmy odpornościowe i zapewniają odporność
określoną przez integralność bariery jelitowej. Ta wysoce
wyspecjalizowana bariera złożona ze ściśle do siebie przylegających komórek nabłonka pokrytych warstwą śluzu
i blaszki właściwej błony śluzowej (łac. lamina propria) –
zasiedlona przez komórki uczestniczące w wrodzonej
i nabytej odpowiedzi immunologicznej (limfocyty T
i B, makrofagi oraz komórki dendrytyczne stanowiące
tkankę limfatyczną związaną z błoną śluzową [MALT,
ang. mucosa-associated lymphoid tissue]) – aktywnie uczestniczy w reakcjach homeostatycznych na mikroorganizmy
oraz fermentacji składników egzogennych – takich jak
błonnik pokarmowy, nie powodując przy tym stanów
zapalnych. Jeśli jednak bariera ta zostanie zaburzona,
mechanizmy wrodzonej i nabytej odpowiedzi immunologicznej indukują mechanizmy odpornościowe wobec
mikroorganizmów i naprawę uszkodzonej tkanki jelit
(Maynard i wsp., 2012).
(Maynard i wsp., 2012).
Choroby zapalne jelit
Wraz z coraz większą liczbą badań nad mikrobiotą jelitową, pojawia się coraz więcej dowodów, na to, że mikrobiota jelitowa wpływa na stan zdrowia pacjentów oraz jest
czynnikiem wpływającym na rozwój chorób (Rycina 1).
Dla zdrowia pacjenta bardzo ważne jest oddziaływanie
symbiotycznego mikrobiomu jelitowego na układ immunologiczny stanowiący o homeostazie jelit. Dlatego nie
jest zadziwiające, że zaburzenia mikrobioty jelitowej
są jedną z przyczyn IBD, które na podstawie obrazu
klinicznego, badań obrazowych oraz histopatologicznych dzieli się na: CD oraz wrzodziejące zapalenia jelita
grubego (UC, ang. ulcerative colitis)
(Pisani i wsp., 2022).
(Pisani i wsp., 2022).
Dokładny mechanizm etiologii IBD nie jest znany,
wiadomo jednak, że choroba jest wynikiem interakcji
wielu czynników, m.in. genetycznych, środowiskowych,
czy socjo-ekonomicznych
(Alshehri i wsp., 2021).
(Alshehri i wsp., 2021).
Ponadto, stan dysbiozy jelitowej przyspiesza proces
postępowania chorób jelit. Rezultatem zaburzenie
równowagi bakterii komensalnych i patogennych jest
nadprodukcja czynników prozapalnych zaostrzających
stan zapalny jelit. Wynikiem stanu zapalnego jest brak
integralności bariery jelitowej związanej z osłabieniem
funkcji ścisłych połączeń (TJ, ang. tight junctions), zmniejszoną ekspresją okludyny, klaudyny i cząstek adhezyjnych
(JAM, ang. tight junctions) oraz niedoborem komórek
kubkowych produkujących śluz. Kolejnym rezultatem
nieszczelności nabłonka jelit jest przenikanie i rozpoznawanie antygenów w świetle jelita prowadzące do ciągłej
aktywacji immunologicznej. Głównym, efektorowym
czynnikiem w przebiegu IBD jest TNF-α, który oddziałuje na transkrypcję białek TJ oraz indukuje apoptozę
enterocytów, co dodatkowo wpływa na zwiększenie przepuszczalności ściany jelita
(Michielan i wsp., 2015).
(Michielan i wsp., 2015). Bardzo
ważnym czynnikiem jest również znaczący spadek ilości
bakterii Faecalibacterium prausnitzii (Firmicutes) kolonizującej jelita zdrowych osób
(Alshehri i wsp., 2021).
(Alshehri i wsp., 2021)
(Rycina 2)

Przewlekłe stany zapalne są powszechnie znanym
czynnikiem towarzyszącym rozwojowi nowotworów.
Dane dostępne w literaturze wskazują, że IBD wiąże się
ze zwiększonym ryzykiem nowotworów jelit, takich jak
rak jelita grubego, czy gruczolakorak jelita cienkiego.
Ponadto, wykazano związek IBD z występowaniem nowotworów pozajelitowych, m.in. chłoniaka, czerniaka i raka
dróg żółciowych
(Pedersen i wsp., 2010;).
(Alshehri i wsp., 2021Kappelman i wsp.,
2014
2014).
Choroby jelit i mikrobiota jelitowa,
a stan zapalny gruczołu krokowego
Związek przewlekłego stanu zapalnego i zespołu objawów
ze strony miednicy mniejszej z dolegliwościami związanymi z jelitami był już opisywany w literaturze. Z obserwacji
(Magri i wsp. (2019)).
Magri i wsp. (2019) wynika, że na 232 pacjentów
ze zdiagnozowanym stanem zapalnym, 146 (63,2%)
z nich deklaruje dolegliwości i zaburzenia związane
z układem trawiennym (bóle brzucha, zaparcia, wzdęcia,
biegunki) i wcześniejsze infekcje układu moczowego.
W badaniach epidemiologicznych powiązano wzrost
zaburzeń związanych ze stanem zapalnym, a odżywieniem według „diety zachodniej”, w której przeważa spożywanie czerwonego mięsa, węglowodanów prostych,
tłuszczu, rafinowanych zbóż oraz niedostateczne spożywanie warzyw, owoców i ryb. Uszkodzenia spowodowane dietą wynikają z braku zdolności zaadoptowania się ludzkiego genomu, do szybkich zmian
w otoczeniu, zwłaszcza diety
(Magri i wsp. (2019)).
(Magri i wsp., 2019).
Stosowana dieta znacząco wpływa na stan zapalny
w organizmie, zarówno w na komórki organizmu, jaki
i na skład mikroflory jelitowej. Komórki jelit, głównie
enterocyty i komórki immunokompetentne, są zaangażowane w system rozpoznawania składników żywności.
Komórki jelit wykazują ekspresję receptorów PRR, wśród
których wyróżnia się receptory Toll-podobne (TLR, ang.
Toll-like receptors), receptory NOD-podobne (NLR, ang.
NOD-like receptors) oraz bogatą w leucynę 1 glikoproteina α-2 (LRG1, ang. leucine rich alpha 2 – glycoprotein 1).
Receptory te rozpoznają zarówno wzorce molekularne
związane z patogenami (PAMP, ang. pathogen associated molecular patterns), wzorce molekularne związane
z uszkodzeniami komórkowymi (DAMP, ang. damage
associated molecular patterns) oraz sygnały powstające
w wyniku zakłóceń procesów molekularnych homoeostazy komórkowej (HAMP, ang. homeostasis-altering
molecular processes). Stan zapalny bez obecności organizmów patogennych może wystąpić w każdej tkance, jako
odpowiedź na wewnętrzną stymulację związaną z zaburzeniem równowagi komórkowej – stan taki nazywany
jest „sterylnym zapaleniem” (ang. ‘sterile inflammation’).
W odniesieniu do składników odżywczych, niektóre
z nich mogą spowodować stres komórkowych i prowadzić do uszkodzeń komórek. Wynikiem tego będzie
zwiększone uwalnianie czynników DAMP, z komórek
i pobudzanie receptorów komórkowych (TLR, NLR),
co będzie wiązało się z odpowiedzią immunologiczną
niezależną od obecności patogenów.
Okazuje się, że w patogenezę ostrego i przewlekłego
zapalenia gruczołu krokowego może być również zaangażowany ogólnoustrojowy stan zapalny o niskim stopniu
nasilenia, który nie musi wynikać bezpośrednio z obecności patogenów bakteryjnych. Jako kolejny czynnik
przyczyniający się do wystąpienia stanu zapalnego prostaty wskazuje się również zwiększona przepuszczalność jelit, obecność bakteryjnych patobiontów jelitowych
oraz ich migracja przez ścianę jelit. Ponadto, powtarzane
terapie antybiotykami, które często towarzyszą klinicznemu procesowi infekcji układu moczowo-płciowego
i gruczołu krokowego, stanowią czynnik, który wielokrotnie nasila dysbiozę związaną z tymi chorobami.
Dlatego bardzo ważne jest podkreślenie znaczenia terapii
bakteriami probiotycznymi w przywracaniu eubiozy
i zatrzymaniu błędnego koła infekcji dysbiozy jelitowej i układu moczowo-płciowego
(Magri i wsp. (2019)).
(Magri i wsp., 2019).
Postawiono także hipotezę, że stany zapalne jelit m.in.
w przebiegu IBD i związane z tym zaburzenia funkcjonowania nabłonka jelitowego i jego bariery, również są czynnikiem wpływającym na wystąpienie stanu zapalnego
gruczołu krokowego, co w konsekwencji może prowadzić do raka prostaty lub łagodnego rozrostu gruczołu
(Sfanos i Joshu 2019).
(Sfanos i Joshu 2019).
Związek IBD z ryzykiem wystąpienia PCa po raz
pierwszy wykazał
(Burns i wsp. (2019).).
Burns i wsp. (2019). W jednoośrodkowym badaniu retrospektywnym przenalizowano
historię chorób pacjentów z rakiem prostaty bez IBD
(n = 9 306) oraz ze zdiagnozowanym IBD (n = 1 033) a,
ponadto przeprowadzono analizę pomiarów stężenia
antygenu specyficznego dla gruczołu krokowego (PSA,
ang. prostate-specific antigen). Wnioskiem płynącym
z badań jest to, że mężczyźni z nieswoistym zapaleniem
jelit mają od czterech do pięciu razy większe ryzyko rozpoznania raka prostaty. Jest to pierwsze badanie, które pokazuje, że ci mężczyźni mają wyższe niż przeciętne wartości
PSA i znacznie wyższe ryzyko wystąpienia raka prostaty.
Ponadto, w grupie pacjentów z IBD przeważała częstość
występowania przypadków PCa o znaczeniu klinicznym
(na 100 tys. osobolat, w grupie z IBD – 462 przypadki,
w grupie bez IBD – 115 przypadków)
(Burns i wsp. (2019).).
(Burns i wsp., 2019).
W metaanalizie przeprowadzonej na podstawie dziewięciu badań również wskazano, że występujące u mężczyzn IBD znacząco zwiększa ryzyko wystąpienia raka
prostaty
(Ge i wsp., 2019).
(Ge i wsp., 2019). Wraz z zastosowaniem kryterium podziału zapalnych chorób jelit na UC i CD,
analiza ta wykazała, że tylko pacjenci z UC są narażeni
na zwiększone ryzyko wystąpienia PCa, takiej zależności
nie zaobserwowano u mężczyzn z CD
(Ge i wsp., 2019).
(Ge i wsp., 2019).
Co więcej, choroby zapalne jelit w znaczący sposób
wpływają na przebieg leczenia operacyjnego u mężczyzn
z rakiem prostaty, co wykazano w badaniu populacyjnych z udziałem 262 189 mężczyzn, wśród których 1,3%
(3 408 mężczyzn) stanowili pacjenci ze zdiagnozowanym
IBD. Stwierdzono, że u mężczyzn poddanych radykalnej
prostatektomii, u pacjentów z IBD, w przeciwieństwie
do mężczyzn bez chorób jelit, notowano wysoki odsetek
powikłań pooperacyjnych. Pacjenci z IBD mieli istotnie
więcej powikłań hematologicznych, powikłań związanych z przewodem pokarmowym, płucami, nerkami oraz
żylną chorobę zakrzepowo-zatorową. U pacjentów z IBD
zanotowano również istotnie wyższy odsetek zakażeń
pooperacyjnych, co jest związane z występującą u nich
immunosupresją wynikającą z przyjmowania kortykosteroidów, jak również leczenia przeciwnowotworowego
(Goldberg i wsp., 2021).
(Goldberg i wsp., 2021).
Przyczyną oddziaływania IBD na rozwój chorób
prostaty jest przewlekły stan zapalny towarzyszący
chorobom jelit. Chroniczne zapalenie jest czynnikiem
ryzyka wielu chorób i
(Meyers i wsp., 2020)
(Meyers i wsp., 2020) wiąże się z rozwojem nowotworów. W wielu badaniach potwierdzono
związek chorób zapalnych jelit z rakiem jelita grubego.
Długo trwający stan zapalny sprzyja rozwojowi procesu
nowotworowego w gruczole krokowym m.in. w wyniku
indukcji uszkodzeń DNA oraz przez zaburzenia epigenetyczne sprzyjające kancerogenezie. Obserwacje kliniczne
również potwierdzają, że u pacjentów chorujący na IBD
przez czas dłuższy niż 20 lat, czyli narażonych na długotrwały stan zapalny, rozwija się nowotwór prostaty
(Meyers i wsp., 2020)
(Meyers i wsp., 2020). W prospektywnym badaniu przeprowadzonym przez
(Meyers i wsp., 2020)
Meyers i wsp. (2020), w którym wzięło
udział 218 084 mężczyzn z Wielkiej Brytanii podobnie
jak w innych badaniach, wykazano, że u mężczyzn z IBD,
w szczególności z UC znacząco wzrasta ryzyko rozwoju
PCa. Z kolei w badaniach kohortowych wśród populacji
azjatyckiej, nie wykazano związku pomiędzy występowaniem IBD, a wzrostem ryzyka zachorowania na raka
prostaty
(Na i wsp., 2022).
(Na i wsp., 2022).
Gruczoł krokowy nie jest bezpośrednio połączony
z układem pokarmowym (chociaż tylna część gruczołu jest położona przy odbytnicy i do niej przylega)
i dokładny mechanizm oddziaływania pomiędzy jelitami i mikrobiotą zasiedlającą tę niszę nie został jeszcze
w pełni wytłumaczony. Mimo to w literaturze dostępne
są badania potwierdzające wpływ chorób jelit oraz stanu
i funkcjonowania mikrobioty jelitowej na rozwój procesu
chorobowego w prostacie.
W badaniach pilotażowych przeprowadzonych przez
(Golombos i wsp. (2018)).
Golombos i wsp. (2018), w grupie 20 mężczyzn (8 z BPH
i 12 z PCa) potwierdzono, że wśród mikrobioty jelitowej
u mężczyźni z PCa dominuje Bacteroides massiliensis, która
przeważa również u pacjentów z rakiem jelita grubego.
Natomiast w grupie mężczyzn z BPH zaobserwowano
większą względną liczebność Faecalibacterium prausnitzii
i Eubacterium rectale mających właściwości przeciwzapalne, co wiąże się z wytwarzaniem SCFA, czy stymulowaniu wytwarzania cytokin przeciwzapalnych.
W badaniach bioróżnorodności bakterii jelitowych
przeprowadzonych przez
(Liss i wsp. (2018),)).
Liss i wsp. (2018), wykazano związek między składem mikrobioty jelitowej,
a potwierdzono diagnozą raka prostaty. Stwierdzono,
że u mężczyzn z PCa występuje znacznie więcej bakterii
z rodzaju Streptococcus i Bacteroides. Ponadto zauważono,
że w tej grupie mężczyzn dochodzi do zaburzeń: wytwarzania kwasu foliowego, innych witamin z grupy B oraz
metabolizmu argininy, co sugeruje że zmieniona mikrobiota jelitowa i zmiany w jej funkcjonowaniu, są czynnikiem sprzyjającym rozwojowi PCa.
W badaniach przeprowadzonych przez
( Sfanos i wsp.
(2018).
Sfanos i wsp.
(2018) przeprowadzono profilowanie mikrobioty w wymazach rektalnych u mężczyzn w różnym stadium raka
prostaty. Zauważono, że Ruminococcaceae i Akkermansia
muciniphila występują znacznie częściej u mężczyzn
przyjmujących doustne terapie antyandrogenowe (ATT,
ang. oral androgen receptor axis-targeted therapies), takie
jak octan abirateronu i enzulamid. Wyniki tych badań
sugerują, że doustna terapia hormonalna może zmieniać
mikrobiotę jelitową oraz oddziaływać na odpowiedź kliniczną na ATT lub też modulować działanie przeciwnowotworowe np. immunoterapii
( Sfanos i wsp.
(2018).
(Sfanos i wsp., 2018). Z kolei
w swoich badaniach
(Liu i wsp. (2020)).
Liu i wsp. (2020) wykazali, że istnieją znaczące różnice w składzie mikrobioty jelitowej
między pacjentami wrażliwymi na hormonoterapię raka
prostaty (HSPC, ang. hormone-sensitive prostate cancer),
a pacjentami ze zdiagnozowanym opornym na leczenie
PCa (CRPC, ang. castration-resistant prostate cancer).
W badaniu przeprowadzonym wśród 152 mężczyzn
w japońskiej populacji (96 zdiagnozowanych z rakiem

stercza, 56 bez diagnozy PCa) przeprowadzono sekwencjonowanie 16S rRNA w celu identyfikacji mikrobioty jelitowej. Wyniki badań wskazują, że u mężczyzn z wysokim
ryzykiem PCa (od 2 stopnia zaawansowania PCa w skali
Gleasona) znacząco wzrosła względna obfitość bakterii z rodziny Rikenellaceae oraz gatunków Alistipes
i Lachnospira, jak również innych gatunków bakterii
produkujących SCFA (Subdoligranulum, Lachnobacterium,
Christensenellaceae, Eggerthella). Ponadto, w tej grupie
pacjentów, na podstawie odczytów operacyjnych jednostek taksonomicznych (OTU, ang. operational taxonomic units) zdefiniowano 18 rodzajów bakterii mających
silną korelację (Rosemonas, Syntrophococcus, Kyotococcus,
p-75-a5, Aeromonas, Raoultella, Eggerthella, Lachnospira,
Phascolarctobacterium) lub jej brak, z występowaniem
PCa wysokiego ryzyka (Prionospira, Sebaldella, Kocuria,
Moryella, Anaerofilium, Atopobium, Peptostreptococcus,
Blautia. Acidaminococcus), co z punktu diagnostycznego
okazuje się być bardziej dokładne, niż oznaczenie PSA
(pole pod krzywą ROC [AUC]: 0,85 vs. 0,74)
(Matsushita
i wsp., 2021) .
(Matsushita
i wsp., 2021) (tabela 2).
Podobne badania przeprowadzono w grupie 66 mężczyzn ze stwierdzonym powiększeniem objętość gruczołu
krokowego ≥ 30 mL. U pacjentów z BPH stwierdzono
większą proporcję Firmicutes i Actinobacteria, natomiast
w grupie kontrolnej większa proporcję Bacteroidetes.
Stwierdzono również, że stosunek Firmicutes/Bacteroidetes
(F/B ratio) był znacząco wyższy u pacjentów z powiększoną prostatą (2,21 ± 0,39 vs. 1,61 ± 0,40, p = 0,015)
(Takezawa i wsp., 2021).
(Takezawa i wsp., 2021).
Finansowanie
Badania finansowane przez Pomorski Uniwersytet
Medyczny w Szczecinie (nr badań: WNoZ-322-03/S
/16/2020).
Podsumowanie
Choroby prostaty mają złożoną etiopatologię, komponentami wpływającymi na rozwój choroby mogą być czynniki genetyczne, dietetyczne, infekcje, zakłócenie równowagi hormonalnej, czy ekspozycja na toksyny. Wyniki
badań z ostatnich lat wskazują również na istnienie osi
„jelito–prostata” (ang. ‘gut–prostate axis’), gdzie specyficzne bakterie oraz ich metabolity, m.in. SCFA, biorą
udział w mechanizmach związanych z występowaniem
i rozwojem zarówno PCa, jak i BPH. Ponadto, specyficzna
mikrobiota jelitowa oddziałuje również na odpowiedź
organizmu na terapię stosowaną przy raku prostaty,
co okazuje się być ważne podczas planowania leczenia.
Badania, gdzie analizowany jest związek chorób jelit oraz
mikrobioty jelitowej, stanowią nowy kierunek w poznaniu
mechanizmów oraz czynników etiologicznych chorób
gruczołu krokowego
Piśmiennictwo
Alshehri D., Saadah O., Mosli M., Edris S., Alhindi R., Bahieldin A.: Dysbiosis of
gut microbiota in inflammatory bowel disease: Current therapies and potential for microbiota-modulating therapeutic approaches. Bosn J Basic Med
Sci. 2021, 21, 270–283. doi: 10.17305/bjbms.2020.5016. PMID: 33052081
Bufe B., Schumann T., Kappl R., Bogeski I., Kummerow C., Podgórska M. i wsp.:
Recognition of bacterial signal peptides by mammalian formyl peptide receptors: a new mechanism for sensing pathogens. J Biol Chem. 2015, 290,
7369–7387. doi: 10.1074/jbc.M114.626747. PMID: 25605714
Burns J. A., Weiner A. B., Catalona W. J., Li E. v., Schaeffer E. M., Hanauer S. B.,
Strong S. i wsp.: (2019). Inflammatory bowel disease and the risk of prostate
cancer. Eur Urol. 2019, 75, 846–852. doi: 10.1016/j.eururo.2018.11.039.
PMID: 30528221
Cai T., Santi R., Tamanini I., Galli I. C., Perletti G., Bjerklund Johansen T. E. i wsp.:
Current knowledge of the potential links between inflammation and prostate cancer. Int J Mol Sci, 2019, 20, 3833. doi: 10.3390/ijms20153833.
PMID: 31390729
Cheng Y., Ling Z., Li L.: The intestinal microbiota and colorectal cancer. Front
Immunol. 2020, 11, 615056. doi: 10.3389/FIMMU.2020.615056. PMID:
33329610
Chow J., Tang H., Mazmanian S. K.: Pathobionts of the gastrointestinal microbiota and inflammatory disease. Curr Opin Immunol. 2011, 23, 473–480.
doi: 10.1016/J.COI.2011.07.010. PMID: 21856139
Claesson M. J., Cusack S., O’Sullivan O., Greene-Diniz R., de Weerd H., Flannery
E. i wsp.: Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proc Natl Acad Sci U S A. 2011, 108 Suppl 1,
4586–4591. doi: 10.1073/pnas.1000097107. PMID: 20571116
Claesson M. J., Jeffery I. B., Conde S., Power S. E., O’Connor E. M., Cusack S. i wsp.:
Gut microbiota composition correlates with diet and health in the elderly.
Nature, 2012, 488, 178–184. doi: 10.1038/nature11319. PMID: 22797518
Cotillard A., Kennedy S. P., Kong L. C., Prifti E., Pons N., Le Chatelier E. i wsp.:
Dietary intervention impact on gut microbial gene richness. Nature, 2013,
500, 585–588. doi: 10.1038/nature12480. PMID: 23985875
de Nunzio C., Kramer G., Marberger M., Montironi R., Nelson W., Schröder F. i wsp.:
The controversial relationship between benign prostatic hyperplasia and
prostate cancer: the role of inflammation. Eur Urol. 2011, 60, 106–117. doi:
10.1016/j.eururo.2011.03.055. PMID: 21497433
Ding H. T., Taur Y., Walkup J. T.: Gut microbiota and autism: key concepts and
findings. J Autism Dev Disord. 2017, 47, 480–489. doi: 10.1007/S10803-
016-2960-9. PMID: 27882443
Fransen F., van Beek A. A., Borghuis T., Aidy S. El, Hugenholtz F., van der Gaast –
de Jongh C., i wsp.: Aged gut microbiota contributes to systemical inflammaging after transfer to germ-free mice. Front Immunol. 2017, 8:1385. doi:
10.3389/fimmu.2017.01385. PMID: 29163474
Fukugaiti M. H., Ignacio A., Fernandes M. R., Ribeiro Júnior U., Nakano V.,
Avila-Campos M. J. i wsp.: High occurrence of Fusobacterium nucleatum
and Clostridium difficile in the intestinal microbiota of colorectal carcinoma patients. Braz J Microbiol. 2015, 46, 1135–1140. doi: 10.1590/S1517-
838246420140665. PMID: 26691472
Gandaglia G., Zaffuto E., Fossati N., Cucchiara V., Mirone V., Montorsi F. i wsp.:
The role of prostatic inflammation in the development and progression of
benign and malignant diseases. Curr Opin Urol. 2017, 27, 99–106. doi:
10.1097/MOU.0000000000000369. PMID: 27906778
Gaudet R. G., Sintsova A., Buckwalter C. M., Leung N., Cochrane A., Li J. i wsp.:
Cytosolic detection of the bacterial metabolite HBP activates TIFA-dependent
innate immunity. Science. 2015, 348, 1251–1255. doi: 10.1126/science.
aaa4921. PMID: 26068852
Ge Y., Shi Q., Yao W., Cheng Y., Ma G.: The association between inflammatory bowel
disease and prostate cancer risk: a meta-analysis. Prostate Cancer Prostatic
Dis. 2019, 23, 53–58. doi: 10.1038/s41391-019-0177-7. PMID: 31591455
Gérard P.: Gut microbiota and obesity. Cell Mol Life Sci. 2016, 73, 147–162.
doi: 10.1007/S00018-015-2061-5. PMID: 26459447
Gill P. A., van Zelm M. C., Muir J. G., Gibson P. R.: Review article: short chain
fatty acids as potential therapeutic agents in human gastrointestinal and
inflammatory disorders. Aliment Pharmacol Ther. 2018, 48, 15–34. doi:
10.1111/apt.14689. PMID: 29722430
Goldberg I. P., Chang S. L., Kundu S. D., Chung B. I., Singer E. A.: Impact of
inflammatory bowel disease on radical prostatectomy outcomes and costs
of care. Prostate Int. 2021, 9, 66–71. doi: 10.1016/J.PRNIL.2020.08.001.
PMID: 34386447
Golombos D. M., Ayangbesan A., O’Malley P., Lewicki P., Barlow L., Barbieri
C. E. i wsp.: The role of gut microbiome in the pathogenesis of prostate cancer: a prospective, pilot study. Urology. 2018, 111, 122–128. doi: 10.1016/j.
urology.2017.08.039. PMID: 28888753
Hesterberg R. S., Cleveland J. L., Epling-Burnette P. K.: Role of polyamines in
immune cell functions. Med Sci (Basel), 2018, 6, 1–19. doi: 10.3390/medsci6010022. PMID: 29517999
Holmes E., Li J. V, Marchesi J. R., Nicholson J. K.: Gut microbiota composition and activity in relation to host metabolic phenotype and disease risk.
Cell Metab. 2012, 16, 559–564. doi: 10.1016/j.cmet.2012.10.007. PMID:
23140640
Hsing A. W., Sakoda L. C., Chua S. C.: Obesity, metabolic syndrome, and prostate cancer. Am J Clin Nutr. 2007, 86, 843-857. doi: 10.1093/ajcn/86.3.843s.
PMID: 18265478
Human Microbiome Project Consortium: Structure, function and diversity of
the healthy human microbiome. Nature, 2012, 486, 207–214. doi: 10.1038/
nature11234. PMID: 22699609
Iebba V., Totino V., Gagliardi A., Santangelo F., Cacciotti F., Trancassini M. i wsp.:
Eubiosis and dysbiosis: the two sides of the microbiota. New Microbiol.
2016, 39, 1–12. PMID: 26922981
Jin U.-H., Lee S.-O., Sridharan G., Lee, K., Davidson, L. A., Jayaraman, A. i wsp.:
Microbiome-derived tryptophan metabolites and their aryl hydrocarbon
receptor-dependent agonist and antagonist activities. Mol. Pharmacol. 2014,
85, 777–788. doi: 10.1124/mol.113.091165. PMID: 24563545
Kappelman M. D., Farkas D. K., Long M. D., Erichsen R., Sandler R. S., Sørensen
H. T. i wsp.: Risk of cancer in patients with inflammatory bowel diseases:
a nationwide population-based cohort study with 30 years of follow-up
evaluation. Clin Gastroenterol Hepatol. 2014, 12, 265-73.e1 doi: 10.1016/J.
CGH.2013.03.034. PMID: 23602821
Kato K., Odamaki T., Mitsuyama E., Sugahara H., Xiao J., Osawa R.: Age-related
changes in the composition of gut Bifidobacterium species. Curr Microbiol.
2017, 74, 987–995. doi: 10.1007/s00284-017-1272-4. PMID: 28593350
Khan F. U., Ihsan A. U., Khan H. U., Jana R., Wazir J., Khongorzul P. i wsp.:
Comprehensive overview of prostatitis. Biomed Pharmacother. 2017, 94,
1064–1076. doi: 10.1016/j.biopha.2017.08.016. PMID: 28813783
Kim K.-A., Jeong J.-J., Yoo S.-Y., Kim D.-H.: Gut microbiota lipopolysaccharide accelerates inflamm-aging in mice. BMC Microbiol. 2016, 16:9. doi:
10.1186/s12866-016-0625-7. PMID: 26772806
Komiya Y., Shimomura Y., Higurashi T., Sugi Y., Arimoto J., Umezawa S. i wsp.:
Patients with colorectal cancer have identical strains of Fusobacterium
nucleatum in their colorectal cancer and oral cavity. Gut. 2018, 68:1335-
1337.doi: 10.1136/gutjnl-2018-316661. PMID: 29934439
Korem T., Zeevi D., Suez J., Weinberger A., Avnit-Sagi T., Pompan-Lotan M.,
i wsp.: Growth dynamics of gut microbiota in health and disease inferred
from single metagenomic samples. Science. 2015, 349, 1101–1106. doi:
10.1126/science.aac4812. PMID: 26229116
Le Chatelier E., Nielsen T., Qin J., Prifti E., Hildebrand F., Falony G. i wsp.:
Richness of human gut microbiome correlates with metabolic markers.
Nature, 2013, 500, 541–546. doi: 10.1038/nature12506. PMID: 23985870
Lee N., Kim W.-U.: Microbiota in T-cell homeostasis and inflammatory diseases. Exp Mol Med. 2017, 49: e340. doi: 10.1038/emm.2017.36. PMID:
28546563
Liss M. A., White J. R., Goros M., Gelfond J., Leach R., Johnson-Pais T. i wsp.:
Metabolic biosynthesis pathways identified from fecal microbiome associated with prostate cancer. Eur Urol. 2018, 74, 575–582. doi: 10.1016/j.
eururo.2018.06.033. PMID: 30007819
Liu Y., Jiang H.: Compositional differences of gut microbiome in matched hormone-sensitive and castration-resistant prostate cancer. Transl Androl Urol.
2020, 9, 1937944–1931944. doi: 10.21037/TAU-20-566. PMID: 33209658
Lloyd G. L., Marks J. M., Ricke W. A.: Benign prostatic hyperplasia and lower
urinary tract symptoms: What is the role and significance of inflammation? Curr Urol Rep. 2019, 20:54 doi: 10.1007/S11934-019-0917-1. PMID:
31377881
Lloyd-Price J., Mahurkar A., Rahnavard G., Crabtree J., Orvis J., Hall A. B. i wsp.:
Strains, functions and dynamics in the expanded Human Microbiome Project.
Nature. 2017, 550, 61-66. doi: 10.1038/nature23889. PMID: 28953883
Maffei V. J., Kim S., Blanchard E., Luo M., Jazwinski S. M., Taylor C. M. i wsp.:
Biological Aging and the Human Gut Microbiota. J Gerontol A Biol Sci Med
Sci. 2017, 72, 1474–1482. doi: 10.1093/gerona/glx042. PMID: 28444190
Magri V., Boltri M., Cai T., Colombo R., Cuzzocrea S., de Visschere P.,
Giuberti, R. i wsp.: Multidisciplinary approach to prostatitis. Arch Ital Urol
Androl. 2019, 90, 227–248. doi: 10.4081/aiua.2018.4.227. PMID: 30655633
Maier L., Pruteanu M., Kuhn M., Zeller G., Telzerow A., Anderson E. E. i wsp.:
Extensive impact of non-antibiotic drugs on human gut bacteria. Nature.
2018, 555, 623–628. doi: 10.1038/nature25979. PMID: 29555994
Malaisé Y., Menard S., Cartier C., Gaultier E., Lasserre F., Lencina C., i wsp.: Gut
dysbiosis and impairment of immune system homeostasis in perinatallyexposed mice to Bisphenol A precede obese phenotype development. Sci
Rep, 2017, 7; 14472. doi: 10.1038/s41598-017-15196-w. PMID: 29101397
Matsushita M., Fujita K., Motooka D., Hatano K., Fukae S., Kawamura N. i wsp.:
The gut microbiota associated with high-Gleason prostate cancer. Cancer
Sci. 2021, 112, 3125–3135. v10.1111/CAS.14998. PMID: 34051009
Maynard C. L., Elson C. O., Hatton R. D., Weaver C. T.: Reciprocal interactions of the intestinal microbiota and immune system. Nature. 2012, 489,
231–241. v10.1038/nature11551. PMID: 22972296
Mazmanian S. K., Round J. L., Kasper D. L.: A microbial symbiosis factor prevents intestinal inflammatory disease. Nature. 2008, 453, 620–625. doi:
10.1038/nature07008. PMID: 18509436
McNeal J. E.: The zonal anatomy of the prostate. Prostate. 1981, 2, 35–49.
doi: 10.1002/pros.2990020105. PMID: 7279811
Meyers T. J., Weiner A. B., Graff R. E., Desai A. S., Cooley L. F., Catalona
W. J. i wsp.: Association between inflammatory bowel disease and prostate cancer: A large-scale, prospective, population-based study. Int J Cancer.
2020, 147, 2735–2742. doi: 10.1002/IJC.33048. PMID: 32399975
Michielan A., D’Incà R.: Intestinal permeability in inflammatory bowel disease: pathogenesis, clinical evaluation, and therapy of leaky gut. Mediators
Inflamm. 2015:628157 doi: 10.1155/2015/628157. PMID: 26582965
Miyoshi J., Bobe A. M., Miyoshi S., Huang Y., Hubert N., Delmont T. O. i wsp.:
Peripartum antibiotics promote gut dysbiosis, loss of immune tolerance,
and inflammatory bowel disease in genetically prone offspring. Cell Rep.
2017, 20, 491–504. doi: 10.1016/j.celrep.2017.06.060. PMID: 28700948
Na J. E., Kim T. J., Lee Y. C., Kim J. E., Kim E. R., Hong S. N. i wsp.: Risk of
prostate cancer in patients with inflammatory bowel disease: a nationwide cohort study in South Korea. Therap Adv Gastroenterol, 2022, 15:
:17562848221137430. doi: 10.1177/17562848221137430. PMID: 36458049
Nagpal R., Tsuji H., Takahashi T., Nomoto K., Kawashima K., Nagata S. i wsp.:
Ontogenesis of the gut microbiota composition in healthy, full-term, vaginally
born and breast-fed infants over the first 3 years of life: A quantitative bird’seye view. Front Microbiol, 2017, 8: 1388. doi: 10.3389/fmicb.2017.01388.
PMID: 28785253
Natividad J. M., Agus A., Planchais J., Lamas B., Jarry A. C., Martin R. i wsp.:
Impaired aryl hydrocarbon receptor ligand production by the gut microbiota is a key factor in metabolic syndrome. Cell Metab. 2018, 28:737-749.
doi: 10.1016/j.cmet.2018.07.001. PMID: 30057068
Ni J., Wu G. D., Albenberg L., Tomov V. T.: Gut microbiota and IBD: causation or correlation? Nat Rev Gastroenterol Hepatol. 2017, 14, 573-584. doi:
10.1038/nrgastro.2017.88. PMID: 28743984
Nickel J. C.: Classification and diagnosis of prostatitis: a gold standard?
Andrologia. 2003, 35, 160–167. doi: 10.1046/j.1439-0272.2003.00557.x.
PMID: 12780534
Nickel J. C.: Prostatitis. Can Urol Assoc J. 2011, 5, 306–315. doi: 10.5489/
cuaj.11211. PMID: 22031609
Nickel, J. C.: Role of prostatic inflammation in the clinical presentation of
benign prostatic hyperplasia. Eur Urol Suppl. 2015, 14, e1459–e1463. doi:
10.1016/S1569-9056(15)30500-5
Nishida A., Inoue R., Inatomi O., Shigeki B., Naito Y., Andoh A.: Gut microbiota
in the pathogenesis of inflammatory bowel disease. Clin J Gastroenterol.
2018, 11, 1–10. doi: 10.1007/s12328-017-0813-5. PMID: 29285689
Org E., Blum Y., Kasela S., Mehrabian M., Kuusisto J., Kangas A. J. i wsp.:
Relationships between gut microbiota, plasma metabolites, and metabolic
syndrome traits in the METSIM cohort. Genome Biol, 2017, 18: 70. doi:
10.1186/s13059-017-1194-2. PMID: 28407784
Pedersen N., Duricova D., Elkjaer M., Gamborg M., Munkholm P., Jess T.: Risk
of extra-intestinal cancer in inflammatory bowel disease: meta-analysis of
population-based cohort studies. Am J Gastroenterol. 2010, 105, 1480–
1487. doi: 10.1038/AJG.2009.760. PMID: 20332773
Penders J., Stobberingh E. E., Brandt P. A., Thijs C.: The role of the intestinal microbiota in the development of atopic disorders. Allergy. 2007, 62,
1223–1236. doi: 10.1111/j.1398-9995.2007.01462.x. PMID: 17711557
Pisani A., Rausch P., Bang C., Ellul S., Tabone T., Marantidis Cordina C. i wsp.:
Dysbiosis in the gut microbiota in patients with inflammatory bowel disease during remission. Microbiol Spectr. 2022, 10 :e0061622. doi: 10.1128/
spectrum.00616-22. PMID: 35532243
Purcell R. V., Pearson J., Aitchison A., Dixon L., Frizelle F. A., Keenan J. I.:
Colonization with enterotoxigenic Bacteroides fragilis is associated with
early-stage colorectal neoplasia. PLoS One. 2017, 12: e0171602. doi: 10.1371/
journal.pone.0171602. PMID: 28151975
Qin J., Li R., Raes J., Arumugam M., Burgdorf K. S., Manichanh C. i wsp.: A human
gut microbial gene catalogue established by metagenomic sequencing. Nature.
2010, 464, 59–65. doi: 10.1038/nature08821. PMID: 20203603
Riaz Rajoka M. S., Zhao H., Li N., Lu Y., Lian Z., Shao D. i wsp.: Origination,
change, and modulation of geriatric disease-related gut microbiota during
life. Appl Microbiol Biotechnol. 2018, 102, 8275–8289. doi: 10.1007/s00253-
018-9264-2. PMID: 30066188
Saltzman E. T., Palacios T., Thomsen M., Vitetta L.: Intestinal microbiome
shifts, dysbiosis, inflammation, and non-alcoholic fatty liver disease. Front
Microbiol, 2018, 9: 61. doi: 10.3389/fmicb.2018.00061. PMID: 29441049
Schenk J. M., Kristal A. R., Neuhouser M. L., Tangen C. M., White E., Lin
D. W. i wsp.: Biomarkers of systemic inflammation and risk of incident,
symptomatic benign prostatic hyperplasia: results from the prostate cancer prevention trial. Am J Epidemiol. 2010, 171, 571–582. doi: 10.1093/
aje/kwp406. PMID: 20142396
Sciarra A., di Silverio F., Salciccia S., Autran Gomez A. M., Gentilucci A., Gentile V.:
Inflammation and chronic prostatic diseases: Evidence for a link? Eur Urol.
2007, 52, 964–972. doi: 10.1016/j.eururo.2007.06.038. PMID: 17618043
Sender R., Fuchs S., Milo R.: Are we really vastly outnumbered? Revisiting
the ratio of bacterial to host cells in humans. Cell. 2016, 164, 337–340. doi:
10.1016/J.CELL.2016.01.013. PMID: 26824647
Sfanos K. S., Joshu C. E.: IBD as a risk factor for prostate cancer: what is the
link? Nat Rev Urol. 2019, 16, 271–272. doi: 10.1038/s41585-019-0157-7.
PMID: 30742047
Sfanos K. S., Markowski M. C., Peiffer L. B., Ernst S. E., White J. R., Pienta
K. J. i wsp.: Compositional differences in gastrointestinal microbiota in
prostate cancer patients treated with androgen axis-targeted therapies.
Prostate Cancer Prostatic Dis, 2018, 1, 539-548. doi: 10.1038/s41391-018-
0061-x. PMID: 29988102
Slingerland A. E., Schwabkey Z., Wiesnoski D. H., Jenq R. R.: Clinical evidence
for the microbiome in inflammatory diseases. Front Immunol. 2017, 8: 400.
doi: 10.3389/fimmu.2017.00400. PMID: 28446909
Sommer F., Anderson J. M., Bharti R., Raes J., Rosenstiel, P.: The resilience of
the intestinal microbiota influences health and disease. Nat Rev Microbiol.
2017, 15, 630–638. doi: 10.1038/nrmicro.2017.58. PMID: 28626231
Tajkarimi M., Wexler H. M.: CRISPR-Cas systems in bacteroides fragilis, an
important pathobiont in the human gut microbiome. Front Microbiol. 2017,
8: 2234. doi: 10.3389/fmicb.2017.02234. PMID: 29218031
Takezawa K., Fujita K., Matsushita M., Motooka D., Hatano K., Banno E. i wsp.:
The Firmicutes/Bacteroidetes ratio of the human gut microbiota is associated
with prostate enlargement. Prostate, 2021, 81, 1287–1293. doi: 10.1002/
PROS.24223. PMID: 34516694
Verze P., Cai T., Lorenzetti S.: The role of the prostate in male fertility, health
and disease. Nat Rev Urol. 2016, 13, 379–386. doi: 10.1038/nrurol.2016.89.
PMID: 27245504
Vuotto C., Battistini L., Caltagirone C., Borsellino G.: Gut microbiota and disorders of the central nervous system. Neuroscientist. 2020, 26, 487–502.
doi: 10.1177/1073858420918826. PMID: 32441219
Wan, P. X., Deng X. R., Zhang C. H., Yuan, H. J.: Gut microbiota and metabolic syndrome. Chin Med J (Engl.). 2020, 133, 808–816. doi: 10.1097/
CM9.0000000000000696. PMID: 32106124
Wang R., Tang R., Li B., Ma X., Schnabl B., Tilg H.: Gut microbiome, liver immunology, and liver diseases. Cell Mol Immunol. 2021, 18, 4–17. doi: 10.1038/
S41423-020-00592-6. PMID: 33318628
Wang S., Ji Y., Chen Y., Du P., Cao Y., Yang X. i wsp.: The values of systemic
immune-inflammation index and neutrophil-lymphocyte ratio in the localized prostate cancer and benign prostate hyperplasia: A retrospective clinical study. Front Oncol. 2022, 11: 812319. doi: 10.3389/fonc.2021.812319.
PMID: 35047413
Wei L., Singh R., Ro S., Ghoshal U. C.: Gut microbiota dysbiosis in functional gastrointestinal disorders: underpinning the symptoms and pathophysiology. JGH Open. 2021, 5, 976–987. doi: 10.1002/JGH3.12528.
PMID: 34584964
Zechner E. L.: Inflammatory disease caused by intestinal pathobionts. Curr
Opin Microbiol. 2017, 35, 64–69. doi: 10.1016/J.MIB.2017.01.011. PMID:
28189956
TREATMENT-INDUCED BONE LOSS IN PROSTATE CANCER PATIENTS: AN INSIGHT INTO THE GONADAL CONTROL OF BONE REMODELLING
Adam Łukaszuk1, Mariusz Łukaszuk2, Gulam Bahadur3
1The University of Edinburgh, College of Medicine and Veterinary Medicine, Edinburgh Medical School, 2Novique Aesthetic
and Anti-aging Medicine, 3North Middlesex University Hospitals Trust/ Homerton Hospitals NHS Trust, Reproductive
Medicine Clinic London
Corresponding author: Adam Łukaszuk, The University of Edinburgh, College of Medicine and Veterinary Medicine,
Edinburgh Medical School, Post Code: EH25 9RG, Easter Bush Campus, Scotland, UK
e-mail: alukaszuk1@gmail.com
Received: 12.01.2023 Accepted: 22.03.2023
DOI: 10.26404/PAO_2353-8791.2022.06
Adam Łukaszuk – medical student at the University of Edinburgh with an intercalating degree in
BSc Anatomy and Development. Co-author of a chapter in a book on diagnostic andrology. Winner
of the first prize at the Anatomy Competition organised by the University of Edinburgh. Received
a award from the Dean of Medical School for his academic performance during the second year
of medical (MBChB) degree.
Abstract
Prostate cancer is diagnosed in over 1.5 million new patients every year, with many of them requiring prolonged treatment, which –
particularly in advanced cases – involves androgen deprivation therapy with the use of luteinizing hormone-releasing hormone analogues. Amongst several side-effects resulting from dysregulation of the body’s hormonal control, skeletal changes have been associated
with the greatest patient burden. The skeletal system is a highly specialised component of the human body that is tightly regulated by
local and systemic factors. While the mechanism of bone remodelling has been described in detail by previous studies, the complex
mechanism of its control still remains to be fully elucidated. In this work, the authors aimed to conduct a systematic review of the
existing literature in an effort to synthesise the existing knowledge about the biochemical pathways involved in the control of bone
remodelling. This has been subsequently utilised to discuss the mechanisms by which gonadal hormones (oestrogens and androgens)
influence bone physiology, with regards to both established theories and emerging hypotheses. The scientific findings summarise in
the review might aid physicians in understanding the mechanism of androgen-deprivation-therapy-related bone loss and identifying
the most effective treatment regime. Whilst there currently seems to be a lack of scientific consensus on the precise aetiology of these
pathological changes, further explorations into the intricate properties of the human bone might yield exciting discoveries that could
contribute to the development of new clinical solutions for prostate cancer patients in the future.
Keywords: prostate cancer, androgen-deprivation therapy, bone loss, bone remodelling
Introduction
The skeletal system is a highly specialised component
of the human body which enables locomotion, provides
protection to major organs, and acts as a structural framework for interaction with the environment. Because of
the fundamental importance of these properties for functioning of the human organism, the skeleton undergoes
constant, tightly regulated processes of adaptation and
repair, collectively referred to as ‘bone remodelling’. This
work will aim to provide a comprehensive overview of the
biochemical mechanisms underpinning these structural
changes, which will then serve as a theoretical foundation for an exploration of the influence of androgens
and oestrogen on bone metabolism. The exact extent to
which systemic hormones affect bone remodelling will
be elucidated by conducting a literature-based analysis
of the pathogenesis of bone diseases in prostate cancer
patients with treatment-induced hypogonadism. Finally,
the aspects of bone physiology considered throughout the
essay will be applied to evaluate both conventional and
novel therapies available to this population of patients.
Mechanism of Bone Remodelling
When the uniquely diverse roles of the human skeleton
are considered in a collective manner, there appears to
be an evolutionary need for a mechanism that would
allow to actively adjust the balance between the bone’s
physical resistance and its motion-aiding lightness. This
has been addressed by bone remodelling, which provides the skeletal system with an ability to remove and
replace osseous tissue in response to mechanical stress
or microscopic injuries. By doing so, the bone maintains
its structural integrity whilst also permitting a degree
of phenotypic plasticity in the face of changing environmental requirements.
At its most fundamental level, the process of bone
remodelling is orchestrated by osteocytes, which are able
to detect changes within osseous tissue via a complex
network of actin-containing dendritic connections. When
the bone is subjected to mechanical loading, the arrangement of actin fibres becomes disrupted, resulting in an
opening of mechanosensitive calcium channels on the
surface of osteocytes
(Qin et al., 2020).
(Qin et al., 2020). The consequent
influx of ions stimulates osteocytes to release prostaglandin E2 (PGE2), which acts to increase the population
of osteoblasts at the region of bone tissue where remodelling is required
(Feyen et al., 1985).
(Feyen et al., 1985). The osteoblasts,
in turn, secrete macrophage colony stimulating factor
(M-CSF), promoting proliferation of osteoclast precursors
that join osteoblasts to form a basic multicellular unit.
These progenitor cells subsequently begin expression
of receptor activator of nuclear factor-kappa B (RANK),
which – upon stimulation by an osteoblast-derived
ligand (RANKL) – mediates their differentiation into
active osteoclasts.
Having adopted a mature phenotype, osteoclasts commence the process of bone resorption by synthesising
hydrochloric acid and proteolytic enzymes, such as matrix
metalloproteinases or cathepsin K
(Delaissé et al., 2003).
(Delaissé et al., 2003).
These biochemical factors act to degrade hydroxyapatite crystals and collagen matrix, leading to a localised
removal of osseous tissue. As the resorption progresses,
the activity of osteoclasts starts to be negatively regulated by osteoprotegerin (OPG), which is released from
osteoblasts to bind and thereby inhibit the actions of
free ligand for the receptor activator of nuclear factor B
(RANKL) molecules. Due to a decrease in RANKLmediated stimulatory signals, osteoclasts undergo apoptosis, which prevents further, unwanted bone resorption.
The external fragments of collagenous matrix –
exposed by osteoclasts – attract endocytic receptors of
‘reversal cells’ that act to phagocytose the remaining collagen fibres
(Abdelgawad et al., 2016).
(Abdelgawad et al., 2016). This prepares the
remodelled portion of the bone for attachment of osteoblasts, which subsequently utilise their extensive rough
endoplasmic reticulum to replace the resorbed tissue with
newly synthesised osteoid. Then, under what is hypothesised to be an osteocyte-mediated regulation, the premature bone matrix becomes fortified with hydroxyapatite crystals
(Atkins and Findlay, 2012).
(Atkins and Findlay, 2012). In consequence,
osteoblasts become enclosed within a mineralised bone
tissue, which causes them to commit apoptosis or differentiate into osteocytes that can initiate another cycle
of bone remodelling in the future.
When the process of bone remodelling is approached
from a broader perspective, it can be observed that the
RANKL:OPG ratio plays a crucial role in controlling
the degree of bone resorption and formation. Hence,
alterations to the relative proportions of both molecules
can allow for localised changes in bone structure – it
is through this mechanism that the skeletal system
responds to mechanical stimuli and systemic factors,
such as cytokines or gonadal hormones.
Influence of Sex Hormones
on Bone Remodelling
Androgen-mediated effects
Since the first suggestion of their involvement in skeletal homeostasis in 1948, androgens have been found
to exert a number of important regulatory effects on
the bone metabolism
(Albright and Reifenstein, 1948).
(Albright and Reifenstein, 1948).
This unobvious connection between endocrine and
skeletal systems is based on androgen receptors, whose
expression has been identified in all types of bone cells
(Vanderschueren et al., 2004).
(Vanderschueren et al., 2004).
According to the evidence provided by in vitro studies,
androgens display an ability to upregulate the synthesis
of transforming growth factor β and insulin growth factor
receptors in osteoblasts
(Kasperk et al., 1990; )
(Bodine et
al., 1995)
(Kasperk et al., 1990; Bodine et
al., 1995). These molecular changes promote divisions
and differentiation amongst cells of osteoblastic linage,
leading to an increased deposition of bone tissue during
the remodelling cycle. Whilst the recruitment of osteoblasts could result in elevated levels of osteoclast-stimulating RANKL, androgens prevent osteoclastogenesis by
decreasing the local availability of interleukin-6
(Yoshitake
et al., 2008).
(Yoshitake
et al., 2008). Interestingly, androgens acting on osteoblasts appear to also enhance the expression of their
own receptor, which increases the sensitivity of their
cellular targets to further hormonal stimulation
(Wiren
et al., 1999).
(Wiren
et al., 1999). This effectively creates a positive feedback
loop that significantly amplifies the potential of male
sex hormones to influence bone remodelling (Figure 1).
The above evidence derived from laboratory studies
seems to have its reflection in human subjects as well.
Clinical trials investigating the effects of testosterone
therapy in elderly males with decreased testosterone
levels have found that androgen supplementation resulted
in an increase in Bone Mineral Density (BMD) and estimated bone strength when compared to placebo
Ng
Tang Fui et al., 2021;).
(Snyder et al., 2017).
(Ng
Tang Fui et al., 2021; Snyder et al., 2017). These anabolic
effects were observed in both appendicular (tibia, radius)
and axial (vertebrae, pelvis) parts of the skeleton. The
improvements in BMD were also more profound in cortical than cancellous bone, which is consistent with the
reported variation in concentration of androgen receptors in both types of osseous tissue
(Kasperk et al., 1997).
(Kasperk et al., 1997).
Yet, the exact extent to which androgens influence
bone physiology remains rather challenging to ascertain
due to a large number of their systemic effects that could
act as potential confounding factors. First, androgeninduced muscle growth can subject bones to increased
mechanical loading that is known to promote deposition
of new osseous tissue. Some studies have also identified
a stimulatory effect of testosterone on the intestinal
absorption of calcium, which reduces the need for bone
resorption to contribute to calcium homeostasis
(Hope
et al.,1992).
(Hope
et al.,1992). Most importantly, however, androgens act
as precursors for synthesis of the vast majority of male
oestrogen – a hormone that itself exhibits a significant
osteomodulatory potential.
Oestrogen-mediated effects
Despite being traditionally perceived as a ‘female
hormone’, oestrogen has been found to play a major role
in the maintenance of normal bone physiology in both
women and men. Analogously to androgens, oestrogen
exerts its influence on osseous tissues via oestrogen
receptors alpha (ERα), which are situated within the cytoplasm of bone cells
(Gustafsson et al., 2016).
(Gustafsson et al., 2016). Stimulation
of ERα by its ligand initiates a number of biochemical

pathways, whose subsequent effects can be broadly categorised into inhibition of bone resorption and promotion of bone deposition.
The osteoprotective potential of oestrogen seems
to primarily stem from its ability to downregulate the
activity of osteoclasts. As evidenced by experiments
involving genetically modified mice, activation of osteoclastic ER promotes the expression of Fas ligand, which
is implicated in the induction of apoptosis
(Nakamura
et al., 2007).
(Nakamura
et al., 2007). Whilst cell death is associated with a release
of pro-osteoclastogenic interleukin-1, oestrogen has
also been shown to reduce the number of interleukin-1
receptors on osteoclast precursors, hence preventing
their differentiation into active cell types
(Sunyer et al.,
1999).
(Sunyer et al.,
1999). This effect is further supported by an increased
local availability of OPG, whose osteoblastic synthesis
is stimulated via ER-mediated pathways
(Hofbauer et
al., 1999).
(Hofbauer et
al., 1999). It can therefore be seen that oestrogen exerts
a significant degree of inhibitory control on osteoclasts
at every stage of their development.
In addition to its anticatabolic influence, oestrogen
seems to also act as a catalyst for deposition of new
osseous tissue. According to the results of biochemical
investigations, this effect arises mainly from the ability of
oestrogen to prolong the lifespan of osteoblasts and stimulate the maturation of their progenitor cells
(Bradford
et al., 2010).
(Bradford
et al., 2010). The former is believed to be a consequence
of a downregulated expression of proapoptotic agents,
and an enhanced activity of glutathione reductase which
neutralizes reactive oxygen species that could otherwise
cause cell death
(Almeida et al., 2010).
(Almeida et al., 2010). Interestingly,
oestrogen has also been shown to increase the amount
of PGE2 production by osteocytes, contributing to their
greater sensitivity to mechanical loading
(Joldersma et al.,
2001).
(Joldersma et al.,
2001). Taken together, the influence of oestrogen on
osteoblasts and osteocytes enables the osseous tissues
to actively respond to any demands for bone formation
or repair, which is essential for the maintenance of skeletal integrity (Figure 2).
In summary, androgens and oestrogen influence
the bone physiology via a complex array of biochemical
mechanisms. By doing so, the sex hormones provide an
important regulatory control over the process of bone
remodelling. This allows to prevent excessive resorption
or deposition of skeletal tissues, which helps to maintain
the bone mass within a physiologically normal range.
Thus, any imbalances of hormonal signalling are likely to
disrupt this homeostatic equilibrium and lead to development of bone pathologies.
Male Hypogonadism
and Bone Remodelling
Skeletal Effects of Prostate Cancer Treatment
With over 52 000 new cases diagnosed each year, prostate cancer is the second leading cause of malignancyrelated death amongst United Kingdom (UK) men
(Joldersma et al.,
2001).
(Cancer
Research UK, 2015). According to the current scientific
understanding, prostate cancer cells – prior to developing
a hormone-resistant phenotype in advanced stages – are
highly dependent on androgen-mediated stimulation for
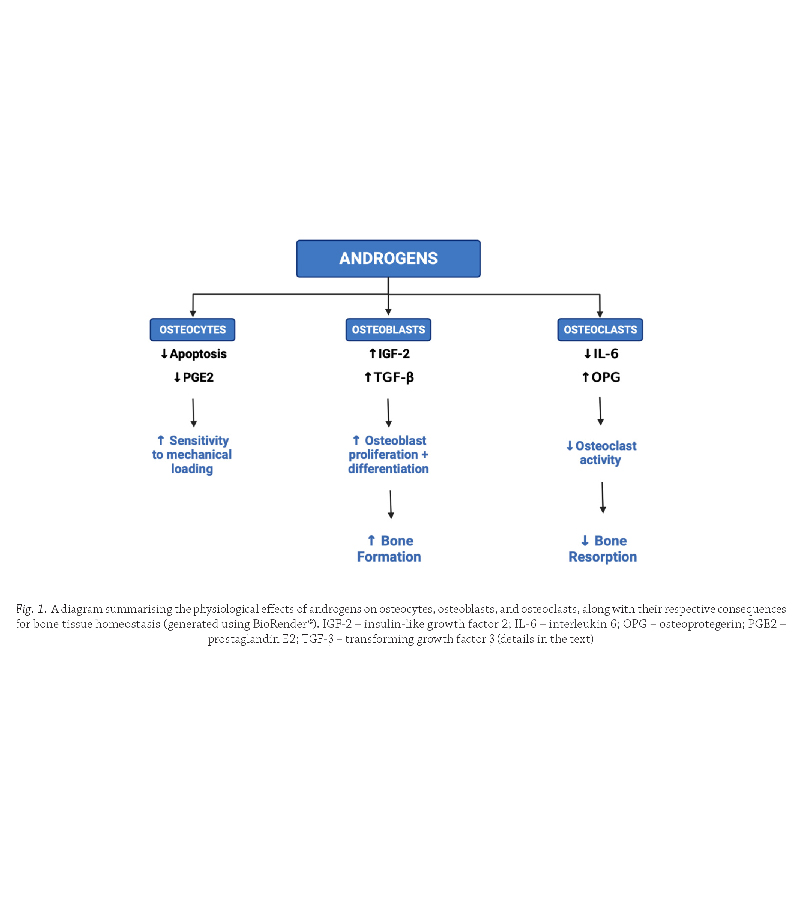
their survival and progression
(Tan et al., 2014).
(Tan et al., 2014). In line
with these observations, the initial treatment offered to
prostate cancer patients focuses on inducing a state of
androgen deprivation using synthetic luteinizing hormone-releasing hormone analogues (LHRH), such as
leuprolide. Whilst this approach might initially seem
counterproductive, continuous LHRH therapy results
in a downregulated expression of LHRH receptors on
the surface of gonadotrophs in the anterior pituitary
(Limonta et al., 2001).
(Limonta et al., 2001). This leads to a reduced secretion of
luteinizing and follicle-stimulating hormones, which in
turn limits the production of androgens and oestrogen.
However, due the fundamental importance of sex hormones for the control of bone remodelling, treatmentinduced hypogonadism in prostate cancer patients is
frequently associated with adverse skeletal effects.
According to the evidence from histomorphometric
investigations, the initiation of androgen deprivation
therapy (ADT) has a number of implications for the function of bone cells. More specifically, treatment-induced
hypogonadism has been found to promote osteoclast
activity, whilst also inhibiting the signalling pathways
responsible for the recruitment of osteoblasts
(Jackson
et al., 1987;).
( Wang et al., 2021).
(Jackson
et al., 1987; Wang et al., 2021). In consequence, the skeletal tissues of prostate cancer patients experience an
excessive amount of bone resorption, which contributes
to a decrease in BMD. When this pathological mechanism was investigated in a longitudinal study, ADT was
observed to cause reductions of BMD at multiple skeletal
sites that ranged between 2.4–4.0% per year
(Greenspal
et al., 2005).
(Greenspal
et al., 2005). The adverse effects of ADT seem to continue
throughout the entire duration of the therapy, with the
most profound changes occurring in the first year of
treatment
(Kiratli et al., 2001).
(Kiratli et al., 2001). The loss of osseous tissue,
which primarily affects the trabecular compartment,
leads to a reduction in the compressive bone strength
that is likely to predispose hypogonadal patients to fractures. Indeed, an analysis of over fifty thousand cases
of prostate cancer showed that ADT contributed to an
increased risk of fractures, with the incidence rising
along with the number of administered LHRH doses
(Shahinian et al., 2005).
(Shahinian et al., 2005).
Due to the significant burden associated with this
method of prostate cancer treatment, some of the more
recent studies have proposed to replace LHRH analogues
with selective androgen receptor antagonists
(Nyquist
et al., 2021).
(Nyquist
et al., 2021). However, the question remains which sex
hormone is primarily responsible for the observed reductions in BMD, and whether supplementation of one of
them would be sufficient to compensate for the inhibition of the other.
Androgens or Oestrogen?
When attempting to dissect the individual contributions
of androgens and oestrogen to the process of hypogonadal bone loss in male populations, there appears to be
a substantial degree of scientific discrepancy. According
to a study conducted on a cohort of Swedish patients, low
levels of both testosterone and oestrogen were found to
correlate with reductions in BMD and increased fracture
risk
(Mellström et al., 2006).
(Mellström et al., 2006). This stands in marked contrast to the findings of an earlier investigation, which
identified such association only for decreased levels of
oestrogen
(Szulc et al., 2003).
(Szulc et al., 2003). To further complicate the
picture, an Australian observational study reached a conclusion that low testosterone – and not oestrogen – is
associated with an increased incidence of fractures
(Meier
et al., 2008).
(Meier
et al., 2008).
The inconsistent results seen across the literature
are likely to stem from the considerable number of confounding factors associated with the investigations of
gonadal influences on bone. For instance, the study by
Szulc et al. did not supplement their analysis with data
on calcium intake, which is an important factor involved
in maintenance of bone homeostasis. The remaining two
studies, on the other hand, failed to consider the participants’ consumption of alcohol, a known inhibitor of
osteoblastic activity
(Laitinen and Välimäki, 1991).
(Laitinen and Välimäki, 1991). Such
investigations can be even more challenging to conduct
among prostate cancer patients as skeletal metastases
or exposure to radiation can significantly influence the
bone physiology.
Therefore, the scientific community remains in a
considerable need of a greater number of multivariate
analyses that could advance the current understanding
of skeletal disorders related to male hypogonadism. The
new insights could then allow for identification of the
safest and most effective method of administering ADT,
which would contribute to a better quality of life amongst
prostate cancer patients undergoing treatment.
Prevention of ADT-related Skeletal Complications
Whilst a substantial body of evidence exists showing
the commencement of ADT to contribute to a reduction
in BMD, along with several pathological states that can
develop in consequence, the most effective treatment
approach aimed at prevention of these skeletal complications still remains to be elucidated
(Laitinen and Välimäki, 1991).
(Alibhai et al., 2018).
Considering the shared aetiology of pathological changes
in ADT-associated side effects and age-related osteoporosis, current scientific efforts have focused on the assessment of the efficacy of bisphosphonates, selective oestrogen receptor modulators (SERMs) and denosumab in
prostate cancer patients undergoing ADT. From a molecular perspective, bisphosphonates and SERMs exert an
osteoprotective effect by stimulating an increased apoptosis of osteoclasts and hence preventing bone resorption
Hussain et al., 2020;
(Langdahl et al., 2020).
(Hussain et al., 2020; Langdahl et al., 2020). Denosumab,
on the other hand, prevents activation of RANKL by
acting as a competitive inhibitor of osteoblast-derived
RANK
(Hussain et al., 2020).
(Hussain et al., 2020).
According to the results of a recent meta-analysis, bisphosphonates lead to a statistically significant improvement in bone mass at all of the investigated skeletal sites
(total hip, femoral neck and lumbar spine), with the mean
percentage difference being equal to 7.1%
(Joseph et al.,
2019).
(Joseph et al.,
2019). Interestingly, the changes observed in the studies
were similar in patients who received bisphosphonates
orally and those who received them intravenously. The
analysis concluded that prostate cancer patients undergoing ADT responded best to therapy that included risedronate (average change in skeletal mass = 12.7%)
(Choo
et al., 2013).
(Choo
et al., 2013). The results, however, showed significant
inconsistencies between skeletal sites – risendronate
proved to be the most effective at spinal sites, but hip
and femoral locations responded best to zoledronic
acid and alendronate respectively (Table 1). Moreover,
approximations for risendronate were associated with
large confidence intervals (CI = 0.57–24.83%), making
the validity of the findings questionable
(Joseph et al.,
2019).
(Joseph et al.,
2019). While bisphosphonates delivered orally can be
more convenient for the patients, the choice of the most
effective bisphosphonate may rely on the site where a
skeletal pathology has been identified but remains in
need of further investigations.
Studies exploring the effects of SERMs in the population of prostate cancer patients undergoing ADT
revealed statistically significant improvements in BMD
at all skeletal sites investigated. Overall, the effect size
was smaller than that seen in trials involving bisphosphonates. Amongst the two SERM drugs (raloxifene
and toremifene) evaluated in the study, raloxifene was
found to lead to a slightly higher percentage increase in
BMD (range = 2.0–3.7%) in comparison to toremifene
(range = 1.9–2.3%)
(Joseph et al.,
2019).
(Joseph et al., 2019). The greatest
percentage improvement was seen in lumbar vertebrae
(raloxifene = 2%; toeremifene =2.3%, with the effect being
significantly less prominent than one seen in case of bisphosphonates
(Smith et al., 2004, 2011)
(Smith et al., 2004, 2011) (Table 1). Given
that similar rates of adverse effects have been reported
in the scientific literature for both therapeutic agents –
which involved osteonecrosis of the jaw and hypocalcaemia – bisphosphonates can be considered a better
pharmacological option due to their superior effectiveness
(Gartrell et al., 2014).
(Gartrell et al., 2014).
A more novel therapeutic agent – denosumab – is a
monoclonal antibody designed to bind to RANKL, hence
inhibiting activation and differentiation of osteoclasts
during the process of bone remodelling. The reported
clinical effectiveness of denosumab (lumbar spine = 7.1%;
hip = 3.2%; femoral neck = 3.9%) is similar to that of bisphosphonates (lumbar spine = 6.7%; hip = 4.8%; femoral
neck = 3.9%), but recent systematic reviews suggest the
novel agent to be associated with higher patient adherence and a decreased risk of fractures. Additionally, the
data from the clinical trials involving the monoclonal
antibody showed a smaller degree of uncertainty, contributing to a higher level of statistical significance. Thus,
denosumab could be a highly effective therapeutic agent
in prostate cancer patients undergoing ADT – however,
as in case of other newly developed pharmacological
options, further investigations are required to identify
the best treatment regime that would allow physicians to
maximise clinical outcomes and quality of life amongst
prostate cancer patients suffering from ADT-related bone
mass loss.
The above evidence has already been partly translated to clinical guidelines that are currently available for management of bone loss in prostate cancer
patients. According to a recent statement by Brown et al.
oral alendronate (70 mg/weekly) or oral riseondronate
(35 mg/weekly) should be chosen as first-line intervention in the event of bone loss occurring upon introduction
of ADT
(Brown et al., 2020).
(Brown et al., 2020). While these pharmacological
agents should prove effective in majority of patients, in
cases when oral therapy is not possible or poorly tolerated, intravenous zoledronic acid (5 mg/yearly) or
subcutaneous denosumab (60 mg/six monthly) can be
used instead
(Michaelson et al., 2007;).
(Smith et al., 2009).
(Michaelson et al., 2007; Smith et al., 2009).
Furthermore, each treatment regimen should be accompanied with regular assessments of the extent and rate of
bone loss in a patient undergoing ADT, which ought to be
performed every 12–18 months
(Brown et al., 2020).
(Brown et al., 2020). Such
insight can be gained with the use of FRAX® Fracture
Risk Assessment Tool, which – despite being developed
from a non-ADT-exclusive patient cohort – can provide
a valid clinical method of monitoring a patient’s bone
homeostasis
(Hoff et al., 2017).
(Hoff et al., 2017). In addition to clinical
interventions, each ADT-treated prostate cancer patient
should also be informed about lifestyle modifications,
such as regular physical activity, adequate calcium intake
(700–1200 mg/daily), and vitamin D supplementation

(800 IU/daily) – all of which have been shown to decrease
the risk of fractures to a statistically significant extent
(Bienz and Saad, 2015).
(Bienz and Saad, 2015).
Conclusions
The bone remodelling cycle is a complex biochemical
mechanism that plays a central role in the maintenance
of bone homeostasis. It provides the human skeleton with
a remarkable ability to alter its phenotype throughout
life, which protects its integrity in the face of changing
mechanical requirements. Although not immediately
evident, the process of bone remodelling is under continuous control of systemic hormones, such as androgens and oestrogen. The importance of this regulation
can be best appreciated when looking at the markedly
increased rates of skeletal disorders seen among prostate
cancer patients undergoing androgen deprivation therapy.
Whilst there currently seems to be a lack of scientific
consensus on the precise aetiology of these pathological
changes, further explorations into the intricate properties of the human bone might yield exciting discoveries
that could contribute to the development of new clinical
solutions in the future.
References
Abdelgawad M.E., Delaisse J.-M., Hinge M., Jensen P.R., Alnaimi R.W., Rolighed L.,
Engelholm L.H., Marcussen N., Andersen T.L.: Early reversal cells in adult human
bone remodelling: osteoblastic nature, catabolic functions, and interactions
with osteoclasts. Histochem. Cell Biol. 2016, 145(6), 603–615. doi:10.1007/
s00418-016-1414-y. PMID: 26860863
Albright F., Reifenstein E.C (ed.): The parathyroid glands and metabolic bone
disease. Baltimore: Wavely Press InC. Baltimore, Maryland, USA, 1948.
Alibhai S.M.H., Zukotynski K., Walker-Dilks C.: Bone Health and Bone-Targeted
Therapies for Nonmetastatic Prostate Cancer. Ann Intern Med. 2018, 168(6),
459–460. doi: 10.7326/L17-0702. PMID: 29554680.
Almeida M, Martin-Millan M., Ambrogini E., Bradsher R., Han L., Chen X.D.,
Roberson P.K., Weinstein R.S., O’Brien C.A., Jilka R.L., Manolagas S.C.: Estrogens
attenuate oxidative stress and the differentiation and apoptosis of osteoblasts by DNA-binding-independent actions of the ERalpha. JBMR, 2010,
25(4), 769–781. doi: 10.1359/jbmr.091017. PMID: 19821774.
Atkins G.J. Findlay D.M.: Osteocyte regulation of bone mineral: a little give
and take. Osteoporos Int. 2012, 23(8), 2067–2079. doi: 10.1007/s00198-
012-1915-z. PMID: 22302104.
Bienz M., Saad F.: Androgen-deprivation therapy and bone loss in prostate
cancer patients: a clinical review. Bonekey Rep. 2015, 4, 716. doi: 10.1038/
bonekey.2015.85. PMID: 26131363.
Bodine P.V.N., Riggs B., Spelsberg, T.C.: Regulation of c-fos expression and
TGF-β production by gonadal and adrenal androgens in normal human
osteoblastic cells. J Steroid Biochem Mol Biol. 1995, 52(2), 149–158. doi:
10.1016/0960-0760(94)00165-i. PMID: 7873450.
Bradford P.G., Gerace K.V., Roland R.L., Chrzan B.G.: Estrogen regulation of
apoptosis in osteoblasts. Physiol Behav. 2010, 99(2), 181–185. doi: 10.1016/j.
physbeh.2009.04.025. PMID: 19426747.
Brown J.E., Handforth C., Compston J.E., Cross W., Parr N., Selby P., Wood S.,
Drudge-Coates L., Walsh J.S., Mitchell C., Collinson F.J., Coleman R.E, James
N., Francis R., Reid D.M., McCloskey E.: Guidance for the assessment and
management of prostate cancer treatment-induced bone loss. A consensus
position statement from an expert group. J Bone Oncol. 2020, 25, 100311.
doi: 10.1016/j.jbo.2020.100311. PMID: 32995252.
Cancer Research UK. (2015). Prostate cancer statistics. [online] Available at:
https://www.cancerresearchuk.org/health-professional/cancer-statistics/
statistics-by-cancer-type/prostate-cancer#heading-One.
Choo R., Lukka H., Cheung P., Corbett T., Briones-Urbina R., Vieth R., Ehrlich L.,
Kiss A., Danjoux C.: Randomized, double-blinded, placebo-controlled, trial
of risedronate for the prevention of bone mineral density loss in nonmetastatic prostate cancer patients receiving radiation therapy plus androgen
deprivation therapy. Int J Radiat Oncol Biol Phys. 2013, 85(5), 1239–1345.
doi: 10.1016/j.ijrobp.2012.11.007. PMID: 23265571.
Delaissé J.M., Andersen T.L., Engsig M.T., Henriksen K., Troen T., Blavier L.:
Matrix metalloproteinases (MMP) and cathepsin K contribute differently
to osteoclastic activities. Microsc Res Tech. 2003, 61(6), 504–513. doi:
10.1002/jemt.10374. PMID: 12879418.
Feyen J.H., Di Bon A., van der Plas A., Löwik C.W., Nijweide P.J.: Effects of
exogenous prostanoids on the proliferation of osteoblast-like cells in vitro.
Prostaglandins. 1985, 30(5), 827–840. doi: 10.1016/0090-6980(85)90011-
5. PMID: 4081065.
Gartrell B.A., Coleman R.E., Fizazi K., Miller K., Saad F., Sternberg C.N.,
Galsky M.D.: Toxicities following treatment with bisphosphonates and
receptor activator of nuclear factor-κB ligand inhibitors in patients with
advanced prostate cancer. Eur Urol. 2014, 65(2), 278–286. doi: 10.1016/j.
eururo.2013.05.015. PMID: 23706567.
Greenspan S.L., Coates P., Sereika S.M., Nelson J.B., Trump D.L., Resnick N.M.:
Bone loss after initiation of androgen deprivation therapy in patients with
prostate cancer. J Clin Endocrinol Metab. 2005, 90(12), 6410–6417. doi:
10.1210/jc.2005-0183. PMID: 16189261.
Gustafsson K.L., Farman H., Henning P., Lionikaite V., Movérare-Skrtic S., Wu J.,
Ryberg H., Koskela A., Gustafsson J.Å., Tuukkanen J., Levin E.R., Ohlsson C.,
Lagerquist M.K.: The role of membrane ERα signaling in bone and other
major estrogen responsive tissues. Sci Rep. 2016, 8, 6:29473. doi: 10.1038/
srep29473. PMID: 27388455.
Hofbauer L.C., Khosla S., Dunstan C.R., Lacey D.L., Spelsberg T.C., Riggs B.L.:
Estrogen stimulates gene expression and protein production of osteoprotegerin in human osteoblastic cells. Endocrinology. 1999, 140(9), 4367–4370.
doi: 10.1210/endo.140.9.7131. PMID: 10465311.
Hoff M., Meyer H.E., Skurtveit S., Langhammer A., Søgaard A.J., Syversen U.,
Dhainaut A., Skovlund E., Abrahamsen B., Schei B.: Validation of FRAX and
the impact of self-reported falls among elderly in a general population:
the HUNT study, Norway. Osteoporos Int. 2017, 28(10), 2935–2944. doi:
10.1007/s00198-017-4134-9. PMID: 28668994.
Hope W.G., Ibarra M.J., Thomas M.L.: Testosterone alters duodenal calcium
transport and longitudinal bone growth rate in parallel in the male rat.
Proc Soc Exp Biol Med. 1992, 200(4), 536–541. doi: 10.3181/00379727-
200-43467. PMID: 1508946.
Hussain A., Tripathi A., Pieczonka C., Cope D., McNatty A., Logothetis C., Guise
T.: Bone health effects of androgen-deprivation therapy and androgen receptor inhibitors in patients with nonmetastatic castration-resistant prostate
cancer. Prostate Cancer Prostatic Dis. 2021, 24(2), 290–300. doi: 10.1038/
s41391-020-00296-y. PMID: 33028943; PMCID: PMC8134041.
Jackson J.A., Kleerekoper M., Parfitt A.M., Rao D.S., Villanueva A.R., Frame B.:
Bone histomorphometry in hypogonadal and eugonadal men with spinal
osteoporosis. J Clin Endocrinol Metab. 1987, 65(1), 53–58. doi: 10.1210/
jcem-65-1-53. PMID: 3584399.
Joldersma M., Klein-Nulend J., Oleksik A.M., Heyligers I.C., Burger E.H.: Estrogen
enhances mechanical stress-induced prostaglandin production by bone cells
from elderly women. Am J Physiol Endocrinol Metab. 2001, 280(3), E436–
442. doi: 10.1152/ajpendo.2001.280.3.E436. PMID: 11171598.
Joseph J.S., Lam V., Patel M.I.: Preventing Osteoporosis in Men Taking
Androgen Deprivation Therapy for Prostate Cancer: A Systematic Review
and Meta-Analysis. Eur Urol Oncol. 2019, 2(5), 551–561. doi: 10.1016/j.
euo.2018.11.001. PMID: 31411986.
Kasperk C., Fitzsimmons R., Strong D., Mohan S., Jennings J., Wergedal J., Baylink
D.: Studies of the mechanism by which androgens enhance mitogenesis and
differentiation in bone cells. J Clin Endocrinol Metab. 1990, 71(5), 1322–
1329. doi: 10.1210/jcem-71-5-1322. PMID: 2229290.
Kasperk C., Helmboldt A., Börcsök I., Heuthe S., Cloos O., Niethard F., Ziegler R.:
Skeletal site-dependent expression of the androgen receptor in human osteoblastic cell populations. Calcif Tissue Int. 1997, 61(6), 464–473. doi: 10.1007/
s002239900369. PMID: 9383273.
Kiratli B.J., Srinivas S., Perkash I., Terris M.K.: Progressive decrease in bone density over 10 years of androgen deprivation therapy in patients with prostate
cancer. Urology. 2001, 57(1), 127–132. doi: 10.1016/s0090-4295(00)00895-
5. PMID: 11164157.
Laitinen K., Välimäki M.: Alcohol and bone. Calcif Tissue Int. 1991, 49, S70–
73. doi: 10.1007/BF02555094. PMID: 1933604.
Langdahl B.L.: Overview of treatment approaches to osteoporosis. Br J
Pharmacol. 2021, 178(9), 1891–1906. doi: 10.1111/bph.15024. PMID:
32060897.
Limonta P., Montagnani Marelli M., Moretti R.M.: LHRH analogues as anticancer agents: pituitary and extrapituitary sites of action. Expert Opin
Investig Drugs. 2001, 10(4), 709–720. doi: 10.1517/13543784.10.4.709.
PMID: 11281820.
Meier C., Nguyen T.V., Handelsman D.J., Schindler C., Kushnir M.M., Rockwood
A.L., Meikle A.W., Center J.R., Eisman J.A., Seibel M.J.: Endogenous sex hormones and incident fracture risk in older men: the Dubbo Osteoporosis
Epidemiology Study. Arch Intern Med. 2008, 168(1), 47–54. doi: 10.1001/
archinternmed.2007.2. PMID: 18195195.
Mellström D., Johnell O., Ljunggren O., Eriksson A.L., Lorentzon M., Mallmin H.,
Holmberg A., Redlund-Johnell I., Orwoll E., Ohlsson C.: Free testosterone is
an independent predictor of BMD and prevalent fractures in elderly men:
MrOS Sweden. J Bone Miner Res. 2006, 21(4), 529–535. doi: 10.1359/
jbmr.060110. PMID: 16598372.
Michaelson M.D., Kaufman D.S., Lee H., McGovern F.J., Kantoff P.W., Fallon
M.A., Finkelstein J.S., Smith M.R.: Randomized controlled trial of annual
zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced
bone loss in men with prostate cancer. J Clin Oncol. 2007, 25(9), 1038–
1042. doi: 10.1200/JCO.2006.07.3361. PMID: 17369566.
Nakamura T., Imai Y., Matsumoto T., Sato S., Takeuchi K., Igarashi K., Harada Y.,
Azuma Y., Krust A., Yamamoto Y., Nishina H., Takeda S., Takayanagi H., Metzger
D., Kanno J., Takaoka K., Martin T.J., Chambon P., Kato S.: Estrogen prevents bone loss via estrogen receptor alpha and induction of Fas ligand in
osteoclasts. Cell. 2007, 130(5), 811–823. doi: 10.1016/j.cell.2007.07.025.
PMID: 17803905.
Ng Tang Fui M., Hoermann R., Bracken K., Handelsman D.J., Inder W.J., Stuckey
B.G.A., Yeap B.B., Ghasem-Zadeh A., Robledo K.P., Jesudason D., Zajac J.D.,
Wittert G.A., Grossmann M.: Effect of Testosterone Treatment on Bone
Microarchitecture and Bone Mineral Density in Men: A 2-Year RCT. J Clin
Endocrinol Metab. 2021, 106(8), e3143-e3158. doi: 10.1210/clinem/dgab149.
Erratum in: J Clin Endocrinol Metab. 2021, 106(7):e2855. PMID: 33693907.
Nyquist M.D., Ang L.S., Corella A., Coleman I.M., Meers M.P., Christiani A.J.,
Pierce C., Janssens D.H., Meade H.E., Bose A., Brady L., Howard T., De Sarkar
N., Frank S.B., Dumpit R.F., Dalton J.T., Corey E., Plymate S.R., Haffner M.C.,
Mostaghel E.A., Nelson P.S.: Selective androgen receptor modulators activate
the canonical prostate cancer androgen receptor program and repress cancer growth. J Clin Invest. 2021, 131(12), e151719. doi: 10.1172/JCI151719.
Erratum for: J Clin Invest. 2021 131(10). PMID: 34128479.
Qin L, Liu W, Cao H, Xiao G.: Molecular mechanosensors in osteocytes. Bone
Res. 2020, 8, 23. doi: 10.1038/s41413-020-0099-y. PMID: 32550039.
Shahinian V.B., Kuo Y.F., Freeman J.L., Goodwin J.S.: Risk of fracture after
androgen deprivation for prostate cancer. N Engl J Med. 2005, 352(2),
154–164. doi: 10.1056/NEJMoa041943. PMID: 15647578.
Smith M.R., Fallon M.A., Lee H., Finkelstein J.S.: Raloxifene to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate
cancer: a randomized controlled trial. J Clin Endocrinol Metab. 2004, 89(8),
3841–3846. doi: 10.1210/jc.2003-032058. PMID: 15292315.
Smith M.R., Malkowicz S.B., Brawer M.K., Hancock M.L., Morton R.A., Steiner
M.S.: Toremifene decreases vertebral fractures in men younger than 80 years
receiving androgen deprivation therapy for prostate cancer. J Urol. 2011,
186(6), 2239–2244. doi: 10.1016/j.juro.2011.07.090. PMID: 22014807.
Smith M.R., Saad F., Egerdie B., Szwedowski M., Tammela T.L., Ke C., Leder
B.Z., Goessl C.: Effects of denosumab on bone mineral density in men
receiving androgen deprivation therapy for prostate cancer. J Urol. 2009
Dec;182(6):2670-5. doi: 10.1016/j.juro.2009.08.048. PMID: 19836774;
PMCID: PMC2900763.
Snyder P.J., Kopperdahl D.L., Stephens-Shields A.J., Ellenberg S.S., Cauley J.A.,
Ensrud K.E., Lewis C.E., Barrett-Connor E., Schwartz A.V., Lee D.C., Bhasin S.,
Cunningham G.R., Gill T.M., Matsumoto A.M., Swerdloff R.S., Basaria S., Diem
S.J., Wang C., Hou X., Cifelli D., Dougar D., Zeldow B., Bauer D.C., Keaveny T.M.:
Effect of Testosterone Treatment on Volumetric Bone Density and Strength
in Older Men With Low Testosterone: A Controlled Clinical Trial. JAMA
Intern Med. 2017, 177(4), 471–479. doi: 10.1001/jamainternmed.2016.9539.
Erratum in: JAMA Intern Med. 2017, 177(4):600. Erratum in: JAMA Intern
Med. 2019,179(3):457. PMID: 28241231.
Sunyer T., Lewis J., Collin-Osdoby P., Osdoby P.: Estrogen’s bone-protective
effects may involve differential IL-1 receptor regulation in human osteoclast-like cells. J Clin Invest. 1999, 15, 103(10), 1409–1418. doi: 10.1172/
JCI4682. PMID: 10330423.
Szulc P., Claustrat B., Marchand F., Delmas P.D.: Increased risk of falls and
increased bone resorption in elderly men with partial androgen deficiency:
the MINOS study. J Clin Endocrinol Metab. 2003, 88(11), 5240–5247. doi:
10.1210/jc.2003-030200. PMID: 14602756.
Tan M.H., Li J., Xu H.E., Melcher K., Yong E.L.: Androgen receptor: structure,
role in prostate cancer and drug discovery. Acta Pharmacol Sin. 2015, 36(1),
3–23. doi: 10.1038/aps.2014.18. PMID: 24909511.
Vanderschueren D., Vandenput L., Boonen S., Lindberg M.K., Bouillon R.,
Ohlsson C.: Androgens and bone. Endocr Rev. 2004, 25(3), 389–425. doi:
10.1210/er.2003-0003. PMID: 15180950.
Wang A., Karunasinghe N., Plank L.D., Zhu S., Osborne S., Brown C., Bishop K.,
Schwass T., Tijono S., Holmes M., Masters J., Huang R., Keven C., Ferguson L.R.,
Lawrenson R.: Effect of androgen deprivation therapy on serum levels of
sclerostin, Dickkopf-1, and osteoprotegerin: a cross-sectional and longitudinal analysis. Sci Rep. 2021. 11(1), 14905. doi: 10.1038/s41598-021-
94090-y. PMID: 34290287.
Wiren K., Keenan E., Zhang X., Ramsey B., Orwoll E.: Homologous androgen
receptor up-regulation in osteoblastic cells may be associated with enhanced
functional androgen responsiveness. Endocrinology. 1999, 140(7), 3114–
3124. doi: 10.1210/endo.140.7.6753. PMID: 10385404.
Yoshitake F., Itoh S., Narita H., Ishihara K., Ebisu S.: Interleukin-6 directly inhibits osteoclast differentiation by suppressing receptor activator of NF-kappaB
signaling pathways. J Biol Chem. 2008, 283(17), 11535–11540. doi: 10.1074/
jbc.M607999200. PMID: 18296709.
INSTRUKCJE DLA AUTORÓW
Informacje ogólne
Czasopismo „Postępy Andrologii Online” jest periodykiem
ukazującym się co 6 miesięcy (półrocznik) w wersji elek-
tronicznej. Czasopismo publikuje prace z zakresu fizjo-
logii i patologii męskiego układu płciowego. Tematyka
obejmuje zarówno zagadnienia kliniczne (etiopato-
geneza, diagnostyka i terapia zaburzeń), jak i wyniki
badań doświadczalnych. Czasopismo przyjmuje prace
oryginalne, poglądowe oraz kazuistyczne. Ponadto będą
zamieszczane listy do Redakcji, streszczenia i tłuma-
czenia publikacji anglojęzycznych, informacje o działal-
ności Polskiego Towarzystwa Andrologicznego, komu-
nikaty informujące o konferencjach naukowych oraz
sprawozdania i streszczenia prezentacji z kongresów
i konferencji naukowych w Polsce i zagranicą.
Opłaty związane z publikacją artykułów
Czasopismo nie pobiera żadnych opłat za przygotowanie,
opublikowanie i rozpowszechnianie artykułów za wyjąt-
kiem komercyjnych reklam.
Odpowiedzialność etyczna autorów
rocedury etyczne stosowane w Postępach Andrologii
Online zostały stworzone w oparciu o wytyczne Committe
on Publication Ethics (COPE), European Associated of
Science Editors (EASE), International Committee of Medical
Journal Editors (ICMJE) i World Association of Medical
Editors (WAME), które mają na celu utrzymanie inte-
gralności badań i ich prezentacji. Manuskrypt zgłoszony
do Redakcji musi spełniać następujące kryteria:
• Praca nie była wcześniej publikowana w części lub
całości (autoplagiat), z wyjątkiem materiałów zjaz-
dowych, chyba że nowa praca dotyczy rozszerzenia
wcześniejszych opublikowanych danych.
• Praca nie została równocześnie skierowana do publi-
kacji w innym czasopiśmie.
• Uzyskane dane z badań oryginalnych nie powinny
być publikowane w częściach w celu zwiększenia
liczby publikacji („salami” publications), ale w całości.
Takie postępowanie jest nieetyczne i nie do przyjęcia.
Jednakże, dopuszczalne jest prezentowanie danych
w częściach, jeśli ma to na celu uzyskanie przejrzy-
stej interpretacji wyników oraz analizę konkretnych
wyników w różnych manuskryptach.
• Żadne dane zamieszczone w manuskrypcie nie
zostały sfabrykowane i/lub zmanipulowane.
• Autorzy powinni być przygotowani na przesłanie
odpowiedniej dokumentacji lub danych w celu wery-
fikacji wyników.
• Publikacja nie narusza praw autorskich innych
osób. Prezentowane dane, teksty i teorie nie są pla-
giatem. Autorzy powinni cytować publikacje innych
autorów oraz własnej grupy badawczej, które są
niezbędne dla analizy i interpretacji prezentowa-
nych danych.
• Wszyscy autorzy powinni wnieść znaczący wkład
naukowy w badania, a także uczestniczyć w pisaniu
i rewizji manuskryptu. Autorzy dzielą się zbiorową
odpowiedzialnością i odpowiedzialnością za wyniki.
Wypełnili i podpisali oświadczenie autorów (http://
www.postepyandrologii.pl/pdf/Oswiadczenie
autorow.pdf), akceptując skierowanie pracy do druku.
• Honorowe autorstwo jest niedozwolone.
• Dodawanie i/lub usuwanie autorów i/lub zmiana
kolejności autorów na etapie rewizji może być dopusz-
czalna i wymaga pisemnego uzasadnienia oraz zgody
wszystkich autorów. Zmiany w autorstwie i/ lub kolej-
ności autorów nie są akceptowane po zatwierdzeniu
manuskryptu do druku.
• Autorzy zobowiązani są do podania w manuskrypcie
wszelkich źródeł finansowania badań.
Jeżeli zgłoszony do Redakcji manuskrypt nie będzie
spełniał powyższych kryteriów Redaktor Naczelny
ma prawo odrzucić artykuł i zwrócić Autorowi.
Badania z udziałem ludzi i/lub zwierząt
Badania przeprowadzone na ludziach powinny być zgodne
z ogólnie przyjętymi standardami etycznymi określo-
nymi w Deklaracji Helsińskiej z 1964 r. i późniejszymi
poprawkami lub porównywalnymi standardami etycz-
nymi. Z kolei, badania prowadzone na zwierzętach
powinny być zgodne z międzynarodowymi, krajowymi
i/lub instytucjonalnymi wytycznymi dotyczącymi opieki
i wykorzystania zwierząt. Informacja o zgodzie właściwej
Komisji Etycznej na przeprowadzenie badania i świa-
domej zgodzie pacjentów na udział w badaniu powinna
znaleźć się w rozdziale „Materiał i metody”. W przypadku
badań retrospektywnych taka zgoda nie jest wymagana.
Autorzy opisów przypadków są zobowiązani do nieujaw-
niania personaliów opisywanych pacjentów, a w przy-
padku fotografii umożliwiających identyfikację pacjenta
zawsze należy uzyskać pisemną zgodę pacjenta.
Konflikt interesów
W pracy powinny być ujawnione wszelkie finansowe i oso-
biste relacje autorów z innymi osobami lub organiza-
cjami, które mogłyby niewłaściwie wpłynąć na ich pracę.
Ewentualny konflikt interesów powinien być opisany
w oświadczeniu autorów (http://www.postepyandrologii.
pl/pdf/Oswiadczenie autorow.pdf). Informacje te nie
będą ujawniane recenzentom.
Informacje o prawach autorskich
Autor/autorzy przesyłając manuskrypt wraz z ilustra-
cjami i tabelami, automatycznie i nieodpłatnie prze-
nosi/przenoszą na „Postępy Andrologii Online” i Polskie
Towarzystwo Andrologiczne wszelkie prawa autorskie
do wydawania oraz rozpowszechniania nadesłanych
materiałów we wszystkich znanych formach i na wszyst-
kich znanych polach eksploatacji, bez ograniczeń tery-
torialnych i językowych, pod warunkiem, że materiały
te zostaną zaakceptowane do publikacji. Publikacja
w całości ani żadna z jej części nie może być powielana,
ani upowszechniana w jakikolwiek mechaniczny lub
elektroniczny sposób bez pisemnej zgody Redaktora
Naczelnego.
Ochrona danych osobowych
Nazwiska i adresy e-mail wprowadzane do serwisu cza-
sopisma „Postępy Andrologii Online” będą wykorzysty-
wane wyłącznie do celów publikacji ich prac i nie będą
udostępniane do żadnych innych celów
Zasady recenzowania prac
Nadsyłane manuskrypty wstępnie ocenia Komitet
Redakcyjny czasopisma. Manuskrypty niekompletne
lub przygotowane w stylu niezgodnym z zasadami poda-
nymi poniżej Redakcja odsyła Autorom bez oceny mery-
torycznej. Pozostałe artykuły zostają zarejestrowane
i są następnie przekazywane do oceny dwóm niezależnym
recenzentom będącym ekspertami w danej dziedzinie,
z zachowaniem anonimowości autorów pracy i recen-
zentów (double-blind peer review process). Recenzenci
są odpowiedzialni za obiektywną ocenę manuskryptu,
deklarują brak konfliktu interesów podpisując oświad-
czenie (http://www.postepyandrologii.pl/pdf/Formularz
recenzenta Postepy Andrologii Online_19-05-2016.pdf).
Przyjęcie pracy odbywa się na podstawie pozytywnych
opinii obydwóch recenzentów. W przypadku rozbież-
nych opinii Redakcja prosi o opinię trzeciego recenzenta.
Autorzy zobowiązani są odnieść się do uwag recenzentów
w ciągu 3 tygodni od daty otrzymania recenzji. Wszelka
korespondencja z Autorami odbywa się drogą e-mailową.
Sposób przygotowania manuskryptu
Nadsyłane prace mogą być pisane w języku polskim
lub angielskim.
Liczbowe wartości i symbole wszystkich wielkości
winny być podane wg międzynarodowego układu jed-
nostek SI.
W manuskrypcie należy używać 12-punktowego
fontu Times New Roman, z zachowaniem 1,5-punk-
towego odstępu między wierszami i marginesami 2,5 cm
z każdej strony. Strony należy numerować kolejno, zaczy-
nając od tytułowej. Numery stron należy umieszczać
w dolnym, prawym rogu każdej strony. Należy zachować
następujący układ: strona tytułowa (osobna strona),
stosowane skróty (osobna strona), streszczenie i słowa
kluczowe (do 5) w języku polskim i angielskim (osobna
strona), tekst podstawowy, piśmiennictwo, podpisy rycin
i tabel, materiał ilustracyjny.
Strona tytułowa powinna zawierać: stopień
naukowy, imię i nazwisko autora (autorów) wraz z afi-
liacją, adres e-mail, kontaktowy numer telefonu każdego
autora (należy podkreślić nazwisko autora do korespon-
dencji), tytuł artykułu i skróconą wersję tytułu (w języku
polskim i angielskim) (40 znaków ze spacjami), oraz
źródła finansowania.
Spis skrótów należy podać w języku polskim
i angielskim w jednym akapicie, według kolejności alfa-
betycznej np.:
hESC – ludzkie embrionalne komórki macierzyste
(ang. human embryonic stem cells); RFT – reaktywne
formy tlenu (ang. reactive oxygen species); RT-PCR –
łańcuchowa reakcja polimerazy z wykorzystaniem
odwrotnej transkryptazy (ang. reverse transcription
polymerase chain reaction); itd.
Skróty użyte w tekście podstawowym po raz pierwszy
należy podać w pełnym brzmieniu. Nie należy rozpo-
czynać zdania od skrótu.
Streszczenie powinno zawierać najistotniejsze
informacje wprowadzające czytelnika w publikowaną
tematykę oraz wnioski końcowe (do 400 wyrazów). Nie
należy używać skrótów
Tekst podstawowy
Artykuł poglądowy powinien zawierać przegląd infor-
macji z danej tematyki. Zaleca się uwzględnienie prac
publikowanych w ostatnich 5–10 latach (ok. 60%) oraz
w latach wcześniejszych (ok. 40%). Dopuszczalna liczba
pozycji piśmiennictwa to 100. W manuskrypcie autorzy
powinni zawrzeć własne przemyślenia, opinie i wnioski,
a istotne informacje przedstawić w postaci schematów,
tabel i rycin. Ponadto, artykuł mogą wzbogacić wyniki
badań autorskich. Liczba stron manuskryptu łącznie
z tabelami i rycinami nie powinna być większa niż 20.
Artykuł oryginalny powinien zawierać opis wła-
snych badań klinicznych lub doświadczalnych Autorów.
Powinien składać się z takich podrozdziałów jak: Wstęp,
Materiał i Metody, Wyniki, Dyskusja, Podsumowanie.
Dopuszczalna liczba pozycji piśmiennictwa to 100. Liczba
stron manuskryptu łącznie z tabelami i rycinami nie
powinna być większa niż 20.
Praca kazuistyczna to krótka forma publikacji pre-
zentująca ciekawe przypadki kliniczne i ich omówienie
oparte na własnych doświadczeniach praktyka klini-
cysty i doświadczeniach innych autorów. Streszczenie
nie powinno przekraczać 150 wyrazów, Wstęp powinien
zawierać nie więcej niż dwa krótkie akapity, Materiał
i Metody nie powinny być podzielone na podrozdziały,
a Wyniki, Dyskusja i Podsumowanie powinny stanowić
jeden rozdział. Liczba rycin i tabel ograniczona do 2–3,
piśmiennictwa do 10. Liczba stron manuskryptu nie
powinna być większa niż 10.
Komunikat to krótka praca oryginalna zawierająca
wstępne, ale istotne wyniki badań. W tego typu publika-
cjach streszczenie nie powinno przekraczać 150 wyrazów,
Wstęp powinien zawierać nie więcej niż dwa krótkie
akapity, Materiał i Metody nie powinny być podzielone
na podrozdziały, a Wyniki, Dyskusja i Podsumowanie
powinny stanowić jeden rozdział. Liczba rycin i tabel
ograniczona do 2–3, piśmiennictwa do 10. Liczba stron
manuskryptu nie powinna być większa niż 10.
Artykuł będący tłumaczeniem publikacji z języka
angielskiego powinien dotyczyć najnowszych i istotnych
pozycji piśmiennictwa anglojęzycznego. Należy dołą-
czyć zgodę redaktora naczelnego czasopisma, w którym
artykuł został opublikowany i autora na tłumaczenie
artykułu. Streszczenie artykułu powinno zawierać treść
istotną do przekazania dla czytelników polskich (do 400
wyrazów).
List do Redakcji jest formą wyrażenia swojej opinii,
a jednocześnie głosem w dyskusji na temat współczesnych
zjawisk w świecie medycyny i nauki. Dopuszczalna liczba
stron manuskryptu nie większa niż 3.
Piśmiennictwo należy podać w kolejności alfabe-
tycznej, nie wprowadzając kolejnych numerów. Każdą
pozycję piśmiennictwa należy zapisywać od nowej
linii. Należy podać nazwisko autora (autorów) pisane
kursywą z inicjałami imion, po których stawiana jest
kropka. Jeśli jest do sześciu autorów, należy przytoczyć
wszystkich. Powyżej tej liczby należy podać pierwszych
sześciu autorów z dopiskiem i wsp. Tytuły periodyków
powinny być skracane zgodnie ze sposobem przyjętym
w Index Medicus (Medline).
Oto przykłady, jak należy cytować książkę: 1)
w całości, 2) fragment konkretnego rozdziału wraz
z podaniem numerów stron, 3) oryginalną pracę naukową,
4) oryginalną pracę naukową w czasopiśmie elektronicz-
nymi (data przeglądania i adres URL) i 5) stronę inter-
netową (nazwa strony – materiału źródłowego, adres
URL i datę wejścia na stronę):
1. Semczuk M., Kurpisz M. (red.): Andrologia. Wyd.
Lek. PZWL, Warszawa 2006.
2. Woźniak W., Bruska M., Kromer P.: Pęcherzyki
nasienne, gruczoł krokowy i gruczoły cew-
kowo-opuszkowe. W: Andrologia. Red.
M. Semczuk, M. Kurpisz. Wyd. Lek. PZWL,
Warszawa 2006, 94–89.
3. Kobori Y., Suzuki K., Iwahata T., Shin T., Sadaoka Y.,
Sato R. i wsp.: Improvement of seminal quality and
sexual function of men with oligoasthenoterato-
zoospermia syndrome following supplementa-
tion with L-arginine and Pycnogenol®. Arch Ital
Urol Androl. 2015, 87, 190–193. doi: 10.4081/
aiua.2015.3.190. PMID: 26428638
4. Walczak-Jędrzejowska R.: Stres oksydacyjny a nie-
płodność męska. Część I: czynniki wywołujące
stres oksydacyjny w nasieniu / Oxidative stress
and male infertility. Part I: factors causing oxida-
tive stress in semen. Post Androl Online. 2015, 2,
5–15. [przeglądany: 07.10.2015 r.]. Dostępny w:
http://www.postepyandrologii.pl
5. Wiley Online Library http://onlinelibrary.wiley.
com/enhanced/doi/10.1111/andr.12051/, data
wejścia 07.10.2015 r.
Cytowane w tekście piśmiennictwo należy podać alfabe-
tycznie w okrągłych nawiasach, wymieniając pierw-
szego autora i podając rok publikacji, np. (Bungum
i wsp., 2011; Cheng i wsp., 2011).
Nazwiska autorów prac wprowadzone w tekście
powinny być napisane kursywą, np.
„Według Bungum i wsp. (2011) należy wprowadzić
określony algorytm leczenia niepłodności męskiej
w zależności od standardowych parametrów semi-
nologicznych i wyników otrzymanych na podstawie
testu z wykorzystaniem oranżu akrydyny ujawniają-
cego zaburzenia kondensacji chromatyny plemników
(SCSA)…”
Piśmiennictwo powinno zawierać publikacje innych
autorów oraz własnej grupy badawczej, które są istotne
dla badań.
Materiał ilustracyjny obejmuje ryciny (wykresy,
diagramy, zdjęcia, schematy) oraz tabele opatrzone
tytułami i podpisami. W przypadku rycin zarówno
tytuł, jak i opis powinny być umieszczone pod ryci-
nami, a w przypadku tabel nad tabelami. Tytuł tabeli
należy wytłuścić. Podpisy rycin i tabel oraz ich tytuły,
a także informacje wewnętrzne na rycinach i w tabelach
należy podać w języku polskim i angielskim (dotyczy
prac w języku polskim). Ryciny i tabele powinny być
opatrzone numerami zgodnie z kolejnością odniesień
w tekście. Osobną numerację posiadają ryciny i osobną
tabele (numery arabskie). Skrót Ryc. (pisany kursywą)
wprowadzamy w podpisie pod rycinami, natomiast
w tytule tabeli nie stosujemy skrótu Tab., lecz Tabela.
Nie stosujemy w tekście podstawowym skrótów ryc. lub
tab., lecz rycina lub tabela.
Mikrofotografie mikroskopowe powinny posiadać
wewnętrzną skalę, a stosowane symbole, strzałki lub
litery muszą być wyraźnie uwidocznione na tle. Zdolność
rozdzielcza mikrofotografii nie powinna być mniejsza niż
300 dpi. Stosowane znaki do opisu danej ryciny powinny
być ujednolicone w całym artykule.
Stosowane oznaczenia i skróty na rycinach i w tabe -
lach powinny być wyjaśnione w opisie rycin i tabel, nie-
zależnie do ich rozwinięcia w tekście podstawowym.
Uwaga: pojedyncze ryciny bądź ryciny złożone z kilku
zdjęć, wykresów, diagramów lub schematów należy zin-
tegrować z wewnętrznymi oznaczeniami.
Rozmiary rycin i tabel: szerokość rycin i tabel
powinna wynosić 17,3 cm lub 8,3 cm, natomiast ich
długość nie powinna przekraczać 24,5 cm. Tekst będzie
składany dwułamowo, dlatego też szerokość rycin i tabel
nie może przekraczać szerokości jednego lub dwóch
łamów, z kolei długość może być dowolna, ale nie większa
niż długość łamu; wielkość powierzchni zadrukowanej
na stronie formatu A4 będzie wynosiła 24,7 cm/17,5 cm
Przesyłanie prac do Redakcji
race należy przesłać elektronicznie na adres redaktora
naczelnego: mpiasecka@ipartner.com.pl
Tekst podstawowy, piśmiennictwo oraz podpisy
rycin i tabel powinny być umieszczone w jednym pliku
(Word), natomiast każda rycina (format CDR, TIF, JPG)
i tabele (Word) w osobnych plikach. Tytuł pliku zawie-
rający tekst manuskryptu powinien zawierać nazwisko
autora do korespondencji oraz pierwsze słowa tytułu
artykułu, natomiast tytuły plików zawierające ryciny
i tabele, obok nazwiska autora, powinny zawierać numery
rycin i tabel.
Do pracy należy dołączyć oświadczenie, że m.n. praca
nie została opublikowana lub skierowana do publikacji
w innym czasopiśmie, została zaaprobowana przez
wszystkich współautorów (wymagane są podpisy
wszystkich autorów) oraz zostały ujawnione wszelkie
źródła finansowania (oświadczenie dostępne na stronie
internetowej http://www.postepyandrologii.pl/pdf/
Oswiadczenie autorow.pdf).
Publikowanie prac
Prace będą publikowane w kolejności otrzymywania,
jednak redakcja zastrzega sobie prawo zmian uzasadnio-
nych treścią drukowanego numeru. Ponadto zastrzega
sobie prawo wprowadzenia poprawek stylistycznych
i dotyczących mianownictwa oraz stosowanych skrótów
bez uzgodnienia z autorem.
Po zaakceptowaniu pracy do publikacji autorzy otrzy-
mują korektę drukarską. Celem korekty drukarskiej jest
sprawdzenie błędów składu lub konwersji oraz komplet-
ności i dokładności tekstu, tabel i rycin. Autorzy są zobo-
wiązani w ciągu trzech dni od otrzymania korekty dru-
karskiej przesłać ewentualne poprawki. Zmiana tytułu
i/lub autorstwa oraz wprowadzanie nowych wartości
jest niedozwolone.
Zasady udostępniania informacji
naukowych zawartych w czasopiśmie
Informacje zawarte w czasopiśmie są udostępniane
na zasadzie Open Access - dostęp do informacji naukowej
jest bezpłatny i nieograniczony. Użytkownicy mogą
czytać, pobierać, kopiować, rozpowszechniać, drukować,
wyszukiwać, łączyć informacje z pełnymi tekstami arty-
kułów lub wykorzystywać je do jakichkolwiek innych
celów zgodnych z obowiązującą licencją CC BY NC ND 3.0
Polska (https://creativecommons.org/licenses/by-nc-
-nd/3.0/pl/legalcode). Licencja ta obliguje do uznania
autorstwa, zezwala na rozpowszechnianie, przedsta-
wianie i wykonywanie utworu jedynie w celach nieko-
mercyjnych oraz pod warunkiem zachowania go w ory-
ginalnej postaci (bez tworzenia utworów zależnych).
RECENZENCI PRAC OPUBLIKOWANYCH W 2022 R.
Monika Frączek
Kamil Gill
Marta Grabowska
Michał Rabijewski
Jolanta Słowikowska-Hilczer
Karolina Skonieczna-Żydecka
Barbara Wiszniewska
