Czasopismo Polskiego Towarzystwa Andrologicznego Journal of Polish Society of Andrology

KOMITET REDAKCYJNY
Redaktor naczelny:
dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego:
prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr n. med. Renata Walczak-Jędrzejowska, Łódź
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst,
Republika Południowej
Afryki
(Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga,
Dania (Copenhagen, Denmark)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Katedra i Zakład Histologii i Biologii Rozwoju
Wydział Nauk o Zdrowiu
Pomorski Uniwersytet Medyczny w Szczecinie
71-210 Szczecin ul. Żołnierska 48
tel. 91 48 00 917, 91 48 00 908
e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Agnieszka Hilczer
Waldemar Jachimczak
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Korekta języka polskiego:
Wojciech Markowski
Korekta języka angielskiego:
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI / CONTENTS / Strony 1–48 / Pages 1–48
O czasopiśmie 4
Artykuły poglądowe
Jolanta Słowikowska-Hilczer
Dysgenezja jąder jako przyczyna męskiej niepłodności
Testicular dysgenesis as a cause of male infertility 5
Mariola Marchlewicz, Ewa Duchnik, Joanna Kruk, Kamila Szumilas
Wpływ androgenów na skórę mężczyzn
Effect of androgens on the male skin 14
Sprawozdanie i streszczenia wykładów z Sympozjum naukowo-szkoleniowego
Polskiego Towarzystwa Andrologicznego – 16. Dzień Andrologiczny 25
Aktualności sympozjalne 39
Recenzje książki
pt. „Układ płciowy męski – badania kliniczne i doświadczalne” 40
Instrukcje dla autorów 43
Recenzenci prac opublikowanych w 2014 r. 47
O CZASOPIŚMIE / ABOUT THE JOURNAL
O czasopiśmie
Zaburzenia męskiego układu płciowego dotyczą osób
w różnym wieku i w większości przypadków prowadzą
do niepłodności, która nabrała już rangi choroby cywilizacyjnej.
Najczęściej identyfikowanymi nieprawidłowościami
są hipogonadyzm, zaburzenia seksualne, wady rozwojowe
narządów płciowych, nowotwory jąder i prostaty.
Ze względu na specyficzne i coraz bardziej zanieczyszczone
środowisko antropogeniczne dotyczą one głównie społeczeństw
rozwiniętych, w tym również Polski, i stanowią
istotny oraz narastający problem medyczny, społeczny,
demograficzny, a także zdrowia publicznego. Nauka, która
zajmuje się fizjologią i zaburzeniami męskiego układu
płciowego w aspekcie nauk podstawowych i klinicznych,
to andrologia. Ponieważ jest to młoda dziedzina nauki,
jeszcze do niedawna niezadowalający stan wiedzy ograniczał
możliwości diagnostyki oraz leczenia zaburzeń
męskiego układu płciowego. Jednak w ostatnich latach
obserwuje się niezwykle dynamiczny rozwój andrologii,
szczególnie molekularnej, spowodowany wprowadzeniem
nowych metod badawczych z zakresu biochemii, biologii
i genetyki molekularnej. Andrologia staje się dziedziną
interdyscyplinarną integrującą wiedzę z różnych dyscyplin
medycznych i naukowych. Informacje związane z tymi
zagadnieniami z trudem docierają do lekarzy i osób zainteresowanych
w naszym kraju, ponieważ jest niewiele literatury
w języku polskim, a wykłady wygłaszane podczas
konferencji nie zawsze wyczerpująco wyjaśniają wątpliwości
dotyczące m.in. postępowania diagnostycznego,
terapeutycznego, rekomendacji czy też proponowanych
algorytmów. Stąd też potrzeba stworzenia czasopisma prezentującego
wiedzę andrologiczną lekarzom różnych specjalności,
diagnostom laboratoryjnym i przedstawicielom
nauk podstawowych. Czasopismo „Postępy Andrologii
Online” powstało z inicjatywy Polskiego Towarzystwa
Andrologicznego, które zainteresowane jest integracją
środowiska osób zajmujących się różnymi aspektami
męskiego układu płciowego, uzupełnieniem i poszerzeniem
ich wiedzy, a także poprawą opieki zdrowotnej nad
mężczyznami w naszym kraju.
Celem czasopisma jest: 1) dostarczenie istotnych
informacji na temat fizjologii i patologii męskiego układu
płciowego, 2) propagowanie praktycznej wiedzy andrologicznej
kierowanej do szerokich kręgów odbiorców,
3) wymiana poglądów i opinii na temat zagadnień klinicznych
oraz wyników badań doświadczalnych oraz
4) przekazywanie informacji dotyczących konferencji
i kursów o tematyce andrologicznej.
Proponowana tematyka czasopisma to: 1) andrologia
kliniczna z uwzględnieniem etiopatogenezy, diagnostyki
i leczenia m.in. zaburzeń rozwojowych, niepłodności i procesów
starzenia mężczyzn, 2) nowatorskie metody diagnostyczne,
3) andrologia doświadczalna rozwijająca się
w oparciu o nauki podstawowe oraz 4) inne interdyscyplinarne
tematy związane z dziedziną andrologii.
Czasopismo kierowane jest do lekarzy specjalności
bezpośrednio lub pośrednio związanych z andrologią,
m.in. urologów, endokrynologów, ginekologów, pediatrów,
ale także do lekarzy rodzinnych spotykających się
z coraz częstszym problemem niepłodności partnerskiej
i problemami starzejących się mężczyzn. Ponadto naszą
intencją jest zdobycie zainteresowania diagnostów laboratoryjnych
odgrywających istotną rolę w prawidłowym
postępowaniu terapeutycznym opartym na szerokim
panelu testów i badań, których wdrożenie wciąż wymaga
odpowiednich i wyczerpujących szkoleń z diagnostyki
andrologicznej, w tym seminologicznej. Mamy nadzieję,
że nasze czasopismo wzbudzi również zainteresowanie
biologów zajmujących się czynnością męskiego układu
płciowego w ramach nauk podstawowych, a także lekarzy
weterynarii oraz innych osób, które znajdą informacje
poszerzające ich wiedzę i kształtujące opinię z zakresu
szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac oryginalnych,
kazuistycznych i krótkich komunikatów, jak
również prac poglądowych, opracowanych w kondensacyjnej,
dydaktycznej i przystępnej formie. W pracach
tych autorzy powinni przedstawiać aktualny stan wiedzy
światowej oraz swoje opinie. Chcemy, aby czasopismo
spełniało rolę informatora i przewodnika w dziedzinie
andrologii oraz stanowiło forum dyskusyjne. Ponadto,
zapraszamy do publikowania artykułów będących tłumaczeniem
publikacji ukazujących się w języku angielskim,
które przedstawiają istotne postępy w andrologii.
http://www.andrologia-pta.
com.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska-Hilczer
przewodnicząca
Polskiego Towarzystwa Andrologicznego
DYSKENEZJA JĄDER JAKO PRZYCZYNA MĘSKIEJ NIEPŁODNOŚCI
Testicular dysgenesis as a cause of male
infertility
Jolanta Słowikowska-Hilczer
Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Autor do korespondencji: Jolanta Słowikowska‑Hilczer
(jolanta.slowikowska-hilczer@
umed.lodz.pl)
Jolanta Słowikowska‑Hilczer
– prof. dr hab. med., profesor nadzwyczajny Uniwersytetu Medycznego w Łodzi, specjalista
pediatrii i endokrynologii, posiadająca europejski certyfikat androloga klinicznego. Kierownik Zakładu Endokrynologii
Płodności Katedry Andrologii i Endokrynologii Płodności na Wydziale Lekarskim Uniwersytetu Medycznego w Łodzi
oraz Poradni Andrologii i Endokrynologii Płodności Uniwersyteckiego Szpitala Klinicznego im. Wojskowej Akademii
Medycznej – Centralny Szpital Weteranów w Łodzi. Wykładowca akademicki, kierownik polskich i europejskich projektów
badawczych, pierwszy autor i współautor ok. 150 publikacji naukowych. Przewodnicząca Polskiego Towarzystwa
Andrologicznego, członek rzeczywisty Europejskiej Akademii Andrologii (ang. European Academy of Andrology), członek
Międzynarodowego Towarzystwa Andrologicznego (ang. International Society of Andrology), Polskiego Towarzystwa
Endokrynologicznego i Polskiego Towarzystwa Endokrynologii Dziecięcej. Praca zawodowa i naukowa autorki związana
jest z fizjologią i patologią męskiego układu płciowego w okresie rozwojowym i dojrzałości płciowej, zarówno
w aspekcie klinicznym, jak i doświadczalnym.
Streszczenie
Jedną z przyczyn męskiej niepłodności jest zaburzenie różnicowania i rozwoju jąder, zwane dysgenezją gonad. Zaburzenie to występuje
z różnym nasileniem. Wiąże się z upośledzeniem czynności komórek Leydiga i Sertoliego, a przez to nieprawidłowym wydzielaniem
testosteronu i hormonu antymüllerowskiego, czego konsekwencją są: nieprawidłowy rozwój męskich narządów płciowych, wnętrostwo,
brak lub zatrzymanie spermatogenezy, a często także zaburzenia płci psychicznej. Jednak w łagodniejszych postaciach dysgenezji jąder
występują tylko niepłodność, spowodowana uszkodzeniem spermatogenezy, i hipogonadyzm hipergonadotropowy, spowodowany
zaburzoną czynnością hormonalną jąder. Wszystkim formom dysgenezji jąder towarzyszy zwiększone ryzyko zmian nowotworowych
wywodzących się z komórek płciowych. Przyczyną mogą być zaburzenia genetyczne, a także substancje o działaniu estrogenopodobnym
i antyandrogennym pochodzenia środowiskowego. Dysgenezja jąder jest zaburzeniem nieodwracalnym i niemożliwym do wyleczenia.
słowa kluczowe: jądro, dysgenezja gonad, zaburzenia rozwoju płci, wnętrostwo, niepłodność, nowotwór jądra z komórek płciowych,
ksenoestrogeny
Abstract
One of the causes of male infertility is a disorder of differentiation and development of testicles called gonadal dysgenesis. This disorder
occurs with varying intensity. It is associated with impaired Leydig and Sertoli cells function, and abnormal secretion of testosterone and
antimüllerian hormone. The consequences are disturbances of male sex organs development, cryptorchidism, lack or arrest of spermatogenesis
and often gender identity disorders. However, in milder forms of testicular dysgenesis, there is only infertility due to the impairment
of spermatogenesis and hypergonadotropic hypogonadism as the result of poor hormonal testis function. All forms of testicular dysgenesis
are accompanied by an increased risk of malignancies derived from germ cells. The cause may be genetic disorder, but also substances
with estrogen‑like
and antiandrogenic activity of environmental origin. Testicular dysgenesis is an irreversible and incurable disorder.
key words: testis, gonadal dysgenesis, disorders of sex development, cryptorchidism, infertility, testicular germ cell neoplasia, xenoestrogens
Skróty / Abbreviations
βhCG – podjednostka β ludzkiej gonadotropiny kosmówkowej (ang. human chorionic gonadotropin, β subunit), AFP – α‑fetoproteina
(ang. α‑fetoprotein),
AMH – hormon antymüllerowski (ang. anti‑Müllerian hormone), ART – techniki rozrodu wspomaganego medycznie
(ang. assisted reproductive technology), CIS – nowotwór in situ (łac. carcinoma in situ), DSD – zaburzenia rozwoju płciowego (ang. disorders of
sex development), DTH – dihydrotestosteron (ang. dihydrotestosterone), EDs/EDCs – środowiskowe związki chemiczne zaburzające funkcje
endokrynne – przerywacze endokrynne (ang. endocrine disrupting compounds), FOXL‑2
– czynnik transkrypcyjny zaangażowany w rozwój
i funkcję jajników, zawierający domenę forkhead odpowiedzialną za wiązanie się z DNA (ang. forkhead box protein L2), FSH – hormon folikulotropowy
(ang. follicle‑stimulating
hormone), GTC – nowotwory wywodzące się z pierwotnych komórek płciowych (ang. germ cell tumors),
hCG – ludzka gonadotropina kosmówkowa (ang. human choronic gonadotropin), Insl‑3
– insulinopodobny peptyd 3 (ang. insulin‑like
peptide 3),
LDH – dehydrogenaza mleczanowa (ang. lactate dehydrogenase), LH – hormon luteinizujący (ang. luteinizng hormone) OCT ¾ – czynnik
transkrypcyjny wiążący oktamer (ang. octamer‑binding
transcription factor), PLAP – fosfataza zasadowa typu łożyskowego (ang. placental
like alkaline phosphatase), pTis – nowotwór przedinwazyjny, nowotwór wewnatrzkanalikowy z komórek płciowych (ang. primary tumor –
intratubular germ cell neoplasia), pTNM – stopień zaawansowania patologicznego nowotworu (ang. pathological tumor stage), SCF/KITLG –
czynnik wzrostu komórek macierzystych/ligand receptora c‑kit
(ang. stem cell factor/kit‑ligand),
SHGB – globulina wiążąca steroidy płciowe
(ang. sex hormone binding globulin), SOX‑9 – czynnik transkrypcyjny związany z SRY, u człowieka kodowany przez gen SOX9 zlokalizowany
na chromosomie 17 (ang. SRY‑related high‑mobility group box 9 protein), TDS – zespół dysgenetycznych jąder (ang. testicular dysgenesis syndrome),
TSPY – białko specyficzne dla gonady męskiej kodowane przez gen zlokalizowany na chromosomie Y (ang. testis-specific
Y‑encoded
protein), USG – badanie ultrasonograficzne (ang. ultrasonography)
Przyczyny niepłodności u mężczyzn dzieli się na przedjądrowe,
jądrowe i pozajądrowe (Kula i Słowikowska‑Hilczer,
2013). Przyczyny przedjądrowe spowodowane są głównie
zaburzeniami regulacji hormonalnej czynności jąder.
Przyczyny jądrowe to uszkodzenia struktury i czynności
kanalików plemnikotwórczych. Przyczyny pozajądrowe
wiążą się z zaburzeniami transmisji plemników
przez drogi wyprowadzające oraz z brakiem ich zdolności
do zapłodnienia komórki jajowej. Obecnie dostępnymi
metodami diagnostycznymi można rozpoznać przyczynę
niepłodności u mężczyzn w ok. 70–80% przypadków
(Adamopoulos i wsp., 2010; Tüttelmann i Nieschlag,
2010).
Jedną z przyczyn „jądrowych” męskiej niepłodności
jest zaburzenie różnicowania i rozwoju jąder, zwane dysgenezją
gonad (ang. gonadal dysgenesis). Wyróżnia się
następujące typy dysgenezji jąder: 1) całkowitą (czystą),
gdzie zamiast struktury jądra obustronnie stwierdza się
pasma łącznotkankowe przypominające zrąb jajnika (ang.
streak gonad), 2) mieszaną, gdzie po jednej stronie znajduje
się słabo rozwinięta struktura jądra, a po drugiej
pasmo łącznotkankowe i 3) częściową, kiedy stwierdza
się obustronnie strukturę jądra, jednak z zaburzeniami
rozwoju kanalików plemnikotwórczych (Nezelof, 1991;
Berkovitz i Seeherunvong, 1998).
Objawy kliniczne dysgenezji jąder
Prawidłowa czynność hormonalna płodowych jąder
warunkuje organogenezę wewnętrznych i zewnętrznych
męskich narządów płciowych. Różnicowanie
narządów płciowych w kierunku męskim odbywa się
pomiędzy 6. a 20. tygodniem życia płodowego pod
wpływem hormonów wytwarzanych przez jądra: testosteronu
i dihydrotestosteronu (DHT, ang. dihydrotestosterone),
a także hormonu antymüllerowskiego – AMH,
ang. anti‑Müllerian hormone (Kula i Słowikowska‑Hilczer,
2013). Testosteron stymuluje przekształcanie przewodów
Wolffa w wewnętrzne narządy płciowe męskie, tj. najądrza,
nasieniowody, pęcherzyki nasienne i brzuszną
część gruczołu krokowego. Z kolei AMH wywołuje
zanik zawiązków żeńskich wewnętrznych narządów
płciowych (przewody Müllera). Do powstania zewnętrznych
narządów płciowych męskich z wzgórka płciowego
i zatoki moczowo‑płciowej
niezbędny jest DHT,
3‑krotnie
silniejszy androgen powstający przy udziale
enzymu 5α-reduktazy
steroidowej z testosteronu.
Androgeny uczestniczą także w zstępowaniu jąder przez
kanał pachwinowy. Powodują m.in. wydłużenie naczyń
krwionośnych powrózka nasiennego, zmniejszają skurcz
mięśnia dźwigacza jądra, zwiększają rozmiary kanału
pachwinowego i moszny, a dzięki działaniu anabolicznemu
pobudzają rozwój mięśni ścian jamy brzusznej,
przez co zwiększają ciśnienie śródbrzuszne. Ponadto
testosteron wydzielany przez jądra w okresie okołoporodowym
ma znaczenie dla determinacji rozwoju struktur
mózgu odpowiedzialnych za męską identyfikację płciową
(Kula i Słowikowska-Hilczer,
2003).
Nasilone zaburzenia organogenezy jąder łączą się
z całkowitym brakiem komórek płciowych lub zatrzymaniem
spermatogenezy we wczesnym stadium, najczęściej
na etapie płodowych komórek płciowych,
gonocytów lub spermatogonii (Słowikowska‑Hilczer
i wsp., 2005). Z kolei konsekwencją nieprawidłowej
czynności hormonalnej jąder w okresie płodowym
są zaburzenia rozwoju narządów płciowych w kierunku
męskim (żeńskie lub obojnacze narządy płciowe,
ciężkie formy spodziectwa), wnętrostwo (często położenie
jąder w jamie brzusznej lub wysoko w kanałach
pachwinowych) oraz często zaburzenia determinacji
męskiej identyfikacji płciowej. Nieprawidłowości
te należą do grupy zaburzeń rozwoju płci – DSD, ang.
disorders of sex development (Arboleda i wsp., 2014; Kula
i Słowikowska-Hilczer,
2013; Słowikowska-Hilczer
i Kula,
2000). Oprócz nasilonych, „ciężkich” postaci dysgenezji jąder,
ujawniających się odwróceniem cech płciowych (cechy
żeńskie u osób z męską płcią genetyczną), istnieją jej
niepełne, „łagodne” formy, przy których DSD nie pojawiają
się, ale może wystąpić słaby rozwój prącia i łagodne
formy spodziectwa. Postacie te często są niezauważane
w okresie dziecięcym i mogą się ujawnić w postaci opóźnionego
dojrzewania płciowego lub niepełnego dojrzewania
na skutek zmniejszonej produkcji i wydzielania
testosteronu (Juul i wsp., 2014; Wohlfart‑Veje
i wsp., 2009).
Najczęściej jednak te „łagodne” formy dysgenezji jąder
objawiają się tylko uszkodzeniem spermatogenezy (azoospermią
lub ciężką postacią oligozoospermii < 5 mln/mL
plemników w nasieniu) i związaną z tym niepłodnością
(tabela 1).
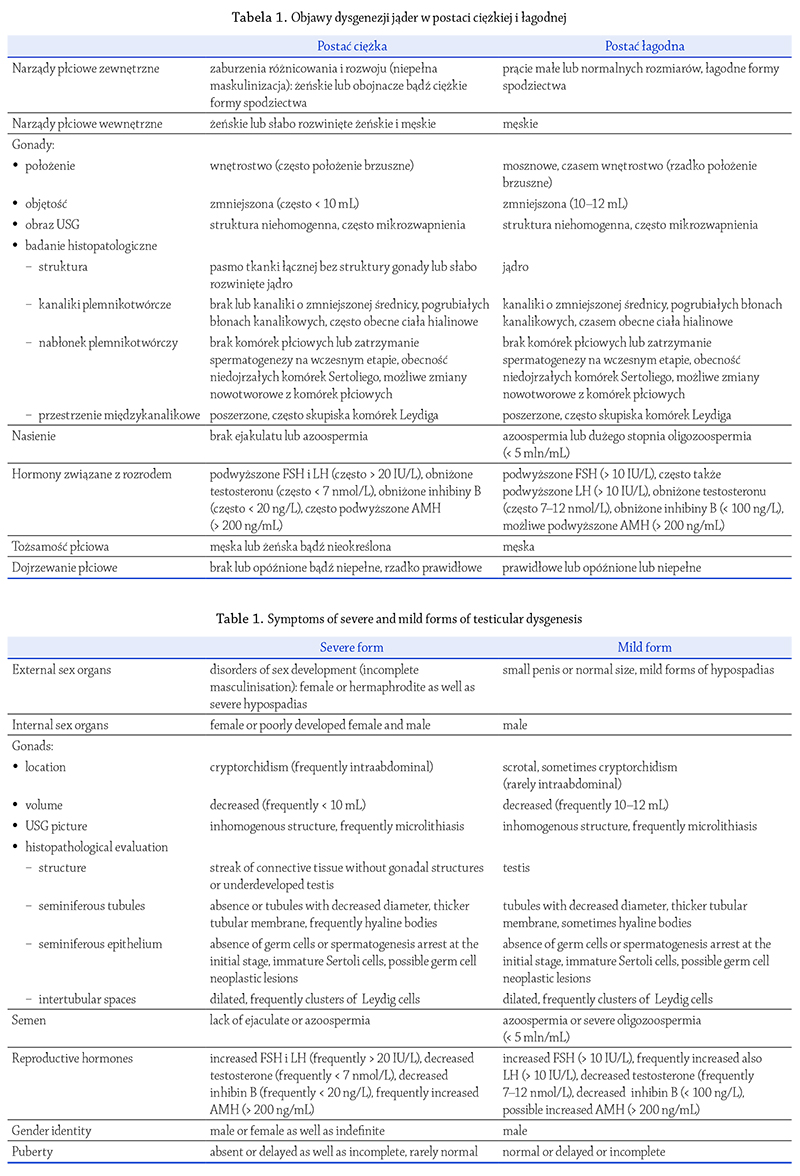
Gorszy stan nabłonka plemnikotwórczego wiąże się
z cechami dysgenezji jąder stwierdzanymi w ocenie histopatologicznej,
m.in. zmniejszoną średnicą kanalików
plemnikotwórczych, pogrubiałą błoną kanalikową, obecnością
kanalików z niedojrzałymi komórkami Sertoliego,
obecnością tzw. ciał hialinowych w świetle kanalików
plemnikotwórczych, poszerzonymi przestrzeniami międzykanalikowymi
i większymi zgrupowaniami komórek
Leydiga (Gumińska i wsp., 2010; Hoei‑Hansen
i wsp.,
2003; Rajpert-DeMeyts
i Hoei-Hansen,
2007) (rycina 1).
W badaniu ultrasonograficznym (USG, ang. ultrasonography)
stwierdza się niehomogenną strukturę jąder
i liczne mikrozwapnienia (Holm i wsp., 2003), a objętość
dysgenetycznych jąder jest zmniejszona (< 12 mL).
Z kolei w badaniach hormonalnych stwierdza się podwyższone
stężenie głównie gonadotropiny: hormonu folikulotropowego
(FSH, ang. follicle‑stimulating
hormone), ale
często także hormonu luteinizującego (LH, ang. luteinizing
hormone) we krwi. Często pojawia się również niskie stężenie
testosteronu i rozwija tzw. hipogonadyzm hipergonadotropowy
(pierwotny), którego konsekwencją mogą
być zaburzenia erekcji, obniżone libido, ginekomastia,
zwiększenie masy tłuszczowej (głównie otyłość centralna),
utrata masy mięśniowej i kostnej, anemia (Kula
i Słowikowska‑Hilczer,
2013). Objawem niedojrzałości i nieprawidłowej
czynności komórek Sertoliego jest, oprócz
podwyższenia stężenia FSH, obniżenie stężenia inhibiny
B (< 100 ng/L) oraz podwyższenie stężenia AMH –
> 200 ng/mL) (Meeker i wsp., 2007; Uhler i wsp., 2003).
We wszystkich postaciach dysgenezji jąder występuje
zwiększone ryzyko rozwoju nowotworów wywodzących
się z komórek płciowych – GCT, ang. germ
cell tumours (Dieckmann i Pichlmeier, 2004; Skakkebaek,
2004; Skakkebaek i wsp., 2003). Z tego powodu u mężczyzn
z azoospermią lub ciężką postacią oligozoospermii,
którym towarzyszy hipogonadyzm hipergonadotropowy
i zmniejszona objętość jąder, wykonuje się badania stężenia
we krwi markerów nowotworowych, takich jak:
α-fetoproteina
(AFP, ang. α-fetoprotein),
podjednostka β
ludzkiej gonadotropiny kosmówkowej (βhCG, ang. human
chorionic gonadotropin, β subunit) i dehydrogenaza mleczanowa
(LDH, ang. lactate dehydrogenase) w celu wykluczenia
jawnych GCT (de Geeter i Albers, 2010; Jacobsen i wsp.,
2000; Raman i wsp., 2005). Markery te nie są podwyższone
w przypadku stanu przedrakowego, tzw. wewnątrzkanalikowego
nowotworu jądra lub nowotworu in situ (CIS,
łac. carcinoma in situ) jądra – według klasyfikacji stopnia
zaawansowania patologicznego nowotworu (pTNM, ang.
pathogical tumor stage): stadium pTis (ang. primary tumor –
intratubular germ cell neoplasia). Stan ten nie daje także
objawów klinicznych oprócz oligozoospermii i często
Ryc. 1.Struktura histologiczna dysgenetycznych jąder u: A) 13-
letniego chłopca i B) 24-
letniego mężczyzny z zaburzeniami rozwoju płci. Widoczne
są charakterystyczne cechy dysgenezji jąder: zmniejszona średnica kanalików plemnikotwórczych (KP), pogrubiałe błony kanalikowe, brak komórek
spermatogenezy i obecność niedojrzałych komórek Sertoliego w nabłonku plemnikotwórczym (duże strzałki), a także ciało hialinowe (mała strzałka)
oraz poszerzone przestrzenie międzykanalikowe z większymi zgrupowaniami komórek Leydiga u dorosłego (groty strzałek). Barwienie hematoksyliną
i eozyną. Skala = 20 μm
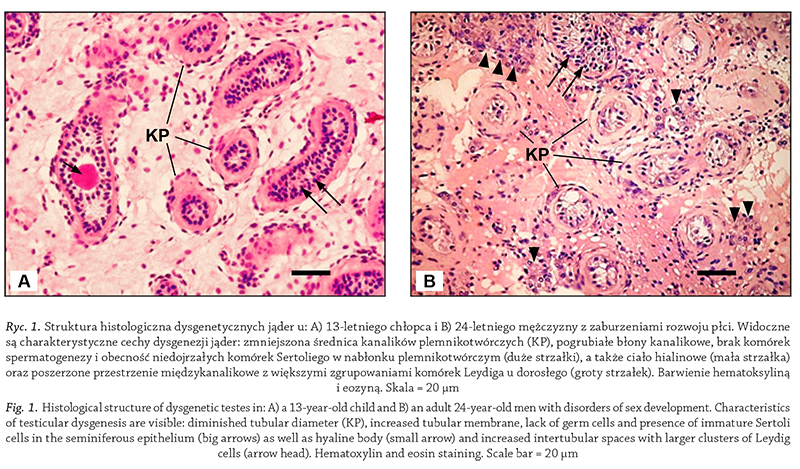 Fig. 1. Histological structure of dysgenetic testes in: A) a 13‑year‑old
child and B) an adult 24-year-old
men with disorders sex development. Characteristics testicular dysgenesis are visible: diminished tubular diameter (KP), increased membrane, lack germ cells presence immature Sertoli in the seminiferous epithelium (big arrows) as well hyaline body (small arrow) intertubular spaces larger clusters Leydig (arrow head). Hematoxylin eosin staining. Scale bar = 20 μm>
Fig. 1. Histological structure of dysgenetic testes in: A) a 13‑year‑old
child and B) an adult 24-year-old
men with disorders sex development. Characteristics testicular dysgenesis are visible: diminished tubular diameter (KP), increased membrane, lack germ cells presence immature Sertoli in the seminiferous epithelium (big arrows) as well hyaline body (small arrow) intertubular spaces larger clusters Leydig (arrow head). Hematoxylin eosin staining. Scale bar = 20 μm>
 mikrozwapnień widocznych w badaniu USG jąder (Holm
i wsp., 2003). Można go wykryć jedynie w badaniu histopatologicznym
wycinka z jądra oraz zastosowaniu reakcji
immunohistochemicznych z przeciwciałami przeciwko
specyficznym antygenom, np. fosfatazie zasadowej typu
łożyskowego – PLAP, ang. placental like alkaline phosphatase
(Dieckmann i wsp., 2011).
Patogeneza dysgenezji jąder
mikrozwapnień widocznych w badaniu USG jąder (Holm
i wsp., 2003). Można go wykryć jedynie w badaniu histopatologicznym
wycinka z jądra oraz zastosowaniu reakcji
immunohistochemicznych z przeciwciałami przeciwko
specyficznym antygenom, np. fosfatazie zasadowej typu
łożyskowego – PLAP, ang. placental like alkaline phosphatase
(Dieckmann i wsp., 2011).
Patogeneza dysgenezji jąder
Podłożem wystąpienia dysgenezji jąder mogą być czynniki
genetyczne, np. liczbowe i strukturalne aberracje chromosomów
płciowych (Juul i wsp., 2014; Lim i wsp., 1998;
Müller i wsp., 1999; Rajpert-DeMeyts,
2006). Zaburzenie
to może być związane z występowaniem specyficznej
haplogrupy chromosomu Y – hp26, która jest najczęściej
stwierdzana w populacji duńskiej. Geny w tej klasie chromosomu
Y mogą być szczególnie wrażliwe na czynniki
środowiskowe (Møller i Evans, 2003).
W ostatnich 50 latach obserwuje się wzrastającą częstość
występowania zaburzeń dotyczących męskiego
układu płciowego. Przypuszcza się, że przyczyną tych
zaburzeń mogą być zanieczyszczenia środowiska naturalnego
przez substancje pochodzenia przemysłowego,
zwłaszcza w regionach o wysokim poziomie rozwoju
gospodarczego. Wiele badań wykazało związek między
częstością występowania zaburzeń układu rozrodczego
i wzmożoną ekspozycją na czynniki środowiskowe o działaniu
biologicznym naśladującym estrogeny (ksenoestrogeny,
ang. xenoestrogens), które mają także działanie
antyandrogenne (Fisher, 2004; Rajpert-DeMeyts,
2006; Sharpe, 2001; Skakkebaek, 2004; Słowikowska‑Hilczer,
2006). Ksenoestrogeny zalicza się do szerokiej
grupy środowiskowych związków chemicznych zaburzających
funkcje endokrynne – przerywaczy endokrynnych
(EDs/EDCs, ang. endocrine disrupting compounds).
Nie mają one jednolitej struktury chemicznej. Zalicza się
do nich zarówno związki alifatyczne, jak i aromatyczne,
niektóre z nich zawierają w strukturze metale ciężkie
lub halogeny. Mogą one zaburzać biosyntezę estrogenów
i androgenów, zwiększać lub zmniejszać metabolizm hormonów
i zmieniać hormonalną homeostazę. Wydaje się,
że ich wpływ na męski układ płciowy jest szczególnie niebezpieczny
w okresie płodowym. Męski płód wytwarza
AFP i globulinę wiążącą steroidy płciowe (SHBG, ang.
sex hormone binding globulin), które wiążą estrogeny
pochodzące od matki. W ten sposób płód jest chroniony
przed działaniem matczynych estrogenów. Natomiast,
ksenoestrogeny
nie są wiązane przez te białka. Prowadzi
to do ekspozycji płodów męskich na estrogenny wpływ
czynników środowiska zewnętrznego (Bonde i Giwercman,
1995). Podejrzewa się, że dzięki temu mogą one uczestniczyć
w patogenezie dysgenezji jąder oraz patogenezie
GCT (Borch i wsp., 2006; Fisher i wsp., 2003; Gray i wsp.,
2000; Howdeshell i wsp., 2007; Saillenfait i wsp., 2008;
Sharpe, 2001). Inne czynniki, które mogą zaburzać rozwój
jąder w okresie płodowym, to wewnątrzmaciczne zahamowanie
wzrostu płodu, wcześniactwo, palenie papierosów
w okresie ciąży (Jensen i wsp., 2004; Juul i wsp.,
2014; Main i wsp., 2006).
Szereg badań klinicznych i doświadczalnych potwierdził,
że zaburzenie organogenezy jąder spowodowane
różnymi przyczynami wtórnie prowadzi zawsze do upośledzenia
czynności komórek Sertoliego i Leydiga
w okresie płodowym, co z kolei jest przyczyną DSD
(Andersson i wsp., 2004; Joensen i wsp., 2008; Sharpe
i wsp., 2003). Stwierdzono, że procesy różnicowania płodowych
komórek Leydiga są regulowane przez komórki
Sertoliego (Booth i wsp., 1987; Sharpe i wsp., 2003).
Zaburzenie interakcji między tymi komórkami może
być przyczyną zmniejszonej sekrecji testosteronu przez
płodowe komórki Leydiga, co z kolei może prowadzić
do zahamowania proliferacji komórek Sertoliego. Liczba
komórek Sertoliego zwiększa się w tym samym czasie,
kiedy poziomy testosteronu są wysokie, w okresie płodowym
i kilka miesięcy po urodzeniu. W jądrach dojrzałych
mężczyzn liczba komórek Sertoliego jest głównym
determinantem odpowiedniej wydajności wytwarzania
plemników. Tak więc obniżenie poziomu testosteronu
w dysgenetycznych płodowych i noworodkowych jądrach
prowadzi do zmniejszenia liczebności komórek Sertoliego,
a w konsekwencji do zmniejszenia liczebności plemników
(Sharpe i wsp., 2003). Ponadto z powodu nieprawidłowego
różnicowania komórek somatycznych jądra nie wytwarzają
właściwie czynników parakrynnych i hormonów,
co w konsekwencji prowadzi do braku stymulacji różnicowania
płodowych komórek płciowych (gonocytów)
i do ich przemiany nowotworowej (Looijenga i wsp., 2010;
Rajpert-DeMeyts
i wsp., 2006). Androgeny stymulują
także ekspresję insulinopodobnego peptydu 3 (Insl‑3,
ang. insulin‑like
peptide 3), który, jak wykazano na modelu
zwierzęcym, ma istotne znaczenie dla procesu zstępowania
jąder (McKinnell i wsp., 2005), a ich brak jest przyczyną
wnętrostwa.
Skakkebaek i wsp. (2001) wysunęli hipotezę, że zaburzenia
rozwojowe męskiego układu płciowego, m.in. wnętrostwo,
spodziectwo, a także niepłodność spowodowaną
uszkodzoną spermatogenezą i nowotwory jąder wywodzące
się z komórek płciowych (GCT), można zaliczyć
do jednej grupy, nazwanej zespołem dysgenetycznych
jąder (TDS, ang. testicular dysgenesis syndrome), obejmującego
nieodwracalne zaburzenia, które są różną manifestacją
nieprawidłowego rozwoju jąder w okresie prenatalnym.
Przypuszcza się, że patogeneza TDS i GCT
jest wspólna. Skakkebaek (1972) przedstawił hipotezę,
według której wszystkie GCT, oprócz nasieniaka spermatocytarnego,
wywodzą się z pierwotnych płodowych
komórek płciowych, gonocytów. Uległy one przemianie
nowotworowej w okresie płodowym, przetrwały
aż do okresu dojrzałości płciowej w obrębie kanalików
plemnikotwórczych (CIS), a następnie dały początek
jawnym, inwazyjnym formom GCT. Podstawą tej teorii
było stwierdzenie, że wszystkie GCT zawierają komórkio cechach morfologicznych i antygenowych podobnych
do gonocytów (Andrews, 1998; Rajpert-DeMeyts
i wsp., 1996). Przypuszcza się, że w dysgenetycznych
jądrach przyczyną zmian nowotworowych nie są zaburzenia
samych gonocytów, ale raczej ma tutaj udział
zaburzenie czynności komórek somatycznych znajdujących
się w otoczeniu komórek płciowych – komórki
Leydiga i Sertoliego lub ich prekursory (Cools i wsp., 2006;
Looijenga i wsp., 2010; Looijenga i wsp., 2011; Skakkebaek,
2004). Nieprawidłowości komórek somatycznych są przyczyną
obumierania większości komórek płciowych, ale
te, które zachowały ekspresję antygenów płodowych,
mają zdolność przeżycia i proliferacji. Płodowe gonocyty,
które przeżyły w obrębie już wytworzonych kanalików
jądra, mają lepsze warunki do przetrwania w niezmienionej,
ale opóźnionej rozwojowo formie przez wiele
lat jako komórki CIS (Słowikowska‑Hilczer
i wsp., 2001).
Komórki CIS mogą ulec zanikowi, ale także mogą dać
początek GCT w okresie dojrzewania lub późniejszym.
Wysokie stężenia gonadotropin w okresie dojrzałości
płciowej u pacjentów z dysgenezją jąder są prawdopodobnie
przyczyną proliferacji komórek CIS (Słowikowska-Hilczer
i wsp., 2003).
Postępowanie terapeutyczne
Dysgenezja jąder jest zaburzeniem nieodwracalnym.
U osób z ciężką postacią dysgenezji jąder i DSD nie
ma jednoznacznych wytycznych co do postępowania
terapeutycznego. Zwykle operacje narządów płciowych
przeprowadzane były we wczesnym dzieciństwie, ale
w ostatnich 10 latach przybywa argumentów na korzyść
przesuwania terminu operacji zewnętrznych narządów
płciowych do okresu, kiedy już można stwierdzić, jaka jest
płeć psychiczna i pacjent jest w stanie podjąć świadomą
decyzję (Kula i wsp., 2001; Köhler i wsp., 2012; Wiesemann
i wsp., 2010).
Ze względu na słaby rozwój, brak aktywności hormonalnej
i gametotwórczej oraz wysokie ryzyko zmian
nowotworowych, gonady usuwa się niezależnie od tożsamości
płciowej, zwykle w okresie przeddojrzewaniowym.
Biopsja jąder u dzieci przeddojrzewaniowych generalnie
nie jest polecana, jednak wyjątek stanowią jądra dysgenetyczne
u dzieci z DSD (Ritzen, 2008, Tekgül i wsp.,
2014). Niektóre ośrodki polecają wykonanie biopsji dysgenetycznych
jąder podczas operacji narządów płciowych
u dzieci prowadzonych w kierunku męskim (Cools
i wsp., 2014). Wskazaniem jest tutaj stwierdzenie zaburzeń
w badaniu klinicznym, takich jak: nieprawidłowa
struktura jądra w badaniu palpacyjnym i USG, wysokie
stężenia FSH, LH, niskie AMH, inhibiny B i testosteronu
oraz brak zwyżki testosteronu w odpowiedzi na podanie
ludzkiej gonadotropiny kosmówkowej (hCG, ang. human
chorionic gonadotropin). Ocena histologiczna oraz reakcje
immunohistochemiczne
z przeciwciałami przeciwko
białku specyficznemu dla gonady męskiej kodowanemu
przez gen zlokalizowany na chromosomie Y (TSPY, ang.
testis-specific
Y‑encoded
protein), czynnikowi transkrypcyjnemu
wiążącemu oktamer (OCT ¾, ang. octamer-binding
transcription factor), czynnikowi wzrostu komórek macierzystych/
ligand receptora c-kit
(SCF/KITLG, ang. stem
cell factor/kit-ligand),
czynnikowi transkrypcyjnemu
związanemu z SRY (SOX-9,
ang. Sry-related
high mobility
group box 9 protein), czynnikowi transkrypcyjnemu
zaangażowanemu w rozwój i funkcję jajników, zawierającemu
domenę forkhead odpowiedzialną za wiązanie się
z DNA (FOXL-2,
ang. forkhead box protein L2) umożliwiają
wczesną identyfikację komórek nowotworowych, a także
prawidłowych komórek płciowych, które we wczesnych
etapach rozwoju mogą przypominać komórki nowotworowe
(Looijenga i wsp., 2010). Takie postępowanie pozwala
na decyzję o pozostawieniu jąder u chłopców, bez profilaktycznej
gonadektomii, w przypadkach z niskim
ryzykiem nowotworowym (Goosens i Tourney, 2014).
Gdy rozwój jąder wydaje się dobry, często pozostawia
się je do okresu dojrzałości. Mają one zwykle zachowaną
czynność komórek Leydiga, co umożliwia samoistne dojrzewanie
płciowe (Lindhardt i wsp., 2012, Słowikowska‑Hilczer
i wsp., 2005).
Pozostawione gonady w miarę możliwości sprowadza
się do moszny (ang. orchidopexia). Obecnie poleca się przeprowadzanie
operacji wnętrostwa ok. 1 r.ż. (Ritzen, 2008;
Feyles i wsp., 2013). U chłopców z jądrami sprowadzonymi
do moszny wymagane jest przynajmniej raz w roku kontrolne
badanie lekarskie. Dzięki częstej kontroli (badanie
palpacyjne, USG jąder) możliwe jest wczesne uchwycenie
zmian nowotworowych gonady. Należy również kontrolować
przebieg dojrzewania płciowego, gdyż dopiero wtedy
mogą ujawnić się objawy hipogonadyzmu (Słowikowska‑Hilczer
i Kula, 2000).
U dojrzałych mężczyzn z zachowanymi dysgenetycznymi
jądrami polecane jest wykonanie biopsji jądra
i ocena histopatologiczna wycinka w celu stwierdzenia
obecności plemników i wykluczenia stanu przednowotworowego,
gdy stwierdzi się podwyższone stężenie FSH,
zmniejszoną objętość jąder (< 12 mL), małą liczebność
plemników w nasieniu oraz mikrozwapnienia (Dieckmann
i wsp., 2011). W przypadku stwierdzenia plemników
możliwe jest zastosowanie technik rozrodu wspomaganego
– ART, ang. assisted reproductive technology (Flannigan
i wsp., 2014). Jednak w większości przypadków stwierdza
się całkowitą i stałą niepłodność.
W towarzyszącym hipogonadyzmie hipergonadotropowym
u osób z męską tożsamością płciową
stosuje się terapię substytucyjną preparatami testosteronu
(Kula i Słowikowska‑Hilczer,
2013; Hewitt i Warne,
2012). Obecnie do terapii substytucyjnej testosteronem
w Polsce dostępne są następujące preparaty: 1) enantat
testosterae podawany domięśniowo, 2) undecylenian
testosteronu podawany doustnie lub 3) domięśniowo,
4) mieszanina estrów testosteronu (propionian, fenylopropionian,
izoheksanian, dekanian) podawana domięśniowo
i 5) testosteron podawany przezskórnie w postaci żelu. Dawkowanie dostosowuje się indywidualnie, aby
utrzymać stężenie testosteronu w średnich granicach
normy dla młodych mężczyzn. Należy unikać stężeń
ponadfizjologicznych ze względu na możliwość wystąpienia
działań ubocznych testosteronu, takich jak zwiększenie
hematokrytu i powikłania zakrzepowo‑zatorowe.
Przed rozpoczęciem leczenia, a następnie przynajmniej
raz w roku należy kontrolować morfologię krwi, stężenie
enzymów wątrobowych i lipidogram. Zaleca się także
badania densytometryczne kości wykonywane co 2 lata.
Terapia ta poprawia gęstość mineralną kości, ale w przypadku
osteoporozy może być niewystarczająca i w takim
przypadku konieczne jest zastosowanie dodatkowego
leczenia preparatami antyosteoporotycznymi (Kula
i Słowikowska‑Hilczer,
2013).
U osób z żeńską tożsamością płciową wykonuje
się gonadektomię wkrótce po postawieniu diagnozy,
a następnie w okresie spodziewanego dojrzewania płciowego
rozpoczyna się substytucyjną terapię zastępczą
preparatami estrogenów w celu rozwoju i utrzymania
żeńskich cech płciowych i zapewnienia działań metabolicznych
steroidów płciowych (Grover, 2012). W Polsce
preparaty etynylestradiolu (ang. ethinylestradiol) dostępne
są w postaci tabletek dojelitowych, tabletek dopochwowych,
systemu transdermalnego i żelu. Dawkę dostosowuje
się do skuteczności działania preparatu u danej
pacjentki, a w leczeniu podtrzymującym stosuje się najmniejszą
skuteczną dawkę. Można zastosować dwa schematy
podawania preparatu: 1) cykliczny – podawanie preparatu
przez 21–28 dni, po czym następuje 2–7‑dniowa
przerwa; 2) ciągły – leczenie bez przerwy w podawaniu
(zwykle stosowane, gdy podczas leczenia cyklicznego
objawy niedoboru estrogenów występowały w czasie, gdy
ich nie podawano). W obu schematach u kobiet z rozwiniętymi
wewnętrznymi narządami płciowymi (macica,
pochwa) należy łącznie z estradiolem podawać progestagen
przez 12–14 dni drugiej połowy każdego cyklu,
w celu zapobiegania rozrostowi błony śluzowej macicy
wywoływanemu przez estrogeny. Przy stosowaniu tych
preparatów obowiązują wszystkie środki ostrożności
zalecane przy stosowaniu antykoncepcji hormonalnej
(Division of Reproductive Health, National Center for Chronic
Disease Prevention and Health Promotion, Centers for Disease
Control and Prevention, 2013). U kobiet z prawidłowo rozwiniętą
macicą często możliwy jest rozród z zastosowaniem
ART, gdzie wykorzystuje się komórkę jajową
dawczyni i plemniki partnera.
Piśmiennictwo
Adamopoulos D., Mitios G., Nicopolou S.: Defining male factor infertility.
W: Clinical andrology. EAU/ESAU course guidelines. Red. Bjorndahl L.,
Giwercman A., Tournaye H., Weidner W. Informa Health, 2010, 293–300.
Andersson A.M., Jørgensen N., Frydelund-Larsen
L., Rajpert-De
Meyts
E., Skakkebaek N.E.: Impaired Leydig cell function in infertile men: A study
of 357 idiopathic infertile men and 318 proven fertile controls. J Clin
Endocrinol Metab. 2004, 89, 3161–3167.
Andrews P.W.: Teratocarcinomas and human embryology: pluripotent human
EC cell lines. APMIS. 1998, 106, 158–167.
Arboleda V.A., Sandberg D.E., Vilain E.: DSDs: genetics, underlying pathologies
and psychosexual differentiation. Nat Rev Endocrinol. 2014, 10, 603–615.
Berkovitz G.D., Seeherunvong T.: Abnormalities of gonadal differentiation.
Baillieres Clin Endocrinol Metab. 1998, 12, 133–142.
Bonde J.P., Giwercman A.: Occupational hazards to male fecundity. Reprod
Med Rev. 1995, 4, 59–73.
Booth J.D., Merriam G.R., Clark R.V., Loriaux D.L., Sherins, R.J.: Evidence
for Leydig cell dysfunction in infertile men with a selective increase in
plasma follicle-stimulating hormone. J Clin Endocrinol Metab. 1987, 64,
1194–1198.
Borch J., Axelstad M., Vinggaard A.M., Dalgaard M.: Diisobutyl phthalate has
comparable anti‑androgenic
effects to di‑n‑butyl
phthalate in fetal rat testis.
Toxicol Lett. 2006, 163, 183–190.
Cools M., Looijenga L., Wolffenbuttel K.P.: Managing the risk of germ cell
tumourigenesis in disorders of sex development patients. W: Understanding
differences and disorders of sex development (DSD). Red. Hiort O., Ahmed
S.F. Endocrine Development, Karger, Basel 2014, 27, 185–196.
Cools M., Stoop H., Kersemaekers A.M.F, Cools M., Molier M., Wolffenbuttel
K. i wsp.: Gonadoblastoma arising in undifferentiated gonadal tissue within
dysgenetic gonads. J Clin Endocrinol Metab. 2006, 91, 2404–2413.
de Geyter C., de Geyter M., Behre H.: Assisted reproduction. W: Andrology.
Male reproductive health and dysfunction. Red. Nieschlag E., Behre H.M.,
Nieschlag S. Springer-Verlag,
Heidelberg, Berlin, 2010, 467–504.
Dieckmann K.P., Kulejewski M., Heinemann V., Loy V.: Testicular biopsy for
early cancer detection-objectives, technique and controversies. Int J Androl.
2011, 34, 7–13.
Dieckmann K.P., Pichlmeier U.: Clinical epidemiology of testicular germ cell
tumours. World J Urol. 2004, 22, 2–14.
Division of Reproductive Health, National Center for Chronic Disease Prevention
and Health Promotion, Centers for Disease Control and Prevention (CDC):
U.S. Selected Practice Recommendations for Contraceptive Use, 2013:
adapted from the World Health Organization selected practice recommendations
for contraceptive use, 2nd edition. MMWR Recomm Rep. 2013,
62 (RR-
05), 1–60.
Feyles F., Peiretti V., Mussa A., Manenti M., Canavese F., Cortese M.G. i. wsp.:
Improved sperm count and motility in young men surgically treated for cryptorchidism
in the first year of life. Eur J Pediatr Surg. 2013, 24, 376–380.
Fisher J.S., Macpherson S., Marchetti N., Sharpe R.M.: Human “testicular dysgenesis
syndrome”: a possible model using in-utero
exposure of the rat
to dibutyl phthalate. Hum Reprod. 2003, 18, 1383–1394.
Fisher J.S.: Environmental anti-androgens
and male reproductive health:
focus on phthalates and testicular dysgenesis syndrome. Reproduction.
2004, 127, 305–315.
Flannigan R.K., Chow V., Ma S., Yuzpe A.: 45,X/46,XY mixed gonadal dysgenesis:
A case of successful sperm extraction. Can Urol Assoc J. 2014,
8, 108–110.
De Geeter P., Albers P.: Infertility and testis cancer. W: EAU/ESAU course
guidelines. Red. Bjorndahl L., Giwercman A., Tournaye H., Weidner W.
Informa Health, 2010, 176–185.
Goossens E., Tournaye H.: Male fertility preservation, where are we in 2014?
Ann Endocrinol (Paris). 2014, 75, 115–117.
Gray L.E. Jr, Ostby J., Furr J., Price M., Veeramachaneni D.N., Parks L.: Perinatal
exposure to the phthalates DEHP, BBP, and DINP, but not DEP, DMP, or DOTP,
alters sexual differentiation of the male rat. Toxicol Sci. 2000, 58, 350–365.
Grover S.R.: Gynaecological management. W: Disorders of sex development.
An integrated approach to management. Red. Hutson J.M., Warne G.L.,
Grover S.R. Springer-Verlag,
Berlin, Heidelberg 2012, 241–250.
Gumińska A., Oszukowska E., Kuzanski W., Sosnowski M., Wolski J.K., Walczak‑Jedrzejowska
R. i wsp.: Less advanced testicular organogenesis is associated
with a higher incidence of germ cell neoplasia. Int J Androl. 2010, 33, 153–162.
Hewitt J.K., Warne G.L.: 46,XY DSD. W: Disorders of sex development. An
integrated approach to management. Red. Hutson J.M., Warne G.L., Grover
S.R. Springer-Verlag,
Berlin, Heidelberg 2012, 63–80.
Hoei-Hansen
C.E., Holm M., Rajpert-De
Meyts E., Skakkebaek N.E.: Histological
evidence of testicular dysgenesis in contralateral biopsies of 218 patients
with testicular germ cell cancer. J Pathol. 2003, 200, 370–374.
Holm M., Hoei-Hansen
C.E., Rajpert-De
Meyts E., Skakkebaek N.E.: Increased
risk of carcinoma in situ in patients with testicular germ cell cancer with
ultrasonic microlithiasis in the contralateral testicle. J Urol. 2003, 170,
1163–1167.
Howdeshell K.L., Furr J., Lambright C.R., Rider C.V., Wilson V.S., Gray L.E. Jr.:
Cumulative effects of dibutyl phthalate and diethylhexyl phthalate on male
rat reproductive tract development: altered fetal steroid hormones and
genes. Toxicol Sci. 2007, 99, 190–202.
Jacobsen R., Bostofte E., Engholm G., Hansen J., Olsen J.H., Skakkebaek N.E.
i wsp.: Risk of testicular cancer in men with abnormal semen characteristics:
cohort study. BMJ. 2000, 321 789–792.
Jensen T.K., Jorgensen N., Punab M., Haugen T.B., Suominen J., Zilaitiene B. i wsp.:
Association of in utero exposure to maternal smoking with reduced semen
quality and testis size in adulthood: a cross-
sectional study of 1770 young
men from the general population in five European countries. Am J Epidemiol.
2004, 159, 49–58.
Joensen U.N., Jorgensen N., Rajpert-DeMeyts
E., Skakkebaek N.E.: Testicular
Dysgenesis Syndrome and Leydig cell function. Basic Clin Pharmacol Toxicol.
2008, 102, 155–161.
Juul A., Almstrup K., Andersson A.M., Jensen T.K., Jørgensen N., Main K.M. i wsp.:
Possible fetal determinants of male infertility. Nat Rev Endocrinol. 2014,
10, 553–562.
Köhler B., Kleinemeier E., Lux A., Hiort O., Grüters A., Thyen U.: DSD Network
Working Group. Satisfaction with genital surgery and sexual life of adults
with XY disorders of sex development: results from the German clinical
evaluation study. J Clin Endocrinol Metab. 2012, 97, 577–588.
Kula K., Słowikowska-Hilczer
J., Oszukowska E.: Korekcja obojnaczych narządów
płciowych. Przegl Urol. 2001, 3, 43–47.
Kula K., Słowikowska-Hilczer
J.: Biologiczny charakter identyfikacji, roli i psychoorientacji
płciowej. Kosmos. 2003, 52, 11–19.
Kula K., Słowikowska‑Hilczer
J.: Choroby jąder. W: Interna Szczeklika. Red.
Gajewski P. Medycyna Praktyczna, Kraków 2013, 1303–1311.
Kula K., Słowikowska-Hilczer
J.: Zaburzenia determinacji i różnicowania płci.
W: Interna Szczeklika. Red. Gajewski P. Medycyna Praktyczna, Kraków
2013, 1312–1317.
Lim H.N., Freestone S.H., Romero D., Kwok C., Hughes I.A., Hawkins J.R.:
Candidate genes in complete and partial XY sex reversal: Mutation analysis of
SRY, SRY-related
genes and FTZ-F1.
Mol Cell Endocrinol. 1998, 140, 51–58.
Lindhardt J.M., Hagen C.P., Rajpert‑De
Meyts E., Kjærgaard S., Petersen B.L.,
Skakkebæk N.E.: 45,X/46,XY mosaicism: phenotypic characteristics, growth,
and reproductive function-
a retrospective longitudinal study. J Clin
Endocrinol Metab. 2012, 97, 1540–1549.
Looijenga L., Gillis A.J.M., Stoop H., Biermann K., Oosterhuis J. W.: Dissecting
the molecular pathways of (testicular) germ cell tumour pathogenesis; from
initiation to treatment-resistance.
Int J Androl. 2011, 34, 234–251.
Looijenga L., Hersmus R., Leeuw H., Stoop H., Cools M., Oosterhuis J.W. i wsp.:
Gonadal tumours and DSD. Best Pract Res Clin Endocrinol Metab. 2010,
24, 291–310.
Main K.M., Jensen R.B., Asklund C., Høi‑Hansen
C.E., Skakkebaek N.E.: Low birth
weight and male reproductive function. Horm Res. 2006, 65, 116–122.
McKinnell C., Sharpe R.M., Mahood K., Hallmark N., Scott H., Ivell R. i wsp.:
Expression of insulin-like
factor 3 protein in the rat testis during fetal and
postnatal development and in relation to cryptorchidism induced by in utero
exposure to di (n-butyl)
phthalate. Endocrinol. 2005, 146, 4117–4126.
Meeker J.D., Godfrey-Bailey
L., Hauser R.: Relationship between serum hormone
levels and semen quality among men from an infertility clinic. J Androl.
2007, 28, 397–406.
Møller H., Evans H.: Epidemiology of gonadal germ cell cancer in males and
females. APMIS. 2003, 111, 43–46.
Müller J., Ritzen E.M., Ivarsson S.A., Rajpert‑De
Meyts E., Norjavaara E.,
Skakkebaek NE.: Management of males with 45,X/46,XY gonadal dysgenesis.
Horm Res. 1999, 52, 11–14.
Nezelof C.: Gonadal dysgenesis and agenesis: anatomical expression. Bull
Assos Anat. 1991, 75, 43–45.
Rajpert-DeMeyts
E., Hoei-Hansen
C.E.: From gonocytes to testicular cancer:
the role of impaired gonadal development. Ann N York Acad Sci. 2007,
1120, 168–180.
Rajpert-DeMeyts
E., Kvist M., Skakkebaek N.E.: Heterogeneity of expression
of immunohistochemical tumour markers in testicular carcinoma in situ:
pathogenetic relevance. Virchows Arch. 1996, 428, 133–139.
Rajpert-DeMeyts
E.: Developmental model for the pathogenesis of testicular
carcinoma in situ: genetic and environmental aspects. Hum Reprod
Update. 2006, 12, 303–323.
Raman J.D., Nobert C.F., Goldstein M.: Increased incidence of testicular cancer
in men presenting with infertility and abnormal semen analysis. J Urol.
2005, 174, 1819–1822.
Ritzén E.M.: Undescended testes: a consensus on management. Eur
J Endocrinol. 2008, 159, 87–90.
Saillenfait A.M., Sabaté J.P., Gallissot F.: Diisobutyl phthalate impairs the
androgen‑dependent
reproductive development of the male rat. Reprod
Toxicol. 2008, 26, 107–115.
Sharpe R.M., McKinnell C., Kivlin C., Fisher J.S.: Proliferation and functional
maturation of Sertoli cells, and their relevance to disorders of testis function
in adulthood. Reproduction. 2003, 125, 769–784.
Sharpe R.M.: Hormones and testis development and the possible adverse
effects of environmental chemicals. Toxicol Lett. 2001, 120, 221–232.
Skakkebaek N.E., Holm M., Hoei-Hansen
C., Jorgenesen N., Rajpert-DeMeyts
E.:
Association between testicular dysgenesis syndrome (TDS) and testicular
neoplasia: Evidence from 20 adult patients with signs of maldevelopment
of the testis. APMIS. 2003, 111, 1–11.
Skakkebaek N.E., Rajpert-De
Meyts E., Main K.M.: Testicular dysgenesis syndrome:
an increasingly common developmental disorder with environmental
aspects. Hum Reprod. 2001, 16, 972–978.
Skakkebaek N.E.: Possible carcinoma-in-
situ of the testis. Lancet. 1972, 9,
516–517.
Skakkebaek N.E.: Testicular dysgenesis syndrome: new epidemiological evidence.
Int J Androl. 2004, 27, 189–191.
Słowikowska-Hilczer
J., Kula K.: Kliniczne konsekwencje zaburzeń organogenezy
jądra i obwodowego działania steroidów płciowych. End Diab Chor
Przem Mat. 2000, 6, supl. 1, 51–56.
Słowikowska-Hilczer
J., Romer T.E., Kula K.: Neoplastic potential of germ
cells in relation to disturbances of gonadal organogenesis and changes in
karyotype. J Androl. 2003, 24, 270–278.
Słowikowska-Hilczer
J., Szarras-Czapnik
M., Kula K.: Testicular pathology in
46,XY dysgenetic male pseudohermaphroditism. An approach to pathogenesis
of testis cancer. J Androl. 2001, 5, 781–791.
Słowikowska-Hilczer
J., Szarras-Czapnik
M., Sosnowski M., Oszukowska E.,
Wolski J.K., Romer T. i wsp.: Dysgenezja jąder ze zmianą nowotworową
u mężczyzny z interseksualizmem: obserwacja i postępowanie kliniczne
od okresu noworodkowego do 29. roku życia. Urol Pol. 2005, 58,
125–128.
Słowikowska-Hilczer
J.: Xenobiotics with estrogen or antiandrogen action –
disruptors of the male reproductive system. Centr Europ J Med. 2006, 3,
205–227.
Tekgül S., Dogan H.S., Hoebeke P., Kocvara R., Nijman J.M., Radmayr C., Stein R.:
Guidelines on paediatric urology. ESPU 2014, http://www.uroweb.org/gls/
pdf/21_Paediatric_Urology_LR_August% 202012.pdf
Tüttelmann F., Nieschlag E.: Classification of andrological disorders.
W: Andrology. Male reproductive health and dysfunction. Red.
Nieschlag E., Behre H.M., Nieschlag S. Springer‑Verlag,
Heidelberg, Berlin
2010, 100–105.
Uhler M.L., Zinaman M.J., Brown C.C., Clegg E.D.: Relationship between sperm
characteristics and hormonal parameters in normal couples. Fertil Steril.
2003, 79, 1535–1542.
Wiesemann C., Ude-Koeller
S., Sinnecker G.H.G., Thyen U.: Ethical principles
and recommendations for the medical management of differences of sex
development (DSD)/intersex in children and adolescents. Eur J Pediatr.
2010, 169, 671–679.
Wohlfart-Veje
C., Main K.M., Skakkebaek N.E.: Testicular dysgenesis syndrome:
foetal origin of adult reproductive problems. Clin Endocrinol. 2009, 71, 459–465.
