STRES OKSYDACYJNY A NIEPŁODNOŚĆ MĘSKA.
CZĘŚĆ I: CZYNNIKI WYWOŁUJĄCE STRES
OKSYDACYJNY W NASIENIU
OXIDATIVE STRESS AND MALE INFERTILITY.
PART I: FACTORS CAUSING OXIDATIVE STRESS IN SEMEN
Renata Walczak-Jędrzejowska
Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Autor do korespondencji: Renata Walczak-Jędrzejowska (renata.walczak-jedrzejowska@umed.lodz.pl)
Renata Walczak-Jędrzejowska – dr n. med., absolwentka Uniwersytetu Łódzkiego, biolog, specjalność biologia molekularna.
Nauczyciel akademicki w Zakładzie Endokrynologii Płodności Katedry Andrologii i Endokrynologii Płodności
Uniwersytetu Medycznego w Łodzi. Współwykonawca polskich i europejskich projektów badawczych. Pierwszy autor
i współautor 93 publikacji naukowych. Skarbnik Polskiego Towarzystwa Andrologicznego, członek Międzynarodowego
Towarzystwa Andrologicznego, Polskiego Towarzystwa Endokrynologicznego, Towarzystwa Histochemików
i Cytochemików oraz Komisji Andrologii Komitetu Biologii Rozrodu PAN. Praca zawodowa i naukowa autorki związana
jest z badaniami nad czynnością męskiego układu płciowego i jego zaburzeniami oraz diagnostyką andrologiczną.
Streszczenie
Reaktywne formy tlenu są produktami normalnego metabolizmu komórkowego i wytwarzane w niewielkich, kontrolowanych przez
systemy antyoksydacyjne organizmu ilościach odgrywają istotną rolę w wielu procesach fi zjologicznych. Jednakże zwiększona produkcja
reaktywnych form tlenu, spowodowana zachwianiem równowagi między ich wytwarzaniem a działaniem ochronnego systemu
antyoksydacyjnego, prowadzi nieuchronnie do wystąpienia stresu oksydacyjnego. Dochodzi wtedy do uszkodzenia głównych makromolekuł
komórkowych, upośledzenia czynności i w konsekwencji śmierci komórki. Obecnie uważa się, że właśnie stres oksydacyjny
występujący w nasieniu jest jedną z głównych przyczyn męskiej niepłodności, w tym niepłodności idiopatycznej, będącej konsekwencją
zaburzenia czynności plemników, głównie na skutek utleniania lipidów błon komórkowych oraz uszkodzenia ojcowskiego DNA.
słowa kluczowe: plemniki, stres oksydacyjny, niepłodność męska
Abstract
Reactive oxygen species are products of normal cellular metabolism and when produced in small amounts, controlled by the antioxidant
systems play an important role in many physiological processes. However, the increased production of reactive oxygen species, caused
by imbalance between their generation and the protective eff ects of antioxidant system, inevitably leads to an oxidative stress. Th is
causes damage to major cellular macromolecules, dysfunction and fi nally cell death. It is presently considered that oxidative stress is
one of the main causes of male infertility, including idiopathic infertility, resulting from impairement of sperm function, mainly due
to peroxidation of cell membrane’s lipids and paternal DNA.
key words: sperm, oxidative stress, male infertility
Skróty / Abbreviations
ERC – nadmiar resztkowej cytoplazmy (ang. excess residual cytoplasm), G6PDH – dehydrogenaza glukozo-6-fosforanowa (ang. glucose-6-
phosphate dehydrogenase), GPX – peroksydaza glutationowa (ang. glutathione peroxidase), GR – reduktaza glutationowa (ang. glutathione
reductase), H₂O₂ – nadtlenek wodoru (ang. hydrogen peroxide), HO₂• – rodnik wodoronadtlenkowy (ang. hydroperoxyl radical), HOCl – kwas
podchlorawy (ang. hypochloric acid), IL-1β – interleukina 1β (ang. interleukin 1β), IL-6 – interleukina 6 (ang. interleukin 6), IL-8 – interleukina
8 (ang. interleukin 8), KT – katalaza (ang. catalase), MDA – dialdehyd malonowy (ang. malondialdehyde), NADH – dinukleotyd nikotynoamidoadeninowy,
forma zredukowana (ang. nicotinamide adenine dinucleotide, reduced), NADPH – fosforan dinukleotydu nikotynoamidoadeninowego,
forma zredukowana (ang. nicotinamide adenine dinucleotide phosphate, reduced), NO• – tlenek azotu (ang. nitric oxide),
NO₂• – dwutlenek azotu (ang. nitrogen dioxide), O₂•− – anionorodnik ponadtlenkowy (ang. superoxide radical), NOX – oksydaza NADPH (ang.
NADPH oxidase), NOX1 – oksydaza NADPH typu 1 (ang. NADPH oxidase 1), NOX2 – oksydaza NADPH typu 2 (ang. NADPH oxidase 2),
NOX3 – oksydaza NADPH typu 3 (ang. NADPH oxidase 3), NOX4 – oksydaza NADPH typu 4 (ang. NADPH oxidase 4), NOX5 – oksydaza
NADPH typu 5 (ang. NADPH oxidase 5), ¹O₂ – tlen singletowy (ang. singlet oxygen), O₃ – ozon (ang. ozone), OH• – rodnik hydroksylowy (ang.
hydroxyl radical), ONOOH – kwas nadtlenoazotawy (ang. peroxynitrous acid), RFA – reatywne formy azotu (ang. reactive nitrogen species),
RF-ERM – promieniowanie elektromagnetyczne o częstotliwości radiowej (ang. radiofrequency electromagnetic radiation), RFT – reaktywne
formy tlenu (ang. reactive oxygen species), RO• – rodnik alkoksylowy (ang. alkoxyl radical), RO₂• – rodnik peroksylowy (ang. peroxyl radical),
SOD – dysmutaza ponadtlenkowa (ang. superoxide dismutase), TNF-α – czynnik martwicy nowotworów α (ang. tumor necrosis factor α),
WHO – Światowa Organizacja Zdrowia (ang. World Health Organization)
Niepłodność według Światowej Organizacji Zdrowia
(WHO, ang. World Health Organization) jest to niemożność
uzyskania ciąży w czasie 12 miesięcy regularnego
współżycia pary w celach koncepcyjnych (Rowe i wsp.,
2000). Dotyka ona nawet do 20% par w Polsce i na świecie,
bez względu na rasę czy przynależność etniczną i w wielu
krajach uznana jest za chorobę społeczną (Bablok i wsp.,
2011; Hull i wsp., 1985; Irvine, 1998; Kotzbach i Kotzbach,
2013). Ocenia się, że wśród par niepłodnych czynnik
męski stanowi od 25% do nawet 60% (Bablok i wsp., 2011;
Esteves i Agarwal, 2011; Safarinejad, 2008; Sharlip i wsp.,
2002; Ursini i wsp., 1999). W większości przypadków przyczyny
męskiej niepłodności objawiają się obniżeniem
liczby i ruchliwości plemników oraz ich nieprawidłową
morfologią. Wskazuje się także na zaburzenia czynności
plemników, które w niektórych przypadkach mogą stanowić
jedyną przyczynę niepłodności (Hull i wsp., 1985).
Wśród czynników odpowiedzialnych za te zaburzenia
wymienia się zwykle, obok czynników genetycznych,
czynniki środowiskowe oraz związane ze stylem życia,
takie jak: narażenie na działanie związków chemicznych,
metali ciężkich, środków ochrony roślin, ksenoestrogenów,
podwyższonej temperatury, napromieniowania, a także
palenie tytoniu, nadużywanie alkoholu, chroniczny stres
czy nieprawidłowa dieta (Jurewicz i wsp., 2014a; Jurewicz
i wsp., 2014b; Lahdetie, 1995; Słowikowska -Hilczer, 2006;
Th onneau i wsp., 1998). Z obniżeniem męskiej płodności
związane są także, często lekceważone, zapalenia i zakażenia
w męskim układzie płciowym (De Celis i wsp., 1996;
Purvis i Christiansen, 1992). Jednakże, pomimo rozwoju
nauki i coraz doskonalszych metod diagnostycznych,
w dalszym ciągu w ok. 20–30% przypadków etiologia
i patogeneza zaburzeń męskiej płodności pozostaje nieznana,
stanowiąc tzw. niepłodność idiopatyczną (Deng
i wsp., 2008; Sanocka -Maciejewska i wsp., 2005). Obecnie
uważa się, że stres oksydacyjny, będący konsekwencją
działania większości wymienionych wyżej czynników,
stanowi jedną z najbardziej prawdopodobnych przyczyn
idiopatycznej niepłodności męskiej.
Reaktywne formy tlenu w nasieniuNiepłodność według Światowej Organizacji Zdrowia
(WHO, ang. World Health Organization) jest to niemożność
uzyskania ciąży w czasie 12 miesięcy regularnego
współżycia pary w celach koncepcyjnych (Rowe i wsp.,
2000). Dotyka ona nawet do 20% par w Polsce i na świecie,
bez względu na rasę czy przynależność etniczną i w wielu
krajach uznana jest za chorobę społeczną (Bablok i wsp.,
2011; Hull i wsp., 1985; Irvine, 1998; Kotzbach i Kotzbach,
2013). Ocenia się, że wśród par niepłodnych czynnik
męski stanowi od 25% do nawet 60% (Bablok i wsp., 2011;
Esteves i Agarwal, 2011; Safarinejad, 2008; Sharlip i wsp.,
2002; Ursini i wsp., 1999). W większości przypadków przyczyny
męskiej niepłodności objawiają się obniżeniem
liczby i ruchliwości plemników oraz ich nieprawidłową
morfologią. Wskazuje się także na zaburzenia czynności
plemników, które w niektórych przypadkach mogą stanowić
jedyną przyczynę niepłodności (Hull i wsp., 1985).
Wśród czynników odpowiedzialnych za te zaburzenia
wymienia się zwykle, obok czynników genetycznych,
czynniki środowiskowe oraz związane ze stylem życia,
takie jak: narażenie na działanie związków chemicznych,
metali ciężkich, środków ochrony roślin, ksenoestrogenów,
podwyższonej temperatury, napromieniowania, a także
palenie tytoniu, nadużywanie alkoholu, chroniczny stres
czy nieprawidłowa dieta (Jurewicz i wsp., 2014a; Jurewicz
i wsp., 2014b; Lahdetie, 1995; Słowikowska -Hilczer, 2006;
Th onneau i wsp., 1998). Z obniżeniem męskiej płodności
związane są także, często lekceważone, zapalenia i zakażenia
w męskim układzie płciowym (De Celis i wsp., 1996;
Purvis i Christiansen, 1992). Jednakże, pomimo rozwoju
nauki i coraz doskonalszych metod diagnostycznych,
w dalszym ciągu w ok. 20–30% przypadków etiologia
i patogeneza zaburzeń męskiej płodności pozostaje nieznana,
stanowiąc tzw. niepłodność idiopatyczną (Deng
i wsp., 2008; Sanocka -Maciejewska i wsp., 2005). Obecnie
uważa się, że stres oksydacyjny, będący konsekwencją
działania większości wymienionych wyżej czynników,
stanowi jedną z najbardziej prawdopodobnych przyczyn
idiopatycznej niepłodności męskiej.
Reaktywne formy tlenu w nasieniu
Reaktywne formy tlenu (RFT, ang. reactive oxygene species)
to związki tlenu wykazujące większą reaktywność niż
tlen cząsteczkowy w stanie podstawowym (trypletowym).
W każdej żywej komórce, a więc i w plemnikach, niewielkie
ilości RFT powstają jako naturalne produkty
metabolizmu komórkowego. Ich ilość jest ściśle kontrolowana
przez mechanizmy antyoksydacyjne organizmu.
Wiele badań wykazało, że niskie, kontrolowane
(tzw. fi zjologiczne) poziomy RFT odgrywają istotną rolę
w prawidłowej czynności plemnika, biorąc udział w kluczowych
procesach gwarantujących zapłodnienie, takich
jak kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika czy też jego fuzja z oocytem (Agarwal i Saleh,
2002; Amaral i wsp., 2013; Chen i wsp., 2013; Frączek
i Kurpisz, 2013; Guerriero i wsp., 2014).
O stresie oksydacyjnym mówimy w sytuacji, gdy
komórki czy też tkanki narażone są na dodatkowe
źródła RFT, gdy zwiększa się tempo ich endogennej produkcji,
czy też dochodzi do niewydolności ochronnych
systemów antyoksydacyjnych. Jako cząsteczki bardzo
reaktywne, RFT szybko wchodzą w reakcje, w tym reakcje
łańcuchowe, i reagując z białkami, lipidami czy kwasami
nukleinowymi, indukują powstanie kolejnych produktów
wolnorodnikowych. Następstwem stresu oksydacyjnego
są uszkodzenia najważniejszych makromolekuł komórkowych
prowadzące do zaburzenia czynności komórki,
a w konsekwencji do jej śmierci (Aitken i wsp., 2010).Niepłodność według Światowej Organizacji Zdrowia
(WHO, ang. World Health Organization) jest to niemożność
uzyskania ciąży w czasie 12 miesięcy regularnego
współżycia pary w celach koncepcyjnych (Rowe i wsp.,
2000). Dotyka ona nawet do 20% par w Polsce i na świecie,
bez względu na rasę czy przynależność etniczną i w wielu
krajach uznana jest za chorobę społeczną (Bablok i wsp.,
2011; Hull i wsp., 1985; Irvine, 1998; Kotzbach i Kotzbach,
2013). Ocenia się, że wśród par niepłodnych czynnik
męski stanowi od 25% do nawet 60% (Bablok i wsp., 2011;
Esteves i Agarwal, 2011; Safarinejad, 2008; Sharlip i wsp.,
2002; Ursini i wsp., 1999). W większości przypadków przyczyny
męskiej niepłodności objawiają się obniżeniem
liczby i ruchliwości plemników oraz ich nieprawidłową
morfologią. Wskazuje się także na zaburzenia czynności
plemników, które w niektórych przypadkach mogą stanowić
jedyną przyczynę niepłodności (Hull i wsp., 1985).
Wśród czynników odpowiedzialnych za te zaburzenia
wymienia się zwykle, obok czynników genetycznych,
czynniki środowiskowe oraz związane ze stylem życia,
takie jak: narażenie na działanie związków chemicznych,
metali ciężkich, środków ochrony roślin, ksenoestrogenów,
podwyższonej temperatury, napromieniowania, a także
palenie tytoniu, nadużywanie alkoholu, chroniczny stres
czy nieprawidłowa dieta (Jurewicz i wsp., 2014a; Jurewicz
i wsp., 2014b; Lahdetie, 1995; Słowikowska -Hilczer, 2006;
Th onneau i wsp., 1998). Z obniżeniem męskiej płodności
związane są także, często lekceważone, zapalenia i zakażenia
w męskim układzie płciowym (De Celis i wsp., 1996;
Purvis i Christiansen, 1992). Jednakże, pomimo rozwoju
nauki i coraz doskonalszych metod diagnostycznych,
w dalszym ciągu w ok. 20–30% przypadków etiologia
i patogeneza zaburzeń męskiej płodności pozostaje nieznana,
stanowiąc tzw. niepłodność idiopatyczną (Deng
i wsp., 2008; Sanocka -Maciejewska i wsp., 2005). Obecnie
uważa się, że stres oksydacyjny, będący konsekwencją
działania większości wymienionych wyżej czynników,
stanowi jedną z najbardziej prawdopodobnych przyczyn
idiopatycznej niepłodności męskiej.
Reaktywne formy tlenu w nasieniu
Reaktywne formy tlenu (RFT, ang. reactive oxygene species)
to związki tlenu wykazujące większą reaktywność niż
tlen cząsteczkowy w stanie podstawowym (trypletowym).
W każdej żywej komórce, a więc i w plemnikach, niewielkie
ilości RFT powstają jako naturalne produkty
metabolizmu komórkowego. Ich ilość jest ściśle kontrolowana
przez mechanizmy antyoksydacyjne organizmu.
Wiele badań wykazało, że niskie, kontrolowane
(tzw. fi zjologiczne) poziomy RFT odgrywają istotną rolę
w prawidłowej czynności plemnika, biorąc udział w kluczowych
procesach gwarantujących zapłodnienie, takich
jak kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika czy też jego fuzja z oocytem (Agarwal i Saleh,
2002; Amaral i wsp., 2013; Chen i wsp., 2013; Frączek
i Kurpisz, 2013; Guerriero i wsp., 2014).
O stresie oksydacyjnym mówimy w sytuacji, gdy
komórki czy też tkanki narażone są na dodatkowe
źródła RFT, gdy zwiększa się tempo ich endogennej produkcji,
czy też dochodzi do niewydolności ochronnych
systemów antyoksydacyjnych. Jako cząsteczki bardzo
reaktywne, RFT szybko wchodzą w reakcje, w tym reakcje
łańcuchowe, i reagując z białkami, lipidami czy kwasami
nukleinowymi, indukują powstanie kolejnych produktów
wolnorodnikowych. Następstwem stresu oksydacyjnego
są uszkodzenia najważniejszych makromolekuł komórkowych
prowadzące do zaburzenia czynności komórki,
a w konsekwencji do jej śmierci (Aitken i wsp., 2010).
Reaktywne formy tlenu możemy podzielić na dwie
grupy: 1) wolne rodniki, mające jeden lub więcej niesparowanych
elektronów na orbicie zewnętrznej, oraz
2) cząsteczki powstające w wyniku metabolizmu tlenu,
niebędące jednak wolnymi rodnikami (tabela 1). Do głównych
i najbardziej rozpowszechnionych RFT należy anionorodnik
ponadtlenkowy (O₂•−, ang. superoxide radical),
który jest wyjściową (pierwotną) formą RFT. Z niego
powstają kolejne, znacznie bardziej reaktywne i toksyczne
dla komórki RFT. I tak, jego dalsza redukcja w procesie
Reaktywne formy tlenu możemy podzielić na dwie
grupy: 1) wolne rodniki, mające jeden lub więcej niesparowanych
elektronów na orbicie zewnętrznej, oraz
2) cząsteczki powstające w wyniku metabolizmu tlenu,
niebędące jednak wolnymi rodnikami (tabela 1). Do głównych
i najbardziej rozpowszechnionych RFT należy anionorodnik
ponadtlenkowy (O₂•−, ang. superoxide radical),
który jest wyjściową (pierwotną) formą RFT. Z niego
powstają kolejne, znacznie bardziej reaktywne i toksyczne
dla komórki RFT. I tak, jego dalsza redukcja w procesie
Reaktywne formy tlenu (RFT, ang. reactive oxygene species)
to związki tlenu wykazujące większą reaktywność niż
tlen cząsteczkowy w stanie podstawowym (trypletowym).
W każdej żywej komórce, a więc i w plemnikach, niewielkie
ilości RFT powstają jako naturalne produkty
metabolizmu komórkowego. Ich ilość jest ściśle kontrolowana
przez mechanizmy antyoksydacyjne organizmu.
Wiele badań wykazało, że niskie, kontrolowane
(tzw. fi zjologiczne) poziomy RFT odgrywają istotną rolę
w prawidłowej czynności plemnika, biorąc udział w kluczowych
procesach gwarantujących zapłodnienie, takich
jak kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika czy też jego fuzja z oocytem (Agarwal i Saleh,
2002; Amaral i wsp., 2013; Chen i wsp., 2013; Frączek
i Kurpisz, 2013; Guerriero i wsp., 2014).
O stresie oksydacyjnym mówimy w sytuacji, gdy
komórki czy też tkanki narażone są na dodatkowe
źródła RFT, gdy zwiększa się tempo ich endogennej produkcji,
czy też dochodzi do niewydolności ochronnych
systemów antyoksydacyjnych. Jako cząsteczki bardzo
reaktywne, RFT szybko wchodzą w reakcje, w tym reakcje
łańcuchowe, i reagując z białkami, lipidami czy kwasami
nukleinowymi, indukują powstanie kolejnych produktów
wolnorodnikowych. Następstwem stresu oksydacyjnego
są uszkodzenia najważniejszych makromolekuł komórkowych
prowadzące do zaburzenia czynności komórki,
a w konsekwencji do jej śmierci (Aitken i wsp., 2010).
Reaktywne formy tlenu możemy podzielić na dwie
grupy: 1) wolne rodniki, mające jeden lub więcej niesparowanych
elektronów na orbicie zewnętrznej, oraz
2) cząsteczki powstające w wyniku metabolizmu tlenu,
niebędące jednak wolnymi rodnikami (tabela 1). Do głównych
i najbardziej rozpowszechnionych RFT należy anionorodnik
ponadtlenkowy (O₂•−, ang. superoxide radical),
który jest wyjściową (pierwotną) formą RFT. Z niego
powstają kolejne, znacznie bardziej reaktywne i toksyczne
dla komórki RFT. I tak, jego dalsza redukcja w procesie
Przykłady reaktywnych for Tabela 1. m tlenu (RFT) i azotu (RFA)
Table 1. Examples of reactive oxygen (RFT) and nitrogen (RFA) species

enzymatycznym katalizowanym przez dysmutazę ponadtlenkową
powoduje powstanie nadtlenku wodoru (H₂O₂,
ang. hydrogen peroxide). Choć mało reaktywny, w przeciwieństwie
do anionorodnika ponadtlenkowego, dyfunduje
on łatwo przez błony komórkowe i w obecności
metali przejściowych takich jak żelazo czy miedź może
ulec przemianie do rodnika hydroksylowego (OH•, ang.
hydroxyl radical). Rodnik hydroksylowy charakteryzuje się
bardzo dużą reaktywnością i natychmiast po powstaniu
reaguje z sąsiadującymi cząsteczkami, niezależnie od tego,
czy są to białka, fragmenty DNA czy inne makromolekuły
komórkowe. Innymi rodnikami powstającymi bezpośrednio
w reakcjach z anionorodnikiem ponadtlenkowym
są chociażby rodnik wodoronadtlenkowy (HO₂•,
ang. hydroperoxyl radical) czy nadtlenoazotyn (ONOO−,
ang. peroxynitrite), który jest wysoce reaktywną formą
azotu. Do RFT należy także tlen singletowy (¹O₂, ang.
singlet oxygen), powstający w wyniku wzbudzenia cząsteczek
tlenu, ozon (O₃, ang. ozone), będący odmianą alotropową
tlenu, czy też związki tworzące się w reakcjach
metabolicznych komórki, np. kwas podchlorawy (HOCl,
ang. hypochloric acid) czy kwas nadtlenoazotawy (ONOOH,
ang. peroxynitrous acid), oraz wolne rodniki azotowe, takie
jak tlenek azotu (NO•, ang. nitric oxide) czy dwutlenek
azotu (NO₂•, ang. nitrogen dioxide). Dodatkowo, reakcje
RFT ze związkami organicznymi prowadzą do powstawania
wolnych rodników substancji organicznych, np.
rodnika peroksylowego (RO₂•, ang. peroxyl radical) czy
alkoksylowego – RO•, ang. alkoxyl radical (Agarwal i wsp.,
2003; Frączek i Kurpisz, 2005; Ługowski i wsp., 2011;
Puzanowska -Tarasiewicz i wsp., 2008).tabela 2). Czynniki obu systemów ściśle współdziałają
ze sobą w celu zapewnienia optymalnej ochrony przed
RFT i wydaje się, że niedobór jednego z nich może powodować
obniżenie całkowitego potencjału antyoksydacyjnego
organizmu.
Tabela 2. Przykłady enzymatycznych i nieenzymatycznych
antyoksydantów w plemnikach i plazmie nasienia
Table 2. Examples of enzymatic and non -enzymatic
antioxidants occurred in spermatozoa and seminal plasma

Tabela 2. Przykłady enzymatycznych i nieenzymatycznych
antyoksydantów w plemnikach i plazmie nasienia
Table 2. Examples of enzymatic and non -enzymatic
antioxidants occurred in spermatozoa and seminal plasma
Podstawowym antyoksydacyjnym systemem enzymatycznym
w nasieniu jest tzw. triada enzymatyczna,
do której zaliczamy dysmutazy ponadtlenkowe, katalazę
oraz peroksydazę glutationową. Dysmutazy ponadtlenkowe
(SOD, ang. superoxide dismutase) są metaloenzymami
katalizującymi reakcję dysmutacji anionorodnika ponadtlenkowego
do nadtlenku wodoru. W swoim centrum
aktywnym, w zależności od typu, mają miedź, cynk lub
mangan. Katalaza (KT, ang. catalase) jest selenoproteiną
i katalizuje reakcję dysproporcjonowania nadtlenku
wodoru prowadzącą do powstania tlenu cząsteczkowego
i wody. Kolejnym enzymem systemu antyoksydacyjnego
w nasieniu jest peroksydaza glutationowa (GPX, ang. glutathione
peroxidase), która katalizuje reakcję redukcji nadtlenku
wodoru oraz nadtlenków organicznych, w tym
nadtlenków fosfolipidów (Frączek i Kurpisz, 2005; Gałecka
i wsp., 2008; Walczak -Jędrzejowska i wsp., 2013). Reakcja
z udziałem GPX wymaga obecności zredukowanej formy glutationu, który sam jest też ważnym antyoksydantem.
Jego regeneracja zachodzi w wyniku enzymatycznej
redukcji utlenionego glutationu, reakcji katalizowanej
przez reduktazę glutationową (GR, ang. glutathione
reductase). Oprócz enzymów neutralizujących nadprodukcję
RFT istotną rolę w antyoksydacyjnym systemie
ochronnym odgrywają tzw. niskocząsteczkowe, nieenzymatyczne
antyoksydanty, które wspomagają aktywność
ww. enzymów. W nasieniu zidentyfi kowano obecność
m.in. witaminy C (Colagar i Marzony, 2009; Th iele i wsp.,
1995), witaminy E (Kutlubay i wsp., 2007), kwasu moczowego
(Xu i wsp., 2004; Zhang i wsp., 2007), pirogronianu
(Webb i Arns, 2006), glutationu (Giannattasio i wsp., 2002;
Lenzi i wsp., 1993), tauryny i hipotauryny (Alvarez i Storey,
1983) czy latoferyny (Tomar i wsp., 2011). Inne znane
antyoksydanty niskocząsteczkowe to cysteina, homocysteina,
koenzym Q10, witamina A, karoten, witaminy
z grupy B, fl awonoidy, mikroelementy takie jak cynk,
selen czy miedź (Aprioku, 2013; Colagar i wsp., 2009;
Frączek i Kurpisz, 2005; Walczak -Jędrzejowska i wsp., 2013).
Komórkowe źródła reaktywnych form
tlenu w nasieniu
W ejakulacie oprócz plemników znajdują się także inne
elementy komórkowe, takie jak komórki plemnikotwórcze
wcześniejszych etapów spermatogenezy, leukocyty czy
komórki nabłonkowe. Za główne endogenne, komórkowe
źródło wytwarzania RFT uważa się leukocyty, głównie
neutrofi le i makrofagi, oraz plemniki o nieprawidłowej
budowie.
Jednym z miejsc powstawania RFT w plemnikach jest
mitochondrialny łańcuch oddechowy i zachodzący tam
proces fosforylacji oksydacyjnej. Przepływ elektronów
przez składowe łańcucha oddechowego nie jest szczelny
i część elektronów „wycieka”, redukując cząsteczkę tlenu
do anionorodnika ponadtlenkowego, w wyniku procesu
jednoelektronowego, przy udziale głównie oksydoreduktazy
NADH (ang. NADH oxidoreductase), a także koenzymu
Q – ang. coenzyme Q (Potargowicz i wsp., 2005).
Mechanizm ten wydaje się być głównym źródłem RFT
w warunkach równowagi oksydoredukcyjnej w plemnikach
prawidłowych (Aitken i De Iuliis, 2010), jak i przy nadprodukcji
RFT w plemnikach o nieprawidłowej budowie,
w których dochodzi do zwiększonego „wycieku” elektronów
z łańcucha oddechowego (Koppers i wsp., 2008),
prawdopodobnie w wyniku dysfunkcji samych mitochondriów
(Wang i wsp., 2003). Dysfunkcja mitochondriów
może być spowodowana wpływem już istniejącego stresu
oksydacyjnego, który powoduje uszkodzenie błony mitochondriów,
tym samym przyczyniając się do wzrostu
wytwarzania w nich RFT. Zaobserwowano korelacje
między wytwarzaniem nadmiaru RFT w mitochondriach
a spadkiem ruchliwości plemników i wzrostem
peroksydacji lipidów na terenie wstawki (Aitken i wsp.,
2014; Evenson i wsp., 1982).
Drugim miejscem, w którym mogą być wytwarzane
RFT w plemniku, jest błona komórkowa, gdzie powstają
one głównie w wyniku działania zależnej od jonów wapnia
oksydazy NADPH – powstaje anionorodnik ponadtlenkowy
oraz syntazy tlenku azotu – powstaje tlenek azotu
(Frączek i Kurpisz, 2013). Oksydazy NADPH są kompleksami
enzymatycznymi¹, których budowa i funkcja oparte
są na białkach NOX (ang. NADPH oxidase), będących
podjednostkami katalitycznymi kompleksów aktywnych.
Do tej pory wykryto kilka ich typów (NOX1, NOX2,
NOX3, NOX4, NOX5). Ostatnie badania nad wytwarzaniem
anionorodnika ponadtlenkowego wykazały,
że w plemnikach obecna jest zależna od jonów wapnia
NOX5 (Musset i wsp., 2012). W warunkach prawidłowych
w dojrzałym plemniku pozbawionym znacznej części
przestrzeni cytoplazmatycznej następuje wytwarzanie,
głównie w mitochondriach, stałych, kontrolowanych
przez systemy antyoksydacyjne ilości RFT niezbędnych
do indukcji procesów przygotowujących plemnik
do zapłodnienia komórki jajowej. Jednakże w uszkodzonych
plemnikach (tzw. niedojrzałych), w których występuje
nadmiar resztkowej cytoplazmy (ERC, ang. excess
residual cytoplasm), następuje wzrost wytwarzania RFT
jako wynik zwiększonej ilości/aktywności enzymów
występujących w cytoplazmie, takich jak dehydrogenaza
glukozo -6 -fosforanowa (G6PDH, ang. glucose -6 -phosphate
dehydrogenase) czy SOD. Z wykorzystaniem szlaku pentozofosforanowego,
G6PDH produkuje zwiększone ilości
NADPH, którego większa dostępność w konsekwencji prowadzi
do zwiększonego wytwarzania RFT (anionorodnika
ponadtlenkowego) przez NOX5 w błonie komórkowej
plemnika (Rengan i wsp., 2012). Anionorodnik ponadtlenkowy
jest następnie przekształcany do nadtlenku
wodoru przez SOD. Nadtlenek wodoru, jak już wspomniano
wcześniej, może zostać przekształcony do najbardziej
reaktywnej formy RFT, czyli rodnika hydroksylowego.
Kiedy zwiększa się ilość RFT, tak jak to ma miejsce
w przypadku plemników z ERC, systemy antyoksydacyjne
plemnika nie są w stanie zneutralizować ich nadmiaru.
Dodatkowo, RFT produkowane przez plemniki o nieprawidłowej
budowie mogą powodować uszkodzenia oksydacyjne
także w plemnikach prawidłowych podczas ich
transportu z kanalików plemnikotwórczych do najądrza
(Gil -Guzman i wsp., 2001; Ollero i wsp., 2001).
W plemnikach, ale przede wszystkim w nasieniu,
obecna jest także oksydaza ksantynowa, która bierze
udział w przemianach metabolicznych zasad purynowych.
Katalizuje ona między innymi reakcję utleniania hipoksantyny
do ksantyny, a następnie ksantyny do kwasu
moczowego. Jej aktywność jest związana z wytwarzaniem
1 Oksydazy zależne od NADPH należące do rodziny oksydaz NOX (ang.
NOX oxidase family) zbudowane są z 6 hydrofobowych transbłonowych
α -heliks (NOX). Domena transbłonowa zawiera dwie grupy hemowe stanowiące
nośnik dla elektronów, z kolei domena cytoplazmatyczna (−COOH)
wiąże dinukleotyd fl awinoadeninowy (FAD) oraz fosforan dinukleotydu
niktynoamidoadeninowego (NADPH). W zależności od izoformy oksydazy
domena cytoplazmatyczna (−NH₂) wiąże m.in. białka regulatorowe
i stabilizujące oraz zawiera domenę wiążącą wapń (przyp. red.). anionorodnika ponadtlenkowego i w konsekwencji nadtlenku
wodoru w nasieniu. U niepłodnych mężczyzn
zaobserwowano wzrost aktywności tego enzymu (Kurpisz
i wsp., 1996; Frączek i Kurpisz, 2005).
W nasieniu leukocyty, przede wszystkim granulocyty,
stanowiące 50–60% wszystkich leukocytów, oraz
makrofagi stanowiące 20–30%, pochodzą głównie z prostaty
lub pęcherzyków nasiennych (Saleh i wsp., 2003).
W momencie aktywacji, przy zakażeniach i stanach zapalnych,
mogą one wytwarzać ponad 100 razy więcej RFT
niż w warunkach prawidłowych i zwiększać produkcję
NADPH z wykorzystaniem szlaku pentozofosforanowego
(Agarwal i wsp., 2003; Lavranos i wsp., 2012). Istnieje silna
korelacja między występowaniem stresu oksydacyjnego
w nasieniu a obecnością zwiększonej liczby leukocytów
(Alvarez i wsp., 2002; Henkel i wsp., 2005; Sharma i wsp.,
2001). Wzrost liczby leukocytów w nasieniu związany
jest także z zaburzeniami parametrów nasienia lub obniżeniem
potencjału zapładniającego plemników (Alvarez
i wsp., 2002; Vogelpoel i wsp., 1991; Wolff i wsp., 1990).
Czynniki wywołujące stres oksydacyjny
Do stresu oksydacyjnego dochodzi w momencie, gdy
zachwiana zostaje równowaga między wytwarzaniem
RFT a ich neutralizacją przez systemy antyoksydacyjne
organizmu. Może to mieć miejsce w momencie zwiększenia
wytwarzania ilości RFT przez czynniki zarówno
endogenne, jak i egzogenne i/lub niewydolności systemów
antyoksydacyjnych.
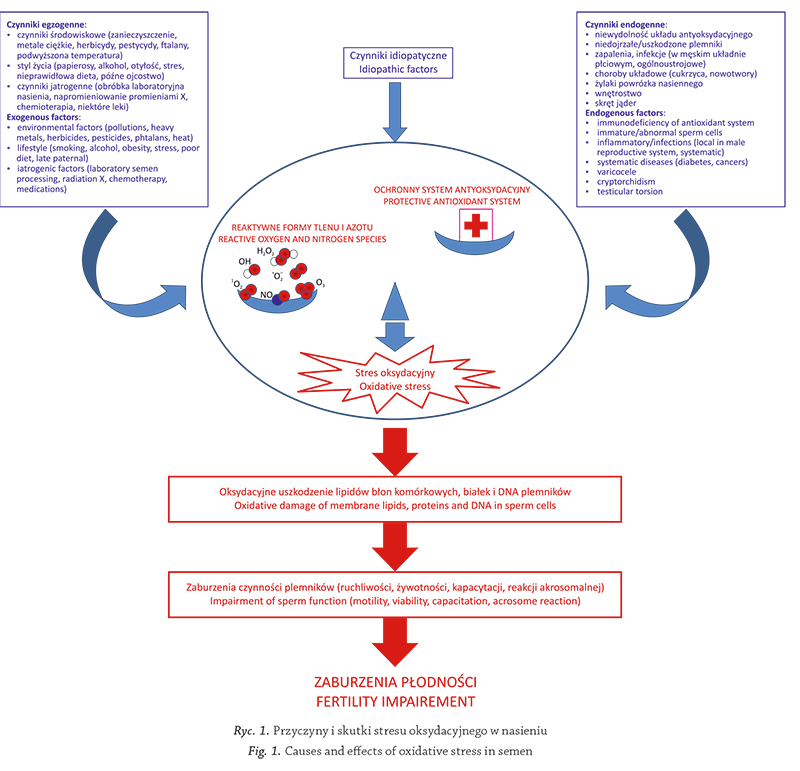
Czynniki wywołujące stres oksydacyjny możemy
podzielić na dwie grupy: 1) egzogenne, do których zaliczymy
m.in. styl życia, czynniki środowiskowe czy czynniki
jatrogenne, oraz 2) czynniki endogenne, do których
zaliczamy m.in. żylaki powrózków nasiennych, wnętrostwo,
skręt jądra czy też zapalenia i zakażenia w męskim
układzie płciowym, choroby ogólnoustrojowe oraz czynniki
idiopatyczne (Agarwal i wsp., 2014; Frączek i Kurpisz,
2013; Tremellen, 2008) (rycina 1).
Wśród czynników związanych ze stylem życia wywołujących
stres oksydacyjny w nasieniu przede wszystkim
Przyczyny i skutki stresu Ryc. 1. oksydacyjnego w nasieniu
Fig. 1. Causes and eff ects of oxidative stress in semen
 wymienić należy palenie papierosów. Toksyny z dymu
papierosowego przedostają się do układu płciowego
i reagują ze składnikami plazmy nasienia (Kulikauskas
i wsp., 1985; Pacifi ci i wsp., 1993; Sepaniak i wsp., 2004;
Trummer i wsp., 2002). Wykazano, że u palaczy występuje
wzrost poziomu RFT, liczby leukocytów oraz komórek
okrągłych w nasieniu, obniżenie ruchliwości i żywotności
plemników i wzrost nasilenia fragmentacji DNA
(Ochędalski i wsp., 1994; Pacifi ci i wsp., 1993; Saleh i wsp.,
2002; Sepaniak i wsp., 2004; Taha i wsp., 2012). Dodatkowo
w nasieniu palaczy obniżony jest poziom takich antyoksydantów
jak witamina E, C oraz cynk, co wzmaga ryzyko
uszkodzeń oksydacyjnych plemników (Fraga i wsp., 1996;
Mostafa i wsp., 2006; Taha i wsp., 2012).
Kolejnym czynnikiem zwiększającym poziom RFT
jest konsumpcja alkoholu. Ponadto wykazano, że nadużywanie
alkoholu często związane jest z niedożywieniem
i dietą ubogą w antyoksydanty (Koch i wsp.,
2004). Z kolei nieprawidłowa dieta, bogata w tłuszcze
i węglowodany oraz siedzący tryb życia mogą prowadzić
do otyłości. Nagromadzenie tkanki tłuszczowej
może powodować uwalnianie z niej cytokin prozapalnych
i wzrost wytwarzania RFT w leukocytach.
Dodatkowo, otyłość doprowadza także do przegrzewania
jąder w wyniku nagromadzenia tkanki tłuszczowej
w regionie pachwin (Khullar i wsp., 2012; Palmer
i wsp., 2012; Singer i Granger, 2007). Z drugiej strony
zbyt intensywne ćwiczenia fi zyczne powodują wzrost
RFT w wyniku zwiększonego metabolizmu tlenowego
w mięśniach (Peake i wsp., 2007). Hipoteza stresu oksydacyjnego
związanego ze starzeniem się organizmu jest
jedną z najbardziej popularnych hipotez wyjaśniających
molekularne podstawy tego procesu (Olinski i wsp., 2007).
Siomek i wsp. (2007) zaobserwowali np. dodatnią korelacje
występującą między wiekiem a poziomem markerów
oksydacyjnego uszkodzenia DNA badanych w leukocytach
krwi obwodowej, a także zależny od wieku spadek
poziomu witaminy C we krwi. Dodatkowo, wykazano
istnienie bezpośredniego związku między ogólnoustrojowym
stresem oksydacyjnym występującym w procesie
starzenia się organizmu a wzrostem uszkodzeń DNA
w plemnikach zarówno u mężczyzn płodnych, jak i niepłodnych
(Junqueira i wsp., 2004). Udokumentowano
także wzrost zaburzeń genetycznych u dzieci starszych
ojców, w wyniku pogarszania się jakości DNA plemników,
czego podłożem może być właśnie zwiększona produkcja
RFT, a zarazem obniżona zdolność antyoksydacyjna
organizmu (Crosnoe i Kim, 2013; Paul i Robaire, 2013).
Jednakże, o ile z jednej strony ogólnoustrojowy stres
oksydacyjny, związany np. ze starzeniem się organizmu,
może wpływać na uszkodzenia DNA w plemnikach,
to z drugiej strony Guz i wsp. (2013) nie znaleźli związku
między istniejącym stresem oksydacyjnym w nasieniu
niepłodnych mężczyzn a tym badanym w leukocytach
krwi obwodowej (tzn. ogólnoustrojowym), co sugeruje,
że stan oksydoredukcyjny nasienia może występować
niezależnie od tego w innych tkankach.
Kolejny czynnik środowiskowy związany ze stylem
życia, którego wpływ na męską płodność jest ostatnio
intensywnie badany, to promieniowanie elektromagnetyczne
o częstotliwości radiowej (RF -ERM, ang. radiofrequency
electromagnetic radiation) emitowane głównie przez
telefony komórkowe. Istnieje wiele doniesień wskazujących
na obniżenie parametrów badania nasienia, głównie
ruchliwości plemników, oraz wzrost uszkodzeń zarówno
jądrowego, jak i mitochondrialnego DNA, prawdopodobnie
w wyniku stresu oksydacyjnego będącego konsekwencją
ekspozycji na RF -ERM (Agarwal i wsp., 2009;
De Iuliis i wsp., 2009; Mailankot i wsp., 2009). W jednym
z pierwszych badań klinicznych wykazano, że w nasieniu
mężczyzn noszących telefony komórkowe w kieszeni
spodni lub przypięte do paska od spodni występuje obniżenie
koncentracji plemników w porównaniu z mężczyznami,
którzy w ogóle nie nosili telefonu lub trzymali go
w innym miejscu (Kilgallon i Simmons, 2005). W kolejnych
badaniach wykazano, że zarówno okres posiadania telefonu
komórkowego, jak i dzienny, średni czas prowadzonych
rozmów czy transmisji danych powoduje spadek
liczby plemników, odsetka plemników żywych i wykazujących
ruch postępowy oraz wzrost częstości występowania
plemników o nieprawidłowej budowie (Agarwal
i wsp., 2008; Fejes i wsp., 2005; Gorpinchenko i wsp., 2014;
Wdowiak i wsp., 2007). Ostatnio przeprowadzona metaanaliza
10 publikacji dotyczących badań (in vivo i in vitro)
nad wpływem RF -ERM na plemniki i męską płodność
wskazuje, że telefony komórkowe wpływają ujemnie
na jakość nasienia (Adams i wsp., 2014).
Ftalany, stosowane powszechnie jako środki zmiękczające
(tzw. plastyfi katory) w przemyśle chemicznym
i w produkcji tworzyw sztucznych, także są czynnikiem
wywołującym stres oksydacyjny na poziomie jądra, prowadząc
do zaburzenia procesu spermatogenezy, zwiększenia
częstości uszkodzeń DNA komórek płciowych,
a w konsekwencji obniżenia jakości nasienia (Duty i wsp.,
2003a; Duty i wsp., 2003b; Hauser i wsp., 2007; Jurewicz
i wsp., 2013; Kasahara i wsp., 2002). Udokumentowano
także uszkodzenia oksydacyjne plemników wywołane
przez pestycydy oraz metale ciężkie – głównie kadm,
ołów (Chitra i wsp., 2001; Hsu i Guo, 2002; Sujatha i wsp.,
2001; Taha i wsp., 2013; Xu i wsp., 2003).
Podawanie cyklofosfamidu, leku cytostatycznego,
powoduje spadek poziomu katalazy (Sanocka i wsp.,
1997; Zini i wsp., 2000) oraz wzrost poziomu dialdehydu
malonowego (MDA, ang. malondialdehyde), wskazując
na peroksydacyjne uszkodzenie lipidów błon komórkowych
(Das i wsp., 2002; Ghosh i wsp., 2002). Z kolei używanie
tak powszechnych leków jak aspiryna czy paracetamol
powoduje zwiększenie aktywności cytochromu
P450, skutkujące wzrostem produkcji wolnych rodników
(Agarwal i Said, 2005). Zwiększenie wytwarzania RFT
może wystąpić także in vitro podczas procedur przygotowywania
plemników do technik wspomaganego
rozrodu, przede wszystkim w wyniku oczyszczania plemników
z plazmy nasienia, tym samym pozbawiania ich
naturalnego środowiska antyoksydacyjnego (Tremellen,
2008). Oprócz tego wirowanie, krioprezerwacja i późniejsze
rozmrażanie plemników oraz niska zawartość
antyoksydantów w mediach zabezpieczających plemniki
mogą generować w nich stres oksydacyjny (Agarwal i wsp.,
2006; Olszewska -Słonina, 2013; Sikka, 2004; Walczak -
-Jędrzejowska i wsp., 2013; Watson, 2000).
Nadmiar wytwarzania RFT spowodowany jest także
zakażeniami i stanami zapalnymi w męskim układzie
płciowym. Zakażenie patogenami wywołuje naturalne
mechanizmy obronne, tzw. „wybuch tlenowy”, czyli nagłe
uwolnienie dużych ilości RFT przez leukocyty i makrofagi
– głównie anionorodnika ponadtlenkowego i nadtlenku
wodoru (Frączek i Kurpisz, 2007; Kovalski i wsp.,
1992; Roos, 1991). U pacjentów z pozytywnym wynikiem
posiewu nasienia na bakterie tlenowe wykazano znaczny
wzrost poziomu anionorodnika ponadtlenkowego
w porównaniu z pacjentami zdrowymi (Mazzilli i wsp.,
1994). W modelu in vitro stanu zapalnego w nasieniu
wykazano, że szczepy takich bakterii jak Escherichia coli,
Staphylococcus haemolyticus i Bacteroides ureolyticus i/lub
obecność leukocytów powodują zaburzenie ruchliwości
plemników oraz peroksydacyjne uszkodzenie ich błony
komórkowej (Frączek i wsp., 2007; Frączek i wsp., 2014).
Także zakażenie chlamydiami czy też infekcje wirusowe
(np. herpes simplex virus) związane są ze wzrostem
uszkodzeń oksydacyjnych plemników (Krause i Bohring,
2003; Krause i wsp., 2003; Segnini i wsp., 2003). Wysoki
poziom uszkodzeń oksydacyjnych plemników został
także potwierdzony u mężczyzn ze zwiększoną skłonnością
do zakażeń układu moczowo -płciowego z powodu
np. paraliżu kończyn dolnych (Brackett i wsp., 2008).
Z kolei w przebiegu przewlekłego, niebakteryjnego zapalenia
prostaty obserwuje się wzrost poziomu prozapalnych
cytokin i aktywację produkcji RFT (Batstone i wsp.,
2002; Motrich i wsp., 2005). Sanocka i wsp. (2003) wykazali,
że prozapalne cytokiny takie jak interleukina 1β
(IL -1β, ang. interleukin 1β), interleukina 6 i 8 (IL -6, IL -8)
i czynnik martwicy nowotworów α (TNF -α, ang. tumor
necrosis factor α) mogą modulować aktywność pro - i antyoksydacyjną
w przebiegu zapalenia dróg wyprowadzających
nasienie. Wyniki badań in vitro sugerują, że podczas
procesu zapalnego cytokiny wzmagają poziom stresu
oksydacyjnego generowanego przez leukocyty, co może
mieć poważne konsekwencje dla integralności błony
komórkowej plemnika (Frączek i wsp., 2008). Wzrost
ilości leukocytów, prozapalnych cytokin i produkcji RFT
w nasieniu był obserwowany np. po operacji rekonstrukcyjnej
dróg wyprowadzających nasienie po wazektomii
(Kolettis i wsp., 1999; Shapiro i wsp., 1998). Wykazano
także, że u pacjentów z żylakami powrózków nasiennych
istnieje ścisły związek między wzrostem poziomu
RFT i uszkodzeniami DNA plemników (Smith i wsp.,
2006). Dodatkowo wzrost poziomu RFT w nasieniu
i uszkodzeń DNA plemników zaobserwowano także
przy skręcie jąder czy wnętrostwie, przy czym w tym
ostatnim przypadku nieprawidłowości te utrzymywały
się nawet po operacyjnym sprowadzeniu jąder do moszny
(Filho i wsp., 2004; Smith i wsp., 2007).
Niskie tzw. fi zjologiczne poziomy RFT w nasieniu,
których produkcja znajduje się pod stałą kontrolą występujących
tam systemów antyoksydacyjnych, odgrywają
istotną rolę w prawidłowej czynności plemnika, biorąc
udział w kluczowych procesach gwarantujących zapłodnienie
(tj. kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika, fuzja plemnika z oocytem). Jednakże,
jakiekolwiek zaburzenie istniejącej równowagi oksydoredukcyjnej
skutkuje wystąpieniem stresu oksydacyjnego.
W ciągu ostatnich 25 lat pojawiło się wiele prac
doświadczalnych i klinicznych na temat patofi zjologii
stresu oksydacyjnego i jego wpływu na męską płodność.
Nie ma obecnie wątpliwości, że stres oksydacyjny zaburza
czynność plemników, ograniczając tym samym szansę
na uzyskanie zapłodnienia komórki jajowej i/lub rozwój
zarodka. Istnieje wiele czynników wywołujących stres
oksydacyjny w nasieniu. Wśród nich są czynniki egzogenne
związane np. ze stylem życia (palenie, alkohol,
otyłość, niezdrowa dieta), na które mężczyzna ma wpływ
i poprzez zmianę swojego stylu życia może je w łatwy
sposób wyeliminować. Niestety możliwości zmiany
innych czynników egzogennych, tj. zanieczyszczenie środowiska
czy ekspozycja na ftalany, często pozostają poza
naszym zasięgiem. Z kolei czynniki endogenne związane
m.in. z zaburzeniami układu płciowego czy też stanami
zapalnymi w nim występującymi oraz tzw. niepłodność
idiopatyczna wymagają interwencji medycznej. Chociażby
w tych dwóch ostatnich przypadkach zasadnym wydaje
się pytanie o możliwość wspomagania leczenia niepłodności
męskiej, u podłoża której leży stres oksydacyjny,
substancjami o udokumentowanym działaniu antyoksydacyjnym.
wymienić należy palenie papierosów. Toksyny z dymu
papierosowego przedostają się do układu płciowego
i reagują ze składnikami plazmy nasienia (Kulikauskas
i wsp., 1985; Pacifi ci i wsp., 1993; Sepaniak i wsp., 2004;
Trummer i wsp., 2002). Wykazano, że u palaczy występuje
wzrost poziomu RFT, liczby leukocytów oraz komórek
okrągłych w nasieniu, obniżenie ruchliwości i żywotności
plemników i wzrost nasilenia fragmentacji DNA
(Ochędalski i wsp., 1994; Pacifi ci i wsp., 1993; Saleh i wsp.,
2002; Sepaniak i wsp., 2004; Taha i wsp., 2012). Dodatkowo
w nasieniu palaczy obniżony jest poziom takich antyoksydantów
jak witamina E, C oraz cynk, co wzmaga ryzyko
uszkodzeń oksydacyjnych plemników (Fraga i wsp., 1996;
Mostafa i wsp., 2006; Taha i wsp., 2012).
Kolejnym czynnikiem zwiększającym poziom RFT
jest konsumpcja alkoholu. Ponadto wykazano, że nadużywanie
alkoholu często związane jest z niedożywieniem
i dietą ubogą w antyoksydanty (Koch i wsp.,
2004). Z kolei nieprawidłowa dieta, bogata w tłuszcze
i węglowodany oraz siedzący tryb życia mogą prowadzić
do otyłości. Nagromadzenie tkanki tłuszczowej
może powodować uwalnianie z niej cytokin prozapalnych
i wzrost wytwarzania RFT w leukocytach.
Dodatkowo, otyłość doprowadza także do przegrzewania
jąder w wyniku nagromadzenia tkanki tłuszczowej
w regionie pachwin (Khullar i wsp., 2012; Palmer
i wsp., 2012; Singer i Granger, 2007). Z drugiej strony
zbyt intensywne ćwiczenia fi zyczne powodują wzrost
RFT w wyniku zwiększonego metabolizmu tlenowego
w mięśniach (Peake i wsp., 2007). Hipoteza stresu oksydacyjnego
związanego ze starzeniem się organizmu jest
jedną z najbardziej popularnych hipotez wyjaśniających
molekularne podstawy tego procesu (Olinski i wsp., 2007).
Siomek i wsp. (2007) zaobserwowali np. dodatnią korelacje
występującą między wiekiem a poziomem markerów
oksydacyjnego uszkodzenia DNA badanych w leukocytach
krwi obwodowej, a także zależny od wieku spadek
poziomu witaminy C we krwi. Dodatkowo, wykazano
istnienie bezpośredniego związku między ogólnoustrojowym
stresem oksydacyjnym występującym w procesie
starzenia się organizmu a wzrostem uszkodzeń DNA
w plemnikach zarówno u mężczyzn płodnych, jak i niepłodnych
(Junqueira i wsp., 2004). Udokumentowano
także wzrost zaburzeń genetycznych u dzieci starszych
ojców, w wyniku pogarszania się jakości DNA plemników,
czego podłożem może być właśnie zwiększona produkcja
RFT, a zarazem obniżona zdolność antyoksydacyjna
organizmu (Crosnoe i Kim, 2013; Paul i Robaire, 2013).
Jednakże, o ile z jednej strony ogólnoustrojowy stres
oksydacyjny, związany np. ze starzeniem się organizmu,
może wpływać na uszkodzenia DNA w plemnikach,
to z drugiej strony Guz i wsp. (2013) nie znaleźli związku
między istniejącym stresem oksydacyjnym w nasieniu
niepłodnych mężczyzn a tym badanym w leukocytach
krwi obwodowej (tzn. ogólnoustrojowym), co sugeruje,
że stan oksydoredukcyjny nasienia może występować
niezależnie od tego w innych tkankach.
Kolejny czynnik środowiskowy związany ze stylem
życia, którego wpływ na męską płodność jest ostatnio
intensywnie badany, to promieniowanie elektromagnetyczne
o częstotliwości radiowej (RF -ERM, ang. radiofrequency
electromagnetic radiation) emitowane głównie przez
telefony komórkowe. Istnieje wiele doniesień wskazujących
na obniżenie parametrów badania nasienia, głównie
ruchliwości plemników, oraz wzrost uszkodzeń zarówno
jądrowego, jak i mitochondrialnego DNA, prawdopodobnie
w wyniku stresu oksydacyjnego będącego konsekwencją
ekspozycji na RF -ERM (Agarwal i wsp., 2009;
De Iuliis i wsp., 2009; Mailankot i wsp., 2009). W jednym
z pierwszych badań klinicznych wykazano, że w nasieniu
mężczyzn noszących telefony komórkowe w kieszeni
spodni lub przypięte do paska od spodni występuje obniżenie
koncentracji plemników w porównaniu z mężczyznami,
którzy w ogóle nie nosili telefonu lub trzymali go
w innym miejscu (Kilgallon i Simmons, 2005). W kolejnych
badaniach wykazano, że zarówno okres posiadania telefonu
komórkowego, jak i dzienny, średni czas prowadzonych
rozmów czy transmisji danych powoduje spadek
liczby plemników, odsetka plemników żywych i wykazujących
ruch postępowy oraz wzrost częstości występowania
plemników o nieprawidłowej budowie (Agarwal
i wsp., 2008; Fejes i wsp., 2005; Gorpinchenko i wsp., 2014;
Wdowiak i wsp., 2007). Ostatnio przeprowadzona metaanaliza
10 publikacji dotyczących badań (in vivo i in vitro)
nad wpływem RF -ERM na plemniki i męską płodność
wskazuje, że telefony komórkowe wpływają ujemnie
na jakość nasienia (Adams i wsp., 2014).
Ftalany, stosowane powszechnie jako środki zmiękczające
(tzw. plastyfi katory) w przemyśle chemicznym
i w produkcji tworzyw sztucznych, także są czynnikiem
wywołującym stres oksydacyjny na poziomie jądra, prowadząc
do zaburzenia procesu spermatogenezy, zwiększenia
częstości uszkodzeń DNA komórek płciowych,
a w konsekwencji obniżenia jakości nasienia (Duty i wsp.,
2003a; Duty i wsp., 2003b; Hauser i wsp., 2007; Jurewicz
i wsp., 2013; Kasahara i wsp., 2002). Udokumentowano
także uszkodzenia oksydacyjne plemników wywołane
przez pestycydy oraz metale ciężkie – głównie kadm,
ołów (Chitra i wsp., 2001; Hsu i Guo, 2002; Sujatha i wsp.,
2001; Taha i wsp., 2013; Xu i wsp., 2003).
Podawanie cyklofosfamidu, leku cytostatycznego,
powoduje spadek poziomu katalazy (Sanocka i wsp.,
1997; Zini i wsp., 2000) oraz wzrost poziomu dialdehydu
malonowego (MDA, ang. malondialdehyde), wskazując
na peroksydacyjne uszkodzenie lipidów błon komórkowych
(Das i wsp., 2002; Ghosh i wsp., 2002). Z kolei używanie
tak powszechnych leków jak aspiryna czy paracetamol
powoduje zwiększenie aktywności cytochromu
P450, skutkujące wzrostem produkcji wolnych rodników
(Agarwal i Said, 2005). Zwiększenie wytwarzania RFT
może wystąpić także in vitro podczas procedur przygotowywania
plemników do technik wspomaganego
rozrodu, przede wszystkim w wyniku oczyszczania plemników
z plazmy nasienia, tym samym pozbawiania ich
naturalnego środowiska antyoksydacyjnego (Tremellen,
2008). Oprócz tego wirowanie, krioprezerwacja i późniejsze
rozmrażanie plemników oraz niska zawartość
antyoksydantów w mediach zabezpieczających plemniki
mogą generować w nich stres oksydacyjny (Agarwal i wsp.,
2006; Olszewska -Słonina, 2013; Sikka, 2004; Walczak -
-Jędrzejowska i wsp., 2013; Watson, 2000).
Nadmiar wytwarzania RFT spowodowany jest także
zakażeniami i stanami zapalnymi w męskim układzie
płciowym. Zakażenie patogenami wywołuje naturalne
mechanizmy obronne, tzw. „wybuch tlenowy”, czyli nagłe
uwolnienie dużych ilości RFT przez leukocyty i makrofagi
– głównie anionorodnika ponadtlenkowego i nadtlenku
wodoru (Frączek i Kurpisz, 2007; Kovalski i wsp.,
1992; Roos, 1991). U pacjentów z pozytywnym wynikiem
posiewu nasienia na bakterie tlenowe wykazano znaczny
wzrost poziomu anionorodnika ponadtlenkowego
w porównaniu z pacjentami zdrowymi (Mazzilli i wsp.,
1994). W modelu in vitro stanu zapalnego w nasieniu
wykazano, że szczepy takich bakterii jak Escherichia coli,
Staphylococcus haemolyticus i Bacteroides ureolyticus i/lub
obecność leukocytów powodują zaburzenie ruchliwości
plemników oraz peroksydacyjne uszkodzenie ich błony
komórkowej (Frączek i wsp., 2007; Frączek i wsp., 2014).
Także zakażenie chlamydiami czy też infekcje wirusowe
(np. herpes simplex virus) związane są ze wzrostem
uszkodzeń oksydacyjnych plemników (Krause i Bohring,
2003; Krause i wsp., 2003; Segnini i wsp., 2003). Wysoki
poziom uszkodzeń oksydacyjnych plemników został
także potwierdzony u mężczyzn ze zwiększoną skłonnością
do zakażeń układu moczowo -płciowego z powodu
np. paraliżu kończyn dolnych (Brackett i wsp., 2008).
Z kolei w przebiegu przewlekłego, niebakteryjnego zapalenia
prostaty obserwuje się wzrost poziomu prozapalnych
cytokin i aktywację produkcji RFT (Batstone i wsp.,
2002; Motrich i wsp., 2005). Sanocka i wsp. (2003) wykazali,
że prozapalne cytokiny takie jak interleukina 1β
(IL -1β, ang. interleukin 1β), interleukina 6 i 8 (IL -6, IL -8)
i czynnik martwicy nowotworów α (TNF -α, ang. tumor
necrosis factor α) mogą modulować aktywność pro - i antyoksydacyjną
w przebiegu zapalenia dróg wyprowadzających
nasienie. Wyniki badań in vitro sugerują, że podczas
procesu zapalnego cytokiny wzmagają poziom stresu
oksydacyjnego generowanego przez leukocyty, co może
mieć poważne konsekwencje dla integralności błony
komórkowej plemnika (Frączek i wsp., 2008). Wzrost
ilości leukocytów, prozapalnych cytokin i produkcji RFT
w nasieniu był obserwowany np. po operacji rekonstrukcyjnej
dróg wyprowadzających nasienie po wazektomii
(Kolettis i wsp., 1999; Shapiro i wsp., 1998). Wykazano
także, że u pacjentów z żylakami powrózków nasiennych
istnieje ścisły związek między wzrostem poziomu
RFT i uszkodzeniami DNA plemników (Smith i wsp.,
2006). Dodatkowo wzrost poziomu RFT w nasieniu
i uszkodzeń DNA plemników zaobserwowano także
przy skręcie jąder czy wnętrostwie, przy czym w tym
ostatnim przypadku nieprawidłowości te utrzymywały
się nawet po operacyjnym sprowadzeniu jąder do moszny
(Filho i wsp., 2004; Smith i wsp., 2007).
Niskie tzw. fi zjologiczne poziomy RFT w nasieniu,
których produkcja znajduje się pod stałą kontrolą występujących
tam systemów antyoksydacyjnych, odgrywają
istotną rolę w prawidłowej czynności plemnika, biorąc
udział w kluczowych procesach gwarantujących zapłodnienie
(tj. kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika, fuzja plemnika z oocytem). Jednakże,
jakiekolwiek zaburzenie istniejącej równowagi oksydoredukcyjnej
skutkuje wystąpieniem stresu oksydacyjnego.
W ciągu ostatnich 25 lat pojawiło się wiele prac
doświadczalnych i klinicznych na temat patofi zjologii
stresu oksydacyjnego i jego wpływu na męską płodność.
Nie ma obecnie wątpliwości, że stres oksydacyjny zaburza
czynność plemników, ograniczając tym samym szansę
na uzyskanie zapłodnienia komórki jajowej i/lub rozwój
zarodka. Istnieje wiele czynników wywołujących stres
oksydacyjny w nasieniu. Wśród nich są czynniki egzogenne
związane np. ze stylem życia (palenie, alkohol,
otyłość, niezdrowa dieta), na które mężczyzna ma wpływ
i poprzez zmianę swojego stylu życia może je w łatwy
sposób wyeliminować. Niestety możliwości zmiany
innych czynników egzogennych, tj. zanieczyszczenie środowiska
czy ekspozycja na ftalany, często pozostają poza
naszym zasięgiem. Z kolei czynniki endogenne związane
m.in. z zaburzeniami układu płciowego czy też stanami
zapalnymi w nim występującymi oraz tzw. niepłodność
idiopatyczna wymagają interwencji medycznej. Chociażby
w tych dwóch ostatnich przypadkach zasadnym wydaje
się pytanie o możliwość wspomagania leczenia niepłodności
męskiej, u podłoża której leży stres oksydacyjny,
substancjami o udokumentowanym działaniu antyoksydacyjnym.
Podziękowania
Praca napisana w ramach grantu Uniwersytetu Medycznego
w Łodzi nr 503/1 -089 -03/503 -01 i grantu NCN nr UMO-
-2012/05/B/NZ5/01308
Piśmiennictwo
Adams J.A., Galloway T.S., Mondal D., Esteves S.C., Mathews F.: Eff ect of mobile
telephones on sperm quality: a systematic review and meta -analysis. Environ
Int. 2014, 70, 106–112.
Agarwal A., Deepinder F., Sharma R.K., Ranga G., Li J.: Eff ect of cell phone
usage on semen analysis in men attending infertility clinic: an observational
study. Fertil Steril. 2008, 89, 124–128.
Agarwal A., Desai N.R., Makker K., Varghese A., Mouradi R., Sabanegh E. i wsp.:
Eff ects of radiofrequency electromagnetic waves (RF -EMW) from cellular
phones on human ejaculated semen: an in vitro pilot study. Fertil Steril.
2009, 92, 1318–1325.
Agarwal A., Said T.M.: Oxidative stress, DNA damage and apoptosis in male
infertility: a clinical approach. BJU Int. 2005, 95, 503–507.
Agarwal A., Said T.M., Bedaiwy M.A., Banerjee J., Alvarez J.G.: Oxidative
stress in an assisted reproductive techniques setting. Fertil Steril. 2006,
86, 503–512.
Agarwal A., Saleh R.A.: Role of oxidants in male infertility: rationale, signifi -
cance, and treatment. Urol Clin North Am. 2002, 29, 817–827.
Agarwal A., Saleh R.A., Bedaiwy M.A.: Role of reactive oxygen species in
the pathophysiology of human reproduction. Fertil Steril. 2003, 79,
829–843.
Agarwal A., Virk G., Ong C., du Plessis S.S.: Eff ect of oxidative stress on male
reproduction. World J Mens Health. 2014, 32, 1–17.
Aitken R.J., De Iuliis G.N.: On the possible origins of DNA damage in human
spermatozoa. Mol Hum Reprod. 2010, 16, 3–13.
Aitken R.J., De Iuliis G.N., Finnie J.M., Hedges A., McLachlan R.I.: Analysis
of the relationships between oxidative stress, DNA damage and sperm
vitality in a patient population: development of diagnostic criteria. Hum
Reprod. 2010, 25, 2415–2426.
Aitken R.J., Smith T.B., Jobling M.S., Baker M.A., De Iuliis G.N.: Oxidative stress
and male reproductive health. Asian J Androl. 2014, 16, 31–38.
Alvarez J.G., Sharma R.K., Ollero M., Saleh R.A., Lopez M.C., Th omas A.J., Jr.
i wsp.: Increased DNA damage in sperm from leukocytospermic semen samples
as determined by the sperm chromatin structure assay. Fertil Steril.
2002, 78, 319–329.
Alvarez J.G., Storey B.T.: Taurine, hypotaurine, epinephrine and albumin
inhibit lipid peroxidation in rabbit spermatozoa and protect against loss
of motility. Biol Reprod. 1983, 29, 548–555.
Amaral A., Lourenco B., Marques M., Ramalho -Santos J.: Mitochondria functionality
and sperm quality. Reproduction. 2013, 146, 163–174.
Aprioku J.S.: Pharmacology of free radicals and the impact of reactive oxygen
species on the testis. J Reprod Infertil. 2013, 14, 158–172.
Bablok L., Dziadecki W., Szymusik I., Wołczyński S., Kurzawa R., Pawelczyk
L. i wsp.: Patterns of infertility in Poland – multicenter study. Neuro
Endocrinol Lett. 2011, 32, 799–804.
Batstone G.R., Doble A., Gaston J.S.: Autoimmune T cell responses to seminal
plasma in chronic pelvic pain syndrome (CPPS). Clin Exp Immunol.
2002, 128, 302–307.
Brackett N.L., Ibrahim E., Grotas J.A., Aballa T.C., Lynne C.M.: Higher sperm
DNA damage in semen from men with spinal cord injuries compared with
controls. J Androl. 2008, 29, 93–99; discussion 100–101.
Chen S.J., Allam J.P., Duan Y.G., Haidl G.: Infl uence of reactive oxygen species
on human sperm functions and fertilizing capacity including therapeutical
approaches. Arch Gynecol Obstet. 2013, 288, 191–199.
Chitra K.C., Sujatha R., Latchoumycandane C., Mathur P.P.: Eff ect of lindane
on antioxidant enzymes in epididymis and epididymal sperm of adult rats.
Asian J Androl. 2001, 3, 205–208.
Colagar A.H., Marzony E.T.: Ascorbic Acid in human seminal plasma: determination
and its relationship to sperm quality. J Clin Biochem Nutr. 2009,
45, 144–149.
Colagar A.H., Marzony E.T., Chaichi M.J.: Zinc levels in seminal plasma are
associated with sperm quality in fertile and infertile men. Nutr Res. 2009,
29, 82–88.
Crosnoe L.E., Kim E.D.: Impact of age on male fertility. Curr Opin Obstet
Gynecol. 2013, 25, 181–185.
Das U.B., Mallick M., Debnath J.M., Ghosh D.: Protective eff ect of ascorbic
acid on cyclophosphamide - induced testicular gametogenic and androgenic
disorders in male rats. Asian J Androl. 2002, 4, 201–207.
De Celis R., Pedron -Nuevo N., Feria -Velasco A.: Toxicology of male reproduction
in animals and humans. Arch Androl. 1996, 37, 201–218.
De Iuliis G.N., Newey R.J., King B.V., Aitken R.J.: Mobile phone radiation
induces reactive oxygen species production and DNA damage in human
spermatozoa in vitro. PLoS One. 2009, 4, e6446, doi: 10.1371/journal.
pone.0006446.
Deng Y., Zhang W., Su D., Yang Y., Ma Y., Zhang H. i wsp.: Some single nucleotide
polymorphisms of MSY2 gene might contribute to susceptibility
to spermatogenic impairment in idiopathic infertile men. Urology. 2008,
71, 878–882.
Duty S.M., Silva M.J., Barr D.B., Brock J.W., Ryan L., Chen Z. i wsp.: Phthalate
exposure and human semen parameters. Epidemiology. 2003a, 14, 269–277.
Duty S.M., Singh N.P., Silva M.J., Barr D.B., Brock J.W., Ryan L. i wsp.: Th e
relationship between environmental exposures to phthalates and DNA
damage in human sperm using the neutral comet assay. Environ Health
Perspect. 2003b, 111, 1164–1169.
Esteves S.C., Agarwal A.: Novel concepts in male infertility. Int Braz J Urol.
2011, 37, 5–15.
Evenson D.P., Darzynkiewicz Z., Melamed M.R.: Simultaneous measurement by
fl ow cytometry of sperm cell viability and mitochondrial membrane potential
related to cell motility. J Histochem Cytochem. 1982, 30, 279–280.
Fejes I., Zavaczki Z., Szollosi J., Koloszar S., Daru J., Kovacs L. i wsp.: Is there
a relationship between cell phone use and semen quality? Arch Androl.
2005, 51, 385–393.
Filho D.W., Torres M.A., Bordin A.L., Crezcynski -Pasa T.B., Boveris A.: Spermatic
cord torsion, reactive oxygen and nitrogen species and ischemia -reperfusion
injury. Mol Aspects Med. 2004, 25, 199–210.
Fraga C.G., Motchnik P.A., Wyrobek A.J., Rempel D.M., Ames B.N.: Smoking
and low antioxidant levels increase oxidative damage to sperm DNA. Mutat
Res. 1996, 351, 199–203.
Frączek M., Kurpisz M.: Infl ammatory mediators exert toxic eff ects of oxidative
stress on human spermatozoa. J Androl. 2007, 28, 325–333.
Frączek M., Kurpisz M.: Th e redox system in human semen and peroxidative
damage of spermatozoa. Postepy Hig Med Dosw (Online). 2005, 59,
523–534.
Frączek M., Kurpisz M.: Stres oksydacyjny w nasieniu. W: Układ płciowy
męski. Badania kliniczne i doświadczalne. Red.: M. Piasecka. Wydawnictwo
Pomorskiego Uniwersytetu Medycznego w Szczecinie, Szczecin 2013.
Frączek M., Sanocka D., Kamieniczna M., Kurpisz M.: Proinfl ammatory cytokines
as an intermediate factor enhancing lipid sperm membrane peroxidation
in in vitro conditions. J Androl. 2008, 29, 85–92.
Frączek M., Szumala -Kakol A., Jędrzejczak P., Kamieniczna M., Kurpisz M.:
Bacteria trigger oxygen radical release and sperm lipid peroxidation in in
vitro model of semen infl ammation. Fertil Steril. 2007, 88, 1076–1085.
Frączek M., Wiland E., Piasecka M., Boksa M., Gączarzewicz D., Szumala -Kakol A.
i wsp.: Fertilizing potential of ejaculated human spermatozoa during in vitro
semen bacterial infection. Fertil Steril. 2014, 102, 711–719.e1.
Gałecka E., Jacewicz R., Mrowicka M., Florkowski A., Gałecki P.: Antioxidative
enzymes – structure, properties, functions. Pol Merkur Lekarski. 2008,
25, 266–268.
Ghosh D., Das U.B., Misro M.: Protective role of alpha -tocopherol -succinate
(provitamin -E) in cyclophosphamide induced testicular gametogenic and
steroidogenic disorders: a correlative approach to oxidative stress. Free
Radic Res. 2002, 36, 1209–1218.
Giannattasio A., De Rosa M., Smeraglia R., Zarrilli S., Cimmino A., Di Rosario
B. i wsp.: Glutathione peroxidase (GPX) activity in seminal plasma of healthy
and infertile males. J Endocrinol Invest. 2002, 25, 983–986.
Gil -Guzman E., Ollero M., Lopez M.C., Sharma R.K., Alvarez J.G., Th omas A.J.,
Jr. i wsp.: Diff erential production of reactive oxygen species by subsets of
human spermatozoa at diff erent stages of maturation. Hum Reprod. 2001,
16, 1922–1930.
Gorpinchenko I., Nikitin O., Banyra O., Shulyak A.: Th e infl uence of direct mobile
phone radiation on sperm quality. Cent European J Urol. 2014, 67, 65–71.
Guerriero G., Trocchia S., Abdel -Gawad F.K., Ciarcia G.: Roles of reactive oxygen
species in the spermatogenesis regulation. Front Endocrinol (Lausanne).
2014, 5, 56, doi: 10.33891 fendo.2014.00056.
Guz J., Gackowski D., Foksinski M., Rozalski R., Zarakowska E., Siomek A. i wsp.:
Comparison of oxidative stress/DNA damage in semen and blood of fertile
and infertile men. PLoS One. 2013, 8, e68490, doi: 10.1371/journal.
pone.0068490.
Hauser R., Meeker J.D., Singh N.P., Silva M.J., Ryan L., Duty S. i wsp.: DNA
damage in human sperm is related to urinary levels of phthalate monoester
and oxidative metabolites. Hum Reprod. 2007, 22, 688–695.
Henkel R., Kierspel E., Stalf T., Mehnert C., Menkveld R., Tinneberg H.R. i wsp.: Eff ect
of reactive oxygen species produced by spermatozoa and leukocytes on sperm
functions in non -leukocytospermic patients. Fertil Steril. 2005, 83, 635–642.
Hsu P.C., Guo Y.L.: Antioxidant nutrients and lead toxicity. Toxicology. 2002,
180, 33–44.
Hull M.G., Glazener C.M., Kelly N.J., Conway D.I., Foster P.A., Hinton R.A. i wsp.:
Population study of causes, treatment, and outcome of infertility. Br Med
J (Clin Res Ed). 1985, 291, 1693–1697.
Irvine D.S.: Epidemiology and aetiology of male infertility. Hum Reprod.
1998, 13 Suppl 1, 33–44.
Junqueira V.B., Barros S.B., Chan S.S., Rodrigues L., Giavarotti L., Abud R.L. i wsp.:
Aging and oxidative stress. Mol Aspects Med. 2004, 25, 5–16.
Jurewicz J., Radwan M., Merecz -Kot D., Sobala W., Ligocka D., Radwan P. i wsp.:
Occupational, life stress and family functioning: does it aff ect semen quality?
Ann Hum Biol. 2014a, 41, 220–228.
Jurewicz J., Radwan M., Sobala W., Ligocka D., Radwan P., Bochenek M. i wsp.:
Lifestyle and semen quality: role of modifi able risk factors. Syst Biol Reprod
Med. 2014b, 60, 43–51.
Jurewicz J., Radwan M., Sobala W., Ligocka D., Radwan P., Bochenek M. i wsp.:
Human urinary phthalate metabolites level and main semen parameters,
sperm chromatin structure, sperm aneuploidy and reproductive hormones.
Reprod Toxicol. 2013, 42, 232–241.
Kasahara E., Sato E.F., Miyoshi M., Konaka R., Hiramoto K., Sasaki J. i wsp.:
Role of oxidative stress in germ cell apoptosis induced by di(2 -ethylhexyl)
phthalate. Biochem J. 2002, 365, 849–856.
Khullar K., Agarwal A., Du Plessis S.S.: A hormonal, physical, and proteomic
view of obesity -induced eff ects on male infertility and possible lifestyle
modifi cations. Asian Pac J Reprod. 2012, 1, 161–168.
Kilgallon S.J., Simmons L.W.: Image content infl uences men’s semen quality.
Biol Lett. 2005, 1, 253–255.
Koch O.R., Pani G., Borrello S., Colavitti R., Cravero A., Farre S. i wsp.: Oxidative
stress and antioxidant defenses in ethanol -induced cell injury. Mol Aspects
Med. 2004, 25, 191–198.
Kolettis P.N., Sharma R.K., Pasqualotto F.F., Nelson D., Th omas A.J., Jr., Agarwal
A.: Eff ect of seminal oxidative stress on fertility after vasectomy reversal.
Fertil Steril. 1999, 71, 249–255.
Koppers A.J., De Iuliis G.N., Finnie J.M., McLaughlin E.A., Aitken R.J.:
Signifi cance of mitochondrial reactive oxygen species in the generation of oxidative
stress in spermatozoa. J Clin Endocrinol Metab. 2008, 93, 3199–3207.
Kotzbach R., Kotzbach M.: Niektóre współczesne problemy prokreacji. Post
Androl Online. 2013, 1, 5–11.
Kovalski N.N., de Lamirande E., Gagnon C.: Reactive oxygen species generated
by human neutrophils inhibit sperm motility: protective eff ect of seminal
plasma and scavengers. Fertil Steril. 1992, 58, 809–816.
Krause W., Bohring C.: Male infertility and genital chlamydial infection: victim
or perpetrator? Andrologia. 2003, 35, 209–216.
Krause W., Bohring C., Gueth A., Horster S., Krisp A., Skrzypek J.: Cellular and
biochemical markers in semen indicating male accessory gland infl ammation.
Andrologia. 2003, 35, 279–282.
Kulikauskas V., Blaustein D., Ablin R.J.: Cigarette smoking and its possible
eff ects on sperm. Fertil Steril. 1985, 44, 526–528.
Kurpisz M., Miesel R., Sanocka D., Jędrzejczak P.: Seminal plasma can be a predictive
factor for male infertility. Hum Reprod. 1996, 11, 1223–1226.
Kutlubay R., Oguz E.O., Can B., Guven M.C., Sinik Z., Tuncay O.L.: Vitamin E
protection from testicular damage caused by intraperitoneal aluminium.
Int J Toxicol. 2007, 26, 297–306.
Lahdetie J.: Occupation - and exposure -related studies on human sperm.
J Occup Environ Med. 1995, 37, 922–930.
Lavranos G., Balla M., Tzortzopoulou A., Syriou V., Angelopoulou R.: Investigating
ROS sources in male infertility: a common end for numerous pathways.
Reprod Toxicol. 2012, 34, 298–307.
Lenzi A., Culasso F., Gandini L., Lombardo F., Dondero F.: Placebo -controlled,
double -blind, cross -over trial of glutathione therapy in male infertility.
Hum Reprod. 1993, 8, 1657–1662.
Ługowski M., Saczko J., Kulbacka J., Baśas T.: Reactive oxygen and nitrogen
species]. Pol Merkur Lekarski. 2011, 31, 313–317.
Mailankot M., Kunnath A.P., Jayalekshmi H., Koduru B., Valsalan R.: Radio
frequency electromagnetic radiation (RF -EMR) from GSM (0.9/1.8GHz)
mobile phones induces oxidative stress and reduces sperm motility in rats.
Clinics (Sao Paulo). 2009, 64, 561–565.
Mazzilli F., Rossi T., Marchesini M., Ronconi C., Dondero F.: Superoxide anion
in human semen related to seminal parameters and clinical aspects. Fertil
Steril. 1994, 62, 862–868.
Mostafa T., Tawadrous G., Roaia M.M., Amer M.K., Kader R.A., Aziz A.: Eff ect
of smoking on seminal plasma ascorbic acid in infertile and fertile males.
Andrologia. 2006, 38, 221–224.
Motrich R.D., Maccioni M., Molina R., Tissera A., Olmedo J., Riera C.M. i wsp.:
Reduced semen quality in chronic prostatitis patients that have cellular
autoimmune response to prostate antigens. Hum Reprod. 2005, 20, 2567–2572.
Musset B., Clark R.A., DeCoursey T.E., Petheo G.L., Geiszt M., Chen Y. i wsp.:
NOX5 in human spermatozoa: expression, function, and regulation. J Biol
Chem. 2012, 287, 9376–9388.
Ochędalski T., Lachowicz -Ochędalska A., Dec W., Czechowski B.: Evaluating
the eff ect of smoking tobacco on some semen parameters in men of reproductive
age. Ginekol Pol. 1994, 65, 80–86.
Olinski R., Siomek A., Rozalski R., Gackowski D., Foksinski M., Guz J. i wsp.:
Oxidative damage to DNA and antioxidant status in aging and age -related
diseases. Acta Biochim Pol. 2007, 54, 11–26.
Ollero M., Gil -Guzman E., Lopez M.C., Sharma R.K., Agarwal A., Larson K. i wsp.:
Characterization of subsets of human spermatozoa at diff erent stages of
maturation: implications in the diagnosis and treatment of male infertility.
Hum Reprod. 2001, 16, 1912–1921.
Olszewska -Słonina D.: Sperm cyropreservation and oxidative damage. What
does it mean? Cent European J Urol. 2013, 66, 50–51.
Pacifi ci R., Altieri I., Gandini L., Lenzi A., Pichini S., Rosa M. i wsp.: Nicotine,
cotinine, and trans -3 -hydroxycotinine levels in seminal plasma of smokers:
eff ects on sperm parameters. Th er Drug Monit. 1993, 15, 358–363.
Palmer N.O., Bakos H.W., Fullston T., Lane M.: Impact of obesity on male
fertility, sperm function and molecular composition. Spermatogenesis.
2012, 2, 253–263.
Paul C., Robaire B.: Ageing of the male germ line. Nat Rev Urol. 2013, 10, 227–234.
Peake J.M., Suzuki K., Coombes J.S.: Th e infl uence of antioxidant supplementation
on markers of infl ammation and the relationship to oxidative stress
after exercise. J Nutr Biochem. 2007, 18, 357–371.
Potargowicz E., Szerszenowicz E., Staniszewska M., Nowak D.: Mitochondria
as an source of reactive oxygen species. Postepy Hig Med Dosw (Online).
2005, 59, 259–266.
Purvis K., Christiansen E.: Male infertility: current concepts. Ann Med. 1992,
24, 259–272.
Puzanowska -Tarasiewicz H., Starczewska B., Kuźmicka L.: Reaktywne formy
tlenu. Bromat Chem Toksykol. 2008, 41, 1007–1015.
Rengan A.K., Agarwal A., van der Linde M., du Plessis S.S.: An investigation of
excess residual cytoplasm in human spermatozoa and its distinction from
the cytoplasmic droplet. Reprod Biol Endocrinol. 2012, 10, 92.
Roos D.: Th e involvement of oxygen radicals in microbicidal mechanisms of
leukocytes and macrophages. Klin Wochenschr. 1991, 69, 975–980.
Rowe P.J., Comhaire F.H., Hargreave T.B., Mahmoud A.M.A.: WHO manual for
the standardized investigation, diagnosis and management of the infertile
male. WHO, 2000
Safarinejad M.R.: Infertility among couples in a population -based study
in Iran: prevalence and associated risk factors. Int J Androl. 2008, 31,
303–314.
Saleh R.A., Agarwal A., Nada E.A., El -Tonsy M.H., Sharma R.K., Meyer A. i wsp.:
Negative eff ects of increased sperm DNA damage in relation to seminal
oxidative stress in men with idiopathic and male factor infertility. Fertil
Steril. 2003, 79 Suppl 3, 1597–1605.
Saleh R.A., Agarwal A., Sharma R.K., Nelson D.R., Th omas A.J., Jr.: Eff ect of
cigarette smoking on levels of seminal oxidative stress in infertile men:
a prospective study. Fertil Steril. 2002, 78, 491–499.
Sanocka -Maciejewska D., Ciupińska M., Kurpisz M.: Bacterial infection and
semen quality. J Reprod Immunol. 2005, 67, 51–56.
Sanocka D., Jędrzejczak P., Szumała -Kaekol A., Frączek M., Kurpisz M.: Male
genital tract infl ammation: Th e role of selected interleukins in regulation
of pro -oxidant and antioxidant enzymatic substances in seminal plasma.
J Androl. 2003, 24, 448–455.
Sanocka D., Miesel R., Jędrzejczak P., Chełmońska -Soyta A.C., Kurpisz M.:
Eff ect of reactive oxygen species and the activity of antioxidant systems
on human semen; association with male infertility. Int J Androl. 1997,
20, 255–264.
Segnini A., Camejo M.I., Proverbio F.: Chlamydia trachomatis and sperm lipid
peroxidation in infertile men. Asian J Androl. 2003, 5, 47–49.
Sepaniak S., Forges T., Fontaine B., Gerard H., Foliguet B., Guillet -May F. i wsp.:
Negative impact of cigarette smoking on male fertility: from spermatozoa
to the off spring. J Gynecol Obstet Biol Reprod (Paris). 2004, 33,
384–390.
Shapiro R.H., Muller C.H., Chen G., Berger R.E.: Vasectomy reversal associated
with increased reactive oxygen species production by seminal fl uid
leukocytes and sperm. J Urol. 1998, 160, 1341–1346.
Sharlip I.D., Jarow J.P., Belker A.M., Lipshultz L.I., Sigman M., Th omas A.J. i wsp.:
Best practice policies for male infertility. Fertil Steril. 2002, 77, 873–882.
Sharma R.K., Pasqualotto A.E., Nelson D.R., Th omas A.J., Jr., Agarwal A.:
Relationship between seminal white blood cell counts and oxidative stress
in men treated at an infertility clinic. J Androl. 2001, 22, 575–583.
Sikka S.C.: Role of oxidative stress and antioxidants in andrology and assisted
reproductive technology. J Androl. 2004, 25, 5–18.
Singer G., Granger D.N.: Infl ammatory responses underlying the microvascular
dysfunction associated with obesity and insulin resistance. Microcirculation.
2007, 14, 375–387.
Siomek A., Gackowski D., Rozalski R., Dziaman T., Szpila A., Guz J. i wsp.: Higher
leukocyte 8 -oxo -7,8 -dihydro -2’ -deoxyguanosine and lower plasma ascorbate
in aging humans? Antioxid Redox Signal. 2007, 9, 143–150.
Słowikowska -Hilczer J.: Xenobiotics with estrogen or antiandrogen
action – disruptors of the male reproductive system. Centr Eur J Med. 2006,
1, 205–227.
Smith R., Kaune H., Parodi D., Madariaga M., Morales I., Rios R. i wsp.: Extent
of sperm DNA damage in spermatozoa from men examined for infertility.
Relationship with oxidative stress. Rev Med Chil. 2007, 135, 279–286.
Smith R., Kaune H., Parodi D., Madariaga M., Rios R., Morales I. i wsp.: Increased
sperm DNA damage in patients with varicocele: relationship with seminal
oxidative stress. Hum Reprod. 2006, 21, 986–993.
Sujatha R., Chitra K.C., Latchoumycandane C., Mathur P.P.: Eff ect of lindane
on testicular antioxidant system and steroidogenic enzymes in adult rats.
Asian J Androl. 2001, 3, 135–138.
Taha E.A., Ez -Aldin A.M., Sayed S.K., Ghandour N.M., Mostafa T.: Eff ect of
smoking on sperm vitality, DNA integrity, seminal oxidative stress, zinc
in fertile men. Urology. 2012, 80, 822–825.
Taha E.A., Sayed S.K., Ghandour N.M., Mahran A.M., Saleh M.A., Amin
M.M. i wsp.: Correlation between seminal lead and cadmium and seminal
parameters in idiopathic oligoasthenozoospermic males. Cent European
J Urol. 2013, 66, 84–92.
Th iele J.J., Friesleben H.J., Fuchs J., Ochsendorf F.R.: Ascorbic acid and urate in
human seminal plasma: determination and interrelationships with chemiluminescence
in washed semen. Hum Reprod. 1995, 10, 110–115.
Th onneau P., Bujan L., Multigner L., Mieusset R.: Occupational heat exposure
and male fertility: a review. Hum Reprod. 1998, 13, 2122–2125.
Tomar A.K., Sooch B.S., Raj I., Singh T.P., Yada S.: Isolation and identifi cation of
Concanavalin A binding glycoproteins from human seminal plasma: a step
towards identifi cation of male infertility marker proteins. Dis Markers. 2011,
31 (6), 379–386.
Tremellen K.: Oxidative stress and male infertility – a clinical perspective.
Hum Reprod Update. 2008, 14, 243–258.
Trummer H., Habermann H., Haas J., Pummer K.: Th e impact of cigarette
smoking on human semen parameters and hormones. Hum Reprod. 2002,
17, 1554–1559.
Ursini F., Heim S., Kiess M., Maiorino M., Roveri A., Wissing J. i wsp.: Dual
function of the selenoprotein PHGPx during sperm maturation. Science.
1999, 285, 1393–1396.
Vogelpoel F.R., van Kooij R.J., te Velde E.R., Verhoef J.: Infl uence of polymorphonuclear
granulocytes on the zona -free hamster oocyte assay. Hum Reprod.
1991, 6, 1104–1107.
Walczak -Jędrzejowska R., Wolski J.K., Słowikowska -Hilczer J.: Th e role of oxidative
stress and antioxidants in male fertility. Cent European J Urol. 2013,
66, 60–67.
Wang X., Sharma R.K., Gupta A., George V., Th omas A.J., Falcone T. i wsp.:
Alterations in mitochondria membrane potential and oxidative stress in
infertile men: a prospective observational study. Fertil Steril. 2003, 80
Suppl 2, 844–850.
Watson P.F.: Th e causes of reduced fertility with cryopreserved semen. Anim
Reprod Sci. 2000, 60 -61, 481–492.
Wdowiak A., Wdowiak L., Wiktor H.: Evaluation of the eff ect of using mobile
phones on male fertility. Ann Agric Environ Med. 2007, 14, 169–172.
Webb G.W., Arns M.: Eff ect of pyruvate and lactate on motility of cold stored
stallion spermatozoa challenged by hydrogen peroxide. J Equine Vet Sci.
2006, 26, 406–411.
Wolff H., Politch J.A., Martinez A., Haimovici F., Hill J.A., Anderson D.J.:
Leukocytospermia is associated with poor semen quality. Fertil Steril.
1990, 53, 528–536.
Xu D.X., Shen H.M., Zhu Q.X., Chua L., Wang Q.N., Chia S.E. i wsp.: Th e associations
among semen quality, oxidative DNA damage in human spermato
zoa and concentrations of cadmium, lead and selenium in seminal plasma.
Mutat Res. 2003, 534, 155–163.
Xu K., Shang X., Chen Y., Zhao F., Zhu P., Huang Y.: Measurement of uric acid
of seminal plasma in fertile and infertile males. Zhonghua Nan Ke Xue.
2004, 10, 900–901.
Zhang H.Y., Lu J.C., Zhang R.S., Xia Y.X., Huang Y.F.: Determination of uric
acid in seminal plasma and correlation between seminal uric acid and semen
parameters. Zhonghua Nan Ke Xue. 2007, 13, 1016–1019.
Zini A., Garrels K., Phang D.: Antioxidant activity in the semen of fertile and
infertile men. Urology. 2000, 55, 922–926.
STRES OKSYDACYJNY A NIEPŁODNOŚĆ MĘSKA.
CZEŚĆ II: ANTYOKSYDANTY W LECZENIU
MĘSKIEJ NIEPŁODNOŚCI
OXIDATIVE STRESS AND MALE INFERTILITY. PART II:
ANTIOXIDANTS IN TREATMENT OF MALE INFERTILITY
Renata Walczak -Jędrzejowska
Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet
Medyczny w Łodzi
Autor do korespondencji: Renata Walczak -Jędrzejowska (renata.walczak -jedrzejowska@umed.lodz.pl)
Renata Walczak -Jędrzejowska – dr n. med., absolwentka Uniwersytetu Łódzkiego, biolog, specjalność biologia molekularna.
Nauczyciel akademicki w Zakładzie Endokrynologii Płodności Katedry Andrologii i Endokrynologii Płodności
Uniwersytetu Medycznego w Łodzi. Współwykonawca polskich i europejskich projektów badawczych. Pierwszy autor
i współautor 93 publikacji naukowych. Skarbnik Polskiego Towarzystwa Andrologicznego, członek Międzynarodowego
Towarzystwa Andrologicznego, Polskiego Towarzystwa Endokrynologicznego, Towarzystwa Histochemików
i Cytochemików oraz Komisji Andrologii Komitetu Biologii Rozrodu PAN. Praca zawodowa i naukowa autorki związana
jest z badaniami nad czynnością męskiego układu płciowego i jego zaburzeniami oraz diagnostyką andrologiczną.
Streszczenie
STRES OKSYDACYJNY A NIEPŁODNOŚĆ MĘSKA.
CZEŚĆ II: ANTYOKSYDANTY W LECZENIU
MĘSKIEJ NIEPŁODNOŚCI
OXIDATIVE STRESS AND MALE INFERTILITY. PART II:
ANTIOXIDANTS IN TREATMENT OF MALE INFERTILITY
Renata Walczak -Jędrzejowska
Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Autor do korespondencji: Renata Walczak -Jędrzejowska (renata.walczak -jedrzejowska@umed.lodz.pl)
Streszczenie
W ostatnich latach opublikowano wiele prac, w których wykazano, że reaktywne formy tlenu występują w zwiększonej ilości w nasieniu
niepłodnych mężczyzn, zaburzając czynności plemników, głównie w wyniku utleniania lipidów błon komórkowych oraz uszkodzenia
ojcowskiego DNA. W konsekwencji uważa się, że stres oksydacyjny jest jedną z głównych przyczyn męskiej niepłodności. Ponieważ
w warunkach stresu oksydacyjnego naturalne systemy antyoksydacyjne nie są w stanie neutralizować i usuwać nadmiaru reaktywnych
form tlenu, wydaje się uzasadnione twierdzenie, że złagodzenie stresu oksydacyjnego poprzez przyjmowanie egzogennych antyoksydantów
może prowadzić do polepszenia czynności plemników i potencjalnie płodności mężczyzny. Mimo iż istnieje wiele badań,
w których wykazano korzystny wpływ podawania antyoksydantów na parametry nasienia czy nawet wzrost odsetka ciąż u partnerek,
to nie ma możliwości ustalenia na ich podstawie jednoznacznych wytycznych co do wprowadzenia terapii antyoksydantami do rutynowej
praktyki leczenia męskiej niepłodności. Dlatego też, obecnie, leczenie antyoksydantami zaburzeń męskiej płodności pozostaje
ciągle w sferze tzw. leczenia empirycznego.
słowa kluczowe: stres oksydacyjny, niepłodność męska, antyoksydanty
Abstract
In recent years many articles have showed, that reactive oxygen species are present in increased amounts in the semen of infertile men,
causing sperm dysfunction, mainly due to peroxidation of cell membrane’s lipids and paternal DNA. Th us, it is presently considered
that oxidative stress is one of the main causes of male infertility. Since at oxidative stress, natural antioxidant systems are not able
to neutralize and remove excess of reactive oxygen species, it seems logical that amelioration of oxidative stress by taking exogenous
antioxidants may lead to improve sperm function and potentially male fertility. Although there are many studies that have demonstrated
a benefi cial eff ect of antioxidant administration to improve semen parameters or even increase in the pregnancy rates, it is
still impossible to establish clear guidelines for the introduction of antioxidant therapy in routine treatment of male infertility. Th us,
until now the treatment of male infertility with antioxidants stays an empirical one.
key words: oxidative stress, male infertility, antioxidants
Skróty / Abbreviations
4HNE – 4 -hydroksynonenal (ang. 4 -hydroxynonenal), 8 -OHdG – 8 -hydroksy -2’ -deoksyguanozyna (ang. 8 -hydroxy -2’ -deoxyguanosine), ATP –
adenozyno -5’ -trifosforan (ang. adenosine -5’ -triphate), CASA – analiza nasienia wspomagana komputerowo (ang. computer -assisted semen
analysis), DFI – indeks fragmentacji DNA (ang. DNA fragmentation index); DHA – kwas dokozaheksaenowy (ang. decosahexaaenoic acid),
G6PDH – dehydrogenaza glukozo -6 -fosforanowa (ang. glucose -6 -phosphate dehydrogenase), GPX – peroksydaza glutationowa (ang. glutathione
peroxidase), GRADE – grupa robocza GRADE (ang. Grades of Recommendation, Assessment, Development, and Evaluation Working Group),
ICSI – docytoplazmatyczna iniekcja plemnika (ang. intracytoplasmic sperm injection), iOAT – idiopatyczna oligoastenoteratozoospermia (ang.
idiopthic oligoasthenoteratozoospermia), IMSI – docytoplazmatyczna iniekcja plemnika wyselekcjonowanego pod względem morfologicznym
(ang. intracytoplasmic morphologically selected sperm injection), MDA – dialdehyd malonowy (ang. malondialdehyde), mtDNA – mitochondrialny
DNA (ang. mitochondrial DNA), NADPH – fosforan dinukleotydu nikotynoamidoadeninowego, forma zredukowana (ang. nicotinamide
adenine dinucleotide phosphate, reduced), NLPZ – niesteroidowe leki przeciwzapalne (ang. non -steroidal anti -infl ammatory drugs), PUFA – wielonienasycone
kwasy tłuszczowe (ang. polyunsaturated fatty acids), RDA – zalecane dzienne spożycie (ang. recommended dietary allowance),
RFT – reaktywne formy tlenu (ang. reactive oxigene species), -SH – grupa sulfhydrylowa (ang. sulfhydryl group)
Stres oksydacyjny spowodowany jest zachwianiem równowagi
między wytwarzaniem tzw. reaktywnych form
tlenu (RFT, ang. reactive oxygene species), powstających
w komórkach podczas wielu procesów metabolicznych,
a działaniem ochronnego systemu antyoksydacyjnego
organizmu odpowiedzialnego za ich neutralizowanie
i usuwanie (Walczak -Jędrzejowska i wsp., 2013). Ocenia się,
że u co najmniej 25% niepłodnych mężczyzn w porównaniu
z mężczyznami płodnymi występuje w nasieniu
podwyższony poziom RFT (Agarwal i wsp., 2004; Aitken
i wsp., 2010; Fraga i wsp., 1991; Iwasaki i Gagnon, 1992;
Zini i wsp., 2009). Nadmiar RFT jest przyczyną występowania
reakcji patologicznych prowadzących do uszkodzenia
ważnych cząsteczek biologicznych (lipidów błon
komórkowych, białek, DNA), powodując nieodwracalne
zmiany w ich strukturze i prowadząc do zaburzenia
czynności plemników, a w konsekwencji obniżenia
ich potencjału zapładniającego (Cummins i wsp., 1994).
Dodatkowo wykazano, że podwyższeniu poziomu RFT
towarzyszy często obniżenie zdolności antyoksydacyjnych
nasienia (Lewis i wsp., 1997; Sanocka i wsp., 1996;
Smith i wsp., 1996). Dlatego też w ostatnich latach ukazuje
się coraz więcej artykułów naukowych poświęconych
badaniu wpływu suplementacji substancjami o udokumentowanym
działaniu antyoksydacyjnym na poprawę
męskiej płodności.
Stres oksydacyjny a parametry nasienia
i czynność plemników
W warunkach stresu oksydacyjnego zaburzone zostaje
prawidłowe wytwarzanie plemników oraz ich jakość
w wyniku interakcji RFT z lipidami błony komórkowej,
białkami oraz DNA. Istnieje wiele doniesień wykazujących,
że wzrost poziomu RFT i/lub obniżenie poziomu
antyoksydantów w nasieniu korelują z zaburzeniem
ruchliwości plemników (Aitken i wsp., 1993a; Aitken
i wsp., 1997; Benedetti i wsp., 2012; de Lamirande i Gagnon,
1992a; 1992b; Gil -Guzman i wsp., 2001; Ollero i wsp., 2001;
Sikka, 1996), nieprawidłową morfologią (Benedetti i wsp.,
2012; Gil -Guzman i wsp., 2001; Ollero i wsp., 2001) czy
oligozoospermią (Aitken i wsp., 1989; Guz i wsp., 2013;
Mahanta i wsp., 2012; Pasqualotto i wsp., 2000). Z drugiej
strony, ocenia się, że u 30–80% niepłodnych mężczyzn
zaobserwować można uszkodzenia oksydacyjne plemników
nawet wtedy, gdy parametry rutynowych badań
nasienia takie jak koncentracja, ruchliwość czy morfologia
plemników są w granicach normy (Tremellen,
2008). Dlatego też uważa się, że właśnie stres oksydacyjny
może leżeć u podstaw wielu przypadków męskiej
niepłodności o nieznanym podłożu – tzw. niepłodności
idiopatycznej.
Błona komórkowa plemników zawiera duże ilości
wielonienasyconych kwasów tłuszczowych (PUFA, ang.
polyunsaturated fatty acids), głównie kwasu dokozaheksaenowego
(DHA, ang. decosahexaaenoic acid), które
z jednej strony odpowiedzialne są za płynność błony,
a z drugiej czynią ją podatną na uszkodzenia peroksydacyjne
wywoływane przez RFT (Alvarez i Storey, 1995;
Alvarez i wsp., 1987). Peroksydacja lipidów jest procesem
łańcuchowym, zapewniającym ciągłą dostawę wolnych
rodników inicjujących następne reakcje peroksydacyjne.
Proces ten uważany jest za jeden z głównych mechanizmów
uszkodzeń oksydacyjnych plemników, skutkujący
obniżeniem płynności błon, zmianami ich struktury,
wzrostem niespecyfi cznej przepuszczalności jonów
oraz unieczynnieniem związanych z błoną receptorów
i białek, co nieuchronnie prowadzi do zaburzeń czynności
plemników i niepłodności (Agarwal i wsp., 2014; Aitken
i wsp., 2014; Frączek i Kurpisz, 2013). Jednym z głównych
efektów tego procesu jest utrata ruchliwości i przeżywalności
plemników głównie na skutek utraty adenozyno-
-5’ -trifosforanu (ATP, ang. adenosine -5’ -triphate) i spadku
fosforylacji białek aksonemalnych (Aitken i wsp., 1993b;
Rao i wsp., 1989; Rivlin i wsp., 2004).
Reakcja peroksydacji lipidów prowadzi także
do wytworzenia cytotoksycznych aldehydów takich
jak dialdehyd malonowy (MDA, ang. malondialdehyde)
czy 4 -hydroksynonenal (4HNE, ang. 4 -hydroxynonenal),
które w dalszym etapie mogą uszkadzać cząsteczki białek
czy też DNA, w tym ostatnim przypadku tworząc tzw.
addukty objętościowe i przyczyniając się do niestabilności
DNA (Grosicka -Maciąg, 2011; Przybyszewski i wsp.,
2005). Aitken i wsp. (2012) w badaniach in vitro wykazali
że, 4HNE i akroleina powodują utratę ruchliwości ludzkich plemników. Z kolei pomiar stężenia MDA jest
wykorzystywany jako biochemiczny marker uszkodzeń
peroksydacyjnych lipidów i koreluje z obniżeniem koncentracji,
morfologii, a przede wszystkim ruchliwości
plemników i jakością DNA, a w konsekwencji ich zdolnością
zapładniającą (Atig i wsp., 2012; Benedetti i wsp.,
2012; Hsieh i wsp., 2006; Jędrzejczak i wsp., 2005).
Oddziaływanie RFT z białkami powoduje ich utlenianie,
które może prowadzić do rozerwania łańcucha
polipeptydowego, pojawienia się zmienionych reszt
amino kwasowych, czy też tworzenia dimerów bądź agregatów
białkowych. Zmiany te w konsekwencji powodują
zmianę struktury białka oraz utratę jego aktywności biologicznej.
Oksydacyjne modyfi kacje w strukturze i topografi
i białek błonowych główki i witki plemnika mogą
zaburzać kapacytancję, reakcję akrosomalną i w efekcie
fuzję plemnika z oocytem (Frączek i Kurpisz, 2013).
W białkach najbardziej podatne na utlenianie są reszty
cysteiny i metioniny zawierające grupy sulfhydrylowe
(–SH, ang. sulfhydryl group) oraz tyrozyna i tryptofan.
Głównymi mediatorami oksydacyjnego uszkodzenia
białek są najczęściej rodnik hydroksylowy, nadtlenek
wodoru i anionorodnik ponadtlenkowy (Grosicka -Maciąg,
2011; Zabłocka i Janusz, 2008). Przykładowo, wykazano,
że nadtlenek wodoru powoduje hamowanie aktywności
enzymu dehydrogenazy glukozo -6 -fosforanowej (G6PDH,
ang. glucose -6 -phosphate dehydrogenase) w plemnikach,
w konsekwencji zmniejszając ilości dostępnego, zredukowanego
fosforanu dinukleotydu nikotynoamidoadeninowego
(NADPH, ang. nicotinamide adenine dinucleotide
phosphate, reduced), który jest niezbędny w reakcji
redukcji utlenionego glutationu do jego formy zredukowanej
(D’Autreaux i Toledano, 2007; Meister, 1988). Wynika
z tego, że zahamowanie aktywności G6PDH obniża
dostępność zredukowanej formy glutationu, która jest
niezbędna dla prawidłowego działania enzymu peroksydazy
glutationowej (GPX, ang. glutathione peroxidase),
powodując tym samym obniżenia zdolności antyoksydacyjnych
plemnika (Griveau i wsp., 1995).
Stres oksydacyjny jest uważany za główny czynnik
powodujący uszkodzenia DNA plemników (Aitken i De
Iuliis, 2010). Za oksydacyjne uszkodzenia DNA odpowiedzialny
jest przede wszystkim rodnik hydroksylowy
oraz tlen singletowy. Nadtlenek wodoru i anionorodnik
ponadtlenkowy nie powodują uszkodzenia kwasów
nukleinowych. Utlenianie DNA prowadzi do modyfi -
kacji zasad azotowych, reszt cukrowych lub powstania
pęknięć kwasów nukleinowych (jedno - i dwuniciowych)
oraz wiązań poprzecznych DNA -białko. Jedną z zasad,
która łatwo ulega utlenianiu, jest guanina. Produktem
reakcji rodnika hydroksylowego z cząsteczką nukleozydu
deoksyguanozyny jest 8 -hydroksy -2’ -deoksyguanozyna
(8 -OHdG, ang. 8 -hydroxy -2’ -deoxyguanosine), która jest
najczęściej spotykanym mutagennym uszkodzeniem
cząsteczki DNA (Grosicka -Maciąg, 2011), dzięki czemu
może być markerem oksydacyjnych uszkodzeń DNA.
Wykazano, że poziom jej koreluje dodatnio z ilością RFT
oraz pęknięciami jądrowego DNA plemnika u niepłodnych
mężczyzn (Aitken i wsp., 2010; De Iuliis i wsp., 2009)
oraz pacjentów z żylakami powrózków nasiennych lub
wnętrostwem (Abd -Elmoaty i wsp., 2010; Agarwal i wsp.,
2008). Obniżenie poziomu pojedynczych antyoksydantów
oraz całkowitej zdolności antyoksydacyjnej nasienia oraz
wzrost poziomu RFT w nasieniu korelują z uszkodzeniami
DNA w plemnikach niepłodnych mężczyzn (Atig i wsp.,
2013; Khosravi i wsp., 2012; Zini i wsp., 2009). Uszkodzenia
te współwystępują często z obniżeniem liczby plemników
i wzrostem odsetka nieprawidłowych plemników (Mehdi
i wsp., 2009; Virro i wsp., 2004) oraz zaburzeniem ich
ruchliwości (Appasamy i wsp., 2007; Erenpreiss i wsp., 2008;
Piasecka i wsp., 2007). Jako że wysoki poziom fragmentacji
jądrowego DNA wykazano także u niepłodnych mężczyzn
z normozoospermią, wydaje się, że uszkodzenia
DNA mogą być główną przyczyną niepłodności idiopatycznej
(Erenpreiss i wsp., 2008; Oleszczuk i wsp., 2013;
Piasecka i wsp., 2006).
W plemniku z prawidłowo dojrzałą i skondensowaną
chromatyną tylko 10–15% jądrowego DNA związane
jest z histonami i wykazuje budowę nukleosomową.
Pozostała część genomowego DNA plemnika (85–90%),
podczas procesu protaminacji obejmującego wymianę
histonów somatycznych na histony jądrowe, tych z kolei
na białka przejściowe i fi nalnie na specyfi czne dla plemnika
białka protaminowe (protamina 1 i protamina 2),
upakowywana jest w formie toroidu, który zabezpiecza
DNA przed szkodliwym działaniem czynników takich
jak stres oksydacyjny. Defekty genów kodujących białka
protaminy czy też zaburzenia ich transkrypcji lub translacji
białek protaminowych mogą prowadzić do nieprawidłowej
ilości i stosunku transkryptów obu protamin,
następnie do deprotaminacji i nieprawidłowej kondensacji
chromatyny, a tym samym do obniżenia integralności
genomu plemników (Kazienko i wsp., 2012; Piasecka
i wsp., 2013). Plemnikowe DNA staje się wtedy bardziej
podatne na uszkodzenia oksydacyjne prowadzące m.in.
do jego fragmentacji (Aoki i wsp., 2006; De Iuliis i wsp.,
2009; Torregrosa i wsp., 2006). Fragmentacja DNA plemnika
koreluje z jakością plemnika, zaburzeniami procesu
zapłodnienia, częstością wystąpienia ciąż oraz urodzeń
(Evenson i Wixon, 2006; Evenson i Wixon, 2008; Zhang
i wsp., 2008; Zini, 2011; Zini i wsp., 2011). Ponadto, integralność
plemnikowego DNA jest także silnie związana
z przypadkami nawracających, spontanicznych
poronień (Gil -Villa i wsp., 2010; Kennedy i wsp., 2011;
Kumar i wsp., 2012; Zini, 2011). Najczęściej, w warunkach
naturalnej selekcji (naturalne zapłodnienie, inseminacja
czy też „klasyczne” zapłodnienie in vitro) plemniki
z oksydacyjnym uszkodzeniem DNA, z powodu
dodatkowo występujących uszkodzeń peroksydacyjnych
błony komórkowej, nie są zdolne do zapłodnienia
komórki jajowej. Jednakże, kiedy warunki naturalnej
selekcji zostają pominięte, tak jak to jest w przypadku
procedury docytoplazmatycznej iniekcji plemnika
do komórki jajowej (ICSI, ang. intracytoplasmic sperm
injection), pomimo uszkodzeń oksydacyjnych plemnika
może dojść do zapłodnienia (Twigg i wsp., 1998b).
Oczywiście, w takim przypadku istnieje jeszcze możliwość
naprawy uszkodzonego DNA plemnika przez
mechanizmy naprawcze komórki jajowej, co uzależnione
może być w dużej mierze od jakości samego oocytu
(Meseguer i wsp., 2011). Uważa się jednak, że mechanizmy
naprawcze oocytu są w stanie naprawić np. DNA
zmodyfi kowane adduktami, a możliwości naprawy
pęknięć nici DNA, zarówno jedno -, jak i dwunicowych,
jest w nich ograniczona, co znacząco może wpływać
na proces zapłodnienia (Gonzalez -Marin i wsp., 2012;
Menezo i wsp., 2010). Zastosowanie w przypadku procedury
ICSI dodatkowych metod selekcji plemnika pod
względem morfologicznym (IMSI, ang. intracytoplasmic
morphologically selected sperm injection) oraz ruchliwości,
ocenianej z wykorzystaniem analizy nasienia wspomaganej
komputerowo (CASA, ang. computer assisted sperm
analysis), może ograniczyć zapłodnienie komórki jajowej
plemnikiem ze zwiększoną fragmentacją DNA (Maettner
i wsp., 2014; Sivanarayana i wsp., 2012). Jednakże zawsze
w przypadku możliwości zapłodnienia komórki jajowej
plemnikiem z podwyższoną ilością pęknięć DNA trzeba
brać pod uwagę zwiększone ryzyko wystąpienia poronień,
niepowodzenia w zagnieżdżeniu blastocysty, czy
też kłopotów z donoszeniem ciąży oraz niekorzystnego
wpływu na zdrowie potomstwa (Benchaib i wsp., 2007;
Bungum i wsp., 2007; Davies i wsp., 2012; Hansen i Bower,
2014; Kennedy i wsp., 2011; Robinson i wsp., 2012).
Oprócz jądrowego DNA, uszkodzeniom oksydacyjnym
może podlegać także DNA mitochondrialne (mtDNA, ang.
mitochondrial DNA). W plemnikach można zaobserwować
liczne zaburzenia budowy morfologicznej oraz czynności
mitochondriów, takie jak: zmniejszenie aktywności lub
ekspresji enzymów mitochondrialnych, w tym enzymów
łańcuch oddechowego, zaburzenia oksydoredukcyjne,
obniżony potencjał błony, mutacje, delecje i polimorfi zmy
mtDNA, czy zaburzenia ubikwitynacji mitochondriów
(Piasecka, 2004). Wykazano na przykład, że komórki,
w których obecne jest zmutowane mtDNA, wykazują
niższą czynność mitochondrialnego łańcucha oddechowego
i zwiększoną produkcję rodnika hydroksylowego,
nadtlenku wodoru oraz anionorodnika ponadtlenkowego
(Bogenhagen, 1999; Liu i wsp., 2004; Taylor i Turnbull, 2005).
Ponadto, wykazano związek między RFT, funkcją mitochondriów
a apoptozą, gdzie wysoki poziom RFT powodował
uszkodzenie wewnętrznej i zewnętrznej błony
mitochondrialnej i uwolnienie cytochromu C (Wang i wsp.,
2003). Z kolei cytochrom C aktywuje kaspazy i indukuje
apoptozę komórek, która wzrasta u niepłodnych
mężczyzn z podwyższonym poziomem RFT w nasieniu.
Badania doświadczalne na myszach wykazały, że zaburzenie
czynności łańcucha oddechowego wynikające
z nieprawidłowości w mtDNA prowadzi do zatrzymania
podziałów mejotycznych komórek płciowych, a w konsekwencji
oligozoospermii, astenozoospermii i teratozoospermii
(Nakada i wsp., 2006). Podobnie u ludzi
zaobserwowano, że wzrost ilości mutacji mtDNA może
prowadzić do zaburzeń budowy plemników i ich defektów
ultrastrukturalnych (Shamsi i wsp., 2008).
Suplementacja antyoksydantami –
czy jest uzasadniona?
Analizując badania nad wpływem stresu oksydacyjnego
na płodność męską, wydaje się oczywiste, że istnieją
naukowe przesłanki przemawiające za możliwością
zastosowania suplementacji antyoksydantami
do leczenia męskiej niepłodności. W nasieniu niepłodnych
mężczyzn oznaczano wyższy poziom RFT oraz
niższy poziom antyoksydantów w porównaniu z mężczyznami
płodnymi (Agarwal i wsp., 2004; Aitken i wsp.,
2010; Fraga i wsp., 1991; Iwasaki i Gagnon, 1992; Zini
i wsp., 2009). Również w badaniach in vitro wykazywano,
że wystawienie plemników na działanie RFT lub stymulacja
wytwarzania RFT przez same plemniki powodowały
spadek ich ruchliwości, zaburzenie integralności
błony komórkowej oraz obniżenie jakości DNA, w konsekwencji
prowadząc do obniżenia potencjału zapładniającego
plemników (Aitken i wsp., 1996; Kemal Duru i wsp.,
2000; Miesel i wsp., 1993; Potts i wsp., 2000; Twigg i wsp.,
1998a). Z kolei po dodaniu do medium antyoksydantów
następowało zahamowanie działania RFT, a tym samym
zahamowanie powstawania uszkodzeń oksydacyjnych
w plemnikach (Hong i wsp., 1994; Kobayashi i wsp., 1991;
Parinaud i wsp., 1997; Verma i Kanwar, 1999). Nie dziwi
więc fakt, że w ciągu ostatnich dwóch dekad pojawiły się
liczne badania kliniczne analizujące wpływ suplementacji
antyoksydantami na płodność mężczyzny (Agarwal
i Sekhon, 2010; Gharagozloo i Aitken, 2011; Imamovic
Kumalic i Pinter, 2014; Ko i Sabanegh, 2012; Lombardo
i wsp., 2011; Ross i wsp., 2010; Zini i Al -Hathal, 2011).
Przy tak dużej liczbie badań oczekuje się, że możliwe
będzie ostateczne wykazanie zasadności stosowania
antyoksydantów w niepłodności męskiej. Jednakże
nie jest to zadanie proste, ponieważ w badaniach tych
występuje duże zróżnicowanie dotyczące typu, dawki
oraz czasu podawania antyoksydantów. Ponadto w wielu
z nich kryteria włączenia opierają się głównie na analizie
parametrów podstawowego badania nasienia, a nie parametrów
jednoznacznie wskazujących na występowanie
w nasieniu stresu oksydacyjnego. Kolejnymi słabymi
punktami większości z tych badań jest brak odpowiedniej
grupy kontrolnej, mała liczebność grupy badanej,
czy też różnorodność analizowanych efektów końcowych.
Zwykle były to parametry podstawowego badania
nasienia, takie jak liczba, ruchliwość czy morfologia,
rzadziej testy oceniające np. uszkodzenia oksydacyjne
poszczególnych makromolekuł plemnika, czy też częstość
występowania ciąż i urodzeń. W ostatnich latach
pojawiły się prace przeglądowe zawierające podsumowanie
dotychczasowych badań klinicznych dotyczących
wpływu zażywania różnego rodzaju antyoksydantów na poprawę męskiej płodności (Agarwal i Sekhon, 2010;
Gharagozloo i Aitken, 2011; Imamovic Kumalic i Pinter, 2014;
Ko i Sabanegh, 2012; Lombardo i wsp., 2011; Ross i wsp.,
2010; Zini i Al -Hathal, 2011) (tabela 1a–f).
W jednym z najwcześniejszych z wymienionych artykułów
przeglądowych Ross i wsp. (2010) wybrali do swojej
analizy wyniki 17 artykułów opisujących tylko randomizowane
badania kliniczne, kontrolowane placebo lub
z grupą kontrolną nieotrzymującą leczenia, opublikowane
przed 31 maja 2009 r., w których grupę docelową stanowili
niepłodni mężczyźni (n = 1665). Niestety, z powodu
niejednorodności analizowanych badań nie było możliwe
dokonanie metaanalizy wyników. Kryteriami włączenia
w analizowanych badaniach były niepłodność (4/17
artykułów), astenozoospermia (8/17 artykułów), oligozoospermia
(1/17 artykułów), oligoastenozoospermia
(2/17 artykułów) oraz stopień fragmentacji DNA plemników
(2/17 artykułów). Badanymi antyoksydantami
były: witamina C i E, cynk, selen, kwas foliowy, karnityna,
N -acetyl-cysteina, astaksantyna oraz Menevit
(komercyjnie dostępny zestaw antyoksydantów, w skład
którego wchodzi witamina E i C, cynk, selen, kwas foliowy,
likopen i czosnek), przy czym kuracja antyoksydantami
trwała od 8 do 26 tygodni (mediana: 13 tygodni). We
wszystkich badaniach analizowane efekty końcowe dotyczyły
parametrów badania nasienia (16/17) i/lub częstości
wystąpienia ciąż (10/17) oraz dodatkowo w siedmiu
z nich jako efekt leczenia badano także stres oksydacyjny
plemników. W podsumowaniu autorzy zaznaczają,
że przeprowadzona analiza randomizowanych
badań wskazuje na fakt, że leczenie niepłodnych mężczyzn
antyoksydantami głównie zmniejsza stres oksydacyjny
w nasieniu (7/7 badań) i może powodować poprawę
ruchliwości plemników (10/16 badań), lecz w mniejszym
stopniu oddziałuje na poprawę liczby plemników (5/15
badań) oraz morfologii (2/12 badań). Dodatkowo, w 6
z 10 analizowanych badań, w których jednym z badanych
efektów końcowych była częstość wystąpienia ciąż u partnerek,
zanotowano poprawę tego parametry po podawaniu
antyoksydantów. Jednakże autorzy podkreślają,
że na podstawie przedstawionej analizy nie ma możliwości
wyciagnięcia jednoznacznych wniosków co do tego,
który antyoksydant lub grupa antyoksydantów powinna
być rekomendowana do stosowania w leczeniu męskiej
niepłodności, jaka powinna być dawka każdego z antyoksydantów,
a także czas trwania kuracji. Niestety, wyniki
analizy także nie wskazują jednoznacznie, jaka grupa niepłodnych
mężczyzn najbardziej skorzystałaby na takiej
terapii, chociaż autorzy spekulują, że prawdopodobnie
mogliby to być pacjenci z asteno zoospermią i obniżoną
zdolnością antyoksydacyjną nasienia, a czas trwania
kuracji powinien być dłuższy niż 9 tygodni.
Agarwala i Sekhona (2010) dokonali przeglądu badań
klinicznych, w których grupę badaną stanowili mężczyźni
z idiopatyczną oligoastenoteratozoospermią
(iOAT, ang. idiopathic oligoastenoteratozoospermia). Autorzy
postanowili zastosować do analizy wyników tych badań
systematyczny i jasno sprecyzowany punktowy system
oceny jakości danych i klasyfi kacji siły zaleceń opracowany
przez Grupę Roboczą „GRADE” (ang. Grades of
Recommendation, Assessment, Development, and Evaluation
Working Group). Zastosowanie tego systemu pozwoliło
wykazać, że najwyższa jakość dotychczasowych
dowodów naukowych przemawia za stosowaniem karnityny
w leczeniu iOAT, oraz, choć w mniejszym stopniu,
także za stosowaniem cynku czy witaminy E i C.
W 2011 r. opublikowano kolejne artykuły, w których
dokonano przeglądu aktualnej literatury naukowej
dotyczącej wykorzystania suplementacji antyoksydantami
w męskiej niepłodności. Podobnie jak Ross
i wsp. (2010), także Zini i Al -Hathal (2011) analizowali
randomizowane badania kliniczne dotyczące suplementacji
różnymi antyoksydantami mężczyzn z zaburzoną
płodnością. Najczęściej badanymi antyoksydantami
w artykułach analizowanych przez tych autorów
były witamina C, E, selen, cynk, glutation, L -karnityna
oraz N -acetyl -cysteina. Na 24 analizowane badania w 18
wykazano dodatni wpływ podawanych antyoksydantów
na poprawę parametrów nasienia, głównie ruchliwości
(14/18), koncentracji (12/18), a w najmniejszym stopniu
morfologii (5/18). Z kolei w 6 z 24 analizowanych badań
nie zanotowano żadnych różnic między grupą kontrolną
a grupą badaną. W przypadku poszczególnie analizowanych
antyoksydantów podawanie samej witaminy C
(1 badanie) powodowało poprawę parametrów nasienia.
Poprawę parametrów nasienia, głównie ruchliwości,
uzyskano także 1) w 3 z 6 badań, w których podawano
witaminę E samą lub w połączeniu z witaminą C
lub selenem, 2) w 5 na 5 badań, w których oceniano
wpływ cynku podawanego oddzielnie lub w połączeniu
z kwasem foliowym, 3) w 2 z 3, w których podawano sam
selen lub w połączeniu z N -acetyl-cysteiną, 4) w 3 z 4,
gdzie podawano samą L -karnitynę lub w połączeniu
z L -acetyl -karnityną. Autorzy przeanalizowali także 8
artykułów, w których kryterium włączenia pacjentów
do badań był podwyższony poziom fragmentacji DNA
plemnika lub obecny w nasieniu stres oksydacyjny.
Parametry te wykazują mniejszą biologiczną zmienność
od parametrów badania nasienia i wydają się bardziej
od nich wiarygodne, jeśli chodzi o dobór grupy badanej,
w której suplementacja antyoksydantami mogłaby przynieść
korzyść. Badane antyoksydanty to Menevit (2/8),
a także witamina C i E podawane razem (2/8) lub dodatkowo
w połączeniu z β -karotenem, cynkiem, selenem czy
np. glutationem. We wszystkich badaniach podawanie
antyoksydantów powodowało polepszenie jakości DNA
plemników i w niektórych przypadkach także wzrost
odsetka ciąż po zastosowaniu metod wspomaganego
rozrodu (3/8).
Lombardo i wsp. (2011) wybrali do swojej analizy 78
artykułów, w których badano wpływ antyoksydantów
na męską płodność w badaniach klinicznych in vivo
(40 badań) oraz w modelach in vitro (38 badań). Jeśli
chodzi o badania kliniczne, jednym z głównych zarzutów

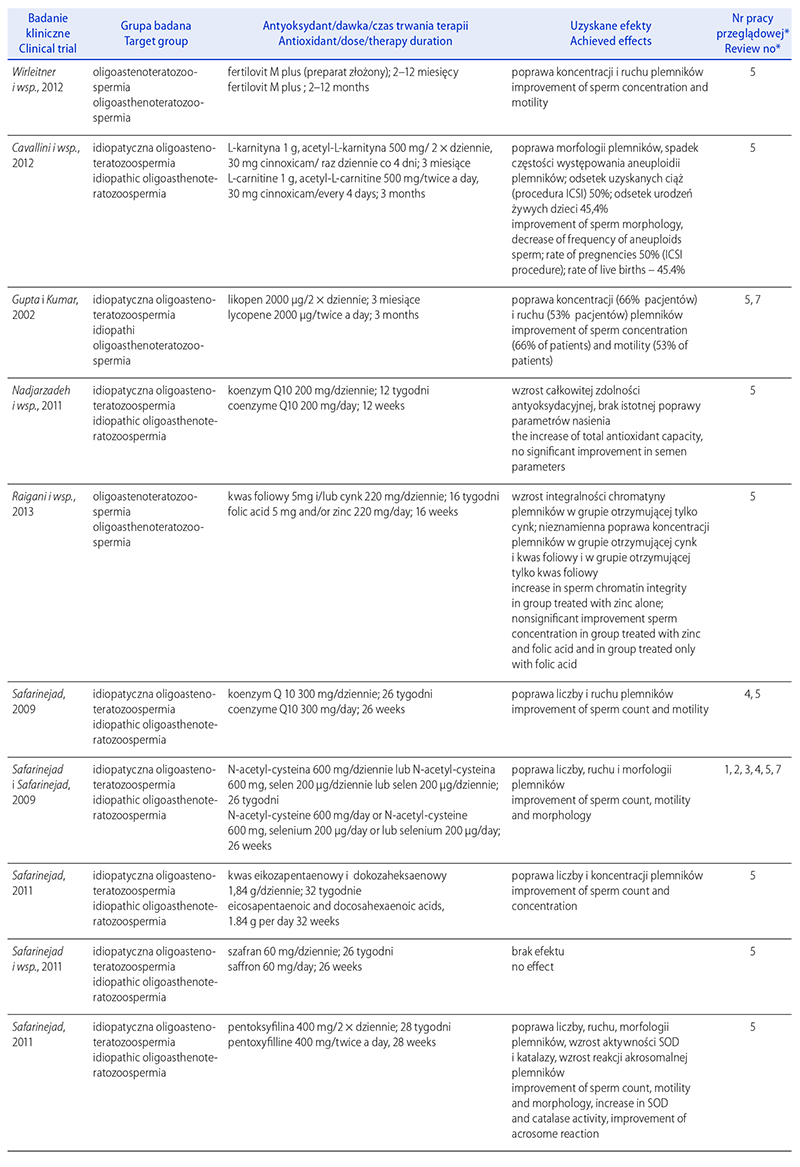
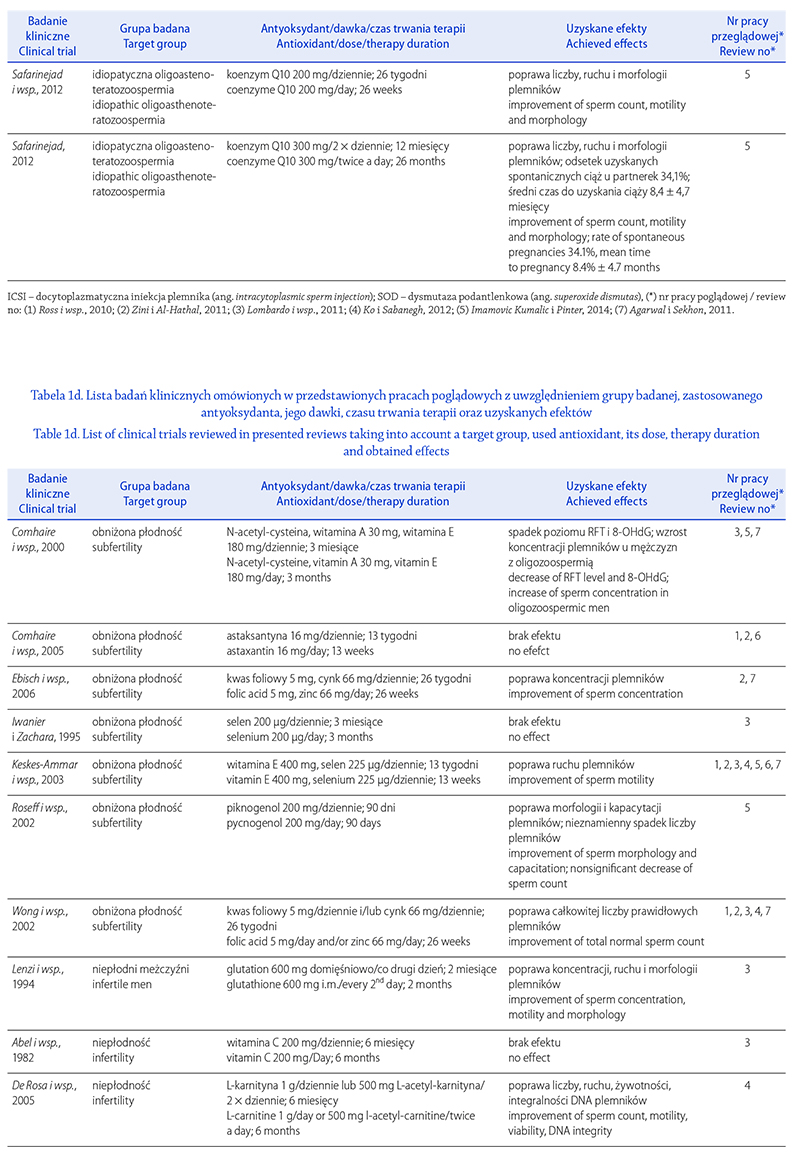
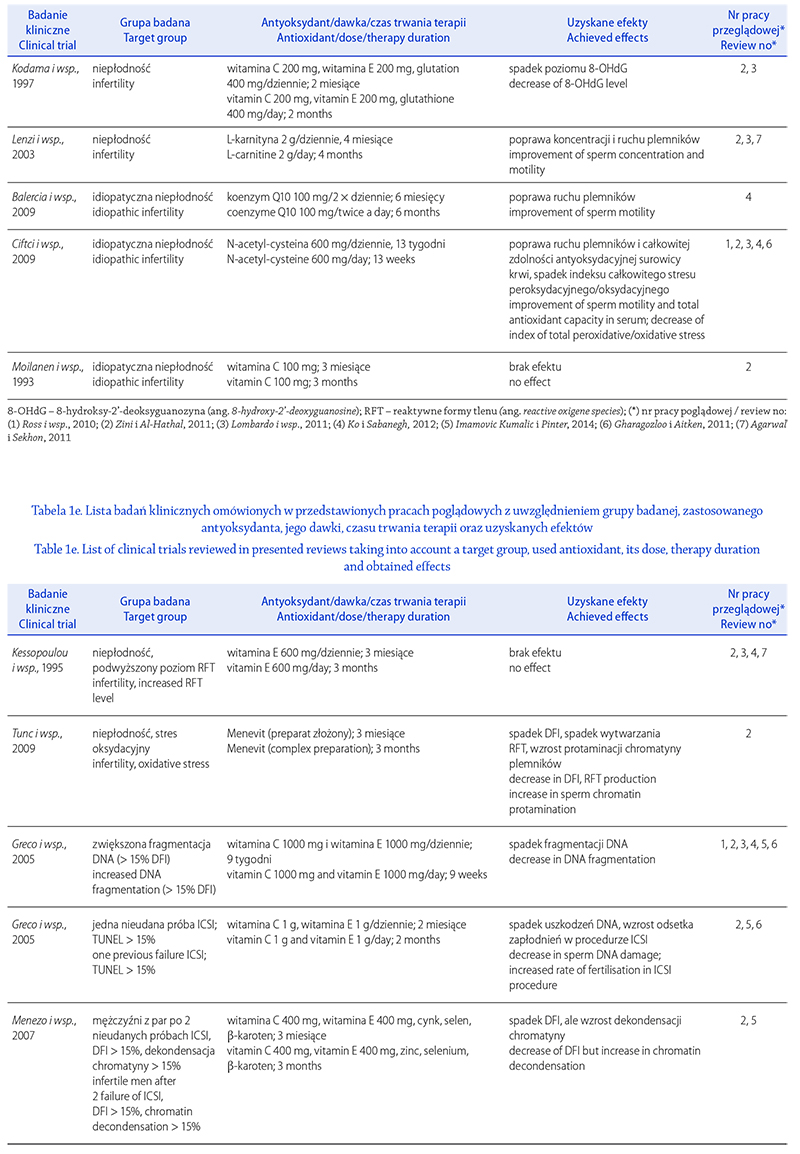
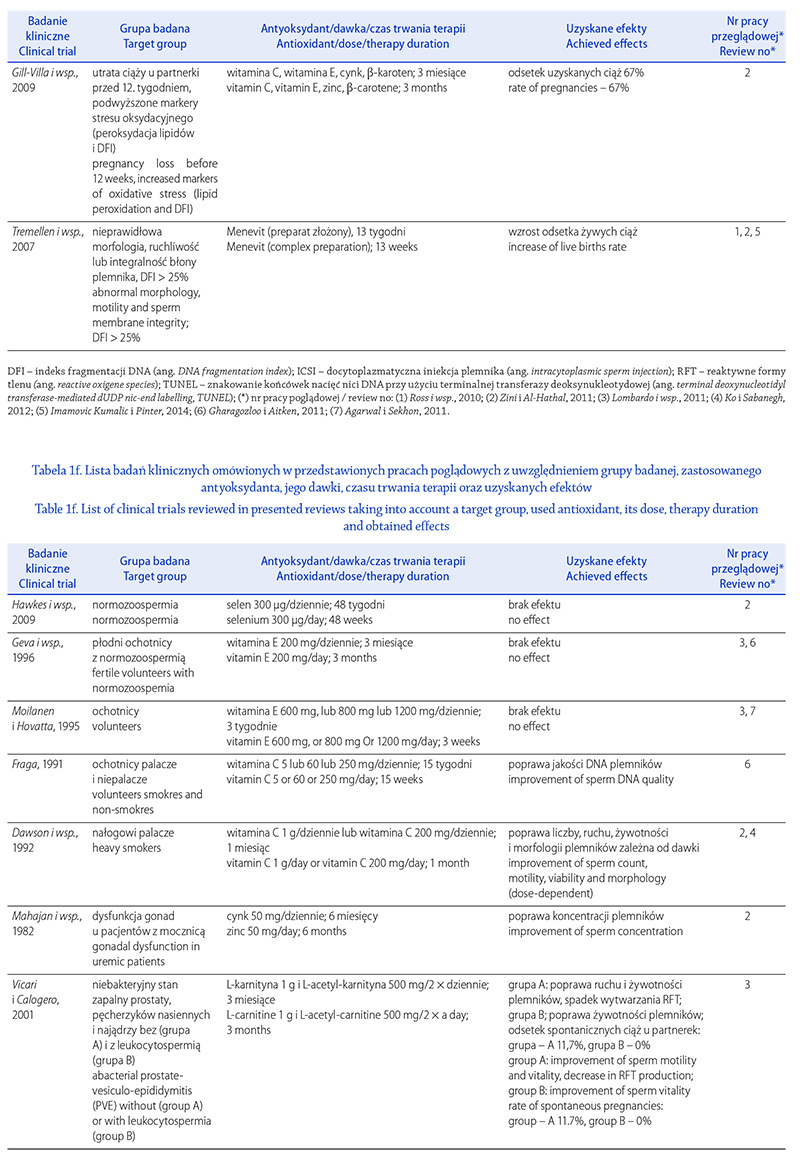

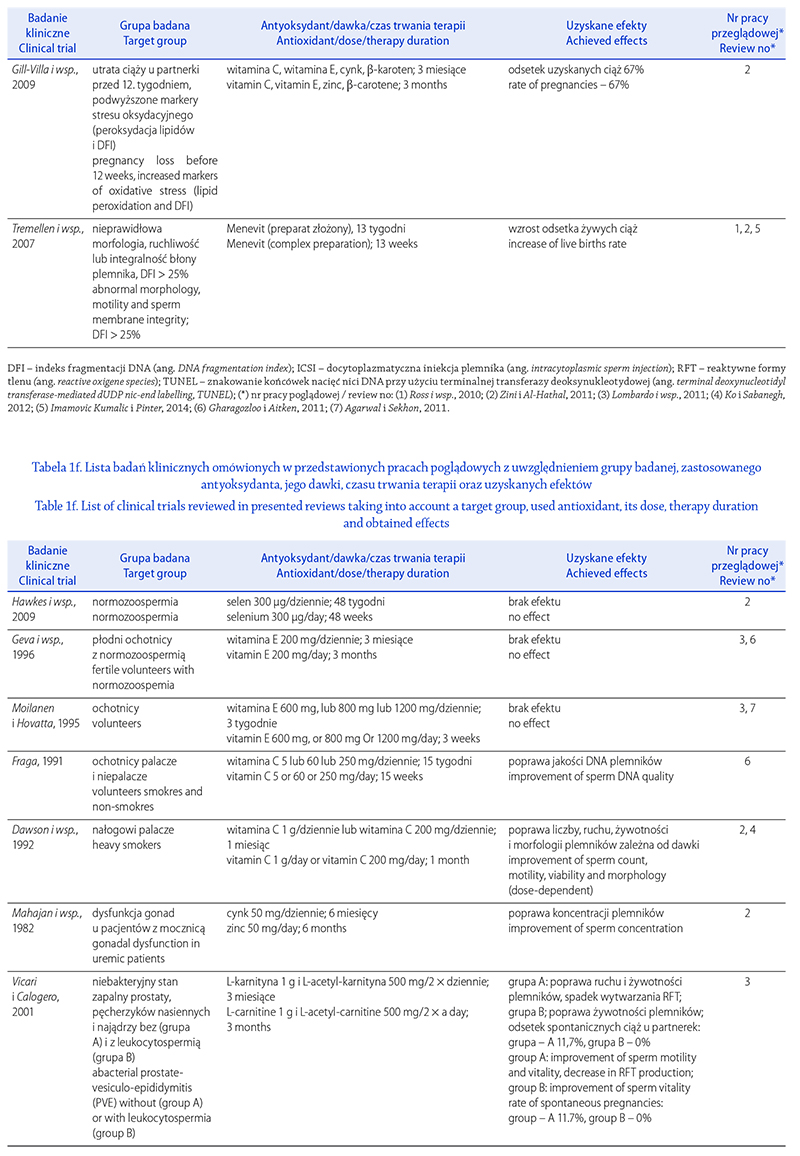
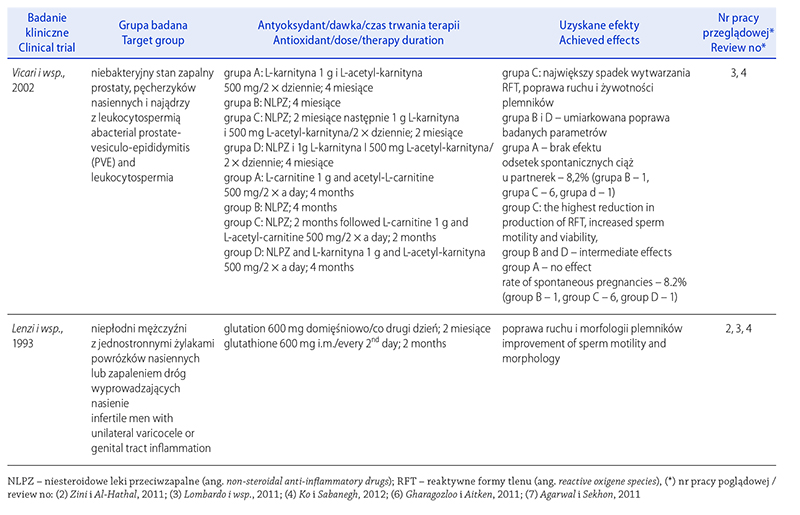
NLPZ – niesteroidowe leki przeciwzapalne (ang. non-steroidal anti-infl ammatory drugs); RFT – reaktywne formy tlenu (ang. reactive oxigene species), (*) nr pracy poglądowej /
review no: (2) Zini i Al-Hathal, 2011; (3) Lombardo i wsp., 2011; (4) Ko i Sabanegh, 2012; (6) Gharagozloo i Aitken, 2011; (7) Agarwal i Sekhon, 2011
przedstawionych przez autorów dotyczących jakości
metodologicznej większości z nich był brak oceny częstości
wystąpienia ciąż u partnerek jako kluczowego
efektu końcowego. Wskazywali oni na fakt, że poprawa
parametrów badania nasienia stosowana najczęściej jako
oceniany efekt końcowy terapii nie zawsze przekłada się
na uzyskanie ciąży u partnerki, gdyż mężczyźni z prawidłowymi
parametrami nasienia mogą w dalszym ciągu
wykazywać obniżony potencjał zapładniający. Wśród
analizowanych przez autorów artykułów w 15 raportowano
odsetek uzyskanych ciąż jako efekt końcowy
terapii antyoksydantami. W dwóch uzyskano wyższy
odsetek uzyskanych ciąż, jednak nie był on znamienny
statystycznie. W dwóch następnych badaniach grupa
mężczyzn, której podawano witaminę C, była porównywana
z grupą mężczyzn, którzy otrzymywali cytrynian
klomifenu (selektywny modulator receptora estrogenowego)
lub mesterolon (pochodna dihydrotestosteronu
o silnym działaniu androgennym). Odsetek ciąż
był niższy w grupach mężczyzn otrzymujących witaminę
C. W dwóch kolejnych badaniach nie zanotowano
żadnego wpływu podawania antyoksydantów na odsetek
uzyskanych ciąż, jednak w pozostałych badaniach był
on statystycznie znamiennie wyższy w grupach mężczyzn
leczonych antyoksydantami. W czterech badaniach,
w których zanotowano wzrost odsetka uzyskanych
ciąż, uzyskano także poprawę co najmniej jednego
z parametrów nasienia i zawsze wśród tych parametrów
poprawie ulegała ruchliwość plemników. Wydaje
się, że anty oksydantami, których podawanie zwiększa
odsetek ciąż, są witamina A, E i karnityna. Dodatkowo,
autorzy tego przeglądu podkreślają fakt, że znaczne
obniżenie poziomu RFT poprzez egzogenne antyoksydanty
może wpływać negatywnie na płodność mężczyzn,
jako że RFT są niezbędne w procesach prowadzących
do uzyskania przez plemnik zdolności do zapłodnienia
komórki jajowej (kapacytacja, hiperaktywacj, reakcja
akrosomalna).
Gharagozloo i Aitken (2011) postanowili przyjrzeć się
dokładniej badaniom klinicznym nad efektem podawania
antyoksydantów na stres oksydacyjny w plemnikach
lub uszkodzenie ich DNA. Na 20 analizowanych
badań w 19 wykazano znamienną redukcję stresu
oksydacyjnego lub poprawę jakości DNA w plemnikach
po zastosowaniu terapii antyoksydantami. Spośród parametrów
badania nasienia w żadnym z badań nie zaobserwowano
wpływu antyoksydantów na poprawę morfologii,
a tylko w 3 zanotowano poprawę koncentracji
plemników. Z kolei w 10 z 16 badań zanotowano poprawę
ruchliwości plemników, przy czym warto zauważyć,
że parametr ten ulegał zawsze poprawie, gdy terapii
poddana była grupa mężczyzn, u których kryterium
włączenia do badania była astenozoospermia (7 badań).
W 10 z analizowanych badań jednym z badanych efektów
końcowych był odsetek uzyskanych ciąż i w 6 z nich było
on wyższy po podawaniu antyoksydantów. Biorąc także
po uwagę fakt, że parametry nasienia mogą ulec poprawie
po zastosowaniu antyoksydantów o właściwościach hydrofi lowych, jak i lipofi lowych, autorzy podsumowania
postanowili dokładniej przeanalizować wpływ
łącznego podawania antyoksydantów pochodzących
z tych dwóch grup, włączając do analizy 12 artykułów.
Witamina E, antyoksydant lipofi lowy, była najczęściej
używana w badaniach razem z takimi antyoksydantami
hydrofi lowymi jak witamina C, selen czy cynk.
Niestety, wyniki uzyskane z tych badań odzwierciedlają
te uzyskane po podawaniu antyoksydantów pojedynczo,
co nie potwierdziło spodziewanego synergistycznego
lub też addytywnego efektu ich łącznego podawania.
Podsumowując, autorzy jednoznacznie wskazują na to,
że terapia antyoksydantami redukuje stres oksydacyjny
w nasieniu i wpływa na poprawę ruchliwości u pacjentów
z athenozoospermią, jednakże nie można jednoznacznie
stwierdzić, czy efekty te przekładają się na uzyskanie
ciąż i ich donoszenie.
W kolejnym podsumowaniu Ko i Sabanegh (2012)
wybrali do swojej analizy 22 randomizowane badania
kliniczne z ostatnich 30 lat, w których badanymi antyoksydantami
były między innymi karnityny, koenzym
Q10, kwas foliowy, glutation, likopen, N -acetyl-cysteina,
witaminy A, C i E oraz selen i cynk. Autorzy analizując
dodatkowo inne dostępne badania dotyczące źródeł
badanych antyoksydantów w pożywieniu, ich zalecanego
dziennego spożycia (RDA, ang. recommended
dietary allowance) oraz biodostępności przy doustnym
przyjmowaniu, a także skutków ubocznych, pokusili
się o wyciągnięcie wniosków na temat ich optymalnej
dawki przy leczeniu męskiej niepłodności. I tak, według
analizy przedstawionej przez autorów artykułu, wydaje
się, że w przypadku karnityn dawka nieprzekraczająca
3 g/dziennie przedstawia potencjalne korzyści
przy leczeniu męskiej niepłodności. Kwas foliowy jest
dobrze tolerowany w dawce nieprzekraczającej 1 mg/
dziennie, podczas gdy 5 mg może powodować już skutki
uboczne. Z drugiej strony już dawki 800–1200 μg mogą
być przyczyną wzrostu ryzyka zawału mięśnia sercowego
u pacjentów kardiologicznych. Autorzy dodatkowo
sugerują, że chociaż kwas foliowy jest potrzebny dla prawidłowego
przebiegu spermatogenezy, to nie ma przekonujących
dowodów na to, że jego dodatkowe spożycie,
ponad RDA, które zapewnia zbilansowana dieta, wpłynie
korzystnie na męska płodność. Jeśli chodzi o koenzym
Q10, to wydaje się, że optymalna dawka mieści się
w zakresie 200–300 mg/dzień i w niektórych przypadkach
może ona być zwiększona do 12 mg/kg/dzień.
Chociaż suplementacja glutationem nieprzekraczająca
3 g/dziennie nie wykazuje skutków ubocznych, a sam
glutation wpływa korzystnie na jakość nasienia, to jego
niska biodostępność po doustnym spożyciu i potrzeba
przyjmowania go w postaci domięśniowych wstrzyknięć
powoduje, że jego wykorzystanie w terapii męskiej
niepłodności jest ograniczone. Jeśli chodzi o likopen,
to wydaje się, że jego dodatkowa suplementacja przy
diecie bogatej w pomidory jest niepotrzebna, chociaż
można rozważyć jej stosowanie przy diecie ubogiej lub
z różnych innych względów niezawierającej pomidorów.
Optymalną dawką dla N -acetyl-cysteiny wydaje się być
600 mg/dzień. Jednakże podobnie jak przy glutationie,
chociaż wydaje się ona wpływać dodatnio na męską płodność,
to niska biodostępność przy doustnym przyjmowaniu,
a także poważne skutki uboczne ograniczają jej
wykorzystanie. Jest mało prawdopodobne, aby przyjmowanie
witaminy A w dawce 10000 IU/dziennie powodowało
wystąpienie skutków ubocznych. Jednakże odkłada
się ona w organizmie i przy długotrwałym przyjmowaniu
wysokich dawek (więcej niż 4000 IU/kg/dzień)
może dojść do wystąpienia poważnych skutków ubocznych.
Chociaż brak jest danych dotyczących wpływu
podawania samej witaminy A na męską płodność, to jej
podawanie wraz z innymi antyoksydantami (witamina
E, C, selen, N -acetylcysteina, cynk) wykazywało
dodatni efekt na parametry nasienia takie jak ruchliwość
plemników. Autorzy podsumowania sugerują
jednak, że nie ma jednoznacznych wskazań do dodatkowej
suplementacji witaminą A przy odpowiednim
spożyciu bogatych w nią produktów spożywczych.
Z kolei, według autorów dawka witaminy C nie powinna
przekraczać 500 mg/dziennie, a optymalna dawka dla
witaminy E powinna być niższa niż 1000 mg/dziennie
(1600 IU/dziennie). Z powodu możliwości wystąpienia
poważnych hematologicznych i sercowo -naczyniowych
skutków ubocznych autorzy rekomendują dawkę dla
witaminy E w zakresie 200–400 IU/dziennie. Optymalna
dawka dla suplementacji selenem wydaje się mieścić
między 100 a 210 μg/dziennie. Dla cynku RDA wynosi
11 mg/dziennie, a potencjalne efekty uboczne mogą być
obserwowane przy 200 mg, z kolei poważne działania
niepożądane przy dawce większej niż 450 mg/dziennie.
Podsumowując, autorzy tego opracowania przestrzegają
przed powszechnym używaniem suplementów diety czy
witamin sprzedawanych bez recepty w dawkach przekraczających
RDA, wskazując przy tym, że dawki te mogą
być uzyskane przez odpowiednio zbilansowaną dietę.
W opublikowanym w ostatnim czasie przeglądzie
piśmiennictwa Imamaovic Kumalic i Pinter (2014) przeanalizowali
32 badania kliniczne opublikowane w okresie
od 1 stycznia 2000 r. do 31 grudnia 2013 r., badające
wpływ podawania antyoksydantów u mężczyzn z iOAT.
W 13 z nich wykazano dodatni wpływ badanych antyoksydantów
na koncentrację plemników, przy czym
w większości tych badań pacjenci otrzymywali połączenie
różnych antyoksydantów, tj.: L -karnityny, koenzymu
Q10, witaminy E i C, cynku czy selenu. Podobnie jak
w poprzednich podsumowaniach, poprawę ruchliwości
plemników zanotowano w największej ilości analizowanych
badań (20/32), przy czym, podobnie jak przy
koncentracji plemników, pacjenci otrzymywali terapię
łączoną, w której głównymi składnikami były witamina
E i selen. Poprawę morfologii plemników wykazano
w 10 z analizowanych publikacji. Niestety, pomimo
wykorzystania do swojej analizy nowszych badań niż
te analizowane w poprzednich podsumowaniach (16 badań opublikowanych w latach 2010–2013, nieanalizowane
w poprzednich podsumowaniach) w dalszym ciągu
tylko w 6 analizowano jako efekt końcowy jakość plemnikowego
DNA, przy czym w każdym z nich zanotowano
poprawę badanego parametru oceniającego fragmentację
DNA czy integralność chromatyny. Badane antyoksydanty,
które wpływały na jakość DNA, to głównie witamina
C i E podawane łącznie oraz cynk i selen. W podsumowaniu
autorzy wskazują, że korzystny wpływ
na parametry nasienia w przypadku iOAT miały głównie
koenzym Q10, witamina E, C, selen, i N -acetyl-cysteina.
W przypadku oligozoospermii najczęściej dodatni wpływ
był udokumentowany dla witaminy E i koenzymu Q10,
w przypadku astenozoospermii – witaminy E, selenu
i koenzymu Q10, a w przypadku teratozoospermii –
selenu i koenzymu Q10.
Stres oksydacyjny uważany jest obecnie za jedną
z głównych przyczyn męskiej niepłodności. Jego obecność
koreluje z zaburzeniem ruchliwości, liczby, morfologii
i czynności plemników. Wiele badań wykazało
dodatni wpływ podawania różnych substancji, o udowodnionym
działaniu antyoksydacyjnym, na poprawę
parametrów nasienia, czynności plemników czy odsetek
uzyskanych ciąż u partnerek. I tak, antyoksydanty takie
jak witamina E, C, selen, cynk, karnityna, wydają się
korzystnie wpływać na poprawę parametrów nasienia
oraz jakości plemników w wyniku zmniejszania poziomu
RFT, spadku peroksydacji lipidów błon komórkowych
i uszkodzeń DNA. Jednakże w badaniach tych występuje
duże zróżnicowanie, jeśli chodzi o typ, dawki oraz
czas podawania antyoksydantów, przy czym w wielu
z nich kryteria włączenie opierają się głównie na analizie
parametrów podstawowego badania nasienia, a nie
na parametrach jednoznacznie wskazujących na występowanie
w nasieniu stresu oksydacyjnego. Dodatkowo,
grupy badane były mało liczne, często bez odpowiedniej
kontroli, a analizowane efekty końcowe dotyczą głównie
parametrów badania nasienia rzadziej, odsetka uzyskanych
i donoszonych ciąż. Tak więc, zanim suplementacja
antyoksydantami wejdzie do rutynowego postępowania
medycznego w leczeniu męskiej niepłodności, niezbędne
są, po pierwsze, ogólna dostępność badań diagnostycznych
oceniających stres oksydacyjny w nasieniu i plemnikach,
po drugie, przeprowadzenie dużych, randomizowanych,
kontrolowanych placebo, wieloośrodkowych badań
potwierdzających, że okołokoncepcyjna suplementacja
mężczyzn poszczególnymi antyoksydantami powoduje
poprawę parametrów nasienia i czynności plemników
oraz istotny wzrost odsetka żywych urodzeń u ich partnerek.
Podziękowania
Praca napisana w ramach grantu Uniwersytetu Medycznego
w Łodzi nr 503/1 -089 -03/503 -01 i grantu NCN
nr UMO -2012/05/B/NZ5/01308
Piśmiennictwobr
Abd -Elmoaty M.A., Saleh R., Sharma R., Agarwal A.: Increased levels of oxidants
and reduced antioxidants in semen of infertile men with varicocele.
Fertil Steril. 2010, 94, 1531–1534.
Agarwal A., Makker K., Sharma R.: Clinical relevance of oxidative stress in male
factor infertility: an update. Am J Reprod Immunol. 2008, 59, 2–11.
Agarwal A., Nallella K.P., Allamaneni S.S., Said T.M.: Role of antioxidants in
treatment of male infertility: an overview of the literature. Reprod Biomed
Online. 2004, 8, 616–627.
Agarwal A., Sekhon L.H.: Th e role of antioxidant therapy in the treatment of
male infertility. Hum Fertil (Camb). 2010, 13, 217–225.
Agarwal A., Virk G., Ong C., du Plessis S.S.: Eff ect of oxidative stress on male
reproduction. World J Mens Health. 2014, 32, 1–17.
Aitken R.J., Buckingham D.W., Carreras A., Irvine D.S.: Superoxide dismutase
in human sperm suspensions: relationship with cellular composition, oxidative
stress, and sperm function. Free Radic Biol Med. 1996, 21, 495–504.
Aitken R.J., Buckingham D., Harkiss D.: Use of a xanthine oxidase free radical
generating system to investigate the cytotoxic eff ects of reactive oxygen
species on human spermatozoa. J Reprod Fertil. 1993a, 97, 441–450.
Aitken R.J., Clarkson J.S., Hargreave T.B., Irvine D.S., Wu F.C.: Analysis of the
relationship between defective sperm function and the generation of reactive
oxygen species in cases of oligozoospermia. J Androl. 1989, 10, 214–220.
Aitken R.J., De Iuliis G.N.: On the possible origins of DNA damage in human
spermatozoa. Mol Hum Reprod. 2010, 16, 3–13.
Aitken R.J., De Iuliis G.N., Finnie J.M., Hedges A., McLachlan R.I.: Analysis
of the relationships between oxidative stress, DNA damage and sperm
vitality in a patient population: development of diagnostic criteria. Hum
Reprod. 2010, 25, 2415–2426.
Aitken R.J., Fisher H.M., Fulton N., Gomez E., Knox W., Lewis B. i wsp.: Reactive
oxygen species generation by human spermatozoa is induced by exogenous
NADPH and inhibited by the fl avoprotein inhibitors diphenylene iodonium
and quinacrine. Mol Reprod Dev. 1997, 47, 468–482.
Aitken R.J., Harkiss D., Buckingham D.: Relationship between iron -catalysed
lipid peroxidation potential and human sperm function. J Reprod Fertil.
1993b, 98, 257–265.
Aitken R.J., Smith T.B., Jobling M.S., Baker M.A., De Iuliis G.N.: Oxidative stress
and male reproductive health. Asian J Androl. 2014, 16, 31–38.
Aitken R.J., Whiting S., De Iuliis G.N., McClymont S., Mitchell L.A., Baker M.A.:
Electrophilic aldehydes generated by sperm metabolism activate mitochondrial
reactive oxygen species generation and apoptosis by targeting succinate
dehydrogenase. J Biol Chem. 2012, 287, 33048–33060.
Alvarez J.G., Storey B.T.: Diff erential incorporation of fatty acids into and
peroxidative loss of fatty acids from phospholipids of human spermatozoa.
Mol Reprod Dev. 1995, 42, 334–346.
Alvarez J.G., Touchstone J.C., Blasco L., Storey B.T.: Spontaneous lipid peroxidation
and production of hydrogen peroxide and superoxide in human
spermatozoa. Superoxide dismutase as major enzyme protectant against
oxygen toxicity. J Androl. 1987, 8, 338–348.
Aoki V.W., Emery B.R., Liu L., Carrell D.T.: Protamine levels vary between
individual sperm cells of infertile human males and correlate with viability
and DNA integrity. J Androl. 2006, 27, 890–898.
Appasamy M., Muttukrishna S., Pizzey A.R., Ozturk O., Groome N.P., Serhal P. i wsp.:
Relationship between male reproductive hormones, sperm DNA damage and markers
of oxidative stress in infertility. Reprod Biomed Online. 2007, 14, 159–165.
Atig F., Kerkeni A., Saad A., Ajina M.: Eff ects of reduced seminal enzymatic
antioxidants on sperm DNA fragmentation and semen quality of Tunisian
infertile men. J Assist Reprod Genet. 2013, doi: 10.1007/s10815 -013 -9936 -x.
Atig F., Raff a M., Ali H.B., Abdelhamid K., Saad A., Ajina M.: Altered antioxidant
status and increased lipid per -oxidation in seminal plasma of tunisian
infertile men. Int J Biol Sci. 2012, 8, 139–149.
Benchaib M., Lornage J., Mazoyer C., Lejeune H., Salle B., Francois Guerin
J.: Sperm deoxyribonucleic acid fragmentation as a prognostic indicator
of assisted reproductive technology outcome. Fertil Steril. 2007, 87,
93–100.
Benedetti S., Tagliamonte M.C., Catalani S., Primiterra M., Canestrari F.,
De Stefani S. i wsp.: Diff erences in blood and semen oxidative status in fertile
and infertile men, and their relationship with sperm quality. Reprod
Biomed Online. 2012, 25, 300–306.
Bogenhagen D.F.: Repair of mtDNA in vertebrates. Am J Hum Genet. 1999,
64, 1276–1281.
Bungum M., Humaidan P., Axmon A., Spano M., Bungum L., Erenpreiss J. i wsp.:
Sperm DNA integrity assessment in prediction of assisted reproduction
technology outcome. Hum Reprod. 2007, 22, 174–179.
Cummins J.M., Jequier A.M., Kan R.: Molecular biology of human male infertility:
links with aging, mitochondrial genetics, and oxidative stress? Mol
Reprod Dev. 1994, 37, 345–362.
D’Autreaux B., Toledano M.B.: ROS as signalling molecules: mechanisms
that generate specifi city in ROS homeostasis. Nat Rev Mol Cell Biol. 2007,
8, 813–824.
Davies M.J., Moore V.M., Willson K.J., Van Essen P., Priest K., Scott H. i wsp.:
Reproductive technologies and the risk of birth defects. N Engl J Med. 2012,
366, 1803–1813.
De Iuliis G.N., Th omson L.K., Mitchell L.A., Finnie J.M., Koppers A.J.,
Hedges A. i wsp.: DNA damage in human spermatozoa is highly correlated
with the effi ciency of chromatin remodeling and the formation of
8 -hydroxy -2’ -deoxyguanosine, a marker of oxidative stress. Biol Reprod.
2009, 81, 517–524.
Erenpreiss J., Elzanaty S., Giwercman A.: Sperm DNA damage in men from
infertile couples. Asian J Androl. 2008, 10, 786–790.
Evenson D.P., Wixon R.: Data analysis of two in vivo fertility studies using
Sperm Chromatin Structure Assay -derived DNA fragmentation index vs.
pregnancy outcome. Fertil Steril. 2008, 90, 1229–1231.
Evenson D., Wixon R.: Meta -analysis of sperm DNA fragmentation using
the sperm chromatin structure assay. Reprod Biomed Online. 2006, 12,
466–472.
Fraga C.G., Motchnik P.A., Shigenaga M.K., Helbock H.J., Jacob R.A., Ames B.N.:
Ascorbic acid protects against endogenous oxidative DNA damage in human
sperm. Proc Natl Acad Sci U S A. 1991, 88, 11003–11006.
Frączek M., Kurpisz M.: Stres oksydacyjny w nasieniu. W: Układ płciowy
męski. Badania kliniczne i doświadczalne. Red. M. Piasecka Wydawnictwo
Pomorskiego Uniwersytetu Medycznego w Szczecinie. Szczecin, 2013.
Gharagozloo P., Aitken R.J.: Th e role of sperm oxidative stress in male infertility
and the signifi cance of oral antioxidant therapy. Hum Reprod. 2011,
26, 1628–1640.
Gil -Guzman E., Ollero M., Lopez M.C., Sharma R.K., Alvarez J.G., Th omas A.J.,
Jr. i wsp.: Diff erential production of reactive oxygen species by subsets of
human spermatozoa at diff erent stages of maturation. Hum Reprod. 2001,
16, 1922–1930.
Gil -Villa A.M., Cardona -Maya W., Agarwal A., Sharma R., Cadavid A.: Assessment
of sperm factors possibly involved in early recurrent pregnancy loss. Fertil
Steril. 2010, 94, 1465–1472.
Gonzalez -Marin C., Gosalvez J., Roy R.: Types, causes, detection and repair
of DNA fragmentation in animal and human sperm cells. Int J Mol Sci.
2012, 13, 14026–14052.
Griveau J.F., Dumont E., Renard P., Callegari J.P., Le Lannou D.: Reactive oxygen
species, lipid peroxidation and enzymatic defence systems in human
spermatozoa. J Reprod Fertil. 1995, 103, 17–26.
Grosicka -Maciąg E.: Biological consequences of oxidative stress induced by
pesticides. Postepy Hig Med Dosw (Online). 2011, 65, 357–366.
Guz J., Gackowski D., Foksiński M., Różalski R., Zarakowska E., Siomek A. i wsp.:
Comparison of oxidative stress/DNA damage in semen and blood of fertile and
infertile men. PLoS One. 2013, 8, e68490. doi: 10.1371/journal.pone.0068490
.
Hansen M., Bower C.: Th e impact of assisted reproductive technologies
on intra -uterine growth and birth defects in singletons. Semin Fetal Neonatal
Med. 2014, 19, 228–233.
Hong C.Y., Lee M.F., Lai L.J., Wang C.P.: Eff ect of lipid peroxidation on beating
frequency of human sperm tail. Andrologia. 1994, 26, 61–65.
Hsieh Y.Y., Chang C.C., Lin C.S.: Seminal malondialdehyde concentration but
not glutathione peroxidase activity is negatively correlated with seminal
concentration and motility. Int J Biol Sci. 2006, 2, 23–29.
Imamovic Kumalic S., Pinter B.: Review of clinical trials on eff ects of
oral antioxidants on basic semen and other parameters in idiopathic
oligo asthenoteratozoospermia. Biomed Res Int. 2014, 2014, doi:
10.1155/2014/426951
Iwasaki A., Gagnon C.: Formation of reactive oxygen species in spermatozoa
of infertile patients. Fertil Steril. 1992, 57, 409–416.
Jędrzejczak P., Frączek M., Szumała -Kąkol A., Taszarek -Hauke G., Pawelczyk L.,
Kurpisz M.: Consequences of semen infl ammation and lipid peroxidation
on fertilization capacity of spermatozoa in in vitro conditions. Int J Androl.
2005, 28, 275–283.
Kazienko A., Piasecka M., Rymaszewska A., Gączarzewicz D., Kurzawa R.,
Frączek M. i wsp.: Molekularne markery niepłodności męskiej: zaburzenia
transkrypcji i translacji protamin chromatyny plemnika – cześc II. Post
Biol Kom. 2012, 39, 371–394.
Kemal Duru N., Morshedi M., Oehninger S.: Eff ects of hydrogen peroxide
on DNA and plasma membrane integrity of human spermatozoa. Fertil
Steril. 2000, 74, 1200–1207.
Kennedy C., Ahlering P., Rodriguez H., Levy S., Sutovsky P.: Sperm chromatin
structure correlates with spontaneous abortion and multiple pregnancy rates
in assisted reproduction. Reprod Biomed Online. 2011, 22, 272–276.
Khosravi F., Valojerdi M.R., Amanlou M., Karimian L., Abolhassani F.: Relationship
of seminal reactive nitrogen and oxygen species and total antioxidant capacity
with sperm DNA fragmentation in infertile couples with normal and
abnormal sperm parameters. Andrologia. 2012, doi: 10.1111/and.12034.
Ko E.Y., Sabanegh E.S., Jr.: Th e role of over -the -counter supplements for
the treatment of male infertility – fact or fi ction? J Androl. 2012, 33,
292–308.
Kobayashi T., Miyazaki T., Natori M., Nozawa S.: Protective role of superoxide
dismutase in human sperm motility: superoxide dismutase activity and
lipid peroxide in human seminal plasma and spermatozoa. Hum Reprod.
1991, 6, 987–991.
Kumar K., Deka D., Singh A., Mitra D.K., Vanitha B.R., Dada R.: Predictive value
of DNA integrity analysis in idiopathic recurrent pregnancy loss following
spontaneous conception. J Assist Reprod Genet. 2012, 29, 861–867.
de Lamirande E., Gagnon C.: Reactive oxygen species and human spermatozoa.
I. Eff ects on the motility of intact spermatozoa and on sperm axonemes.
J Androl. 1992a, 13, 368–378.
de Lamirande E., Gagnon C.: Reactive oxygen species and human spermatozoa.
II. Depletion of adenosine triphosphate plays an important role in the
inhibition of sperm motility. J Androl. 1992b, 13, 379–386.
Lewis S.E., Sterling E.S., Young I.S., Th ompson W.: Comparison of individual
antioxidants of sperm and seminal plasma in fertile and infertile men.
Fertil Steril. 1997, 67, 142–147.
Liu C.Y., Lee C.F., Hong C.H., Wei Y.H.: Mitochondrial DNA mutation and
depletion increase the susceptibility of human cells to apoptosis. Ann N Y
Acad Sci. 2004, 1011, 133–145.
Lombardo F., Sansone A., Romanelli F., Paoli D., Gandini L., Lenzi A.: Th e role
of antioxidant therapy in the treatment of male infertility: an overview.
Asian J Androl. 2011, 13, 690–697.
Maettner R., Sterzik K., Isachenko V., Strehler E., Rahimi G., Alabart J.L. i wsp.:
Quality of human spermatozoa: relationship between high -magnifi cation
sperm morphology and DNA integrity. Andrologia. 2014, 46, 547–555.
Mahanta R., Gogoi A., Chaudhury P.N., Roy S., Bhattacharyya I.K., Sharma P.:
Association of oxidative stress biomarkers and antioxidant enzymatic activity
in male infertility of north -East India. J Obstet Gynaecol India. 2012,
62, 546–550.
Mehdi M., Khantouche L., Ajina M., Saad A.: Detection of DNA fragmentation
in human spermatozoa: correlation with semen parameters. Andrologia.
2009, 41, 383–386.
Meister A.: Glutathione metabolism and its selective modifi cation. J Biol
Chem. 1988, 263, 17205–17208.
Menezo Y., Dale B., Cohen M.: DNA damage and repair in human oocytes
and embryos: a review. Zygote. 2010, 18, 357–365.
Meseguer M., Santiso R., Garrido N., Garcia -Herrero S., Remohi J., Fernandez J.L.:
Eff ect of sperm DNA fragmentation on pregnancy outcome depends
on oocyte quality. Fertil Steril. 2011, 95, 124–128.
Miesel R., Jęrzejczak P.J., Kurpisz M.: Oxidative stress during the interaction
of gametes. Biol Reprod. 1993, 49, 918–923.
Nakada K., Sato A., Yoshida K., Morita T., Tanaka H., Inoue S. i wsp.:
Mitochondria -related male infertility. Proc Natl Acad Sci U S A. 2006, 103,
15148–15153.
Oleszczuk K., Augustinsson L., Bayat N., Giwercman A., Bungum M.: Prevalence
of high DNA fragmentation index in male partners of unexplained infertile
couples. Andrology. 2013, 1, 357–360.
Ollero M., Gil -Guzman E., Lopez M.C., Sharma R.K., Agarwal A., Larson K. i wsp.:
Characterization of subsets of human spermatozoa at diff erent stages of
maturation: implications in the diagnosis and treatment of male infertility.
Hum Reprod. 2001, 16, 1912–1921.
Parinaud J., Le Lannou D., Vieitez G., Griveau J.F., Milhet P., Richoilley G.:
Enhancement of motility by treating spermatozoa with an antioxidant solution
(Sperm -Fit) following ejaculation. Hum Reprod. 1997, 12, 2434–2436.
Pasqualotto F.F., Sharma R.K., Nelson D.R., Th omas A.J., Agarwal A.: Relationship
between oxidative stress, semen characteristics, and clinical diagnosis in men
undergoing infertility investigation. Fertil Steril. 2000, 73, 459–464.
Piasecka M.: Morfologia i funkcja mitochondriów plemnika a męska płodność.
Część II. Zaburzenia morfologiczno -funkcjonalne mitochondriów wstawki
plemnika. Post Biol Kom. 2004, 31, 489–516.
Piasecka M., Gączarzewicz D., Laszczyńska M.: Evaluation of sperm genomic
integrity of normozoospermic men: a prospective study. Folia Histochem
Cytobiol. 2006, 44, 117–122.
Piasecka M., Gączarzewicz D., Laszczyńska M., Starczewski A., Brodowska A.:
Flow cytometry application in the assessment of sperm DNA integrity of
men with asthenozoospermia. Folia Histochem Cytobiol. 2007, 45 Suppl
1, 127–136.
Piasecka M., Gill K., Gączarzewicz D., Kazienko A., Rosiak A., Udała J. i wsp.:
Znaczenie morfologicznej oceny plemników w diagnostyce seminologicznej.
W: Układ płciowy męski. Badania kliniczne i doświadczalne. Red.
M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego w Szczecinie,
Szczecin 2013, 97–123
Potts R.J., Notarianni L.J., Jeff eries T.M.: Seminal plasma reduces exogenous
oxidative damage to human sperm, determined by the measurement of DNA
strand breaks and lipid peroxidation. Mutat Res. 2000, 447, 249–256.
Przybyszewski W.M., Kasperczyk J., Stokłosa K., Bkhiyan A.: DNA damage
induced by products of lipid peroxidation. Postepy Hig Med Dosw (Online).
2005, 59, 75–81.
Rao B., Soufi r J.C., Martin M., David G.: Lipid peroxidation in human spermatozoa
as related to midpiece abnormalities and motility. Gamete Res.
1989, 24, 127–134.
Rivlin J., Mendel J., Rubinstein S., Etkovitz N., Breitbart H.: Role of hydrogen
peroxide in sperm capacitation and acrosome reaction. Biol Reprod.
2004, 70, 518–522.
Robinson L., Gallos I.D., Conner S.J., Rajkhowa M., Miller D., Lewis S. i wsp.:
Th e eff ect of sperm DNA fragmentation on miscarriage rates: a systematic
review and meta -analysis. Hum Reprod. 2012, 27, 2908–2917.
Ross C., Morriss A., Khairy M., Khalaf Y., Braude P., Coomarasamy A. i wsp.:
A systematic review of the eff ect of oral antioxidants on male infertility.
Reprod Biomed Online. 2010, 20, 711–723.
Sanocka D., Miesel R., Jędrzejczak P., Kurpisz M.K.: Oxidative stress and male
infertility. J Androl. 1996, 17, 449–454.
Shamsi M.B., Kumar R., Bhatt A., Bamezai R.N., Gupta N.P., Das T.K. i wsp.:
Mitochondrial DNA Mutations in etiopathogenesis of male infertility. Indian
J Urol. 2008, 24, 150–154.
Sikka S.C.: Oxidative stress and role of antioxidants in normal and abnormal
sperm function. Front Biosci. 1996, 1, 78–86.
Sivanarayana T., Krishna Ch R., Prakash G.J., Krishna K.M., Madan K., Rani B.S.
i wsp.: CASA derived human sperm abnormalities: correlation with chromatin
packing and DNA fragmentation. J Assist Reprod Genet. 2012, 29,
1327–1334.
Smith R., Vantman D., Ponce J., Escobar J., Lissi E.: Total antioxidant capacity
of human seminal plasma. Hum Reprod. 1996, 11, 1655–1660.
Taylor R.W., Turnbull D.M.: Mitochondrial DNA mutations in human disease.
Nat Rev Genet. 2005, 6, 389–402.
Torregrosa N., Dominguez -Fandos D., Camejo M.I., Shirley C.R., Meistrich M.L.,
Ballesca J.L. i wsp.: Protamine 2 precursors, protamine 1/protamine 2 ratio,
DNA integrity and other sperm parameters in infertile patients. Hum Reprod.
2006, 21, 2084–2089.
Tremellen K.: Oxidative stress and male infertility – a clinical perspective.
Hum Reprod Update. 2008, 14, 243–258.
Twigg J., Fulton N., Gomez E., Irvine D.S., Aitken R.J.: Analysis of the impact
of intracellular reactive oxygen species generation on the structural and
functional integrity of human spermatozoa: lipid peroxidation, DNA
fragmentation and eff ectiveness of antioxidants. Hum Reprod. 1998a, 13,
1429–1436.
Twigg J.P., Irvine D.S., Aitken R.J.: Oxidative damage to DNA in human
spermatozoa does not preclude pronucleus formation at intracytoplasmic
sperm injection. Hum Reprod. 1998b, 13, 1864–1871.
Verma A., Kanwar K.C.: Eff ect of vitamin E on human sperm motility and
lipid peroxidation in vitro. Asian J Androl. 1999, 1, 151–154.
Virro M.R., Larson -Cook K.L., Evenson D.P.: Sperm chromatin structure assay
(SCSA) parameters are related to fertilization, blastocyst development, and
ongoing pregnancy in in vitro fertilization and intracytoplasmic sperm
injection cycles. Fertil Steril. 2004, 81, 1289–1295.
Walczak -Jędrzejowska R., Wolski J.K., Słowikowska -Hilczer J.: Th e role of oxidative
stress and antioxidants in male fertility. Cent European J Urol. 2013,
66, 60–67.
Wang X., Sharma R.K., Gupta A., George V., Th omas A.J., Falcone T. i wsp.:
Alterations in mitochondria membrane potential and oxidative stress in
infertile men: a prospective observational study. Fertil Steril. 2003, 80
Suppl 2, 844–850.
Zabłocka A., Janusz M.: Th e two faces of reactive oxygen species. Postepy
Hig Med Dosw (Online). 2008, 62, 118–124.
Zhang Y., Wang H., Wang L., Zhou Z., Sha J., Mao Y. i wsp.: Th e clinical signifi -
cance of sperm DNA damage detection combined with routine semen testing
in assisted reproduction. Mol Med Rep. 2008, 1, 617–624.
Zini A.: Are sperm chromatin and DNA defects relevant in the clinic? Syst
Biol Reprod Med. 2011, 57, 78–85.
Zini A., Al -Hathal N.: Antioxidant therapy in male infertility: fact or fi ction?
Asian J Androl. 2011, 13, 374–381.
Zini A., Jamal W., Cowan L., Al -Hathal N.: Is sperm DNA damage associated
with IVF embryo quality? A systematic review. J Assist Reprod Genet.
2011, 28, 391–397.
Zini A., San Gabriel M., Baazeem A.: Antioxidants and sperm DNA damage:
a clinical perspective. J Assist Reprod Genet. 2009, 26, 427–432.
WPŁYW SPORTU
NA MĘSKI UKŁAD ROZRODCZY
SPORT INFLUENCE ON MALE REPRODUCTIVE SYSTEM
Natalia Ignaszak -Kaus, Piotr Jędrzejczak
Katedra Ginekologii, Położnictwa i Onkologii Ginekologicznej, Klinika Niepłodności i Endokrynologii Rozrodu w Poznaniu
Autor do korespondencji: Natalia Ignaszak -Kaus (natalia.ignaszak@gmail.com)
Natalia Ignaszak -Kaus – Absolwentka Wydziału Lekarskiego I Uniwersytetu Medycznego im. Karola Marcinkowskiego
w Poznaniu. Od października 2014 r. lekarz stażysta w Szpitalu Klinicznym im. H. Święcickiego UM w Poznaniu.
Wielokrotnie brała czynny udział w konferencjach naukowych, prezentując własne prace naukowe, realizowane w okresie
studiów. Współautorka kilku artykułów medycznych. Swoją przyszłość chciałaby związać z ginekologią i położnictwem.
Zainteresowania naukowe: niepłodność, endokrynologia ginekologiczna.
Streszczenie
W artykule przedstawiono przegląd piśmiennictwa dotyczącego wpływu różnych dyscyplin sportu oraz intensywności treningów
na parametry seminologiczne i poziomy hormonów płciowych u mężczyzn. Sport jest nieodłącznym elementem zdrowego stylu życia,
a korzyści wynikające z aktywności fi zycznej są bezsprzeczne. Brak ćwiczeń ruchowych oraz związana z nim otyłość negatywnie
wpływają na męski potencjał rozrodczy. Niestety, także zbyt intensywne treningi mogą doprowadzić do zaburzeń hormonalnych,
pogarszając jakość nasienia. Niniejszy artykuł porusza też kwestię urazów układu moczowo -płciowego, do których dochodzi u sportowców,
najczęściej rowerzystów i jeźdźców konnych. Przedstawiono możliwe przyczyny zaburzeń płodności u mężczyzn wyczynowo
uprawiających sport. Problem niepłodności męskiej powinien być obszarem zainteresowania nie tylko andrologów, ale też urologów,
endokrynologów oraz lekarzy medycyny sportowej.
słowa kluczowe: niepłodność męska, jakość nasienia, stres oksydacyjny, jazda na rowerze, jazda konna, urazy jąder
Abstract
In this article review of the literature concerning the infl uence of diff erent sport disciplines and intensity of workouts on seminal parameters
and sex hormone levels has been presented. Sport is inseparable element of healthy lifestyle and benefi ts of physical activity are
indisputable. Lack of physical activity and associated obesity have negative infl uence on male reproductive potential. Unfortunately
also too intense workouts can lead to hormonal imbalance, worsening the quality of semen. Th is paper also have been discussed genitourinary
injuries which occur in athletes, especially cyclists and equestrians. In this article potential causes of fertility disorders
among competitive athletes has been shown. Th e problem of male infertility should be an area of interest not only andrologists but
also urologists, endocrinologists and sports medicine doctors.
key words: male infertility, semen quality, oxidative stress, cycling, riding, testicular injuries
Skróty / Abbreviations
AMH – hormon antymüllerowski (ang. anti -Müllerian hormone), BMI – wskaźnik masy ciała (ang. body mass index), CRH – hormon uwalniający
kortykotropinę (ang. corticotropin -releasing hormone), FSH – hormon folikulotropowy (ang. follicle -stimulating hormone), GnRH – hormon
uwalniający gonadotropiny (ang. gonadotropin -releasing hormone), HPA – oś podwzgórze–przysadka–nadnercza (ang. hypothalamic–pituitary–
adrenal axis), IL -1β – interleukina 1β (ang. interleukin 1 β), IL -6 – interleukina 6 (ang. interleukin 6), IL -8 – interleukina 8 (ang. interleukin
8), LH – hormon luteinizujący (ang. luteinizing hormone), PNE – zespół ucisku na nerw sromowy (ang. pudendal nerve entrapment),
PRL – prolaktyna (ang. prolactin), SHBG – globulina wiążąca hormony płciowe (ang. sex hormone binding globulin), TNF -α – czynnik martwicy
nowotworów α (ang. tumor necrosis factor α); VO2max – maksymalny pułap tlenowy (ang. maximal oxygen consumption); WHO – Światowa
Organizacja Zdrowia (ang. World Health Organization).
Sport jest nieodłącznym elementem zdrowego stylu życia.
Regularny wysiłek fi zyczny zapobiega wielu chorobom
cywilizacyjnym, zmniejsza ryzyko otyłości, cukrzycy
typu 2, chorób sercowo -naczyniowych. Ćwiczenia fi zyczne
wspomagają produkcję masy kostnej, przez co chronią
przed rozwojem osteoporozy. Sport pomaga utrzymać
zarówno zdrowie fi zyczne, jak i psychiczne (WHO, 2010).
Światowa Organizacja Zdrowia (WHO, ang. World Health
Organization) zaleca osobom w wieku 18–65 lat minimum
150 minut umiarkowanego wysiłku fi zycznego w tygodniu
lub minimum 75 minut ćwiczeń o wysokiej intensywności
w tygodniu. Korzystne jest również połączenie
obu wymienionych intensywności aktywności fi zycznej
(WHO, 2010).
Według danych Głównego Urzędu Statystycznego
coraz więcej Polaków deklaruje podejmowanie regularnej
aktywności fi zycznej. Najpopularniejszymi dyscyplinami
sportu są jazda na rowerze (64,8%) oraz pływanie (42,1%).
W porównaniu do 2008 r. odsetek mężczyzn uprawiających
jakikolwiek sport wzrósł o 8,8% (GUS, 2013).
Z kolei siedzący tryb życia nie tylko zwiększa ryzyko
incydentów sercowo -naczyniowych i ma negatywny
wpływ na gospodarkę węglowodanowo -lipidową, ale
może też upośledzać męską płodność. Optymalna temperatura
dla spermatogenezy jest 3–4°C niższa od temperatury
wnętrza ciała. Do jej utrzymania przyczynia
się nie tylko położenie jąder w mosznie, które w warunkach
prawidłowych zstępują do niej pod koniec życia
płodowego, ale również pofałdowana, bogato unaczyniona
powierzchnia worka mosznowego umożliwiająca
oddawanie nadmiaru ciepła. Wchodzący w skład
powrózka nasiennego splot wiciowaty również odgrywa
istotną rolę w regulacji temperatury jąder. Długie przebywanie
w pozycji siedzącej powoduje wzrost temperatury
w mosznie, co przyczynia się do zaburzeń spermatogenezy
i obniżenia płodności (Jung i wsp., 2007). Podobne
wyniki, wskazujące na negatywny wpływ hipertermii
na spermatogenezę, przedstawiono też w innych pracach
(Durairajanayagam i wsp., 2015; Korfanty i wsp., 2014).
Garolla i wsp. (2013) przeprowadzili badania dotyczące
wpływu regularnego korzystania z sauny (15 minutowe
sesje, 2 -krotnie w tygodniu przez 3 miesiące) na spermatogenezę.
Grupę badaną stanowili mężczyźni z prawidłowymi
parametrami seminologicznymi, którzy
próbki nasienia do analizy oddawali przed rozpoczęciem
korzystania z sauny, w momencie zakończenia
regularnego korzystania, a następnie po 3 i po 6 miesiącach
od ekspozycji na wysoką temperaturę panującą
w saunie (80–90°C). W nasieniu zebranym w momencie
zakończenia regularnego korzystania z sauny odnotowano
statystycznie istotne (p < 0,001) zmniejszenie
ruchliwości i liczby plemników w odniesieniu do parametrów
oznaczonych przed rozpoczęciem korzystania
z sauny. Obniżone parametry seminologiczne utrzymywały
się także 3 miesiące po zaprzestaniu korzystania
z sauny. Dopiero po 6 miesiącach wszystkie parametry
powróciły do wartości wyjściowych.
Otyłość a zdrowie reprodukcyjne
mężczyzn
Wysiłek fi zyczny pomaga w utrzymaniu właściwej masy
ciała, a jak wykazało wiele badań, nadmierna masa ciała
wpływa negatywnie zarówno na gospodarkę hormonalną,
jak i parametry nasienia (Eisenberg i wsp., 2014;
Fariello i wsp., 2012; Macdonald i wsp., 2013). Fariello i wsp.
(2012) przeprowadzili badanie parametrów nasienia uzyskanego
od 305 mężczyzn, których podzielono na trzy
grupy według wskaźnika masy ciała (BMI, ang. body mass
index): 1) grupa z prawidłową masą ciała (BMI < 25 kg/m²),
2) nadwagą (BMI ≥ 25 i < 30 kg/m²) oraz 3) otyłością
(BMI > 30 kg/m²). Nasienie mężczyzn z prawidłowym
BMI charakteryzowało się istotnie wyższą (p = 0,008)
koncentracją plemników niż nasienie mężczyzn z otyłością.
Wykazano również istotnie wyższy (p = 0,001)
odsetek plemników o ruchu postępowym w nasieniu
grupy mężczyzn z prawidłowym BMI w porównaniu
do grupy z nadwagą i otyłością. Istotne różnice (p = 0,012)
między parametrami seminologicznymi analizowanych
grup wykazano także w całkowitej liczbie plemników
wykazujących ruch. Ponadto, u mężczyzn z grupy o najwyższym
współczynniku BMI stwierdzono istotnie
niższą (p = 0,0045) aktywność oksydoredukcyjną mitochondriów
plemników oraz istotnie wyższy (p = 0,002)
odsetek męskich komórek rozrodczych niewykazujących
aktywności mitochondriów w porównaniu do pozostałych
badanych grup. Wykazano również, że mężczyźni
otyli posiadali istotnie wyższy (p = 0,0004) procent plemników
z dużą fragmentacją DNA. Z przedstawionego
badania wynika, że wzrost masy ciała istotnie obniża
nie tylko standardowe parametry seminologiczne, ale również ma wpływ na aktywność oksydoredukcyjną mitochondriów
oraz integralność DNA plemników. Z kolei
w dużym badaniu przekrojowym, przeprowadzonym
w Nowej Zelandii wśród mężczyzn, którzy wraz z partnerkami
zgłosili się do ośrodka leczenia niepłodności,
stwierdzono istotną statystycznie negatywną korelację
pomiędzy BMI a stężeniem testosteronu całkowitego
(r = −0,35, p = 0,0001), wolnego testosteronu (r = −0,25,
p = 0,0012) oraz globuliną wiążącą hormony płciowe
(SHBG, ang. sex hormone binding globulin) – r = −0,44,
p = 0,0001 (Macdonald i wsp., 2013). Ponadto, jak wykazali
Eisenberg i wsp. (2014), nie tylko nadmierna masa
ciała, ale także zbyt duży obwód talii wiąże się z gorszymi
parametrami nasienia.
Tezę, która głosi, że otyłość jest związana z potencjalnym
pogorszeniem zdrowia reprodukcyjnego, potwierdzają
również badania stężenia inhibiny B i hormonu
antymüllerowskiego (AMH, ang. anti -Müllerian hormone)
w surowicy krwi. Wartości tych hormonów są proporcjonalne
do liczby komórek Sertoliego, które wykazują działanie
podporowe, ochronne i odżywcze dla komórek plemnikotwórczych.
Robeva i wsp. (2012) wykazali, że zarówno
stężenie inhibiny B, jak i AMH były statystycznie istotnie
niższe (odpowiednio: p = 0,025; p = 0,002) w grupie mężczyzn
otyłych z towarzyszącymi objawami zespołu metabolicznego
w porównaniu do grupy kontrolnej, którą stanowili
mężczyźni z prawidłową masą ciała. Tym bardziej
niepokojące są ostatnie dane opublikowane przez Główny
Urząd Statystyczny, z których wynika, że odsetek mężczyzn
z nadwagą i otyłych ciągle wzrasta i w 2009 r.
wynosił odpowiednio 45% i 17%. Z tego wynika, że blisko
62% mężczyzn miało nieprawidłową, zbyt wysoką masę
ciała. W porównaniu z latami poprzednimi największy
wzrost odnotowano niestety wśród mężczyzn w wieku
reprodukcyjnym – 20–39 lat (GUS, 2011).
Intensywny trening a oś podwzgórze-
-przysadka -jądro i parametry nasienia
Należy odróżnić sport rekreacyjny od wyczynowego. Jak
wynika z danych prezentowanych przez portal bieganie.pl,
w 2013 r. w Polsce odbyło się aż 69 biegów maratońskich,
co stawia nasz kraj na 15. miejscu, jeśli chodzi
o liczbę zorganizowanych maratonów. Liczba osób, które
ukończyły ten dystans, również jest imponująca (36 533
zawodników), co plasuje Polskę na 8. lokacie. Trójbój
(triathlon) do niedawna mniej popularny w Polsce, także
zyskuje rzesze fanów. Jest to niezwykle wymagająca dyscyplina,
łącząca jazdę na rowerze, pływanie oraz bieg.
Obecnie trenuje go 6–8 tys. osób, ale ich liczba co roku
podwaja się. Czy tak intensywny sport również wywiera
pozytywny wpływ na zdrowie mężczyzny, a zwłaszcza
jego funkcje rozrodcze?
Odpowiedź organizmu na długotrwały, intensywny
wysiłek fi zyczny jest podobna do odpowiedzi na chroniczny
stres. Dochodzi do aktywacji autonomicznego
układu nerwowego i osi podwzgórze–przysadka–nadnercza
(HPA, ang. hypothalamic–pituitary–adrenal axis).
Hormon uwalniający kortykotropinę (CRH, ang.
corticotropin -releasing hormone), zarówno poprzez oś
HPA, jak i stymulację wydzielania β -endorfi n, upośledza
wydzielanie hormonu uwalniającego gonadotropiny
– GnRH, ang. gonadotropin -releasing hormone
(Chrousos, 1992). Podobna supresja podwzgórza i jednocześnie
całego układu rozrodczego jest obserwowana również
u intensywnie trenujących kobiet. Biologiczne podłoże
tego zjawiska wynika z ciągłej stymulacji przez glikokortykosteroidy,
będące „hormonami stresu”. Organizm zmuszony
jest więc do oszczędzania energii na wypadek sytuacji
nagłych, kosztem wyłączenia w pierwszej kolejności
aktywności gonad. U kobiet przejawia się to w postaci
tzw. triady sportsmenek, na którą składają się zaburzenia
odżywiania, brak miesiączki i osteoporoza (Szyguła i wsp.,
2010). Czynnikiem prowadzącym do tych dysfunkcji
jest hipoestrogenemia powiązana z hiperkortyzolemią
(Łagowska i wsp., 2011). U sportowców mężczyzn narażonych
na przewlekły, intensywny trening poziom wolnego
i całkowitego testosteronu oraz hormonu luteinizującego
(LH, ang. luteinizing hormone) jest obniżony. Zjawisko
to nazywane jest stanem hipogonadyzmu zależnego
od ćwiczeń – ang. exercise -hypogonadal male condition
(Hackney, 2008).
Safarinejad i wsp. (2009) wykazali, że długotrwały,
intensywny wysiłek fi zyczny negatywnie wpływa
na jakość nasienia oraz oś podwzgórze–przysadka–
jądro. Uczestników badania podzielono na dwie grupy,
którym zalecono 2 -godzinny bieg na bieżni sportowej
5 razy w tygodniu przez 60 tyg. Grupa pierwsza biegała
ze średnią intensywnością (jak sportowcy wyczynowi),
na poziomie maksymalnego pułapu tlenowego (VO₂max,
ang. maximal oxygen consumption) ~60%; grupa druga
z bardzo wysoką intensywnością, VO₂max ~80%, po czym
następował okres regeneracji, w którym obie grupy
wykonywały ten sam trening przez kolejne 36 tyg., ale
przy niskiej intensywności, na poziomie VO₂max ~30%.
Po pierwszych 24 tyg. wykonano badania, które wykazały
istotnie gorsze parametry nasienia (koncentracja,
ruchliwość i morfologia plemników) w grupie biegającej
z większą intensywnością (p = 0,03). Różnice między
obiema grupami nasiliły się w kolejnych badaniach
nasienia (w 36. i 48. tyg. ćwiczeń, odpowiednio: p = 0,02;
p = 0,01). W grupie biegającej ze średnią intensywnością
parametry nasienia były istotnie niższe w porównaniu
z wynikami uzyskanymi przed rozpoczęciem ćwiczeń,
a u wykonujących wysiłek o bardzo dużej intensywności
zaburzenia jakości nasienia po 60 tyg. treningów były
zaniżone w jeszcze większym stopniu. Również istotne
zmiany dotyczyły stężeń poziomu hormonów: stężenie
testosteronu całkowitego, wolnego, LH i hormonu folikulotropowego
(FSH, ang. follicle -stimulating hormone) uległo
obniżeniu; wzrósł natomiast poziom SHBG i prolaktyny
(PRL, ang. prolactin). Nie zaobserwowano istotnych statystycznie
zmian stężeń hormonów w grupie ćwiczącej ze średnią intensywnością. Po okresie 36 -tyg. regeneracji
wszystkie parametry w obu grupach wróciły do poziomów
przedtreningowych. Jest to dowód na to, że nadmierny
trening o wysokiej intensywności negatywnie wpływa
na funkcje rozrodcze, natomiast po rezygnacji ze zbyt
obciążających ćwiczeń parametry nasienia i poziomy
hormonów płciowych wracają do normy.
Ciekawe wyniki uzyskano także w dużym badaniu
kohortowym oceniającym nasienie mężczyzn, którzy zgłosili
się wraz z partnerkami do ośrodka leczenia niepłodności
(Wise i wsp., 2011). Pobrano 2261 próbek nasienia
przed procedurą zapłodnienia in vitro. Zebrano szczegółowy
wywiad dotyczący rodzaju aktywności fi zycznej,
jej intensywności i długości treningów. Interesującym
wydaje się fakt, że istotny spadek koncentracji i ruchliwości
plemników wykazano tylko w grupie mężczyzn
jeżdżących na rowerze dłużej niż 5 godz./tyg. Wysiłek
o mniejszym natężeniu nie wpłynął istotnie na parametry
nasienia.
Podczas kolejnych badań prowadzonych przez
Kupchaka i wsp. (2014) sprawdzano, jaki wpływ na gospodarkę
hormonalną ma przebiegnięcie ultramaratonu
(trasa 161 km). Próbki krwi pobrano od 12 mężczyzn
przed zawodami, bezpośrednio po ukończeniu biegu
oraz jeden, dwa i trzy dni po wysiłku. W porównaniu
do wyników sprzed przebiegnięcia ultramaratonu
poziom testosteronu, LH oraz SHBG był istotnie statystycznie
niższy, a poziom kortyzolu wyższy tuż po przebiegnięciu
trasy (p ≤ 0,05). Podobne wyniki uzyskano
również w następnych pomiarach. Jest to kolejny niezaprzeczalny
dowód na to, że nawet jednorazowy ekstremalny
wysiłek fi zyczny upośledza funkcjonowanie
osi podwzgórze–przysadka–jądro.
Stres oksydacyjny powiązany ze sportem
a jakość nasienia
Intensywny wysiłek fi zyczny 10 -krotnie zwiększa zużycie
tlenu przez komórki. Jednocześnie nasila się produkcja
reaktywnych form tlenu, które mogą uszkadzać błony
komórkowe. Istnieje wiele mechanizmów obronnych usuwających
wolne rodniki. Do głównych enzymów zapobiegających
peroksydacji lipidów błonowych i uszkodzeniu
DNA komórek, w tym komórek plemnikotwórczych,
należą: dysmutaza ponadtlenkowa, katalaza i peroksydaza
(Koziorowska -Gilun, 2013).
Liczne badania dowodzą, że intensywne uprawianie
sportu wyczynowego zwiększa stężenie wykładników
stanu zapalnego: interleukin prozapalnych (Bernecker,
2013) oraz białka C -reaktywnego (Kasprowicz, 2013).
W jednym z badań sprawdzano zależność poziomu
reaktywnych form tlenu i enzymów antyoksydacyjnych
od intensywności treningów. Próbki nasienia pobrano
od mężczyzn uprawiających sport wyczynowo (4–5 razy
w tyg., tętno 180–190 skurczów serca/min), rekreacyjnie
(2–3 razy w tyg., tętno 127–132 skurczów serca/
min) i od mężczyzn nieuprawiających żadnego sportu.
Najlepsze wyniki, czyli statystycznie istotnie wyższe
(p < 0,001) poziomy katalazy i dysmutazy ponadtlenkowej
przy obniżonych wykładnikach stresu oksydacyjnego
(8 -izoprostanu, kwasu metylomalonowego,
reaktywnych form tlenu), wykazano w nasieniu mężczyzn
rekreacyjnie uprawiających sport (Hajizadeh i wsp.,
2013). Co więcej, mężczyźni uprawiający sport wyczynowo
prezentowali istotnie wyższe (p < 0,001) stężenia
wykładników stanu zapalnego zarówno od tych uprawiających
sport rekreacyjnie, jak i od mężczyzn nietrenujących
w ogóle. Parametry nasienia: prawidłowa
morfologia, ruchliwość i liczba plemników korelowały
z wysokim stężeniem enzymów antyoksydacyjnych
i niskim stężeniem reaktywnych form tlenu. Najlepsze
parametry wykazano w grupie rekreacyjnie uprawiających
sport, następnie w grupie nieuprawiających
żadnych sportów. Najsłabsze parametry oznaczono
w grupie trenujących wyczynowo. Nie tylko kolarstwo
i biegi długodystansowe mogą zaburzać równowagę
oksydacyjno -antyoksydacyjną nasienia i tym samym
pogarszać parametry seminologiczne. Analizowano
wyniki w dwóch grupach: 1) 56 sportowców wyczynowych
trenujących sporty walki (trening intensywny: 4–5
razy w tyg., tętno 180–190 skurczów serca/min, VO₂max
~62%) oraz 2) 52 sportowców rekreacyjnych (2–3 razy
w tyg., tętno 127–132 skurczów serca/min, VO₂max ~50%).
Również zwracały uwagę istotnie statystycznie gorsze
parametry seminologiczne, wyższe stężenia wykładników
stresu oksydacyjnego, powiązane z zaburzoną
integralnością DNA plemników w grupie trenujących
wyczynowo (Tartibian i wsp., 2012).
Czy można więc określić, przy jakiej intensywności
aktywności fi zycznej parametry nasienia, a tym samym
i płodność, nie zostają pogorszone? Wyniki badań nie
wskazują jednoznacznie bezpiecznej intensywności i częstotliwości
treningów.
Hajizadeh i wsp. (2014) udowadniają, że nawet
16 -tyg. trening na rowerze o średniej intensywności
(VO2max < 52%) może obniżyć jakość nasienia. W ramach
badań od 24 mężczyzn jeżdżących amatorsko na rowerze,
uzyskano i zbadano nasienie przed okresem treningowym,
po 8 i po 16 tyg. treningów oraz 7 i 30 dni po zakończonej
sesji treningowej. Zarówno objętość, koncentracja,
ruchliwość, jak i morfologia plemników były istotnie statystycznie
niższe (p < 0,008) w porównaniu z wynikami
sprzed okresu treningowego. Także wykładniki stanu
zapalnego: interleukina 1β (IL -1β, ang. interleukin 1 β),
interleukina 6 (IL -6, ang. interleukin 6), interleukina 8
(IL -8, ang. interleukin 8) oraz czynnika martwicy nowotworów
α (TNF -α, ang. tumor necrosis factor α) były podwyższone
po sesji treningów (p < 0,008). Pogorszenie
jakości nasienia było obserwowalne po 8 i 16 tyg. jazdy
na rowerze, a obniżone parametry utrzymywały się
jeszcze w 7. dniu po treningach. Dopiero po 30 dniach
regeneracji zaobserwowano powrót do poziomów wejściowych
niektórych parametrów nasienia, jednak morfologia
i liczba plemników pozostały obniżone, a poziom IL -1β,
IL -6 oraz IL -8 podwyższony (p < 0,008).
Wpływ jazdy na rowerze na męski układ
moczowo -płciowy
Kolarstwo, rekreacyjne lub wyczynowe, to najbardziej
popularna dyscyplina sportu, znajdująca rzesze fanów
na całym świecie. Jazda na rowerze to sport ogólnodostępny,
jako wysiłek aerobowy pomagający utrzymać
organizm w dobrej kondycji fi zycznej i pozytywnie
wpływający na układ sercowo -naczyniowy. Jak jednak
wynika z omówionych wyników badań, może wiązać
się z pogorszeniem jakości nasienia, a tym samym negatywnie
wpływać na męską płodność. Co więcej, jeździe
na rowerze towarzyszyć mogą też inne zaburzenia, niewystępujące
w przypadku uprawiania innych dyscyplin.
Do najczęstszych należą: zespół ucisku na nerw sromowy
(PNE, ang. pudendal nerve entrapment) oraz zaburzenia
erekcji. Zespół ucisku może przejawiać się zarówno bólem
w obrębie moszny i krocza, jak i drętwieniem, upośledzeniem
czucia w tej lokalizacji. W trakcie jazdy dochodzi
też do ucisku struktur naczyniowych; przewlekłe niedotlenienie
tkanek w prąciu może prowadzić do rozplemu
tkanki łącznej w obrębie ciał jamistych i jednocześnie
zniszczenia mięśni gładkich (Sommer i wsp., 2010).
Konsekwencją tak zmienionej struktury prącia mogą być
zaburzenia erekcji (Tomada i wsp., 2010). Wśród 100 badanych
kolarzy, pokonujących tygodniowo dystans powyżej
400 km, zespół ucisku nerwu sromowego występował
u 61% z nich, podczas gdy zaburzenia erekcji zgłaszało
24% badanych (Sommer i wsp., 2001). Nieco mniejszy
odsetek powikłań związanych z jazdą na rowerze przedstawiony
został w pracy Andersen i wsp. (1997): zespół
ucisku oraz zaburzenia erekcji prezentowało odpowiednio
21% i 13% długodystansowych kolarzy amatorów.
Odmienne wyniki badań mogą być związane z chorobami
towarzyszącymi, różnym wiekiem kolarzy, intensywnością
trenowania. Mimo to duża częstość wymienionych
powikłań wśród rowerzystów jest nie do podważenia.
Priapizm to długotrwały, bolesny wzwód członka,
który nie jest związany z podnieceniem lub pobudzeniem
seksualnym. Wiele badań dowodzi, że zaburzenie to może
być związane z jazdą na rowerze. Priapizm powiązany
z kolarstwem ma przeważnie charakter wysokoprzepływowy
(Ul Islam i wsp., 2014). Jest on spowodowany
uszkodzeniem naczyń i wytworzeniem przetok lub przecieków
tętniczo -żylnych, przez które krew w sposób niekontrolowany
wpływa do zatok ciał jamistych prącia.
Okazuje się, że sposobem na uniknięcie niektórych
powikłań, związanych z jazdą na rowerze, może
być dobranie odpowiedniego ekwipunku rowerowego.
Wskazane są ergonomiczne, szerokie siodełka, na których
ciężar ciała rozkłada się bardziej równomiernie niż w przypadku
wąskich sportowych modeli (Guess i wsp., 2011).
Co więcej, największy wpływ na miejscowy nacisk
na okolicę krocza podczas jazdy ma masa ciała (Bressel
i wsp., 2010). Redukcja masy ciała może więc przyczynić
się do zmniejszenia ryzyka zaburzeń erekcji czy zespołu
ucisku na nerw sromowy u rowerzystów.
Urazy jąder wśród sportowców
Urazy układu moczowo -płciowego stanowią ok. 13%
wszystkich urazów związanych z uprawianiem sportu
(Sacco, 2010). W jednej z prac wykazano, że w latach
2002–2012 w Stanach Zjednoczonych było ponad
137 tys. interwencji lekarskich powiązanych z tymi
kontuzjami (Bagga i wsp., 2015). Do uszkodzeń układu
moczowo -płciowego dochodzi najczęściej u długodystansowych
kolarzy, osób uprawiających jeździectwo
konne oraz u sportowców trenujących sporty kontaktowe,
m.in. piłkę nożną (Frauscher i wsp., 2001; Grinsell
i wsp., 2012; Turgut i wsp., 2005). W badaniu ankietowym,
przeprowadzonym w Danville, w Stanach Zjednoczonych
wśród nastoletnich sportowców okazało się, że 18%
z nich doświadczyło urazów jądra związanych z uprawianiem
sportu, 36,4% z ankietowanych potwierdziło,
że tego typu urazu doznał przynajmniej jeden członek
z ich drużyny, a tylko 12,9% respondentów przyznała,
że używa ochraniaczy na okolicę krocza w trakcie treningów.
Najniższy odsetek urazów dotyczył chłopców
trenujących piłkę nożną (17,8%), a najwyższy (48,5%)
lacrosse oraz zapasy (32,8%). Jak wynika z przeprowadzonego
badania, urazy jąder nie należą do rzadkości
wśród aktywnych sportowo nastolatków (Bieniek i wsp.,
2014). Mając na uwadze potencjalne zagrożenia związane
z tego typu kontuzjami oraz częstość ich występowania,
powinno zwracać się większą uwagę na ochronę krocza
w trakcie uprawiania sportu (Dalton i wsp., 2014).
W przypadku jeździectwa już po 5 latach regularnych
treningów obserwuje się wzrost występowania nieprawidłowości
opisywanych podczas badania ultrasonografi cznego
worka mosznowego, w porównaniu do mężczyzn
nieuprawiających tej dyscypliny sportu – p < 0,05 (Turgut
i wsp., 2005). Do najczęściej występujących zaburzeń
u jeźdźców należą żylaki powrózka nasiennego (46%),
wodniaki jądra (19%), torbiele najądrzy (35%) oraz zwapnienia
w jądrach i najądrzach (odpowiednio 19% i 8%).
Kolarstwo, jak już wspomniano, jest jedną z dyscyplin
związanych najsilniej z zaburzeniami płodności męskiej.
Spowodowane jest to także częstością urazów układu
moczowo -płciowego wśród kolarzy. Korzystanie ze specjalistycznej
odzieży oraz kasku w czasie jazdy zmniejsza
istotnie ryzyko poważnych kontuzji (de Rome i wsp., 2014).
W Austrii wykonano badania ultrasonografi czne moszny
u 85 mężczyzn, jeżdżących na rowerze górskim 6 dni
w tyg. przez min. 2 godz. oraz u 31 mężczyzn nietrenujących
tej dyscypliny. W grupie kolarzy aż u 94% mężczyzn
wykazano patologiczne zmiany. Do najczęstszych należały:
zwapnienia w jądrach i najądrzach (odpowiednio
32% i 40%), torbiele najądrza (46%), wodniaki jądra (28%) oraz żylaki powrózka nasiennego (11%). W grupie nietrenujących
jazdy na rowerze opisano zmiany jedynie
u 16% badanych; wszystkie przypadki dotyczyły torbieli
najądrza (Frauscher i wsp., 2001). Rowerzyści są bardziej
predysponowani do występowania zaburzeń ultrasonografi
cznych od jeźdźców konnych (tabela 1). Choć torbiele
najądrza dominują w obu grupach, to już zwapnienia
w ich obrębie występują częściej u rowerzystów.
Co ciekawe, żylaki powrózka nasiennego, najczęstsze
w grupie jeźdźców, były tylko w niewielkim odsetku
opisywane u rowerzystów. Być może wynika to z innego
rodzaju wstrząsów i nacisku w trakcie jazdy konnej.
Korzyści wynikające z aktywności fi zycznej są bezsprzeczne.
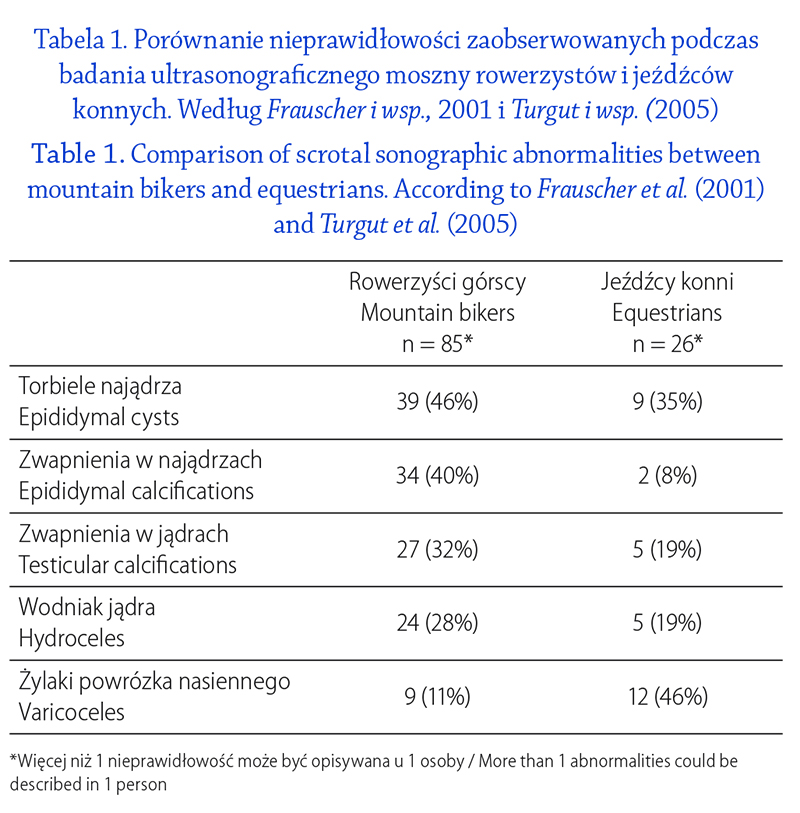 Brak ćwiczeń ruchowych negatywnie wpływa
na męski potencjał rozrodczy, jednakże zbyt intensywne
treningi mogą doprowadzić do zaburzeń hormonalnych
i zaburzeń równowagi oksydacyjnej, pogarszając jakość
nasienia. Również urazy jąder, zdarzające się najczęściej
w grupie rowerzystów i jeźdźców konnych, są problemem
klinicznym, na który należy zwrócić uwagę.
Rozwój sportów wyczynowych, coraz większa popularność
aktywności fi zycznej, zauważalna chociażby
w statystykach maratonów czy triatlonów, to z pewnością
zjawisko pozytywne. Należy jednak uwzględnić wpływ
zaawansowanych treningów na zdrowie reprodukcyjne
mężczyzn. Poprawa edukacji w zakresie możliwych powikłań,
korzystanie z ergonomicznych siodełek w trakcie
jazdy na rowerze oraz lepsza protekcja jąder podczas
uprawiania sportów jest niezbędna. Być może rozwiązaniem
byłoby też przesiewowe badanie ultrasonografi
czne wśród mężczyzn wyczynowo uprawiających sport,
a przede wszystkim badanie palpacyjne jąder. Jest ono
tanie, łatwo dostępne, a często pozwala wykryć patologiczne
zmiany. Problem niepłodności męskiej powinien
być obszarem zainteresowania nie tylko andrologów, ale
też urologów, endokrynologów oraz lekarzy medycyny
sportowej.
Piśmiennictwo
Andersen K.V., Bovim G.: Impotence and nerve entrapment in long distance
amateur cyclists. Acta Neurol Scand. 1997, 95, 233–240.
Brak ćwiczeń ruchowych negatywnie wpływa
na męski potencjał rozrodczy, jednakże zbyt intensywne
treningi mogą doprowadzić do zaburzeń hormonalnych
i zaburzeń równowagi oksydacyjnej, pogarszając jakość
nasienia. Również urazy jąder, zdarzające się najczęściej
w grupie rowerzystów i jeźdźców konnych, są problemem
klinicznym, na który należy zwrócić uwagę.
Rozwój sportów wyczynowych, coraz większa popularność
aktywności fi zycznej, zauważalna chociażby
w statystykach maratonów czy triatlonów, to z pewnością
zjawisko pozytywne. Należy jednak uwzględnić wpływ
zaawansowanych treningów na zdrowie reprodukcyjne
mężczyzn. Poprawa edukacji w zakresie możliwych powikłań,
korzystanie z ergonomicznych siodełek w trakcie
jazdy na rowerze oraz lepsza protekcja jąder podczas
uprawiania sportów jest niezbędna. Być może rozwiązaniem
byłoby też przesiewowe badanie ultrasonografi
czne wśród mężczyzn wyczynowo uprawiających sport,
a przede wszystkim badanie palpacyjne jąder. Jest ono
tanie, łatwo dostępne, a często pozwala wykryć patologiczne
zmiany. Problem niepłodności męskiej powinien
być obszarem zainteresowania nie tylko andrologów, ale
też urologów, endokrynologów oraz lekarzy medycyny
sportowej.
Piśmiennictwo
Andersen K.V., Bovim G.: Impotence and nerve entrapment in long distance
amateur cyclists. Acta Neurol Scand. 1997, 95, 233–240.
Bagga H.S., Fisher P.B., Tasian G.E., Blaschko S.D., McCulloch C.E., McAninch J.W.
i wsp.: Sports -related genitourinary injuries presenting to United States
emergency departments. Urology. 2015, 1, 239–244.
Bernecker C., Scherr J., Schinner S., Braun S., Scherbaum W.A., Halle M.: Evidence
for an exercise induced increase of TNF -α and IL -6 in marathon runners.
Scand J Med Sci Sports. 2013, 2, 207–214.
Bieniek J.M., Sumfest J.M.: Sports -related testicular injuries and the use
of protective equipment among young male athletes. Urology. 2014, 6,
1485–1489.
Bressel E., Nash D., Dolny D.: Association between attributes of a cyclist and
bicycle seat pressure. J Sex Med. 2010, 10, 3424–3433.
Chrousos G.P.: Regulation and dysregulation of the hypothalamic -pituitary-
-adrenal axis. Endocrinol Metab Clin North Am. 1992, 21, 833–858.
Dalton D.M., Davis N.F., O’Neill D.C., Brady C.M., Kiely E.A., O’Brien M.F.:
Aetiology, epidemiology and management strategies for blunt scrotal trauma.
Surgeon. 2014, doi: 10.1016/j.surge.2014.06.006.
Durairajanayagam D., Agarwal A., Ong C.: Causes, eff ects and molecular mechanisms
of testicular heat stress. Reprod Biomed Online. 2015, 1, 14–27.
Eisenberg M.L., Kim S., Chen Z., Sundaram R., Schisterman E.F., Buck Louis G.M.:
Th e relationship between male BMI and waist circumference on semen quality:
data from the LIFE study. Hum Reprod. 2014, 2, 193–200.
Fariello R.M., Pariz J.R., Spaine D.M., Cedenho A.P., Bertolla R.P., Fraietta R.:
Association between obesity and alteration of sperm DNA integrity and
mitochondrial activity. BJU Int. 2012, 6, 863–867.
Frauscher F., Klauser A., Stenzl A., Helweg G., Amort B., zur Nedden D.: US
fi ndings in the scrotum of extreme mountain bikers. Radiology. 2001, 2,
427–431.
Garolla A., Torino M., Sartini B., Cosci I., Patassini C., Carraro U., Foresta C.:
Seminal and molecular evidence that sauna exposure aff ects human spermatogenesis.
Hum Reprod. 2013, 4, 877–885.
Grinsell M.M., Butz K., Gurka M.J., Gurka K.K., Norwood V.: Sport -related kidney
injury among high school athletes. Pediatrics. 2012, 1, 40–45.
Guess M.K., Partin S.N., Schrader S., Lowe B., LaCombe J., Reutman S.: Women’s
bike seats: a pressing matter for competitive female cyclists. J Sex Med. 2011.
8 (11), 3144–3153.
GUS (Główny Urząd Statystyczny). Departament Badań Społecznych
i Warunków Życia. Red. Łysoń P. Uczestnictwo Polaków w sporcie i rekreacji
ruchowej w 2012. Zakład Wydawnictw Statystycznych, Warszawa
2013.
GUS (Główny Urząd Statystyczny). Departament Badań Społecznych. Stan
zdrowia ludności Polski w 2009. Opracowanie: Zajenkowska -Kozłowska A.
Zakład Wydawnictw Statystycznych. Warszawa 2011.
Hackney A.C.: Eff ects of endurance exercise on the reproductive system
of men: the “exercise -hypogonadal male condition. J Endocrinol Invest.
2008, 10, 932–938.
Hajizadeh M.B., Tartibian B., Eghbali M., Asri -Rezaei S.: Comparison of seminal
oxidants and antioxidants in subjects with diff erent levels of physical
fi tness. Andrology. 2013, 4, 607–614.
Hajizadeh M.B., Tartibian B.: Long -term low -to -intensive cycling training:
impact on semen parameters and seminal cytokines. Clin J Sport Med. 2014,
doi: 10.1097/JSM.0000000000000122
Jung A., Schuppe H.C.: Infl uence of genital heat stress on semen quality in
humans. Andrologia. 2007, 6, 203–15.Kasprowicz K., Ziemann E., Ratkowski W., Laskowski R., Kaczor J.J., Dadci R. i wsp.:
Running a 100 -km ultra -marathon induces an infl ammatory response but
does not raise the level of the plasma iron -regulatory protein hepcidin.
J Sports Med Phys Fitness. 2013, 5, 533–537.
Korfanty J., Stokowy T., Widlak P., Gogler -Piglowska A., Handschuh L.,
Podkowiński J.: Crosstalk between HSF1 and HSF2 during the heat shock
response in mouse testes. Int J Biochem Cell Biol. 2014, 57, 76–83.
Koziorowska -Gilun M., Gilun P., Fraser L., Koziorowski M., Kordan W., Stefanczyk -
-Krzymowska S.: Antioxidant enzyme activity and mRNA expression in
reproductive tract of adult male European Bison (Bison bonasus, Linnaeus
1758). Reprod Domest Anim. 2013, 1, 7–14.
Kupchak B.R., Kraemer W.J., Hoff man M.D., Phinney S.D., Volek J.S.: Th e impact
of an ultramarathon on hormonal and biochemical parameters in men.
Wilderness Environ Med. 2014, 3, 278–288.
Łagowska K., Jeszka J.: Are young female athletes at risk of amenorrhoea?
An analysis of body composition and nutritional and endocrine factors.
Acta Sci.Pol. Technol. Aliment. 2011, 10, 227–232.
Macdonald A.A., Stewart A.W., Farquhar C.M.: Body mass index in relation
to semen quality and reproductive hormones in New Zealand men: a cross-
-sectional study in fertility clinics. Hum Reprod. 2013, 12, 3178–3187.
Robeva R., Tomova A., Kirilov G., Kumanov P.: Anti -Müllerian hormone
and inhibin B levels refl ect altered Sertoli cell function in men with metabolic
syndrome. Andrologia. 2012, 44, Suppl 1, 329–334.
de Rome L., Boufous S., Georgeson T., Senserrick T., Ivers R.: Cyclists’ clothing and
reduced risk of injury in crashes. Accid Anal Prev. 2014, 73, 392–398.
Sacco E., Marangi F., Pinto F., D’Addessi A., Racioppi M., Gulino G. i wsp.: Sports
and genitourinary traumas. Urologia. 2010, 2, 112–125.
Safarinejad M.R., Azma K., Kolahi A.A: Th e eff ects of intensive, long -term
treadmill running on reproductive hormones, hypothalamus -pituitary-
-testis axis, and semen quality: a randomized controlled study. J Endocrinol.
2009, 3, 259–271.
Sommer F., Goldstein I., Korda J.B.: Bicycle riding and erectile dysfunction:
a review. J Sex Med. 2010, 7, 2346–2358.
Sommer F., Konig D., Graft C., Schwarzer U., Bertram C,. Klotz T. i wsp.: Impotence
and genital numbness in cyclists. Int J Sports Med. 2001, 22, 410–413.
Szyguła Z., Strzała M., Rolski Z.: Triada zaburzeń u kobiet uprawiających
sport – nieprawidłowe łaknienie, brak miesiączki i osteoporoza. Med Sport
Practica, 2010, 1, 1–7.
Tartibian B., Maleki B.H.: Correlation between seminal oxidative stress biomarkers
and antioxidants with sperm DNA damage in elite athletes and
recreationally active men. Clin J Sport Med. 2012, 2, 132–139.
Tomada N., Tomada I., Cruz F., Vendeira P., Neves D.: Characterization of VEGF
and angiopoietins expression in human corpus cavernosum during aging.
J Sex Med. 2010, 7, 1410–1418.
Turgut A.T., Kosar U., Kosar P., Karabulut A.: Scrotal sonographic fi ndings in
Equestrians. J Ultrasound Med. 2005, 24, 911–917.
Ul Islam J., Browne R., Th ornhill J.: Mountain bikers priapism: a rare phenomenon.
Ir Med J. 2014, 1, 21–22.
WHO. Global recommendations on physical activity for health. World Health
Organization Press, Geneva; 2010.
Wise L.A., Cramer D.W., Hornstein M.D., Ashby R.K., Missmer S.A.: Physical
activity and semen quality among men attending an infertility clinic. Fertil
Steril. 2011, 3, 1025–1030
WPŁYW WYBRANYCH KSENOESTROGENÓW
NA MĘSKI UKŁAD ROZRODCZY SSAKÓW
THE IMPACT OF SOME XENOESTROGENS
ON MAMMALIAN MALE REPRODUCTIVE SYSTEM
Małgorzata Maria Dobrzyńska
Zakład Higieny Radiacyjnej i Radiobiologii, Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, Warszawa
Autor do korespondencji: Małgorzata Maria Dobrzyńska (mdobrzynska@pzh.gov.pl)
Małgorzata Maria Dobrzyńska – dr hab. n. med., prof. nadzwyczajny Narodowego Instytutu Zdrowia Publicznego –
Państwowego Zakładu Higieny (NIZP-PZH ) w Warszawie. Absolwentka Wydziału Biologii Uniwersytetu Warszawskiego.
Kierownik Pracowni Mutagenezy Radiacyjnej i Chemicznej Zakładu Higieny Radiacyjnej i Radiobiologii NIZP-PZH.
Członek Europejskiego Towarzystwa Mutagenezy Środowiskowej, Polskiego Genetycznego, Polskiego Towarzystwa
Badań Radiacyjnych. Stypendystka Royal Society w BIBRA International i na Uniwersytecie w Bradford w Wielkiej
Brytanii oraz na Uniwersytecie Padewskiego we Włoszech. Kierownik i współwykonawca projektów naukowych krajowych
i zagranicznych. Praca naukowo-badawcza autorki związana jest głównie z badaniami wpływu czynników
fi zycznych i chemicznych, ze szczególnym uwzględnieniem związków estrogenopodobnych, na gamety męskie in vivo
oraz in vitro, oraz na reprodukcję i rozwój potomstwa. Zajmuje się także mutagenezą radiacyjną i chemiczną oraz
wpływem nanocząstek na komórki somatyczne i generatywne.
Streszczenie
Ksenoestrogeny to związki pochodzenia egzogennego o niejednorodnej strukturze chemicznej, które wykazują zdolność interakcji
z układem hormonalnym i modulowania jego czynności w sposób charakterystyczny dla estrogenów, i które wykazują również działanie
antyandrogenne. Powszechne narażenie na ksenoestrogeny, które wchodzą w skład wielu produktów powszechnego użytku, uważane
jest za jedną z przyczyn zmniejszającej się objętości nasienia oraz pogarszającej się jego jakości. Może to prowadzić do niepłodności
i przyczyniać się do zwiększenia częstości występowania wad wrodzonych męskich narządów rozrodczych.
W niniejszej pracy omówiono działanie ftalanów butylobenzylu, dibutylu i dietyloheksylu oraz nonylofenolu i bisfenolu A. Wszystkie
te ksenoestrogeny powodują u ssaków zmniejszenie liczebności gamet męskich, zwiększenie częstości występowania zmian morfologicznych
oraz uszkodzeń DNA plemników, szczególnie w przypadku długotrwałego narażenia oraz narażenia, które rozpoczęło się
przed osiągnięciem dojrzałości płciowej. Zmiany indukowane w gametach męskich mogą powodować mutacje prowadzące do zwiększonej
śmiertelności pre - i postnatalnej potomstwa oraz do wystąpienia wad rozwojowych, opóźnienia w rozwoju i osiąganiu dojrzałości
płciowej, zaburzenia stosunku płci, a także obniżenia jakości nasienia w pokoleniu F1, dlatego wskazane jest ograniczenie kontaktu
z ksenoestrogenami osób dorosłych, a przede wszystkim dzieci.
słowa kluczowe: ksenoestrogeny, ilość i jakość plemników, potomstwo
Abstract
Xenoestrogens are exogenous group of compounds, which own heterogenous chemical structure. Th ey may interact with endocrine
system and mimic the action of natural hormones as well as may act as antiandrogens. Widespread exposure to xenostrogens, which
enter to composition of many articles of general applications, is considered one of reason reduced sperm volume and diminished sperm
quality, and may lead to infertility as well as contribute for increased frequency of congenital defects of male genitals.
Current paper describes the eff ects of benzylbutyl phthalate (BBP), di -n -butyl phthalate (DBP), di(2 -ethylhexyl)phthalate (DEHP), nonylphenol
(NP) and bisphenol A (BPA). All above xenoestrogens cause diminished sperm count, increased frequency of abnormal spermatozoa
and DNA damage in mammals, especially following long exposure and after starting of exposure before achievement of sexual
maturity. Changes induced in male gametes may cause mutations leading to increased pre - and postnatal mortality of the off spring and
to incidence of congenital malformations, growth retardation, delay in sexual development, disturbances in sex ratio and diminished
quality of semen in F1 generation. So, limitation of contact with xenoestrogens of adult and particularly of children is recommended.
key words: xenoestrogens, sperm count and quality, off spring
Skróty / Abbreviations
BBP – ftalan butylobenzylu (ang. benzylbutyl phthalate); BPA – bisfenol A (ang. bisphenol A); DBP – ftalan dibutylu (ang. di -n -butyl phthalate);
DEHP – ftalan di -2 -etyloheksylu (ang. di -(2 -ethylhexyl) phthalate); FSH – hormon folikulotropowy (ang. follicle -stimulating hormone);
3 -β -HSD – dehydrogenaza Δ-5-3 -β-hydroksysteroidowa (ang. 3 -β -hydroxysteroid dehydrogenase/Δ -5 -4 isomerase; NP – nonylofenol
(ang. nonylphenol); PCV – polichlorek winylu (ang. polyvinyl chloride); WWF – Światowy Fundusz na Rzecz Przyrody (ang. World Wide Fund
for Nature)
Parametry seminologiczne
współczesnego mężczyzny
W latach 90. minionego stulecia w czasopismach naukowych
zaczęły pojawiać się doniesienia dotyczące obniżenia
potencjału rozrodczego mężczyzn. Na podstawie
analizy 61 publikacji, które ukazały się pomiędzy 1938
a 1990 rokiem i obejmowały dane dotyczące 14 947
mężczyzn, Carlsen i wsp. (1992) stwierdzili, że w ciągu
50 -lecia średnia liczebność plemników w 1 mL nasienia
zmniejszyła się ze 113 mln w 1940 r. do 66 mln w 1990 r.
Jednocześnie średnia objętość nasienia zmniejszyła się
z 3,40 mL do 2,75 mL. Wyniki te zostały potwierdzone
w późniejszych badaniach obejmujących analizę 101 prac
opublikowanych w latach 1934–1996 (Swan i wsp., 2000),
natomiast najnowsze badania przeprowadzone w Danii
i Szwecji nie potwierdziły wsześniejszych wyników
co do zmniejszającej się liczebności plemników (Axelsson
i wsp., 2011, Jorgensen i wsp., 2012). Pogorszeniu uległa też
jakość nasienia – zaobserwowano wzrost częstości występowania
zmian morfologicznych plemników i zmniejszoną
ich ruchliwość (Bonde i Giwercman, 1995; Carlsen i wsp.,
1992). W tym samym czasie 2–4 -krotnie wzrosła zachorowalność
mężczyzn na nowotwory, takie jak rak jąder
i rak prostaty (Boyle i wsp., 1987). Ponadto, dwukrotnie
częściej rodzą się chłopcy, u których stwierdza się wady
narządów płciowych, takie jak wnętrostwo i spodziectwo
(Bonde i Giwercman, 1995; Carlsen i wsp., 1992). Zjawisko
zmniejszającej się liczby plemników w nasieniu współczesnych
mężczyzn, przy pogarszającej się równocześnie
jego jakości, powoduje zmniejszenie szans reprodukcji.
Stanowi to istotny problem z punktu widzenia zdrowia
publicznego i jest prawdopodobnie jedną z przyczyn
ujemnego przyrostu naturalnego w wielu krajach Europy.
Mechanizm działania estrogenów
i ksenoestrogenów
Człowiek narażony jest na działanie naturalnych i syntetycznych
związków chemicznych. Wśród nich ważną rolę
odgrywają związki estrogenopodobne (ksenoestrogeny).
Są to związki pochodzenia egzogennego o niejednorodnej
strukturze chemicznej, które wykazują zdolność interakcji
z układem hormonalnym i modulowania jego czynności
w sposób charakterystyczny dla estrogenów, i które wykazują
również działanie antyandrogenne (Pfl ieger-Bruss
i wsp., 2004; Słowikowska-Hilczer, 2006; Toft i wsp., 2004).
W piśmiennictwie angielskim ksenoestrogeny zaliczane
są do grupy związków zwanych endocrine disruptor lub
endocrine disrupting compounds. W języku polskim nazywane
są one najczęściej „modulatorami hormonalnymi”
lub „pseudohormonami” (Słowikowska -Hilczer i wsp.,
2013). Ksenoestrogenami są niektóre farmaceutyki (np.
środki antykoncepcyjne), metale (np. aluminium, kadm,
miedź), parabeny używane jako konserwanty w kosmetykach,
detergenty oraz związki używane do utwardzania
plastików, np. bisfenol A, ftalany (Langauer-Lewowicka
i Pawlas, 2015; Markey i wsp., 2002; Soto i wsp., 1995;
Woźniak i Murias, 2008).
Ksenoestrogeny dostają się do organizmu człowieka
i innych ssaków przede wszystkim drogą pokarmową.
Migrują one z opakowań do żywności i napojów, szczególnie
po podgrzaniu. Rzadszą, ale bardzo toksyczną
drogą narażenia jest inhalacja. Ponadto, ksenoestrogeny
mogą wnikać do organizmu przez skórę oraz dostawać
się bezpośrednio do krwioobiegu, przedostając się z produktów
medycznych podczas przeprowadzanych procedur.
Charakteryzują się lipofi lnością, która ułatwia
znacznie pokonywanie błon biologicznych i wnikanie
do wnętrza komórek oraz akumulację w tkance tłuszczowej.
Właściwość ta umożliwia również pokonanie
zarówno bariery łożyskowej, jak i bariery krew–mózg,
dlatego ksenoestrogeny oddziałują na rozwijające się organizmy
już od najwcześniejszych etapów życia (Latini i wsp.,
2004; Swan i wsp., 2005; Szychowski i Wojtowicz, 2013).
W organizmie kobiety estrogeny odpowiedzialne
są m.in. za kształtowanie narządów płciowych i piersi,
rozwój drugo- i trzeciorzędowych cech płciowych, regulują
cykl miesiączkowy, gospodarkę wapniowa i lipidową,
wpływają na zwiększanie syntezy białek wiążących
hormony tarczycy i nadnerczy oraz fi brynogenu, a także
zwiększają krzepliwość krwi i pobudliwość mięśni gładkich
(Frye, 2009; Świtalska i Strządała, 2007). Hormony
żeńskie, głównie estradiol, występują również w organizmie
mężczyzny. Estrogeny powstają z androgenów dzięki
aktywności enzymu aromatazy¹. Obecność receptorów
estrogenowych i aromatazy stwierdzono w układzie rozrodczym,
sercowo -naczyniowym, tkance tłuszczowej,
komórkach mięśniowych, mózgu, kościach i płucach
samców. Estrogeny wytwarzane są w nadnerczach,
wątrobie, gruczołach sutkowych i włosach oraz w gonadzie
męskiej. W mózgu samców oprócz receptorów dla
testosteronu występują receptory dla estrogenów oraz
enzym aromataza. Estrogeny pełnią ważną fi zjologiczną
rolę w męskim układzie rozrodczym, odpowiadają za prawidłowy rozwój układu rozrodczego w prenatalnym
okresie życia. Fizjologiczne działanie estradiolu polega
na współdziałaniu z hormonem folikulotropowym
(FSH, ang. follicle -stimulating hormone) przy dojrzewaniu
kanalika jądra oraz zapoczątkowaniu spermatogenezy.
W okresie dojrzewania płciowego są odpowiedzialne za
rozpoczęcie spermatogenezy, a następnie za utrzymanie
jej efektywności w całym okresie dojrzałości płciowej
poprzez wpływ na funkcjonowanie komórek Leydiga,
komórek Sertoliego oraz komórek plemnikotwórczych.
Hormony żeńskie odpowiadają także za resorpcję wody
przez kanaliki odprowadzające oraz komórki nabłonka
najądrza, wpływając w ten sposób na zagęszczenie plemników,
a także na kapacytację i reakcję akrosomalną
plemników oraz ich przeżywalność. Ponadto, estrogeny
wpływają na pobudzanie wzrostu i mineralizacji
kości, hamowanie wzrostu kości długich w końcowym
okresie dojrzewania płciowego, przeciwdziałanie rozwojowi
otyłości brzusznej i rozwój zaburzeń lipidowych
oraz mają działanie kardioprotekcyjne (Bilińska i wsp.,
2001, 2006; Hejmej i wsp., 2013; Filipiak i wsp., 2012;
Kula i wsp., 2001, 2004; O’Donnell i wsp., 2001; Walczak-
-Jędrzejowska i Kula, 2013).
Żeńskie hormony płciowe mogą wpływać bezpośrednio
lub pośrednio na ekspresję genów za pomocą
jądrowych receptorów estrogenowych α i β oraz oddziaływać
na komórkę poprzez receptory estrogenowe obecne
w rejonie błony komórkowej (działanie niegenomowe).
Estrogeny i ksenoestrogeny mogą wywierać wpływ
tylko na komórki zaopatrzone w receptory estrogenowe.
Najdokładniej poznane działanie estrogenów polega
na regulacji ekspresji określonych genów. Połączenie
hormonu z receptorem estrogenowym powoduje jego
fosforylację, zmianę konformacji i łączenie się z określonym
rejonem DNA. Kompleks estrogen–receptor
stanowi czynnik transkrypcyjny i nasila lub hamuje
ekspresję genów. Może także stymulować produkcję
innych czynników transkrypcyjnych wpływających
na transkrypcję niektórych genów (Diel, 2002; Switalska
i Strzągała, 2007).
Jednym z najpowszechniejszych mechanizmów
działania ksenoestrogenów jest mimikra hormonalna.
Podobieństwo strukturalne ksenoestrogenów szczególnie
do steroidowych hormonów płciowych powoduje,
że łatwo wiążą się one z receptorami estrogenów, a także
androgenów, najprawdopodobniej na zasadzie mechanizmu
kompetycyjnego (ligand o podobnej do estradiolu
budowie chemicznej łączy się z receptorem estrogenowym
i działa jako jego antagonista, aktywując receptor).
Ksenoestrogeny mogą także blokować receptory estrogenowe
lub za pośrednictwem receptora hamować oddziaływanie
naturalnych hormonów, wpływać na syntezę,
rozpad lub eliminację z ustroju hormonów, na biodostępność
hormonów, np. poprzez ograniczenie stężenia białka
wiążącego hormony płciowe, mogą też wpływać bezpośrednio
na ekspresję genów w DNA. Ponadto, mogą zaburzać
gospodarkę hormonalną oraz oddziaływać na aktywność
podwzgórza lub przysadki mózgowej (Sharpe, 2006).
W gonadach ksenoestrogeny m.in. zaburzają aktywność
dehydrogenazy Δ-5-3 -β-hydroksysteroidowej (3β -HSD,
ang. 3 -β -hydroxysteroid dehydrogenase/Δ -5 -4 isomerase)
i sekrecje hormonów steroidowych, lokalizację i ekspresję
ERα w komórkach Leydiga, ekspresję receptora androgenowego
i innych białek w gonadzie, modulują reakcję
akrosomalną (Hejmej i wsp., 2011; Kotula -Balak i wsp.,
2011, 2013, 2014).
Powszechne narażenie na ksenoestrogeny, uważane
za jedną z przyczyn zmniejszającej się objętości nasienia
oraz pogarszającej się jego jakości, może prowadzić do niepłodności
i przyczyniać się do zwiększenia częstości
występowania wad wrodzonych męskich narządów rozrodczych
(Carlsen i wsp., 1992; Rajpert -DeMeyts, 2006;
Sharpe i wsp., 1995; Sharpe, 2001; Słowikowska -Hilczer,
2006). Danych na temat wpływu ksenoestrogenów
na męski układ rozrodczy dostarczają głównie badania
na zwierzętach doświadczalnych. Omówione zostanie
działanie ftalanów butylobenzylu (BBP, ang. benzylbutyl
phthalate), dibutylu (DBP, ang. di -n -butyl phthalate) i di -2-
-etyloheksylu (DEHP, ang. di -2(2 -ethylhexyl) phthalate) oraz
nonylofenolu (NP, ang. nonylphenol ) i bisfenolu A (BPA,
ang. bisphenol A). Wyniki podsumowano w tabeli 1.
Ftalan butylobenzylu
Ftalan butylobenzylu jest cieczą oleistą, przezroczystą,
o słabym zapachu, stosowaną przede wszystkim jako
plastyfi kator przy produkcji wyrobów zawierających polichlorek
winylu (PCW, ang. polyvinyl chloride). Budowę
chemiczną BBP przedstawiono na rycinie 1. Ftalan ten


 może wchodzić w skład takich wyrobów jak winylowe
może wchodzić w skład takich wyrobów jak winylowe
wykładziny podłogowe, pokrycia dachowe, obicia tapicerskie,
przylepce i uszczelniacze, skóra syntetyczna, plastikowe
opakowania do żywności, zabawki, rozpuszczalniki
przemysłowe, artykuły pielęgnacyjne i kosmetyki
(Hauser i Calafat, 2005).
Narażenie na BBP podczas pracy zawodowej związane
jest przede wszystkim z inhalacją ftalanu. Oszacowane,
że stężenie BBP w powietrzu podczas produkcji ftalanów
wynosi 1 mg/m3, a podczas produkcji PCW 2 mg/m³,
co odpowiada narażeniu pracownika odpowiednio
na dawki 143 μg/kg/masy ciała/dzień (produkcja ftalanów)
i 286 μg/kg/masy ciała/dzień (produkcja PCW)
(RAR, 2004). Narażenie populacji generalnej, związane
z występowaniem BBP w produktach codziennego
użytku, następuje głównie za pośrednictwem
wody do picia, żywności i kurzu domowego. Badania
Federalnego Urzędu Ochrony Środowiska wykazały
średnią obecność 48 mg BBP na kg kurzu domowego
(Nagorka i wsp., 2010). Dzienne narażenie osób dorosłych
na BBP szacowane jest na 2 μg/kg masy ciała, a narażenie
dzieci może być nawet 3 -krotnie wyższe (Kavlock i wsp.,
2002). Badania przeprowadzone na populacji Hong-
-Kongu wykazały 0,82–1,97 ng (średnio 1,30 ng) BBP
w mL surowicy krwi, przy czym poziomy te były wyższe
u osób poniżej 40. r.ż. (Wan i wsp., 2013). Stężenie metabolitów
BBP w moczu ciężarnych kobiet z Tajwanu wynosiło
od poniżej 0,25–55 μg/L (średnia 1,23 μg/L), u ich
2 -letnich dzieci średnio 3,86 μg/L, a u dzieci 5 -letnich
3,66 μg/L (Lin i wsp., 2011).
Podawanie dorosłym szczurom w diecie 2,5% (v/v) lub
5% (v/v) BBP przez 14 dni wpływa na zmniejszenie masy
ich jąder i najądrzy (Agarwal i wsp., 1985). Długotrwałe
narażenie (4–25 tygodni) szczurów powoduje zmniejszenie
masy jąder, najądrzy i prostaty oraz zmniejszenie
liczby plemników (Li i wsp., 2004; NTP, 1997). Narażanie
samców myszy na BBP przez jeden pełny cykl spermatogenezy
przyczynia się do nieznacznego zmniejszenia
liczebności oraz istotnego pogorszenia jakości gamet,
przejawiającego się znacznym zwiększeniem odsetka
plemników o nieprawidłowej budowie (Tyrkiel i wsp.,
2007).
Podawanie BBP ciężarnym samicom szczura wpływa
toksycznie na zarodki i płody, prowadząc do ich śmierci
przed implantacją lub po niej. Obserwowano także
zmniejszenie ciężaru jąder i najądrzy oraz odległości anogenitalnej
(odległość odbytu od narządów płciowych), jak
również zwiększenie częstości występowania nieprawidłowości
w budowie narządów rozrodczych (Ahmad i wsp.,
2014; Ema i Miyawaki, 2002; Ema i wsp., 1998; Nagao
i wsp., 2000). Narażanie samic szczura Wistar na BBP
w dawkach 500 i 1000 mg/kg/dzień od 15. do 17. dnia
ciąży powoduje zmniejszenie wielkości miotów oraz
wpływa niekorzystnie na rozwój układu rozrodczego
samców potomnych, powodując wnętrostwo i zmniejszenie
odległości anogenitalnej u samców pokolenia
F1 (Ema i Miyawaki, 2002). Ekspozycja samic szczurów
na BBP od 14. dnia do końca ciąży indukuje zmniejszenie
ciężaru ciała płodów bezpośrednio po urodzeniu oraz
w 21. dniu życia. Ponadto, po zastosowaniu in utero BBP
w dawce 100 mg/kg odnotowano zmniejszenie ciężaru
organów reprodukcyjnych, liczby plemników i ich ruchliwości
oraz zwiększenie odsetka plemników o nieprawidłowej
morfologii oraz wzmożoną produkcję testosteronu
u dojrzałych płciowo samców pokolenia F1 (Ahmad
i wsp., 2014).
Ftalan butylobenzylu podawany samicom gryzoni
podczas ciąży i laktacji może działać jako antyandrogen,
powodując zmniejszenie produkcji testosteronu u płodów
płci męskiej, co prowadzi do deformacji zewnętrznych
narządów płciowych, degeneracji kanalików nasiennych
i zmniejszenia produkcji nasienia (Gray i wsp., 2000;
Sharpe, 2001). U potomstwa F1 szczurów, którym podawano
BBP przed kojarzeniem oraz podczas ciąży, stwierdzono
zmniejszenie ciężaru jąder i najądrzy oraz zmiany
histopatologiczne w budowie kanalików nasiennych
i komórek Leydiga, szczególnie po zastosowaniu najwyższej
dawki – 400 mg/kg mc/dzień, natomiast u samców
pokolenia F2 obserwowano zmniejszenie odległości anogenitalnej
(Aso i wsp., 2005). Z kolei narażenie na BBP
w okresie perinatalnym powoduje także zmniejszenie
masy jąder i liczby plemników, jak również opóźnienie
dojrzałości płciowej samców (Ashby i wsp., 1997; Nagao
i wsp., 2000; Piersma i wsp., 2000; Tyl i wsp., 2004).
Ftalan dibutylu
Ftalan dibutylu (ester butylowy kwasu ftalowego) to bezbarwna
lub bladożółta ciecz o słabym zapachu przypominającym
eter oraz wyrazistym gorzkim smaku. Budowę
chemiczną DBP przedstawiono na rycinie 2. Używany
jest jako plastyfi kator PCW, do impregnacji tekstyliów
oraz jako rozpuszczalnik do farb i jako środek przeciwpieniący.
Obecność DBP można stwierdzić w wyrobach
plastikowych, kontenerach do przechowywania żywności,
tuszach drukarskich, klejach, tkaninach impregnowanych,
w produktach higieny osobistej, kosmetykach
i środkach do pielęgnacji paznokci (CIRC, 1985). Obecność
DBP w ilości 444,567– 1671,139 μg/mL stwierdzono
w 19 z 21 lakierów do paznokci oraz 11 z 42 próbek
perfum (Koo i Lee, 2004).
Stężenie DBP w wodach powierzchniowych
Stanów Zjednoczonych Ameryki oraz Europy wynosi
0,01–622,9 μg/dm³ (Wypych, 2004). Na podstawie
badań przeprowadzonych w różnych europejskich
zakładach pracy wykazano, że stężenie DBP na większości
stanowisk pracy przy produkcji tego ftalanu nie
przekracza 0,5 mg/m³, jakkolwiek na niektórych było
nawet 10 -krotnie wyższe. Stężenia DBP podczas wytwarzania
produktów zawierających ten związek wnosiło
0,19–0,75 mg/m³ przy produkcji; < 0,008 mg/m³ przy
produkcji polimerów; < 0,03 mg/m³ przy produkcji polimerów
dla przemysłu dekarskiego (RAR, 2004). Obecność
DBP w ilości 36–50 mg/kg wykazano także w kurzu
domowym (Heudorf i wsp., 2007; Nagorka i wsp., 2010).
Narażenie zawodowe (przede wszystkim inhalacja oraz
w mniejszym stopniu kontakt ze skórą) oszacowano
na ok. 143 μg/kg masy ciała/dzień, a narażenie populacji
generalnej (przede wszystkim droga pokarmowa)
na 2–10 μg/kg masy ciała/dzień (NTP -CERHR, 2003).
W badaniu Światowego Funduszu na Rzecz Przyrody
(WWF, ang. World Wide Fund for Nature) średnie stężenie
DBP we krwi polskich uczestników wynosiło 23,4
ng/g (Struciński i wsp., 2006). Z kolei w surowicy krwi
mieszkańców Hong -Kongu stwierdzono 0,77–12,50 ng
(średnio 4,19 ng) DBP w mL (Wan i wsp., 2013). Badania
chińskie wykazały średnio 7,67 mg/L DBP we krwi matek
oraz 5,71 mg/L w krwi pępowinowej (Lin i wsp., 2008).
W innych badaniach przeprowadzonych w Chinach
stwierdzono u kobiet po odbytym porodzie DBP w stężeniu
średnio 84,75 μg/mL we krwi żylnej, 52,23 μg/mL
we krwi pępowinowej, 57,78 μg/mL w mleku oraz
24,93 μg/mL w moczu (Chen i wsp., 2008). Stężenie metabolitów
DBP w moczu ciężarnych kobiet z Tajwanu wynosiło
1,02– 269 μg/L, u dzieci 2 -letnich 3,31–252,69 μg/L,
a u 5 -letnich 4,16–165 μg/L (Lin i wsp., 2011).
W badaniach na zwierzętach wykazano, że DBP
wpływa szczególnie toksycznie na reprodukcję samców,
ponieważ powoduje zaburzenia procesów różnicowania
i rozwoju tkanek androgenozależnych, prowadząc do niedorozwoju
gonad męskich, martwicy nabłonka kanalików
nasiennych, a w konsekwencji do obniżenia zdolności rozrodczych
(Barlow i wsp., 2004; Gray i wsp., 2000; Kavlock
i wsp., 2002; Mylchreest i wsp., 1998). Podawanie DBP
dorosłym gryzoniom powoduje występowanie zmian
patologicznych i biochemicznych w jądrach, zmniejszenie
masy jąder i najądrzy oraz hypospermię (Boekelheide i wsp.,
2004; Marsman, 1995; Sharpe i wsp., 1995). Wykazano,
że potencjalnym celem ftalanów, szczególnie DBP,
są komórki Sertoliego. Komórki te nie namnażają się
po osiągnięciu dojrzałości płciowej, dlatego ich uszkodzenie
może w sposób istotny wpływać na zaburzenie
procesu spermatogenezy (Fukuoto i wsp., 1989; Heindel
i Chapin, 1989; Heindel i Powell, 1992; Jobling i wsp.,
1995). W następstwie podawania DBP samcom myszy
przez 8 tygodni obserwowano także pogorszenie jakości
gamet, a w szczególności zwiększenie odsetka plemników
o nieprawidłowej budowie (Dobrzyńska i wsp., 2009).
Jednorazowe podanie DBP 3 -tygodniowym szczurom
powoduje opóźnienie w dojrzewaniu gamet męskich
(Alam i wsp., 2010). Ponadto stwierdzono, że ftalan dibutylu
podawany szczurom indukuje stres oksydacyjny prowadzący
do zmian w strukturze i funkcjonowaniu najądrzy
(Zhou i wsp., 2011).
Ekspozycja na DBP in utero może indukować zaburzenie
w ekspresji genów wpływających na rozwój
organów androgenozależnych, czego rezultatem jest
nieprawidłowy rozwój organów reprodukcyjnych (Kim
i wsp., 2010). W badaniach na zwierzętach laboratoryjnych
stwierdzono, że DBP działa toksycznie na rozwój
gryzoni powodując zmiany teratogenne po zastosowaniu
wyższych dawek, przy braku równoczesnego efektu
u narażanych samic (Ema i wsp., 1993, Shiota i Nishimura,
1982). Narażenie płodów na DBP za pośrednictwem ciężarnych
samic indukuje zaburzenia organogenezy jąder,
wnętrostwo, spodziectwo, zmniejszenie liczebności plemników
i produkcji testosteronu oraz niepłodność u 60%
potomstwa płci męskiej (Fisher i wsp., 2003; McKinnell
i wsp., 2005; Mylchreest i wsp., 1998, 2002). Narażanie
płodów od 7. do 14. dnia ciąży powoduje u dorosłych zwierząt
znaczne zmniejszenie liczebności plemników, ich
żywotności i ruchliwości oraz zwiększenie liczby gamet
o nieprawidłowej budowie (Giribabu i wsp., 2014). Ftalan
dibutylu powoduje także zmniejszenie produkcji testosteronu
oraz zaburzenia metabolizmu hormonów steroidowych
w pokoleniu F1 (Ahmad i wsp., 2014; Giribabu i wsp.,
2014; Hirosawa i wsp., 2006; Kim i wsp., 2010; Lehmann
i wsp., 2004; Xiao -feng i wsp., 2009). U potomstwa samic
szczurów, którym podawano DBP od 14. dnia do końca
ciąży, obserwowano w okresie postnatalnym zmniejszenie
ciężaru ciała. W dawce co najmniej DBP 50 mg/kg
indukuje zmniejszenie ciężaru organów reprodukcyjnych,
liczby plemników i ich ruchliwości oraz zwiększenie
odsetka plemników o nieprawidłowej budowie
u dojrzałych płciowo samców pokolenia F1 (Ahmad
i wsp., 2014). Podawanie ciężarnym samicom szczura
DBP w okresie bezpośrednio poprzedzającym różnicowanie
się jąder wpływa na znaczną redukcję liczby
zarodkowych komórek płciowych oraz ograniczenie ich
różnicowania (Jobling i wsp., 2011).
Narażenie płodów in utero lub noworodków zwierząt
laboratoryjnych na DBP powoduje nieprawidłowy rozwój
układu rozrodczego oraz zmniejszenie produkcji i ruchliwości
gamet, a także zwiększenie odsetka plemników
o nieprawidłowej morfologii u dorosłych zwierząt (Ahmad
i wsp., 2014; Auharek i wsp., 2010; Jeng i Yu, 2008; Kim
i wsp., 2004; Kleymenova i wsp., 2005; Mahood i wsp., 2007;
Wang i wsp., 2005; Working i wsp., 1985; Zhang i wsp., 2004).
Badania Colborn i Clement (1992) oraz Wine i wsp. (1997)
wykazały, że DBP może w większym stopniu wpływać
na niepłodność i pogorszenie jakości gamet u potomstwa
niż u zwierząt, którym podawano ftalan. Niższa
liczebność plemników oraz ich obniżona jakość może być
spowodowana zaburzeniami w przebiegu procesu spermatogenezy
indukowanymi przez ftalany (Ahmad i wsp., 2014).
Lee i wsp. (2004) wykazali niewielkie opóźnienie
w osiąganiu dojrzałości płciowej u szczurów narażanych
na DBP podczas ciąży i laktacji. Podawanie DBP
samicom szczura w ostatnim trymestrze ciąży powoduje
opóźnienia zstąpienia jąder u samców pokolenia F1
(Ema i wsp., 2000). Z kolei narażenie na DBP w dawkach
250–500 mg/kg m.c. podczas ciąży i laktacji powoduje
zmniejszenie odległości anogenitalnej u samców pokolenia
F1 (Zhang i wsp., 2004). Podawanie DBP w dawce
500 mg/kg m.c. przez 8 tygodni samcom myszy pokolenia
F0 nie wpływa na obniżenie ich płodności, powodując
jednocześnie opóźnienie we wzroście młodych
oraz zaburzenie stosunku płci u potomstwa (rodziło się
dwukrotnie więcej samców niż samic). Ponadto, narażenie
samców przed kojarzeniem z samicami indukuje
2,5 -dniowe opóźnienie w otwarciu pochwy u samic pokolenia
F1. Ftalan dibutylu podawany samcom pokolenia
F0 w dawce 2000 mg/kg m.c. wpływa na zwiększenie
częstości występowania plemników o nieprawidłowej
morfologii w pokoleniu ich synów (Dobrzyńska i wsp.,
2011).
W badaniach nasienia mężczyzn z par bezpłodnych
stwierdzono zależność pomiędzy stężeniem w moczu
metabolitu DBP, ftalanu monobutylowego a liczbą i jakością
plemników (Duty i wsp., 2003a, 2003b; Hauser i wsp.,
2007). W badaniach in vitro nasienia ludzkiego stwierdzono
zmniejszenie żywotności i ruchliwości gamet pod
wpływem działania DBP (Pant i wsp., 2011).
Ftalan di -2 -etyloheksylu
Ftalan di -2 -etyloheksylu (ftalan dwu -2 -etyloheksylu, ester
dwuoktylowy kwasu 1,2 -benzenodwukarboksylowego)
jest oleistą cieczą stosowana w przemyśle chemicznym.
Budowę chemiczną DEHP przedstawiono na rycinie 3.
Ftalan di -2 -etyloheksylu jest najczęściej stosowanym
plastyfi katorem (ok. 50% zużycia ftalanów) dla tworzyw
sztucznych (PCW, polipropylen, polietylen), farb, mieszanek
gumowych, kabli. Stosowany jest również jako
modyfi kator dla żywic epoksydowych oraz w płynach
dielektrycznych i hydraulicznych używanych w kondensatorach.
Ftalan ten może wchodzić w skład różnych
ze sztucznej skóry, meble i dodatki tapicerskie, plastikowe
węże, rury i kabli, obrusy i zasłony prysznicowe,
płaszcze i obuwie przeciwdeszczowe, detergenty, kleje,
lakiery oraz farby (ATSDR, 2002). Jednym z najważniejszych
źródeł narażenia na DEHP są wyroby medyczne
(plastikowe zestawy do transfuzji, woreczki do przechowywania
krwi, zestawy do intubacji, dializ, maseczki
tlenowe, itp.). Ftalan di -2 -etyloheksylu jest też istotnym
składnikiem opakowań do przechowywania żywności
i zabawek dla dzieci (Fauozi i wsp., 1999; Parks i wsp.,
2000; U.S. EPA, 1999).
Wartości stężenia DEHP w wodach powierzchniowych
wynoszą 0–97,8 μg/L, a w wodach gruntowych
0–5,661 μg/L. W ściekach stwierdzono obecność DEHP
w ilości 0,716–400 μg/L, a w glebie 1–264 mg/kg suchej
masy (Zolfaghari i wsp., 2014). Stężenie DEHP w powietrzu
pomieszczeń mieszkalnych wynosi od poniżej 0,002 μg/L
do 5 ng/m³ (Fromme i wsp., 2004), a w halach produkcyjnych
ok. 60 ng/m³ (Kim i wsp., 2003). Zawartość DEHP
w wodzie do picia, która jest istotnym źródłem tego
ftalanu, jest różna w różnych krajach świata, przykładowo
w Polsce i Niemczech wynosi 0,05–0,06 μg/L, w Grecji
0,93 μg/L, w USA 0,95 μg/L, a w Chinach 3,47 μg/L
(Zolfaghari i wsp., 2014). Dzienną dawkę DEHP pobieraną
przez człowieka z żywnościa szacuje się na 25 μg
(Nakamiya i wsp., 2005). Przykładowo w rybach stężenie
DEHP wynosi 129,5–253,9 mg/kg suchej masy (Huang
i wsp., 2008). Badania przeprowadzone w krajach europejskich
wykazały, że średnie stężenie DEHP w mleku
wynosi 12 mg/L, a w serze 2000 mg/L (Sharman i wsp.,
1994). Na tej podstawie oszacowano dawkę DEHP przyjmowaną
przez niemowlęta z mlekiem matki oraz krowim
na 1–10 μg/kg/dzień (Kamrin, 2009). Produkty higieny
osobistej, kosmetyki i zabawki powodują narażenie
na dawki 8,2–25,8 μg/kg dziennie (Kavlock i wsp., 2006).
Pozostałości DEHP są wykrywane we krwi i innych
tkankach pacjentów poddawanych wielokrotnym transfuzjom
krwi lub innym zabiegom medycznym (Faouzi
i wsp., 1999; Sjöberg i wsp., 1985). Osoby te mogą otrzymywać
znacznie większe dawki DEHP niż populacja generalna,
na przykład pacjenci poddawani dializom mogą
być narażeni na dawkę 12 g DEHP w ciągu roku (Fauozi
i wsp., 1999). Podkreślić należy zagrożenie związane
z ekspozycją dzieci na DEHP uwalniający się z zabawek
oraz narażenie ciężarnych pacjentek poddawanych dializom
i transfuzjom krwi na DEHP będący składnikiem
wyrobów medycznych stosowanych w tych procedurach
(Parks i wsp., 2000).
Średnie stężenie DEHP w krwi polskich uczestników
badania WWF wynosiło 181,1 ng/g krwi (Struciński
i wsp., 2006). W surowicy krwi mieszkańców Hong-
-Kongu stwierdzono 3,15–28,45 ng (średnio 11,13 ng)
DEHP w mL (Wan i wsp., 2013). Badania przeprowadzone
w Chinach wykazały średnio 8,84 mg/L DEHP
w krwi matek oraz 5,20 mg/L w krwi pępowinowej (Lin
i wsp., 2008). Stężenie metabolitów DEHP w moczu
ciężarnych kobiet z Tajwanu wynosiło 0,09–859 μg/L,
u ich 2 -letnich dzieci 1,25–8,81 μg/L, a u dzieci w wieku
5 lat 1,04–1390 μg/L (Lin i wsp., 2011).
Ftalan di -2 -etyloheksylu zaburza ekspresję genów
związanych z rozwojem jąder i syntezą hormonów steroidowych
(Shultz i wsp., 2001; Wong i Gill, 2002). Podobnie
jak w przypadku innych ftalanów, głównym celem toksycznego
działania DEHP są komórki Sertoliego, których
dysfunkcja może prowadzić do zaburzeń w rozwoju
i różnicowaniu kolejnych stadiów rozwojowych gamet
męskich, a w szczególności do progresywnej degeneracji
spermatocytów i spermatyd (Sjoberg i wsp., 1985). Ftalan
ten indukuje zmiany morfologiczne komórek Sertoliego,
czego rezultatem jest nekroza spermatogoniów oraz usuwanie
spermatocytów i spermatyd ze światła kanalików
nasiennych (Jones i wsp., 1993; Poon i wsp., 1997). U dorosłych
samców szczurów, którym podawano przez 5 dni
DEHP w dawkach 1000 mg/kg i 2000 mg/kg/dzień,
stwierdzono całkowity zanik spermatogoniów i spermatocytów
(Dostal i wsp., 1988).
Badania na zwierzętach laboratoryjnych wykazały,
że DEHP działa toksycznie na reprodukcję i rozwój
ssaków (DFG, 2002; Kavlock i wsp., 2002). Podawanie
DEHP gryzoniom w skrajnych przypadkach prowadzi
do zaniku spermatogenezy i atrofi i jąder (Ablake i wsp.,
2004; Ishihara i wsp., 2000). Narażanie samców dojrzewających
płciowo lub dorosłych gryzoni na ten ftalan
powoduje zmniejszenie produkcji testosteronu i nasienia
oraz ciężaru jąder i najądrzy, indukuje też zmiany patologiczne
w jądrach (Agarwal i wsp., 1986; Arcadi i wsp., 1998;
ATSDR, 2002; Dobrzyńska i wsp., 2007, 2012; Ishihara i wsp.,
2000; Kavlock i wsp., 2002; Kwack i wsp., 2009; Moore i wsp.,
2001; Parmar i wsp., 1986; Siddiqui i Srivatsava, 1992).
Może powodować również zmniejszenie ruchliwości
plemników i zmiany w budowie gamet (Agarwal i wsp.,
1986; Dobrzyńska i wsp., 2007, 2012). Myszy, którym
podawano DEHP (500 mg/kg/dzień) przez 4 tygodnie,
wykazywały 3 -krotnie więcej mutacji w DNA komórek
gonady niż zwierzęta kontrolne (Huang i wsp., 2012).
Podawanie samcom myszy DEHP od 7. dnia życia prowadzi
w 60. dniu życia do pogorszenia jakości i zmniejszenia
liczby gamet oraz do zmian histopatologicznych
w jądrach. Według Zhang i wsp. (2013) przyczyną tych
zjawisk jest spowodowana przez DEHP zmniejszona ekspresja
genów DDx3Y, Usp9Y, RBM, E1F1AY, EGF, FSHR,
EGFR. Redukcję wielkości miotów u gryzoni obserwowano
w wyniku podawania DEHP samcom przed kojarzeniem
z samicami (Agarwal i wsp., 1986; Dobrzyńska
i wsp., 2012), ciężarnym samicom (Moore i wsp., 2001)
oraz rodzicom obu płci (Lamb i wsp., 1987).
Prekoncepcyjne narażanie samców niedojrzałych
płciowo na DEHP przez 8 tygodni powoduje znaczne
zwiększenie częstości braku ciąży u samic kojarzonych
z tymi samcami oraz zwiększenie częstości występowania
martwych płodów w miotach (Dobrzyńska i wsp.,
2012). Z kolei w przypadku ekspozycji samców dorosłych
na dawkę 8000 mg/kg m.c./dzień obserwowano zmniejszenie liczby płodów żywych w miotach
(Dobrzyńska i wsp., 2007). Podobnie redukcję liczby
płodów żywych w pokoleniu F1 notowano w następstwie
podawania DEHP w paszy samcom i samicom myszy
(Lamb i wsp., 1987). Inne badania wykazały, że narażenie
na DEHP in utero i w okresie laktacji indukuje zwiększającą
się zależnie od dawki śmiertelność postnatalną potomstwa
(Moore i wsp., 2001). Podobne efekty odnotowano
w następstwie narażania samców na DEHP w dawkach
2000 i 8000 mg/kg m.c./dzień przez 8 tygodni poprzedzających
zapłodnienie (Dobrzyńska i wsp., 2007).
Prenatalne narażanie na DEHP indukuje u płodów
widoczne wady rozwojowe oraz wady w budowie szkieletu
(Dobrzyńska i wsp., 2012; Gray i wsp., 2000; Hellwig
i wsp., 1997; Shirota i wsp., 2005). Podawanie ciężarnym
samicom szczura DEHP w dawce co najmniej 1000 mg/kg
m.c./dzień powoduje zmniejszenie liczby żywych płodów
w miotach, ich ciężaru ciała oraz zwiększenie liczby ww.
wad (Gray i wsp., 2000; Hellwig i wsp., 1997; Moore i wsp.,
2001). Ponadto u potomstwa myszy narażanych na DEHP
od 7. do 14. dnia ciąży stwierdzono w pokoleniach od F1
do F4 redukcję liczby plemników i pogorszenie ich jakości
(Doyle i wsp., 2013).
Prekoncepcyjne 8 -tygodniowe podawanie DEHP
dorosłym samcom myszy powoduje znaczne opóźnienie
w zstąpieniu jąder samców pokolenia F1 (Dobrzyńska
i wsp., 2007). Podobnie, u szczurów narażanych na DEHP
podczas ciąży i laktacji obserwowano znaczne zwiększenie
częstości występowania wad w układzie rozrodczym oraz
nieprawidłowości w rozwoju seksualnym samców (Borch
i wsp., 2004; Gray i wsp., 2000; Moore i wsp., 2001; Parks
i wsp., 2000). Podawanie ciężarnym samicom metabolitu
DEHP i ftalanu monobenzylu może być przyczyną
zwiększenia liczby przypadków wnętrostwa u potomstwa
(Ema i wsp., 2003). U potomstwa F1 szczurzyc narażanych
na DEHP podczas ciąży i podczas laktacji stwierdzono
zmniejszenie odległości anogenitalnej i liczby
plemników oraz pogorszenie ich jakości (Andrade i wsp.,
2006; Dalsenter i wsp., 2006; Gray i wsp., 2000; Vo i wsp.,
2009). U myszy DEHP redukuje ciężar jąder potomstwa
samic narażanych podczas ciąży (Song i wsp., 2009) oraz
zmniejsza ruchliwość gamet u potomstwa samców narażanych
przez cały okres spermatogenezy (Dobrzyńska i wsp.,
2012). Niektóre badania wykazały, że układ rozrodczy
samców jest najbardziej wrażliwy na działanie DEHP we
wczesnych etapach rozwoju (Gray i Beamand, 1984; Gray
i Butterworth, 1980; Moore i wsp., 2001). Noriega i wsp.
(2009) wykazali, że podawanie DEHP dojrzewającym
samcom szczura Long -Evans i Sprague -Dawley powoduje
opóźnienie w osiąganiu dojrzałości płciowej oraz zmniejszenie
ciężaru tkanek androgenozależnych. Gonady
młodych niedojrzałych płciowo gryzoni są bardziej wrażliwe
na uszkodzenia indukowane przez DEHP, a zmiany
te mogą być obserwowane po krótszym okresie ekspozycji
niż w przypadku dorosłych zwierząt (Dobrzyńska
i wsp., 2012; Sjoberg i wsp., 1985).Podobnie jak w badaniach
in vivo, mysie plemniki, które in vitro podawano
działaniu DEHP (1 μg/mL), wykazywały znacznie
mniejszą zdolność reprodukcyjną (Huang i wsp., 2012).
Nonylofenol
Nonylofenol jest oleistą bezbarwna cieczą o charakterystycznym
zapachu. Jest mieszaniną izomerów zawierających
głównie p -nonylfenol. Budowę chemiczną NP przedstawiono
na rycinie 4. Nonylofenol używany jest głównie
do produkcji niejonowych środków powierzchniowo czynnych
oraz żywic epoksydowych i fenolowych. Stosowany
jest także jako dodatek do smarów oraz w produkcji chemikaliów
rolniczych i w przemyśle oponiarskim. Ponadto,
występuje w wielu produktach codziennego użytku,
szczególnie w wyrobach zawierających PCW, takich jak
opakowania do żywności, zabawki, folie, rury plastikowe
oraz detergenty, środki dezynfekujące i owadobójcze,
farby, pestycydy (Soares i wsp., 2008). Pojawiały się tez
informacje o wykryciu nonylofenolu i jego etoksylatu
w odzieży produkowanej w Azji.
Ryc. 4. Budowa chemiczna nonylofenolu
Fig. 4. Chemical structure of nonylphenol
 Obecność NP stwierdzono w próbach środowiskowych
z różnych krajów. Wyniki opisano szczegółowo
w pracy poglądowej (Careghini i wsp., 2015). Wykazano
obecność NP w glebie w ilości 0,01–0,95 μg/kg suchej
masy, w osadach dennych od 3,6 μg/kg do 72 mg/kg
suchej masy. Stężenie NP w wodach gruntowych wynosiło
0,001–3,85 mg/m³, a w wodach powierzchniowych
od 3×10−⁴ do 37,3 mg/m³ (Careghini i wsp., 2015).
W wodach ściekowych stężenie tego związku wynosiło
0,05 μg/dm³, a w ściekach poprzemysłowych w USA
0,1–253 μg/dm3 (Diaz i Ventura, 2002; Kuch i Ballshmiter,
2000; Lee i wsp., 2000).
Narażenie ludzi na NP związane jest głównie z jego
migracją z rur plastikowych do wody wodociągowej
oraz do żywności z pojemników używanych podczas
jej produkcji i przechowywania (Soto i wsp., 1991). Woda
przechowywana w pojemnikach z PCW może zawierać
300 ng/L nonylofenolu (Guenther i wsp., 2002; Soto i wsp.,
1991), a w plastikowych butelkach 15–300 μg/m³ (Loyo-
-Rosales i wsp., 2004). Znaczne stężenie NP stwierdzono
w produktach spożywczych (0,1–100 μg/kg świeżej masy)
oraz w napojach (< 7,7 μg/m³ do 0,30 mg/m³) z rożnych
krajów Europy. Najwyższe stężenie tego związku
wykazano w marchwi (10,4 μg/kg świeżej masy), dyni
(11,3 μg/kg świeżej masy), jabłkach (17,1 μg/kg świeżej masy) oraz w owocach cytrusowych (29,5 μg/kg świeżej
masy) (Careghini i wsp., 2015). Dzienna dawka NP przyjmowana
przez człowieka szacowana jest na 0,6 μg/kg
(EC Report, 2002), 0,67–0,370 μg/kg może pochodzić
z żywności (Careghini i wsp., 2015), a 0,36–060 μg/kg
z wody butelkowanej (Loyo -Rosales i wsp., 2004). Obecność
NP stwierdzono także w płynach ciała człowieka. Związek
ten obecny był m.in. we krwi matek (4,5–33,4 ng/mL)
we krwi pępowinowej (4,4–57,6 ng/mL), w łożysku
(5,4–54,4 ng/g), a także w mleku ludzkim od < 1,87
do 160,1 ng/mL w 1 miesiącu oraz 27,2–104,8 ng/mL
w 3. miesiącu po porodzie (Huang i wsp., 2014).
Nonylofenol powoduje zaburzenia w funkcjonowaniu
męskiego układu rozrodczego ryb, gadów i ssaków
(Cardinali i wsp., 2004; Lee, 1998; Weber i wsp., 2002).
Działa toksycznie na gonady męskie, powodując zmniejszenie
ciężaru jąder i najądrzy, co często jest związane
ze zmniejszoną produkcją komórek płciowych (Aly i wsp.,
2012; Chitra i wsp., 2002; Dobrzyńska, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004). Nonylofenol redukuje
żywotność i liczebność gamet męskich różnych gatunków
ssaków (Aly i wsp., 2012; Chapin i wsp., 1999; de Jager
i wsp., 1999a; Dobrzyńska, 2011, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004; Kimura i wsp., 2006;
Tiwari i Vanage, 2013). Równocześnie ze zmniejszoną
liczebnością plemników obserwowano także pogorszenie
jakości gamet, m.in. zmniejszenie ich ruchliwości
i zwiększenie częstości występowania plemników o nieprawidłowej
morfologii (Chapin i wsp., 1999; de Jager
i wsp., 1999b; Dobrzyńska, 2011, 2012; Tiwari i Vanage,
2013; Zhang i wsp., 2003). Badania Han i wsp. (2004)
wykazały, że NP uszkadza akrosomy plemników mysich.
Inne badania wykazały opóźnienie reakcji akrosomalnej
plemników mysich in vitro (Shao i wsp., 2011). Wyniki
kolejnych badań wskazują, że obecność NP zaburza równowagę
pomiędzy utleniaczami i przeciwutleniaczami,
powodując stres oksydacyjny w nasieniu szczurów (Aly
i wsp., 2012; Chitra i wsp., 2002). Stres oksydacyjny może
być odpowiedzialny za wystąpienie niekorzystnych zmian
w gametach (Chitra i Mathur, 2004; El -Dakdoky i Helal,
2007; Gong i Han 2006). Nonylofenol indukuje apoptozę
w męskich komórkach płciowych oraz w komórkach
Sertoliego (Chitra i wsp., 2002; Gong i Han, 2006).
Indukuje również pękanie nici DNA w haploidalnych
komórkach płciowych myszy (Dobrzyńska, 2011). Z kolei
u szczurów NP wpływa na zmniejszoną produkcje testosteronu
(Laurenzana i wsp., 2002; Ying i wsp., 2012).
Narażanie niedojrzałych płciowo szczurów laboratoryjnych
przez 30 dni na NP w dawce 100 mg/kg dziennie
powoduje opóźnienie w osiągania przez nie dojrzałości
płciowej, zaburzenia w funkcjonowaniu jąder i w procesie
spermatogenezy, prowadzące do zmniejszonej produkcji
gamet oraz indukuje zmiany histopatologiczne w jądrach
(Tan i wsp., 2003). Podobnie w przypadku podawania
młodym zwierzętom NP w niższych dawkach przez
2 tygodnie notowano zmniejszenie liczebności gamet
(Herath i wsp., 2004). W badaniach in vitro obserwowano
zwiększoną częstość występowania apoptozy w komórkach
Sertoliego po 72 -godzinnej hodowli w obecności
NP (Wang i wsp., 2003) oraz zmniejszenie produkcji testosteronu
(Murano i wsp., 1999; Wu i wsp., 2010). W próbach
nasienia pobranych od szczurów po 1–4 -godzinnej inkubacji
w obecności NP stwierdzono zmniejszenie ruchliwości
gamet oraz integralności akrosomalnej (Uguz i wsp.,
2009).
Nonylofenol podawany w czasie ciąży i laktacji
wpływa na stan zdrowia potomstwa ze szczególnym
uwzględnieniem występowania zmian w męskim układzie
rozrodczym. Narażanie ciężarnych samic szczura
na NP w dawkach 80–200 mg/kg/dzień powoduje
znaczne zmniejszenie liczby żywych płodów w miotach.
U potomstwa w wieku 90 dni obserwowano zmniejszenie
ciężaru jąder i prostaty, stężenia testosteronu w osoczu
krwi i nasienia w najądrzach oraz zmiany histopatologiczne
w jądrach. Ponadto stwierdzono zahamowanie
procesów spermatogenezy i spermiogenezy (Jie i wsp.,
2010). Zaburzenia przebiegu spermatogenezy w następstwie
narażania potomstwa za pośrednictwem ciężarnych
i karmiących matek oraz młodych od urodzenia
do 30. dnia życia obserwowali McClusky i wsp. (2007).
U potomstwa myszy narażanych na NP od 5. do 20. dnia
ciąży obserwowano większą śmiertelność okołoporodową
płodów płci męskiej oraz zmniejszenie ciężaru ich jąder
i najądrzy (Kimura i wsp., 2006). Podawanie samicom
szczura NP w dawkach 15–17 mg/kg przez 8 dni ciąży
wpływa na zmniejszenie ciężaru najądrzy u męskiego
potomstwa (Hossaini i wsp., 2001).
Prekoncepcyjne narażanie samców myszy pokolenia
F0 na NP w dawce 50 mg/kg/dzień przez 8 tygodni skutkuje
znacznym zmniejszeniem częstości zachodzenia
w ciążę przez kojarzone z nimi samice, co może być
spowodowane nieprawidłowościami w budowie plemników
oraz zwiększoną częstością pęknięć nici DNA
w haploidalnyych komórkach płciowych (Dobrzyńska,
2012). Z kolei w doświadczeniach obejmujących narażenie
na NP 3 pokoleń szczurów, wykazano zmniejszenie
liczebności gamet w pokoleniu F2, chociaż nie notowano
takiego efektu w pokoleniach F0 i F1 (Chapin i wsp.,
1999). Z kolei, Kyselova i wsp. (2003) wykazali redukcję
ciężaru narządów płciowych, zarówno w pokoleniu F0,
jak i F1 oraz zmniejszenie wielkości miotów w pokoleniu
F2. Ponadto, badania in vitro wykazały znaczną wrażliwość
nasienia ludzkiego na działanie nonylfenolu, który
indukował fragmentację nici DNA już po zastosowaniu
w dawce 1 μmol/L (Anderson i wsp., 1997).
Obecność NP stwierdzono w próbach środowiskowych
z różnych krajów. Wyniki opisano szczegółowo
w pracy poglądowej (Careghini i wsp., 2015). Wykazano
obecność NP w glebie w ilości 0,01–0,95 μg/kg suchej
masy, w osadach dennych od 3,6 μg/kg do 72 mg/kg
suchej masy. Stężenie NP w wodach gruntowych wynosiło
0,001–3,85 mg/m³, a w wodach powierzchniowych
od 3×10−⁴ do 37,3 mg/m³ (Careghini i wsp., 2015).
W wodach ściekowych stężenie tego związku wynosiło
0,05 μg/dm³, a w ściekach poprzemysłowych w USA
0,1–253 μg/dm3 (Diaz i Ventura, 2002; Kuch i Ballshmiter,
2000; Lee i wsp., 2000).
Narażenie ludzi na NP związane jest głównie z jego
migracją z rur plastikowych do wody wodociągowej
oraz do żywności z pojemników używanych podczas
jej produkcji i przechowywania (Soto i wsp., 1991). Woda
przechowywana w pojemnikach z PCW może zawierać
300 ng/L nonylofenolu (Guenther i wsp., 2002; Soto i wsp.,
1991), a w plastikowych butelkach 15–300 μg/m³ (Loyo-
-Rosales i wsp., 2004). Znaczne stężenie NP stwierdzono
w produktach spożywczych (0,1–100 μg/kg świeżej masy)
oraz w napojach (< 7,7 μg/m³ do 0,30 mg/m³) z rożnych
krajów Europy. Najwyższe stężenie tego związku
wykazano w marchwi (10,4 μg/kg świeżej masy), dyni
(11,3 μg/kg świeżej masy), jabłkach (17,1 μg/kg świeżej masy) oraz w owocach cytrusowych (29,5 μg/kg świeżej
masy) (Careghini i wsp., 2015). Dzienna dawka NP przyjmowana
przez człowieka szacowana jest na 0,6 μg/kg
(EC Report, 2002), 0,67–0,370 μg/kg może pochodzić
z żywności (Careghini i wsp., 2015), a 0,36–060 μg/kg
z wody butelkowanej (Loyo -Rosales i wsp., 2004). Obecność
NP stwierdzono także w płynach ciała człowieka. Związek
ten obecny był m.in. we krwi matek (4,5–33,4 ng/mL)
we krwi pępowinowej (4,4–57,6 ng/mL), w łożysku
(5,4–54,4 ng/g), a także w mleku ludzkim od < 1,87
do 160,1 ng/mL w 1 miesiącu oraz 27,2–104,8 ng/mL
w 3. miesiącu po porodzie (Huang i wsp., 2014).
Nonylofenol powoduje zaburzenia w funkcjonowaniu
męskiego układu rozrodczego ryb, gadów i ssaków
(Cardinali i wsp., 2004; Lee, 1998; Weber i wsp., 2002).
Działa toksycznie na gonady męskie, powodując zmniejszenie
ciężaru jąder i najądrzy, co często jest związane
ze zmniejszoną produkcją komórek płciowych (Aly i wsp.,
2012; Chitra i wsp., 2002; Dobrzyńska, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004). Nonylofenol redukuje
żywotność i liczebność gamet męskich różnych gatunków
ssaków (Aly i wsp., 2012; Chapin i wsp., 1999; de Jager
i wsp., 1999a; Dobrzyńska, 2011, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004; Kimura i wsp., 2006;
Tiwari i Vanage, 2013). Równocześnie ze zmniejszoną
liczebnością plemników obserwowano także pogorszenie
jakości gamet, m.in. zmniejszenie ich ruchliwości
i zwiększenie częstości występowania plemników o nieprawidłowej
morfologii (Chapin i wsp., 1999; de Jager
i wsp., 1999b; Dobrzyńska, 2011, 2012; Tiwari i Vanage,
2013; Zhang i wsp., 2003). Badania Han i wsp. (2004)
wykazały, że NP uszkadza akrosomy plemników mysich.
Inne badania wykazały opóźnienie reakcji akrosomalnej
plemników mysich in vitro (Shao i wsp., 2011). Wyniki
kolejnych badań wskazują, że obecność NP zaburza równowagę
pomiędzy utleniaczami i przeciwutleniaczami,
powodując stres oksydacyjny w nasieniu szczurów (Aly
i wsp., 2012; Chitra i wsp., 2002). Stres oksydacyjny może
być odpowiedzialny za wystąpienie niekorzystnych zmian
w gametach (Chitra i Mathur, 2004; El -Dakdoky i Helal,
2007; Gong i Han 2006). Nonylofenol indukuje apoptozę
w męskich komórkach płciowych oraz w komórkach
Sertoliego (Chitra i wsp., 2002; Gong i Han, 2006).
Indukuje również pękanie nici DNA w haploidalnych
komórkach płciowych myszy (Dobrzyńska, 2011). Z kolei
u szczurów NP wpływa na zmniejszoną produkcje testosteronu
(Laurenzana i wsp., 2002; Ying i wsp., 2012).
Narażanie niedojrzałych płciowo szczurów laboratoryjnych
przez 30 dni na NP w dawce 100 mg/kg dziennie
powoduje opóźnienie w osiągania przez nie dojrzałości
płciowej, zaburzenia w funkcjonowaniu jąder i w procesie
spermatogenezy, prowadzące do zmniejszonej produkcji
gamet oraz indukuje zmiany histopatologiczne w jądrach
(Tan i wsp., 2003). Podobnie w przypadku podawania
młodym zwierzętom NP w niższych dawkach przez
2 tygodnie notowano zmniejszenie liczebności gamet
(Herath i wsp., 2004). W badaniach in vitro obserwowano
zwiększoną częstość występowania apoptozy w komórkach
Sertoliego po 72 -godzinnej hodowli w obecności
NP (Wang i wsp., 2003) oraz zmniejszenie produkcji testosteronu
(Murano i wsp., 1999; Wu i wsp., 2010). W próbach
nasienia pobranych od szczurów po 1–4 -godzinnej inkubacji
w obecności NP stwierdzono zmniejszenie ruchliwości
gamet oraz integralności akrosomalnej (Uguz i wsp.,
2009).
Nonylofenol podawany w czasie ciąży i laktacji
wpływa na stan zdrowia potomstwa ze szczególnym
uwzględnieniem występowania zmian w męskim układzie
rozrodczym. Narażanie ciężarnych samic szczura
na NP w dawkach 80–200 mg/kg/dzień powoduje
znaczne zmniejszenie liczby żywych płodów w miotach.
U potomstwa w wieku 90 dni obserwowano zmniejszenie
ciężaru jąder i prostaty, stężenia testosteronu w osoczu
krwi i nasienia w najądrzach oraz zmiany histopatologiczne
w jądrach. Ponadto stwierdzono zahamowanie
procesów spermatogenezy i spermiogenezy (Jie i wsp.,
2010). Zaburzenia przebiegu spermatogenezy w następstwie
narażania potomstwa za pośrednictwem ciężarnych
i karmiących matek oraz młodych od urodzenia
do 30. dnia życia obserwowali McClusky i wsp. (2007).
U potomstwa myszy narażanych na NP od 5. do 20. dnia
ciąży obserwowano większą śmiertelność okołoporodową
płodów płci męskiej oraz zmniejszenie ciężaru ich jąder
i najądrzy (Kimura i wsp., 2006). Podawanie samicom
szczura NP w dawkach 15–17 mg/kg przez 8 dni ciąży
wpływa na zmniejszenie ciężaru najądrzy u męskiego
potomstwa (Hossaini i wsp., 2001).
Prekoncepcyjne narażanie samców myszy pokolenia
F0 na NP w dawce 50 mg/kg/dzień przez 8 tygodni skutkuje
znacznym zmniejszeniem częstości zachodzenia
w ciążę przez kojarzone z nimi samice, co może być
spowodowane nieprawidłowościami w budowie plemników
oraz zwiększoną częstością pęknięć nici DNA
w haploidalnyych komórkach płciowych (Dobrzyńska,
2012). Z kolei w doświadczeniach obejmujących narażenie
na NP 3 pokoleń szczurów, wykazano zmniejszenie
liczebności gamet w pokoleniu F2, chociaż nie notowano
takiego efektu w pokoleniach F0 i F1 (Chapin i wsp.,
1999). Z kolei, Kyselova i wsp. (2003) wykazali redukcję
ciężaru narządów płciowych, zarówno w pokoleniu F0,
jak i F1 oraz zmniejszenie wielkości miotów w pokoleniu
F2. Ponadto, badania in vitro wykazały znaczną wrażliwość
nasienia ludzkiego na działanie nonylfenolu, który
indukował fragmentację nici DNA już po zastosowaniu
w dawce 1 μmol/L (Anderson i wsp., 1997).
Bisfenol A
 Bisfenol A (dian, 2,2 -bis(p -hydroksyfenylo)propan) jest
białym lub jasnobrązowym proszkiem, słabo rozpuszczalnym
w wodzie. Budowę chemiczna BPA przedstawiono
na rycinie 5. Bisfenol A stosowany jest głównie
do produkcji tworzyw sztucznych; poliestrów (głównie poliwęglanów, które są wykorzystywane m.in. do wytwarzania
butelek dla niemowląt), polieterów, polisulfonów,
żywic epoksydowych (m.in. wyściełających wewnętrzne
powierzchnie puszek). Ponadto stosowany jest jako przeciwutleniacz
w środkach spożywczych i kosmetycznych.
Obecność BPA wykryto w takich produktach jak pojemniki
do przechowywania żywności, wykonane z przezroczystych
plastików butelki do karmienia niemowląt
i do napojów, wewnętrzne powłoki metalowych puszek
do napojów i żywności, cystern do przechowywania
wody, mleka i wina, zabawki, papier termiczny, płyty
kompaktowe, farby, kaski ochronne, części samochodowe,
okna plastikowe, materiały do wypełnień dentystycznych,
soczewki i plastry opatrunkowe (Lyons, 2000;
Markey i wsp., 2003).
Obecność BPA wykryto w środowisku naturalnym,
w glebie w stężeniu 0,55–147 μg/kg suchej masy,
w osadach dennych od <0,24 do 492 μg/kg suchej masy,
w wodach gruntowych 0,001–20 mg/m³, w wodach
powierzchniowych od <0,001 do 92 mg/m³ (Careghini
i wsp., 2015). Stężenie BPA w powietrzu wynosiło
2–208 μg/m³ (Rudel i wsp., 2001).
Bisfenol A dostaje się do organizmu człowieka głównie
drogą pokarmową oraz przez układ oddechowy i skórę.
Może być uwalniany z tworzyw sztucznych, w skład
których wchodzi do żywności, napojów i odżywek dla
niemowląt, szczególnie jeżeli opakowanie jest podgrzewane,
myte detergentem lub poddane zmianom
mechanicznym (gniecenie, rozciąganie). Najbardziej
narażoną grupą są niemowlęta i małe dzieci ze względu
na stosukowo niski ciężar ciała oraz powszechne użycie
butelek, kubeczków, talerzyków, łyżeczek itp. wykonanych
z tworzyw zawierających BPA. Związek ten może
być również wymywany do śliny pacjentów po założeniu
wypełnień dentystycznych (Markey i wsp., 2003;
Tyl i wsp., 2002). Obecność BPA wykazano w żywności
w ilości 4–23 μg/puszka, w napojach 7–58 μg/g, w ślinie
pacjentów stomatologicznych 90–913 μg po 1 godz.
od założenia wypełnienia (Akingbemi i wsp., 2004).
Stężenia BPA w produktach spożywczych pochodzących
z różnych krajów wynosiły 0,1–790 μg/kg suchej
masy, a wodzie do picia i napojach 0,0073–0,86 μg/m³
(Careghini i wsp., 2015). Przykładowo, badania szwedzkie
wykazały obecność BPA w rybach (2,5–29 μg/kg świeżej
masy), mięsie (6,9–13 μg/kg), ziemniakach (2,2 μg/kg),
w produktach mleczarskich (2,4 μg/kg) (Gyllenhammer
i wsp., 2012). Basheer i wsp. (2004) oznaczali stężenie BPA
w owocach morza (13,3–213,1 μg/kg świeżej masy), a Sun
i wsp. (2006) w konserwach (32,8–164,5 μg/kg świeżej
masy). Interesujące jest, że migracja BPA z nowych naczyń
stołowych dla niemowląt wynosiła 1–1,9 μg/kg roztworu,
podczas gdy z wielokrotnie używanych 1,8–7,9 μg/kg
(Lyons, 2000). Z kolei Brede i wsp. (2003) wykazali, że stężenie
BPA w napoju z nowych butelek dla niemowląt
wynosiło 0,2 μg/L, w używanych 51 dni – 8,4 μg/L,
a w używanych 169 dni – 6,7 μg/L. Na podstawie
wyników najowszych badań dzienną dawkę BPA przyjmowaną
przez ludzi oszacowano na 0,02–0,181 μg/kg
dla dorosłych oraz na 0,22–0,33 μg/kg dla niemowląt
(Careghini i wsp., 2015).
Obecność BPA wykryto także w płynach ciała człowieka.
Badania przeprowadzone przez Calafat i wsp.
(2005) wykazały w moczu średnio 1,28 μg/L BPA.
Obecność BPA stwierdzono także w krwi matek, noworodków
i w łożysku w stężeniach odpowiednio 3,1; 2,3
oraz 12,7 mg/mL (Schonfelder i wsp., 2002). W badaniach
przeprowadzonych w różnych krajach, opisanych
w pracy poglądowej Dash i wsp. (2006) wykazano obecność
BPA w moczu kobiet niebędących w ciąży w stężeniu
0,2–586,14 μg/L, podczas gdy w przypadku ciężarnych
0,05–29,43 μg/L, natomiast w moczu mężczyzn od < 0,4
do > 8,02 μg/L. Stężenie BPA w krwi mężczyzn wynosiło
0,38–1,49 μg/L, a w krwi kobiet niebędących w ciąży
0–2,9 μg/L. Ponadto, w nasieniu mężczyzn stwierdzono
obecność BPA w ilości 0–12 μg/L.
Badania na zwierzętach laboratoryjnych, które narażano
w okresie neonatalnym, młodzieńczym i po osiągnięciu
dojrzałości płciowej, oraz badania in vitro wykazały,
że bisfenol A działa toksycznie na jądra. Genotoksyczne
działanie BPA związane jest z indukcją stresu oksydacyjnego
oraz osłabieniem enzymatycznych mechanizmów
antyoksydacyjnych (Anjum i wsp., 2011; Chitra
i wsp., 2003a; Meeker i wsp., 2010). Aydogan i wsp. (2010)
wykazali, że BPA indukuje powstawanie reaktywnych
form tlenu, które powodują powstawanie stresu oksydacyjnego
w jądrach szczurów.
Narażanie różnych gatunków ssaków na BPA
w różnych dawkach i w różnych okresach życia powoduje
zmniejszenie liczebności gamet męskich (Al -Hiyasat
i wsp., 2002; Chitra i wsp., 2003a, 2003b; Dobrzyńska
i Radzikowska, 2013; Dobrzyńska i wsp., 2014; Herath i wsp.,
2004; Pacchierotti i wsp., 2008; Park i wsp., 2004; Sakue
i wsp., 2001; vom Saal i wsp., 1998). W wyniku podawania
gryzoniom BPA obserwowano także zwiększenie częstości
występowania nieprawidłowości w budowie plemników
(Aikawa i wsp., 2004; Dobrzyńska i Radzikowska,
2013; Dobrzyńska i wsp., 2014; Park i wsp., 2004; Toyama
i wsp., 2004; Toyama i Yuasa, 2004), zmniejszenie ich
ruchliwości (Aikawa i wsp., 2004; Chitra i wsp., 2003a, b;
Park i wsp., 2004) oraz obniżenie ciężaru jąder i najądrzy
(Akingbemi i wsp., 2004; Al -Hiyasat i wsp., 2002; Chitra
i wsp., 2003a). Bisfenol A indukuje pęknięcia nici DNA
w haploidalnych komórkach płciowych samców myszy
(Dobrzyńska i Radzikowska, 2013). Pod wpływem działania
BPA obserwowano występowanie zmian histopatologicznych
w kanalikach nasiennych zwierząt laboratoryjnych
(Dobrzyńska i wsp., 2014; Takao i wsp., 1999; Tan i wsp., 2003; Toyama i wsp., 2004; Toyama i Yuasa,
2004). Zmiany powyższe występują nawet po zastosowaniu
dawek BPA niższych niż 50 mg/kg dziennie, tj.
najniższej dawki, po której zastosowaniu spodziewane
jest wystąpienie jakiegokolwiek efektu (ang. lowest observed
adverse eff ect level, LOAEL) (Richter i wsp., 2007).
Badania niektórych autorów wskazują na większą
wrażliwość gamet zwierząt niedojrzałych płciowo. Zhang
i wsp. (2013) podawali BPA myszom od 3. dnia życia
przez okres od 19 do 47 dni. Liczebność i jakość gamet
oceniano u zwierząt w wieku 7 tygodni i stwierdzono
znaczne obniżenie powyższych parametrów. Herath i wsp.
(2004) obserwowali, że podawanie BPA dojrzewającym
płciowo szczurom przez 5 tygodni znacznie redukuje
liczbę plemników oraz poziom testosteronu w osoczu
krwi. W innych badaniach zanotowano mniejszą liczebność
gamet u myszy, którym rozpoczęto 8 -tygodniowe
podawanie BPA w dawce 20 mg/kg/dzień w wieku 4,5
tygodni w porównaniu ze zwierzętami dojrzałymi
płciowo. Równocześnie u zwierząt tych obserwowano
znaczną degenerację spermatogoniów i spermatocytów
oraz występowanie gigantycznych wielojądrzastych
komórek w kanalikach nasiennych (Dobrzyńska i wsp.,
2014). Podobne rezultaty uzyskali Toyama i Yuasa (2004)
w wyniku narażania szczurów od 1. do 11. dnia życia.
Zmiany histopatologiczne w jądrach samców pokolenia
F1 obserwowali także Gamez i wsp. (2014) oraz Liu i wsp.
(2013) w następstwie narażania szczurów podczas ciąży
i laktacji. Ekspozycja na BPA podczas ciąży i laktacji
wpływa również na obniżenie jakości nasienia w pokoleniu
F1 poprzez zmniejszenie ruchliwości gamet i zwiększenie
częstości występowania plemników o nieprawidłowej
budowie (Viela i wsp., 2014).
Narażenie na BPA w okresie pre - lub neonatalnym
może indukować anomalie męskiego układu rozrodczego,
takie jak zwiększenie odległości anogenitalnej,
powiększenie prostaty, zmniejszenie ciężaru najądrzy,
produkcji testosteronu, liczby plemników oraz obniżenie
ich jakości (Timms i wsp., 2005; Vandenberg i wsp., 2009;
vom Saal i Hughes, 2005; Welshons i wsp., 2006). Ponadto,
w następstwie ekspozycji na BPA w tym okresie mogą
nastąpić komplikacje w przebiegu ciąży (Berger i wsp.,
2008) oraz zwiększenie częstości występowania nowotworów
po osiągnięciu dorosłości (Ho i wsp., 2006; Soto
i wsp., 2008). Podawanie BPA myszom w okresie prenatalnym
za pośrednictwem ciężarnych samic powoduje
zmniejszoną ekspresję genów związanych z funkcjonowaniem
komórek Sertoliego, a w konsekwencji oddziałuje
na funkcje reprodukcyjne potomstwa męskiego
(Tainaka i wsp., 2012). Podawanie BPA samicom szczurów
w różnych okresach ciąży wpływa na zmniejszenie ciężaru
jąder samców potomnych (Kim i wsp., 2003, Kubo i wsp.,
2003). Inni autorzy obserwowali zmniejszenie ciężaru
jąder u potomstwa myszy, którym podawano BPA podczas
ciąży i laktacji (Kawai i wsp., 2003; Kobuto i wsp., 2004).
Al -Hiyasat i wsp. (2002) obserwowali zmniejszoną
częstość zachodzenia w ciążę przez samice kojarzone
z samcami narażanymi uprzednio przez 30 dni na BPA.
Podobne wyniki uzyskano w następstwie prekoncepcyjnego
8 -tygodniowego narażania samców myszy
na BPA. Ponadto, obserwowano istotne zmniejszenie
wielkości miotów, zmniejszenie liczby żywych płodów
oraz zwiększoną śmiertelność postnatalną i obniżoną
ruchliwość gamet w pokoleniu F1 (Dobrzyńska i wsp., submitted).
Zhang i wsp. (2013) wykazali wolniejsze przybieranie
na wadze potomstwa myszy narażanych na BPA
od 3. do 47. dnia życia. Prekoncepcyjne narażanie samców
szczurów przez 6 dni na BPA indukuje występowanie
dominujących mutacji letalnych, szczególnie w przypadku
ekspozycji spermatyd i spermatocytów (Tiwari i Vanage,
2013). Narażanie zarówno samców, jak i samic myszy
na BPA przed kojarzeniem może być przyczyną zwiększonej
resorpcji płodów (Al -Hiyasat i wsp., 2002, 2004).
Z kolei badania Peknicova i wsp. (2002), w których podawano
BPA w małych dawkach trzem pokoleniom myszy,
wykazały zmniejszenie wielkości miotów w pokoleniu
drugim i trzecim oraz zmiany histopatologiczne w kanalikach
nasiennych w pierwszej i drugiej generacji. Należy
podkreślić, że badania epidemiologiczne dzieci z rodzin,
w których co najmniej jedno z rodziców było narażone
na BPA w okresie ciąży, wykazały związek takiej ekspozycji
z niską wagą urodzinową w oraz skróconą odległością
anogenitalną u noworodków (Miao i wsp., 2011).
Bisfenol A (dian, 2,2 -bis(p -hydroksyfenylo)propan) jest
białym lub jasnobrązowym proszkiem, słabo rozpuszczalnym
w wodzie. Budowę chemiczna BPA przedstawiono
na rycinie 5. Bisfenol A stosowany jest głównie
do produkcji tworzyw sztucznych; poliestrów (głównie poliwęglanów, które są wykorzystywane m.in. do wytwarzania
butelek dla niemowląt), polieterów, polisulfonów,
żywic epoksydowych (m.in. wyściełających wewnętrzne
powierzchnie puszek). Ponadto stosowany jest jako przeciwutleniacz
w środkach spożywczych i kosmetycznych.
Obecność BPA wykryto w takich produktach jak pojemniki
do przechowywania żywności, wykonane z przezroczystych
plastików butelki do karmienia niemowląt
i do napojów, wewnętrzne powłoki metalowych puszek
do napojów i żywności, cystern do przechowywania
wody, mleka i wina, zabawki, papier termiczny, płyty
kompaktowe, farby, kaski ochronne, części samochodowe,
okna plastikowe, materiały do wypełnień dentystycznych,
soczewki i plastry opatrunkowe (Lyons, 2000;
Markey i wsp., 2003).
Obecność BPA wykryto w środowisku naturalnym,
w glebie w stężeniu 0,55–147 μg/kg suchej masy,
w osadach dennych od <0,24 do 492 μg/kg suchej masy,
w wodach gruntowych 0,001–20 mg/m³, w wodach
powierzchniowych od <0,001 do 92 mg/m³ (Careghini
i wsp., 2015). Stężenie BPA w powietrzu wynosiło
2–208 μg/m³ (Rudel i wsp., 2001).
Bisfenol A dostaje się do organizmu człowieka głównie
drogą pokarmową oraz przez układ oddechowy i skórę.
Może być uwalniany z tworzyw sztucznych, w skład
których wchodzi do żywności, napojów i odżywek dla
niemowląt, szczególnie jeżeli opakowanie jest podgrzewane,
myte detergentem lub poddane zmianom
mechanicznym (gniecenie, rozciąganie). Najbardziej
narażoną grupą są niemowlęta i małe dzieci ze względu
na stosukowo niski ciężar ciała oraz powszechne użycie
butelek, kubeczków, talerzyków, łyżeczek itp. wykonanych
z tworzyw zawierających BPA. Związek ten może
być również wymywany do śliny pacjentów po założeniu
wypełnień dentystycznych (Markey i wsp., 2003;
Tyl i wsp., 2002). Obecność BPA wykazano w żywności
w ilości 4–23 μg/puszka, w napojach 7–58 μg/g, w ślinie
pacjentów stomatologicznych 90–913 μg po 1 godz.
od założenia wypełnienia (Akingbemi i wsp., 2004).
Stężenia BPA w produktach spożywczych pochodzących
z różnych krajów wynosiły 0,1–790 μg/kg suchej
masy, a wodzie do picia i napojach 0,0073–0,86 μg/m³
(Careghini i wsp., 2015). Przykładowo, badania szwedzkie
wykazały obecność BPA w rybach (2,5–29 μg/kg świeżej
masy), mięsie (6,9–13 μg/kg), ziemniakach (2,2 μg/kg),
w produktach mleczarskich (2,4 μg/kg) (Gyllenhammer
i wsp., 2012). Basheer i wsp. (2004) oznaczali stężenie BPA
w owocach morza (13,3–213,1 μg/kg świeżej masy), a Sun
i wsp. (2006) w konserwach (32,8–164,5 μg/kg świeżej
masy). Interesujące jest, że migracja BPA z nowych naczyń
stołowych dla niemowląt wynosiła 1–1,9 μg/kg roztworu,
podczas gdy z wielokrotnie używanych 1,8–7,9 μg/kg
(Lyons, 2000). Z kolei Brede i wsp. (2003) wykazali, że stężenie
BPA w napoju z nowych butelek dla niemowląt
wynosiło 0,2 μg/L, w używanych 51 dni – 8,4 μg/L,
a w używanych 169 dni – 6,7 μg/L. Na podstawie
wyników najowszych badań dzienną dawkę BPA przyjmowaną
przez ludzi oszacowano na 0,02–0,181 μg/kg
dla dorosłych oraz na 0,22–0,33 μg/kg dla niemowląt
(Careghini i wsp., 2015).
Obecność BPA wykryto także w płynach ciała człowieka.
Badania przeprowadzone przez Calafat i wsp.
(2005) wykazały w moczu średnio 1,28 μg/L BPA.
Obecność BPA stwierdzono także w krwi matek, noworodków
i w łożysku w stężeniach odpowiednio 3,1; 2,3
oraz 12,7 mg/mL (Schonfelder i wsp., 2002). W badaniach
przeprowadzonych w różnych krajach, opisanych
w pracy poglądowej Dash i wsp. (2006) wykazano obecność
BPA w moczu kobiet niebędących w ciąży w stężeniu
0,2–586,14 μg/L, podczas gdy w przypadku ciężarnych
0,05–29,43 μg/L, natomiast w moczu mężczyzn od < 0,4
do > 8,02 μg/L. Stężenie BPA w krwi mężczyzn wynosiło
0,38–1,49 μg/L, a w krwi kobiet niebędących w ciąży
0–2,9 μg/L. Ponadto, w nasieniu mężczyzn stwierdzono
obecność BPA w ilości 0–12 μg/L.
Badania na zwierzętach laboratoryjnych, które narażano
w okresie neonatalnym, młodzieńczym i po osiągnięciu
dojrzałości płciowej, oraz badania in vitro wykazały,
że bisfenol A działa toksycznie na jądra. Genotoksyczne
działanie BPA związane jest z indukcją stresu oksydacyjnego
oraz osłabieniem enzymatycznych mechanizmów
antyoksydacyjnych (Anjum i wsp., 2011; Chitra
i wsp., 2003a; Meeker i wsp., 2010). Aydogan i wsp. (2010)
wykazali, że BPA indukuje powstawanie reaktywnych
form tlenu, które powodują powstawanie stresu oksydacyjnego
w jądrach szczurów.
Narażanie różnych gatunków ssaków na BPA
w różnych dawkach i w różnych okresach życia powoduje
zmniejszenie liczebności gamet męskich (Al -Hiyasat
i wsp., 2002; Chitra i wsp., 2003a, 2003b; Dobrzyńska
i Radzikowska, 2013; Dobrzyńska i wsp., 2014; Herath i wsp.,
2004; Pacchierotti i wsp., 2008; Park i wsp., 2004; Sakue
i wsp., 2001; vom Saal i wsp., 1998). W wyniku podawania
gryzoniom BPA obserwowano także zwiększenie częstości
występowania nieprawidłowości w budowie plemników
(Aikawa i wsp., 2004; Dobrzyńska i Radzikowska,
2013; Dobrzyńska i wsp., 2014; Park i wsp., 2004; Toyama
i wsp., 2004; Toyama i Yuasa, 2004), zmniejszenie ich
ruchliwości (Aikawa i wsp., 2004; Chitra i wsp., 2003a, b;
Park i wsp., 2004) oraz obniżenie ciężaru jąder i najądrzy
(Akingbemi i wsp., 2004; Al -Hiyasat i wsp., 2002; Chitra
i wsp., 2003a). Bisfenol A indukuje pęknięcia nici DNA
w haploidalnych komórkach płciowych samców myszy
(Dobrzyńska i Radzikowska, 2013). Pod wpływem działania
BPA obserwowano występowanie zmian histopatologicznych
w kanalikach nasiennych zwierząt laboratoryjnych
(Dobrzyńska i wsp., 2014; Takao i wsp., 1999; Tan i wsp., 2003; Toyama i wsp., 2004; Toyama i Yuasa,
2004). Zmiany powyższe występują nawet po zastosowaniu
dawek BPA niższych niż 50 mg/kg dziennie, tj.
najniższej dawki, po której zastosowaniu spodziewane
jest wystąpienie jakiegokolwiek efektu (ang. lowest observed
adverse eff ect level, LOAEL) (Richter i wsp., 2007).
Badania niektórych autorów wskazują na większą
wrażliwość gamet zwierząt niedojrzałych płciowo. Zhang
i wsp. (2013) podawali BPA myszom od 3. dnia życia
przez okres od 19 do 47 dni. Liczebność i jakość gamet
oceniano u zwierząt w wieku 7 tygodni i stwierdzono
znaczne obniżenie powyższych parametrów. Herath i wsp.
(2004) obserwowali, że podawanie BPA dojrzewającym
płciowo szczurom przez 5 tygodni znacznie redukuje
liczbę plemników oraz poziom testosteronu w osoczu
krwi. W innych badaniach zanotowano mniejszą liczebność
gamet u myszy, którym rozpoczęto 8 -tygodniowe
podawanie BPA w dawce 20 mg/kg/dzień w wieku 4,5
tygodni w porównaniu ze zwierzętami dojrzałymi
płciowo. Równocześnie u zwierząt tych obserwowano
znaczną degenerację spermatogoniów i spermatocytów
oraz występowanie gigantycznych wielojądrzastych
komórek w kanalikach nasiennych (Dobrzyńska i wsp.,
2014). Podobne rezultaty uzyskali Toyama i Yuasa (2004)
w wyniku narażania szczurów od 1. do 11. dnia życia.
Zmiany histopatologiczne w jądrach samców pokolenia
F1 obserwowali także Gamez i wsp. (2014) oraz Liu i wsp.
(2013) w następstwie narażania szczurów podczas ciąży
i laktacji. Ekspozycja na BPA podczas ciąży i laktacji
wpływa również na obniżenie jakości nasienia w pokoleniu
F1 poprzez zmniejszenie ruchliwości gamet i zwiększenie
częstości występowania plemników o nieprawidłowej
budowie (Viela i wsp., 2014).
Narażenie na BPA w okresie pre - lub neonatalnym
może indukować anomalie męskiego układu rozrodczego,
takie jak zwiększenie odległości anogenitalnej,
powiększenie prostaty, zmniejszenie ciężaru najądrzy,
produkcji testosteronu, liczby plemników oraz obniżenie
ich jakości (Timms i wsp., 2005; Vandenberg i wsp., 2009;
vom Saal i Hughes, 2005; Welshons i wsp., 2006). Ponadto,
w następstwie ekspozycji na BPA w tym okresie mogą
nastąpić komplikacje w przebiegu ciąży (Berger i wsp.,
2008) oraz zwiększenie częstości występowania nowotworów
po osiągnięciu dorosłości (Ho i wsp., 2006; Soto
i wsp., 2008). Podawanie BPA myszom w okresie prenatalnym
za pośrednictwem ciężarnych samic powoduje
zmniejszoną ekspresję genów związanych z funkcjonowaniem
komórek Sertoliego, a w konsekwencji oddziałuje
na funkcje reprodukcyjne potomstwa męskiego
(Tainaka i wsp., 2012). Podawanie BPA samicom szczurów
w różnych okresach ciąży wpływa na zmniejszenie ciężaru
jąder samców potomnych (Kim i wsp., 2003, Kubo i wsp.,
2003). Inni autorzy obserwowali zmniejszenie ciężaru
jąder u potomstwa myszy, którym podawano BPA podczas
ciąży i laktacji (Kawai i wsp., 2003; Kobuto i wsp., 2004).
Al -Hiyasat i wsp. (2002) obserwowali zmniejszoną
częstość zachodzenia w ciążę przez samice kojarzone
z samcami narażanymi uprzednio przez 30 dni na BPA.
Podobne wyniki uzyskano w następstwie prekoncepcyjnego
8 -tygodniowego narażania samców myszy
na BPA. Ponadto, obserwowano istotne zmniejszenie
wielkości miotów, zmniejszenie liczby żywych płodów
oraz zwiększoną śmiertelność postnatalną i obniżoną
ruchliwość gamet w pokoleniu F1 (Dobrzyńska i wsp., submitted).
Zhang i wsp. (2013) wykazali wolniejsze przybieranie
na wadze potomstwa myszy narażanych na BPA
od 3. do 47. dnia życia. Prekoncepcyjne narażanie samców
szczurów przez 6 dni na BPA indukuje występowanie
dominujących mutacji letalnych, szczególnie w przypadku
ekspozycji spermatyd i spermatocytów (Tiwari i Vanage,
2013). Narażanie zarówno samców, jak i samic myszy
na BPA przed kojarzeniem może być przyczyną zwiększonej
resorpcji płodów (Al -Hiyasat i wsp., 2002, 2004).
Z kolei badania Peknicova i wsp. (2002), w których podawano
BPA w małych dawkach trzem pokoleniom myszy,
wykazały zmniejszenie wielkości miotów w pokoleniu
drugim i trzecim oraz zmiany histopatologiczne w kanalikach
nasiennych w pierwszej i drugiej generacji. Należy
podkreślić, że badania epidemiologiczne dzieci z rodzin,
w których co najmniej jedno z rodziców było narażone
na BPA w okresie ciąży, wykazały związek takiej ekspozycji
z niską wagą urodzinową w oraz skróconą odległością
anogenitalną u noworodków (Miao i wsp., 2011).
Podsumowanie
Ksenoestrogeny (ftalany: BBP, DEHP, DBP oraz BPA
i NP) powodują zmniejszenie liczebności gamet męskich,
zwiększenie częstości występowania zmian morfologicznych
oraz uszkodzeń DNA plemników. Szczególnie
niebezpieczne może być długotrwałe narażanie ssaków
na ksenoestrogeny oraz rozpoczęcie ich narażania przed
osiągnięciem dojrzałości płciowej. Zmiany indukowane
w gametach męskich mogą powodować mutacje prowadzące
do zwiększonej śmiertelności pre - i postnatalnej
potomstwa. W następstwie narażania na ksenoestrogeny
pokolenia F0 u potomstwa w linii męskiej
mogą wystąpić wady rozwojowe, opóźnienia w rozwoju
i osiąganiu dojrzałości płciowej, zaburzenie stosunku
płci, a także obniżenie jakości nasienia w pokoleniu F1.
Duże rozpowszechnienie w środowisku ftalanów, nonylofenolu,
bisfenolu A, może więc wpływać negatywnie
na zdrowie reprodukcyjne. Aby tym skutkom zapobiec,
należy w miarę możliwości ograniczyć kontakt z ksenoestrogenami
osób dorosłych, a przede wszystkim dzieci.
Szczególnie ważne jest unikanie podgrzewania żywności
i napojów w puszkach i w pojemnikach plastikowych.
Należy zwrócić uwagę na obecność ksenoestrogenów
w zabawkach, artykułach pielęgnacyjnych, butelkach
dla niemowląt i małych dzieci, a także w kosmetykach,
detergentach i artykułach codziennego użytku.
Dyrektywy Unii Europejskiej wprowadziły szereg ograniczeń,
szczególnie dotyczących wprowadzania do obrotu zabawek i artykułów dla dzieci zawierających ftalany
i bisfenol A. Regulacje dotyczą szczególnie zabawek, które
mają kontakt z buzią dziecka. Mimo to na rynek wciąż
trafi a wiele zabawek wyprodukowanych w Azji, które
nie spełniają tych wymogów.
Piśmiennictwo
Ablake M., Itoh M., Terayama H., Hayashi S., Shoji S., Naito M. i wsp.: Di -(2-
-ethylhexyl) phthalate induces severe aspermatogenesis in mice, however,
subsequent antioxidant vitamins supplementation accelerates regeneration
of the seminiferous epithelium. Int J Androl. 2004, 27 (5), 274–281.
Agarwal D.K., Eustis S., Lamb J.C., Reel J.R., Kluwe W.M.: Eff ects of di(2-
-ethylhexyl) phthalate on the gonadal pathophysiology, sperm morphology,
and reproductive performance of male rats. Environ Health Perspect.
1986, 65, 343–350.
Agarwal D.K., Moroonpot R.R., Lamb J.J., Kluwe W.M.: Adverse eff ects of
butyl benzyl phthalate on the reproductive and hematopoietic systems in
male rats. Toxicology. 1985, 35 (3), 189–206.
Ahmad R., Gautam A.K., Verma V., Sedha S., Kumar S.: Eff ects of in utero
di -butyl phthalate and butyl benzyl phthalate exposure on off spring development
and male reproduction of rat. Environ Sci Pollut Res. 2014, 21,
3156–3165.
Aikawa H., Koyama S., Matsuda M., Nakahashi K., Akazome Y., Mori T.: Relief
eff ect of vitamin A on the decreased motility of sperm and increased incidence
of malformed sperm in mice exposed to bisphenol A. Cell Tissue Res.
2004, 315, 1119–1124.
Akingbemi B.T., Sottas C.M., Koulova A.I., Klinefelter G.R., Harddy M.P.:
Inhibition of testicular steroidogenesis by the xenoestrogen bisphenol
A is associated with reduced pituitary lutenizing hormone secretion
and decreased steroidogenic enzyme gene expression in rat Leydig cells.
Endocrinology. 2004, 145, 592–603.
Alam M.S., Andrina B.B., Tay T.W., Tsunekawa N.: Single administration of
di(n -butyl) phthalate spermatogenesis in prepubertal rats. Tissue Cells.
2010, 142, 129–135.
Al -Hiyasat A.S., Darmani H., Elbeticha A.M.: Eff ects of bisphenol A on adult
male mouse fertility. Eu. J Oral Sci. 2002, 110, 163–167.
Al -Hiyasat A.S., Darmani H., Elbeticha A.M.: Leached components from dental
composites and their eff ects on fertility of female mice. Eur J Oral Sci.
2004, 112, 267–272.
Aly H.A., Domenech O., Banjar Z.M.: Eff ect of nonylphenol on male reproduction:
analysis of rat epididymal biochemical markers and antioxidant
defense enzymes. Toxicol Appl Pharmacol. 2012, 261 (2), 134–141.
Anderson D., Dobrzyńska M.M., Basaran N.: Eff ects of various genotoxins
and reproductive toxins in human lymphocytes and sperm in the Comet
assay. Teratog Carcinog Mutagen. 1997, 17, 29–43.
Andrade A.J., Grande S.W., Talsness C.E., Gericke C., Grote K., Golembiewski A.
i wsp.: A dose response study following in utero and lactational exposure
to di -(2 -ethylhexyl) phthalate (DEHP): reproductive eff ects on adult male
off spring rats. Toxicology. 2006. 228, 85–97.
Anjum S., Rahman S., Kaur M., Ahmad F., Rashid H., Ansari R.A. i wsp.: Melatonin
ameliorates bisphenol A -induced biochemical toxicity in testicular mitochondria
of mouse. Food Chem Toxicol. 2011, 49, 2849–2854.
Arcadi F.A., Costa C., Imperatore C., Marchese A., Rapisardi A., Salemi M. i wsp.:
Oral toxicity of bis(2 -ethylhexyl)phthalate during pregnancy and sucking
in the Long -Evans rat. Food Chem Toxicol. 1998, 35, 963–970.
Ashby J., Timwell H., Lefevre P.A., Odum J., Patson D., Millward S.W. i wsp.:
Normal sexual development rats exposed to butyl benzyl phthalate from
conception to wearing. Regular Toxicol Pharmacol. 1997, 26, 102–118.
Aso S., Ehara H., Miyata K., Hosyuyama S., Shiraishi K., Umano T.I. i wsp.: A two-
-generation reproductive toxicity study of butyl benzyl phthalate in rats.
J Toxicol Sci. 2005, 30, 39–58.
ATSDR. Toxicological profi le for di -(2 -ethylhexyl) phthalate (DEHP). Agency
for Toxic Substances and Disease Registry, United States Public Health
Service, Atlanta GA 2002.
Auharek S.A., Franca L.R., McKinell C., Jobling M.S., Scott H.M., Sharpe R.M.:
Prenatal plus postnatal exposure to di(n -butyl) phthalate and/or fl utamide
markedly reduces fi nal Sertoli cell number in the rat. Endocrinology. 2010,
151, 2868–2875.
Axelsson J., Rylander L., Rignell -Hydbom A., Giwercman A.: No secular trend
over the last decade in sperm counts among Swedish men from the general
population. Human Reprod. 2011, 26 (5), 1012–1016.
Aydogan M., Korkmaz A., Barlas N., Kolankaya D.: Pro -oxidant eff ect of vitamin
C coadministration with bisphenol A, nonylphenol, and octylphenol on the
reproductive tract of male rats. Drug Chem Toxicol. 2010, 33, 193–203.
Barlow N.J., McIntyre B.S., Foster P.M.: Male reproductive tract lesions at 6,
12, and 18 months of age following in utero exposure to di(n -butyl) phthalate.
Toxicol Pathol. 2004, 32, 79–90.
Basheer C., Lee H.K., Tan K.S.: Endocrine disrupting alkylophenols and
bisphenol -A in coastal waters and supermarket seafood from Singapore.
Mar Pollute Bull. 2004, 48, 1145–1167.
Berger R.G., Shaw J., deCatanzaro D.: Impact of acute bisphenol -A exposure
upon intrauterine implantation of fertilized ova and urinary levels of progesterone
and 17β -estradiol. Reprod Toxicol. 2008, 26, 94–99.
Bilińska B., Schmalz -Frączek B., Kotula M., Carreau S.: Photoperiod -dependent
capability of androgen aromatization and the role of estrogens in the
bank vole testis visualized by means of immunohistochemistry. Mol Cell
Endocrinol. 2001, 178, 189–198.
Bilińska B., Wiszniewska B., Kosiniak -Kamysz K., Kotula -Balak M., Gancarczyk M.,
Hejmej A. i wsp.: Hormonal status of male reproductive system: androgens
and estrogens in the testis and epididymis,. In vivo and in vitro approaches.
Reprod Biol. 2006, 6 (Suppl 1), 43–58.
Boekelheide K., Johnson K.J., Richburg J.H.: Sertoli cell toxicants, In: Skinner
M.K., Griswold M.D. (Eds.), Sertolli cell biology. Elsevier Academic Press,
San Diego, 2004.
Bonde J.P., Giwercman A.: Occupational hazard to male fecundity. Reprod
Med Rev. 1995, 4, 59–73.
Borch J., Ladefoged O., Hass U., Vinggaard A.M.: Steroidogenesis in fetal male
rats is reduced by DEHP and DINP, but endocrine eff ects of DEHP are
not modulated by DEHA in fetal, prepubertal and adult male rats. Reprod
Toxicol. 2004, 18 (1), 53–61.
Boyle P., Kaye S., Robertson A.G.: Changes in testicular cancer in Scotland.
Eur J Canc Clin Oncol. 1987, 23, 827–830.
Brede C., Fjeldal P., Skjevrak I., Herikstad H.: Increased migration levels
od bisphenol A from polycarbonate baby bottles after dishwashing, boiling
and brushing. Food Addit Contam. 2003, 20, 684–689.
Calafat A.M., Kuklenyik Z., Reidy J.A., Caudill S.P., Ekong J., Needham L.L.:
Unrinary concentrations of bisphenol A and 4 -nonylphenol in a human reference
population. Environ Health Perspect. 2005, 113, 391–395.
Cardinali M., Maradonna F., Olivotto I., Bortoluzzi G., Mosconi G., Polzonetti-
-Magni A.M. i wsp.: Temporary impairment of reproduction in freshwater
teleost exposed to nonylphenol Reprod Toxicol. 2004, 18 (4), 597–604.
Careghini A., Mastorgio A.F., Saponaro S., Sezenne E.: Bisphenol A, nonylphenols,
benzophenones, and benzotriazoles in soil, groundwater, surface water, sediments,
and food: a review. Environ Sci Pollut Res. 2015, 22, 5711–5741.
Carlsen E., Giwercman A., Keiding N., Skakkebaek N.E.: Evidence for decreasing
quality of semen during past. Br Med J. 1992, 305, 609–613.
Chapin R.F., Delaney J., Wang Y., Lanning L., Davis B., Collins B. i wsp.: Th e
eff ect of 4 -nonylphenol in rats: A mutligeneration reproductive study. Toxicol
Sci. 1999, 52, 80–91.
Chen J.A., Liu H., Shu W.: Analysis of di -n -butyl phthalate and other organic
pollutanta in Chongqing women undergoing parturition. Environ Pollut.
2008, 156 (3), 849–853.
Chitra K.C., Latchoumycandane C., Mathur P.P.: Eff ect of nonylphenol on the
antioxidant system in epididymal sperm of rats. Arch Toxicol. 2002, 76,
545–551.
Chitra K.C., Latchoumycandane C., Mathur P.P.: Induction of oxidative stress
by bisphenol A in the epididymal sperm of rats. Toxicology. 2003a, 185,
119–127.
Chitra K.C., Mathur P.P.: Vitamin E prevents nonylphenol induced oxidative
stress in testes of rats. Ind J Exp Biol. 2004, 42, 220–223.
Chitra K.C., Rao K.R., Mathur P.P.: Eff ect of bisphenol A and vitamin C on epididymis
of adult rats: a histopathological and biochemical study. Asian J Androl.
2003b, 5, 203–208.
CIRC (Cosmetic Ingradient Review Committee). Final report on the safety assessment
of dibutyl phthalate, dimethyl phthalate and diethyl phthalate. J Am
Coll Toxicol. 1985, 4, 267–303.
Colborn T., Clement C.: Advances in modern environmental toxicology. Vol.
XXI. Chemically -induced alterations in sexual and functional development:
the wildlife/human connection. Princeton Scientifi c Publishing Co. Inc,
Princeton 1992.
Dalsenter P.R., Santana G.M., Grande S.W., Andrado A.J., Araujo S.L.: Phthalate
aff ect the reproductive function and sexual behavior of male Wistar rats.
Human Exp Toxicol. 2006, 25, 297–303.
Dash C., Marcus M., Terry P.D.: Bisphenol A.: Do recent studies of health
eff ects among human inform the long -standing debate? Mutat Res. 2006,
613, 68–75.
De Jager C., Bornman M.S., Oosthuizen J.M.: Th e eff ect of p -nonylphenol
on the fertility potential of male rats after gestational, lactational and
direct exposure. Andrologia. 1999a, 31, 107–113.
De Jager C., Bornman M.S., van der Horst G.: Th e eff ect of p -nonylphenol, an
environmental toxicant with oestrogenic properties, on fertility potential
in adult male rats. Andrologia. 1999b, 31, 99–106.
DFG, Deutsche Forschungsgemeinschaft. Di(2 -ethylhexyl)phthalate (DEHP).
W: Gesundheitsschadliche Arbeitsstoff e -Toxikologischarbeitsmedizinische
Begrundungen von MAK -Werten. 35. Red. H. Greim H, Erganzungslieferung,
Wiley -VCH, 2002.
Diaz A., Ventura F.: Simultaneous Determination of Estrogenic Short Ethoxy
Chain Nonylphenols and Th eir Acidic Metabolites in Water by an In -Sample
Derivatization/Solid -Phase Microextraction Method. Anal Chem. 2002,
74 (15), 3869–3876
Diel P.: Tissue-specifi c estrogenic response and molecular mechanisms.
Toxicol Lett. 2002, 127, 217-224.
Dobrzyńska M.M.: Male -mediated eff ects in mice exposed to nonylphenol
or to a combination of X -rays and nonylphenol. Drug Chem Toxicol. 2012,
35 (1), 36–42.
Dobrzyńska M.M., Czajka U., Tyrkiel E.J.: Male -mediated F1 eff ects in mice
exposed to di(2 -ethylhexyl)phthalate (DEHP). W: Male -mediated developmental
toxicity. Red. D. Anderson, M.H.Brinkworth. RSC Publishing
2007.
Dobrzyńska M.M., Gajowik A., Radzikowska J., Tyrkiel E.J., Jankowska-
-Steifer E.A.: Male -mediated F1 eff ects in mice exposed to bisphenol A alone
or in combination with irradiation. Mutat Res. 2015 (submitted).
Dobrzyńska M.M., Jankowska -Steifer E.A., Tyrkiel E.J., Gajowik A., Radzikowska J.,
Pachocki K.A.: Comparison of the eff ects of bisphenol A alone and in a combination
with X -irradiation on sperm count and quality in male adult and
pubescent mice. Environ Toxicol. 2014, 29 (11), 1301–1313.
Dobrzyńska M.M., Radzikowska J.: Genotoxicity and reproductive toxicity of
bisphenol A and X -rays -bisphenol A combination in male mice. Drug Chem
Toxicol. 2013, 36 (1), 10–26.
Dobrzyńska M.M., Tyrkiel E.J., Derezińska E., Pachocki K.A., Ludwicki J.K.: Two
generation reproductive and developmental toxicity following subchronic
exposure of pubescent male mice to di(2 -ethylhexyl)phthalate. Ann Agric
Environ Med. 2012, 19 (1), 31–37.
Dobrzyńska M.M., Tyrkiel E.J., Hernik A., Derezińska E., Góralczyk K.,
Ludwicki J.K.: Th e eff ects of di -n -butyl phthalate on the germ cells of laboratory
mice. Rocz Panstw Zakl Hig. 2009, 60 (4), 317–324.
Dobrzyńska M.M., Tyrkiel E.J., Pachocki K.A.: Developmental toxicity in mice
following paternal exposure to Di -N -butyl -phthalate. Biomed Environ Sci.
2011, 24 (5), 569–578.
Dobrzyńska M.M.: Combined action of X -rays and nonylpheol on mouse
sperm. Cent Eur J Biol. 2011, 6 (3), 320–329.
Dostal L.A., Chapin R.E., Stefanski S.A., Harris M.W., Schwetz B.A:. Testicular
toxicity and reduced Sertoli cell numbers in neonatal rats by di(2 -ethylhexyl)
phthalate and the recovery of fertility as adults. Toxicol Appl Pharmacol.
1988, 95, 104–121.
Doyle T.J., Bowman J.L., Windell V.L., McLean D.J., Kim K.H.: Transgenerational
eff ects of di -(2 -ethylhexyl) phthalate on testicular germ cell associations
and spermatogonial stem cells in mice. Biol Reprod. 2013, 88 (5), 112, 1–15.
Duty S.M., Silva M.J., Barr D.B., Brock J., Ryan L., Chen Z. i wsp.: Phthalate
exposure and human semen parameters. Epidemiology. 2003a, 14, 269–277.
Duty S.M., Singh N.P., Silva M.J., Barr D.B., Brock J.W., Ryan L. i wsp.: Th e relationship
between environmental exposure to phthalates and DNA damage
in human sperm using the neutral comet assay, Environ Health Perspect.
2003b, 1119, 1164–1169.
EC Report. 4 -Nonylphenol (Branched) and Nonylphenol. Summary risk
assessment report. European Communities. 2002.
El -Dakdoky M.E., Helal M.A.: Reproductive toxicity of male mice after exposure
to nonylphenol. Bull Environ Contam Toxicol. 2007, 79, 188–191.
Ema M., Amano H., Itami T., Kawasaki H.: Teratogenic evaluation of di -n-
-butyl phthalate in rats. Toxicol Lett. 1993, 69, 197–203.
Ema M., Miyawaki E., Kawashima K.: Eff ects of dibutyl phthalate on reproductive
function in pregnant and pseudopregnant rats. Reprod Toxicol.
2000, 14, 13–19.
Ema M., Miyawaki E., Kawashima K.: Further evaluation of developmental
toxicity of di -n -butyl phthalate following administration during late pregnancy
in rats. Toxicol Lett. 1998, 98 (1 -2), 87–93
Ema M., Miyawaki E.: Eff ects on development of the reproductive system in
male off spring of rats given butyl benzyl phthalate during late pregnancy.
Reprod Toxicol. 2002, 16 (1), 71–76.
Ema M., Miyawaki N.E., Hirose A., Kamata E.: Decreased anogenital distance
and increased incidence of undescended testes in fetuses of rats
given monobenzyl phthalate, a major metabolite of butyl benzyl phthalate.
Reprod Toxicol. 2003, 17, 407–412.
Faouzi A.., Dine T., Gressier B., Kambia K., Lucky M., Pagniez D. i wsp.: Exposure
of hemodialysis patients to di -2 -ethylhexyl phthalate. Int J Pharmacol.
1999, 180, 113–121.
Filipiak E., Suliborska D., Leszczyńska M., Walczak -Jędrzejowska R., Oszukowska E.,
Marchlewska K. i wsp.: Estrogen receptor alpha localization in the testis
of men normal spermatogenesis. Folia Histochem Cytobiol. 2012, 50 (3),
340–345.
Fisher J.S., Macpherson S., Marchetti N., Sharpe R.M.: Human “testicular dysgenesis
syndrome”: a possible model using in -utero exposure of the rat
to dibutyl phthalate. Human Reprod. 2003, 18, 1383–1394.
Fromme H.,Lahrz T., PilotyM., Gebhart H., Oddoy A., Rüden H.: Occurrence of
phthalates and musk fragrances in idoor air and dust from apartments and
kindergartens in Berlin (Germany). Indoor Air 2004, 14, 188–195.
Fukuoto H., Tanimoto T., Zhou Y., Hayakawa T.: Mechanism of testicular atrophy
induced by di -n -butyl phthalate in rats. J Appl Toxicol. 1989, 9, 277–289.
Gamez J.M., Penalba R., Cardoso N., Ponzo O., Carbone S., Pandolfi M. i wsp.:
Low dose of bisphenol A impairs the reproductive axis of prepubertal male
rats. J Physiol Biochem. 2014, 70 (1), 239–246.
Giribabu N., Sainath S.B., Sreenivasula Reddy P.: Perinatal di -n -butyl phthalate
exposure alters reproductive function at adulthood in male rats. Environ
Toxicol. 2014, 29 (5), 534–544.
Gong Y., Han X.: Nonylphenol induced oxidative stress and cytotoxicity in
testicular Sertoli cells. Reprod Toxicol. 2006, 22, 623–630.
Gray L.E. Jr., Satby J., Furr J., Price M., Veeramachaneni D.N., Parks L.: Perinatal
exposure to the phthalates DEHP, BBP, and DOTP, alters sexual diff erentiation
of the male rat. Toxicol Sci. 2000, 58, 350–365.
Gray T.J., Beamand J.A.: Eff ect of some phthalates esters and other testicular
toxins on primary cultures of testicular cells. Food Chem Toxicol.
1984, 22, 123–131.
Gray T.J., Butterworth K.R.: Testicular atrophy produced by phthalate esters.
Arch Toxicol Suppl. 1980, 4, 432–455.
Guenther K., Heinke V., Th iele B., Kleist E., Prast H., Raecker T.: Endocrine disrupting
nonylphenols are ubiquitous in food. Environ Sci Technol. 2002,
36, 1676–1680.
Gyllenhammer I., Glynn A., Darnerud P.O., Lignell S., van Delft R., Aune M.:
4 -Nonylphenol and bisphenol A in Swedish nursing women. Environ Int.
2012, 43, 21–28.
Han X.D., Tu Z.G., Gong Y., Shen S.N., Wang X.Y., Kang L.N. i wsp. Th e toxic
eff ects of nonylphenol on the reproductive system of male rats. Reprod
Toxicol. 2004, 19, 215–221.
Hauser R., Calafat A.M.: Phthalates and human health. Occupat Environ
Med. 2005, 62, 806–818.
Hauser R., Meeker J.D., Singh N.P., Silva M.J., Ryan L., Duty S i wsp.: DNA
damage in human sperm is related to urinary levels of phthalate monoester
and oxidative metabolites. Hum Reprod. 2007, 22, 88–95.
Heindel J.J., Chapin R.E.: Inhibition of FSH -stimulated c -AMP accumulation
by mono(2 -ethylhexyl)phthalate in primary rat Sertoli -cell cultures.
Toxicol Appl Pharmacol. 1989, 97, 372–385.
Heindel J.J., Powell C.J.: Phthalate esters eff ects on rat Sertoli cell function
in vitro, eff ects of phthalatic side chain and age of animal. Toxicol Appl
Pharmacol. 1992, 115, 116–123.
Hejmej A., Kotula -Balak M., Galas J., Bilińska B.: Eff ects of 4 -tert -octylphenol
on the testes and seminal vesicles in adult male bank voles. Reprod Tox.
2011, 31 (1), 95–105.
Hejmej A., Kotula -Balak M. ,Górowska E., Bilińska B.: Badania nad rolą estrogenów
w gonadzie męskiej. W: Układ płciowy męski – badania kliniczne
i doświadczalne. Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu
Medycznego, Szczecin 2013, 282–291.
Hellwig J., Freudenberger J., Jackh. R.: Diff erential prenatal toxicity of branched
phthalate esters in rats. Food Chem Toxicol. 1997, 35, 501–512.
Herath C.B., Jin W., Watanabe G., Arai K., Suzuki A.K., Taya K.: Adverse eff ects
of environmental toxicants, octylphenol and bisphenol A, on male reproductive
function in pubertal rats. Endocrine. 2004, 25, 163–172.
Heudorf U., Mersch -Sudermann V., Angerer J.: Phthalates: Toxicology and
exposure. Int J Hyg Environ Health. 2007, 210 (5), 623–634.
Hirosawa N., Yano K., Suzuki Y., Sakamoto Y.: Endocrine disrupting eff ect of
di -(2 -ethylhexyl) phthalate on female rats and proteome analysis of their
pituitaries. Proteomics. 2006, 6, 958–971.
Ho S.M., Tang W.Y., Belmonte de Frausto J., Prins G.S.: Developmental exposure
to estradiol and bisphenol A increases susceptibility to prostate carcinogenesis
and epigenetically regulates phosphodiestrase type 4 variant
4. Cancer Res. 2006, 66, 5624–5632
Hossaini A., Dalgaard M., Vinggaard A.M., Frandsen H., Larsen J.J.: In utero
reproductive study in rats exposed to nonylphenol. Reprod Toxicol. 2001,
15, 537–543.
Huang P.C., Tien C.J., Sun Y.M., Hsieh C.Y., Lee C.C.: Occurrence of phthalates
in sediment and biota: relationship to aquatic factors and the biota sediment
accumulation factor, Chemosphere. 2008, 73, 539–544.
Huang X.F., Li Y., Gu Y.H., Liu M., Xu Y., Sun F. i wsp.: Th e eff ects of
di -(2 -ethylhexyl) -phthalate exposure on fertilization and embryonic development
in vitro and testicular genomic mutation in vivo. PLoS One. 2012,
7 (11), 1–7.
Huang Y.F., Wang P.W., Huang L.W., Yang W., Yu C.J., Yang S.H. i wsp.:
Nonylphenol in pregnant women and their matching fetuses: Placental
transfer and potential risks of infants. Environ Res. 2014, 134, 143–49.
Ishihara M., Itoh M., Miyamoto K., Suna S., Takeuchi Y., Takenaka I. i wsp.:
Spermatogenic disturbance induced by di -(2 -ethylhexyl) phthalate is signifi
cantly prevented by treatment with antioxidant vitamins in the rat. Int
J Androl. 2000, 23 (2), 85–94.
Jeng H.A., Yu L.: Alterations in sperm quality and hormone levels by polycyclic
aromatic hydrocarbons on airborne particulae. J Environ Sci Health
A Tox Hazard Subst Environ Eng. 2008, 43, 675–681.
Jie X., Yang W., Jie Y., Hashim J.H., Liu X.Y., Fan Q.Y. i wsp.: Toxic eff ect of
gestational exposure to nonylphenol on F male rats. Birth Defects Res B.
2010, 89 (5), 418–428.
Jobling M.S., Hutchinson G.R., van den Driesche S., Sharpe R.M.: Eff ects of
di(n -butyl) phthalate exposure on foetal rat gern -cell number and diff erentiation:
identifi cation of age -specyfi c windows of vulnerability. Int J Androl.
2011, 34, 886–896.
Jobling S., Reynolds T., White R., Parker M.G., Sumpter J.P.: A variety of environmentally
peristent chemicals including some phthalate plasticizers, are
weekly estrogenic. Environ Health Perspect. 1995, 103, 582–587.
Jones H.B., Garside D.A., Liu R., Roberts J.C.: Th e infl uence of phthalate esters
on Leydig cell structure and function in vitro and in vivo. Exp Mol Pathol.
1993, 58 (3), 179–193.
Jorgensen N., Joensen U.N., Jensen T.K., Jensen M.B., Almstrup K., Olesen I.A.
i wsp.: Human semen quality in the new millennium: a prospective cross-
-sectional population -based study of 4867 men. BMJ. 2012, 2, 1–13.
Kamrin M.A.: Phthalate risks, phthalate regulation and public health: A review.
J Toxicol Environ Health Part B. 2009, 12, 157–174.
Kavlock R., Barr D., Boekelheide K.,Breslin W., Breysse P., Chapin R. i wsp.: NTP-
-CERHR expert panel updateon the reproductive and developmental toxicity
on di -(2 -ethylhexyl) phthalate. Reprod Toxicol. 2006, 22, 291–399.
Kavlock R., Boekelheide K., Chapin R., Cunningham M., Faustman E., Foster P.
i wsp.: NTP Center for Evaluation of Risks to Human Reproduction: phthalates
expert panel report on the reproductive and developmental toxicity
of di -n -butyl phthalate. Reprod Toxicol. 2002, 16, 453–487.
Kawai K., Nozaki T., Nishikata H., Aou S., Takii M., Kubo C.: Aggressive behavior
and serum testosterone concentration during the maturation process
of male mice. Th e eff ects of fetal exposure to bisphenol A. Environ Health
Perspect. 2003, 111 (2), 175–178.
Kim H.S., Kim T.S., Shin J.H., Moon H.J., Kang I.H., Kim I.Y. i wsp.: Neonatal
exposure to di(n -butyl) phthalate (DBP) alters male reproductive -tract development.
J Toxicol Environ Health A. 2004, 67 (23 -24), 2045–2060.
Fisher J.S., Macpherson S., Marchetti N., Sharpe R.M.: Human “testicular dysgenesis
syndrome”: a possible model using in -utero exposure of the rat
to dibutyl phthalate. Human Reprod. 2003, 18, 1383–1394.
Fromme H.,Lahrz T., PilotyM., Gebhart H., Oddoy A., Rüden H.: Occurrence of
phthalates and musk fragrances in idoor air and dust from apartments and
kindergartens in Berlin (Germany). Indoor Air 2004, 14, 188–195.
Fukuoto H., Tanimoto T., Zhou Y., Hayakawa T.: Mechanism of testicular atrophy
induced by di -n -butyl phthalate in rats. J Appl Toxicol. 1989, 9, 277–289.
Gamez J.M., Penalba R., Cardoso N., Ponzo O., Carbone S., Pandolfi M. i wsp.:
Low dose of bisphenol A impairs the reproductive axis of prepubertal male
rats. J Physiol Biochem. 2014, 70 (1), 239–246.
Giribabu N., Sainath S.B., Sreenivasula Reddy P.: Perinatal di -n -butyl phthalate
exposure alters reproductive function at adulthood in male rats. Environ
Toxicol. 2014, 29 (5), 534–544.
Gong Y., Han X.: Nonylphenol induced oxidative stress and cytotoxicity in
testicular Sertoli cells. Reprod Toxicol. 2006, 22, 623–630.
Gray L.E. Jr., Satby J., Furr J., Price M., Veeramachaneni D.N., Parks L.: Perinatal
exposure to the phthalates DEHP, BBP, and DOTP, alters sexual diff erentiation
of the male rat. Toxicol Sci. 2000, 58, 350–365.
Gray T.J., Beamand J.A.: Eff ect of some phthalates esters and other testicular
toxins on primary cultures of testicular cells. Food Chem Toxicol.
1984, 22, 123–131.
Gray T.J., Butterworth K.R.: Testicular atrophy produced by phthalate esters.
Arch Toxicol Suppl. 1980, 4, 432–455.
Guenther K., Heinke V., Th iele B., Kleist E., Prast H., Raecker T.: Endocrine disrupting
nonylphenols are ubiquitous in food. Environ Sci Technol. 2002,
36, 1676–1680.
Gyllenhammer I., Glynn A., Darnerud P.O., Lignell S., van Delft R., Aune M.:
4 -Nonylphenol and bisphenol A in Swedish nursing women. Environ Int.
2012, 43, 21–28.
Han X.D., Tu Z.G., Gong Y., Shen S.N., Wang X.Y., Kang L.N. i wsp. Th e toxic
eff ects of nonylphenol on the reproductive system of male rats. Reprod
Toxicol. 2004, 19, 215–221.
Hauser R., Calafat A.M.: Phthalates and human health. Occupat Environ
Med. 2005, 62, 806–818.
Hauser R., Meeker J.D., Singh N.P., Silva M.J., Ryan L., Duty S i wsp.: DNA
damage in human sperm is related to urinary levels of phthalate monoester
and oxidative metabolites. Hum Reprod. 2007, 22, 88–95.
Heindel J.J., Chapin R.E.: Inhibition of FSH -stimulated c -AMP accumulation
by mono(2 -ethylhexyl)phthalate in primary rat Sertoli -cell cultures.
Toxicol Appl Pharmacol. 1989, 97, 372–385.
Heindel J.J., Powell C.J.: Phthalate esters eff ects on rat Sertoli cell function
in vitro, eff ects of phthalatic side chain and age of animal. Toxicol Appl
Pharmacol. 1992, 115, 116–123.
Hejmej A., Kotula -Balak M., Galas J., Bilińska B.: Eff ects of 4 -tert -octylphenol
on the testes and seminal vesicles in adult male bank voles. Reprod Tox.
2011, 31 (1), 95–105.
Hejmej A., Kotula -Balak M. ,Górowska E., Bilińska B.: Badania nad rolą estrogenów
w gonadzie męskiej. W: Układ płciowy męski – badania kliniczne
i doświadczalne. Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu
Medycznego, Szczecin 2013, 282–291.
Hellwig J., Freudenberger J., Jackh. R.: Diff erential prenatal toxicity of branched
phthalate esters in rats. Food Chem Toxicol. 1997, 35, 501–512.
Herath C.B., Jin W., Watanabe G., Arai K., Suzuki A.K., Taya K.: Adverse eff ects
of environmental toxicants, octylphenol and bisphenol A, on male reproductive
function in pubertal rats. Endocrine. 2004, 25, 163–172.
Heudorf U., Mersch -Sudermann V., Angerer J.: Phthalates: Toxicology and
exposure. Int J Hyg Environ Health. 2007, 210 (5), 623–634.
Hirosawa N., Yano K., Suzuki Y., Sakamoto Y.: Endocrine disrupting eff ect of
di -(2 -ethylhexyl) phthalate on female rats and proteome analysis of their
pituitaries. Proteomics. 2006, 6, 958–971.
Ho S.M., Tang W.Y., Belmonte de Frausto J., Prins G.S.: Developmental exposure
to estradiol and bisphenol A increases susceptibility to prostate carcinogenesis
and epigenetically regulates phosphodiestrase type 4 variant
4. Cancer Res. 2006, 66, 5624–5632
Hossaini A., Dalgaard M., Vinggaard A.M., Frandsen H., Larsen J.J.: In utero
reproductive study in rats exposed to nonylphenol. Reprod Toxicol. 2001,
15, 537–543.
Huang P.C., Tien C.J., Sun Y.M., Hsieh C.Y., Lee C.C.: Occurrence of phthalates
in sediment and biota: relationship to aquatic factors and the biota sediment
accumulation factor, Chemosphere. 2008, 73, 539–544.
Huang X.F., Li Y., Gu Y.H., Liu M., Xu Y., Sun F. i wsp.: Th e eff ects of
di -(2 -ethylhexyl) -phthalate exposure on fertilization and embryonic development
in vitro and testicular genomic mutation in vivo. PLoS One. 2012,
7 (11), 1–7.
Huang Y.F., Wang P.W., Huang L.W., Yang W., Yu C.J., Yang S.H. i wsp.:
Nonylphenol in pregnant women and their matching fetuses: Placental
transfer and potential risks of infants. Environ Res. 2014, 134, 143–49.
Ishihara M., Itoh M., Miyamoto K., Suna S., Takeuchi Y., Takenaka I. i wsp.:
Spermatogenic disturbance induced by di -(2 -ethylhexyl) phthalate is signifi
cantly prevented by treatment with antioxidant vitamins in the rat. Int
J Androl. 2000, 23 (2), 85–94.
Jeng H.A., Yu L.: Alterations in sperm quality and hormone levels by polycyclic
aromatic hydrocarbons on airborne particulae. J Environ Sci Health
A Tox Hazard Subst Environ Eng. 2008, 43, 675–681.
Jie X., Yang W., Jie Y., Hashim J.H., Liu X.Y., Fan Q.Y. i wsp.: Toxic eff ect of
gestational exposure to nonylphenol on F male rats. Birth Defects Res B.
2010, 89 (5), 418–428.
Jobling M.S., Hutchinson G.R., van den Driesche S., Sharpe R.M.: Eff ects of
di(n -butyl) phthalate exposure on foetal rat gern -cell number and diff erentiation:
identifi cation of age -specyfi c windows of vulnerability. Int J Androl.
2011, 34, 886–896.
Jobling S., Reynolds T., White R., Parker M.G., Sumpter J.P.: A variety of environmentally
peristent chemicals including some phthalate plasticizers, are
weekly estrogenic. Environ Health Perspect. 1995, 103, 582–587.
Jones H.B., Garside D.A., Liu R., Roberts J.C.: Th e infl uence of phthalate esters
on Leydig cell structure and function in vitro and in vivo. Exp Mol Pathol.
1993, 58 (3), 179–193.
Jorgensen N., Joensen U.N., Jensen T.K., Jensen M.B., Almstrup K., Olesen I.A.
i wsp.: Human semen quality in the new millennium: a prospective cross-
-sectional population -based study of 4867 men. BMJ. 2012, 2, 1–13.
Kamrin M.A.: Phthalate risks, phthalate regulation and public health: A review.
J Toxicol Environ Health Part B. 2009, 12, 157–174.
Kavlock R., Barr D., Boekelheide K.,Breslin W., Breysse P., Chapin R. i wsp.: NTP-
-CERHR expert panel updateon the reproductive and developmental toxicity
on di -(2 -ethylhexyl) phthalate. Reprod Toxicol. 2006, 22, 291–399.
Kavlock R., Boekelheide K., Chapin R., Cunningham M., Faustman E., Foster P.
i wsp.: NTP Center for Evaluation of Risks to Human Reproduction: phthalates
expert panel report on the reproductive and developmental toxicity
of di -n -butyl phthalate. Reprod Toxicol. 2002, 16, 453–487.
Kawai K., Nozaki T., Nishikata H., Aou S., Takii M., Kubo C.: Aggressive behavior
and serum testosterone concentration during the maturation process
of male mice. Th e eff ects of fetal exposure to bisphenol A. Environ Health
Perspect. 2003, 111 (2), 175–178.
Kim H.S., Kim T.S., Shin J.H., Moon H.J., Kang I.H., Kim I.Y. i wsp.: Neonatal
exposure to di(n -butyl) phthalate (DBP) alters male reproductive -tract development.
J Toxicol Environ Health A. 2004, 67 (23 -24), 2045–2060.
Słowikowska -Hilczer J., Szarras -Czapnik M., Marchlewska K., Filipiak E.,
Oszukowska E., Walczak -Jędrzejowska R. i wsp.: Zespół dysgenetycznych
jąder: patogeneza i konsekwencje kliniczne. Endokrynol Ped. 2013, 1 (42),
67–76.
Słowikowska -Hilczer J.: Xenobiotics with estrogen or antiandrogen action
– disruptors of the male reproductive system. Centr Europ J Med. 2006,
3, 205–227.
Soares A., Guieysse B., Jeff erson B., Cartmell E., Lester J.N.: Nonylphenol in
the environment: a critical review on occurrence, fate, toxicity and treatment
in wastewaters. Environ Int. 2008, 34 (7), 1033–1049.
Song X.F., Deng Y.J., Zhang D.Y., Liu X., Wu S.D., Wei G.H.: Eff ects of
Di(2 -ethylhexyl) phthalate on the testis and testicular gubernaculums of
fetal KM mice (Abstr). Zhonghua Nan Ke Xue. 2009, 15, 195–199.
Soto A.M., Justice H., Wray J.W., Sonnenschein C.: p -Nonylphenol ann estrogenic
xenobiotic released from “modifi ed” polystyrene. Environ Health
Perspect. 1991, 92, 167–173.
Soto A.M., Sonnenschein C., Chung K.L., Fernandez M.F., Olea N., Serrano O.:
he E-SCREEN assay as a tool to identify estrogens: an update on estrogenic
environmental pollutants. Environ Health Perspect. 1995, 103(7)
113–122.
Soto A.M., Vandenberg L.N., Muffi ni M.V., Sonnenschein C.: Does breast cancer
start in the womb?, Basic Clinical Pharmacol Toxicol. 2008, 102, 25–33.
Struciński P., Goralczyk K., Ludwicki J.K., Czaja K., Hernik A., Korcz W.: Poziomy
wybranych insektycydów, polichlorowanych bifenyli, ftalanów i perfl uorowanych
związków alifatycznych we krwi – badanie WWF Polska. Rocz
Panstw Zakl Hig 2006, 57, 99–112.
Sun C., Leon L.P., Barlow P.J., Chan S.H., Bloodworth B.C.: Single laboratory
validation of method for the determination bisphenol A, bisphenol A diglycidal
ether and its derivatives in canned foods by reserved -phase liquid
chromatography. J Chromatogr A. 2006, 1129, 145–148.
Swan S.H., Elkin E.P., Fenster L.: Th e question of declining sperm density
revisited: An analysis of 101 studies published 1934–1996. Environ Health
Perspect. 2000, 108 (10), 961–966.
Swan S.H., Main K.M., Liu F., Stewart S.L., Kruse R.L., Calafat A.M. i wsp.:
Study for future families research team: decrease in anogenital distan ce
among male infants with prenatal phthalate exposure. Environ. Health
Perspect. 2005, 113, 1056–1061.
Szychowski K.A. i Wójtowicz A.K.: Składniki tworzyw sztucznych zaburzające
funkcje układu nerwowego. Postępy Hig Med. Dosw. (online) 2013, 67,
499–506.
Świtalska M., Strządała L.: Niegenomowe działanie estrogenów. Non-genomic
action of estrogens. Postepy Hig Med Dosw. (online). 2007, 61, 541–547.
Tainaka H., Takahashi M., Umezawa H., Tanaka Y., Nishimune S., Oshio S. i wsp.:
Evaluation of the testicular toxicity of prenatal exposure to bisphenol A based
on microarray analysis combined with MeSH annotation. J Toxicol Sci.
2012, 37, 539–348.
Takao T., Nanamiya T., Nagano I., Asaba K., Kawabata K., Hashimoto K.: Exposure
with the environmental estrogen bisphenol A disrupts the male reproductive
tract in young mice. Life Sci. 1999, 65, 2351–2357.
Tan B.L.L., Kassim N.M., Mohd M.A.: Assessment of pubertal development
of juvenile male rats after sub -acute exposure to bisphenol A and nonylphenol.
Toxicol Lett. 2003, 143, 261–270.
Timms B.G., Howdeshell K.L.,. Barton L., Bradley S., Richter C.A., vom Saal F.S.:
Estrogenic chemicals in plastic and oral contraceptives disrupt development
of the fetal mouse prostate and urethra, Proc Natl Acad Sci USA.
2005, 102, 7014–7019.
Tiwari D., Vanage G.: Mutagenic eff ect of bisphenol A on adult rat male germ
cells and their fertility. Reprod Toxicol. 2013, 40, 60–68.
Toft G., Hagmar L.,Giwerman A., Bonde J.P.: Epidemiological evidence on
reproductive eff ects of persistent organochlorines in humans. Reprod
Toxicol. 2004, 19, 5–26.
Toyama Y., Suzuki -Toyoata F., Maekawa M., Ito C., Toshimori K.: Adverse eff ects
of bisphenol A to spermatogenesis in mice and rats. Arch Histol Cytol. 2004,
67, 373–381.
Toyama Y., Yuasa S.: Eff ects of neonatal administration of 17 -ß -estradiol
3 -benzoate or bisphenol A on mouse and rat spermatogenesis. Reprod
Toxicol. 2004, 19, 181–188.
Tyl R.W., Myers C.B., Marr M.C., Fail P.A., Seely J.C., Brine D.R. i wsp.:
Reproductive toxicity evaluation of dietary butyl benzyl phthalate (BBP)
in rtas. Reprod Toxicol. 2004, 18, 241–264.
Tyl R.W., Myers C.B., Marr M.C., Th omas B.F., Keimowitz A.R., Brine D.R. i wsp.:
Th ree -generation reproductive toxicity study of dietary bisphenol A in CD
Sprague -Dawley rats. Toxicol Sci. 2002, 68, 121–146.
Tyrkiel E.J., Dobrzyńska M.M., Derezińska E., Ludwicki J.K.: Badanie wpływu
ftalanu butylobenzylu (BBP) na ilość i jakość gamet męskich przy subchronicznym
narażeniu myszy laboratoryjnych. Rocz Panstw Zakl Hig. 2007,
58 (4), 677–686.
U.S. EPA (United States Environmental Protection Agency). Offi ce of Ground
Water and Drinking Water. Drinking Water and Health 1999.
Uguz C., Varisli O., Agca C., Agca Y.: Eff ects of nonylphenol on motility and
subcellular elements of epididymal rat sperm. Reprod Toxicol. 2009, 28
(4), 542–549.
Vandenberg L.N., Maffi ni M.V., Sonnenschein C., Rubin B.S., Soto A.M.: Bisphenol
A and the great divide: a review of controversies in the fi eld of endocrine
disruption, Endocrinol Rev. 2009, 30, 75–95.
Viela J., Hartmann A., Silva E.F., Cardoso T., Corcini C.D., Varela -Junior A.S. i wsp.:
Sperm impairments in adult vesper mice (Calomys laucha) caused by in utero
exposure to bisphenol A. Andrologia. 2014, 46 (9), 971–978.
Vo T.T., Jung E.M., Dang V.H., Jung R., Baek J., Choi K.C. i wsp.: Diff erential
eff ects of fl utamide and di -(2 -ethylhexyl) phthalate on male reproductive
organs in rat model. J Reprod Develop. 2009, 55, 400–411.
vom Saal F.S., Cooke P.S., Buchanan D.L., Palanza P., Th ayer K.A., Nagel S.C. i wsp.:
A physiologically based approach to the study of bisphenol A and other estrogenic
chemicals on the size of reproductive organs, daily sperm production,
and behavior. Toxicol Ind Health. 1998, 14, 239–260.
vom Saal F.S., Hughes C.: An extensive new literature concerning low -dose
eff ects of bisphenol A shows the need for a new risk assessment. Environ
Health Perspect. 2005, 113, 926–933.
Walczak -Jędrzejowska R., Kula K.: Rola steroidowych hormonów płciowych
jadra i ich interakcji przy wywołaniu dojrzewania kanalików plemnikotwórczych.
W: Układ płciowy meski – badania kliniczne i doświadczalne.
Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego, Szczecin
2013, 282–291.
Wan H.T., Leung P.Y., Zhao Y.G., Wei X., Wong M.H., Wong C.K.: Blood plasma
concentrations of endocrine disrupting chemicals in Hong Kong populations.
J Hazard Mat. 2013, 261, 763–769.
Wang X., Han X., Hou Y., Yao G., Wang Y.: Eff ects of nonylphenol on apoptosis
of Sertoli cells in vitro. Bull Environ Contam Toxicol. 2003, 70, 898–904.
Wang Y.B., Song L., Zhou Z.P., Chen J.F., Wang X.R.: Eff ects of dibutyl phthalate
on Sertoli cells of rat testis. Zhonghua Yu Fang Yi Xue Za Zhi. 2005,
39, 179–181.
Weber L.P., Kiparissis Y., Hwang G.S., Niimi A.J., Janz D.M., Metcalfe C.D.:
Increased cellular apoptosis after chronic aqueous exposure to nonylphenol
and quercetin in adult medaka (Oryzias latipes). Comp Biochem Physiol
C Toxicol Pharmacol. 2002, 131 (1), 51–59.
Welshons W.V., Nagel S.C., vom Saal F.S.: Large eff ects from small exposures.
III Endocrine mechanisms mediating eff ects of bisphenol A at levels of
human exposure. Endocrinol. 2006, 146, 156–169.
Wine R.N., Li L.H., Barries L.H., Gulati D.K., Chapin J.P.: A variety of environmental
peristant chemicals, including some phthalate plasticizers are
weakly estrogenic. Environ Health Perspect. 1997, 107, 102–107.
Wong J.S., Gill S.S.: Gene expression changes induced in mouse liver by
di(2 -ethylhexyl)phthalate. Toxicol Appl Pharmacol. 2002, 185, 180–196.
Wozniak M., i Murias M.: Ksenostrogeny: substancje zakłócające funkcjonowanie
układu hormonalnego. Ginecol Pol. 2008, 79, 785–790.
Working P.K., Bus J.S., Hamm T.E. Jr.: Reproductive eff ects of inhaled methyl
chloride in the male Fisher 344 rat. II. Spermatogonial toxicity and sperm
quality. Toxicol Appl Pharm. 1985, 77, 144–157.
Wu J.J., Wang K.L., Wang S.W., Hwang G.S., Mao I.F., Chen M.L. i wsp.:
Diff erential eff ects of nonylphenol on testosterone secretion in rat Leydig
cells. Toxicology. 2010, 268, 1–7.
Wypych G.: Handbook of Plasticizers. ChemTec Publishing, Ontario, Canada, 2004.
Xiao -feng Z., NaQiang Q., Jing Z., Zi L., Yang Z.: Di (n -butyl) phthalate inhibits
testosterone synthesis through a glucocorticoid -mediated pathways in
rats. Int J Toxicol. 2009, 28, 448–456.
Ying F., Ding C., Ge R., Wang X., Li F., Zhang Y. i wsp.: Comparative evaluation
of nonylphenol isomers on steroidogenesis of rat Leydig Cells. Toxicol In
Vitro. 2012, 26 (7), 1114–1121.
Zhang G.L., Zhang X.F., Feng Y.M., Li L., Huynh E., Sun X.F. i wsp.: Exposure
to bisphenol A results in decline in mouse spermatogenesis. Reprod Fertil
Dev. 2013, 25 (6), 847–859.
Hang H., Zeng Y., Cheng W., Wu D.: Adverse eff ects of nonylphenol on the
reproductive function of adult male SD rats. Sichuan Da Xue Xue Bao Yi
Xue Ban. 2003, 34, 292–297.
Zhang X.F., Zhang T., Wang L., Zhang H.Y., Chen Y.D., Qin X.S. i wsp.: Eff ect
of dietylhexyl phthalate (DEHP) given neonatally on spermatogenesis of
mice. Mol Biol Rep. 2013, 40, 6509–6517.
Zhang Y., Jiang X., Chen B.: Reproductive and developmental toxicity in F1
Sprague -Dawley male rats exposed to di -n -butyl phthalate in utero and
during lactation and determination of its NOAEL. Reprod Toxicol. 2004,
18, 669–676.
Zhou D., Wang H., Zhang J.: Di -n -butyl phthalate (DBP) exposure induces
oxidative stress in epididymis of adult rats. Toxicol Ind Health. 2011, 27
(1), 65–71.
Zolfaghari M., Drogui P., Seyhi B., Brar S.K., Bueina G., Dube R.: Occurrence
fate and eff ects of Di (2 -ethylhexyl) phthalate in wastewater treatment
plants: A review. Environ Pollut. 2014, 194, 281–292.




 wymienić należy palenie papierosów. Toksyny z dymu
papierosowego przedostają się do układu płciowego
i reagują ze składnikami plazmy nasienia (Kulikauskas
i wsp., 1985; Pacifi ci i wsp., 1993; Sepaniak i wsp., 2004;
Trummer i wsp., 2002). Wykazano, że u palaczy występuje
wzrost poziomu RFT, liczby leukocytów oraz komórek
okrągłych w nasieniu, obniżenie ruchliwości i żywotności
plemników i wzrost nasilenia fragmentacji DNA
(Ochędalski i wsp., 1994; Pacifi ci i wsp., 1993; Saleh i wsp.,
2002; Sepaniak i wsp., 2004; Taha i wsp., 2012). Dodatkowo
w nasieniu palaczy obniżony jest poziom takich antyoksydantów
jak witamina E, C oraz cynk, co wzmaga ryzyko
uszkodzeń oksydacyjnych plemników (Fraga i wsp., 1996;
Mostafa i wsp., 2006; Taha i wsp., 2012).
Kolejnym czynnikiem zwiększającym poziom RFT
jest konsumpcja alkoholu. Ponadto wykazano, że nadużywanie
alkoholu często związane jest z niedożywieniem
i dietą ubogą w antyoksydanty (Koch i wsp.,
2004). Z kolei nieprawidłowa dieta, bogata w tłuszcze
i węglowodany oraz siedzący tryb życia mogą prowadzić
do otyłości. Nagromadzenie tkanki tłuszczowej
może powodować uwalnianie z niej cytokin prozapalnych
i wzrost wytwarzania RFT w leukocytach.
Dodatkowo, otyłość doprowadza także do przegrzewania
jąder w wyniku nagromadzenia tkanki tłuszczowej
w regionie pachwin (Khullar i wsp., 2012; Palmer
i wsp., 2012; Singer i Granger, 2007). Z drugiej strony
zbyt intensywne ćwiczenia fi zyczne powodują wzrost
RFT w wyniku zwiększonego metabolizmu tlenowego
w mięśniach (Peake i wsp., 2007). Hipoteza stresu oksydacyjnego
związanego ze starzeniem się organizmu jest
jedną z najbardziej popularnych hipotez wyjaśniających
molekularne podstawy tego procesu (Olinski i wsp., 2007).
Siomek i wsp. (2007) zaobserwowali np. dodatnią korelacje
występującą między wiekiem a poziomem markerów
oksydacyjnego uszkodzenia DNA badanych w leukocytach
krwi obwodowej, a także zależny od wieku spadek
poziomu witaminy C we krwi. Dodatkowo, wykazano
istnienie bezpośredniego związku między ogólnoustrojowym
stresem oksydacyjnym występującym w procesie
starzenia się organizmu a wzrostem uszkodzeń DNA
w plemnikach zarówno u mężczyzn płodnych, jak i niepłodnych
(Junqueira i wsp., 2004). Udokumentowano
także wzrost zaburzeń genetycznych u dzieci starszych
ojców, w wyniku pogarszania się jakości DNA plemników,
czego podłożem może być właśnie zwiększona produkcja
RFT, a zarazem obniżona zdolność antyoksydacyjna
organizmu (Crosnoe i Kim, 2013; Paul i Robaire, 2013).
Jednakże, o ile z jednej strony ogólnoustrojowy stres
oksydacyjny, związany np. ze starzeniem się organizmu,
może wpływać na uszkodzenia DNA w plemnikach,
to z drugiej strony Guz i wsp. (2013) nie znaleźli związku
między istniejącym stresem oksydacyjnym w nasieniu
niepłodnych mężczyzn a tym badanym w leukocytach
krwi obwodowej (tzn. ogólnoustrojowym), co sugeruje,
że stan oksydoredukcyjny nasienia może występować
niezależnie od tego w innych tkankach.
Kolejny czynnik środowiskowy związany ze stylem
życia, którego wpływ na męską płodność jest ostatnio
intensywnie badany, to promieniowanie elektromagnetyczne
o częstotliwości radiowej (RF -ERM, ang. radiofrequency
electromagnetic radiation) emitowane głównie przez
telefony komórkowe. Istnieje wiele doniesień wskazujących
na obniżenie parametrów badania nasienia, głównie
ruchliwości plemników, oraz wzrost uszkodzeń zarówno
jądrowego, jak i mitochondrialnego DNA, prawdopodobnie
w wyniku stresu oksydacyjnego będącego konsekwencją
ekspozycji na RF -ERM (Agarwal i wsp., 2009;
De Iuliis i wsp., 2009; Mailankot i wsp., 2009). W jednym
z pierwszych badań klinicznych wykazano, że w nasieniu
mężczyzn noszących telefony komórkowe w kieszeni
spodni lub przypięte do paska od spodni występuje obniżenie
koncentracji plemników w porównaniu z mężczyznami,
którzy w ogóle nie nosili telefonu lub trzymali go
w innym miejscu (Kilgallon i Simmons, 2005). W kolejnych
badaniach wykazano, że zarówno okres posiadania telefonu
komórkowego, jak i dzienny, średni czas prowadzonych
rozmów czy transmisji danych powoduje spadek
liczby plemników, odsetka plemników żywych i wykazujących
ruch postępowy oraz wzrost częstości występowania
plemników o nieprawidłowej budowie (Agarwal
i wsp., 2008; Fejes i wsp., 2005; Gorpinchenko i wsp., 2014;
Wdowiak i wsp., 2007). Ostatnio przeprowadzona metaanaliza
10 publikacji dotyczących badań (in vivo i in vitro)
nad wpływem RF -ERM na plemniki i męską płodność
wskazuje, że telefony komórkowe wpływają ujemnie
na jakość nasienia (Adams i wsp., 2014).
Ftalany, stosowane powszechnie jako środki zmiękczające
(tzw. plastyfi katory) w przemyśle chemicznym
i w produkcji tworzyw sztucznych, także są czynnikiem
wywołującym stres oksydacyjny na poziomie jądra, prowadząc
do zaburzenia procesu spermatogenezy, zwiększenia
częstości uszkodzeń DNA komórek płciowych,
a w konsekwencji obniżenia jakości nasienia (Duty i wsp.,
2003a; Duty i wsp., 2003b; Hauser i wsp., 2007; Jurewicz
i wsp., 2013; Kasahara i wsp., 2002). Udokumentowano
także uszkodzenia oksydacyjne plemników wywołane
przez pestycydy oraz metale ciężkie – głównie kadm,
ołów (Chitra i wsp., 2001; Hsu i Guo, 2002; Sujatha i wsp.,
2001; Taha i wsp., 2013; Xu i wsp., 2003).
Podawanie cyklofosfamidu, leku cytostatycznego,
powoduje spadek poziomu katalazy (Sanocka i wsp.,
1997; Zini i wsp., 2000) oraz wzrost poziomu dialdehydu
malonowego (MDA, ang. malondialdehyde), wskazując
na peroksydacyjne uszkodzenie lipidów błon komórkowych
(Das i wsp., 2002; Ghosh i wsp., 2002). Z kolei używanie
tak powszechnych leków jak aspiryna czy paracetamol
powoduje zwiększenie aktywności cytochromu
P450, skutkujące wzrostem produkcji wolnych rodników
(Agarwal i Said, 2005). Zwiększenie wytwarzania RFT
może wystąpić także in vitro podczas procedur przygotowywania
plemników do technik wspomaganego
rozrodu, przede wszystkim w wyniku oczyszczania plemników
z plazmy nasienia, tym samym pozbawiania ich
naturalnego środowiska antyoksydacyjnego (Tremellen,
2008). Oprócz tego wirowanie, krioprezerwacja i późniejsze
rozmrażanie plemników oraz niska zawartość
antyoksydantów w mediach zabezpieczających plemniki
mogą generować w nich stres oksydacyjny (Agarwal i wsp.,
2006; Olszewska -Słonina, 2013; Sikka, 2004; Walczak -
-Jędrzejowska i wsp., 2013; Watson, 2000).
Nadmiar wytwarzania RFT spowodowany jest także
zakażeniami i stanami zapalnymi w męskim układzie
płciowym. Zakażenie patogenami wywołuje naturalne
mechanizmy obronne, tzw. „wybuch tlenowy”, czyli nagłe
uwolnienie dużych ilości RFT przez leukocyty i makrofagi
– głównie anionorodnika ponadtlenkowego i nadtlenku
wodoru (Frączek i Kurpisz, 2007; Kovalski i wsp.,
1992; Roos, 1991). U pacjentów z pozytywnym wynikiem
posiewu nasienia na bakterie tlenowe wykazano znaczny
wzrost poziomu anionorodnika ponadtlenkowego
w porównaniu z pacjentami zdrowymi (Mazzilli i wsp.,
1994). W modelu in vitro stanu zapalnego w nasieniu
wykazano, że szczepy takich bakterii jak Escherichia coli,
Staphylococcus haemolyticus i Bacteroides ureolyticus i/lub
obecność leukocytów powodują zaburzenie ruchliwości
plemników oraz peroksydacyjne uszkodzenie ich błony
komórkowej (Frączek i wsp., 2007; Frączek i wsp., 2014).
Także zakażenie chlamydiami czy też infekcje wirusowe
(np. herpes simplex virus) związane są ze wzrostem
uszkodzeń oksydacyjnych plemników (Krause i Bohring,
2003; Krause i wsp., 2003; Segnini i wsp., 2003). Wysoki
poziom uszkodzeń oksydacyjnych plemników został
także potwierdzony u mężczyzn ze zwiększoną skłonnością
do zakażeń układu moczowo -płciowego z powodu
np. paraliżu kończyn dolnych (Brackett i wsp., 2008).
Z kolei w przebiegu przewlekłego, niebakteryjnego zapalenia
prostaty obserwuje się wzrost poziomu prozapalnych
cytokin i aktywację produkcji RFT (Batstone i wsp.,
2002; Motrich i wsp., 2005). Sanocka i wsp. (2003) wykazali,
że prozapalne cytokiny takie jak interleukina 1β
(IL -1β, ang. interleukin 1β), interleukina 6 i 8 (IL -6, IL -8)
i czynnik martwicy nowotworów α (TNF -α, ang. tumor
necrosis factor α) mogą modulować aktywność pro - i antyoksydacyjną
w przebiegu zapalenia dróg wyprowadzających
nasienie. Wyniki badań in vitro sugerują, że podczas
procesu zapalnego cytokiny wzmagają poziom stresu
oksydacyjnego generowanego przez leukocyty, co może
mieć poważne konsekwencje dla integralności błony
komórkowej plemnika (Frączek i wsp., 2008). Wzrost
ilości leukocytów, prozapalnych cytokin i produkcji RFT
w nasieniu był obserwowany np. po operacji rekonstrukcyjnej
dróg wyprowadzających nasienie po wazektomii
(Kolettis i wsp., 1999; Shapiro i wsp., 1998). Wykazano
także, że u pacjentów z żylakami powrózków nasiennych
istnieje ścisły związek między wzrostem poziomu
RFT i uszkodzeniami DNA plemników (Smith i wsp.,
2006). Dodatkowo wzrost poziomu RFT w nasieniu
i uszkodzeń DNA plemników zaobserwowano także
przy skręcie jąder czy wnętrostwie, przy czym w tym
ostatnim przypadku nieprawidłowości te utrzymywały
się nawet po operacyjnym sprowadzeniu jąder do moszny
(Filho i wsp., 2004; Smith i wsp., 2007).
Niskie tzw. fi zjologiczne poziomy RFT w nasieniu,
których produkcja znajduje się pod stałą kontrolą występujących
tam systemów antyoksydacyjnych, odgrywają
istotną rolę w prawidłowej czynności plemnika, biorąc
udział w kluczowych procesach gwarantujących zapłodnienie
(tj. kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika, fuzja plemnika z oocytem). Jednakże,
jakiekolwiek zaburzenie istniejącej równowagi oksydoredukcyjnej
skutkuje wystąpieniem stresu oksydacyjnego.
W ciągu ostatnich 25 lat pojawiło się wiele prac
doświadczalnych i klinicznych na temat patofi zjologii
stresu oksydacyjnego i jego wpływu na męską płodność.
Nie ma obecnie wątpliwości, że stres oksydacyjny zaburza
czynność plemników, ograniczając tym samym szansę
na uzyskanie zapłodnienia komórki jajowej i/lub rozwój
zarodka. Istnieje wiele czynników wywołujących stres
oksydacyjny w nasieniu. Wśród nich są czynniki egzogenne
związane np. ze stylem życia (palenie, alkohol,
otyłość, niezdrowa dieta), na które mężczyzna ma wpływ
i poprzez zmianę swojego stylu życia może je w łatwy
sposób wyeliminować. Niestety możliwości zmiany
innych czynników egzogennych, tj. zanieczyszczenie środowiska
czy ekspozycja na ftalany, często pozostają poza
naszym zasięgiem. Z kolei czynniki endogenne związane
m.in. z zaburzeniami układu płciowego czy też stanami
zapalnymi w nim występującymi oraz tzw. niepłodność
idiopatyczna wymagają interwencji medycznej. Chociażby
w tych dwóch ostatnich przypadkach zasadnym wydaje
się pytanie o możliwość wspomagania leczenia niepłodności
męskiej, u podłoża której leży stres oksydacyjny,
substancjami o udokumentowanym działaniu antyoksydacyjnym.
wymienić należy palenie papierosów. Toksyny z dymu
papierosowego przedostają się do układu płciowego
i reagują ze składnikami plazmy nasienia (Kulikauskas
i wsp., 1985; Pacifi ci i wsp., 1993; Sepaniak i wsp., 2004;
Trummer i wsp., 2002). Wykazano, że u palaczy występuje
wzrost poziomu RFT, liczby leukocytów oraz komórek
okrągłych w nasieniu, obniżenie ruchliwości i żywotności
plemników i wzrost nasilenia fragmentacji DNA
(Ochędalski i wsp., 1994; Pacifi ci i wsp., 1993; Saleh i wsp.,
2002; Sepaniak i wsp., 2004; Taha i wsp., 2012). Dodatkowo
w nasieniu palaczy obniżony jest poziom takich antyoksydantów
jak witamina E, C oraz cynk, co wzmaga ryzyko
uszkodzeń oksydacyjnych plemników (Fraga i wsp., 1996;
Mostafa i wsp., 2006; Taha i wsp., 2012).
Kolejnym czynnikiem zwiększającym poziom RFT
jest konsumpcja alkoholu. Ponadto wykazano, że nadużywanie
alkoholu często związane jest z niedożywieniem
i dietą ubogą w antyoksydanty (Koch i wsp.,
2004). Z kolei nieprawidłowa dieta, bogata w tłuszcze
i węglowodany oraz siedzący tryb życia mogą prowadzić
do otyłości. Nagromadzenie tkanki tłuszczowej
może powodować uwalnianie z niej cytokin prozapalnych
i wzrost wytwarzania RFT w leukocytach.
Dodatkowo, otyłość doprowadza także do przegrzewania
jąder w wyniku nagromadzenia tkanki tłuszczowej
w regionie pachwin (Khullar i wsp., 2012; Palmer
i wsp., 2012; Singer i Granger, 2007). Z drugiej strony
zbyt intensywne ćwiczenia fi zyczne powodują wzrost
RFT w wyniku zwiększonego metabolizmu tlenowego
w mięśniach (Peake i wsp., 2007). Hipoteza stresu oksydacyjnego
związanego ze starzeniem się organizmu jest
jedną z najbardziej popularnych hipotez wyjaśniających
molekularne podstawy tego procesu (Olinski i wsp., 2007).
Siomek i wsp. (2007) zaobserwowali np. dodatnią korelacje
występującą między wiekiem a poziomem markerów
oksydacyjnego uszkodzenia DNA badanych w leukocytach
krwi obwodowej, a także zależny od wieku spadek
poziomu witaminy C we krwi. Dodatkowo, wykazano
istnienie bezpośredniego związku między ogólnoustrojowym
stresem oksydacyjnym występującym w procesie
starzenia się organizmu a wzrostem uszkodzeń DNA
w plemnikach zarówno u mężczyzn płodnych, jak i niepłodnych
(Junqueira i wsp., 2004). Udokumentowano
także wzrost zaburzeń genetycznych u dzieci starszych
ojców, w wyniku pogarszania się jakości DNA plemników,
czego podłożem może być właśnie zwiększona produkcja
RFT, a zarazem obniżona zdolność antyoksydacyjna
organizmu (Crosnoe i Kim, 2013; Paul i Robaire, 2013).
Jednakże, o ile z jednej strony ogólnoustrojowy stres
oksydacyjny, związany np. ze starzeniem się organizmu,
może wpływać na uszkodzenia DNA w plemnikach,
to z drugiej strony Guz i wsp. (2013) nie znaleźli związku
między istniejącym stresem oksydacyjnym w nasieniu
niepłodnych mężczyzn a tym badanym w leukocytach
krwi obwodowej (tzn. ogólnoustrojowym), co sugeruje,
że stan oksydoredukcyjny nasienia może występować
niezależnie od tego w innych tkankach.
Kolejny czynnik środowiskowy związany ze stylem
życia, którego wpływ na męską płodność jest ostatnio
intensywnie badany, to promieniowanie elektromagnetyczne
o częstotliwości radiowej (RF -ERM, ang. radiofrequency
electromagnetic radiation) emitowane głównie przez
telefony komórkowe. Istnieje wiele doniesień wskazujących
na obniżenie parametrów badania nasienia, głównie
ruchliwości plemników, oraz wzrost uszkodzeń zarówno
jądrowego, jak i mitochondrialnego DNA, prawdopodobnie
w wyniku stresu oksydacyjnego będącego konsekwencją
ekspozycji na RF -ERM (Agarwal i wsp., 2009;
De Iuliis i wsp., 2009; Mailankot i wsp., 2009). W jednym
z pierwszych badań klinicznych wykazano, że w nasieniu
mężczyzn noszących telefony komórkowe w kieszeni
spodni lub przypięte do paska od spodni występuje obniżenie
koncentracji plemników w porównaniu z mężczyznami,
którzy w ogóle nie nosili telefonu lub trzymali go
w innym miejscu (Kilgallon i Simmons, 2005). W kolejnych
badaniach wykazano, że zarówno okres posiadania telefonu
komórkowego, jak i dzienny, średni czas prowadzonych
rozmów czy transmisji danych powoduje spadek
liczby plemników, odsetka plemników żywych i wykazujących
ruch postępowy oraz wzrost częstości występowania
plemników o nieprawidłowej budowie (Agarwal
i wsp., 2008; Fejes i wsp., 2005; Gorpinchenko i wsp., 2014;
Wdowiak i wsp., 2007). Ostatnio przeprowadzona metaanaliza
10 publikacji dotyczących badań (in vivo i in vitro)
nad wpływem RF -ERM na plemniki i męską płodność
wskazuje, że telefony komórkowe wpływają ujemnie
na jakość nasienia (Adams i wsp., 2014).
Ftalany, stosowane powszechnie jako środki zmiękczające
(tzw. plastyfi katory) w przemyśle chemicznym
i w produkcji tworzyw sztucznych, także są czynnikiem
wywołującym stres oksydacyjny na poziomie jądra, prowadząc
do zaburzenia procesu spermatogenezy, zwiększenia
częstości uszkodzeń DNA komórek płciowych,
a w konsekwencji obniżenia jakości nasienia (Duty i wsp.,
2003a; Duty i wsp., 2003b; Hauser i wsp., 2007; Jurewicz
i wsp., 2013; Kasahara i wsp., 2002). Udokumentowano
także uszkodzenia oksydacyjne plemników wywołane
przez pestycydy oraz metale ciężkie – głównie kadm,
ołów (Chitra i wsp., 2001; Hsu i Guo, 2002; Sujatha i wsp.,
2001; Taha i wsp., 2013; Xu i wsp., 2003).
Podawanie cyklofosfamidu, leku cytostatycznego,
powoduje spadek poziomu katalazy (Sanocka i wsp.,
1997; Zini i wsp., 2000) oraz wzrost poziomu dialdehydu
malonowego (MDA, ang. malondialdehyde), wskazując
na peroksydacyjne uszkodzenie lipidów błon komórkowych
(Das i wsp., 2002; Ghosh i wsp., 2002). Z kolei używanie
tak powszechnych leków jak aspiryna czy paracetamol
powoduje zwiększenie aktywności cytochromu
P450, skutkujące wzrostem produkcji wolnych rodników
(Agarwal i Said, 2005). Zwiększenie wytwarzania RFT
może wystąpić także in vitro podczas procedur przygotowywania
plemników do technik wspomaganego
rozrodu, przede wszystkim w wyniku oczyszczania plemników
z plazmy nasienia, tym samym pozbawiania ich
naturalnego środowiska antyoksydacyjnego (Tremellen,
2008). Oprócz tego wirowanie, krioprezerwacja i późniejsze
rozmrażanie plemników oraz niska zawartość
antyoksydantów w mediach zabezpieczających plemniki
mogą generować w nich stres oksydacyjny (Agarwal i wsp.,
2006; Olszewska -Słonina, 2013; Sikka, 2004; Walczak -
-Jędrzejowska i wsp., 2013; Watson, 2000).
Nadmiar wytwarzania RFT spowodowany jest także
zakażeniami i stanami zapalnymi w męskim układzie
płciowym. Zakażenie patogenami wywołuje naturalne
mechanizmy obronne, tzw. „wybuch tlenowy”, czyli nagłe
uwolnienie dużych ilości RFT przez leukocyty i makrofagi
– głównie anionorodnika ponadtlenkowego i nadtlenku
wodoru (Frączek i Kurpisz, 2007; Kovalski i wsp.,
1992; Roos, 1991). U pacjentów z pozytywnym wynikiem
posiewu nasienia na bakterie tlenowe wykazano znaczny
wzrost poziomu anionorodnika ponadtlenkowego
w porównaniu z pacjentami zdrowymi (Mazzilli i wsp.,
1994). W modelu in vitro stanu zapalnego w nasieniu
wykazano, że szczepy takich bakterii jak Escherichia coli,
Staphylococcus haemolyticus i Bacteroides ureolyticus i/lub
obecność leukocytów powodują zaburzenie ruchliwości
plemników oraz peroksydacyjne uszkodzenie ich błony
komórkowej (Frączek i wsp., 2007; Frączek i wsp., 2014).
Także zakażenie chlamydiami czy też infekcje wirusowe
(np. herpes simplex virus) związane są ze wzrostem
uszkodzeń oksydacyjnych plemników (Krause i Bohring,
2003; Krause i wsp., 2003; Segnini i wsp., 2003). Wysoki
poziom uszkodzeń oksydacyjnych plemników został
także potwierdzony u mężczyzn ze zwiększoną skłonnością
do zakażeń układu moczowo -płciowego z powodu
np. paraliżu kończyn dolnych (Brackett i wsp., 2008).
Z kolei w przebiegu przewlekłego, niebakteryjnego zapalenia
prostaty obserwuje się wzrost poziomu prozapalnych
cytokin i aktywację produkcji RFT (Batstone i wsp.,
2002; Motrich i wsp., 2005). Sanocka i wsp. (2003) wykazali,
że prozapalne cytokiny takie jak interleukina 1β
(IL -1β, ang. interleukin 1β), interleukina 6 i 8 (IL -6, IL -8)
i czynnik martwicy nowotworów α (TNF -α, ang. tumor
necrosis factor α) mogą modulować aktywność pro - i antyoksydacyjną
w przebiegu zapalenia dróg wyprowadzających
nasienie. Wyniki badań in vitro sugerują, że podczas
procesu zapalnego cytokiny wzmagają poziom stresu
oksydacyjnego generowanego przez leukocyty, co może
mieć poważne konsekwencje dla integralności błony
komórkowej plemnika (Frączek i wsp., 2008). Wzrost
ilości leukocytów, prozapalnych cytokin i produkcji RFT
w nasieniu był obserwowany np. po operacji rekonstrukcyjnej
dróg wyprowadzających nasienie po wazektomii
(Kolettis i wsp., 1999; Shapiro i wsp., 1998). Wykazano
także, że u pacjentów z żylakami powrózków nasiennych
istnieje ścisły związek między wzrostem poziomu
RFT i uszkodzeniami DNA plemników (Smith i wsp.,
2006). Dodatkowo wzrost poziomu RFT w nasieniu
i uszkodzeń DNA plemników zaobserwowano także
przy skręcie jąder czy wnętrostwie, przy czym w tym
ostatnim przypadku nieprawidłowości te utrzymywały
się nawet po operacyjnym sprowadzeniu jąder do moszny
(Filho i wsp., 2004; Smith i wsp., 2007).
Niskie tzw. fi zjologiczne poziomy RFT w nasieniu,
których produkcja znajduje się pod stałą kontrolą występujących
tam systemów antyoksydacyjnych, odgrywają
istotną rolę w prawidłowej czynności plemnika, biorąc
udział w kluczowych procesach gwarantujących zapłodnienie
(tj. kapacytacja, hiperaktywacja, reakcja akrosomalna
plemnika, fuzja plemnika z oocytem). Jednakże,
jakiekolwiek zaburzenie istniejącej równowagi oksydoredukcyjnej
skutkuje wystąpieniem stresu oksydacyjnego.
W ciągu ostatnich 25 lat pojawiło się wiele prac
doświadczalnych i klinicznych na temat patofi zjologii
stresu oksydacyjnego i jego wpływu na męską płodność.
Nie ma obecnie wątpliwości, że stres oksydacyjny zaburza
czynność plemników, ograniczając tym samym szansę
na uzyskanie zapłodnienia komórki jajowej i/lub rozwój
zarodka. Istnieje wiele czynników wywołujących stres
oksydacyjny w nasieniu. Wśród nich są czynniki egzogenne
związane np. ze stylem życia (palenie, alkohol,
otyłość, niezdrowa dieta), na które mężczyzna ma wpływ
i poprzez zmianę swojego stylu życia może je w łatwy
sposób wyeliminować. Niestety możliwości zmiany
innych czynników egzogennych, tj. zanieczyszczenie środowiska
czy ekspozycja na ftalany, często pozostają poza
naszym zasięgiem. Z kolei czynniki endogenne związane
m.in. z zaburzeniami układu płciowego czy też stanami
zapalnymi w nim występującymi oraz tzw. niepłodność
idiopatyczna wymagają interwencji medycznej. Chociażby
w tych dwóch ostatnich przypadkach zasadnym wydaje
się pytanie o możliwość wspomagania leczenia niepłodności
męskiej, u podłoża której leży stres oksydacyjny,
substancjami o udokumentowanym działaniu antyoksydacyjnym.










 Brak ćwiczeń ruchowych negatywnie wpływa
na męski potencjał rozrodczy, jednakże zbyt intensywne
treningi mogą doprowadzić do zaburzeń hormonalnych
i zaburzeń równowagi oksydacyjnej, pogarszając jakość
nasienia. Również urazy jąder, zdarzające się najczęściej
w grupie rowerzystów i jeźdźców konnych, są problemem
klinicznym, na który należy zwrócić uwagę.
Rozwój sportów wyczynowych, coraz większa popularność
aktywności fi zycznej, zauważalna chociażby
w statystykach maratonów czy triatlonów, to z pewnością
zjawisko pozytywne. Należy jednak uwzględnić wpływ
zaawansowanych treningów na zdrowie reprodukcyjne
mężczyzn. Poprawa edukacji w zakresie możliwych powikłań,
korzystanie z ergonomicznych siodełek w trakcie
jazdy na rowerze oraz lepsza protekcja jąder podczas
uprawiania sportów jest niezbędna. Być może rozwiązaniem
byłoby też przesiewowe badanie ultrasonografi
czne wśród mężczyzn wyczynowo uprawiających sport,
a przede wszystkim badanie palpacyjne jąder. Jest ono
tanie, łatwo dostępne, a często pozwala wykryć patologiczne
zmiany. Problem niepłodności męskiej powinien
być obszarem zainteresowania nie tylko andrologów, ale
też urologów, endokrynologów oraz lekarzy medycyny
sportowej.
Piśmiennictwo
Andersen K.V., Bovim G.: Impotence and nerve entrapment in long distance
amateur cyclists. Acta Neurol Scand. 1997, 95, 233–240.
Brak ćwiczeń ruchowych negatywnie wpływa
na męski potencjał rozrodczy, jednakże zbyt intensywne
treningi mogą doprowadzić do zaburzeń hormonalnych
i zaburzeń równowagi oksydacyjnej, pogarszając jakość
nasienia. Również urazy jąder, zdarzające się najczęściej
w grupie rowerzystów i jeźdźców konnych, są problemem
klinicznym, na który należy zwrócić uwagę.
Rozwój sportów wyczynowych, coraz większa popularność
aktywności fi zycznej, zauważalna chociażby
w statystykach maratonów czy triatlonów, to z pewnością
zjawisko pozytywne. Należy jednak uwzględnić wpływ
zaawansowanych treningów na zdrowie reprodukcyjne
mężczyzn. Poprawa edukacji w zakresie możliwych powikłań,
korzystanie z ergonomicznych siodełek w trakcie
jazdy na rowerze oraz lepsza protekcja jąder podczas
uprawiania sportów jest niezbędna. Być może rozwiązaniem
byłoby też przesiewowe badanie ultrasonografi
czne wśród mężczyzn wyczynowo uprawiających sport,
a przede wszystkim badanie palpacyjne jąder. Jest ono
tanie, łatwo dostępne, a często pozwala wykryć patologiczne
zmiany. Problem niepłodności męskiej powinien
być obszarem zainteresowania nie tylko andrologów, ale
też urologów, endokrynologów oraz lekarzy medycyny
sportowej.
Piśmiennictwo
Andersen K.V., Bovim G.: Impotence and nerve entrapment in long distance
amateur cyclists. Acta Neurol Scand. 1997, 95, 233–240.

 może wchodzić w skład takich wyrobów jak winylowe
może wchodzić w skład takich wyrobów jak winylowe


 Obecność NP stwierdzono w próbach środowiskowych
z różnych krajów. Wyniki opisano szczegółowo
w pracy poglądowej (Careghini i wsp., 2015). Wykazano
obecność NP w glebie w ilości 0,01–0,95 μg/kg suchej
masy, w osadach dennych od 3,6 μg/kg do 72 mg/kg
suchej masy. Stężenie NP w wodach gruntowych wynosiło
0,001–3,85 mg/m³, a w wodach powierzchniowych
od 3×10−⁴ do 37,3 mg/m³ (Careghini i wsp., 2015).
W wodach ściekowych stężenie tego związku wynosiło
0,05 μg/dm³, a w ściekach poprzemysłowych w USA
0,1–253 μg/dm3 (Diaz i Ventura, 2002; Kuch i Ballshmiter,
2000; Lee i wsp., 2000).
Narażenie ludzi na NP związane jest głównie z jego
migracją z rur plastikowych do wody wodociągowej
oraz do żywności z pojemników używanych podczas
jej produkcji i przechowywania (Soto i wsp., 1991). Woda
przechowywana w pojemnikach z PCW może zawierać
300 ng/L nonylofenolu (Guenther i wsp., 2002; Soto i wsp.,
1991), a w plastikowych butelkach 15–300 μg/m³ (Loyo-
-Rosales i wsp., 2004). Znaczne stężenie NP stwierdzono
w produktach spożywczych (0,1–100 μg/kg świeżej masy)
oraz w napojach (< 7,7 μg/m³ do 0,30 mg/m³) z rożnych
krajów Europy. Najwyższe stężenie tego związku
wykazano w marchwi (10,4 μg/kg świeżej masy), dyni
(11,3 μg/kg świeżej masy), jabłkach (17,1 μg/kg świeżej masy) oraz w owocach cytrusowych (29,5 μg/kg świeżej
masy) (Careghini i wsp., 2015). Dzienna dawka NP przyjmowana
przez człowieka szacowana jest na 0,6 μg/kg
(EC Report, 2002), 0,67–0,370 μg/kg może pochodzić
z żywności (Careghini i wsp., 2015), a 0,36–060 μg/kg
z wody butelkowanej (Loyo -Rosales i wsp., 2004). Obecność
NP stwierdzono także w płynach ciała człowieka. Związek
ten obecny był m.in. we krwi matek (4,5–33,4 ng/mL)
we krwi pępowinowej (4,4–57,6 ng/mL), w łożysku
(5,4–54,4 ng/g), a także w mleku ludzkim od < 1,87
do 160,1 ng/mL w 1 miesiącu oraz 27,2–104,8 ng/mL
w 3. miesiącu po porodzie (Huang i wsp., 2014).
Nonylofenol powoduje zaburzenia w funkcjonowaniu
męskiego układu rozrodczego ryb, gadów i ssaków
(Cardinali i wsp., 2004; Lee, 1998; Weber i wsp., 2002).
Działa toksycznie na gonady męskie, powodując zmniejszenie
ciężaru jąder i najądrzy, co często jest związane
ze zmniejszoną produkcją komórek płciowych (Aly i wsp.,
2012; Chitra i wsp., 2002; Dobrzyńska, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004). Nonylofenol redukuje
żywotność i liczebność gamet męskich różnych gatunków
ssaków (Aly i wsp., 2012; Chapin i wsp., 1999; de Jager
i wsp., 1999a; Dobrzyńska, 2011, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004; Kimura i wsp., 2006;
Tiwari i Vanage, 2013). Równocześnie ze zmniejszoną
liczebnością plemników obserwowano także pogorszenie
jakości gamet, m.in. zmniejszenie ich ruchliwości
i zwiększenie częstości występowania plemników o nieprawidłowej
morfologii (Chapin i wsp., 1999; de Jager
i wsp., 1999b; Dobrzyńska, 2011, 2012; Tiwari i Vanage,
2013; Zhang i wsp., 2003). Badania Han i wsp. (2004)
wykazały, że NP uszkadza akrosomy plemników mysich.
Inne badania wykazały opóźnienie reakcji akrosomalnej
plemników mysich in vitro (Shao i wsp., 2011). Wyniki
kolejnych badań wskazują, że obecność NP zaburza równowagę
pomiędzy utleniaczami i przeciwutleniaczami,
powodując stres oksydacyjny w nasieniu szczurów (Aly
i wsp., 2012; Chitra i wsp., 2002). Stres oksydacyjny może
być odpowiedzialny za wystąpienie niekorzystnych zmian
w gametach (Chitra i Mathur, 2004; El -Dakdoky i Helal,
2007; Gong i Han 2006). Nonylofenol indukuje apoptozę
w męskich komórkach płciowych oraz w komórkach
Sertoliego (Chitra i wsp., 2002; Gong i Han, 2006).
Indukuje również pękanie nici DNA w haploidalnych
komórkach płciowych myszy (Dobrzyńska, 2011). Z kolei
u szczurów NP wpływa na zmniejszoną produkcje testosteronu
(Laurenzana i wsp., 2002; Ying i wsp., 2012).
Narażanie niedojrzałych płciowo szczurów laboratoryjnych
przez 30 dni na NP w dawce 100 mg/kg dziennie
powoduje opóźnienie w osiągania przez nie dojrzałości
płciowej, zaburzenia w funkcjonowaniu jąder i w procesie
spermatogenezy, prowadzące do zmniejszonej produkcji
gamet oraz indukuje zmiany histopatologiczne w jądrach
(Tan i wsp., 2003). Podobnie w przypadku podawania
młodym zwierzętom NP w niższych dawkach przez
2 tygodnie notowano zmniejszenie liczebności gamet
(Herath i wsp., 2004). W badaniach in vitro obserwowano
zwiększoną częstość występowania apoptozy w komórkach
Sertoliego po 72 -godzinnej hodowli w obecności
NP (Wang i wsp., 2003) oraz zmniejszenie produkcji testosteronu
(Murano i wsp., 1999; Wu i wsp., 2010). W próbach
nasienia pobranych od szczurów po 1–4 -godzinnej inkubacji
w obecności NP stwierdzono zmniejszenie ruchliwości
gamet oraz integralności akrosomalnej (Uguz i wsp.,
2009).
Nonylofenol podawany w czasie ciąży i laktacji
wpływa na stan zdrowia potomstwa ze szczególnym
uwzględnieniem występowania zmian w męskim układzie
rozrodczym. Narażanie ciężarnych samic szczura
na NP w dawkach 80–200 mg/kg/dzień powoduje
znaczne zmniejszenie liczby żywych płodów w miotach.
U potomstwa w wieku 90 dni obserwowano zmniejszenie
ciężaru jąder i prostaty, stężenia testosteronu w osoczu
krwi i nasienia w najądrzach oraz zmiany histopatologiczne
w jądrach. Ponadto stwierdzono zahamowanie
procesów spermatogenezy i spermiogenezy (Jie i wsp.,
2010). Zaburzenia przebiegu spermatogenezy w następstwie
narażania potomstwa za pośrednictwem ciężarnych
i karmiących matek oraz młodych od urodzenia
do 30. dnia życia obserwowali McClusky i wsp. (2007).
U potomstwa myszy narażanych na NP od 5. do 20. dnia
ciąży obserwowano większą śmiertelność okołoporodową
płodów płci męskiej oraz zmniejszenie ciężaru ich jąder
i najądrzy (Kimura i wsp., 2006). Podawanie samicom
szczura NP w dawkach 15–17 mg/kg przez 8 dni ciąży
wpływa na zmniejszenie ciężaru najądrzy u męskiego
potomstwa (Hossaini i wsp., 2001).
Prekoncepcyjne narażanie samców myszy pokolenia
F0 na NP w dawce 50 mg/kg/dzień przez 8 tygodni skutkuje
znacznym zmniejszeniem częstości zachodzenia
w ciążę przez kojarzone z nimi samice, co może być
spowodowane nieprawidłowościami w budowie plemników
oraz zwiększoną częstością pęknięć nici DNA
w haploidalnyych komórkach płciowych (Dobrzyńska,
2012). Z kolei w doświadczeniach obejmujących narażenie
na NP 3 pokoleń szczurów, wykazano zmniejszenie
liczebności gamet w pokoleniu F2, chociaż nie notowano
takiego efektu w pokoleniach F0 i F1 (Chapin i wsp.,
1999). Z kolei, Kyselova i wsp. (2003) wykazali redukcję
ciężaru narządów płciowych, zarówno w pokoleniu F0,
jak i F1 oraz zmniejszenie wielkości miotów w pokoleniu
F2. Ponadto, badania in vitro wykazały znaczną wrażliwość
nasienia ludzkiego na działanie nonylfenolu, który
indukował fragmentację nici DNA już po zastosowaniu
w dawce 1 μmol/L (Anderson i wsp., 1997).
Obecność NP stwierdzono w próbach środowiskowych
z różnych krajów. Wyniki opisano szczegółowo
w pracy poglądowej (Careghini i wsp., 2015). Wykazano
obecność NP w glebie w ilości 0,01–0,95 μg/kg suchej
masy, w osadach dennych od 3,6 μg/kg do 72 mg/kg
suchej masy. Stężenie NP w wodach gruntowych wynosiło
0,001–3,85 mg/m³, a w wodach powierzchniowych
od 3×10−⁴ do 37,3 mg/m³ (Careghini i wsp., 2015).
W wodach ściekowych stężenie tego związku wynosiło
0,05 μg/dm³, a w ściekach poprzemysłowych w USA
0,1–253 μg/dm3 (Diaz i Ventura, 2002; Kuch i Ballshmiter,
2000; Lee i wsp., 2000).
Narażenie ludzi na NP związane jest głównie z jego
migracją z rur plastikowych do wody wodociągowej
oraz do żywności z pojemników używanych podczas
jej produkcji i przechowywania (Soto i wsp., 1991). Woda
przechowywana w pojemnikach z PCW może zawierać
300 ng/L nonylofenolu (Guenther i wsp., 2002; Soto i wsp.,
1991), a w plastikowych butelkach 15–300 μg/m³ (Loyo-
-Rosales i wsp., 2004). Znaczne stężenie NP stwierdzono
w produktach spożywczych (0,1–100 μg/kg świeżej masy)
oraz w napojach (< 7,7 μg/m³ do 0,30 mg/m³) z rożnych
krajów Europy. Najwyższe stężenie tego związku
wykazano w marchwi (10,4 μg/kg świeżej masy), dyni
(11,3 μg/kg świeżej masy), jabłkach (17,1 μg/kg świeżej masy) oraz w owocach cytrusowych (29,5 μg/kg świeżej
masy) (Careghini i wsp., 2015). Dzienna dawka NP przyjmowana
przez człowieka szacowana jest na 0,6 μg/kg
(EC Report, 2002), 0,67–0,370 μg/kg może pochodzić
z żywności (Careghini i wsp., 2015), a 0,36–060 μg/kg
z wody butelkowanej (Loyo -Rosales i wsp., 2004). Obecność
NP stwierdzono także w płynach ciała człowieka. Związek
ten obecny był m.in. we krwi matek (4,5–33,4 ng/mL)
we krwi pępowinowej (4,4–57,6 ng/mL), w łożysku
(5,4–54,4 ng/g), a także w mleku ludzkim od < 1,87
do 160,1 ng/mL w 1 miesiącu oraz 27,2–104,8 ng/mL
w 3. miesiącu po porodzie (Huang i wsp., 2014).
Nonylofenol powoduje zaburzenia w funkcjonowaniu
męskiego układu rozrodczego ryb, gadów i ssaków
(Cardinali i wsp., 2004; Lee, 1998; Weber i wsp., 2002).
Działa toksycznie na gonady męskie, powodując zmniejszenie
ciężaru jąder i najądrzy, co często jest związane
ze zmniejszoną produkcją komórek płciowych (Aly i wsp.,
2012; Chitra i wsp., 2002; Dobrzyńska, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004). Nonylofenol redukuje
żywotność i liczebność gamet męskich różnych gatunków
ssaków (Aly i wsp., 2012; Chapin i wsp., 1999; de Jager
i wsp., 1999a; Dobrzyńska, 2011, 2012; El -Dakdoky
i Helal, 2007; Han i wsp., 2004; Kimura i wsp., 2006;
Tiwari i Vanage, 2013). Równocześnie ze zmniejszoną
liczebnością plemników obserwowano także pogorszenie
jakości gamet, m.in. zmniejszenie ich ruchliwości
i zwiększenie częstości występowania plemników o nieprawidłowej
morfologii (Chapin i wsp., 1999; de Jager
i wsp., 1999b; Dobrzyńska, 2011, 2012; Tiwari i Vanage,
2013; Zhang i wsp., 2003). Badania Han i wsp. (2004)
wykazały, że NP uszkadza akrosomy plemników mysich.
Inne badania wykazały opóźnienie reakcji akrosomalnej
plemników mysich in vitro (Shao i wsp., 2011). Wyniki
kolejnych badań wskazują, że obecność NP zaburza równowagę
pomiędzy utleniaczami i przeciwutleniaczami,
powodując stres oksydacyjny w nasieniu szczurów (Aly
i wsp., 2012; Chitra i wsp., 2002). Stres oksydacyjny może
być odpowiedzialny za wystąpienie niekorzystnych zmian
w gametach (Chitra i Mathur, 2004; El -Dakdoky i Helal,
2007; Gong i Han 2006). Nonylofenol indukuje apoptozę
w męskich komórkach płciowych oraz w komórkach
Sertoliego (Chitra i wsp., 2002; Gong i Han, 2006).
Indukuje również pękanie nici DNA w haploidalnych
komórkach płciowych myszy (Dobrzyńska, 2011). Z kolei
u szczurów NP wpływa na zmniejszoną produkcje testosteronu
(Laurenzana i wsp., 2002; Ying i wsp., 2012).
Narażanie niedojrzałych płciowo szczurów laboratoryjnych
przez 30 dni na NP w dawce 100 mg/kg dziennie
powoduje opóźnienie w osiągania przez nie dojrzałości
płciowej, zaburzenia w funkcjonowaniu jąder i w procesie
spermatogenezy, prowadzące do zmniejszonej produkcji
gamet oraz indukuje zmiany histopatologiczne w jądrach
(Tan i wsp., 2003). Podobnie w przypadku podawania
młodym zwierzętom NP w niższych dawkach przez
2 tygodnie notowano zmniejszenie liczebności gamet
(Herath i wsp., 2004). W badaniach in vitro obserwowano
zwiększoną częstość występowania apoptozy w komórkach
Sertoliego po 72 -godzinnej hodowli w obecności
NP (Wang i wsp., 2003) oraz zmniejszenie produkcji testosteronu
(Murano i wsp., 1999; Wu i wsp., 2010). W próbach
nasienia pobranych od szczurów po 1–4 -godzinnej inkubacji
w obecności NP stwierdzono zmniejszenie ruchliwości
gamet oraz integralności akrosomalnej (Uguz i wsp.,
2009).
Nonylofenol podawany w czasie ciąży i laktacji
wpływa na stan zdrowia potomstwa ze szczególnym
uwzględnieniem występowania zmian w męskim układzie
rozrodczym. Narażanie ciężarnych samic szczura
na NP w dawkach 80–200 mg/kg/dzień powoduje
znaczne zmniejszenie liczby żywych płodów w miotach.
U potomstwa w wieku 90 dni obserwowano zmniejszenie
ciężaru jąder i prostaty, stężenia testosteronu w osoczu
krwi i nasienia w najądrzach oraz zmiany histopatologiczne
w jądrach. Ponadto stwierdzono zahamowanie
procesów spermatogenezy i spermiogenezy (Jie i wsp.,
2010). Zaburzenia przebiegu spermatogenezy w następstwie
narażania potomstwa za pośrednictwem ciężarnych
i karmiących matek oraz młodych od urodzenia
do 30. dnia życia obserwowali McClusky i wsp. (2007).
U potomstwa myszy narażanych na NP od 5. do 20. dnia
ciąży obserwowano większą śmiertelność okołoporodową
płodów płci męskiej oraz zmniejszenie ciężaru ich jąder
i najądrzy (Kimura i wsp., 2006). Podawanie samicom
szczura NP w dawkach 15–17 mg/kg przez 8 dni ciąży
wpływa na zmniejszenie ciężaru najądrzy u męskiego
potomstwa (Hossaini i wsp., 2001).
Prekoncepcyjne narażanie samców myszy pokolenia
F0 na NP w dawce 50 mg/kg/dzień przez 8 tygodni skutkuje
znacznym zmniejszeniem częstości zachodzenia
w ciążę przez kojarzone z nimi samice, co może być
spowodowane nieprawidłowościami w budowie plemników
oraz zwiększoną częstością pęknięć nici DNA
w haploidalnyych komórkach płciowych (Dobrzyńska,
2012). Z kolei w doświadczeniach obejmujących narażenie
na NP 3 pokoleń szczurów, wykazano zmniejszenie
liczebności gamet w pokoleniu F2, chociaż nie notowano
takiego efektu w pokoleniach F0 i F1 (Chapin i wsp.,
1999). Z kolei, Kyselova i wsp. (2003) wykazali redukcję
ciężaru narządów płciowych, zarówno w pokoleniu F0,
jak i F1 oraz zmniejszenie wielkości miotów w pokoleniu
F2. Ponadto, badania in vitro wykazały znaczną wrażliwość
nasienia ludzkiego na działanie nonylfenolu, który
indukował fragmentację nici DNA już po zastosowaniu
w dawce 1 μmol/L (Anderson i wsp., 1997). Bisfenol A (dian, 2,2 -bis(p -hydroksyfenylo)propan) jest
białym lub jasnobrązowym proszkiem, słabo rozpuszczalnym
w wodzie. Budowę chemiczna BPA przedstawiono
na rycinie 5. Bisfenol A stosowany jest głównie
do produkcji tworzyw sztucznych; poliestrów (głównie poliwęglanów, które są wykorzystywane m.in. do wytwarzania
butelek dla niemowląt), polieterów, polisulfonów,
żywic epoksydowych (m.in. wyściełających wewnętrzne
powierzchnie puszek). Ponadto stosowany jest jako przeciwutleniacz
w środkach spożywczych i kosmetycznych.
Obecność BPA wykryto w takich produktach jak pojemniki
do przechowywania żywności, wykonane z przezroczystych
plastików butelki do karmienia niemowląt
i do napojów, wewnętrzne powłoki metalowych puszek
do napojów i żywności, cystern do przechowywania
wody, mleka i wina, zabawki, papier termiczny, płyty
kompaktowe, farby, kaski ochronne, części samochodowe,
okna plastikowe, materiały do wypełnień dentystycznych,
soczewki i plastry opatrunkowe (Lyons, 2000;
Markey i wsp., 2003).
Obecność BPA wykryto w środowisku naturalnym,
w glebie w stężeniu 0,55–147 μg/kg suchej masy,
w osadach dennych od <0,24 do 492 μg/kg suchej masy,
w wodach gruntowych 0,001–20 mg/m³, w wodach
powierzchniowych od <0,001 do 92 mg/m³ (Careghini
i wsp., 2015). Stężenie BPA w powietrzu wynosiło
2–208 μg/m³ (Rudel i wsp., 2001).
Bisfenol A dostaje się do organizmu człowieka głównie
drogą pokarmową oraz przez układ oddechowy i skórę.
Może być uwalniany z tworzyw sztucznych, w skład
których wchodzi do żywności, napojów i odżywek dla
niemowląt, szczególnie jeżeli opakowanie jest podgrzewane,
myte detergentem lub poddane zmianom
mechanicznym (gniecenie, rozciąganie). Najbardziej
narażoną grupą są niemowlęta i małe dzieci ze względu
na stosukowo niski ciężar ciała oraz powszechne użycie
butelek, kubeczków, talerzyków, łyżeczek itp. wykonanych
z tworzyw zawierających BPA. Związek ten może
być również wymywany do śliny pacjentów po założeniu
wypełnień dentystycznych (Markey i wsp., 2003;
Tyl i wsp., 2002). Obecność BPA wykazano w żywności
w ilości 4–23 μg/puszka, w napojach 7–58 μg/g, w ślinie
pacjentów stomatologicznych 90–913 μg po 1 godz.
od założenia wypełnienia (Akingbemi i wsp., 2004).
Stężenia BPA w produktach spożywczych pochodzących
z różnych krajów wynosiły 0,1–790 μg/kg suchej
masy, a wodzie do picia i napojach 0,0073–0,86 μg/m³
(Careghini i wsp., 2015). Przykładowo, badania szwedzkie
wykazały obecność BPA w rybach (2,5–29 μg/kg świeżej
masy), mięsie (6,9–13 μg/kg), ziemniakach (2,2 μg/kg),
w produktach mleczarskich (2,4 μg/kg) (Gyllenhammer
i wsp., 2012). Basheer i wsp. (2004) oznaczali stężenie BPA
w owocach morza (13,3–213,1 μg/kg świeżej masy), a Sun
i wsp. (2006) w konserwach (32,8–164,5 μg/kg świeżej
masy). Interesujące jest, że migracja BPA z nowych naczyń
stołowych dla niemowląt wynosiła 1–1,9 μg/kg roztworu,
podczas gdy z wielokrotnie używanych 1,8–7,9 μg/kg
(Lyons, 2000). Z kolei Brede i wsp. (2003) wykazali, że stężenie
BPA w napoju z nowych butelek dla niemowląt
wynosiło 0,2 μg/L, w używanych 51 dni – 8,4 μg/L,
a w używanych 169 dni – 6,7 μg/L. Na podstawie
wyników najowszych badań dzienną dawkę BPA przyjmowaną
przez ludzi oszacowano na 0,02–0,181 μg/kg
dla dorosłych oraz na 0,22–0,33 μg/kg dla niemowląt
(Careghini i wsp., 2015).
Obecność BPA wykryto także w płynach ciała człowieka.
Badania przeprowadzone przez Calafat i wsp.
(2005) wykazały w moczu średnio 1,28 μg/L BPA.
Obecność BPA stwierdzono także w krwi matek, noworodków
i w łożysku w stężeniach odpowiednio 3,1; 2,3
oraz 12,7 mg/mL (Schonfelder i wsp., 2002). W badaniach
przeprowadzonych w różnych krajach, opisanych
w pracy poglądowej Dash i wsp. (2006) wykazano obecność
BPA w moczu kobiet niebędących w ciąży w stężeniu
0,2–586,14 μg/L, podczas gdy w przypadku ciężarnych
0,05–29,43 μg/L, natomiast w moczu mężczyzn od < 0,4
do > 8,02 μg/L. Stężenie BPA w krwi mężczyzn wynosiło
0,38–1,49 μg/L, a w krwi kobiet niebędących w ciąży
0–2,9 μg/L. Ponadto, w nasieniu mężczyzn stwierdzono
obecność BPA w ilości 0–12 μg/L.
Badania na zwierzętach laboratoryjnych, które narażano
w okresie neonatalnym, młodzieńczym i po osiągnięciu
dojrzałości płciowej, oraz badania in vitro wykazały,
że bisfenol A działa toksycznie na jądra. Genotoksyczne
działanie BPA związane jest z indukcją stresu oksydacyjnego
oraz osłabieniem enzymatycznych mechanizmów
antyoksydacyjnych (Anjum i wsp., 2011; Chitra
i wsp., 2003a; Meeker i wsp., 2010). Aydogan i wsp. (2010)
wykazali, że BPA indukuje powstawanie reaktywnych
form tlenu, które powodują powstawanie stresu oksydacyjnego
w jądrach szczurów.
Narażanie różnych gatunków ssaków na BPA
w różnych dawkach i w różnych okresach życia powoduje
zmniejszenie liczebności gamet męskich (Al -Hiyasat
i wsp., 2002; Chitra i wsp., 2003a, 2003b; Dobrzyńska
i Radzikowska, 2013; Dobrzyńska i wsp., 2014; Herath i wsp.,
2004; Pacchierotti i wsp., 2008; Park i wsp., 2004; Sakue
i wsp., 2001; vom Saal i wsp., 1998). W wyniku podawania
gryzoniom BPA obserwowano także zwiększenie częstości
występowania nieprawidłowości w budowie plemników
(Aikawa i wsp., 2004; Dobrzyńska i Radzikowska,
2013; Dobrzyńska i wsp., 2014; Park i wsp., 2004; Toyama
i wsp., 2004; Toyama i Yuasa, 2004), zmniejszenie ich
ruchliwości (Aikawa i wsp., 2004; Chitra i wsp., 2003a, b;
Park i wsp., 2004) oraz obniżenie ciężaru jąder i najądrzy
(Akingbemi i wsp., 2004; Al -Hiyasat i wsp., 2002; Chitra
i wsp., 2003a). Bisfenol A indukuje pęknięcia nici DNA
w haploidalnych komórkach płciowych samców myszy
(Dobrzyńska i Radzikowska, 2013). Pod wpływem działania
BPA obserwowano występowanie zmian histopatologicznych
w kanalikach nasiennych zwierząt laboratoryjnych
(Dobrzyńska i wsp., 2014; Takao i wsp., 1999; Tan i wsp., 2003; Toyama i wsp., 2004; Toyama i Yuasa,
2004). Zmiany powyższe występują nawet po zastosowaniu
dawek BPA niższych niż 50 mg/kg dziennie, tj.
najniższej dawki, po której zastosowaniu spodziewane
jest wystąpienie jakiegokolwiek efektu (ang. lowest observed
adverse eff ect level, LOAEL) (Richter i wsp., 2007).
Badania niektórych autorów wskazują na większą
wrażliwość gamet zwierząt niedojrzałych płciowo. Zhang
i wsp. (2013) podawali BPA myszom od 3. dnia życia
przez okres od 19 do 47 dni. Liczebność i jakość gamet
oceniano u zwierząt w wieku 7 tygodni i stwierdzono
znaczne obniżenie powyższych parametrów. Herath i wsp.
(2004) obserwowali, że podawanie BPA dojrzewającym
płciowo szczurom przez 5 tygodni znacznie redukuje
liczbę plemników oraz poziom testosteronu w osoczu
krwi. W innych badaniach zanotowano mniejszą liczebność
gamet u myszy, którym rozpoczęto 8 -tygodniowe
podawanie BPA w dawce 20 mg/kg/dzień w wieku 4,5
tygodni w porównaniu ze zwierzętami dojrzałymi
płciowo. Równocześnie u zwierząt tych obserwowano
znaczną degenerację spermatogoniów i spermatocytów
oraz występowanie gigantycznych wielojądrzastych
komórek w kanalikach nasiennych (Dobrzyńska i wsp.,
2014). Podobne rezultaty uzyskali Toyama i Yuasa (2004)
w wyniku narażania szczurów od 1. do 11. dnia życia.
Zmiany histopatologiczne w jądrach samców pokolenia
F1 obserwowali także Gamez i wsp. (2014) oraz Liu i wsp.
(2013) w następstwie narażania szczurów podczas ciąży
i laktacji. Ekspozycja na BPA podczas ciąży i laktacji
wpływa również na obniżenie jakości nasienia w pokoleniu
F1 poprzez zmniejszenie ruchliwości gamet i zwiększenie
częstości występowania plemników o nieprawidłowej
budowie (Viela i wsp., 2014).
Narażenie na BPA w okresie pre - lub neonatalnym
może indukować anomalie męskiego układu rozrodczego,
takie jak zwiększenie odległości anogenitalnej,
powiększenie prostaty, zmniejszenie ciężaru najądrzy,
produkcji testosteronu, liczby plemników oraz obniżenie
ich jakości (Timms i wsp., 2005; Vandenberg i wsp., 2009;
vom Saal i Hughes, 2005; Welshons i wsp., 2006). Ponadto,
w następstwie ekspozycji na BPA w tym okresie mogą
nastąpić komplikacje w przebiegu ciąży (Berger i wsp.,
2008) oraz zwiększenie częstości występowania nowotworów
po osiągnięciu dorosłości (Ho i wsp., 2006; Soto
i wsp., 2008). Podawanie BPA myszom w okresie prenatalnym
za pośrednictwem ciężarnych samic powoduje
zmniejszoną ekspresję genów związanych z funkcjonowaniem
komórek Sertoliego, a w konsekwencji oddziałuje
na funkcje reprodukcyjne potomstwa męskiego
(Tainaka i wsp., 2012). Podawanie BPA samicom szczurów
w różnych okresach ciąży wpływa na zmniejszenie ciężaru
jąder samców potomnych (Kim i wsp., 2003, Kubo i wsp.,
2003). Inni autorzy obserwowali zmniejszenie ciężaru
jąder u potomstwa myszy, którym podawano BPA podczas
ciąży i laktacji (Kawai i wsp., 2003; Kobuto i wsp., 2004).
Al -Hiyasat i wsp. (2002) obserwowali zmniejszoną
częstość zachodzenia w ciążę przez samice kojarzone
z samcami narażanymi uprzednio przez 30 dni na BPA.
Podobne wyniki uzyskano w następstwie prekoncepcyjnego
8 -tygodniowego narażania samców myszy
na BPA. Ponadto, obserwowano istotne zmniejszenie
wielkości miotów, zmniejszenie liczby żywych płodów
oraz zwiększoną śmiertelność postnatalną i obniżoną
ruchliwość gamet w pokoleniu F1 (Dobrzyńska i wsp., submitted).
Zhang i wsp. (2013) wykazali wolniejsze przybieranie
na wadze potomstwa myszy narażanych na BPA
od 3. do 47. dnia życia. Prekoncepcyjne narażanie samców
szczurów przez 6 dni na BPA indukuje występowanie
dominujących mutacji letalnych, szczególnie w przypadku
ekspozycji spermatyd i spermatocytów (Tiwari i Vanage,
2013). Narażanie zarówno samców, jak i samic myszy
na BPA przed kojarzeniem może być przyczyną zwiększonej
resorpcji płodów (Al -Hiyasat i wsp., 2002, 2004).
Z kolei badania Peknicova i wsp. (2002), w których podawano
BPA w małych dawkach trzem pokoleniom myszy,
wykazały zmniejszenie wielkości miotów w pokoleniu
drugim i trzecim oraz zmiany histopatologiczne w kanalikach
nasiennych w pierwszej i drugiej generacji. Należy
podkreślić, że badania epidemiologiczne dzieci z rodzin,
w których co najmniej jedno z rodziców było narażone
na BPA w okresie ciąży, wykazały związek takiej ekspozycji
z niską wagą urodzinową w oraz skróconą odległością
anogenitalną u noworodków (Miao i wsp., 2011).
Bisfenol A (dian, 2,2 -bis(p -hydroksyfenylo)propan) jest
białym lub jasnobrązowym proszkiem, słabo rozpuszczalnym
w wodzie. Budowę chemiczna BPA przedstawiono
na rycinie 5. Bisfenol A stosowany jest głównie
do produkcji tworzyw sztucznych; poliestrów (głównie poliwęglanów, które są wykorzystywane m.in. do wytwarzania
butelek dla niemowląt), polieterów, polisulfonów,
żywic epoksydowych (m.in. wyściełających wewnętrzne
powierzchnie puszek). Ponadto stosowany jest jako przeciwutleniacz
w środkach spożywczych i kosmetycznych.
Obecność BPA wykryto w takich produktach jak pojemniki
do przechowywania żywności, wykonane z przezroczystych
plastików butelki do karmienia niemowląt
i do napojów, wewnętrzne powłoki metalowych puszek
do napojów i żywności, cystern do przechowywania
wody, mleka i wina, zabawki, papier termiczny, płyty
kompaktowe, farby, kaski ochronne, części samochodowe,
okna plastikowe, materiały do wypełnień dentystycznych,
soczewki i plastry opatrunkowe (Lyons, 2000;
Markey i wsp., 2003).
Obecność BPA wykryto w środowisku naturalnym,
w glebie w stężeniu 0,55–147 μg/kg suchej masy,
w osadach dennych od <0,24 do 492 μg/kg suchej masy,
w wodach gruntowych 0,001–20 mg/m³, w wodach
powierzchniowych od <0,001 do 92 mg/m³ (Careghini
i wsp., 2015). Stężenie BPA w powietrzu wynosiło
2–208 μg/m³ (Rudel i wsp., 2001).
Bisfenol A dostaje się do organizmu człowieka głównie
drogą pokarmową oraz przez układ oddechowy i skórę.
Może być uwalniany z tworzyw sztucznych, w skład
których wchodzi do żywności, napojów i odżywek dla
niemowląt, szczególnie jeżeli opakowanie jest podgrzewane,
myte detergentem lub poddane zmianom
mechanicznym (gniecenie, rozciąganie). Najbardziej
narażoną grupą są niemowlęta i małe dzieci ze względu
na stosukowo niski ciężar ciała oraz powszechne użycie
butelek, kubeczków, talerzyków, łyżeczek itp. wykonanych
z tworzyw zawierających BPA. Związek ten może
być również wymywany do śliny pacjentów po założeniu
wypełnień dentystycznych (Markey i wsp., 2003;
Tyl i wsp., 2002). Obecność BPA wykazano w żywności
w ilości 4–23 μg/puszka, w napojach 7–58 μg/g, w ślinie
pacjentów stomatologicznych 90–913 μg po 1 godz.
od założenia wypełnienia (Akingbemi i wsp., 2004).
Stężenia BPA w produktach spożywczych pochodzących
z różnych krajów wynosiły 0,1–790 μg/kg suchej
masy, a wodzie do picia i napojach 0,0073–0,86 μg/m³
(Careghini i wsp., 2015). Przykładowo, badania szwedzkie
wykazały obecność BPA w rybach (2,5–29 μg/kg świeżej
masy), mięsie (6,9–13 μg/kg), ziemniakach (2,2 μg/kg),
w produktach mleczarskich (2,4 μg/kg) (Gyllenhammer
i wsp., 2012). Basheer i wsp. (2004) oznaczali stężenie BPA
w owocach morza (13,3–213,1 μg/kg świeżej masy), a Sun
i wsp. (2006) w konserwach (32,8–164,5 μg/kg świeżej
masy). Interesujące jest, że migracja BPA z nowych naczyń
stołowych dla niemowląt wynosiła 1–1,9 μg/kg roztworu,
podczas gdy z wielokrotnie używanych 1,8–7,9 μg/kg
(Lyons, 2000). Z kolei Brede i wsp. (2003) wykazali, że stężenie
BPA w napoju z nowych butelek dla niemowląt
wynosiło 0,2 μg/L, w używanych 51 dni – 8,4 μg/L,
a w używanych 169 dni – 6,7 μg/L. Na podstawie
wyników najowszych badań dzienną dawkę BPA przyjmowaną
przez ludzi oszacowano na 0,02–0,181 μg/kg
dla dorosłych oraz na 0,22–0,33 μg/kg dla niemowląt
(Careghini i wsp., 2015).
Obecność BPA wykryto także w płynach ciała człowieka.
Badania przeprowadzone przez Calafat i wsp.
(2005) wykazały w moczu średnio 1,28 μg/L BPA.
Obecność BPA stwierdzono także w krwi matek, noworodków
i w łożysku w stężeniach odpowiednio 3,1; 2,3
oraz 12,7 mg/mL (Schonfelder i wsp., 2002). W badaniach
przeprowadzonych w różnych krajach, opisanych
w pracy poglądowej Dash i wsp. (2006) wykazano obecność
BPA w moczu kobiet niebędących w ciąży w stężeniu
0,2–586,14 μg/L, podczas gdy w przypadku ciężarnych
0,05–29,43 μg/L, natomiast w moczu mężczyzn od < 0,4
do > 8,02 μg/L. Stężenie BPA w krwi mężczyzn wynosiło
0,38–1,49 μg/L, a w krwi kobiet niebędących w ciąży
0–2,9 μg/L. Ponadto, w nasieniu mężczyzn stwierdzono
obecność BPA w ilości 0–12 μg/L.
Badania na zwierzętach laboratoryjnych, które narażano
w okresie neonatalnym, młodzieńczym i po osiągnięciu
dojrzałości płciowej, oraz badania in vitro wykazały,
że bisfenol A działa toksycznie na jądra. Genotoksyczne
działanie BPA związane jest z indukcją stresu oksydacyjnego
oraz osłabieniem enzymatycznych mechanizmów
antyoksydacyjnych (Anjum i wsp., 2011; Chitra
i wsp., 2003a; Meeker i wsp., 2010). Aydogan i wsp. (2010)
wykazali, że BPA indukuje powstawanie reaktywnych
form tlenu, które powodują powstawanie stresu oksydacyjnego
w jądrach szczurów.
Narażanie różnych gatunków ssaków na BPA
w różnych dawkach i w różnych okresach życia powoduje
zmniejszenie liczebności gamet męskich (Al -Hiyasat
i wsp., 2002; Chitra i wsp., 2003a, 2003b; Dobrzyńska
i Radzikowska, 2013; Dobrzyńska i wsp., 2014; Herath i wsp.,
2004; Pacchierotti i wsp., 2008; Park i wsp., 2004; Sakue
i wsp., 2001; vom Saal i wsp., 1998). W wyniku podawania
gryzoniom BPA obserwowano także zwiększenie częstości
występowania nieprawidłowości w budowie plemników
(Aikawa i wsp., 2004; Dobrzyńska i Radzikowska,
2013; Dobrzyńska i wsp., 2014; Park i wsp., 2004; Toyama
i wsp., 2004; Toyama i Yuasa, 2004), zmniejszenie ich
ruchliwości (Aikawa i wsp., 2004; Chitra i wsp., 2003a, b;
Park i wsp., 2004) oraz obniżenie ciężaru jąder i najądrzy
(Akingbemi i wsp., 2004; Al -Hiyasat i wsp., 2002; Chitra
i wsp., 2003a). Bisfenol A indukuje pęknięcia nici DNA
w haploidalnych komórkach płciowych samców myszy
(Dobrzyńska i Radzikowska, 2013). Pod wpływem działania
BPA obserwowano występowanie zmian histopatologicznych
w kanalikach nasiennych zwierząt laboratoryjnych
(Dobrzyńska i wsp., 2014; Takao i wsp., 1999; Tan i wsp., 2003; Toyama i wsp., 2004; Toyama i Yuasa,
2004). Zmiany powyższe występują nawet po zastosowaniu
dawek BPA niższych niż 50 mg/kg dziennie, tj.
najniższej dawki, po której zastosowaniu spodziewane
jest wystąpienie jakiegokolwiek efektu (ang. lowest observed
adverse eff ect level, LOAEL) (Richter i wsp., 2007).
Badania niektórych autorów wskazują na większą
wrażliwość gamet zwierząt niedojrzałych płciowo. Zhang
i wsp. (2013) podawali BPA myszom od 3. dnia życia
przez okres od 19 do 47 dni. Liczebność i jakość gamet
oceniano u zwierząt w wieku 7 tygodni i stwierdzono
znaczne obniżenie powyższych parametrów. Herath i wsp.
(2004) obserwowali, że podawanie BPA dojrzewającym
płciowo szczurom przez 5 tygodni znacznie redukuje
liczbę plemników oraz poziom testosteronu w osoczu
krwi. W innych badaniach zanotowano mniejszą liczebność
gamet u myszy, którym rozpoczęto 8 -tygodniowe
podawanie BPA w dawce 20 mg/kg/dzień w wieku 4,5
tygodni w porównaniu ze zwierzętami dojrzałymi
płciowo. Równocześnie u zwierząt tych obserwowano
znaczną degenerację spermatogoniów i spermatocytów
oraz występowanie gigantycznych wielojądrzastych
komórek w kanalikach nasiennych (Dobrzyńska i wsp.,
2014). Podobne rezultaty uzyskali Toyama i Yuasa (2004)
w wyniku narażania szczurów od 1. do 11. dnia życia.
Zmiany histopatologiczne w jądrach samców pokolenia
F1 obserwowali także Gamez i wsp. (2014) oraz Liu i wsp.
(2013) w następstwie narażania szczurów podczas ciąży
i laktacji. Ekspozycja na BPA podczas ciąży i laktacji
wpływa również na obniżenie jakości nasienia w pokoleniu
F1 poprzez zmniejszenie ruchliwości gamet i zwiększenie
częstości występowania plemników o nieprawidłowej
budowie (Viela i wsp., 2014).
Narażenie na BPA w okresie pre - lub neonatalnym
może indukować anomalie męskiego układu rozrodczego,
takie jak zwiększenie odległości anogenitalnej,
powiększenie prostaty, zmniejszenie ciężaru najądrzy,
produkcji testosteronu, liczby plemników oraz obniżenie
ich jakości (Timms i wsp., 2005; Vandenberg i wsp., 2009;
vom Saal i Hughes, 2005; Welshons i wsp., 2006). Ponadto,
w następstwie ekspozycji na BPA w tym okresie mogą
nastąpić komplikacje w przebiegu ciąży (Berger i wsp.,
2008) oraz zwiększenie częstości występowania nowotworów
po osiągnięciu dorosłości (Ho i wsp., 2006; Soto
i wsp., 2008). Podawanie BPA myszom w okresie prenatalnym
za pośrednictwem ciężarnych samic powoduje
zmniejszoną ekspresję genów związanych z funkcjonowaniem
komórek Sertoliego, a w konsekwencji oddziałuje
na funkcje reprodukcyjne potomstwa męskiego
(Tainaka i wsp., 2012). Podawanie BPA samicom szczurów
w różnych okresach ciąży wpływa na zmniejszenie ciężaru
jąder samców potomnych (Kim i wsp., 2003, Kubo i wsp.,
2003). Inni autorzy obserwowali zmniejszenie ciężaru
jąder u potomstwa myszy, którym podawano BPA podczas
ciąży i laktacji (Kawai i wsp., 2003; Kobuto i wsp., 2004).
Al -Hiyasat i wsp. (2002) obserwowali zmniejszoną
częstość zachodzenia w ciążę przez samice kojarzone
z samcami narażanymi uprzednio przez 30 dni na BPA.
Podobne wyniki uzyskano w następstwie prekoncepcyjnego
8 -tygodniowego narażania samców myszy
na BPA. Ponadto, obserwowano istotne zmniejszenie
wielkości miotów, zmniejszenie liczby żywych płodów
oraz zwiększoną śmiertelność postnatalną i obniżoną
ruchliwość gamet w pokoleniu F1 (Dobrzyńska i wsp., submitted).
Zhang i wsp. (2013) wykazali wolniejsze przybieranie
na wadze potomstwa myszy narażanych na BPA
od 3. do 47. dnia życia. Prekoncepcyjne narażanie samców
szczurów przez 6 dni na BPA indukuje występowanie
dominujących mutacji letalnych, szczególnie w przypadku
ekspozycji spermatyd i spermatocytów (Tiwari i Vanage,
2013). Narażanie zarówno samców, jak i samic myszy
na BPA przed kojarzeniem może być przyczyną zwiększonej
resorpcji płodów (Al -Hiyasat i wsp., 2002, 2004).
Z kolei badania Peknicova i wsp. (2002), w których podawano
BPA w małych dawkach trzem pokoleniom myszy,
wykazały zmniejszenie wielkości miotów w pokoleniu
drugim i trzecim oraz zmiany histopatologiczne w kanalikach
nasiennych w pierwszej i drugiej generacji. Należy
podkreślić, że badania epidemiologiczne dzieci z rodzin,
w których co najmniej jedno z rodziców było narażone
na BPA w okresie ciąży, wykazały związek takiej ekspozycji
z niską wagą urodzinową w oraz skróconą odległością
anogenitalną u noworodków (Miao i wsp., 2011).