ZESPÓŁ KLINEFELTERA – AKTUALNE ZALECENIA
ODNOŚNIE POSTĘPOWANIA MEDYCZNEGO
KLINEFELTER SYNDROME – CURRENT RECOMMENDATIONS
REGARDING MEDICAL PROCEDURES
Tomasz Purwin¹, Jolanta Słowikowska -Hilczer²
¹ Oddział Urologiczny, Szpital w Giżycku, ² Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności,
Uniwersytet Medyczny w Łodzi
Autor do korespondencji/corresponding author: Jolanta Słowikowska -Hilczer, Zakład Endokrynologii Płodności,
Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. Sterlinga 5, 91-425 Łódź,
tel.: 42 633 07 05, jolanta.slowikowska -hilczer@umed.lodz.pl
Otrzymano/received: 07.05.2015 r. • Zaakceptowano/accepted: 21.11.2015 r.
Tomasz Purwin – absolwent Wydziału Lekarskiego Akademii Medycznej w Białymstoku (2005),
specjalista urolog FEBU (ang. Fellow of the European Board of Urology), androlog kliniczny Europejskiej
Akademii Andrologii (EAA, ang. European Academy of Andrology), lekarz medycyny seksualnej FECSM
(ang. Fellow of the European Committee of Sexual Medicine), obecnie asystent Oddziału Urologicznego
Szpitala Giżyckiego. Członek Polskiego i Europejskiego Towarzystwa Urologicznego, Andrologicznego,
Europejskiego Towarzystwa Medycyny Seksualnej (ESSM, ang. European Society of Sexual Medicine).
Streszczenie
Zespół Klinefeltera jest najpowszechniejszą (0,1–0,2% noworodków płci męskiej) uwarunkowaną genetycznie przyczyną niepłodności
oraz hipogonadyzmu hipergonadotropowego u mężczyzn. Rozwija się na skutek aberracji liczbowej chromosomów X (najczęściej
47,XXY). W dzieciństwie i we wczesnym okresie dojrzewania płciowego czynność układu podwzgórze–przysadka–jądra jest zwykle prawidłowa.
Od środkowego okresu dojrzewania (stadium GIII wg klasyfi kacji Tannera) rozwija się obraz kliniczny hipogonadyzmu hipergonadotropowego
na skutek postępującej degeneracji struktury i upośledzenia czynności jąder. Fenotyp jest zróżnicowany, począwszy
od niemalże prawidłowego do znacznie odbiegającego od normy. U noworodków z zespołem Klinefeltera fenotyp jest z reguły prawidłowy
męski. Często jedyną cechą kliniczną są małe jądra, które najczęściej są identyfi kowane dopiero po okresie dojrzewania płciowego.
Pacjenci z tym zespołem są zazwyczaj niepłodni (aczkolwiek w około połowie przypadków możliwe jest znalezienie plemników
w jądrach), a także mają większe ryzyko zachorowania m.in. na raka piersi, zespół metaboliczny, choroby układu krążenia, osteopenię/
osteoporozę, choroby autoimmunologiczne. Ponadto, występują w zróżnicowanym stopniu zaburzenia poznawcze, społeczne, behawioralne
oraz trudności w nauce. Rekomendowana jest wczesna diagnostyka w kierunku tego zespołu, aby możliwie najszybciej wdrożyć
postępowanie terapeutyczne i prewencyjne przeciwko chorobom towarzyszącym.
słowa kluczowe: aberracja liczbowa chromosomów X, małe jądra, wysoki wzrost, hipogonadyzm hipergonadotropowy, niepłodność
Abstract
Klinefelter syndrome is the most common (0,1–0,2% male newborns), genetic form of infertility and hypergonadotropic hypogonadism
in men. It develops as a result of numerical aberrations of chromosome X (usually 47,XXY). In childhood and early puberty activity of
the hypothalamo–pituitary–testicular axis is usually normal. From the middle of puberty (GIII Tanner’s stage) develops the clinical
picture of hypergonadotropic hypogonadism due to progressive degeneration of the structure and impaired testicular function. Th e
phenotype is variable, ranging from almost normal to signifi cantly diff erent. Newborns with Klinefelter syndrome usually present
normal male phenotype. Often the only clinical symptom is small testes, which are usually identifi ed after puberty. Patients with that
syndrome are usually infertile, however in about half the cases, it is possible to fi nd spermatozoa in the testes, and have a higher risk
of i.e. breast cancer, metabolic syndrome, cardiovascular disease, osteopenia/osteoporosis, autoimmune diseases. In addition, there
is varying degree of cognitive, social, behavioral and learning diffi culties. Early diagnosis of Klinefelter syndrome is recommended
to implement early therapy and prevention of co -morbidities.
key words: numerical aberration of chromosome X, small testes, tall stature, hypergonadotropic hypogonadism, infertility
Skróty / Abbreviations
AMH – hormon antymüllerowski (ang. anti-Müllerian hormone), ART – techniki rozrodu wspomaganego (ang. assisted reproductive technology),
BMC – zawartość mineralna kości (ang. bone mineral content), BMD – gęstość mineralna kości (ang. bone mineral density), BFM – masa
tkanki tłuszczowej (ang. body fat mass), BMI – wskaźnik masy ciała (ang. body mass index), DEXA – absorcjometria podwójnej wiązki promieniowania
rentgenowskiego (ang. dual -energy X -ray absorptiometry), FSH – hormon folikulotropowy (ang. follicle stimulating hormone),
GH -IGF – hormon wzrostu – insulinopodobny czynnik wzrostu (ang. growth hormone – insulin -like growth factor), HbA1C – hemoglobina
glikolowana (ang. glycated hemoglobin), hCG – ludzka gonadotropina kosmówkowa (ang. human chorionic gonadotropin), ICSI – docytoplazmatyczna
iniekcja plemnika do komórki jajowej (ang. intracytoplasmic sperm injection), IGF -1 – insulinopodobny czynnik wzrostu 1 (ang.
insulin -like growth factor 1), IGFBP -3 – globulina wiążąca insulinopodobny czynnik wzrostu 3 (ang. insulin -like growth factor binding protein 3),
INSL -3 – insulinopodobny czynnik 3 (ang. insulin -like factor 3), LBM – sucha masa ciała (ang. lean body mass), LH – hormon luteinizujący
(ang. luteinizing hormone), MESA – mikrochirurgiczna aspiracja plemników z najądrzy (ang. microsurgical epididymal sperm aspiration),
PAR1 – pseudoautosomalny region 1 (ang. pseudoautosomal region 1), PSA – antygen specyfi czny dla prostaty (ang. prostate specifi c antigen),
RXFP2 – gen kodujący receptor 2 należący do rodziny białek relaksyno -/insulinopodobnych (ang. relaxin/insulin -like family peptide receptor 2
gene), SHOX – gen związany ze wzrostem, zawierający homeodomenę, zlokalizowany w regionie pseudoautosomalnym 1 na chromosomie
X i Y (ang. short stature homeobox -containing gene), SMR – standaryzowany wskaźnik umieralności (ang. standardized mortality rate), TESE –
pobranie plemników z jąder (ang. testicular sperm extraction), ZK – zespół Klinefeltera (ang. Klinefelter syndrome)
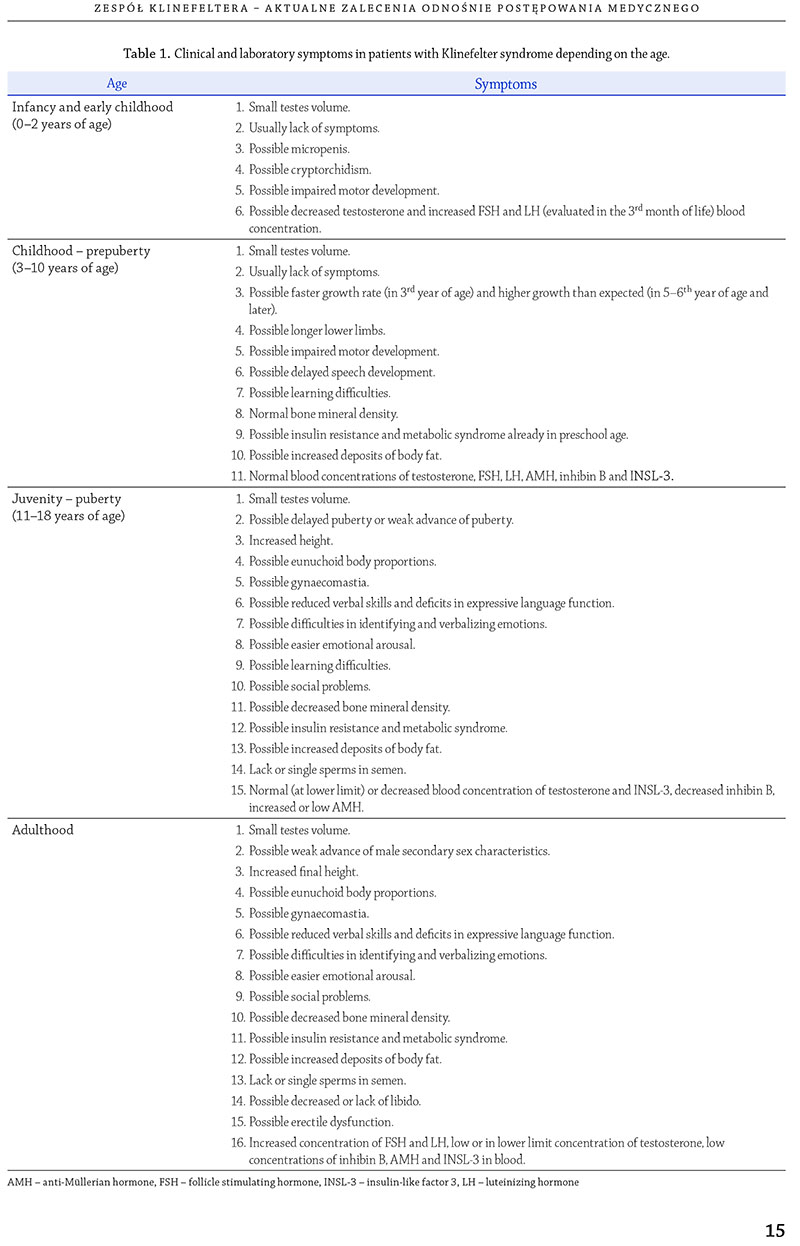
Zespół Klinefeltera
Zespół Klinefeltera (ZK, ang. Klinefelter syndrome) charakteryzuje
się obecnością jednego lub więcej dodatkowych chromosomów
X i jest najczęstszą przyczyną pierwotnej niewydolności
jąder. Większość przypadków to nosiciele jednego
dodatkowego chromosomu X (47,XXY), a wyższe aneuploidie
(np. 48,XXXY) lub mozaiki (np. 47,XXY/46,XY) stanowią
ok. 20% przypadków. Kariotyp 47, XXY występuje
u 11% mężczyzn z azoospermią oraz u 3% mężczyzn niepłodnych
i jest najczęstszą genetyczną przyczyną męskiej
niepłodności (van Assche i wsp., 1996). Szacuje się, że ZK
występuje u 1–2 : 1000 noworodków płci męskiej i jest najczęstszą
aneuploidią chromosomalną po zespole Downa
w ogólnej populacji (Bojesen i wsp., 2003; Nielsen i Wohlert,
1990). Obszerne badania przeprowadzone w Danii wykazały,
że częstość występowania ZK jest znacznie niedoszacowana
i że ostatecznie zostaje zdiagnozowanych mniej
niż 25% pacjentów (Bojesen i wsp., 2003), z czego większość
przypadków wykrywana jest w okresie dojrzałości.
Fenotyp jest zróżnicowany, ale ogólnie charakteryzuje
się pierwotną niewydolnością jąder, z ich zredukowaną
objętością, towarzyszącym hipogonadyzmem
hipergonadotropowym i wysokim wzrostem (tabela 1).
U pacjentów z ZK obserwuje się częściej niż w ogólnej
populacji choroby współwystępujące, takie jak rak piersi,
zespół metaboliczny (otyłość, cukrzyca typu II, nadciśnienie,
zaburzenia lipidogramu), choroby układu krążenia,
choroba zakrzepowo -zatorowa, żylaki, osteopenia/
osteoporoza, padaczka, pozagonadalne nowotwory
z komórek płciowych i choroby autoimmunologiczne
(Aksglaede i wsp., 2013; Nieschlag, 2013). Dodatkowo
u pacjentów z ZK upośledzone są funkcje psychospołeczne,
behawioralne i poznawcze oraz obniżone są zdolności
werbalne (Cohen i Durham, 1985a,b; Girardin i wsp.,
2009; Nielsen, 1990; Nielsen i Pelsen, 1987; Ratcliff e, 1999;
Ross i wsp., 2008; Rovet i wsp., 1995, 1996; Sorensen, 1992;
Van i wsp., 2006b, 2008a). Przyczyny tych zaburzeń nie
są wyjaśnione. Niektóre z nich mogą być konsekwencją
hipogonadyzmu, podczas gdy inne mogą być bezpośrednio
związane z anomaliami chromosomowymi.
Istnieje hipoteza, że geny na dodatkowym chromosomie
X, które nie podlegają inaktywacji, mogą wywoływać
niepożądany efekt. Stwierdzono, że fenotyp mężczyzn
z ZK tym bardziej różni się od prawidłowego, im
większa jest liczba dodatkowych chromosomów X, natomiast
mężczyźni z kariotypem mozaikowym częściej
mają lżejsze postacie choroby (Lanfranco i wsp., 2004).
Czynność jąder
Pierwotny opis ZK opublikowany w 1942 r. przez
Harry’ego F. Klinefeltera i współpracowników wskazywał
na obecność małych jąder z atrofi ą i hialinizacją
kanalików plemnikotwórczych, co wykazano w badaniu
histopatologicznym (Klinefelter i wsp., 1942). W innych
badaniach stwierdzono degenerację komórek płciowych
już na etapie życia płodowego (Aksglaede i wsp., 2006).
W konsekwencji, objętość jąder u płodów i u chłopców
 AMH – hormon antymüllerowski, FSH – hormon folikulotropowy, INSL -3 – insulinopodobny czynnik 3, LH – hormon luteinizujący
AMH – hormon antymüllerowski, FSH – hormon folikulotropowy, INSL -3 – insulinopodobny czynnik 3, LH – hormon luteinizujący
AMH – anti-Müllerian hormone, FSH – follicle stimulating hormone, INSL -3 – insulin -like factor 3, LH – luteinizing hormone
w okresie przedpokwitaniowym jest zmniejszona, a proces
degeneracji jąder postępuje w dzieciństwie i przyspiesza
podczas okresu dojrzewania, co ostatecznie skutkuje
włóknieniem i hialinizacją kanalików plemnikotwórczych
oraz przerostem tkanki śródmiąższowej jąder
u dorosłych mężczyzn z ZK (Ross i wsp., 2005; Zeger
i wsp., 2008). W okresie dojrzewania obserwuje się nieznaczny
wzrost objętości jąder, który później zatrzymuje
się wraz z pogarszaniem się funkcji gonad (Aksglaede
i wsp., 2011b; Wikstrom i wsp., 2004). Ostatecznie objętość
jąder jest obniżona w wieku dojrzałym – średnio
wynosi ok. 3 mL (1,0–7,0 mL) w porównaniu do średnio
ok. 22 mL w grupie zdrowych mężczyzn (Aksglaede i wsp.,
2011b). U pacjentów z kariotypem 47,XXY najczęściej
spotyka się azoospermię. Plemniki są obecne w nasieniu
niezwykle rzadko (ok. 8% mężczyzn), a przypadki spontanicznego
ojcostwa odnotowywane są sporadycznie.
Większą szansę na produkcję plemników mają mężczyźni
z kariotypem mozaikowym (Aksglaede i Juul, 2013).
W 3. miesiącu życia u chłopców aktywna jest oś podwzgórze–
przysadka–jądra, dzięki czemu w tym okresie
można zbadać jej czynność (Main i wsp., 2002). Kilka
wcześniejszych badań wskazuje, że chłopcy z ZK mogą
już w tym czasie wykazywać hormonalne oznaki hipogonadyzmu
hipergonadotropowego (Lahlou i wsp., 2004;
Ross i wsp., 2005), podczas gdy inne badania nie potwierdziły
tych obserwacji i wykazały prawidłowe stężenia
testosteronu (Aksglaede i wsp., 2007b; Cabrol i wsp., 2011).
W przypadkach z wczesnym hipogonadyzmem u noworodków
męskich może wystąpić obustronne wnętrostwo
i niedorozwój prącia (ang. micropenis).
W okresie dzieciństwa chłopcy z ZK mają prawidłowe
stężenia testosteronu, hormonu folikulotropowego
(FSH, ang. follicle stimulating hormone), hormonu
luteinizującego (LH, ang. luteinizing hormone), hormonu
antymüllerowskiego (AMH, ang. anti-Müllerian hormone),
inhibiny B oraz insulinopodobnego czynnika 3 (INSL -3,
ang. insulin -like factor 3) (Aksglaede i wsp., 2008b, 2011a;
Andersson i wsp., 1997; Bastida i wsp., 2007; Christiansen
i wsp., 2003; Salbenblatt i wsp., 1985; Topper i wsp., 1982;
Wikstrom i wsp., 2004, 2006a,b,c).
W początkowym okresie dojrzewania płciowego obserwuje
się zwykle prawidłowy wzrost stężenia testosteronu,
INSL -3 i inhibiny B, jednak podczas środkowej
fazy pokwitania (stadium GIII wg klasyfi kacji Tannera)
stężenia testosteronu i INSL -3 obniżają się i pozostają
w dolnej granicy normy (Aksglaede i wsp., 2008b;
Salbenblatt i wsp., 1985; Topper i wsp., 1982; Wikstrom
i wsp., 2004). U zdecydowanej większości pacjentów z ZK
stężenia inhibiny B obniżają się gwałtownie i pozostają
bardzo niskie lub niewykrywalne w końcowym okresie
pokwitania (Aksglaede i wsp., 2008b; Christiansen i wsp.,
2003; Wikstrom i wsp., 2004). Fizjologiczny spadek stężenia
AMH w okresie dojrzewania u chłopców z ZK
występuje później niż u zdrowych (Aksglaede i wsp., 2010;
Bastida i wsp., 2007; Wikstrom i wsp., 2006c). Podczas
środkowej fazy pokwitania obserwuje się wzrost stężeń
FSH i LH do wartości hipergonadotropowych (Aksglaede
i wsp., 2011b; Salbenblatt i wsp., 1985; Topper i wsp., 1982;
Wikstrom i wsp., 2006b).
Dorośli z ZK mają znacznie podwyższone stężenia
FSH i LH. Stężenie testosteronu jest najczęściej na dolnej
granicy normy dla zdrowych mężczyzn, rzadziej poniżej
normy. Stężenie inhibiny B jest w większości przypadków
poniżej poziomu wykrywalności i odzwierciedla
upośledzoną spermatogenezę (Aksglaede i wsp.,
2008b), podczas gdy stężenia AMH i INSL -3 są znacznie
obniżone w stosunku do populacji zdrowych mężczyzn
(Aksglaede i wsp., 2011a; Bay i wsp., 2005; Foresta i wsp.,
2004). Dane na temat stężeń estradiolu u mężczyzn z ZK
są ograniczone i sprzeczne. W okresie dzieciństwa stężenie
estradiolu jest prawidłowe, podczas gdy u dorosłych
wzrasta (Aksglaede i wsp., 2008b) lub pozostaje na niskim
poziomie (Aksglaede i wsp., 2007a).
Wzrost
Do klasycznych objawów klinicznych ZK u dorosłych
zalicza się wysoki wzrost i eunuchoidalne proporcje ciała.
Należy jednak podkreślić, że prawidłowy, a nawet niski
wzrost, nie wyklucza tego zespołu. W okresie wczesnego
niemowlęctwa długość ciała chłopca z ZK jest z reguły
w granicach normy dla zdrowych. Tempo wzrostu jest
wyraźnie przyspieszone w wieku 3 lat (Ratcliff e i wsp.,
1990), co prowadzi do znacznie wyższego wzrostu niż
oczekiwany w wieku 5–6 lat i późniejszym (Aksglaede
i wsp., 2008b; Ottesen i wsp., 2010; Ratcliff e, 1999; Ratcliff e
i wsp., 1990; Schibler i wsp., 1974; Stewart i wsp., 1982;
Tanner i wsp., 1959). Ponadto, znacznie wzrasta długość
kończyn dolnych przed okresem dojrzewania, co było
opisywane przez wielu autorów (Aksglaede i wsp., 2008b;
Schibler i wsp., 1974; Stewart i wsp., 1959, 1982; Tanner
i wsp., 1959; Zuppinger i wsp., 1967). Zaproponowano
kilka hipotez wyjaśniających nieprawidłowy przebieg
wzrostu obserwowany u pacjentów z ZK. Powszechnie
uznaje się, że oddziaływanie pomiędzy steroidowymi
hormonami płciowymi i hormonem wzrostu – insulinopodobnym
czynnikiem wzrostu (GH -IGF, ang. growth
hormone – insulin -like growth factor) ma istotne znaczenie
w regulacji wzrostu kości na długość. Hipogonadyzm,
który jest obecny w okresie pokwitania, jest związany
ze zwiększoną długością kończyn dolnych u dorosłych
mężczyzn (Smals i wsp., 1974; Tanner i wsp., 1976), jednak
w ZK to zjawisko jest już obecne przed pokwitaniem,
a więc upośledzona sekrecja androgenów i jako pierwotna
przyczyna wydaje się nie mieć znaczenia w tym przypadku.
U osób z ZK wykazano również prawidłowe stężenia
insulinopodobnego czynnika wzrostu 1 (IGF -1, ang.
insulin -like growth factor 1) i globuliny wiążącej insulinopodobny
czynnik wzrostu 3 (IGFBP -3, ang. insulin -like growth
factor binding protein 3) od niemowlęctwa do dorosłości
(Aksglaede i wsp., 2008b), więc także te czynniki wpływające
na wzrost nie mają znaczenia w tych przypadkach.
Liczne geny, m.in. te zlokalizowane na chromosomach
płciowych, są zaangażowane w regulację wzrostu.
W ostatnich latach pojawia się coraz więcej dowodów
na to, że gen związany ze wzrostem zawierający homeodomenę
(SHOX, short stature homeobox -containing gene)
bierze udział w regulacji wzrostu (Rappold i wsp., 2012).
Jest on zlokalizowany na chromosomach X i Y w pseudoautosomalnym
regionie 1 (PAR1, ang. pseudoautosomal
region 1) (Rao i wsp., 1997b) i wpływa pozytywnie
na wzrost pacjentów z dodatkowymi chromosomami
płciowymi, podczas gdy niewydolność genu SHOX obserwowana
w zespole Turnera (45,X) prowadzi do niskiego
wzrostu (Ottesen i wsp., 2010; Rao i wsp., 1997).
Choroby współistniejące
Obniżona mineralizacja kości
Niedobór androgenów u zdrowych mężczyzn jest związany
z podwyższonym ryzykiem rozwoju osteopenii
i osteoporozy (Finkelstein i wsp., 1987; Seeman i wsp.,
1983). Dorośli mężczyźni z ZK często mają obniżoną
gęstość mineralną kości (BMD, ang. bone mineral density)
(Aksglaede i wsp., 2011b; Bojesen i wsp., 2010; Ferlin i wsp.,
2011b; Horowitz i wsp., 1992), jednak Ferlin i wsp. (2010)
nie znaleźli związku między masą kostną a stężeniem
testosteronu u 112 pacjentów z ZK nieleczonych androgenami.
Okazało się, że młodzi mężczyźni z mutacją
w genie RXFP2 (gen kodujący receptor 2 należący
do rodziny białek relaksyno -/insulinopodobnych, ang.
relaxin/insulin -like family peptide receptor 2 gene), kodującym
receptor dla INSL -3, mają zredukowaną masę
kostną (Ferlin i wsp., 2011a), dlatego stworzono hipotezę,
że obniżona masa kostna u mężczyzn z ZK może być
związana z małym stężeniem krążącego INSL -3 (Ferlin
i wsp., 2011c). W przeciwieństwie do dorosłych z ZK,
u dzieci w okresie przeddojrzewaniowym stwierdzono
prawidłowe BMD oraz zawartość mineralną kości (BMC,
ang. bone mineral content) (Aksglaede i wsp., 2008a).
Zespół metaboliczny
Wykazano, że dorośli z ZK mają 5 -krotnie wyższe ryzyko
rozwinięcia zespołu metabolicznego w porównaniu
z grupą kontrolną (Bojesen i wsp., 2006b). W badaniu
Bardsleya i wsp. (2001) wykazano, że insulinooporność
i zespół metaboliczny były obecne odpowiednio u 24%
i 7% spośród 89 dzieci z ZK, w wieku pomiędzy 4. a 12.
rokiem życia. W obu badaniach otyłość brzuszna, która
jest związana z zespołem metabolicznym, była charakterystyczna
dla pacjentów z ZK (Timar i wsp., 2000).
Wzrastającą ilość tkanki tłuszczowej, począwszy od wczesnego
dzieciństwa, stwierdzono metodą absorcjometrii
podwójnej wiązki promieniowania rentgenowskiego
(DEXA, ang. dual -energy X -ray absorptiometry) (Aksglaede
i wsp., 2008a) i poprzez pomiar fałdów skórnych w okolicy
podłopatkowej i nad mięśniem trójgłowym ramienia
(Ratcliff e, 1982; Ratcliff e i wsp., 1990). Ponadto wykazano
zwiększoną masę tkanki tłuszczowej (BFM, ang. body fat
mass) mimo prawidłowego dla wieku wskaźnika masy
ciała (BMI, ang. body mass index) i suchej masy ciała (LBM,
ang. lean body mass), co sugeruje niekorzystną kompozycję
ciała już w dzieciństwie i okresie dojrzewania (Aksglaede
i wsp., 2008a).
Rak sutka
Pacjenci z ZK mają podwyższone ryzyko rozwoju raka
sutka, jednak mechanizm tego zjawiska nie jest dobrze
poznany. Wieloletnia ginekomastia, predyspozycja
genetyczna, podwyższony stosunek stężenia estradiolu
do testosteronu, otyłość i brak aktywności fi zycznej, jak
również egzogenne androgeny, są czynnikami potencjalnie
sprzyjającymi. W badaniu przeprowadzonym
przez Swerdlowa i wsp. (2001) wśród 646 pacjentów
z ZK stwierdzono 2 przypadki śmiertelne z powodu raka
sutka. Dane porównano do szacunkowych wskaźników
dla populacji Wielkiej Brytanii i ustalono standaryzowany
wskaźnik umieralności¹ (SMR, ang. standardized
mortality rate) dla ZK – 61,7. W innym badaniu (Swerdlow
i wsp., 2005b) spośród 3518 mężczyzn z ZK w Wielkiej
Brytanii, 5 pacjentów zmarło z powodu raka sutka, a 4
było w trakcie choroby.
Inne choroby
Bojesen i wsp. (2006a) stwierdzili znacznie wyższą częstość
występowania guzów śródpiersia, niedokrwistości,
niedoczynności tarczycy, chorób sercowo -naczyniowych,
płuc, żołądkowo -jelitowych, reumatycznych, skórnych
i naczyniowych oraz autoimmunologicznych w grupie 832
pacjentów z ZK. Szczególnie wzrastało ryzyko systemowego
tocznia rumieniowatego w porównaniu do ogólnej
populacji męskiej, które było 14 -krotnie wyższe i zbliżone
do ryzyka zachorowania u kobiet. Zjawisko to sugeruje
wpływ dodatkowych genów na chromosomie X
(Rovenský, 2006; Sawalha i wsp., 2009). U 75 pacjentów
z ZK stwierdzono obniżone poziomy wolnej tyroksyny
bez wyrównawczego wzrostu stężenia hormonu tyreotropowego
w surowicy (Bjorn i wsp., 2009). Uważa się,
że za zwiększoną zachorowalność u pacjentów z ZK odpowiedzialny
jest hipogonadyzm, ale również jest to efekt
nieinaktywowanych genów na dodatkowym chromosomie
X. Możliwy jest także wpływ niższego statusu
socjoekonomicznego, który jest często związany z tym
zespołem (Bojesen i wsp., 2011).
Bojesen i wsp. (2004) stwierdzili zwiększone ryzyko
śmierci w ZK, na co wskazuje mediana przeżycia
niższa o 2,1 roku w porównaniu z grupą rówieśników.
Podwyższona śmiertelność była spowodowana infekcjami,
chorobami neurologicznymi, chorobami płuc
i układu moczowego.
Dane te zostały potwierdzone
1 Standaryzowany wskaźnik umieralności mężczyzn z ZK względem
wieku jest to wartość, która pokazuje, ilokrotnie obserwowany poziom
umieralności tych mężczyzn jest wyższy od tego, który występuje w danej
populacji, gdyby struktura wiekowa mężczyzn z ZK była zgodna ze strukturą
populacji przyjętej jako standard.
przez brytyjskie badanie oparte na 3518 pacjentach
z ZK, zdiagnozowanych w latach 1959–2003. Badanie
to pokazało SMR o wartości 1,5, w tym z powodu nowotworów
– 1,2, chorób sercowo -naczyniowych – 1,3, neurologicznych
– 2,1, schorzeń układu oddechowego – 2,3
(Swerdlow i wsp., 2005a). Wśród bardziej szczegółowych
kategorii ryzyko zgonu było szczególnie wysokie dla
cukrzycy – 5,8, padaczki – 5,2, zatorowości płucnej – 5,7,
chorób naczyń obwodowych – 7,9, naczyniopochodnej
niewydolności jelit – 12,3, wrodzonych anomalii sercowo-
-naczyniowych – 7,3, złamań kości udowej – 39. W przypadku
nowotworów najwyższe ryzyko zgonu wiązało się
z rakiem sutka i płuc oraz chłoniakiem nieziarniczym
(ang. non -Hodgkin lymphoma), natomiast mniejsze było
ryzyko zgonu z powodu raka gruczołu krokowego.
Rozwój mowy
Chłopcy z ZK mogą prezentować upośledzony rozwój
motoryczny i obniżone zdolności werbalne, dlatego często
potrzebują fi zjoterapii, terapii mowy oraz dodatkowej
pomocy edukacyjnej (Cohen i Durham, 1985a,b; Girardin
i wsp., 2009; Nielsen, 1990; Nielsen i Pelsen, 1987; Ross
i wsp., 2008; Rovet i wsp., 1995, 1996; Sorensen, 1992; Van
i wsp., 2008b). Funkcje poznawcze w ZK charakteryzują
się upośledzonym rozwojem mowy, koncentracji i zdolności
akademickich. U młodszych chłopców obserwuje się
postęp rozwoju mowy mimo jej opóźnienia, podczas gdy
u starszych pacjentów powszechny jest znaczący defi cyt
w funkcji ekspresywnej języka. Dodatkowo pacjenci z ZK
mają trudności w identyfi kacji i werbalizacji emocji (Van
i wsp., 2007) oraz łatwiej ulegają pobudzeniu emocjonalnemu
(Van i wsp., 2006a).
Problemy społeczne
Mężczyźni z ZK mają podwyższone ryzyko występowania
problemów społecznych (Ratcliff e, 1999; Van i wsp., 2006a).
W Danii wykazano, że pacjenci z ZK rzadziej tworzyli
związki partnerskie, posiadali mniej potomstwa, mieli
niższy poziom edukacji, osiągali niższe dochody oraz
wcześniej uzyskiwali świadczenia emerytalne w porównaniu
z grupą kontrolną (Bojesen i wsp., 2011). Ponadto
wśród mężczyzn z ZK stwierdzano znacznie wyższą
przestępczość kryminalną, podczas gdy wykroczenia
komunikacyjne i związane z narkotykami były rzadsze.
Jednakże, gdy wzięto pod uwagę status socjoekonomiczny,
okazało się, że liczba przestępstw wśród pacjentów z ZK
nie była istotnie większa (Stochholm i wsp., 2012).
Diagnostyka
W ultrasonografi i prenatalnej nie stwierdza się żadnych
szczególnych nieprawidłowości typowych dla ZK, dlatego
postawienie prenatalnej diagnozy zespołu jest zwykle
przypadkowe w ciążach, w których wykonuje się genetyczne
badania prenatalne ze względu na podwyższony
wiek matki i/lub podwyższone ryzyko trisomii autosomalnej
(Aksglaede i wsp., 2011b). U noworodków z ZK
na ogół występuje prawidłowy męski fenotyp. Można
podejrzewać ZK u dziecka z obustronnym wnętrostwem
lub małym prąciem, ale poza tym nie ma specyfi
cznych objawów prowadzących do diagnozy na tym
etapie życia.
Podczas dzieciństwa opóźnienie rozwoju motorycznego,
zaburzenia mowy, zachowania lub nadmierny
wzrost mogą prowadzić do podejrzenia zaburzeń genetycznych,
jednak dowiedziono, że tylko ok. 10% przypadków
zostaje zidentyfi kowanych przed okresem dojrzewania
płciowego (Bojesen i wsp., 2003). W okresie
pokwitania u chłopców diagnoza może być postawiona
w przypadku opóźnionego lub słabo postępującego dojrzewania
płciowego, ginekomastii, małych jąder oraz zaburzeń
zachowania lub wysokiego wzrostu. Zdecydowana
większość pacjentów z ZK jest identyfi kowana w życiu
dorosłym podczas diagnostyki niepłodności, hipogonadyzmu
lub ginekomastii (Aksglaede i wsp., 2011b). Średnia
wieku w momencie diagnozy w okresie dzieciństwa i dojrzewania
wynosi ok. 14 lat (0,25–17. r.ż.), podczas gdy
w życiu dorosłym – 29 lat (18.–57. r.ż.).
Zmniejszona świadomość występowania tego zespołu
wśród pracowników służby zdrowia i panujące ogólne
przekonanie, że wszyscy pacjenci z ZK wykazują klasyczny
fenotyp, skutkują późną diagnozą, a nawet
brakiem diagnozy u ok. 75% pacjentów. Tymczasem
wczesne wykrycie tego zespołu jest zalecane z powodu
możliwości leczenia na odpowiednim etapie rozwoju, aby
zapobiec powikłaniom związanym np. z hipogonadyzmem,
osteopenią/osteoporozą, zespołem metabolicznym,
dysfunkcjami neurorozwojowymi i psychospołecznymi.
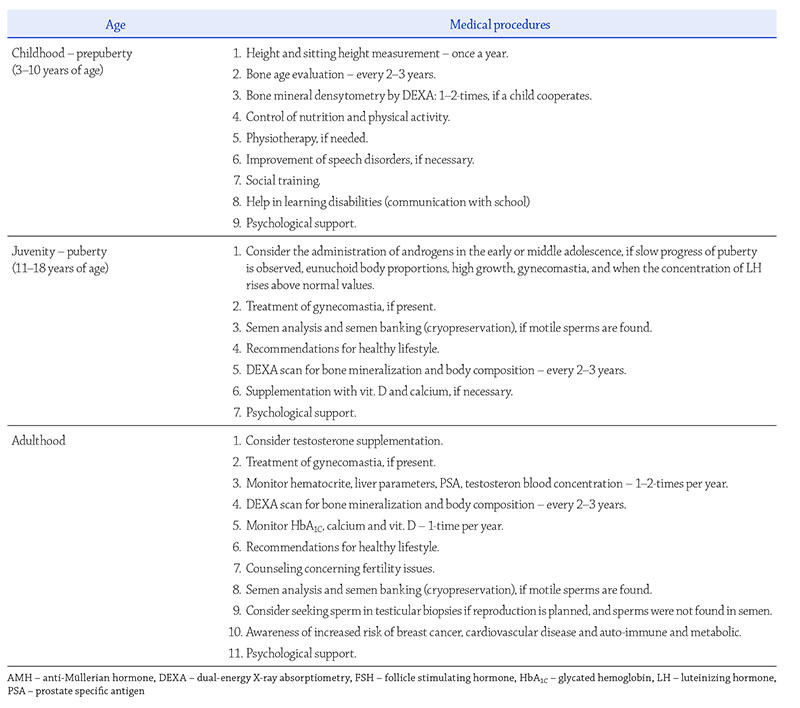
Postępowanie medyczne
Postępowanie medyczne u pacjentów z ZK jest zadaniem
wielodyscyplinarnym i dotyczy lekarzy pediatrów, endokrynologów
dziecięcych, endokrynologów/andrologów
dla dorosłych, specjalistów zajmujących się niepłodnością,
genetyków klinicznych, logopedów, fi zjoterapeutów, psychologów,
terapeutów zajęciowych i w razie potrzeby personelu
pomocniczego. Postępowanie medyczne powinno
być organizowane stosownie do wieku i wymagań
pacjenta (tabela 2).
U pacjentów z ZK wprowadza się substytucję preparatami
testosteronu zwykle w momencie stwierdzenia
jego niskich poziomów w surowicy krwi oraz objawów
klinicznych hipogonadyzmu (Kula i Słowikowska -Hilczer,
2014). Zwykle substytucję otrzymują dopiero dorośli mężczyźni,
ponieważ wcześniej wydzielanie testosteronu jest
wystarczające dla zapoczątkowania i postępu dojrzewania
płciowego. W niektórych jednak przypadkach obserwuje
się słaby postęp dojrzewania, pojawia się eunuchoidalna

AMH – anti-Müllerian hormone, DEXA – dual -energy X -ray absorptiometry, FSH – follicle stimulating hormone, HbA1C – glycated hemoglobin, LH – luteinizing hormone,
PSA – prostate specifi c antigen
budowa ciała, wysoki wzrost i ginekomastia. Wówczas
konieczne jest wcześniejsze wprowadzenie terapii androgenami,
zwykle we wczesnym lub środkowym okresie
dojrzewania płciowego, odpowiednio stadium GII lub
GIII według skali Tannera (Romer, 2011). Dawkowanie
preparatów testosteronu dostosowuje się do stężenia
tego hormonu w surowicy krwi, aby utrzymać go w granicach
normy. Do terapii substytucyjnej testosteronem
stosuje się preparaty podawane domięśniowo, doustnie
i przezskórnie (Nieschlag i Behre, 2010). Terapię tę stosuje
się dożywotnio w celu uniknięcia następstw defi cytu
androgenów. Należy kontrolować morfologię krwi (szczególnie
hematokryt), stężenie enzymów wątrobowych,
antygenu specyfi cznego dla prostaty (PSA, ang. prostate
specifi c antygen) z częstością 1–2 razy w roku oraz gęstość
mineralną kości metodą DEXA co 2–3 lata (Aksglaede
i wsp., 2013).
Wczesne rozpoznanie i leczenie znacząco polepsza
jakość życia pacjentów i chroni ich przed rozwojem chorób
towarzyszących, m.in. zespołu metabolicznego, chorób
układu krążenia. Pozwala na uzyskanie pełnego rozwoju
wtórnych męskich cech płciowych, prawidłowej masy
i siły mięśniowej oraz gęstości mineralnej kości, odpowiedniego
poziomu libido i sprawności seksualnej, a także
wpływa pozytywnie na nastrój, zachowanie, poczucie
własnej wartości, zmniejsza uczucie zmęczenia i drażliwość.
Podawanie testosteronu zwykle nie zmniejsza ginekomastii
u dorosłych pacjentów z ZK. Jedynym leczeniem
jest wówczas usunięcie chirurgiczne nadmiaru tkanki
gruczołowej, tłuszczowej, łącznej i skóry (Nieschlag i wsp.,
2010). Skuteczne może być leczenie antyestrogenami,
jeśli terapia zostanie zastosowana w okresie dojrzewania
płciowego, wkrótce po pojawieniu się powiększenia gruczołów
piersiowych. Pod wpływem terapii testosteronem
zanika niedokrwistość i poprawia się gęstość mineralna
kości. Korzystne efekty działania testosteronu u chorych
ze stabilną chorobą wieńcową oraz u tych z przewlekłymi
schorzeniami mięśnia sercowego są opisywane
zarówno u eugonadalnych mężczyzn, jak i hipogonadyków
(English i wsp., 2000). Substytucja testosteronu koryguje objawy defi cytu
androgenów, ale nie wpływa na poprawę płodności.
Niektórzy pacjenci z ZK, wytwarzający w jądrach plemniki,
mają szansę na ojcostwo dzięki technikom rozrodu
wspomaganego (ART, ang. assisted reproductive technology),
przede wszystkim dzięki technice iniekcji plemnika
lub dojrzałej spermatydy do cytoplazmy komórki jajowej
(ICSI, ang. intracytoplasmic sperm injection). Męskie komórki
płciowe uzyskuje się z nasienia mężczyzn z ZK (ok. 8–10%
mężczyzn ma pojedyncze plemniki w nasieniu, zwłaszcza
pacjenci z kariotypem mozaikowym 46,XY/47,XXY).
W niektórych przypadkach azoospermii można uzyskać
plemniki dzięki mikrochirurgicznej aspiracji z najądrzy
(MESA, ang. microsurgical epididymal sperm aspiration) lub
ich pobraniu z jądra (TESE, ang. testicular sperm extraction),
gdyż pomimo zaburzonego rozwoju jąder mogą ogniskowo
istnieć kanaliki z pełną spermatogenezą (Sciurano i wsp.,
2009). Młodzi mężczyźni mają większą szansę na uzyskanie
plemników (Bryson i wsp., 2014; Ramasamy i wsp.,
2009). Z tego powodu proponuje się zamrażanie nasienia
od chłopców z ZK w okresie dojrzewania płciowego lub
od młodych mężczyzn (jeśli znajdzie się ruchliwe plemniki
w nasieniu), zanim dojdzie do całkowitej degeneracji
nabłonka plemnikotwórczego i zanim rozpocznie się substytucję
testosteronem. Proponuje się również pobranie
bioptatu z jądra i poszukiwanie spermatyd, a następnie
ich zamrożenie do wykorzystania w przyszłości w procedurze
ICSI (Plotton i wsp., 2015). Ocena histopatologiczna
bioptatu z jądra jest najlepszym sposobem oszacowania
szans na pozyskanie męskich komórek płciowych do ICSI
(Aksglaede i Juul, 2013; Damani i wsp., 2001). Powodzenie
procedury ICSI u pacjentów z ZK, u których nie stwierdzono
kariotypu mozaikowatego, jest porównywalne
z tym, które występuje u mężczyzn z prawidłowym
kariotypem cierpiących na azoospermię nieobturacyjną
(Vernaeve i wsp., 2004). W niektórych badaniach
stwierdzono, że mężczyźni, którzy dobrze odpowiadają
na podanie inhibitorów aromatazy, klomifenu, ludzkiej
gonadotropiny kosmówkowej (hCG, ang. human chorionic
gonadotropin), mają większą szansę na pozyskanie plemników
z bioptatów (Ramasamy i wsp., 2009), jednak inne
badania tego nie potwierdziły (Reifsnyder i wsp., 2012).
Po raz pierwszy opisano zapłodnienie plemnikami mężczyzny
z ZK z kariotypem 47,XXY, uzyskane w sposób
naturalny w 1982 r. (Laron i wsp., 1982), a skuteczną próbę
zapłodnienia metodą ICSI w 1997 r. (Bourne i wsp., 1997).
Panuje pogląd, że mężczyźni z ZK mają małe szanse na biologiczne
ojcostwo. Zatem nie należy tym pacjentom robić
zbyt dużych nadziei. Niemniej jednak w tych przypadkach,
coraz częściej opisywane są skuteczne próby uzyskania
ciąży metodami rozrodu wspomaganego. Z metaanalizy
publikacji z lat 1980–2009 przeprowadzonej przez
Fullerton i wsp. (2010) wynika, że poszukiwania plemników
w jądrach mężczyzn z ZK (bez kariotypu mozaikowego)
w średnio 44% (16–60%) kończą się sukcesem. Pacjenci,
a w przypadku młodzieży także rodzice powinni być poinformowani
o takich możliwościach. Jednak opóźniony
rozwój emocjonalny i psychospołeczny pacjentów z ZK,
często brak partnerki i odległych planów życiowych,
zwłaszcza u młodych osób, może utrudniać decyzję o rozpoczęciu
takiego postępowania.
Większość dzieci mężczyzn z ZK ma prawidłowy
kariotyp (Morel i wsp., 2003; Lanfranco i wsp., 2004).
Należy jednak pamiętać, że istnieją doniesienia o zwiększonej
częstości autosomalnych aneuploidii w plemnikach
mężczyzn z ZK bez kariotypu mozaikowego. Szczególnie
częste są disomie chromosomów 13, 18, 21. Błędy chromosomalne
mogą być dziedziczone przez potomstwo
mężczyzn z ZK, dlatego ważne jest, aby omówić z parami
starającymi się o dziecko ryzyko zaburzeń genetycznych
u potomstwa oraz potrzebę genetycznej diagnostyki przedimplantacyjnej
i diagnostyki prenatalnej (Nieschlag, 2013).
Badania przesiewowe
Herlihy i wsp. (2010, 2011) w swoich pracach rozważają
krótko - i długoterminowe korzyści płynące z populacyjnych
badań przesiewowych w kierunku ZK, ponieważ
problemem jest obecnie brak diagnostyki i brak lub późne
rozpoznanie tego zespołu. Jaki jest jednak odpowiedni
wiek do tych badań? W jaki sposób stworzyć odpowiednią
opiekę medyczną i psychologiczną dla pacjentów z ZK
w różnym wieku? Czy poprawi to ich jakość życia?
Nowoczesne metody genetyczne otwierają możliwość
prowadzenia badań przesiewowych opartych na olbrzymich
populacjach (Aksglaede i wsp., 2012; Inaba i wsp.,
2012). Jednakże kwestie społeczne, prawne i etyczne
oraz potencjalne, pozytywne i negatywne, konsekwencje
diagnozy powinny być dokładnie przemyślane, zanim
takie badania zostaną wprowadzone.
Piśmiennictwo
Aksglaede L., Andersson A.M., Jorgensen N., Jensen T.K., Carlsen E., McLachlan R.I.
i wsp.: Primary testicular failure in Klinefelter’s syndrome: Th e use of bivariate
luteinizing hormonetestosterone reference charts. Clin Endocrinol (Oxf). 2007a,
66, 276–281. doi: 10.1111/j.1365-2265.2006.02722.x. PMID: 17223999.
Aksglaede L., Christiansen P., Sorensen K., Boas M., Linneberg A., Main K.M. i wsp.:
Serum concentrations of Anti -Mullerian Hormone (AMH) in 95 patients
with Klinefelter syndrome with or without cryptorchidism. Acta Paediatr.
2011a, 100, 839–845. doi: 10.1111/j.1651-2227.2011.02148.x. PMID:
21251056.
Aksglaede L., Garn I., Hollegaard M., Hougaard D., Rajpert -De Meyts E., Juul A.:
Detection of increased gene copy number in DNA from dried blood spot
samples allows effi cient screening for Klinefelter syndrome. Acta Paediatr.
2012, 101, 561–563. doi: 10.1111/apa.12008. PMID: 22928958.
Aksglaede L., Juul A.: Testicular function and fertility in men with Klinefelter
syndrome: a review. Eur J Endocrinol. 2013, 168 (4), 67–76. doi: 10.1530/
EJE-12-0934. PMID: 23504510.
Andersson A.M., Juul A., Petersen J.H., Muller J., Groome N.P., Skakkebaek N.E.:
Serum inhibin B in healthy pubertal and adolescent boys: Relation to age,
stage of puberty, and follicle -stimulating hormone, luteinizing hormone, testosterone,
and estradiol levels. J Clin Endocrinol Metab. 1997, 82, 3976–3981.
doi: http://dx.doi.org/10.1210/jcem.82.12.4449.
Aksglaede L., Link K., Giwercman A., Jørgensen N., Skakkebaek N.E., Juul A.:
47,XXY Klinefelter syndrome: clinical characteristics and age -specifi c
recommendations for medical management. Am J Med Genet C Semin
Med Genet. 2013, 163C (1), 55–63. doi: 10.1002/ajmg.c.31349. PMID:
23345262.
Aksglaede L., Molgaard C., Skakkebaek N.E., Juul A.: Normal bone mineral
content but unfavourable muscle/fat ratio in Klinefelter syndrome.
Arch Dis Child. 2008a, 93, 30–34. doi: 10.1136/adc.2007.120675. PMID:
17916585.
Aksglaede L., Petersen J.H., Main K.M., Skakkebaek N.E., Juul A.: High normal
testosterone levels in infants with non -mosaic Klinefelter’s syndrome.
Eur J Endocrinol. 2007b, 157, 345–350. doi: 10.1530/EJE-07-0310. PMID:
17766718.
Aksglaede L., Skakkebaek N.E., Almstrup K., Juul A.: Clinical and biological
parameters in 166 boys, adolescents and adults with nonmosaic
Klinefelter syndrome: A Copenhagen experience. Acta Paediatr. 2011b,
100, 793–806. doi: 10.1111/j.1651-2227.2011.02246.x. PMID: 21362037.
Aksglaede L., Skakkebaek N.E., Juul A.: Abnormal sex chromosome constitution
and longitudinal growth: Serum levels of insulin -like growth factor
(IGF) -I, IGF binding protein -3, luteinizing hormone, and testosterone in
109 males with 47, XXY, 47,XYY, or sex -determining region of the Y chromosome
(SRY) -positive 46,XX karyotypes. J Clin Endocrinol Metab. 2008b,
93, 169–176. doi: http://dx.doi.org/10.1210/jc.2007-1426. PMID: 17940117.
Aksglaede L., Sorensen K., Boas M., Mouritsen A., Hagen C.P., Jensen R.B. i wsp.:
Changes in anti -Mullerian hormone (AMH) throughout the life span:
A population -based study of 1027 healthy males from birth (cord blood)
to the age of 69 years. J Clin Endocrinol Metab. 2010, 95, 5357–5364. doi:
10.1210/jc.2010-1207. PMID: 20843948.
Aksglaede L., Wikstrom A.M., Rajpert -De Meyts E., Dunkel L., Skakkebaek N.E.,
Juul A.: Natural history of seminiferous tubule degeneration in Klinefelter
syndrome. Hum Reprod Update. 2006, 12, 39–48. doi: 10.1093/humupd/
dmi039. PMID: 16172111.
van Assche E., Bonduelle M., Tournaye H., Joris H., Verheyen G., Devroey P. i wsp.:
Cytogenetics of infertile men. Hum Reprod. 1996,11, 1–24. doi: 10.1093/
humrep/11.suppl_4.1. PMID: 9147109.
Bardsley M.Z., Falkner B., Kowal K., Ross J.L.: Insulin resistance and metabolic
syndrome in prepubertal boys with Klinefelter syndrome. Acta
Paediatr. 2011, 100, 866–870. doi: 10.1111/j.1651-2227.2011.02161.x.
PMID: 21251059.
Bastida M.G., Rey R.A., Bergada I., Bedecarras P., Andreone L., del Rey G. i wsp.:
Establishment of testicular endocrine function impairment during childhood
and puberty in boys with Klinefelter syndrome. Clin Endocrinol (Oxf). 2007,
67, 863–870. doi: 10.1111/j.1365-2265.2007.02977.x. PMID: 17645574.
Bay K., Hartung S., Ivell R., Schumacher M., Jurgensen D., Jorgensen N. i wsp.:
Insulin -like factor 3 (INSL3) serum levels in 135 normal men and 85 men
with testicular disorders: article american journal of medical genetics part
c (seminars in medical genetics) 61 Relationship to the LH -testosterone
axis. J Clin Endocrinol Metab. 2005, 90, 3410–3418. doi: http://dx.doi.
org/10.1210/jc.2004-2257. PMID: 15755855.
Bjorn A.M., Bojesen A., Gravholt C.H., Laurberg P.: Hypothyroidism secondary
to hypothalamic -pituitary dysfunction may be part of the phenotype in
Klinefelter syndrome: A case -control study. J Clin Endocrinol Metab. 2009,
94, 2478–2481. doi: 10.1210/jc.2009-0365. PMID: 19401367.
Bojesen A., Birkebaek N., Kristensen K., Heickendorff L., Mosekilde L., Christiansen
J.S. i wsp.: Bone mineral density in Klinefelter syndrome is reduced and
primarily determined by muscle strength and resorptive markers, but not
directly by testosterone. Osteoporos Int. 2010, 22, 1441–1450. doi: 10.1007/
s00198-010-1354-7. PMID: 20658127.
Bojesen A., Juul S., Birkebaek N., Gravholt C.H.: Increased mortality in
Klinefelter syndrome. J Clin Endocrinol Metab. 2004, 89, 3830–3834.
doi: http://dx.doi.org/10.1210/jc.2004-0777. PMID: 15292313.
Bojesen A., Juul S., Birkebaek N.H., Gravholt C.H.: Morbidity in Klinefelter syndrome:
A Danish register study based on hospital discharge diagnoses. J Clin
Endocrinol Metab. 2006a, 91, 1254–1260. doi: http://dx.doi.org/10.1210/
jc.2005-0697. PMID: 16394093.
Bojesen A., Juul S., Gravholt C.H.: Prenatal and postnatal prevalence of
Klinefelter syndrome: A national registry study. J Clin Endocrinol Metab.
2003, 88, 622–626. doi: http://dx.doi.org/10.1210/jc.2002-021491. PMID:
12574191.
Bojesen A., Kristensen K., Birkebaek N.H., Fedder J., Mosekilde L., Bennett P. i wsp.:
Th e metabolic syndrome is frequent in Klinefelter’s syndrome and is associated
with abdominal obesity and hypogonadism. Diabetes Care. 2006b,
29, 1591–1598. doi: 10.2337/dc06-0145. PMID: 16801584.
Bojesen A., Stochholm K., Juul S., Gravholt C.H.: Socioeconomic trajectories
aff ect mortality in Klinefelter syndrome. J Clin Endocrinol Metab. 2011,
96, 2098–2104. doi: 10.1210/jc.2011-0367. PMID: 21565794.
Bourne H., Stern K., Clarke G., Pertile M., Speirs A., Baker H.W.: Delivery of
normal twins following the intracytoplasmic injection of spermatozoa
from a patient with 47,XXY Klinefelter’s syndrome. Hum Reprod. 1997,
12, 2447–2450. doi: 10.1093/humrep/12.11.2447. PMID: 9436682.
Bryson C.F., Ramasamy R., Sheehan M., Palermo G.D., Rosenwaks Z., Schlegel P.N.:
Severe testicular atrophy does not aff ect the success of microdissection
testicular sperm extraction. J Urol. 2014, 191 (1), 175–178. doi: 10.1016/j.
juro.2013.07.065. PMID: 23911635.
Cabrol S., Ross J.L., Fennoy I., Bouvattier C., Roger M., Lahlou N.: Assessment
of Leydig and Sertoli cell functions in infants with nonmosaic Klinefelter
syndrome: Insulin -like peptide 3 levels are normal and positively correlated
with LH levels. J Clin Endocrinol Metab. 2011, 96, e746–e753. doi:
10.1210/jc.2010-2103. PMID: 21307139.
Christiansen P., Andersson A.M., Skakkebaek N.E.: Longitudinal studies of
inhibin B levels in boys and young adults with Klinefelter syndrome. J Clin
Endocrinol Metab. 2003, 88, 888–891. doi: http://dx.doi.org/10.1210/
jc.2002-021379. PMID: 12574229.
Cohen F.L., Durham J.D.: Klinefelter syndrome. J Psychosoc Nurs Ment
Health Serv. 1985, 23, 19–25. doi: 10.3928/0279-3695-19850101-05.
PMID: 3844477.
Cohen F.L., Durham J.D.: Sex chromosome variations in school -age children.
J Sch Health. 1985, 55, 99–102. doi: 10.1111/j.1746-1561.1985.tb04089.x.
PMID: 3845264.
Damani M.N., Mittal R., Oates R.D.: Testicular tissue extraction in a young
male with 47,XXY Klinefelter’s syndrome: potential strategy for preservation
of fertility. Fertil Steril. 2001, 76, 1054–1056. doi: 10.1016/S0015-
0282(01)02837-0. PMID: 11704135.
English K.M., Steeds R.P., Jones T.H., Diver M.J., Channers K.S.: Low -dose
transdermal testosterone therapy improves angina threshold in men with
chronic stable angina. Circulation. 2000, 102, 1906–1911. doi: 10.1161/01.
CIR.102.16.1906. PMID: 11034937.
Ferlin A., Perilli L., Gianesello L., Taglialavoro G., Foresta C.: Profi ling insulin
like factor 3 (INSL3) signaling in human osteoblasts. PLoS ONE. 2011a, 6,
e29733. doi: 10.1371/journal.pone.0029733. PMID: 22216350.
Ferlin A., Schipilliti M., Di Mambro A., Vinanzi C., Foresta C.: Osteoporosis
in Klinefelter’s syndrome. Mol Hum Reprod. 2010, 16 (6), 402–410. doi:
10.1093/molehr/gaq026. PMID: 20348548.
Ferlin A., Schipilliti M., Foresta C.: Bone density and risk of osteoporosis
in Klinefelter syndrome. Acta Paediatr. 2011c, 100, 878–884. doi:
10.1111/j.1651-2227.2010.02138.x. PMID: 21214887.
Ferlin A., Schipilliti M., Vinanzi C., Garolla A., Di Mambro A., Selice R. i wsp.:
Bone mass in subjects with Klinefelter syndrome: Role of testosterone levels
and androgen receptor gene CAG polymorphism. J Clin Endocrinol Metab.
2011b, 96, 739–745. doi: 10.1210/jc.2010-1878. PMID: 21270324.
Finkelstein J.S., Klibanski A., Neer R.M., Greenspan S.L., Rosenthal D.I.,
Crowley W.F. Jr.: Osteoporosis in men with idiopathic hypogonadotropic
hypogonadism. Ann Intern Med. 1987, 106, 354–361. doi: 10.7326/0003-
4819-106-3-399. PMID: 3544993.
Foresta C., Bettella A., Vinanzi C., Dabrilli P., Meriggiola M.C., Garolla A. i wsp.:
A novel circulating hormone of testis origin in humans. J Clin Endocrinol
Metab. 2004, 89, 5952–5958. doi: http://dx.doi.org/10.1210/jc.2004-0575.
PMID: 15579743.
Fullerton G., Hamilton M., Maheshwari A.: Should non -mosaic Klinefelter
syndrome men be labelled as infertile in 2009? Hum Reprod. 2010, 25 (3),
588–597. doi: 10.1093/humrep/dep431. PMID: 20085911.
Girardin C.M., Lemyre E., Alos N., Deal C., Huot C., Van V.G.: Comparison of
adolescents with Klinefelter syndrome according to the circumstances of
diagnosis: Amniocentesis versus clinical signs. Horm Res. 2009, 72, 98–105.
doi: 10.1159/000232162. PMID: 1969042.
Herlihy A.S., Gillam L., Halliday J.L., McLachlan R.I.: Postnatal screening for
Klinefelter syndrome: Is there a rationale? Acta Paediatr. 2011, 100, 923–933.
doi: 10.1111/j.1651-2227.2011.02151.x. PMID: 21226761.
Herlihy A.S., Halliday J., McLachlan R.I., Cock M., Gillam L.: Assessing the
risks and benefi ts of diagnosing genetic conditions with variable phenotypes
through population screening: Klinefelter syndrome as an example.
J Commun Genet. 2010, 1, 41–46. doi: 10.1007/s12687-010-0006-0.
PMID: 22422359.
Horowitz M., Wishart J.M., O’Loughlin P.D., Morris H.A., Need A.G., Nordin B.E.:
Osteoporosis and Klinefelter’s syndrome. Clin Endocrinol (Oxf). 1992, 36,
113–118. doi: 10.1111/j.1365-2265.1992.tb02910.x. PMID: 1532769.
Inaba Y., Herlihy A.S., Schwartz C.E., Skinner C., Bui Q.M., Cobb J. i wsp.: Fragile
X -related element 2 methylation analysis may provide a suitable option for
inclusion of fragile X syndrome and/or sex chromosome aneuploidy into
newborn screening: A technical validation study. Genet Med. 2013, 15 (4),
290–298. doi: 10.1038/gim.2012.134. PMID: 23060046.
Klinefelter H.F., Reifenstein E.C., Albright F.: Syndrome characterized by gynecomastia,
aspermatogenesis without a -Leydigism, and increased excretion
of follicle -stimulating hormone. J Clin Endocrinol. 1942, 2, 615–627. doi:
http://dx.doi.org/10.1210/jcem-2-11-615.
Kula K., Słowikowska -Hilczer J.: Choroby jąder. W: Interna Szczeklika,
Gajewski P. (red.). Medycyna Praktyczna, Kraków 2014, 1303–1311.
Lahlou N., Fennoy I., Carel J.C., Roger M.: Inhibin B and anti -Müllerian hormone,
but not testosterone levels, are normal in infants with nonmosaic
Klinefelter syndrome. J Clin Endocrinol Metab. 2004, 89, 1864–1868. doi:
http://dx.doi.org/10.1210/jc.2003-031624. PMID: 15070957.
Lanfranco F., Kamischke A., Zitzmann M., Nieschlag E.: Klinefelter’s syndrome.
Lancet. 2004, 364, 273–283. doi:10.1016/S0140-6736(04)16678-6. PMID:
15262106.
Laron Z., Dickerman Z., Zamir R., Galatzer A.: Paternity in Klinefelter’s
syndrome: a case report. Arch Androl. 1982, 8, 149–151. doi: 10.3109/
01485018208987032. PMID: 6803694.
Main K.M., Schmidt I.M., Toppari J., Skakkebaek N.E.: Early postnatal treatment
of hypogonadotropic hypogonadism with recombinant human FSH
and LH. Eur J Endocrinol. 2002, 146, 75–79. doi: 10.1530/eje.0.1460075.
PMID: 11751071.
Morel F., Bernicot I., Herry A., Le Bris M.J., Amice V., De Braekeleer M.: An
increased incidence of autosomal aneuploidies in spermatozoa from a patient
with Klinefelter’s syndrome. Fertil Steril. 2003, 79, 1644–1646. doi: 10.1016/
S0015-0282(03)00343-1. PMID: 12801572.
Nielsen J.: Follow -up of 25 unselected children with sex chromosome abnormalities
to age 12. Birth Defects Orig Artic Ser. 1990, 26, 201–207. PMID:
2090318.
Nielsen J., Pelsen B.: Follow -up 20 years later of 34 Klinefelter males with
karyotype 47,XXY and 16 hypogonadal males with karyotype 46,XY. Hum
Genet. 1987, 77, 188–192. doi: 10.1007/BF00272390. PMID: 3653891.
Nielsen J., Wohlert M.: Sex chromosome abnormalities found among 34,910
newborn children: Results from a 13 -year incidence study in Arhus, Denmark.
Birth Defects Orig Artic Ser. 1990, 26, 209–223. doi: 10.1007/BF01213097.
PMID: 2090319.
Nieschlag E.: Klinefelter syndrome: the commonest form of hypogonadism,
but often overlooked or untreated. Dtsch Arztebl Int. 2013, 110 (20),
347–353. doi: 10.3238/arztebl.2013.0347. PMID: 2382548.
Nieschlag E., Behre H.: Testosterone therapy. W: Andrology. Male reproductive
health and dysfunction. Nieschlag E., Behre H.M., Nieschlag S. (red.).
Springer–Verlag, Heidelberg–Berlin 2010, 437–453.
Nieschlag E., Behre H., Wieacker P., Meschede D., Kamischke A., Kliesch S.:
Disorders at the testicular level. W: Andrology. Male reproductive health
and dysfunction. Nieschlag E., Behre H.M., Nieschlag S. (red.). Springer-
-Verlag, Heidelberg–Berlin 2010, 192–238.
Ottesen A.M., Aksglaede L., Garn I., Tartaglia N., Tassone F., Gravholt C.H. i wsp.:
Increased number of sex chromosomes aff ects height in a nonlinear fashion:
A study of 305 patients with sex chromosome aneuploidy. Am J Med
Genet. Part A. 2010, 152A, 1206–1212. doi: 10.1002/ajmg.a.33334. PMID:
20425825.
Plotton I., Giscard d’Estaing S., Cuzin B., Brosse A., Benchaib M., Lornage J. i wsp.:
Preliminary results of a prospective study of testicular sperm extraction
in young versus adult patients with nonmosaic 47,XXY Klinefelter syndrome.
J Clin Endocrinol Metab. 2015, 100 (3), 961–967. doi: 10.1210/
jc.2014-3083. PMID: 25423570.
Ramasamy R., Ricci J.A., Palermo G.D., Gosden L.V., Rosenwaks Z., Schlegel P.N.:
Successful fertility treatment for Klinefelter’s syndrome. J Urol. 2009, 182
(3), 1108–1113. doi: 10.1016/j.juro.2009.05.019. PMID: 19616796.
Rao E., Weiss B., Fukami M., Rump A., Niesler B., Mertz A. i wsp.: Pseudoautosomal
deletions encompassing a novel homeobox gene cause growth failure in idiopathic
short stature and Turner syndrome. Nat Genet. 1997b, 16, 54–63.
doi: 10.1038/ng0597-54. PMID: 9140395.
Rao E., Weiss B., Fukami M., Mertz A., Meder J., Ogata T. i wsp.: FISH -deletion
mapping defi nes a 270 -kb short stature critical interval in the pseudoautosomal
region PAR1 on human sex chromosomes. Hum Genet. 1997a, 100,
236–239. doi: 10.1007/s004390050497. PMID: 9254856.
Rappold G.A., Durand C., Decker E., Marchini A., Schneider K.U.: New roles of
SHOX as regulator of target genes. Pediatr Endocrinol Rev. 2012, 9, 733–738.
doi: 10.1297/cpe.23.65. PMID: 22946287.
Ratcliff e S.: Long -term outcome in children of sex chromosome abnormalities.
Arch Dis Child. 1999, 80, 192–195. doi: 10.1136/adc.80.2.192. PMID:
10325742.
Ratcliff e S.G.: Th e sexual development of boys with the chromosome constitution
47, XXY (Klinefelter’s syndrome). Clin Endocrinol Metab. 1982, 11,
703–716. doi: 10.1016/S0300-595X(82)80008-X. PMID: 7139994.
Ratcliff e S.G., Butler G.E., Jones M.: Edinburgh study of growth and development
of children with sex chromosome abnormalities. IV. Birth Defects
Orig Artic Ser. 1990, 26, 1–44. PMID: 2090314.
Reifsnyder J.E., Ramasamy R., Husseini J., Schlegel P.N.: Role of optimizing
testosterone before microdissection testicular sperm extraction in men
with nonobstructive azoospermia. J Urol. 2012, 188 (2), 532–536. doi:
10.1016/j.juro.2012.04.002. PMID: 22704105.
Romer T.E.: Zaburzenia wzrastania i dojrzewania płciowego. Medical Tribune,
Warszawa 2011.
Ross J.L., Roeltgen D.P., Stefanatos G., Benecke R., Zeger M.P., Kushner H. i wsp.:
Cognitive and motor development during childhood in boys with Klinefelter
syndrome. Am J Med Genet. Part A. 2008, 146A, 708–719. doi: 10.1002/
ajmg.a.32232. PMID: 18266239.
Ross J.L., Samango -Sprouse C., Lahlou N., Kowal K., Elder F.F., Zinn A.: Early
androgen defi ciency in infants and young boys with 47,XXY Klinefelter
syndrome. Horm Res. 2005, 64, 39–45. PMID: 16088206.
Rovensky J.: Rheumatic diseases and Klinefelter’s syndrome. Autoimmun Rev.
2006, 6, 33–36. doi: 10.1016/j.autrev.2006.03.005. PMID: 17110314.
Rovet J., Netley C., Bailey J., Keenan M., Stewart D.: Intelligence and achievement
in children with extra X aneuploidy: Alongitudinal perspective. Am J Med Genet. Part A. 1995, 60A, 356–363. doi: 10.1002/ajmg.1320600503.
PMID: 8546146.
Rovet J., Netley C., Keenan M., Bailey J., Stewart D.: Th e psychoeducational profi
le of boys with Klinefelter syndrome. J Learn Disabil. 1996, 29, 180–196.
doi: 10.1177/002221949602900208. PMID: 8820203.
Salbenblatt J.A., Bender B.G., Puck M.H., Robinson A., Faiman C., Winter J.S.:
Pituitary gonadal function in Klinefelter syndrome before and during puberty.
Pediatr Res. 1985, 19, 82–86. doi: 10.1203/00006450-198501000-00022.
PMID: 3918293.
Sawalha A.H., Harley J.B., Scofi eld R.H.: Autoimmunity and Klinefelter’s
syndrome: When men have two X chromosomes. J Autoimmun. 2009, 33,
31–34. doi: 10.1016/j.jaut.2009.03.006. PMID: 19464849.
Schibler D., Brook C.G., Kind H.P., Zachmann M., Prader A.: Growth and body
proportions in 54 boys and men with Klinefelter’s syndrome. Helv Paediatr
Acta. 1974, 29 (40), 325–333. PMID: 4372201.
Sciurano R.B., Luna Hisano C.V., Rahn M.I., Brugo Olmedo S., Rey Valzacchi G.,
Coco R. i wsp.: Focal spermatogenesis originates in euploid germ cells in classical
Klinefelter patients. Hum Reprod. 2009, 24, 2353–2361. doi: 10.1093/
humrep/dep180. PMID: 19443454.
Seeman E., Melton L.J. III, O’Fallon W.M., Riggs B.L.: Risk factors for spinal
osteoporosis in men. Am J Med. 1983, 75, 977–983. doi: 10.1016/0002-
9343(83)90878-1. PMID: 6650552.
Smals A.G., Kloppenborg P.W., Benraad T.J.: Body proportions and androgenicity
in relation to plasma testosterone levels in Klinefelter’s syndrome.
Acta Endocrinol (Copenh). 1974, 77, 387–400. doi: 10.1530/acta.0.0770387.
PMID: 4479330.
Sorensen K.: Physical and mental development of adolescent males with
Klinefelter syndrome. Horm Res. 1992, 37, 55–61. doi :10.1159/000182402.
PMID: 1427643.
Stewart J.S., Mack W.S., Govan A.D., Ferguson -Smith M.A., Lennox B.:
Klinefelter’s syndrome: Clinical and hormonal aspects. Q J Med. 1959,
28, 561–571. doi: 616.64-007-071. PMID: 13834600.
Stewart D.A., Netley C.T., Park E.: Summary of clinical fi ndings of children
with 47,XXY,47,XYY, and 47,XXX karyotypes. Birth Defects Orig Artic Ser.
1982, 18, 1–5. PMID: 7159715.
Stochholm K., Bojesen A., Jensen A.S., Juul S., Gravholt C.H.: Criminality
in men with Klinefelter’s syndrome and XYY syndrome: A cohort study.
BMJ Open. 2012, 2, e000650. doi: 10.1136/bmjopen-2011-000650. PMID:
22357573.
Swerdlow A.J., Hermon C., Jacobs P.A., Alberman E., Beral V., Daker M. i wsp.:
Mortality and cancer incidence in persons with numerical sex chromosome
abnormalities: A cohort study. Ann Hum Genet. 2001, 65, 177–188. doi:
http://dx.doi.org/10.1017/S0003480001008569. PMID: 11427177.
Swerdlow A.J., Higgins C.D., Schoemaker M.J., Wright A.F., Jacobs P.A.: Mortality
in patients with Klinefelter syndrome in Britain: A cohort study. J Clin
Endocrinol Metab. 2005a, 90, 6516–6522. doi: http://dx.doi.org/10.1210/
jc.2005-1077. PMID: 16204366.
Swerdlow A.J., Schoemaker M.J., Higgins C.D., Wright A.F., Jacobs P.A.: Cancer
incidence and mortality in men with Klinefelter syndrome: A cohort study.
J Natl Cancer Inst. 2005b, 97, 1204–1210. doi: 10.1093/jnci/dji240. PMID:
16106025.
Tanner J.M., Prader A., Habich H., Ferguson -Smith M.A.: Genes on the Y chromosome
infl uencing rate of maturation in man: Skeletal age studies in children
with Klinefelter’s (XXY) and Turner’s (XO) syndromes. Lancet. 1959, 2,
141–144. doi: 10.1016/S0140-6736(59)90558-6. PMID: 13836841.
Tanner J.M., Whitehouse R.H., Hughes P.C., Carter B.S.: Relative importance of
growth hormone and sex steroids for the growth at puberty of trunk length,
limb length, and muscle width in growth hormone -defi cient children. J Pediatr.
1976, 89, 1000–1008. doi: 10.1016/S0022-3476(76)80620-8. PMID: 993900.
Timar O., Sestier F., Levy E.: Metabolic syndrome X: A review. Can J Cardiol.
2000, 16, 779–789. PMID: 10863169.
Topper E., Dickerman Z., Prager -Lewin R., Kaufman H., Maimon Z., Laron Z.:
1982. Puberty in 24 patients with Klinefelter syndrome. Eur J Pediatr. 1982,
139, 8–12. doi: 10.1007/BF00442070. PMID: 6816603.
Van R.S., Aleman A., Swaab H., Kahn R.: Klinefelter’s syndrome (karyotype
47,XXY) and schizophrenia -spectrum pathology. Br J Psychiatry. 2006a,
189, 459–460. doi: 10.1192/bjp.bp.105.008961. PMID: 17077438.
Van R.S., Aleman A., Swaab H., Krijn T., Vingerhoets G., Kahn R.: What it is
said versus how it is said: Comprehension of aff ective prosody in men with
Klinefelter (47,XXY) syndrome. J Int Neuropsychol Soc. 2007, 13, 1065–1070.
doi: http://dx.doi.org/10.1017/S1355617707071044. PMID: 17942024.
Van R.S., Aleman A., Swaab H., Vink M., Sommer I., Kahn R.S.: Eff ects of
an extra X chromosome on language lateralization: An fMRI study with
Klinefelter men (47,XXY). Schizophr Res. 2008a, 101, 17–25. doi: 10.1016/j.
schres.2008.02.001. PMID: 1837216.
Van R.S., Swaab H., Aleman A., Kahn R.S.: Social behavior and autism traits
in a sex chromosomal disorder: Klinefelter (47XXY) syndrome. J Autism
Dev Disord. 2008b, 38, 1634–1641. doi: 10.1007/s10803-008-0542-1.
PMID: 18324463.
Van R.S., Swaab H., Aleman A., Kahn R.S.: X Chromosomal eff ects on social
cognitiveprocessing and emotion regulation: A study with Klinefelter
men (47,XXY). Schizophr Res. 2006b, 84, 194–203. doi: 10.1016/j.
schres.2006.02.020. PMID: 16603340.
Vernaeve V., Staessen C., Verheyen G., Van Steirteghem A., Devroey P., Tournaye H.:
Can biological or clinical parameters predict testicular sperm recovery in
47,XXY Klinefelter’s syndrome patients? Hum Reprod. 2004, 19, 1135–1139.
doi: 10.1093/humrep/deh253. PMID: 15070870.
Wikstrom A.M., Bay K., Hero M., Andersson A.M., Dunkel L.: Serum insulin-
-like factor 3 levels during puberty in healthy boys and boys with Klinefelter
syndrome. J Clin Endocrinol Metab. 2006a, 91, 4705–4708. doi: http://
dx.doi.org/10.1210/jc.2006-0669. PMID: 16926256.
Wikstrom A.M., Dunkel L., Wickman S., Norjavaara E., Ankarberg -Lindgren C.,
Raivio T.: Are adolescent boys with Klinefelter syndrome androgen defi -
cient? A longitudinal study of Finnish 47,XXY boys. Pediatr Res. 2006b, 59,
854–859. doi: 10.1203/01.pdr.0000219386.31398.c3. PMID: 16641204.
Wikstrom A.M., Hoei -Hansen C.E., Dunkel L., Rajpert -De Meyts E.: Immunoexpression
of androgen receptor and nine markers of maturation in the testes
of adolescent boys with Klinefelter syndrome: Evidence for degeneration
of germ cells at the onset of meiosis. J Clin Endocrinol Metab. 2006c, 92,
714–719. doi: http://dx.doi.org/10.1210/jc.2006-1892. PMID: 17148558.
Wikstrom A.M., Raivio T., Hadziselimovic F., Wikstrom S., Tuuri T., Dunkel L.:
Klinefelter syndrome in adolescence: Onset of puberty is associated with accelerated
germ cell depletion. J Clin Endocrinol Metab. 2004, 89, 2263–2270.
doi: http://dx.doi.org/10.1210/jc.2003-031725. PMID: 15126551.
Zeger M.P., Zinn A.R., Lahlou N., Ramos P., Kowal K., Samango -Sprouse C. i wsp.:
Eff ect of ascertainment and genetic features on the phenotype of Klinefelter
syndrome. J Pediatr. 2008, 152, 716–722. doi: 10.1016/j.jpeds.2007.10.019.
PMID: 18410780.
Zuppinger K., Engel E., Forbes A.P., Mantooth L., Claff ey J.: Klinefelter’s syndrome,
a clinical and cytogenetic study in twenty four cases. Acta Endocrinol
(Copenh) 1967, 113, 5. doi: 10.1530/acta.0.054S005. PMID: 6071572.
REKOMENDACJE MEDYCZNE
Rekomendacje medyczne (zwane inaczej wytycznymi
lub zaleceniami) są dokumentem, który tworzony jest
w celu zapewnienia jednolitego postępowania diagnostycznego
i terapeutycznego w danej dziedzinie medycyny.
Takie dokumenty stosowane były w medycynie podczas
całej jej historii. Jednak w przeciwieństwie do wcześniejszych
zaleceń, które oparte były często na tradycyjnych
praktykach, niesprawdzonych teoriach i irracjonalnych
wierzeniach, nowoczesne wytyczne medyczne oparte
są na aktualnych danych uzyskanych w badaniach naukowych,
co nazywane jest medycyną opartą na dowodach
(EBM, ang. evidence based medicine). Rekomendacje są formułowane
przez uznanych specjalistów z danej dziedziny
i powstają jako konsensus ich opinii na dany temat.
Andrologia jest dziedziną medycyny, która powstała
na pograniczu endokrynologii, urologii, medycyny
rozrodu, seksuologii i pediatrii, dlatego rekomendacje
odnośnie postępowania w zaburzeniach andrologicznych
są często tworzone w ramach różnych specjalizacji.
Europejska Akademia Andrologii (EAA, ang. European
Academy of Andrology), której zadaniem jest m.in. kształcenie
w dziedzinie andrologii, poleca lekarzom andrologom
oraz kandydatom do zdobycia tytułu androloga
klinicznego zapoznanie się z Rekomendacjami
Europejskiego Towarzystwa Urologicznego (EAU, ang.
European Association of Urology). Przedstawiciele EAA
i EAU wypracowali bowiem wspólny program nauczania
tematyki andrologicznej.
W 2015 r. ukazało się nowe, zaktualizowane wydanie
Rekomendacji EAU. Aby ułatwić polskim lekarzom zapoznanie
się z tymi Rekomendacjami, Polskie Towarzystwo
Andrologiczne (PTA) podjęło się ich tłumaczenia na język
polski. Dotychczas zostały przetłumaczone rekomendacje
odnośnie postępowania w męskim hipogonadyzmie,
zaburzeniach seksualnych u mężczyzn i w męskiej
niepłodności. Polskie wersje Rekomendacji EAU będą
się ukazywały w częściach w czasopiśmie „Postępy
Andrologii Online”, a także będą umieszczone na stronie
internetowej PTA. Mamy nadzieję, że Rekomendacje
podniosą wiedzę i umiejętności lekarzy zajmujących
się problemami andrologicznymi w Polsce, a także będą
pomocne w wyjaśnieniu często kontrowersyjnych zagadnień.
Prof. dr hab. n. med. Jolanta Słowikowska -Hilczer
Przewodnicząca
Polskiego Towarzystwa Andrologicznego
REKOMENDACJE DOTYCZĄCE DIAGNOSTYKI
I LECZENIA MĘSKIEGO HIPOGONADYZMU
G.R. Dohle (Przewodniczący), S. Arver, C. Bettocchi, T.H. Jones, S. Kliesch, M. Punab
Tłumaczenie i przygotowanie wersji polskiej:
Łukasz Wojnar¹, Elżbieta Oszukowska², Jolanta Słowikowska-Hilczer³
¹ Klinika Urologii i Onkologii Urologicznej, Uniwersytet Medyczny w Poznaniu; ² II Klinika Urologii, Uniwersytet Medyczny w Łodzi;
³ Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Autor do korespondencji/corresponding author: Jolanta Słowikowska-Hilczer, Zakład Endokrynologii Płodności,
Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. Sterlinga 5, 91-425 Łódź,
tel.: 42 633 07 05, jolanta.slowikowska-hilczer@umed.lodz.pl
Otrzymano/received: 23.10.2015 r. • Zaakceptowano/accepted: 10.12.2015 r.
© European Association of Urology 2015
Skróty / Abbreviations
AMH – hormon antymüllerowski (ang. anti-Müllerian hormone), AR – receptor androgenowy (ang. androgen receptor), BMD – gęstość mineralna
kości (ang. bone mineral density), BMI – wskaźnik masy ciała (ang. body mass index), CMDh – Grupa koordynacyjna ds. procedury
wzajemnego uznawania oraz procedury zdecentralizowanej (dotyczących produktów stosowanych u ludzi) (ang. Coordination Group for
Mutual Recognition and Decentralised Procedures-human), DAX1 – region krytyczny genu DSS -AHC1 na chromo somie X /gen receptora kodowanego
w specy fi cznym regionie chromosomu X, którego dupli kacja prowadzi do odwrócenia płci męskiej w żeńską (ang. dosage -sensitive
sex reversal -adrenal hypoplasia congenita critical region on the X chromosome), DHT – 5α-dihydrotestosteron (ang. 5α-dihydrotestosterone),
EAU – Europejskie Towarzystwo Urologiczne (ang. European Association of Urology), EBRT – radioterapia wiązką zewnętrzną (ang. external
beam radiation therapy), EMA – Europejska Agencja Leków (ang. European Medicines Agency), FDA – Agencja Żywności i Leków (ang. Food
and Drug Administration), FSH – hormon folikulotropowy, folikulotropina (ang. follicle-stimulating hormone, folikulotropin), GnRH – gonadoliberyna
(ang. gonadotrophin releasing hormone), GR – stopień rekomendacji (ang. grade of recommendation), hCG – gonadotropina kosmówkowa
ang. human choriongonadotropin), HIV – ludzki wirus niedoboru odporności (ang. human immunodefi ciency virus), IHH – izolowany
hipogonadyzm hipogonadotropowy (ang. isolated hypogonadotrophic hypogonadism), IIEF – międzynarodowy wskaźnik funkcji erekcyjnej
(ang. international index of erectile function), INSL-3 – insulinopodobny peptyd 3 (ang. insulin-like peptide 3), IU – jednostki międzynarodowe
(ang. international units), LE – poziom wiarygodności dowodu naukowego (ang. level of evidence), LH – hormon luteinizujący, lutropina
(ang. luteinising hormone, lutropin), MACE – poważne niepożądane zdarzenia sercowo-naczyniowe (ang. major cardiovascular events),
NYHA – Nowojorskie Towarzystwo Chorób Serca (ang. New York Heart Association), OSA – obturacyjny bezdech senny (ang. obstructive
sleep apnoea), PDE5 – fosfodiesteraza typu 5 (ang. phosphodiesterase type 5), PSA – antygen specyfi czny dla prostaty (ang. prostate specifi c
antigen), SHBG – globulina wiążąca hormony płciowe (ang. sex hormone binding globulin), SOX – gen kodujący czynnik transkrypcyjny
należący do klasy HMG -box, związany z SRY (ang. SRY -related high -mobility group box gene), SRY – gen na chromosomie Yp determinujący
płeć (ang. sex-determining region on the Yp), TOM – testosteron u starszych mężczyzn z ograniczeniami ruchu (ang. testosterone in older men
with mobility limitations), TRT – terapia zastępcza testosteronem (ang. testosterone replacement therapy), WHR – stosunek obwodu pasa do
obwodu bioder (ang. waist to hip ratio)
Spis treści
1. WSTĘP . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
1.1. Cel. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..28
1.2. Historia publikacji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .....28
1.3. Skład zespołu multidyscyplinarnego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
2. METODOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
3. EPIDEMIOLOGIA, ETIOLOGIA I PATOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
3.1. Epidemiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .29
3.1.1. Rola testosteronu w zdrowiu reprodukcyjnym mężczyzn . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .29
3.2. Fizjologia. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .29
3.2.1. Receptor androgenowy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .30
3.3. Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3.4. Klasyfi kacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3.4.1. Hipogonadyzm męski pochodzenia gonadalnego (hipogonadyzm pierwotny) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .31
3.4.2. Hipogonadyzm męski pochodzenia podwzgórzowo- przysadkowego (hipogonadyzm wtórny) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .31
3.4.3. Hipogonadyzm męski spowodowany mieszaną dysfunkcją przysadki/podwzgórza i gonad . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3.4.4. Hipogonadyzm męski spowodowany zaburzeniami działania androgenów w narządach docelowych . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
4. DIAGNOSTYKA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
4.1. Objawy kliniczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .33
4.2. Badanie podmiotowe i kwestionariusze . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
4.3. Badanie przedmiotowe. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
4.4. Wnioski i rekomendacje dotyczące postępowania diagnostycznego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
4.5. Konsekwencje kliniczne hipogonadyzmu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
4.5.1. Płodowy niedobór androgenów . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
4.5.2. Niedobór androgenów przed dojrzewaniem płciowym . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .34
4.5.3. Hipogonadyzm w okresie dorosłości . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
4.5.3.1. Wskazania do obserwacji mężczyzn z hipogonadyzmem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. . . . . . . . . .36
5. LECZENIE CHORYCH Z HIPOGONADYZMEM . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. . . . 36
5.1. Wskazania i przeciwwskazania do leczenia testosteronem. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .36
5.2. Korzyści płynące z leczenia testosteronem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .36
5.3. Wybór leczenia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
5.3.1. Preparaty . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .37
5.3.1.1. Undecylenian testosteronu. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .37
5.3.1.2. Cypionat i enantan testosteronu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
5.3.1.3. Przezskórne preparaty testosteronu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
5.3.1.4. Podpoliczkowe i podjęzykowe preparaty testosteronu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
5.3.1.5. Podskórne preparaty testosteronu o przedłużonym działaniu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
5.4. Płodność a hipogonadyzm. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .38
5.5. Zalecenia odnośnie terapii zastępczej testosteronem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
5.6. Ryzyko związane z terapią testosteronem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
5.6.1. Rak piersi u mężczyzn. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
5.6.2. Rak gruczołu krokowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .39
5.6.3. Choroby układu krążenia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
5.6.4. Obturacyjny bezdech senny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
5.7. Podsumowanie i zalecenia odnośnie czynników ryzyka terapii testosteronem . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
6. MONITOROWANIE CHORYCH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
6.1. Monitorowanie chorych poddanych terapii testosteronem. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .41
6.2. Poziom testosteronu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
6.3. Gęstość kości . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
6.4. Hematokryt . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
6.5. Gruczoł krokowy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
6.6. Układ krążenia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
6.7. Wskazania odnośnie monitorowania chorych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
7. PIŚMIENNICTWO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
8. KONFLIKT INTERESÓW. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
Wstęp
1.1. Cel
Androgeny pełnią istotną rolę w rozwoju i utrzymaniu
męskich funkcji rozrodczych i seksualnych, budowy ciała
i kości oraz zachowania. Niski poziom androgenów we
krwi płodu może spowodować zaburzenia w rozwoju
płciowym w kierunku męskim, czego rezultatem mogą
być wady wrodzone męskiego układu rozrodczego. W późniejszym
okresie życia może to prowadzić do obniżonej
płodności, zaburzeń seksualnych, zmniejszonej masy
mięśniowej i mineralizacji kości, zaburzeń metabolizmu
lipidów oraz defi cytów poznawczych. Poziom testosteronu
obniża się nieznacznie w procesie starzenia się organizmu,
a objawy niedoboru testosteronu są uważane za element
starzenia się. Niski poziom testosteronu we krwi może
być również spowodowany otyłością i niektórymi chorobami
przewlekłymi. Wobec tego niektórzy pacjenci z objawami
hipogonadyzmu mogą odnieść korzyści z terapii
zastępczej testosteronem.
Dokument ten przedstawia wytyczne Europejskiego
Towarzystwa Urologicznego (EAU, ang. European
Association of Urology) na temat postępowania diagnostycznego
i terapeutycznego w hipogonadyzmie męskim.
Wytyczne te mają na celu przedstawienie praktycznych
wskazówek odnośnie radzenia sobie z pierwotnym oraz
związanym z wiekiem niskim poziomem testosteronu
we krwi u mężczyzn, jak również postępowania w przypadku
objawów niedoboru testosteronu.
1.2. Historia publikacji
Aktualne wytyczne odnośnie męskiego hipogonadyzmu
są powtórną publikacją, która powstała na bazie wytycznych
EAU pierwszej edycji, opublikowanych w 2012 r.
Obecna wersja z 2015 r. została uaktualniona i dostosowana
do ujednoliconego formatu wytycznych nieonkologicznych
EAU.
Powstały również wytyczne w mniejszym (kieszonkowym)
formacie, dostępne w formie drukowanej i w kilku
wersjach elektronicznych na telefony komórkowe, prezentujące
główne zalecenia zawarte w „Rekomendacjach
dotyczących diagnostyki i leczenia w męskim hipogonadyzmie”.
Jest to wersja skrócona, która wymaga porównania
z wersją pełnotekstową. Wszystkie te materiały
można obejrzeć i pobrać ze strony internetowej EAU
dla własnego użytkowania: http://www.uroweb.org/
guidelines/online -guidelines/. Na stronie internetowej
EAU znajduje się także szereg innych rekomendacji EAU
w wersji anglojęzycznej oraz przetłumaczonych na różne
języki przez poszczególne towarzystwa urologiczne.
Dokument ten był recenzowany przed opublikowaniem.
1.3. Skład zespołu multidyscyplinarnego
W skład sekcji EAU zajmującej się męskim hipogonadyzmem
wchodzi grupa ekspertów, w tym urolodzy specjalizujący
się w leczeniu niepłodności, endokrynolodzy
i androlodzy.
2. Metodologia
Wykorzystane źródła piśmiennictwa zostały ocenione
w zależności od poziomu wiarygodności dowodu naukowego
(LE, ang. level of evidence), dzięki czemu zalecenia
zawierają także stopień rekomendacji (GR, ang. grade of
recommendation). W obecnych „Rekomendacjach dotyczących
diagnostyki i leczenia w męskim hipogonadyzmie”
EAU z 2015 r. wszystkie informacje na temat
LE i GR zostały usunięte dla zachowania zwięzłości
tekstu. Znajdują się one na początku pełnej wersji
Rekomendacji EAU i zostały utworzone zgodnie z klasyfikacją
Oksfordzkiego Centrum do spraw oceny
poziomu dowodów naukowych w medycynie (ang.
Oxford Centre for Evidence -based Medicine Levels of
Evidence)¹.
Tabela A. Poziomy wiarygodności dowodu naukowego (LE)
 Wytyczne zawarte w tym dokumencie są oparte
na systematycznym przeglądzie piśmiennictwa przeprowadzonym
przez ekspertów zespołu EAU. W celu
znalezienia oryginalnych oraz przeglądowych artykułów
przeszukano bazy danych MedLine, Embase
i Cochrane. Wzięto pod uwagę wszystkie artykuły
opublikowane przed listopadem 2014 r. Zespół ekspertów
przejrzał wyniki wyszukiwania oraz wybrał
artykuły o najwyższym LE zgodnie z systemem oceny
opracowanym przez Oxford Centre for Evidence – Based
Medicine.
Celem podawania GR jest zapewnienie przejrzystości
pomiędzy odpowiednimi dowodami naukowymi
a daną rekomendacją. Trzeba zaznaczyć, że kiedy rekomendacje
są przygotowywane, nie istnieje ustalony
związek pomiędzy LE a GR. W szczególności dostępność
badań randomizowanych będących podstawą rekomendacji
nie musi automatycznie oznaczać, że ta rekomendacja
otrzyma stopień A, jeśli w tych badaniach
znajdują się ograniczenia metodologiczne lub badania
nie mają zgodnych wyników. Odwrotnie, brak popierających
badań o wysokim LE nie musi od razu wykluczać
rekomendacji z poziomu A w sytuacji, gdy rekomendacja
wynika z niepodważalnych wyników badań
klinicznych. Ponadto, mogą mieć miejsce sytuacje wyjątkowe,
w których rekomendacja nie może zostać poparta
badaniami, ponieważ badania takie nie mogą zostać
przeprowadzone, na przykład z powodów etycznych
lub innych. W takich przypadkach uważa się, że jednoznaczne
rekomendacje są pomocne czytelnikowi. Jeśli
kiedykolwiek taka sytuacja ma miejsce, to zaznaczono
to w tekście z uwagą ,,uaktualnione na podstawie zgody
zespołu”. Jakość LE jest bardzo istotnym czynnikiem,
ale musi uwzględniać równowagę między korzyściami
i stratami, wartościami i preferencjami oraz kosztami,
kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza ani analiz
kosztów, ani nie zawsze może uwzględniać lokalne czy
narodowe warunki. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod
uwagę.
Wytyczne zawarte w tym dokumencie są oparte
na systematycznym przeglądzie piśmiennictwa przeprowadzonym
przez ekspertów zespołu EAU. W celu
znalezienia oryginalnych oraz przeglądowych artykułów
przeszukano bazy danych MedLine, Embase
i Cochrane. Wzięto pod uwagę wszystkie artykuły
opublikowane przed listopadem 2014 r. Zespół ekspertów
przejrzał wyniki wyszukiwania oraz wybrał
artykuły o najwyższym LE zgodnie z systemem oceny
opracowanym przez Oxford Centre for Evidence – Based
Medicine.
Celem podawania GR jest zapewnienie przejrzystości
pomiędzy odpowiednimi dowodami naukowymi
a daną rekomendacją. Trzeba zaznaczyć, że kiedy rekomendacje
są przygotowywane, nie istnieje ustalony
związek pomiędzy LE a GR. W szczególności dostępność
badań randomizowanych będących podstawą rekomendacji
nie musi automatycznie oznaczać, że ta rekomendacja
otrzyma stopień A, jeśli w tych badaniach
znajdują się ograniczenia metodologiczne lub badania
nie mają zgodnych wyników. Odwrotnie, brak popierających
badań o wysokim LE nie musi od razu wykluczać
rekomendacji z poziomu A w sytuacji, gdy rekomendacja
wynika z niepodważalnych wyników badań
klinicznych. Ponadto, mogą mieć miejsce sytuacje wyjątkowe,
w których rekomendacja nie może zostać poparta
badaniami, ponieważ badania takie nie mogą zostać
przeprowadzone, na przykład z powodów etycznych
lub innych. W takich przypadkach uważa się, że jednoznaczne
rekomendacje są pomocne czytelnikowi. Jeśli
kiedykolwiek taka sytuacja ma miejsce, to zaznaczono
to w tekście z uwagą ,,uaktualnione na podstawie zgody
zespołu”. Jakość LE jest bardzo istotnym czynnikiem,
ale musi uwzględniać równowagę między korzyściami
i stratami, wartościami i preferencjami oraz kosztami,
kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza ani analiz
kosztów, ani nie zawsze może uwzględniać lokalne czy
narodowe warunki. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod
uwagę.
3. Epidemiologia, etiologia i patologia
3.1. Epidemiologia
Defi nicja: Hipogonadyzm męski jest zespołem klinicznym
spowodowanym niedoborem androgenów, który może
niekorzystnie wpływać na funkcje narządów oraz jakość
życia (Nieschlag i wsp., 2010).
Niedobór androgenów zwiększa się wraz z wiekiem
także u zdrowych mężczyzn (Kaufman i Vermeulan,
2005; Wu i wsp., 2008). U mężczyzn w średnim wieku
częstość biochemicznego hipogonadyzmu wynosi
2,1–12,8% (Hall i wsp., 2008). Częstość występowania
obniżonego poziomu testosteronu i objawów hipogonadyzmu
u mężczyzn w wieku 40–79 lat wynosi 2,1–5,7%.
Hipogonadyzm częściej występuje u starszych mężczyzn,
u mężczyzn z otyłością, chorobami współistniejącymi
oraz u mężczyzn ze złym stanem zdrowia.
3.1.1. Rola testosteronu w zdrowiu reprodukcyjnym
mężczyzn
Androgeny, produkowane przez jądra i nadnercza,
odgrywają kluczową rolę w męskich funkcjach rozrodczych
i seksualnych, mają też ważne znaczenie
dla rozwoju męskich narządów płciowych, takich jak
najądrza, nasieniowody, pęcherzyki nasienne, gruczoł
krokowy i prącie. Ponadto hormony te istotne są dla
procesu dojrzewania płciowego, męskiej płodności,
funkcji seksualnych, budowy mięśni, utrzymywania
odpowiedniego składu ciała, mineralizacji kości, metabolizmu
tłuszczów i funkcji poznawczych (Nieschlag
i Behre, 2004).
3.2. Fizjologia
U mężczyzn rozwój płciowy zaczyna się między 7. a 12.
tygodniem życia płodowego. Niezróżnicowane gonady
rozwijają się w płodowe jądra dzięki ekspresji kilku
genów znajdujących się na krótkim ramieniu chromosomu
Y, w tym w regionie determinującym płeć (SRY,
ang. the sex -determining region of the Y chromosome) oraz
genów SOX na chromosomie 17 (Parker i wsp., 1999).
Jądra płodowe wytwarzają trzy hormony: testosteron,
insulinopodobny peptyd 3 (INSL-3, ang. insulin -like
peptide 3) i hormon antymüllerowski (AMH, ang.
anti -Müllerian hormone). Testosteron jest potrzebny
do rozwoju przewodów Wolff a, z których powstają
najądrza, nasieniowody i pęcherzyki nasienne. Hormon
antymüllerowski indukuje zanik przewodów Müllera
(rycina 1). Insulinopodobny peptyd 3 i AMH wpływają
na zstępowanie jąder do moszny.
W okresie płodowym pod wpływem wewnątrzjądrowego
testosteronu liczba gonocytów na kanalik
jądra wzrasta trzykrotnie (Brinkmann, 2011). Ponadto,
testosteron jest potrzebny do rozwoju gruczołu krokowego,
prącia i moszny. Jednakże w tych narządach
testosteron jest przekształcany w silniejszy metabolit
5α -dihydrotestosteron (DHT, ang. 5α -dihydrotestosterone)
przez enzym 5α -reduktazę. Oba te hormony aktywują
receptor androgenowy (Bentvelsen i wsp., 1994).
Wewnątrzjądrowy testosteron konieczny jest także
do utrzymania procesu spermatogenezy oraz hamowania
apoptozy komórek płciowych (Singh i wsp., 1995).
Kanaliki plemnikotwórcze jąder są poddane działaniu
testosteronu w stężeniu 25–100 -krotnie większym niż
we krwi. Zahamowanie działania gonadotropin (np.
poprzez nadużywanie testosteronu) powoduje zmniejszenie
liczby plemników w ejakulacie i obniżenie wydajności
spermatogenezy (Sun i wsp., 1989). Całkowite zahamowanie
działania wewnątrzjądrowego testosteronu
skutkuje zatrzymaniem procesu mejozy aż do poziomu
spermatyd (McLachlan i wsp., 2002; Weinbauer i Nieschlag,
1993). Testosteron może być również metabolizowany
 FSH – hormon folikulotropowy; INSL-3 – insulinopodobny peptyd 3; LH – hormon luteinizujący; SOX – gen kodujący czynnik transkrypcyjny
należący do klasy HMG -box, związany z SRY; SRY – gen na chromosomie Yp determinujący płeć męską
FSH – hormon folikulotropowy; INSL-3 – insulinopodobny peptyd 3; LH – hormon luteinizujący; SOX – gen kodujący czynnik transkrypcyjny
należący do klasy HMG -box, związany z SRY; SRY – gen na chromosomie Yp determinujący płeć męską
do estradiolu przez enzym aromatazę, obecny w tkance
tłuszczowej, gruczole krokowym, jądrach i kościach.
Estradiol jest niezbędny dla mineralizacji kości, także
u mężczyzn (de Ronde i de Jong, 2011).
Wytwarzanie testosteronu u płodu jest kontrolowane
przez gonadotropinę kosmówkową (hCG, ang. human choriongonadotropin),
a po urodzeniu przez hormon luteinizujący
(LH, ang. luteinising hormone) wytwarzany przez
przysadkę. Zaraz po urodzeniu poziom testosteronu
w surowicy osiąga stężenie takie jak u dorosłych mężczyzn
i utrzymuje się przez kilka miesięcy (tzw. minidojrzewanie,
ang. minipuberty). Następnie, aż do okresu
dojrzewania poziom testosteronu jest niski, co zapobiega
wirylizacji. Dojrzewanie zaczyna się produkcją
gonadotropin, zainicjowaną przez wydzielanie gonadoliberyny
(GnRH, ang. gonadotrophin releasing hormone)
z podwzgórza, które pobudzają produkcję testosteronu
w jądrach, co wpływa na rozwój wtórnych męskich cech
płciowych i rozpoczęcie spermatogenezy (Brinkmann,
2001). Na rycinie 1 przedstawiono rozwój męskiego
układu rozrodczego.
3.2.1. Receptor androgenowy
Testosteron wywiera swoje działanie poprzez receptor
androgenowy (AR, ang. androgen receptor), który znajduje
się w cytoplazmie i błonie jądrowej komórek docelowych.
Podczas okresu płodowego testosteron zwiększa liczbę
AR poprzez zwiększenie liczby komórek z AR, ale również
poprzez zwiększenie liczby AR w każdej pojedynczej
komórce (Bentvelsen i wsp., 1994; de Ronde i de Jong, 2011).
Gen AR znajduje się w chromosomie X (Xq 11 -12).
Uszkodzenia i mutacje w genie AR mogą powodować
zaburzenia rozwoju w kierunku męskim, czego efektem
może być zespół całkowitej niewrażliwości na androgeny
(inaczej – zespół feminizujących jąder) lub obniżona
wirylizacja, co oznacza zaburzenie rozwoju płci
(DSD, ang. disorders of sex development). Mniej znaczące
mutacje w genie AR mogą powodować łagodne formy niewrażliwości na androgeny i niepłodność u mężczyzn
(Zitzmann, 2007). W eksonie 1 genu AR znajduje się transaktywowana
domena składająca się z łańcucha trinukleotydów
– cytozyny, adeniny, guaniny (powtórzenia
CAG) o zmiennej długości. Wrażliwość na androgeny
zależy od liczby powtórzeń CAG w eksonie 1 genu AR
(Zitzmann, 2007). Liczba powtórzeń CAG w genie AR
koreluje dodatnio z poziomem testosteronu całkowitego
i wolnego (aktywnego biologicznie) oraz estradiolu
w surowicy krwi u mężczyzn. Mniejsza liczba powtórzeń
jest związana ze zwiększonym ryzykiem rozwoju raka
gruczołu krokowego, a większa ze zmniejszonym działaniem
androgenów w tkankach (Rajender i wsp., 2007).
Liczba powtórzeń CAG może wpływać na androgenne
efekty fenotypowe nawet w przypadku prawidłowego
poziomu testosteronu we krwi (Canale i wsp., 2005).

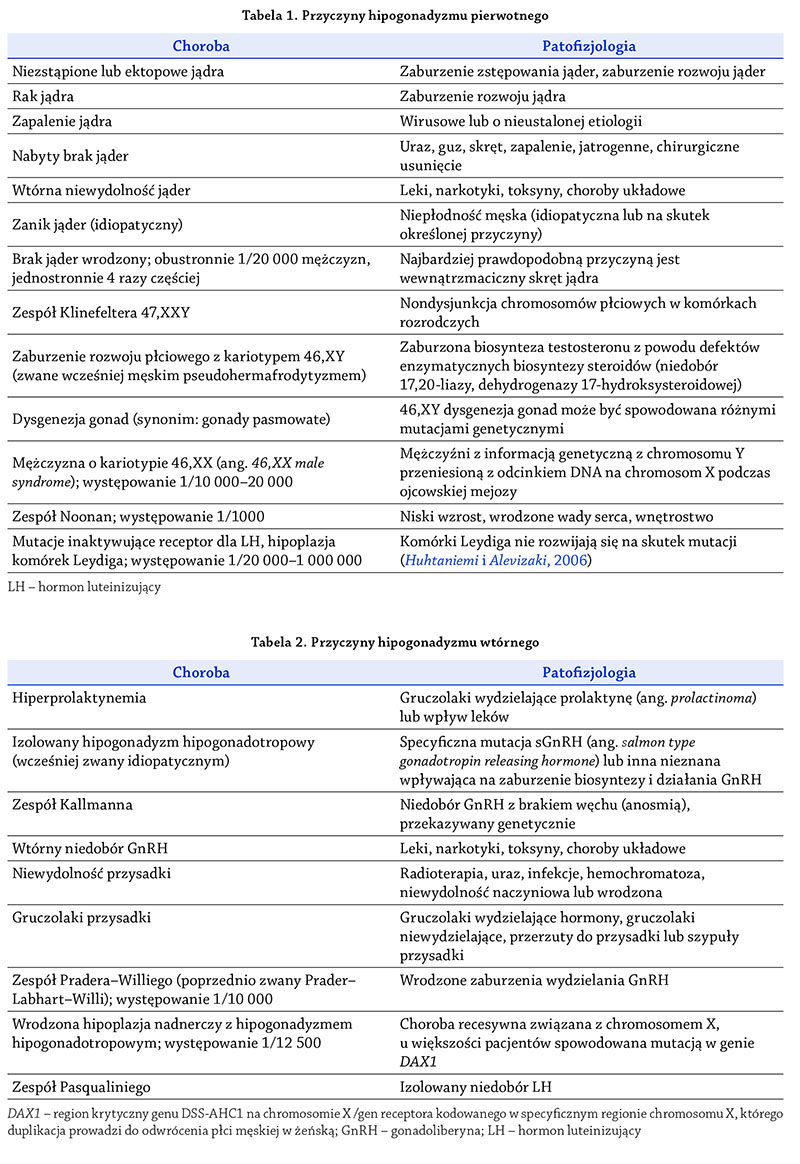 DAX1 – region krytyczny genu DSS -AHC1 na chromo somie X /gen receptora kodowanego w specy fi cznym regionie chromosomu X, którego
dupli kacja prowadzi do odwrócenia płci męskiej w żeńską; GnRH – gonadoliberyna; LH – hormon luteinizujący
DAX1 – region krytyczny genu DSS -AHC1 na chromo somie X /gen receptora kodowanego w specy fi cznym regionie chromosomu X, którego
dupli kacja prowadzi do odwrócenia płci męskiej w żeńską; GnRH – gonadoliberyna; LH – hormon luteinizujący
neuronów wydzielających GnRH (Behre i wsp., 2010;
Pitteloud i wsp., 2010). Najważniejszym objawem jest
opóźnienie dojrzewania płciowego, którego najczęstszą
przyczyną jest konstytucjonalne opóźnienie dojrzewania
płciowego (łac. pubertas tarda) (Sedlmeyer i wsp., 2002).
Inne rzadsze przyczyny hipogonadyzmu wtórnego
są wymienione w tabeli 2.
3.4.3. Hipogonadyzm męski spowodowany
mieszaną dysfunkcją przysadki/podwzgórza
i gonad
Mieszana pierwotna i wtórna niewydolność jąder objawia
się niskim poziomem testosteronu i różnymi poziomami
gonadotropin. Poziom gonadotropin zależy od tego, która
komponenta niewydolności, pierwotna czy wtórna, dominuje.
Ta forma hipogonadyzmu jest także znana jako
hipogonadyzmem późny lub hipogonadyzm związany
z wiekiem (Nieschlag i wsp., 2005; Wang i wsp., 2009).
3.4.4. Hipogonadyzm męski spowodowany
zaburzeniami działania androgenów
w narządach docelowych
Te formy występują rzadko i nie zostaną szczegółowo
opisane w tych wytycznych. Istnieją defekty AR z całkowitą,
częściową lub minimalną niewrażliwością na androgeny,
zespół Reifensteina, opuszkowo -rdzeniowy zanik
mięśni (choroba Kennedy’ego), niedobór 5α-reduktazy
(Nieschlag i wsp., 2010).
Rozpoznanie różnych typów hipogonadyzmu posiada
swoje implikacje kliniczne. U pacjentów z hipogonadyzmem
wtórnym stymulacja hormonalna preparatami hCG,
FSH lub podawanymi pulsacyjnie preparatami GnRH
może przywrócić płodność w większości przypadków
(Buchter i wsp., 1998; Sykiotis i wsp., 2010). Szczegółowa
ocena przyczyn hipogonadyzmu może wykazać np. guzy
przysadki, choroby ogólnoustrojowe lub guzy jąder.
Mieszany hipogonadyzm obserwowany jest zazwyczaj
u starzejących się mężczyzn, zwłaszcza otyłych, z towarzyszącym
zależnym od wieku obniżeniem poziomu
testosteronu wynikającym z zaburzeń czynności jąder,
jak i zaburzeń funkcji układu podwzgórze–przysadka.
REKOMENDACJE LE GR
Konieczne różnicowanie hipogonadyzmu pierwotnego
i wtórnego (poziom LH), ponieważ ma
to znaczenie dla dalszej diagnostyki i leczenia
oraz umożliwia rozpoznanie innych chorób i niepłodności.
1b B
GR – stopień rekomendacji; LE – poziom wiarygodności dowodu
naukowego; LH – hormon luteinizujący
4. Diagnostyka
Hipogonadyzm jest diagnozowany na podstawie występujących
stale objawów związanych z niedoborem androgenów
oraz stwierdzenia (przynajmniej dwukrotnie)
istotnie obniżonego stężenia testosteronu w surowicy
krwi (Hall i wsp., 2008; Bhasin i wsp., 2010; Rosner i wsp.,
2007; Rosner i Vesper, 2010; Wang i wsp., 2004).
4.1. Objawy kliniczne
Obniżone stężenie testosteronu w surowicy krwi może
być związane z objawami przedstawionymi w tabeli 3
(Bhasin i wsp., 2010; Hall i wsp., 2008, Wu i wsp., 2010).
Najczęstszymi objawami hipogonadyzmu u starzejących
się mężczyzn są obniżone libido, zmniejszona
aktywność seksualna, zaburzenia wzwodu oraz uderzenia
gorąca (Hall i wsp., 2008; Wu i wsp., 2010). Wykazano
związek obniżonego poziomu testosteronu ze zwiększonym
obwodem pasa i gorszym ogólnym stanem
zdrowia (Hall i wsp., 2008). Objawy niedoboru androgenów
różnią się w zależności od wieku, w którym rozpoczął
się niedobór, czasu jego trwania i nasilenia. Wartości
referencyjne dolnej granicy normy stężenia testosteronu
(2,5 percentyl) w surowicy krwi zostały ostatnio
obliczone na podstawie trzech dużych prób, sugerując
punkty odcięcia 12,1 nmol/L dla testosteronu całkowitego
oraz 243 pmol/L dla testosteronu wolnego (Bhasin
i wsp., 2001). Objawy sugerujące hipogonadyzm (Bhasin
i wsp., 2001; Hall i wsp., 2008) zostały przedstawione
w tabeli 3. Należy jednak podkreślić, że podobne objawy
mogą wystąpić także u zdrowych mężczyzn z prawidłowymi
poziomami testosteronu, a ich przyczyna może
być inna niż niedobór androgenów.
U mężczyzn w wieku 40–79 lat stężenie progowe
testosteronu wynosiło 8 nmol/L dla obniżonego libido,
8,5 nmol/L dla zaburzeń wzwodu, 11 nmol/L dla zmniejszonej
częstości porannych erekcji, 13 nmol/L dla zmniejszonej
ogólnej aktywności życiowej (Vesper i wsp., 2009).

Najsilniejszymi objawami prognostycznymi dla hipogonadyzmu
w tej grupie wiekowej były trzy objawy
ze sfery seksualnej (obniżone libido, zmniejszenie częstości
porannych wzwodów, zaburzenia wzwodu) i stężenie
testosteronu całkowitego <8 nmol/L lub stężenie
testosteronu całkowitego w przedziale 8–11 nmol/L
i testosteronu wolnego <220 pmol/L. Dane te zostały
oparte na oznaczeniach poziomu testosteronu w próbkach
krwi pobranych rano, kiedy poziom testosteronu jest
najwyższy i najbardziej powtarzalny u młodych mężczyzn
(Bremner i wsp., 1983). Zarówno testy immunologiczne,
jak i oparte na spektrometrii masowej mogą dać wiarygodne
wyniki, jeśli są dobrze przeprowadzone. Ocena
wyników pacjenta powinna być oparta na ich porównaniu
z wartościami referencyjnymi dla zdrowych mężczyzn.
Objawy hipogonadyzmu mogą być nieznaczne i nie
zawsze typowe dla niskiego poziomu testosteronu.
Na przykład mężczyźni z pierwotnym uszkodzeniem
jąder często mają prawidłowy poziom testosteronu, ale
wysokie stężenie LH. Taka sytuacja może być uważana
za hipogonadyzm subkliniczny lub skompensowany.
Kliniczne konsekwencje izolowanego, podwyższonego
poziomu LH nie są jeszcze jasne, ale prawdopodobnie
u tych mężczyzn rozwinie się pełnoobjawowy hipogonadyzm
w przyszłości.
Aby zróżnicować pierwotny i wtórny hipogonadyzm
oraz rozpoznać hipogonadyzm późny, konieczne jest oznaczenie
poziomu LH we krwi. Zarówno poziom LH, jak
i poziom testosteronu powinny być zbadane dwukrotnie.
Badanie podmiotowe i k 4.2. westionariusze
Objawy hipogonadyzmu wymienione w tabeli 3 powinny
stanowić element wywiadu. Wczesny początek hipogonadyzmu
powoduje brak dojrzewania płciowego i rozwoju
wtórnych cech płciowych. Może to ponadto prowadzić
do powstania eunuchoidalnych proporcji ciała i wysokiego
głosu (brak mutacji). Objawy te wskazują z dużym
prawdopodobieństwem na hipogonadyzm pierwotny.
Hipogonadyzm wieku dorosłego charakteryzuje się zaburzeniami
seksualnymi, otyłością i utratą energii życiowej.
Dostępne kwestionariusze do oceny objawów hipogonadyzmu
są niewiarygodne, mają niską swoistość i nie
nadają się do identyfi kacji tego typu zaburzeń (Buvat
i wsp., 1997; Moore i wsp., 2004; Morley i wsp., 2000; Smith
i wsp., 2000). Istotne jest, aby potwierdzić lub wykluczyć
występowanie chorób układowych, zaburzeń odżywiania
i wchłaniania oraz trwających aktualnie ostrych
chorób. Informacje o przyjmowaniu kortykosteroidów
lub testosteronu, nadużywanie narkotyków (marihuana,
opiaty), alkoholu lub sterydów anabolicznych powinny
być uwzględnione przy zbieraniu wywiadu.
4.3. Badanie przedmiotowe
Podczas badania przedmiotowego powinny zostać ocenione:
wskaźnik masy ciała (BMI, ang. body mass index),
stosunek obwodu pasa do obwodu bioder (WHR, ang.
waist to hip ratio), owłosienie ciała, występowanie łysienia
androgenowego i ginekomastii, rozmiar jąder (pomiar
orchidometrem lub ultrasonografi cznie), budowa prącia
i budowa prostaty per rectum.
4.4. Wnioski i rekomendacje dotyczące
postępowania diagnostycznego
WNIOSEK
Rozpoznanie hipogonadyzmu męskiego opiera się na stwierdzeniu
objawów przedmiotowych i podmiotowych niedoboru
androgenów oraz znacząco obniżonego stężenia testosteronu
w surowicy krwi.
4.5. Konsekwencje kliniczne hipogonadyzmu
Konsekwencje kliniczne hipogonadyzmu zależą od wieku,
w którym rozwinął się hipogonadyzm, oraz od nasilenia
objawów.
4.5.1. Płodowy niedobór androgenów
Podczas pierwszych 14 tygodni życia płodowego obecność
testosteronu jest kluczowa dla prawidłowej wirylizacji
narządów płciowych. Niedobór androgenów lub oporność
na androgeny z powodu wady receptora androgenowego
lub receptora dla LH w tym okresie może spowodować
nieprawidłowy rozwój męskich narządów płciowych,
od spodziectwa do rozwoju żeńskich narządów płciowych
z jądrami położonymi wewnątrzbrzusznie. Zazwyczaj
pacjenci z zaburzeniami rozwoju płciowego są diagnozowani
na wczesnym etapie życia ze względu na nieprawidłowe
zewnętrzne narządy płciowe. Jednak pacjenci z obu
krańców spektrów tych zaburzeń mogą pozostać niezdiagnozowani
w okresie dzieciństwa. Diagnostyka może
mieć miejsce w czasie dojrzewania, kiedy chłopcy prezentować
będą opóźnione dojrzewanie płciowe, a dziewczęta
z XY pierwotny brak miesiączki.
4.5.2. Niedobór androgenów przed dojrzewaniem
płciowym
Początek pokwitania wiąże się z rosnącymi poziomami
gonadotropin, co powoduje wzrost objętości jąder, aktywację
spermatogenezy oraz wydzielania testosteronu.
W okresie dojrzewania zwiększanie się poziomu testosteronu
powoduje rozwój wtórnych męskich cech płciowych,
w tym obniżenie głosu, rozwój owłosienia ciała,
owłosienia w okolicach płciowych oraz zarostu na twarzy,
zwiększenie wielkości prącia, zwiększenie masy mięśniowej
oraz masy kostnej, przyspieszenie wzrostu
(skok wzrostowy) i ostatecznie zamknięcie nasad kości.
Ponadto, testosteron ma wyraźne efekty psychoseksualne,
m.in. zwiększa libido.
Opóźnione dojrzewanie płciowe jest defi niowane
jako brak powiększenia jąder w wieku 14 lat (Traggiai
i Starhope, 2002). Ponieważ jest to „statystyczna” defi -
nicja, oparta na wartościach referencyjnych dla wieku,
w którym występuje początek dojrzewania w normalnej
populacji, opóźnione dojrzewanie nie zawsze wskazuje
na obecność choroby. W przypadkach ciężkiego niedoboru

GR – stopień rekomendacji; HIV – ludzki wirus niedoboru odporności; LE – poziom wiarygodności dowodu naukowego; LH – hormon
luteinizujący
androgenów obraz kliniczny przedpokwitaniowej postaci
hipogonadyzmu jest jednoznaczny (tabela. 4), a diagnostyka
i leczenie dość proste. Większym wyzwaniem jest
różnicowanie idiopatycznego hipogonadyzmu hipogonadotropowego
u młodszych osób z konstytucjonalnym
opóźnieniem dojrzewania i decyzja o czasie rozpoczęcia
terapii androgenami. W łagodniejszych przypadkach
niedoboru androgenów, tak jak to bywa u pacjentów
z zespołem Klinefeltera, dojrzewanie płciowe może być
niekompletne lub opóźnione, co daje mniej wyraźny obraz
kliniczny. U tych pacjentów kilka objawów może doprowadzić
do rozpoznania hipogonadyzmu. Należą do nich:
małe jądra, wnętrostwo, ginekomastia, rzadkie owłosienie
Tabela 4. Objawy sugerujące hipogonadyzm
o początku przedpokwitaniowym
 ciała, eunuchoidalne proporcje ciała, niska masa kostna
i obniżona płodność (Lanfranco i wsp., 2004).
ciała, eunuchoidalne proporcje ciała, niska masa kostna
i obniżona płodność (Lanfranco i wsp., 2004).
4.5.3. Hipogonadyzm w okresie dorosłości
Defi nicja: Hipogonadyzm wieku dorosłego jest defi niowany
jako niedobór testosteronu, w większości przypadków
z objawami klinicznymi, u osoby, która rozwijała
się prawidłowo w okresie dojrzewania i posiada prawidłowo
rozwinięte wtórne męskie cechy płciowe.
W zależności od przyczyny hipogonadyzmu, obniżenie
czynności gonad może być stopniowe i częściowe.
Obraz kliniczny może być różnorodny, a objawy mogą
być ukryte przez fi zjologicznie zmienny fenotyp. Objawy,
które łączą się z hipogonadyzmem wieku dorosłego, to:
utrata libido, zaburzenia wzwodu, sarkopenia, niska
masa kostna, myśli depresyjne, zmęczenie, utrata energii
życiowej, utrata owłosienia, uderzenia gorąca i obniżona
płodność (tabela 3). Większość z tych objawów ma etiologię
wieloczynnikową, przypomina proces normalnego
starzenia się i można je stwierdzić również u mężczyzn
z całkowicie prawidłowymi poziomami testosteronu
(Kaufman i Vermeulan, 2005). W rezultacie objawy hipogonadyzmu
rozpoczynającego się w okresie dojrzałości
są niespecyfi czne i konieczne jest potwierdzenie podejrzenia
klinicznego przez badania hormonalne. Dla większości
z wymienionych powyżej objawów prawdopodobieństwo
ich wystąpienia zwiększa się przy obniżeniu
poziomu testosteronu w surowicy krwi. Większość badań
wskazuje na istnienie wartości granicznej poziomu testosteronu,
poniżej której częstość występowania objawów
klinicznych zaczyna wzrastać (Wu i wsp., 2010; Zitzmann i wsp., 2006). Wartość ta znajduje się w pobliżu dolnej
granicy normalnego poziomu testosteronu we krwi
młodych mężczyzn, ale wydaje się, że istnieją znaczne
różnice tego progu pomiędzy ludźmi, a nawet u jednej
osoby wartość ta może być różna dla różnych organów
docelowych.
Wskazania d 4.5.3.1. o obserwacji mężczyzn
z hipogonadyzmem
 Leczenie chorych z hipogonadyzmem
Leczenie chorych z hipogonadyzmem
5.1. Wskazania i przeciwwskazania do leczenia
testosteronem
Leczenie testosteronem ma na celu przywrócenie poziomu
testosteronu we krwi do zakresu fi zjologicznego u mężczyzn
z ciągle niskim poziomem testosteronu i związanymi
z nim objawami niedoboru androgenów. Celem leczenia jest poprawa jakości życia, poczucia dobrostanu,
funkcji seksualnych, siły mięśniowej i gęstości mineralnej
kości. W tabeli 5 przedstawione zostały główne
wskazania do leczenia testosteronem. Tabela 6 zawiera
główne przeciwwskazania do leczenia testosteronem.
5.2. Korzyści płynące z leczenia testosteronem
Leczenie jest zwykle wskazane we wrodzonym hipogonadyzmie
hipogonadotropowym. U tych pacjentów leczenie
hormonalne polega na podawaniu preparatów hCG i FSH
lub podawaniu pulsacyjnie preparatów GnRH. Preparaty
te pobudzają dojrzewanie płciowe, w większości przypadków
przywracają płodność i normalizują mineralizację
kości (Buchter i wsp., 1998; Sykiotis i wsp., 2010).
Terapia zastępcza testosteronem (TRT, ang. testosterone
replacement therapy) może zmniejszyć objawy hipogonadyzmu,
ale u mężczyzn z niedoborem testosteronu,
którzy mają dodatkowe choroby i w większości przypadków
są otyli, ważniejsza niż TRT jest redukcja masy
ciała, modyfi kacja stylu życia i leczenie chorób współtowarzyszących.
Terapia zastępcza testosteronem zapewnia wiele
korzyści, jeśli chodzi o skład ciała, kontrolę metabolizmu,
stan psychiczny i sprawność seksualną. Randomizowane
badania wykazały korelację między przywróconym
fi zjologicznym poziomem testosteronu we krwi a masą
i siłą mięśniową mierzoną siłą nacisku nogi i objętością
mięśnia czworogłowego uda (Bhasin i wsp., 2001;
Caminiti i wsp., 2009; Saad i wsp., 2011; Storer i wsp., 2008).
Podobnie pozytywny wpływ wykazano w metaanalizie
badań nad oceną wpływu egzogennego testosteronu
na gęstość mineralną kości. Terapia zastępcza testosteronem
poprawia gęstość mineralną w odcinku lędźwiowym
kręgosłupa, zmniejszając jednocześnie stężenie
markerów resorpcji kości. Dostępne badania nie wykazały
jednak podobnej zależności dla szyjki kości udowej
(Isidori i wsp., 2005; Saad i wsp., 2011; Tracz i wsp., 2006).
U mężczyzn z hipogonadyzmem skład ciała zmienia się
w trakcie terapii testosteronem, mianowicie obniża się
zawartość tkanki tłuszczowej i zwiększa beztłuszczowa
masa ciała (Saad i wsp., 2013). Liczne badania w oparciu
o doświadczenia z undecylenianem testosteronu wykazały
znaczne zmniejszenie zawartości tkanki tłuszczowej
w obrębie tułowia i pasa, prowadząc do wyraźnego zmniejszenia
obwodu pasa (Saad i wsp., 2013; Traish i wsp., 2014).
W tych samych badaniach podawanie undecylenianu
testosteronu spowodowało poprawę wagi ciała, BMI oraz
profi lu lipidowego po 3 miesiącach leczenia (Saad i wsp.,
2013). Terapia zastępcza testosteronem ma pozytywny
wpływ na poziom glikemii oraz lipidów, insulinooporność
i otyłość brzuszną u mężczyzn z hipogonadyzmem
oraz nieprawidłową tolerancją glukozy i nieprawidłowym
profi lem lipidowym, co w konsekwencji zmniejsza śmiertelność
(Kapoor i wsp., 2006; Muraleedharan i wsp., 2013).
W metaanalizie wykazano także silną zależność pomiędzy
obniżonym poziomem testosteronu a zwiększoną śmiertelnością
z powodów sercowo -naczyniowych, a w kilku
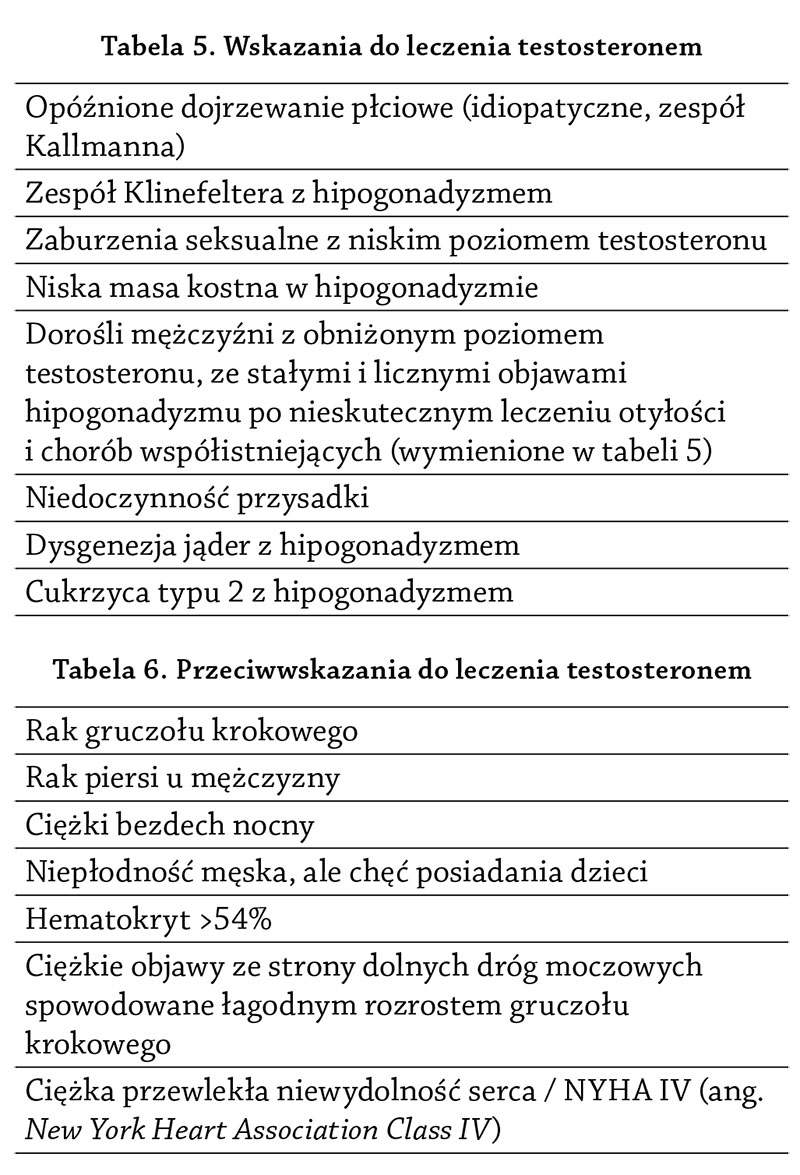
badaniach retrospektywnych wykazano, że prawidłowe
poziomy całkowitego i wolnego testosteronu związane
są ze zmniejszoną śmiertelnością (Araujo i wsp., 2011;
Corona i wsp., 2014; Haring i wsp., 2010; Morgentaler, 2014;
Yeap i wsp., 2014).
Pozytywny wpływ na libido, erekcję i ejakulację
u hipogonadalnych mężczyzn odnotowano w kilku badaniach
retrospektywnych i opisach przypadków. W 17
badaniach z grupą kontrolną odnotowano niewielką
poprawę satysfakcji z osiąganej erekcji i umiarkowany
wzrost libido (Saad i wsp., 2011; Bolona i wsp., 2007; Moon
i wsp., 2010; Yassin i wsp., 2006). W ostatnim wieloośrodkowym
badaniu prospektywnym odnotowano znaczący
wzrost międzynarodowego wskaźnika funkcji erekcyjnej
(IIEF, ang. international index of erectile function), gdzie
oceniano komponentę związaną z pożądaniem seksualnym,
satysfakcją ze współżycia płciowego i ogólnego
zadowolenia w czasie 6 tygodni od rozpoczęcia leczenia
(Moon i wsp., 2010). W kilku badaniach klinicznych wykazano
też obiecujące wyniki zastosowania TRT u hipogonadalnych
mężczyzn cierpiących na zaburzenia erekcji,
którzy zgłaszali satysfakcjonujące współżycie seksualne
po co najmniej 3 miesiącach od rozpoczęcia terapii (Saad
i wsp., 2011; Yassin i wsp., 2006). Zmniejszenie zaburzeń
seksualnych zależy od ich etiologii: TRT u mężczyzn
z prawidłowym poziomem testosteronu wydaje się być
mało efektywna, ale może poprawić działanie inhibitorów
fosfodiesterazy 5 (PDE5, ang. phosphodiesterase type 5)
u hipogonadalnych mężczyzn (Corona i wsp., 2014).
W niedawnym randomizowanym badaniu wykazano
znaczną poprawę objawów depresji u mężczyzn leczonych
undecylenianem testosteronu (Giltay i wsp., 2010),
jak również poprawę zdolności poznawczych (Zitzmann
i wsp., 2001). Metaanaliza wyników badań randomizowanych
z grupą kontrolną wykazała znaczący wpływ podawania
testosteronu na poprawę nastroju (Amanatkar i wsp.,
2014). Korzyści związane z poprawą zdolności poznawczych
odnotowano w mniej istotnych badaniach.
 BMI – wskaźnik masy ciała; TRT – terapia zastępcza testosteronem
BMI – wskaźnik masy ciała; TRT – terapia zastępcza testosteronem
5.3. Wybór leczenia
Celem TRT jest przywrócenie fi zjologicznych poziomów
testosteronu we krwi u mężczyzn z hipogonadyzmem
(Bassil i wsp., 2009). Dostępne są liczne preparaty, różniące
się drogą podania, farmakokinetyką i działaniami ubocznymi,
a ich wybór zależy od wspólnej decyzji pacjenta
i lekarza (Calof i wsp., 2005). Krótko działające preparaty
mogą być preferowane w początkowej fazie leczenia,
tak aby wszelkie działania niepożądane, które mogą się
pojawić, można było zaobserwować i przerwać leczenie
w odpowiednim czasie (Parsons i wsp., 2005). Dostępne
preparaty występują w postaci doustnej, iniekcji domięśniowych,
żeli przezskórnych lub plastrów.
5.3.1. Preparaty
5.3.1.1. Undecylenian testosteronu
Undecylenian testosteronu jest najczęściej stosowanym
i najbezpieczniejszym preparatem doustnym. Rzadko
powoduje nadmierny wzrost poziomu testosteronu ponad
środkowe wartości poziomów prawidłowych i dlatego
rzadko wywołuje działania niepożądane (Bassil i wsp.,
2009). Przy podawaniu doustnym absorpcja zależy
od jednoczesnego przyjmowania pokarmu bogatego
w tłuszcze.
Undecylenian testosteronu jest dostępny również
jako preparat długo działający podawany domięśniowo
(w odstępach do 3 miesięcy). Długotrwałe działanie
umożliwia utrzymanie prawidłowego stężenia testosteronu
w surowicy przez cały czas, ale z drugiej strony,
w razie pojawienia się działań ubocznych, długi okres
pozbywania się leku z ustroju stwarza większe problemy
(Wang i wsp., 2010).
5.3.1.2. Cypionat i enantan testosteronu
Cypionat i enantan testosteronu dostępne są jako preparaty
krótko działające do podawania domięśniowego
(w odstępach 2–3 tygodni). Są preparatami bezpiecznymi.
Jednak w trakcie terapii tymi preparatami mogą
mieć miejsce znaczące wahania stężenia testosteronu
we krwi (od wysokiego do stężenia w dolnych granicach
normy), w związku z tym występują okresy dobrego
samopoczucia na przemian z okresami niezadowalającej
odpowiedzi klinicznej (Bhasin i Bremner, 1997; Comhaire,
2000). W trakcie terapii występuje również podwyższona
liczba erytrocytów.
5.3.1.3. Przezskórne preparaty testosteronu
Preparaty testosteronu do podawania przezskórnego
dostępne są w postaci plastrów na skórę lub żelu do smarowania.
Zapewniają one stabilny, prawidłowy poziom
testosteronu w surowicy w ciągu 24 godzin (podawanie
codzienne). Częste działania niepożądane to podrażnienia
skóry w miejscu aplikacji (plastry) oraz ryzyko
przeniesienia substancji na inną osobę, jeśli nie zostaną
podjęte odpowiednie środki ostrożności (żel) (Lakshman
i Basaria, 2009; Swerdloff i Wang, 2005). Miejscowe stosowanie
2% testosteronu w okolicę pachy ostatnio zyskuje
coraz większą popularność: w międzynarodowym
otwartym badaniu klinicznym wykazano, że jest to bezpieczna
i skuteczna metoda, zatwierdzona w Stanach
Zjednoczonych i Europie (Muram i Baygani, 2014; Muram
i wsp., 2012; Wang i wsp., 2011).
Podpoliczkowe i pod 5.3.1.4. językowe preparaty
testosteronu
Podpoliczkowe i podjęzykowe tabletki z testosteronem
są skutecznymi i dobrze tolerowanymi preparatami, które
mogą zapewnić szybkie osiągnięcie jednolitego fi zjologicznego
poziomu testosteronu przy podawaniu raz dziennie
(Salehian i wsp., 1995; Wang i wsp., 2004).
5.3.1.5. Podskórne preparaty testosteronu
o przedłużonym działaniu
Podskórne preparaty testosteronu o przedłużonym działaniu
(depot) muszą być wszczepiane co 5–7 miesięcy.
Zapewniają długi okres działania bez znaczących wahań
poziomu testosteronu w surowicy krwi. Ryzyko wynikające
z korzystania z tego sposobu podawania jest związane
z zakażeniami oraz możliwością wypadnięcia implantu,
które mogą występować nawet u 10% chorych (Bassil
i wsp., 2009; Jockenhovel i wsp., 1996; Kelleher i wsp., 2001).
5.4. Płodność a hipogonadyzm
Egzogenne podawanie testosteronu zmniejsza endogenną
produkcję testosteronu poprzez ujemne sprzężenie
zwrotne w osi podwzgórze–przysadka–gonady. Jeśli
hipogonadyzmowi wtórnemu towarzyszy niepłodność,
powinno się rozważyć zastosowanie hCG, zwłaszcza
u mężczyzn z obniżonym poziomem gonadotropin.
Gonadotropina kosmówkowa stymuluje produkcję testosteronu
w komórkach Leydiga. Jej zastosowanie powinno
być ograniczone do pacjentów z wtórną postacią hipogonadyzmu,
jeśli problem płodności ma znaczenie dla
pacjenta. Fizjologiczne poziomy testosteronu w surowicy
można osiągnąć przy zastosowaniu standardowej
dawki 1500–5000 IU (ang. international units, jednostki
międzynarodowe), podawanej domięśniowo lub podskórnie
2 razy w tygodniu. U pacjentów z hipogonadyzmem
wtórnym stosuje się hCG w połączeniu z FSH
(zwykle 150 IU 3 razy na tydzień domięśniowo lub podskórnie),
aby pobudzić spermatogenezę i poprawić płodność.
Koszt leczenia hCG jest większy niż koszt leczenia
testosteronem. Nie ma wystarczających informacji
Tabela 7. Preparaty testosteronu dostępne do terapii zastępczej
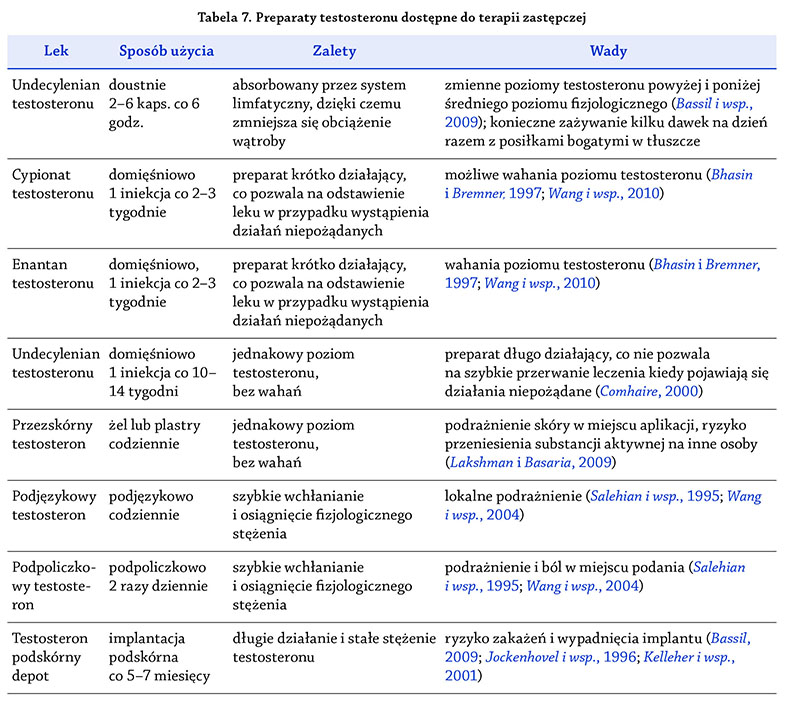 o terapeutycznych oraz niepożądanych skutkach długotrwałego
stosowania hCG, dlatego nie zaleca się rutynowego
stosowania hCG w hipogonadyzmie, z wyjątkiem
pacjentów, u których ważne jest leczenie niepłodności.
o terapeutycznych oraz niepożądanych skutkach długotrwałego
stosowania hCG, dlatego nie zaleca się rutynowego
stosowania hCG w hipogonadyzmie, z wyjątkiem
pacjentów, u których ważne jest leczenie niepłodności.
 GR – stopień rekomendacji; hCG – ludzka gonadotropina kosmówkowa;
LE – poziom wiarygodności dowodu naukowego
GR – stopień rekomendacji; hCG – ludzka gonadotropina kosmówkowa;
LE – poziom wiarygodności dowodu naukowego
Zalecenia odnośnie 5.5. terapii zastępczej
testosteronem
GR – stopień rekomendacji; hCG – ludzka gonadotropina kosmówkowa;
LE – poziom wiarygodności dowodu naukowego
Lekarze często niechętnie oferują TRT, zwłaszcza u starszych
mężczyzn, ze względu na potencjalne działania
niepożądane tej formy leczenia. Najczęstsze wątpliwości
są związane z możliwymi konsekwencjami ze strony
gruczołu krokowego i układu sercowo -naczyniowego
oraz bezdechem sennym.
5.6.1. Rak piersi u mężczyzn
Rak piersi jest rzadką chorobą u mężczyzn i stanowi mniej
niż 1% wszystkich nowotworów u mężczyzn (Johansen
Taber i wsp., 2010). Częstość występowania jest wyższa
u chorych z zespołem Klinefeltera. Leczenie testosteronem
jest przeciwwskazane u mężczyzn z obecnym lub
przebytym rakiem sutka (Wang i wsp., 2009). Związek
między TRT i rozwojem raka sutka nie jest poparty
mocnymi dowodami, aczkolwiek zanotowano kilka
przypadków opisanych na podstawie badania niewielkiej
grupy pacjentów (Medras i wsp., 2006).
5.6.2. Rak gruczołu krokowego
Testosteron ma wpływ na wzrost raka gruczołu krokowego:
badania wskazują, że hipogonadyzm wiąże się
z mniejszą częstością występowania raka gruczołu krokowego,
ale jeśli już rak gruczołu krokowego występuje
u mężczyzn z hipogonadyzmem, to zwykle jest bardziej
zaawansowany i ma wyższy wynik w punktacji Gleasona
(Severi i wsp., 2006; Stattin i wsp., 2004). Krótkoterminowe
randomizowane badania z grupą kontrolną potwierdzają
hipotezę, że TRT nie powoduje zmian w budowie
histologicznej prostaty, ani znamiennego podwyższenia
poziomów testosteronu i DHT wewnątrz gruczołu krokowego
(Marks i wsp., 2006; Shabsigh i wsp., 2009). Najnowsze
badania wskazują, że TRT nie zwiększa ryzyka zachorowania
na raka prostaty (Cooper i wsp., 1998; Fernandez-
-Balsells i wsp., 2010; Marks i wsp., 2006; Shabsigh i wsp.,
2009), ale długoterminowe dane z badań prospektywnych
nie są jeszcze dostępne. Wyniki ostatniej metaanalizy
wskazują na wyższy (ale nie statystycznie istotny) odsetek
patologii w gruczole krokowym u mężczyzn w średnim
wieku i starszych otrzymujących TRT. Mężczyźni ci częściej
są poddawani biopsji gruczołu krokowego z powodu
podwyższonego poziomu PSA (ang. prostate specifi c antigen,
antygen specyfi czny dla prostaty), często obserwowanego
wśród mężczyzn otrzymujących TRT (Calof i wsp., 2005).
Leczenie testosteronem jest bezwzględnie przeciwwskazane
u mężczyzn z rakiem gruczołu krokowego.
Dyskusyjne jest stosowanie TRT u mężczyzn z hipogonadyzmem
oraz przebytym rakiem gruczołu krokowego,
bez aktywnej choroby. Dostępne są wyniki obserwacji
niewielkiej liczby pacjentów, w stosunkowo krótkim
okresie, które nie wskazują na zwiększone ryzyko
wznowy raka prostaty (Shabsigh i wsp., 2009). Według
ostatnich retrospektywnych badań u mężczyzn hipogonadalnych
z rakiem prostaty w wywiadzie i otrzymujących
TRT, leczenie to nie wiąże się ze zwiększoną śmiertelnością
ogólną i śmiertelnością zależną od nowotworu.
Terapia zastępcza testosteronem była częściej przepisywana
pacjentom poddawanym radykalnej prostatektomii
i z dobrze zróżnicowanymi guzami (Kaplan i wsp., 2014).
Brak jest randomizowanych badań przeprowadzonych
pod kontrolą placebo, które by dokumentowały bezpieczeństwo
długoterminowego stosowania TRT (Bassil
i wsp., 2009). U mężczyzn z objawami hipogonadyzmu
po leczeniu chirurgicznym miejscowego raka gruczołu
krokowego i bez dowodów na aktywną chorobę (tzn. podwyższonego
PSA, nieprawidłowości w badaniu per rectum,
przerzutów do kości / narządów trzewnych) można
ostrożnie rozważyć TRT (Aversa i wsp., 2012; Morgentaler,
2009; Morgentaler i Morales, 2010). W tej grupie pacjentów
stosowanie TRT należy ograniczyć do chorych z niskim
ryzykiem wznowy raka prostaty (tzn. punktacja Gleasona
<8, pT1 -2, PSA przed operacją <10 ng/mL). Terapia nie
powinna rozpoczynać się przed zakończeniem 1. roku
obserwacji po zabiegu i nie powinno być cech wznowy
biochemicznej w oznaczeniach PSA (Kaufman i Graydon,
2004; Morgentaler, 2009; Morgentaler i Morales, 2010).
Pacjenci, którzy przeszli brachyterapię lub radioterapię
wiązką zewnętrzną (EBRT, ang. external beam radiation
therapy) z powodu raka prostaty o niskim ryzyku, w przypadku
hipogonadyzmu mogą być również ostrożnie
leczeni TRT, przy ścisłej kontroli nawrotu raka gruczołu
krokowego (Kaplan i wsp., 2014; Kaufman i Graydon, 2004;
Morgentaler, 2009; Sarosdy, 2007), chociaż obecnie nie ma danych z badań długoterminowych potwierdzających
bezpieczeństwo tego leczenia.
5.6.3. Choroby układu krążenia
Wiele danych wskazuje, że niedobór testosteronu i zaburzenia
erekcji są niezależnymi biologicznymi wskaźnikami
obecności chorób układu krążenia oraz ryzyka zgonu nie
tylko w przebiegu chorób układu sercowo -naczyniowego
(Muraleedharan i Jones, 2014). Najniższe ryzyko zgonu
wykazano u mężczyzn z poziomami endogennego testosteronu
w środkowych wartościach prawidłowego zakresu
(Yeap i wsp., 2014). W dwóch badaniach wykazano,
że mężczyźni ze stężeniami testosteronu w górnym kwartylu
normalnego poziomu mają mniejszą liczbę incydentów
sercowo -naczyniowych w porównaniu do mężczyzn
z pozostałych trzech niższych kwartyli (Ohlsson i wsp.,
2011; Soisson i wsp., 2013). Wiedza o tym, że hipogonadyzm
i zaburzenia erekcji są biomarkerami chorób układu
krążenia, powinna skłaniać do wykonywania u każdego
pacjenta oceny ryzyka chorób sercowo -naczyniowych
i w stosownych przypadkach kierować wybranych chorych
do kardiologa. Indywidualne czynniki ryzyka rozwoju
chorób sercowo -naczyniowych (np. styl życia, dieta,
aktywność fi zyczna, palenie tytoniu, nadciśnienie tętnicze,
cukrzyca, dyslipidemia) powinny być eliminowane lub
leczone u mężczyzn z jeszcze nie wykrytą chorobą układu
sercowo -naczyniowego. Prewencja tych czynników ryzyka
powinna być zoptymalizowana najlepiej jak to możliwe.
W niektórych badaniach wykazano korzystny wpływ
TRT na pewne czynniki ryzyka chorób układu sercowo-
-naczyniowego (Jones, 2010). Wśród mężczyzn z angiografi
cznie potwierdzoną chorobą wieńcową chorzy
z niskim poziomem testosteronu mieli wyższe ryzyko
zgonu (Corona i wsp., 2011; Malkin i wsp., 2010). Od czasu
wprowadzenia TRT nie opublikowano w literaturze
medycznej żadnych wyników badań oceniających ryzyko
wystąpienia poważnych niepożądanych zdarzeń sercowo-
-naczyniowych (MACE, ang. major cardiovascular events)
w czasie stosowania TRT (Haddad i wsp., 2007). Do MACE
zalicza się: zgon z przyczyn sercowo -naczyniowych, ostry
zawał mięśnia sercowego, ostry zespół wieńcowy, udar
mózgu i niewydolność serca. Trzy niedawno przeprowadzone
badania (jedno z grupą kontrolowaną placebo
(Basaria i wsp., 2010) i dwa badania obserwacyjne (Finkle
i wsp., 2014; Vigen i wsp., 2013) sugerują, że TRT może być
związana ze zwiększonym ryzykiem powikłań sercowo-
-naczyniowych. Badania te zostały ocenione przez amerykańską
Agencję Żywności i Leków (FDA, ang. Food and
Drug Administration), która stwierdziła, że „każde z tych
badań miało poważne ograniczenia, co wyklucza możliwość
wyciągnięcia ostatecznych wniosków” (FDA, 2014b).
Ocena ta poparta jest licznymi listami komentującymi
pracę Vigen i wsp., 2013 (FDA, 2014a). Europejska Agencja
Leków (EMA, ang. European Medicines Agency) stwierdziła,
że „Grupa Koordynacyjna ds. Wzajemnie Uznanych
i Zdecentralizowanych Procedur dla produktów leczniczych
stosowanych u ludzi (CMDh, ang. Coordination Group
for Mutual Recognition and Decentralised Procedures -human),
organ nadzorujący, reprezentujący państwa członkowskie
Unii Europejskiej, w wyniku konsensusu uzgodniła,
że nie ma spójnych dowodów na zwiększone ryzyko
rozwoju chorób sercowo -naczyniowych u mężczyzn
leczonych preparatami testosteronu z powodu niskiego
poziomu tego hormonu (zaburzenie nazywane hipogonadyzmem).
Ponadto ulotki informacyjne o preparatach
testosteronu powinny być aktualizowane zgodnie z najnowszą
dostępną wiedzą na temat bezpieczeństwa ich
stosowania i zawierać ostrzeżenie, że niedobór testosteronu
powinien być potwierdzony przez objawy kliniczne
oraz badania laboratoryjne przed rozpoczęciem leczenia”.
W badaniu starszych mężczyzn z ograniczeniem
ruchu (TOM, ang. Testosterone in Older Men with Mobility
Limitations) (Basaria i wsp., 2010) zastosowano początkowe
dawki testosteronu 2 razy większe niż zalecane,
co nie odzwierciedlało normalnej praktyki klinicznej,
i nie wykazano zwiększonego ryzyka zdarzeń sercowo-
-naczyniowych. Ostatnia dostępna, obszerna i szczegółowa
metaanaliza randomizowanych badań z grupą
kontrolowaną placebo nie wykazała przyczynowego
związku pomiędzy TRT i niepożądanymi zdarzeniami
sercowo -naczyniowymi (Corona i wsp., 2014). Nie istnieją
jednak żadne długoterminowe badania lub badania randomizowane
z grupą kontrolną, które udzieliłyby jednoznacznej
odpowiedzi. Badania obserwacyjne dowodzą,
że TRT poprawia długość życia w porównaniu do mężczyzn,
których nie leczono (Muraleedharan i wsp., 2013;
Shores i wsp., 2012). W dużym retrospektywnym badaniu
6355 mężczyzn leczonych TRT i 19 065 nieleczonych
nie wykazano zwiększonego ryzyka zawału serca przy
leczeniu TRT (Baillargeon i wsp., 2014).
Szczególną ostrożność należy jednak zachować u mężczyzn
z istniejącymi wcześniej chorobami układu krążenia.
Po pierwsze, hipogonadyzm musi być dokładnie
zdiagnozowany ponad wszelką wątpliwość. Po drugie,
jeśli TRT jest stosowana, to poziomy testosteronu we
krwi nie powinny przekraczać średnich wartości normy,
a hematokryt nie powinien przekraczać 54%. Jeśli
wartość hematokrytu przekracza 54%, należy zmniejszyć
dawkę testosteronu i/lub rozważyć upuszczenie
krwi (500 mL), co w razie potrzeby można powtarzać.
Poziom hematokrytu przekraczający 54% prowadzi
do zwiększonego ryzyka śmierci z powodów sercowo-
-naczyniowych, co wykazano w badaniu Framingham
Heart Study (Gagnon i wsp., 1994), a co zostało niedawno
powtórnie potwierdzone w badaniu Boff etta i wsp. (2013).
Podwyższony hematokryt wiąże się ze zwiększonym
ryzykiem zakrzepicy we wrodzonej idiopatycznej erytrocytozie
(McMullin i wsp., 2005). Większość pacjentów
z chorobami układu krążenia otrzymuje leczenie przeciwkrzepliwe.
U mężczyzn z hipogonadyzmem można
rozważyć wykonanie elektrokardiogramu przed rozpoczęciem
leczenia testosteronem.
W jednym z badań odnotowano 42 przypadki żylnej
choroby zakrzepowo -zatorowej u pacjentów stosujących
TRT, z których 40 miało współistniejącą trombofi lię (niedobór
czynnika V Leiden, mutacje genu protrombiny,
homocysteinurię), jednak u 39 z nich trombofi lię zdiagnozowano
dopiero po zdarzeniu zakrzepowo -zatorowym.
Wysoki poziom endogennego testosteronu i/lub estradiolu
nie jest związany ze zwiększonym ryzykiem żylnej
choroby zakrzepowo -zatorowej (Holmegard i wsp., 2014).
Terapia zastępcza testosteronem jest przeciwwskazana
u mężczyzn z ciężką przewlekłą niewydolnością serca,
z retencją płynów, która może prowadzić do zaostrzenia
choroby. Niektóre badania, w tym jedno 12 -miesięczne,
wykazały, że mężczyźni z umiarkowaną przewlekłą niewydolnością
serca (klasa NYHA III) mogą odnosić korzyść
z podawania niskich dawek testosteronu, które umożliwiają
osiągnięcie poziomu testosteronu w środkowych
wartościach prawidłowego zakresu (Caminiti i wsp., 2009;
Malkin i wsp., 2006; Pugh i wsp., 2004). Jeśli zostanie
podjęta decyzja o leczeniu hipogonadyzmu u mężczyzn
z przewlekłą niewydolnością serca, to konieczne jest,
aby pacjent był poddawany regularnej ocenie klinicznej,
badaniu poziomu testosteronu i hematokrytu.
5.6.4. Obturacyjny bezdech senny
Brak jest spójnych dowodów wiążących TRT z obturacyjnym
bezdechem sennym (OSA, ang. obstructive sleep
apnoea). Nie ma również dowodów na to, że TRT może
prowadzić do wystąpienia lub pogorszenia tego schorzenia
(Hanafy i wsp., 2007).
5.7. Podsumowanie i zalecenia odnośnie czynników
ryzyka terapii testosteronem

 6. Monitorowanie chorych
6. Monitorowanie chorych
6.1. Monitorowanie chorych poddanych terapii
testosteronem
U pacjentów otrzymujących leczenie testosteronem jest
konieczna regularna kontrola, ponieważ istnieje potencjalne
ryzyko wystąpienia działań niepożądanych zależnych
od androgenów w trakcie leczenia TRT. Skutki
uboczne TRT są ograniczone, ale częstość ich występowania
i znaczenie kliniczne nie są jeszcze w pełni wyjaśnione.
Głównym celem TRT jest złagodzenie objawów
klinicznych niedoboru testosteronu. Uważna ocena
nasilenia objawów klinicznych niedoboru testosteronu
powinna być ważną częścią każdej wizyty kontrolnej.
Odczuwalny wpływ TRT na zachowania seksualne może
pojawić się już po 3 tygodniach leczenia i osiągnąć plateau
po 6 tygodniach (Saad i wsp., 2011). Poprawa erekcji i ejakulacji
może wymagać do 6 miesięcy leczenia (Saad i wsp.,
2011). Poprawa jakości życia, a także na samopoczucie,
może stać się zauważalne w ciągu 1 miesiąca, ale osiągnięcie
maksymalnego efektu może zająć więcej czasu
(Saad i wsp., 2011).
6.2. Poziom testosteronu
Nie ma jeszcze wystarczających danych, aby zdefi niować
optymalny poziom testosteronu w surowicy krwi w czasie
stosowania TRT. Eksperci sugerują, że TRT powinna przywracać
poziom testosteronu w surowicy do połowy prawidłowego
zakresu dla odpowiedniej grupy wiekowej
mężczyzn, co jest zazwyczaj wystarczające do złagodzenia
objawów niedoboru tego hormonu. Optymalna kontrola
poziomu testosteronu w surowicy zależy od zastosowanej
postaci farmakologicznej testosteronu.
6.3. Gęstość kości
Gęstość mineralna kości (BMD, ang. bone mineral density)
powinna być kontrolowana tylko u chorych, u których
BMD było nieprawidłowe przed rozpoczęciem TRT.
Wzrost BMD w kręgosłupie lędźwiowym może być
wykrywalny już po 6 miesiącach stosowania TRT i trwać
przez 3 następne lata (Saad i wsp., 2011).
6.4. Hematokryt
Ważne jest, aby podczas pobierania próbki krwi
do pomiaru hematokrytu stosować tylko minimalny ucisk
żyły, lub nie stosowanie go wcale (McMullin i wsp., 2005).
Podwyższony hematokryt jest najczęstszym efektem
ubocznym TRT. Znaczenie kliniczne wysokiego hematokrytu
jest niejasne, ale może on powodować nadmierną
lepkość krwi i zwiększone ryzyko wystąpienia zakrzepicy
(Holmegard i wsp., 2014). Pobudzający wpływ TRT
na erytropoezę staje się widoczny po 3 miesiącach i osiąga
maksimum po 12 miesiącach (Saad i wsp., 2011).
6.5. Gruczoł krokowy
Stosowanie TRT może powodować nieznaczne zwiększenie
stężenia PSA we krwi i zwiększenie objętości gruczołu
krokowego, osiągając plateau w 12. miesiącu leczenia
(Saad i wsp., 2011). Wcześniejsze obawy, że TRT może
zwiększyć ryzyko zachorowania na raka gruczołu krokowego,
zostały podważone przez wyniki licznych metaanaliz
(Calof i wsp., 2005; Marks i wsp., 2006; Shabsigh i wsp.,
2009; Fernandez -Balsells i wsp., 2010). Jednakże nie ma
wystarczającej ilości danych z badań długoterminowych
wskazujących, że stosowanie TRT jest pozbawione ryzyka
zachorowania na raka gruczołu krokowego. W związku
z tym monitorowanie prostaty jest nadal zalecane. Pacjenci
ze znacznym lub ciągłym wzrostem stężenia PSA powinni
być badani w celu wykluczenia raka gruczołu krokowego.
6.6. Układ krążenia
Należy zachować ostrożność u mężczyzn z współistniejącymi
chorobami układu krążenia. U mężczyzn cierpiących
na przewlekłą niewydolność serca TRT może powodować
zatrzymanie płynów i nasilenie objawów (Malkin
i wsp., 2006; Pugh i wsp., 2004). Jeśli zostanie podjęta
decyzja o leczeniu hipogonadyzmu u mężczyzn z przewlekłą
niewydolnością serca, istotne jest, żeby pacjent
był pod stałą opieką kliniczną, a pomiar poziomu testosteronu
i hematokrytu odbywał się regularnie.
6.7. Wskazania odnośnie monitorowania chorych
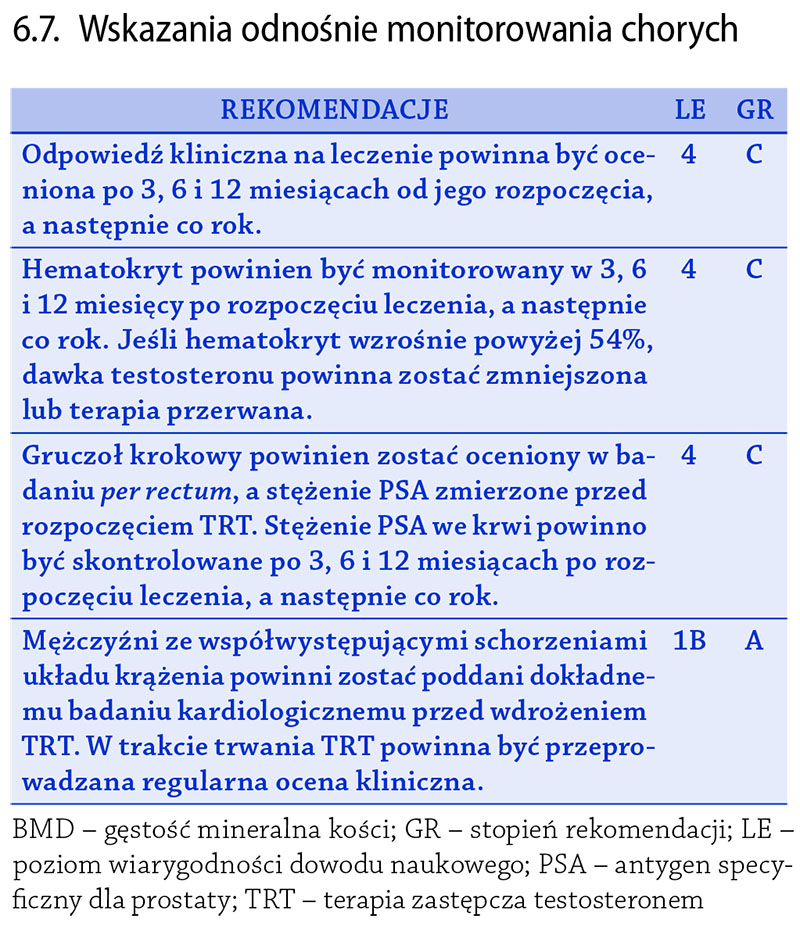 BMD – gęstość mineralna kości; GR – stopień rekomendacji; LE –
poziom wiarygodności dowodu naukowego; PSA – antygen specyfi
czny dla prostaty; TRT – terapia zastępcza testosteronem
BMD – gęstość mineralna kości; GR – stopień rekomendacji; LE –
poziom wiarygodności dowodu naukowego; PSA – antygen specyfi
czny dla prostaty; TRT – terapia zastępcza testosteronem
7. Piśmiennictwo
Amanatkar H.R., Chibnall J.T., Seo B.W., Manepalli J.N., Grossberg G.T.: Impact
of exogenous testosterone on mood: a systematic review and meta -analysis of
randomized placebo -controlled trials. Ann Clin Psychiatry. 2014, 26 (1), 19–32.
Araujo A.B., Dixon J.M., Suarez E.A., Murad M.H., Guey L.T., Wittert G.A.:
Clinical review: Endogenous testosterone and mortality in men: a systematic
review and metaanalysis. J Clin Endocrinol Metab. 2011, 96 (10), 3007–3019.
Aversa A., Francomano D., Lenzi A.: Cardiometabolic complications after androgen
deprivation therapy in a man with prostate cancer: eff ects of 3 years intermittent
testosterone supplementation. Front Endocrinol (Lausanne). 2012, 3, 17, 1–4.
Baillargeon J., Urban R.J., Kuo Y.F., Ottenbacher K.J., Raji M.A., Du F. i wsp.:
Risk of Myocardial Infarction in Older Men Receiving Testosterone Th erapy.
Ann Pharmacother. 2014, 48 (9), 1138–1144.
Basaria S., Coviello A.D., Travison T.G., Storer T.W., Farewell W.R., Jette
A.M. i wsp.: Adverse events associated with testosterone administration.
N Engl J Med. 2010, 363 (2), 109–122.
Bassil N., Alkaade S., Morley J.E.: Th e benefi ts and risks of testosterone replacement
therapy: a review. Th er Clin Risk Manag. 2009, 5 (3), 427–448.
Behre H.M., Nieschlag E., Partsch C.J., Wieacker P., Simoni M.: Diseases of the
hypothalamus and the pituitary gland. W: Red. E. Nieschlag, H.M. Behre,
S. Nieschlag. Andrology: male reproductive health and dysfunction.
Springer-Verlag, Berlin–Heidelberg, 2010, 169–192.
Bentvelsen F.M., McPhaul M.J., Wilson J.D., George F.W.: Th e androgen receptor
of the urogenital tract of the fetal rat is regulated by androgen. Mol Cell
Endocrinol. 1994, 105 (1), 21–26.
Bhasin S., Bremner W.J.: Clinical review 85: Emerging issues in androgen
replacement therapy. J Clin Endocrinol Metab. 1997, 82 (1), 3–8.
Bhasin S., Cunningham G.R., Hayes F.J., Matsumoto A.M., Snyder P.J., Swerdloff
R.S. i wsp.: Testosterone therapy in men with androgen defi ciency syndromes:
an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab.
2010 95 (6), 2536–2559.
Bhasin S., Pencina M., Jasuja G.K., Travison T.G., Coviello A., Orwoll E. i wsp.:
Reference ranges for testosterone in men generated using liquid chromatogra phy tandem mass spectrometry in a community -based sample of healthy nonobese
young men in the Framingham Heart Study and applied to three geographically
distinct cohorts. J Clin Endocrinol Metab. 2011, 96 (8), 2430–2439.
Bhasin S., Woodhouse L., Casaburi R., Singh A.B., Bhasin D., Berman N. i wsp.:
Testosterone dose -response relationships in healthy young men. Am J Physiol
Endocrinol Metab. 2001, 281 (6), E1172–1181.
Boff etta P., Islami F., Vedanthan R., Pourshams A., Kamangar F., Khademi H. i wsp.:
A U -shaped relationship between haematocrit and mortality in a large prospective
cohort study. Int J Epidemiol. 2013, 42 (2), 601–615.
Bojesen A., Juul S., Gravholt C.H.: Prenatal and postnatal prevalence of
Klinefelter syndrome: a national registry study. J Clin Endocrinol Metab.
2003, 88 (2), 622–626.
Bolona E.R., Uraga M.V., Haddad R.M., Tracz M.J., Sideras K., Kennedy C.C. i wsp.:
Testosterone use in men with sexual dysfunction: a systematic review and
meta -analysis of randomized placebo -controlled trials. Mayo Clin Proc.
2007, 82 (1), 20–28.
Bremner W.J., Vitiello M.V., Prinz P.N.: Loss of circadian rhythmicity in blood
testosterone levels with aging in normal men. J Clin Endocrinol Metab.
1983, 56 (6), 1278–1281.
Brinkmann A.O.: Molecular basis of androgen insensitivity. Mol Cell
Endocrinol. 2001, 179 (1 -2), 105–109.
Brinkmann A.O.: Molecular mechanisms of androgen action – a historical
perspective. Methods Mol Biol. 2011, 776, 3–24.
Buchter D., Behre H.M., Kliesch S., Nieschlag E.: Pulsatile GnRH or human
chorionic gonadotropin/human menopausal gonadotropin as eff ectivetreatment
for men with hypogonadotropic hypogonadism: a review of 42
cases. Eur J Endocrinol. 1998, 139 (3), 298–303.
Buvat J., Lemaire A.: Endocrine screening in 1,022 men with erectile dysfunction:
clinical signifi cance and cost -eff ective strategy. J Urol. 1997, 158 (5), 1764–1767.
Calof O.M., Singh A.B., Lee M.L., Kenny A.M., Urban R.J., Trenover J.L. i wsp.:
Adverse events associated with testosterone replacement in middle -aged
and older men: a meta -analysis of randomized, placebo -controlled trials.
J Gerontol A Biol Sci Med Sci. 2005, 60 (11), 1451–1457.
Caminiti G., Volterrani M., Iellamo F., Marazzi G., Massaro R., Miceli M i wsp.:
Eff ect of long -acting testosterone treatment on functional exercise capacity,
skeletal muscle performance, insulin resistance, and barorefl ex sensitivity in
elderly patients with chronic heart failure a doubleblind, placebo -controlled,
randomized study. J Am Coll Cardiol. 2009, 54 (10), 919–927.
Canale D., Caglieresi C., Moschini C., Liberati C.D., Macchia E., Pinchera A. i wsp.:
Androgen receptor polymorphism (CAG repeats) and androgenicity. Clin
Endocrinol (Oxf). 2005, 63 (3), 356–361.
Comhaire F.H.: Andropause: hormone replacement therapy in the ageing
male. Eur Urol. 2000, 38 (6), 655–662.
Cooper C.S., Perry P.J., Sparks A.E., MacIndoe J.H., Yates W.R., Williams R.D.: Eff ect
of exogenous testosterone on prostate volume, serum and semen prostate
specifi c antigen levels in healthy young men. J Urol. 1998, 159 (2), 441–443.
Corona G., Isidori A.M., Buvat J., Aversa A., Rastrelli G., Hackett G. i wsp.:
Testosterone supplementation and sexual function: a meta -analysis study.
J Sex Med. 2014, 11 (6), 1577–1592.
Corona G., Maseroli E., Rastrelli G., Isidori A.M., Sforza A., Mannucci E. i wsp.:
Cardiovascular risk associated with testosterone -boosting medications:
a systematic review and meta -analysis. Expert Opin Drug Saf. 2014, 13
(10), 1327–1351.
Corona G., Rastrelli G., Monami M., Guay A., Buvat J., Sforza A. i wsp.:
Hypogonadism as a risk factor for cardiovascular mortality in men: a meta-
-analytic study. Eur J Endocrinol. 2011, 165 (5), 687–701.
Eberhard J., Ståhl O., Cwikiel M., Cavallin -Ståhl E., Giwercman Y., Salmonson
E.C. i wsp.: Risk factors for post -treatment hypogonadism in testicular cancer
patients. Eur J Endocrinol. 2008, 158 (4), 561–570.
FDA. Advisory committee industry briefi ng document. Testosterone therapy.
Bone, reproductive and urologic drugs advisory committee and the drug
safety and risk management advisory committee. 2014a
FDA. Briefi ng Information for the September 17, 2014b, Joint Meeting of the
Bone, Reproductive and Urologic Drugs Advisory Committee [BRUDAC] and
the Drug Safety and Risk Management [DSaRM] Advisory Committee Meeting.
Fernandez -Balsells M.M., Murad M.H., Lane M., Lampropulos J.F., Albuquerque
F., Mullan R.J. i wsp.: Clinical review 1: Adverse eff ects of testosterone therapy
in adult men: a systematic review and meta -analysis. J Clin Endocrinol
Metab. 2010, 95 (6), 2560–2575.
Finkle W.D., Greenland S., Ridgeway G.K., Adams J.L., Frasco M.A., Cook
M.B. i wsp.: Increased risk of non -fatal myocardial infarction following testosterone
therapy prescription in men. PLoS One. 2014, 9 (1), p. e85805.
Gagnon D.R., Zhang T.J., Brand F.N., Kannel W.B.: Hematocrit and the risk of
cardiovascular disease – the Framingham study: a 34 -year follow up. Am
Heart J. 1994, 127 (3), 674–682.
Giltay E.J., Tishova Y.A., Mskhalaya G.J., Gooren L.J., Saad F. i wsp.: Eff ects of
testosterone supplementation on depressive symptoms and sexual dysfunction
in hypogonadal men with the metabolic syndrome. J Sex Med. 2010,
7 (7), 2572–2582.
Haddad R.M., Kennedy C.C., Caples S.M., Tracz M.J., Bolona E.R., Snideras
K. i wsp.: Testosterone and cardiovascular risk in men: a systematic review
and meta -analysis of randomized placebo -controlled trials. Mayo Clin Proc.
2007, 82 (1), 29–39.
Hall S.A., Esche G.R., Araujo A.B., Travison T.G., Clark R.V., Williams R.E. i wsp.:
Correlates of low testosterone and symptomatic androgen defi ciency in
a population -based sample. J Clin Endocrinol Metab. 2008, 93 (10), 3870–3877.
Hanafy H.M.: Testosterone therapy and obstructive sleep apnea: is there
a real connection? J Sex Med. 2007, 4 (5), 1241–1246.
Haring R., Volzke H., Steveling A., Krebs A., Felix S.B., Schofl C. et al.: Association
of low testosterone levels with all -cause mortality by diff erent cut -off s from
recent studies. Eur Heart J. 2010, 31 (12), 1494–1501.
Holmegard H.N., Nordestgaard B.G., Schnohr P., Tybjerg -Hansen A., Benn M.:
Endogenous sex hormones and risk of venous thromboembolism in women
and men. J Th romb Haemost. 2014, 12 (3), 297–305.
Huhtaniemi I., Alevizaki M.: Gonadotrophin resistance. Best Pract Res Clin
Endocrinol Metab. 2006, 20 (4), 561–576.
Isidori A.M., Gianetta E., Greco E.A., Gianfrilli D., Bonifacio V., Isidori A. i wsp.:
Eff ects of testosterone on body composition, bone metabolism and serum
lipid profi le in middle -aged men: a meta -analysis. Clin Endocrinol (Oxf).
2005, 63 (3), 280–293.
Jockenhovel F., Vogel E., Kreutzer M., Reinhardt W., Lederbogen S., Reinwein D.:
Pharmacokinetics and pharmacodynamics of subcutaneous testosterone
implants in hypogonadal men. Clin Endocrinol (Oxf). 1996, 45 (1), 61–71.
Johansen Taber K.A., Morisy L.R., Osbahr A.J., Dickinson B.D.: Male breast
cancer: risk factors, diagnosis, and management. Oncol Rep. 2010, 24 (5),
1115–1120.
Jones T.H.: Testosterone defi ciency: a risk factor for cardiovascular disease?
Trends Endocrinol Metab. 2010, 21 (8), 496–503.
Kaplan A.L., Trinh Q.D., Sun M., Carter S.C., Nguyen P.L., Shih Y.C. i wsp.:
Testosterone replacement therapy following the diagnosis of prostate cancer:
outcomes and utilization trends. J Sex Med. 2014, 11 (4), 1063–1070.
Kapoor D., Goodwin E., Channer K.S., Jones T.H.: Testosterone replacement
therapy improves insulin resistance, glycaemic control, visceral adiposity
and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur
J Endocrinol. 2006, 154 (6), 899–906.
Kaufman J.M., Graydon R.J.: Androgen replacement after curative radical
prostatectomy for prostate cancer in hypogonadal men. J Urol. 2004, 172
(3), 920–922.
Kaufman J.M., Vermeulan A.: Th e decline of androgen levels in elderly men and
its clinical and therapeutic implications. Endocr Rev. 2005, 26 (6), 833–876.
Kelleher S., Conway A.J., Handelsman D.J.: Infl uence of implantation site and
track geometry on the extrusion rate and pharmacology of testosterone
implants. Clin Endocrinol (Oxf). 2001, 55 (4), 531–536.
Lakshman K.M., Basaria S.: Safety and effi cacy of testosterone gel in the treatment
of male hypogonadism. Clin Interv Aging. 2009, 4, 397–412.
Lanfranco F., Kamischke A., Zitzmann M., Nieschlag E.: Klinefelter’s syndrome.
Lancet. 2004, 364 (9430), 273–283.
Malkin C.J., Pugh P.J., Morris P.D., Asif S., Jones T.H., Channer K.S.: Low
serum testosterone and increased mortality in men with coronary heart
disease. Heart. 2010, 96 (22), 1821–1825.
Malkin C.J., Pugh P.J., West J.N., van Beek E.J., Jones T.H., Channer K.S.:
Testosterone therapy in men with moderate severity heart failure: a double-
-blind randomized placebo controlled trial. Eur Heart J. 2006, 27 (1),
57–64.
Marks L.S., Mazer N.A., Mostaghel E., Hess D.L., Dorey F.J., Epstein J.I. i wsp.:
Eff ect of testosterone replacement therapy on prostate tissue in men with
late -onset hypogonadism: a randomized controlled trial. JAMA. 2006, 296
(19), 2351–2361.
McLachlan R.I., O’Donnell L., Meachem S.J., Stanton P.G., de Kretser D.M., Pratis
K. i wsp.: Hormonal regulation of spermatogenesis in primates and man:
insights for development of the male hormonal contraceptive. J Androl.
2002, 23 (2), 149–162.
McMullin M.F., Bareford D., Campbell P., Green A.R., Harrison C., Hunt B. i wsp.:
Guidelines for the diagnosis, investigation and management of polycythaemia/
erythrocytosis. Br J Haematol. 2005, 130 (2), 174–195
Medras M., Filus A., Jozkow P., Winowski J., Sicinska -Werner T.: Breast cancer
and long -term hormonal treatment of male hypogonadism. Breast Cancer
Res Treat. 2006, 96 (3), 263–265.
Moon du G., Park M.G., Lee S.W., Park K., Kim S.W., Park N.C. i wsp.: Th e
effi cacy and safety of testosterone undecanoate [Nebido[[R]] in testosterone
defi ciency syndrome in Korean: a multicenter prospective study. J Sex
Med. 2010, 7 (6), 2253–2260.
Moore C., Huebler D., Zimmermann T., Heinemann L.A., Saad F., Th ai D.M.: Th e
Aging Males’ Symptoms scale (AMS) as outcome measure for treatment of
androgen defi ciency. Eur Urol. 2004, 46 (1), 80–87.
Morgentaler A.: Testosterone, cardiovascular risk, and hormonophobia. J Sex
Med. 2014, 11 (6), 1362–1366.
Morgentaler A.: Testosterone therapy in men with prostate cancer: scientifi c
and ethical considerations. J Urol. 2009, 181 (3), 972–979.
Morgentaler A., Morales A.: Should hypogonadal men with prostate cancer
receive testosterone? J Urol. 2010, 184 (4), 1257–1260.
Morley J.E., Charlton E., Patrick P., Kaiser F.E., Cadeau P., McReady D. i wsp.:
Validation of a screening questionnaire for androgen defi ciency in aging
males. Metabolism. 2000, 49 (9), 1239–1242.
Muraleedharan V., Jones T.H.: Testosterone and mortality. Clin Endocrinol
(Oxf). 2014, 81 (4), 477–487.
Muraleedharan V., Marsh H., Kapoor D., Channer K.S., Jones T.H.: Testosterone
defi ciency is associated with increased risk of mortality and testosterone
replacement improves survival in men with type 2 diabetes. Eur J Endocrinol.
2013, 169 (6), 725–733.
Muram D., Baygani S.: Comparability of single measurements of serum testosterone
to the 24 -hour C(avg) in patients using testosterone 2% solution.
J Sex Med. 2014, 11 (11), 2826–2829.
Muram D., Melby T., Alles Kingshill E.: Skin reactions in a phase 3 study of
a testosterone topical solution applied to the axilla in hypogonadal men.
Curr Med Res Opin. 2012, 28 (5), 761–766.
Nieschlag E., Behre H.M., Nieschlag S. (red.): Andrology: male reproductive
health and dysfunction. Springer -Verlag, Berlin Heidelberg 2010.
Nieschlag E., Behre H.M.: Testosterone: action, defi ciency, substitution.
Cambridge University Press, Cambridge 2004.
Nieschlag E., Swerdloff R., Behre H.M., Gooren L.J., Kaufman J.M., Legros J.J. i wsp.:
Investigation, treatment and monitoring of late -onset hypogonadism in
males. ISA, ISSAM, and EAU recommendations. Eur Urol. 2005, 48 (1), 1–4.
Nord C., Bjøro T., Ellingsen D., Mykletun A., Dahl O., Klepp O. i wsp.: Gonadal
hormones in long -term survivors 10 years after treatment for unilateral
testicular cancer. Eur Urol. 2003, 44 (3), 322–328.
Ohlsson C., Barrett -Connor E., Bhasin S., Orwoll E., Labrie F., Karlsson M.K. i wsp.:
High serum testosterone is associated with reduced risk of cardiovascular
events in elderly men. Th e MrOS (Osteoporotic Fractures in Men) study in
Sweden. J Am Coll Cardiol. 2011, 58 (16), 1674–1681.
Parker K.L., Schimmer B.P., Schedl A.: Genes essential for early events in
gonadal development. Cell Mol Life Sci. 1999, 55 (6 -7), 831–838.
Parsons J.K., Carter H.B., Platz E.A., Wright E.J., Landis P., Metter E.J.: Serum
testosterone and the risk of prostate cancer: potential implications for
testosterone therapy. Cancer Epidemiol Biomarkers Prev. 2005, 14 (9),
2257–2260.
Pitteloud N., Durrani S., Raivio T., Sykiotis G.P.: Complex genetics in idiopathic
hypogonadotropic hypogonadism. Front Horm Res. 2010, 39, 142–153.
Pugh P.J., Jones R.D., West J.N., Jones T.H., Channer K.S.: Testosterone treatment
for men with chronic heart failure. Heart. 2004, 90 (4), 446–447.
Puhse G., Secker A., Kemper S., Hertle L., Kliesch S.: Testosterone defi ciency in
testicular germ -cell cancer patients is not infl uenced by oncological treatment.
Int J Androl. 2011, 34 (5 Pt 2), e351–357.
Rajender S., Singh L., Th angaraj K.: Phenotypic heterogeneity of mutations in
androgen receptor gene. Asian J Androl. 2007, 9 (2), 147–179.
de Ronde W., de Jong F.H.: Aromatase inhibitors in men: eff ects and therapeutic
options. Reprod Biol Endocrinol. 2011, 9, 93.
Rosner W., Auchus R.J., Azziz R., Sluss P.M., Raff H.: Position statement: Utility,
limitations, and pitfalls in measuring testosterone: an Endocrine Society
position statement. J Clin Endocrinol Metab. 2007, 92 (2), 405–413.
Rosner W., Vesper H.: Toward excellence in testosterone testing: a consensus
statement. J Clin Endocrinol Metab. 2010, 95 (10), 4542–4548.
Saad F., Aversa A., Isidori A.M., Zafalon L., Zitzmann M., Gooren L. i wsp.: Onset
of eff ects of testosterone treatment and time span until maximum eff ects
are achieved. Eur J Endocrinol. 2011, 165 (5), 675–685.
Saad F., Haider A., Doros G., Traish A.: Long -term treatment of hypogonadal
men with testosterone produces substantial and sustained weight loss.
Obesity (Silver Spring). 2013, 21 (10), 1975–1981.
Salehian B., Wang C., Alexander G., Davidson T., McDonald V., Berman N. i wsp.:
Pharmacokinetics, bioeffi cacy, and safety of sublingual testosterone cyclodextrin
in hypogonadal men: comparison to testosterone enanthate –
a clinical research center study. J Clin Endocrinol Metab. 1995, 80 (12),
3567–3575.
Sarosdy M.F.: Testosterone replacement for hypogonadism after treatment
of early prostate cancer with brachytherapy. Cancer. 2007, 109 (3), 536–541.
Sedlmeyer I.L., Hirschhorn J.N., Palmert M.R.: Pedigree analysis of constitutional
delay of growth and maturation: determination of familial aggregation
and inheritance patterns. J Clin Endocrinol Metab. 2002, 87 (12),
5581–5586.
Severi G., Morris H.A., MacInnis R.J., English D.R., Tilley W., Hooper J.L. i wsp.:
Circulating steroid hormones and the risk of prostate cancer. Cancer
Epidemiol Biomarkers Prev. 2006, 15 (1), 86–91.
Shabsigh R., Crawford E.D., Nehra A., Slawin K.M.: Testosterone therapy in
hypogonadal men and potential prostate cancer risk: a systematic review.
Int J Impot Res. 2009, 21 (1), 9–23.
Shores M.M., Smith N.L., Forsberg C.W., Anawalt B.D., Matsumoto A.M.:
Testosterone treatment and mortality in men with low testosterone levels.
J Clin Endocrinol Metab. 2012, 97 (6), 2050–2058.
Singh J., O’Neill C., Handelsman D.J.: Induction of spermatogenesis by androgens
in gonadotropin -defi cient (hpg) mice. Endocrinology. 1995, 136 (12),
5311–5321.
Smith K.W., Feldman H.A., McKinlay J.B.: Construction and fi eld validation
of a self -administered screener for testosterone defi ciency (hypogonadism)
in ageing men. Clin Endocrinol (Oxf). 2000, 53 (6), 703–711.
Soisson V., Brailly -Tabard S., Helmer C., Rouaud O., Ancelin M.L., Zerhouni
C. i wsp.: A J -shaped association between plasma testosterone and risk of
ischemic arterial event in elderly men: the French 3C cohort study. Maturitas.
2013, 75 (3), 282–288.
Stattin P., Lumme S., Tenkanen L., Alfthan H., Jellum E., Hallmans G. i wsp.:
High levels of circulating testosterone are not associated with increased
prostate cancer risk: a pooled prospective study. Int J Cancer. 2004, 108
(3), 418–424.
Storer T.W., Woodhouse L., Magliano L., Singh A.B., Dzekov C., Dzekov J. i wsp.:
Changes in muscle mass, muscle strength, and power but not physical function
are related to testosterone dose in healthy older men. J Am Geriatr
Soc. 2008, 56 (11), 1991–1999.
Sun Y.T., Irby D.C., Robertson D.M., de Kretser D.M.: Th e eff ects of exogenously
administered testosterone on spermatogenesis in intact and hypophysectomized
rats. Endocrinology. 1989, 125 (2), 1000–1010.
Swerdloff R.S., Wang C.: Transdermal androgens: pharmacology and applicability
to hypogonadal elderly men. J Endocrinol Invest. 2005, 28 (3 Suppl),
112–116.
Sykiotis G.P., Hoang X.H., Avbelj M., Hayes F.J., Th ambundit A., Dwyer A. i wsp.:
Congenital idiopathic hypogonadotropic hypogonadism: evidence of defects
in the hypothalamus, pituitary, and testes. J Clin Endocrinol Metab. 2010,
95 (6), 3019–3027.
Tracz M.J., Sideras K., Bolona E.R., Haddad R.M., Kennedy C.C., Uraga M.V. i wsp.:
Testosterone use in men and its eff ects on bone health. A systematic review
and meta -analysis of randomized placebo -controlled trials. J Clin Endocrinol
Metab. 2006, 91 (6), 2011–2016.
Traggiai C., Starhope R.: Delayed puberty. Best Pract Res Clin Endocrinol
Metab. 2002, 16 (1), 139–151.
Traish A.M., Haider A., Doros G., Saad F.: Long -term testosterone therapy
in hypogonadal men ameliorates elements of the metabolic syndrome:
an observational, long -term registry study. Int J Clin Pract. 2014, 68 (3),
314–329.
Tuttelmann F., Gromoll J.: Novel genetic aspects of Klinefelter’s syndrome.
Mol Hum Reprod. 2010, 16 (6), 386–395.
Vesper H.W., Bhasin S., Wang C., Tai S.S., Dodge L.A., Singh R.J. i wsp.:
Interlaboratory comparison study of serum total testosterone (corrected)
measurements performed by mass spectrometry methods. Steroids. 2009,
74 (6), 498–503.
Vigen R., O’Donnell C.I., Baron A.E., Grunwald G.K., Maddox T.M., Bradley
S.M. i wsp.: Association of testosterone therapy with mortality, myocardial
infarction, and stroke in men with low testosterone levels. JAMA. 2013,
310 (17), 1829–1836.
Wang C., Catlin D.H., Demers L.M., Starcevic B., Swerdloff R.S.: Measurement
of total serum testosterone in adult men: comparison of current laboratory
methods versus liquid chromatography -tandem mass spectrometry. J Clin
Endocrinol Metab 2004, 89 (2), 534–543.
Wang C., Harnett M., Dobs A.S., Swerdloff R.S.: Pharmacokinetics and safety
of long -acting testosterone undecanoate injections in hypogonadal men: an
84 -week phase III clinical trial. J Androl. 2010, 31 (5), 457–465.
Wang C., Ilani N., Arver S., McLachlan R.I., Soulis T., Watkinson A.: Effi cacy
and safety of the 2% formulation of testosterone topical solution applied
to the axillae in androgen -defi cient men. Clin Endocrinol (Oxf). 2011, 75
(6), 836–843.
Wang C., Nieschlag E., Swerdloff F., Behre H.M., Hellstrom W.J., Gooren L.J. i wsp.:
Investigation, treatment, and monitoring of late -onset hypogonadism in
males: ISA, ISSAM, EAU, EAA, and ASA recommendations. Eur Urol. 2009,
55 (1), 121–130.
Wang C., Swerdloff R., Kipnes M., Matsumoto A.M., Dobs A.S., Cunningham
G. i wsp.: New testosterone buccal system (Striant) delivers physiological
testosterone levels: pharmacokinetics study in hypogonadal men. J Clin
Endocrinol Metab. 2004, 89 (8), 3821–3829.
Weinbauer G.F., Nieschlag E.: Gonadotrophin -releasing hormone analogue-
-induced manipulation of testicular function in the monkey. Hum Reprod.
1993, Suppl 2, 45–50.
Wu F.C., Tajar A., Beynon J.M., Pye S.R., Silman A.J., Finn J.D. i wsp.:
Identifi cation of late -onset hypogonadism in middle -aged and elderly men.
N Engl J Med. 2010, 363 (2), 123–135.
Wu F.C., Tajar A., Pye S.R., Silman A.J., Finn J.D., O’Neill T.W. i wsp.:
Hypothalamic -pituitary -testicular axis disruptions in older men are differentially
linked to age and modifi able risk factors: the European Male
Aging Study. J Clin Endocrinol Metab. 2008, 93 (7), 2737–2745.
Yassin A.A., Saad F., Traish A.: Testosterone undecanoate restores erectile
function in a subset of patients with venous leakage: a series of case reports.
J Sex Med. 2006, 3 (4), 727–735.
Yeap B.B., Alfonso H., Chubb S.A., Handelsman D.J., Hankey G.J., Almeida
O.P. i wsp.: In older men an optimal plasma testosterone is associated with
reduced all -cause mortality and higher dihydrotestosterone with reduced
ischemic heart disease mortality, while estradiol levels do not predict mortality.
J Clin Endocrinol Metab. 2014, 99 (1), E9–18.
Zitzmann M.: Mechanisms of disease: pharmacogenetics of testosterone
therapy in hypogonadal men. Nat Clin Pract Urol. 2007, 4 (3), 161–166.
Zitzmann M., Faber S., Nieschlag E.: Association of specifi c symptoms and
metabolic risks with serum testosterone in older men. J Clin Endocrinol
Metab. 2006, 91 (11), 4335–4343.
Zitzmann M., Weckesser M., Schober O., Nieschlag E.: Changes in cerebral glucose
metabolism and visuospatial capability in hypogonadal males under
testosterone substitution therapy. Exp Clin Endocrinol Diabetes. 2001,
109 (5), 302–304.
8. Konflikt interesów
Wszyscy członkowie Panelu Ekspertów EAU opracowującego
„Rekomendacje dotyczące męskiego hipogonadyzmu”
dostarczyli oświadczenia na temat wszystkich
relacji, które mogłyby być odebrane jako konfl ikt interesów.
Informacja ta jest ofi cjalnie dostępna na stronie
internetowej EAU. Przygotowanie rekomendacji było
fi nansowane przez EAU. Nie były zaangażowane żadne
zewnętrzne środki fi nansowania i wsparcia. Europejskie
Towarzystwo Urologiczne jest organizacją non -profi t,
a fi nansowanie zostało ograniczone do wydatków na działalność
administracyjną, koszty podróży i spotkań. Nie
opłacano honorariów ani innych wydatków.


 AMH – hormon antymüllerowski, FSH – hormon folikulotropowy, INSL -3 – insulinopodobny czynnik 3, LH – hormon luteinizujący
AMH – hormon antymüllerowski, FSH – hormon folikulotropowy, INSL -3 – insulinopodobny czynnik 3, LH – hormon luteinizujący


 Wytyczne zawarte w tym dokumencie są oparte
na systematycznym przeglądzie piśmiennictwa przeprowadzonym
przez ekspertów zespołu EAU. W celu
znalezienia oryginalnych oraz przeglądowych artykułów
przeszukano bazy danych MedLine, Embase
i Cochrane. Wzięto pod uwagę wszystkie artykuły
opublikowane przed listopadem 2014 r. Zespół ekspertów
przejrzał wyniki wyszukiwania oraz wybrał
artykuły o najwyższym LE zgodnie z systemem oceny
opracowanym przez Oxford Centre for Evidence – Based
Medicine.
Celem podawania GR jest zapewnienie przejrzystości
pomiędzy odpowiednimi dowodami naukowymi
a daną rekomendacją. Trzeba zaznaczyć, że kiedy rekomendacje
są przygotowywane, nie istnieje ustalony
związek pomiędzy LE a GR. W szczególności dostępność
badań randomizowanych będących podstawą rekomendacji
nie musi automatycznie oznaczać, że ta rekomendacja
otrzyma stopień A, jeśli w tych badaniach
znajdują się ograniczenia metodologiczne lub badania
nie mają zgodnych wyników. Odwrotnie, brak popierających
badań o wysokim LE nie musi od razu wykluczać
rekomendacji z poziomu A w sytuacji, gdy rekomendacja
wynika z niepodważalnych wyników badań
klinicznych. Ponadto, mogą mieć miejsce sytuacje wyjątkowe,
w których rekomendacja nie może zostać poparta
badaniami, ponieważ badania takie nie mogą zostać
przeprowadzone, na przykład z powodów etycznych
lub innych. W takich przypadkach uważa się, że jednoznaczne
rekomendacje są pomocne czytelnikowi. Jeśli
kiedykolwiek taka sytuacja ma miejsce, to zaznaczono
to w tekście z uwagą ,,uaktualnione na podstawie zgody
zespołu”. Jakość LE jest bardzo istotnym czynnikiem,
ale musi uwzględniać równowagę między korzyściami
i stratami, wartościami i preferencjami oraz kosztami,
kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza ani analiz
kosztów, ani nie zawsze może uwzględniać lokalne czy
narodowe warunki. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod
uwagę.
Wytyczne zawarte w tym dokumencie są oparte
na systematycznym przeglądzie piśmiennictwa przeprowadzonym
przez ekspertów zespołu EAU. W celu
znalezienia oryginalnych oraz przeglądowych artykułów
przeszukano bazy danych MedLine, Embase
i Cochrane. Wzięto pod uwagę wszystkie artykuły
opublikowane przed listopadem 2014 r. Zespół ekspertów
przejrzał wyniki wyszukiwania oraz wybrał
artykuły o najwyższym LE zgodnie z systemem oceny
opracowanym przez Oxford Centre for Evidence – Based
Medicine.
Celem podawania GR jest zapewnienie przejrzystości
pomiędzy odpowiednimi dowodami naukowymi
a daną rekomendacją. Trzeba zaznaczyć, że kiedy rekomendacje
są przygotowywane, nie istnieje ustalony
związek pomiędzy LE a GR. W szczególności dostępność
badań randomizowanych będących podstawą rekomendacji
nie musi automatycznie oznaczać, że ta rekomendacja
otrzyma stopień A, jeśli w tych badaniach
znajdują się ograniczenia metodologiczne lub badania
nie mają zgodnych wyników. Odwrotnie, brak popierających
badań o wysokim LE nie musi od razu wykluczać
rekomendacji z poziomu A w sytuacji, gdy rekomendacja
wynika z niepodważalnych wyników badań
klinicznych. Ponadto, mogą mieć miejsce sytuacje wyjątkowe,
w których rekomendacja nie może zostać poparta
badaniami, ponieważ badania takie nie mogą zostać
przeprowadzone, na przykład z powodów etycznych
lub innych. W takich przypadkach uważa się, że jednoznaczne
rekomendacje są pomocne czytelnikowi. Jeśli
kiedykolwiek taka sytuacja ma miejsce, to zaznaczono
to w tekście z uwagą ,,uaktualnione na podstawie zgody
zespołu”. Jakość LE jest bardzo istotnym czynnikiem,
ale musi uwzględniać równowagę między korzyściami
i stratami, wartościami i preferencjami oraz kosztami,
kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza ani analiz
kosztów, ani nie zawsze może uwzględniać lokalne czy
narodowe warunki. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod
uwagę. FSH – hormon folikulotropowy; INSL-3 – insulinopodobny peptyd 3; LH – hormon luteinizujący; SOX – gen kodujący czynnik transkrypcyjny
należący do klasy HMG -box, związany z SRY; SRY – gen na chromosomie Yp determinujący płeć męską
FSH – hormon folikulotropowy; INSL-3 – insulinopodobny peptyd 3; LH – hormon luteinizujący; SOX – gen kodujący czynnik transkrypcyjny
należący do klasy HMG -box, związany z SRY; SRY – gen na chromosomie Yp determinujący płeć męską
 DAX1 – region krytyczny genu DSS -AHC1 na chromo somie X /gen receptora kodowanego w specy fi cznym regionie chromosomu X, którego
dupli kacja prowadzi do odwrócenia płci męskiej w żeńską; GnRH – gonadoliberyna; LH – hormon luteinizujący
DAX1 – region krytyczny genu DSS -AHC1 na chromo somie X /gen receptora kodowanego w specy fi cznym regionie chromosomu X, którego
dupli kacja prowadzi do odwrócenia płci męskiej w żeńską; GnRH – gonadoliberyna; LH – hormon luteinizujący

 ciała, eunuchoidalne proporcje ciała, niska masa kostna
i obniżona płodność (Lanfranco i wsp., 2004).
ciała, eunuchoidalne proporcje ciała, niska masa kostna
i obniżona płodność (Lanfranco i wsp., 2004). Leczenie chorych z hipogonadyzmem
Leczenie chorych z hipogonadyzmem
 BMI – wskaźnik masy ciała; TRT – terapia zastępcza testosteronem
BMI – wskaźnik masy ciała; TRT – terapia zastępcza testosteronem o terapeutycznych oraz niepożądanych skutkach długotrwałego
stosowania hCG, dlatego nie zaleca się rutynowego
stosowania hCG w hipogonadyzmie, z wyjątkiem
pacjentów, u których ważne jest leczenie niepłodności.
o terapeutycznych oraz niepożądanych skutkach długotrwałego
stosowania hCG, dlatego nie zaleca się rutynowego
stosowania hCG w hipogonadyzmie, z wyjątkiem
pacjentów, u których ważne jest leczenie niepłodności. GR – stopień rekomendacji; hCG – ludzka gonadotropina kosmówkowa;
LE – poziom wiarygodności dowodu naukowego
GR – stopień rekomendacji; hCG – ludzka gonadotropina kosmówkowa;
LE – poziom wiarygodności dowodu naukowego
 6. Monitorowanie chorych
6. Monitorowanie chorych