3L. ZABURZENIA WYTRYSKU
Zaburzenia wytrysku (ejakulacji) nie są powszechnymi,
ale jednak ważnymi przyczynami męskiej niepłodności.
3L.1. Klasyfikacja i etiologia
3L.1.1. Brak wytrysku
Brak wytrysku (ang. anejaculation) to całkowity brak prawidłowego
lub wstecznego wytrysku. Jest on spowodowany
zaburzeniem emisji nasienia, składającego się m.in.
z wydzielin pęcherzyków nasiennych i stercza, do cewki
moczowej
(Buvat, 1984).
Prawdziwy brak wytrysku jest
zwykle związany z prawidłowym uczuciem orgazmu.
Prawdziwy brak wytrysku jest zawsze związany z dysfunkcją
obwodowego lub ośrodkowego układu nerwowego
lub z działaniem leków
(Wang i wsp., 1996)
(tabela 6).
3L.1.2. Brak orgazmu
Brak orgazmu (ang. anorgasmia) to niemożność osiągnięcia
orgazmu, która może prowadzić do braku
wytrysku. Anorgazmia jest często pierwotnym stanem,
którego przyczyna jest zwykle psychologiczna.
3L.1.3. Wytrysk opóźniony
W opóźnionej ejakulacji potrzebna jest nietypowa stymulacja
prącia we wzwodzie do osiągnięcia orgazmu
z wytryskiem. Opóźniona ejakulacja może być umiarkowaną
formą anorgazmii. Przyczyny opóźnionej ejakulacji
są psychologiczne, organiczne – np. częściowe
uszkodzenie rdzenia kręgowego
(Pryor, 1997),
jatrogenne
uszkodzenie unerwienia prącia
(Yachia, 1994)
lub farmakologiczne
– np. SSRI, leki przeciwnadciśnieniowe lub
przeciwpsychotyczne
(Rudkin i wsp., 2004).
3L.1.4. Wytrysk wsteczny
Wytrysk wsteczny jest całkowitym lub czasami częściowym
brakiem prawidłowego (zstępującego)
wytrysku w wyniku przesuwania się nasienia wstecz
poprzez szyję do światła pęcherza moczowego. Chory
doświadcza prawidłowego lub zmniejszonego uczucia
orgazmu. Przyczyny wstecznego wytrysku można
podzielić na neurogenne, farmakologiczne, cewkowe
lub związane z niesprawnością szyi pęcherza moczowego
(tabela 6).
3L.1.5. Wytrysk osłabiony
Wytrysk osłabiony (asteniczny) charakteryzuje się zmienioną
fazą wyrzutową, ale z prawidłową fazą emisyjną.
Uczucie orgazmu jest zmniejszone i nie ma typowych rytmicznych
skurczów związanych z ejakulacją. Asteniczna
ejakulacja zwykle nie zaburza jakości nasienia.
3L.1.6. Wytrysk przedwczesny
Międzynarodowe Towarzystwo Medycyny Seksualnej
przyjęło pierwszą opartą na faktach (EBM, ang. evidence-
-based medicine) definicję wytrysku przedwczesnego (PE,
ang. premature ejaculation), który jest problemem przez
Tabela 6. Etiologia anejakulacji i wstecznego wytrysku
 całe życie: „Wytrysk przedwczesny to męska dysfunkcja
seksualna polegającą na ejakulacji, która zawsze lub
prawie zawsze pojawia się w ciągu lub około jednej minuty
od rozpoczęcia penetracji pochwy, oraz niezdolność do
odroczenia wytrysku w trakcie wszystkich lub prawie
wszystkich penetracji pochwy, a także negatywne konsekwencje
osobiste takie jak cierpienie, zakłopotanie, frustracja
i/lub unikanie seksualnych sytuacji intymnych”.
Wytrysk przedwczesny może być wyłącznie organiczny
(np. związany z zapaleniem stercza) lub psychogenny,
związany z konkretnym partnerem lub nie, a także
mogą mu towarzyszyć zaburzenia erekcji. Nie wpływa
on na płodność, pod warunkiem, że ejakulacja odbywa
się w pochwie.
całe życie: „Wytrysk przedwczesny to męska dysfunkcja
seksualna polegającą na ejakulacji, która zawsze lub
prawie zawsze pojawia się w ciągu lub około jednej minuty
od rozpoczęcia penetracji pochwy, oraz niezdolność do
odroczenia wytrysku w trakcie wszystkich lub prawie
wszystkich penetracji pochwy, a także negatywne konsekwencje
osobiste takie jak cierpienie, zakłopotanie, frustracja
i/lub unikanie seksualnych sytuacji intymnych”.
Wytrysk przedwczesny może być wyłącznie organiczny
(np. związany z zapaleniem stercza) lub psychogenny,
związany z konkretnym partnerem lub nie, a także
mogą mu towarzyszyć zaburzenia erekcji. Nie wpływa
on na płodność, pod warunkiem, że ejakulacja odbywa
się w pochwie.
3L.2. Diagnostyka
Diagnostyka obejmuje poniższe zalecane procedury.
3L.2.1. Wywiad kliniczny
Pacjent powinien być dokładnie sprawdzony pod kątem
cukrzycy, neuropatii, urazów, infekcji urogenitalnych,
przebytych zabiegów i przyjmowanych leków. Szczególna
uwaga powinna być zwrócona na charakterystykę mikcji
i ejakulacji (obecność nocnych polucji, możliwość ejakulacji
w określonych sytuacjach oraz pierwotne lub nabyte
zaburzenia), jak również aspekty psychoseksualne.
3L.2.2. Badanie fizykalne
Przeprowadza się badanie narządów płciowych i odbytu,
włączając w to ocenę gruczołu krokowego, odruchu opuszkowo-
jamistego i napięcia zwieracza odbytu.
3L.2.3. Badanie moczu po wytrysku
Badanie moczu po ejakulacji i odwirowaniu służy do określenia,
czy występuje całkowity lub częściowy wytrysk
wsteczny.
3L.2.4. Badania mikrobiologiczne
Posiewy moczu z początkowego i środkowego strumienia
moczu, wydzieliny stercza oraz moczu po masażu stercza
wykonuje się w celu znalezienia infekcji gruczołu krokowego.
W przypadku zwiększonej liczby leukocytów
w nasieniu zalecany jest także posiew nasienia lub
markery biochemiczne zakażenia
(Abdel-Hamid i wsp.,2001).
3L.2.5. Dodatkowe testy diagnostyczne
Dodatkowe testy diagnostyczne mogą zawierać:
yy badania neurofizjologiczne
(wywołanie odpowiedzi opuszkowo-jamistej
i potencjałów somatosensorycznych nerwu
grzbietowego),
badania w kierunku neuropatii autonomicznych,
ocenę psychoseksuologiczną,
wideocystometrię,
cystoskopię,
ultrasonografię przezodbytniczą,
uroflowmetrię,
stymulację wibracyjną prącia.
3L.3. Postępowanie terapeutyczne
Niepłodność spowodowana zaburzeniami ejakulacji jest
rzadko leczona w oparciu o etiologię. Leczenie zwykle
opiera się na pozyskaniu plemników do ich zastosowania
w procedurach rozrodu wspomaganego. Następujące
aspekty powinny być brane pod uwagę przy wyborze
leczenia:
wiek pacjenta i jego partnerki,
problemy psychologiczne pacjenta i jego partnerki,
życzenia pary i akceptacja różnych procedur wspomagających
płodność,
towarzyszące patologie,
konsultacje psychoseksualne.
3L.3.1. Leczenie przyczynowe
Jeśli to możliwe, jakiekolwiek leczenie farmakologiczne
wpływające na ejakulację powinno być wstrzymane.
W bolesnych wytryskach może być stosowana tamsulozyna
łącznie z leczeniem przeciwdepresyjnym
(Demyttenaere i Huygens, 2002).
Powinno się wdrożyć
leczenie zakażeń urogenitalnych (np. w przypadku
bolesnych wytrysków)
(Abdel-Hamid i wsp., 2001).
Dapoksetyna jest lekiem z grupy SSRI, który został
wprowadzony do terapii PE
(McMahon i wsp., 2011),
gdyż wydaje się, że jest to zaburzenie zależne od
poziomu serotoniny. Psychoterapia jest zwykle mało
efektywna.
3L.3.2. Leczenie objawowe
3L.3.2.1. Wytrysk przedwczesny
Wytrysk przedwczesny może być leczony za pomocą
dapoksetyny lub miejscowych środków znieczulających
celem wydłużenia czasu wewnątrzpochwowego
opóźnienia wytrysku, terapii behawioralnej i/lub psychoterapii.
3L.3.2.2. Wytrysk wsteczny
W przypadku braku urazów rdzenia kręgowego, anomalii
anatomicznych cewki moczowej lub działania
środków farmakologicznych powinno się zastosować leki
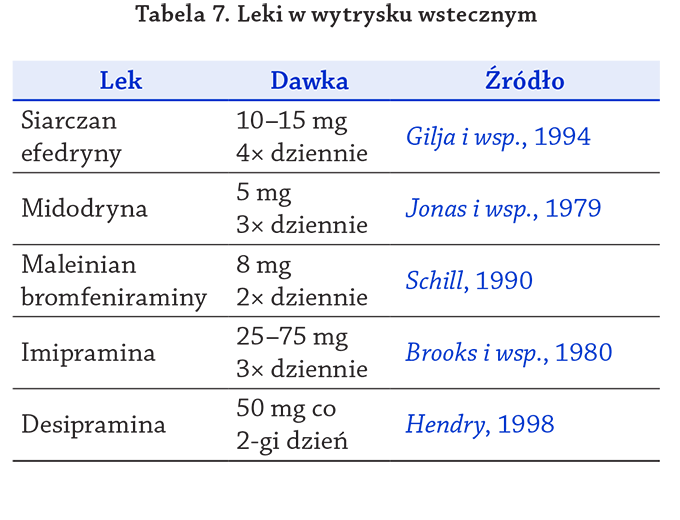
indukujące prawidłowy (zstępujący) wytrysk (tabela 7).
Alternatywnie można pacjenta zachęcić do ejakulacji przy
wypełnionym pęcherzu celem lepszego zamknięcia szyi
pęcherza moczowego
(Crich i Jacquier, 1978).
Tabela 7. Leki w wytrysku wstecznym
 Izolacja plemników z moczu po orgazmie do zastosowania
w ART jest zalecana, gdy:
Izolacja plemników z moczu po orgazmie do zastosowania
w ART jest zalecana, gdy:
leczenie farmakologiczne jest nieskuteczne lub nie
jest tolerowane z powodu działań ubocznych,
pacjent ma uraz rdzenia kręgowego,
leczenie farmakologiczne wywołujące wytrysk
wsteczny nie może być przerwane.
Jeśli uzyskane plemniki nie są zadowalającej jakości do
inseminacji domacicznej, para powinna zostać poddana
procedurom in vitro wspomaganego rozrodu (np. ICSI).
W przypadku niewystarczającej terapii lekowej techniki
pobrania plemników z jąder (TESE lub PESA) lub najądrzy
(MESA) można wykorzystać do wspomaganego rozrodu.
3L.3.2.3. Brak wytrysku
Leczenie farmakologiczne anejakulacji wywołanej limfadenektomią
i neuropatią oraz terapia psychoseksualna
w leczeniu anorgazmii nie są zbyt skuteczne. W tych
wszystkich przypadkach oraz u mężczyzn z urazem
rdzenia kręgowego wibrostymulacja (np. stymulacja
prącia wibratorem) jest metodą pierwszego rzutu.
Wibrostymulacja wywołuje odruch wytrysku, do którego
niezbędna jest czynność nienaruszonego segmentu lędźwiowo-
krzyżowego rdzenia kręgowego
(Brindley, 1981).
Jeśli jakość nasienia jest słaba lub dochodzi do wytrysku
wstecznego, para może przystąpić do programu IVF. Jeśli
wibrostymulacja zawiodła, elektro-ejakulacja może być
terapią z wyboru
(Elliott i wsp., 1994).
Jeśli elektro-ejakulacja
jest nieskuteczna lub nie może zostać przeprowadzona,
plemniki mogą być pozyskane poprzez aspirację
z nasieniowodów
(Waldinger, 2002)
(patrz rozdział 3D) lub
poprzez wypłukanie z dróg wyprowadzających plemniki
(Jankowicz i wsp., 2001).
Można także zastosować TESE
(Abdel-Hamid i wsp., 2001;).
(Maurer i wsp., 2001).
Można
uniknąć anejakulacji po operacji z powodu raka jądra
lub totalnej resekcji odbytnicy z tkankami otaczającymi
dzięki jednostronnej limfadenektomii lub zachowaniu
nerwów autonomicznych
(Maurer i wsp., 2001).
3L.4. Wnioski i rekomendacje dotyczące
postępowania w zaburzeniach wytrysku
 3M. KRIOPREZERWACJA NASIENIA
3M. KRIOPREZERWACJA NASIENIA
Krioprezerwacja jest to przechowywanie materiału
biologicznego w ujemnych temperaturach, np. −80°C
lub −196°C (punkt wrzenia ciekłego azotu), w których
procesy biochemiczne metabolizmu komórkowego są spowolnione lub przerwane. W temperaturze −196°C
reakcje biochemiczne, które doprowadzają do śmierci
komórki, zatrzymują się.
3M.1. Wskazania do przechowywania nasienia
3M.1. Wskazania do przechowywania nasienia
Przechowywanie nasienia jest dostępne w wielu klinikach
z następujących wskazań:
przed potencjalnie sterylizującą chemioterapią
(Saitoi wsp., 2005)
lub radioterapią z powodu raka lub niezłośliwych
schorzeń,
przed operacjami, które mogą ingerować w płodność
(np. operacje szyi pęcherza moczowego u młodszych
mężczyzn lub usunięcie jądra u mężczyzn z nowotworami
jąder lub przed wazektomią lub operacjami
zmiany płci),
postępujące pogarszanie się jakości nasienia w wyniku
choroby, która związana jest z ryzykiem wystąpienia
azoospermii (takich jak np. makrogruczolak
przysadki, czaszkogardlak, zespół pustego siodła,
przewlekła neuropatia, niekontrolowana cukrzyca
i stwardnienie rozsiane),
paraplegia, gdy nasienie zostało uzyskane na drodze
elektro-ejakulacji lub poprzez stymulację wibracyjną
prącia,
psychogenna anejakulacja, gdy uzyskano nasienie
przez elektro-ejakulację lub procedury zabiegowe
pozyskania plemników (np. TESE),
po leczeniu gonadotropinami, które zastymulowało
spermatogenezę u mężczyzn z hipogonadyzmem
hipogonadotropowym,
nieobturacyjna azoospermia (NOA), gdy szansa na
znalezienie plemników przy zastosowaniu m-TESE
wynosi ok. 50%.
Krioprezerwacja może być stosowana do plemników
uzyskanych poprzez TESE, dzięki czemu unika się powtarzania
procedur pozyskiwania plemników i niepotrzebnej
hiperstymulacji partnerki:
w każdej sytuacji, w której plemniki zostały uzyskane
poprzez procedury zabiegowego pozyskania
plemników (np. po nieudanej operacji odwrócenia
wazektomii lub w niektórych przypadkach niedrożności
przewodów najądrzy nie podlegających operacji),
do przechowywania nasienia dawców, dlatego że krioprezerwacja
redukuje ryzyko transmisji infekcji od
dawców nasienia. Zgodnie z Dyrektywą 2004/23/WE
Parlamentu Europejskiego i Rady Unii Europejskiej
oraz Dyrektywą Komisji Europejskiej 2006/17/WE
świeże nasienie nie może być używane do donacji
dla innych osób niż partnerka.
3M.2. Środki ostrożności i techniki krioprezerwacji
nasienia
3M.2.1. Proces zamrażania i rozmrażania nasienia
Stosowane obecnie techniki krioprezerwacji nie są optymalne,
ponieważ w ich wyniku oraz w wyniku przedłużonego
przechowywania powstają uszkodzenia
komórek. Większość uszkodzeń powstaje podczas uszkodzeń podczas zamrażania są formujące się kryształki
lodu i odwodnienie komórek, co rozrywa ścianę
komórkową i organelle wewnątrzkomórkowe. Po rozmrożeniu
nasienia znacząco pogarsza się morfologia,
ruchliwość i żywotność plemników, a także zwiększają
się uszkodzenia DNA plemników
(Askari i wsp., 1994;).
(Chohan i wsp., 2004;).
(Desrosiers i wsp., 2006;).
(Donnelly
i wsp., 2001).
Kolejne zaburzenia mogą być spowodowane
przez zanieczyszczenie próbek nasienia mikroorganizmami
i wysokim stężeniem wolnych rodników
tlenowych
(Agarwal i Said, 2005;).
(Smith i Steinberg, 1973).
Aby zredukować powstawanie kryształków lodu, dodaje
się tzw. roztwór krioprezerwacyjny przed zamrażaniem.
Różne roztwory krioprezerwacyjne są dostępne komercyjnie;
większość zawiera glicerol i albuminy w różnych
proporcjach.
W czasie prób zredukowania uszkodzeń spowodowanych
zamrażaniem i rozmrażaniem nasienia opracowano
kilka technik, włączając w to:
metodę jednostopniowego zamrażania
(Grischenko i wsp., 2003;).
(Sherman i Bunge, 1953).
: próbka jest trzymana
w fazie gazowej przez 10 min przed zanurzeniem
w ciekłym azocie,
metodę powolną lub wielostopniową
(Sawada i wsp.,1967):
próbka jest stopniowo schładzana w fazie
gazowej przez ok. 40 min. W tym celu stosuje się
programowalne automatyczne urządzenie zamrażające,
które schładza próbkę w tempie 1–10°C/min.
Od możliwości laboratorium zależy zastosowanie
danej metody. Za każdym razem, gdy stosowane są
techniki zamrażania, powinno się je testować przy
użyciu nasienia dawcy i oceniać po rozmrożeniu, a także
powinny regularnie podlegać programowi kontroli jakości.
Prawdopodobieństwo przeżycia plemników zmniejsza
się wraz z powtarzaniem procesu zamrażania i rozmrażania.
Maksymalny czas przechowywania żywych ludzkich
plemników nie jest znany.
3M.2.2. Krioprezerwacja nasienia z małą liczbą
plemników
Standardowa krioprezerwacja w słomkach jest efektywną
metodą przechowywania dużej ilości próbek nasienia (np.
w programie dawstwa nasienia). W micro-TESE można
pozyskać tylko kilka plemników, dlatego jest kwestią
wyboru, czy zamrozić tkankę jądra i poszukiwać plemniki
po rozmrożeniu tkanki, czy zamrozić pojedyncze
plemniki. Jeśli plemniki są zamrożone w słomkach, może
być trudne znalezienie jakichkolwiek plemników po rozmrożeniu.
Zamiast tego nasienie powinno być zamrażane
w peletkach
(Bahadur i wsp., 2002):
lub pojemnikach
(Hallak i wsp., 1998).:
3M.2.3. Badanie w kierunku infekcji i zapobieganie
krzyżowej kontaminacji
Przechowywanie nasienia w słomkach jest stosowane
powszechnie. Duża ilość słomek jest przechowywana w metalowych zbiornikach, gdzie słomki są zanurzone
w ciekłym azocie. Zanieczyszczenie bakteriologiczne
łaźni ciekłego azotu skutkuje zanieczyszczeniem
zewnętrznej strony wszystkich słomek (Clarke, 1999).
Najpowszechniejszą ochroną jest stosowanie tzw. wysoce
bezpiecznie zamkniętych słomek. Zgodnie z europejskimi
dyrektywami 2004/23 i 2006/17 próbki powinny być
sprawdzane pod kątem obecności wirusów zapalenia
wątroby typu B i C oraz ludzkiego wirusa niedoboru
odporności (HIV, ang. human immunodeficiency virus).
W przypadku donacji nasienia nie od partnera, próbki
są badane pod kątem Chlamydia trachomatis poprzez test
kwasów nukleinowych (NAT ang. nucleic acid testing) i kiły,
jak również przeprowadzane są badania genetyczne, czyli
kariotyp, oraz badania w kierunku zaburzeń genetycznych
najczęściej występujących w populacji, do której
należy dawca. Do czasu uzyskania wyników testów próbki
muszą być przechowywane w odrębnych naczyniach kwarantannowych
(przechowywanie izolowane). Jeśli używa
się otwartych słomek (np. w celach witryfikacji), niektóre
laboratoria stosują dodatkowe środki ochronne w postaci
podwójnego opakowania słomek przed zamrożeniem,
chociaż jest to bardziej kosztowne. Niektóre centra badają
próbki nasienia także pod kątem wirusa cytomegalii
(CMV, łac. Cytomegalovirus) i przechowują pozytywne
i negatywne próbki oddzielnie. Rozważane są kwestie
etyczne dotyczące przechowywania próbek nasienia
mężczyzn HIV- lub HBV/HCV-pozytywnych przed
chemioterapią z powodu nowotworu. Niektóre kliniki
mają osobne pojemniki dla próbek HIV-pozytywnych.
Jednakże sukces terapii antyretrowirusowych powoduje
wzrost liczby mężczyzn HIV-pozytywnych, którzy pragną
przechować nasienie. Istnieje także obawa o przekazanie
wirusa HIV dzieciom poczętym przy użyciu nasienia HIV‑pozytywnego,
gdyż techniki płukania nasienia zawodzą
w ok. 5% przypadków.
3M.2.4. Środki ostrożności w celu zapobiegania
utracie przechowywanego materiału
Każde laboratorium podejmujące się długoterminowego
przechowywania ludzkiego materiału biologicznego
powinno mieć procedury, które chronią przed przypadkową
utratą materiału spowodowaną uszkodzeniem
pojemników do przechowywania. Jest to szczególnie
ważne dla nasienia przechowywanego przed chemioterapią
potencjalnie uszkadzającą płodność, gdyż może nie
być możliwości pozyskania plemników od tych pacjentów
w późniejszym czasie.
3M.2.5. Pozostawione próbki nasienia
Może minąć kilka lat zanim przechowywane próbki
nasienia mężczyzn z chorobą nowotworową lub w innych
trudnych sytuacjach będą mogły być wykorzystane.
Możliwe jest, że w tym czasie właściciele niektórych
próbek nasienia stracą kontakt z ośrodkiem lub umrą,
pozostawiając próbki „sieroty”. Takie sytuacje mogą stwarzać
poważne problemy.
3M.3. Aspekty biologiczne
Krioprezerwacja powoduje pogorszenie jakości nasienia.
Po tym, jak próbka zostanie rozmrożona, ruchliwość
(O’Connell i wsp., 2002)
i morfologia plemników
(Watson,1995;)
(Woolley i Richardson, 1978)
są gorsze, włączając w to
uszkodzenia mitochondriów akrosomalnych i witki plemnika
(Donnelly i wsp., 2001).
Zamrażanie nasienia obniża
ruchliwość plemników o 31%, a aktywność mitochondrialną
o 36% oraz powoduje zaburzenia morfologiczne
37% plemników
(Grischenko i wsp., 2003).
W rozmrożonej
próbce nasienia najlepiej skorelowana ze zdolnością
plemników do zapłodnienia w procedurze IVF jest
ich ruchliwość. Dalsza poprawa zdolności plemników do
zapłodnienia może być osiągnięta przez selekcję subpopulacji
plemników z najlepszą ruchliwością i integralnością
DNA, a następnie zamrażanie tych plemników
z plazmą nasienia
(Bahadur i wsp., 2002).
3M.4. Wnioski i rekomendacje dotyczące
krioprezerwacji nasienia

4. PIŚMIENNICTWO
Abdel-Meguid T.A.: Predictors of sperm recovery and azoospermia relapse
in men with nonobstructive azoospermia after varicocele repair. J Urol.
2012, 187 (1), 222–226.
Abdel-Hamid I.A., El Naggar E.A., El Gilany A.H.: Assessment of as needed
use of pharmacotherapy and the pause-squeeze technique in premature
ejaculation. Int J Impot Res. 2001, 13 (1), 41–45.
Agarwal A., Deepinder F., Cocuzza M., Agarwal R., Short R.A., Sabanegh E. i wsp.:
Efficacy of varicocelectomy in improving semen parameters: new metaanalytical
approach. Urology. 2007, 70 (3), 532–538.
Agarwal A., Said T.M.: Oxidative stress, DNA damage and apoptosis in male
infertility: a clinical approach. BJU Int. 2005, 95 (4), 503–507.
Aitken R.J., Baker H.W.: Seminal leukocytes: passengers, terrorists or good
samaritans? Hum Reprod. 1995, 10 (7), 1736–1739.
Alexander R.B., Ponniah S., Hasday J., Hebel J.R.: Elevated levels of proinflammatory
cytokines in the semen of patients with chronic prostatitis/chronic
pelvic pain syndrome. Urology. 1998, 52 (5), 744–749.
Andersson A.M., Jørgensen N., Frydelund-Larsen L., Rajpert-De Meyts E.,
Skakkebaek N.E.: Impaired Leydig cell function in infertile men: a study
of 357 idiopathic infertile men and 318 proven fertile controls. J Clin
Endocrinol Metab. 2004, 89 (7), 3161–3167.
Askari H.A., Check J.H., Peymer N., Bollendorf A.: Effect of natural antioxidants
tocopherol and ascorbic acids in maintenance of sperm activity during
freeze-thaw process. Arch Androl. 1994, 33 (1), 11–15.
Augarten A., Yahav Y., Kerem B.S., Halle D., Laufer J., Szeinberg A. i wsp.:
Congenital bilateral absence of vas deferens in the absence of cystic fibrosis.
Lancet. 1994, 344 (8935), 1473–1474.
Baazeem A., Belzile E., Ciampi A., Dohle G., Jarvi K., Salonia A. i wsp.: Varicocele
and male factor infertility treatment: a new meta-analysis and review of
the role of varicocele repair. Eur Urol. 2011, 60 (4), 796–808.
Baccetti B., Collodel G., Marzella R., Moretti E., Piomboni P., Scapigliati G.
i wsp.: Ultrastructural studies of spermatozoa from infertile males with
Robertsonian translocations and 18, X, Y aneuploidies. Hum Reprod. 2005,
20 (8), 2295–2300.
Bahadur G., Ling K.L., Hart R., Ralph D., Wafa R., Ashraf A. i wsp.: Semen
quality and cryopreservation in adolescent cancer patients. Hum Reprod.
2002, 17 (12), 3157–3161.
Barone M.A., Irsula B., Chen-Mok M., Sokal D.C.: Effectiveness of vasectomy
using cautery. BMC Urol. 2004, 4, 10.
Belker A.M., Thomas A.J. Jr, Fuchs E.F., Konnak J.W., Sharlip I.D.: Results
of 1,469 microsurgical vasectomy reversals by the Vasovasostomy Study
Group. J Urol. 1991, 145 (3), 505–511.
Belva F., de Schrijver F., Tournaye H., Liebaers I., Devroey P., Haentjens. i wsp.:
Neonatal outcome of 724 children born after ICSI using non-ejaculated
sperm. Hum Reprod. 2011, 26 (7), 1752–1758.
Ben-Yosef D., Yogev L., Hauser R., Yavetz H., Azem F., Yovel I. i wsp.: Testicular
sperm retrieval and cryopreservation prior to initiating ovarian stimulation
as the first line approach in patients with non-obstructive azoospermia.
Hum Reprod. 1999, 14 (7), 1794–1801.
Berger R.E.: Epididymitis. W: Sexually Transmitted diseases, in sexually
transmitted diseases. Red. K.K. Holmes, P.A. Mardh, P.F. Sparling. McGraw-
Hill, New York 1984, 650–662.
Berger R.E., Alexander E.R., Harnisch J.P., Paulsen C.A., Monda G.D., Ansell J.
i wsp.: Etiology, manifestations and therapy of acute epididymitis: prospective
study of 50 cases. J Urol. 1979, 121 (6), 750–754.
Bernal-Delgado E., Latour-Pérez J., Pradas-Arnal F., Gómez-López L.I.: The association
between vasectomy and prostate cancer: a systematic review of the
literature. Fertil Steril. 1998, 70 (2), 191–200.
Bianco S.D., Kaiser U.B.: The genetic and molecular basis of idiopathic hypogonadotropic
hypogonadism. Nat Rev Endocrinol. 2009, 5 (10), 569–576.
Borges E. Jr., Rossi-Ferragut L.M., Pasqualotto F.F., dos Santos D.R., Rocha
C.C., Iaconelli A Jr.: Testicular sperm results in elevated miscarriage rates
compared to epididymal sperm in azoospermic patients. Sao Paulo Med J.
2002, 120 (4), 122–126.
Borovikov A.: Treatment of large vasal defects. W: Surgery of male infertility.
Red. M. Goldstein. WB Saunders, Philadelphia 1995, 77–95.
de Braekeleer M., Ferec C.: Mutations in the cystic fibrosis gene in men with
congenital bilateral absence of the vas deferens. Mol Hum Reprod. 1996,
2 (9), 669–677.
Brindley G.S.: Reflex ejaculation under vibratory stimulation in paraplegic
men. Paraplegia. 1981, 19 (5), 299–302.
Brooks M.E., Berezin M., Braf Z.: Treatment of retrograde ejaculation with
imipramine. Urology. 1980, 15 (4), 353–355.
Buvat J.: Glossaire. Disruptions in ejaculation. W: Ejaculation and its disruptions.
Red. J. Buvat, P. Jouannet. SIMEP, Lyon-Villeurbanne 1984, 9.
Carrell D.T.: The clinical implementation of sperm chromosome aneuploidy
testing: pitfalls and promises. J Androl. 2008, 29 (2), 124–133.
van Casteren N.J., Looijenga L.H., Dohle G.R.: Testicular microlithiasis and
carcinoma in situ overview and proposed clinical guideline. Int J Androl.
2009, 32 (4), 279–287.
Chan P.T., Brandell R.A., Goldstein M.: Prospective analysis of outcomes after
microsurgical intussusception vasoepididymostomy. BJU Int. 2005, 96
(4), 598–601.
Chevret E., Rousseaux S., Monteil M., Usson Y., Cozzi J., Pelletier R. i wsp.:
Increased incidence of hyperhaploid 24,XY spermatozoa detected by
three-colour FISH in a 46,XY/47,XXY male. Hum Genet. 1996, 97 (2),
171–175.
Chillon M., Casals T., Mercier B., Bassas L., Lissens W., Silber S. i wsp.: Mutations
in the cystic fibrosis gene in patients with congenital absence of the vas
deferens. N Engl J Med. 1995, 332 (22), 1475–1480.
Chohan K.R., Griffin J.T., Carrell D.T.: Evaluation of chromatin integrity in
human sperm using acridine orange staining with different fixatives and
after cryopreservation. Andrologia. 2004, 36 (5), 321–326.
Christiansen C.G., Sandlow J.I.: Testicular pain following vasectomy: a review
of postvasectomy pain syndrome. J Androl. 2003, 24 (3), 293–298.
Christiansen E., Tollefsrud A, Purvis K.: Sperm quality in men with chronic
abacterial prostatovesiculitis verified by rectal ultrasonography. Urology.
1991, 38 (6), 545–549.
Chua M.E., Escusa K.G., Luna S., Tapia L.C., Dofitas B., Morales M.: Revisiting
oestrogen antagonists (clomiphene or tamoxifen) as medical empiric therapy
for idiopathic male infertility: a meta-analysis. Andrology. 2013, 1 (5),
749–757.
Clarke G.N.: Sperm cryopreservation: is there a significant risk of crosscontamination?
Hum Reprod.. 1999, 14 (12), 2941–2943. [no abstract]
Clementini E., Palka C., Iezzi I., Stuppia L., Guanciali-Franchi P., Tiboni G.M.:
Prevalence of chromosomal abnormalities in. 2078, infertile couples referred
for assisted reproductive techniques. Hum Reprod. 2005, 20 (2), 437–442.
Colpi G.M., Casella F., Zanollo A., Ballerini G., Balerna M., Campana A. i wsp.:
Functional voiding disturbances of the ampullo-vesicular seminal tract:
a cause of male infertility. Acta Eur Fertil. 1987, 18 (3), 165–179.
Colpi G.M., Piediferro G., Nerva F., Giacchetta D., Colpi E.M., Piatti E.: Sperm
retrieval for intra-cytoplasmic sperm injection in non-obstructive azoospermia.
Minerva Urol Nefrol. 2005, 57 (2), 99–107.
Comhaire F.H., Rowe P.J., Farley T.M.: The effect of doxycycline in infertile
couples with male accessory gland infection: a double blind prospective
study. Int J Androl. 1986, 9 (2), 91–98.
Comhaire F.H., Verschraegen G., Vermeulen L.: Diagnosis of accessory gland
infection and its possible role in male infertility. Int J Androl. 1980, 3
(1), 32–45.
Cook L.A., Van Vliet H.A., Pun A., Gallo M.F.: Vasectomy techniques for male
sterilization: systematic Cochrane review of randomized controlled trials
and controlled clinical trials. Hum Reprod. 2004, 19 (11), 2431–2438.
Cozzi J., Chevret E., Rousseaux S., Pelletier R., Benitz V., Jalbert H. i wsp.:
Achievement of meiosis in XXY germ cells: study of 543 sperm karyotypes
from an XY/XXY mosaic patient. Hum Genet. 1994, 93 (1), 32–34.
Crich J.P., Jequier A.M.: Infertility in men with retrograde ejaculation: the
action of urine on sperm motility, and a simple method for achieving antegrade
ejaculation. Fertil Steril. 1978, 30 (5), 572–576.
Davies M.J., Moore V.M., Willson K.J., van Essen P., Priest K., Scott H. i wsp.:
Reproductive technologies and the risk of birth defects. N Engl J Med.
2012, 366 (19), 1803–1813.
Davila Garza S.A., Patrizio P.: Reproductive outcomes in patients with male
infertility because of Klinefelter’s syndrome, Kartagener’s syndrome, roundhead
sperm, dysplasia fibrous sheath, and ‘stump’ tail sperm: an updated
literature review. Curr Opin Obstet Gynecol. 2013, 25 (3), 229–246.
Demyttenaere K., Huygens R.: Painful ejaculation and urinary hesitancy
in association with antidepressant therapy: relief with tamsulosin. Eur
Neuropsychopharmacol. 2002, 12 (4), 337–341.
Depuydt C.E., Bosmans E., Zalata A., Schoonjans F., Comhaire F.H.: The relation
between reactive oxygen species and cytokines in andrological patients with
or without male accessory gland infection. J Androl. 1996, 17 (6), 699–707.
Derogee M., Bevers R.F., Prins H.J., Jonges T.G., Elbers F.H., Boon T.A.: Testicular
microlithiasis, a premalignant condition: prevalence, histopathologic findings,
and relation to testicular tumor. Urology. 2001, 57 (6), 1133–1137.
Deruyver Y., Vanderschueren D., van der Aa F.: Outcome of microdissection
TESE compared with conventional TESE in nonobstructive azoospermia:
a systematic review. Andrology. 2014, 2 (1), 20–24.
Desrosiers P., Légaré C., Leclerc P., Sullivan R.: Membranous and structural
damage that occur during cryopreservation of human sperm may be timerelated
events. Fertil Steril. 2006, 85 (6), 1744–1752.
Ding H., Tian J., Du W., Zhang L., Wang H., Wang Z.: Open non-microsurgical,
laparoscopic or open microsurgical varicocelectomy for male infertility:
a meta-analysis of randomized controlled trials. BJU Int. 2012, 110
(10), 1536–1542.
Dohle G., Arver S., Bettocchi C., Jones T.H., Kliesch S., Punab M.: Guidelines
on male hypogonadism. European Association of Urology, Paris 2012a.
Dohle G.R., Colpi G.M., Hargreave T.B., Papp G.K., Jungwirth A., Weidner W.:
EAU guidelines on male infertility. Eur Urol. 2005, 48 (5), 703–711.
Dohle G.R., Diemer T., Kopa Z., Krausz C., Giwercman A., Jungwirth A.: European
Association of Urology guidelines on vasectomy. Eur Urol. 2012b, 61 (1),
159–163.
Donat R., McNeill A.S., Fitzpatrick D.R., Hargreave T.B.: The incidence of cystic
fibrosis gene mutations in patients with congenital bilateral absence of the
vas deferens in Scotland. Br J Urol. 1997, 79 (1), 74–77.
Donnelly E.T., McClure N., Lewis S.E.: Cryopreservation of human semen and
prepared sperm: effects on motility parameters and DNA integrity. Fertil
Steril. 2001, 76 (5), 892–900.
Dousset B., Hussenet F., Daudin M., Bujan L., Foliguet B., Nabet P.: Seminal
cytokine concentrations (IL-1beta, IL-2, IL-6, sR IL-2, sR IL-6), semen
parameters and blood hormonal status in male infertility. Hum Reprod.
1997, 12 (7), 1476–1479.
Drake M.J., Quinn F.M.: Absent vas deferens and ipsilateral multicystic dysplastic
kidney in a child. Br J Urol. 1996, 77 (5), 756–757.
Dul E.C., Groen H., van Ravenswaaij-Arts C.M., Dijkhuizen T., van Echten-Arends
J., Land J.A.: The prevalence of chromosomal abnormalities in subgroups
of infertile men. Hum Reprod. 2012, 27 (1), 36–43.
Eberhard J., Ståhl O., Cohn-Cedermark G., Cavallin-Ståhl E., Giwercman Y.,
Rylander L. i wsp.: Sexual function in men treated for testicular cancer. J
Sex Med. 2009, 6 (7), 1979–1989.
Eberhard J., Ståhl O., Cwikiel M., Cavallin-Ståhl E., Giwercman Y., Salmonson
E.C i wsp.: Risk factors for post-treatment hypogonadism in testicular cancer
patients. Eur J Endocrinol. 2008, 158 (4), 561–570.
Eberhard J., Ståhl O., Giwercman Y., Cwikiel M., Cavallin-Ståhl E., Lundin K.B.
i wsp.: Impact of therapy and androgen receptor polymorphism on sperm
concentration in men treated for testicular germ cell cancer: a longitudinal
study. Hum Reprod. 2004, 19 (6), 1418–1425.
von Eckardstein S., Tsakmakidis G., Kamischke A., Rolf C., Nieschlag E.:
Sonographic testicular microlithiasis as an indicator of premalignant conditions
in normal and infertile men. J Androl. 2001, 22 (5), 818–824.
Elder J.S., Mostwin J.L.: Cyst of the ejaculatory duct/urogenital sinus. J Urol.
1984, 132 (4), 768–771.
Elliott S.: Treatment of anejaculation. W: Treating male infertility: new possibilities.
Red. G.M. Colpi, M. Balerna. Karger AG, Basel 1994, 240–254.
ESHRE Capri Workshop Group. Intracytoplasmic sperm injection (ICSI)
in 2006: evidence and evolution. Hum Reprod Update. 2007, 13 (6),
515–526.
Esteves S.C., Miyaoka R., Agarwal A.: Sperm retrieval techniques for assisted
reproduction. Int Braz J Urol. 2011, 37 (5), 570–583.
Estop A.M., Munné S., Cieply K.M., Vandermark K.K., Lamb A.N., Fisch H. i wsp.:
Meiotic products of a Klinefelter 47,XXY male as determined by sperm fluorescence
in-situ hybridization analysis. Hum Reprod. 1998, 13 (1), 124–127.
Evers J.H., Collins J., Clarke J.: Surgery or embolisation for varicoceles in
subfertile men. Cochrane Database Syst Rev. 2009, 1, CD000479.
Ferlin A., Vinanzi C., Garolla A., Selice R., Zuccarello D., Cazzadore C. i wsp.:
Male infertility and androgen receptor gene mutations: clinical features
and identification of seven novel mutations. Clin Endocrinol (Oxf). 2006,
65 (5), 606–610.
Finkelstein J.: Androgens and bone metabolism. W: Testosterone: action,
deficiency, substitution. Red. E. Nieschlag, H.M. Behre. Springer Verlag,
Berlin 1998, 187–207.
Fisch H., Lambert S.M., Goluboff E.T.: Management of ejaculatory duct obstruction:
etiology, diagnosis, and treatment. World J Urol. 2006, 24 (6), 604–610.
Foresta C., Bettella A., Spolaore D., Merico M., Rossato M., Ferlin A.: Suppression
of the high endogenous levels of plasma FSH in infertile men are associated
with improved Sertoli cell function as reflected by elevated levels of
plasma inhibin B. Hum Reprod. 2004, 19 (6), 1431–1437.
Foresta C., Galeazzi C., Bettella A., Stella M., Scandellari C.: High incidence
of sperm sex chromosomes aneuploidies in two patients with Klinefelter’s
syndrome. J Clin Endocrinol Metab. 1998, 83 (1), 203–205.
Ghanem M., Bakr N.I., Elgayaar M.A., el Mongy S., Fathy H., Ibrahim A.H.:
Comparison of the outcome of intracytoplasmic sperm injection in obstructive
and non-obstructive azoospermia in the first cycle: a report of case
series and meta-analysis. Int J Androl. 2005, 28 (1), 16–21
Giachini C., Laface I., Guarducci E., Balercia G., Forti G., Krausz C.: Partial
AZFc deletions and duplications: clinical correlates in the Italian population.
Hum Genet. 2008, 124 (4), 399–410.
Giamarellou H., Tympanidis K., Bitos N.A., Leonidas E., Daikos G.K.: Infertility
and chronic prostatitis. Andrologia. 1984, 16 (5), 417–422.
Gianaroli L., Magli M.C., Cavallini G., Crippa A., Nadalini M., Bernardini L. i
wsp.: Frequency of aneuploidy in sperm from patients with extremely severe
male factor infertility. Hum Reprod. 2005, 20 (8), 2140–2152.
Gil Salom M.: [Spermatic recovery techniques for intracytoplasmic spermatozoid
injection (ICSI) in male infertility]. Arch Esp Urol. 2004, 57 (9),
1035–1046.
Gilja I., Parazajder J., Radej M., Cvitković P., Kovacić M.: Retrograde ejaculation
and loss of emission: possibilities of conservative treatment. Eur Urol.
1994, 25 (3), 226–228.
Giwercman A., Bruun E., Frimodt-Møller C., Skakkebaek N.E.: Prevalence of
carcinoma in situ and other histopathological abnormalities in testes of
men with a history of cryptorchidism. J Urol. 1989, 142 (4), 998–1001.
Giwercman A., Hansen L.L., Skakkebaek N.E.: Initiation of sperm production
after bilateral orchiopexy: clinical and biological implications. J Urol.
2000a, 163 (4), 1255–1256.
Giwercman A., Kledal T., Schwartz M., Giwercman Y.L., Leffers H., Zazzi H. i wsp.:
Preserved male fertility despite decreased androgen sensitivity caused by
a mutation in the ligand-binding domain of the androgen receptor gene.
J Clin Endocrinol Metab. 2000b, 85 (6), 2253–2259.
Giwercman A., Müller J., Skakkebaek N.E.: Carcinoma in situ of the undescended
testis. Semin Urol. 1988, 6 (2), 110–119.
Giwercman A., Müller J., Skakkebaek N.E.: Prevalence of carcinoma in situ
and other histopathological abnormalities in testes from 399 men who died
suddenly and unexpectedly. J Urol. 1991, 145 (1), 77–80.
Goldstein M., Gilbert B.R., Dicker A.P., Dwosh J., Gnecco C.: Microsurgical
inguinal varicocelectomy with delivery of the testis: an artery and lymphatic
sparing technique. J Urol. 1992, 148 (6), 1808–1811.
Gottlieb B., Lombroso R., Beitel L.K., Trifiro M.A.: Molecular pathology of
the androgen receptor in male (in)fertility. Reprod Biomed Online. 2005,
10 (1), 42–48.
de Gouveia Brazao C.A., Pierik F.H., Oosterhuis J.W., Dohle G.R., Looijenga
L.H., Weber R.F.: Bilateral testicular microlithiasis predicts the presence
of the precursor of testicular germ cell tumors in subfertile men. J Urol.
2004, 171 (1), 158–160.
Gracia J., González N., Gómez M.E., Plaza L., Sánchez J., Alba J.: Clinical and
anatomopathological study of. 2000, cryptorchid testes. Br J Urol. 1995,
75 (6), 697–701.
Greenhall E., Vessey M.: The prevalence of subfertility: a review of the current
confusion and a report of two new studies. Fertil Steril. 1990, 54 (6), 978–983.
Grischenko V.I., Dunaevskaya A.V., Babenko V.I.: Cryopreservation of human
sperm using rapid cooling rates. Cryo Letters. 2003, 24 (2), 67–76.
Guttenbach M., Michelmann H.W., Hinney B., Engel W., Schmid M.: Segregation
of sex chromosomes into sperm nuclei in a man with 47,XXY Klinefelter’s
karyotype: a FISH analysis. Hum Genet. 1997, 99 (4), 474–477.
Hadziselimovic F., Hocht B., Herzog B., Buser M.W.: Infertility in cryptorchidism
is linked to the stage of germ cell development at orchidopexy. Horm
Res. 2007, 68 (1), 46–52.
Hallak J., Hendin B.N., Thomas A.J. Jr, Agarwal A.: Investigation of fertilizing
capacity of cryopreserved spermatozoa from patients with cancer. J
Urol. 1998, 159 (4), 1217–1220.
Handelsman D.J., Conway A.J., Boylan L.M., Turtle J.R.: Young’s syndrome.
Obstructive azoospermia and chronic sinopulmonary infections. N Engl
J Med. 1984, 310 (1), 3–9.
Handelsman D., Waites G.M.: Hormonal male contraception. W: Andrology
for the clinician. Red. W. Schill, F. Comhaire, T. Hargreave. Springer Verlag,
Berlin 2006a, 520–524
Handelsman D., Waites G.M.: Traditional methods. W: Andrology for the clinician.
Red. W. Schill, F. Comhaire, T. Hargreave. Springer Verlag, Berlin
2006b, 122–124.
Hauser R., Temple-Smith P.D., Southwick G.J., de Kretser D.: Fertility in cases
of hypergonadotropic azoospermia. Fertil Steril. 1995, 63 (3), 631–636.
Hauser R., Yogev L., Amit A., Yavetz H., Botchan A., Azem F. i wsp.: Severe hypospermatogenesis
in cases of nonobstructive azoospermia: should we use
fresh or frozen testicular spermatozoa? J Androl. 2005, 26 (6), 772–778.
Heidenreich A., Altmann P., Engelmann U.H.: Microsurgical vasovasostomy
versus microsurgical epididymal sperm aspiration/testicular extraction
of sperm combined with intracytoplasmic sperm injection. A cost benefit
analysis. Eur Urol. 2000, 37 (5), 609–614.
Hendry W.F.: Azoospermia and surgery for testicular obstruction. W: Male
infertility. Red. T.B. Hargreave. Springer Verlag, Berlin 1997.
Hendry W.F.: Disorders of ejaculation: congenital, acquired and functional.
Br J Urol. 1998, 82 (3), 331–341.
Hendry W.F., Parslow J.M., Stedronska J.: Exploratory scrototomy in 168
azoospermic males. Br J Urol. 1983, 55 (6), 785–791.
Heyns C.F., Hutson J.M.: Historical review of theories on testicular descent.
J Urol. 1995, 153 (3 Pt 1), 754–767.
Holden C.A., McLachlan R.I., Cumming R., Wittert G., Handelsman D.J., de
Kretser D.M. i wsp.: Sexual activity, fertility and contraceptive use in middle-
aged and older men: Men in Australia, Telephone Survey (MATeS). Hum
Reprod. 2005, 20 (12), 3429–3434.
Huleihel M., Lunenfeld E., Levy A., Potashnik G., Glezerman M.: Distinct expression
levels of cytokines and soluble cytokine receptors in seminal plasma
of fertile and infertile men. Fertil Steril. 1996, 66 (1), 135–139.
Huyghe E., Matsuda T., Thonneau P.: Increasing incidence of testicular cancer
worldwide: a review. J Urol. 2003, 170 (1), 5–11.
Ivanissevich O.: Left varicocele due to reflux; experience with 4,470 operative
cases in forty-two years. J Int Coll Surg. 1960, 34, 742–55.
Jacobsen R., Bostofte E., Engholm G., Hansen J., Olsen J.H., Skakkebaek N.E.
i wsp.: Risk of testicular cancer in men with abnormal semen characteristics:
cohort study. BMJ. 2000, 321 (7264), 789–792.
Jankowicz E., Drozdowski W., Pogumirski J.: Samoistna neuropatia autonomiczna
(pandysautonomia). Neurol Neurochir Pol. 2001, 35 (3), 439–452.
Jarvi K., Zini A., Buckspan M.B., Asch M., Ginzburg B., Margolis M.: Adverse
effects on vasoepididymostomy outcomes for men with concomitant abnormalities
in the prostate and seminal vesicle. J Urol. 1998, 160 (4), 1410–1412.
Jequier A.M.: Obstructive azoospermia: a study of 102 patients. Clin Reprod
Fertil. 1985, 3 (1), 21–36.
Johnson M.D.: Genetic risks of intracytoplasmic sperm injection in the treatment
of male infertility: recommendations for genetic counseling and screening.
Fertil Steril. 1998, 70 (3), 397–411.
Jonas D., Linzbach P., Weber W.: The use of Midodrin in the treatment of
ejaculation
disorders following retroperitoneal lymphadenectomy. Eur Urol.
1979, 5 (3), 184–187.
Jones P.F.: Approaches to orchidopexy. Br J Urol. 1995, 75 (6), 693–636.
Jungwirth A., Giwercman A., Tournaye H., Diemer T., Kopa Z., Dohle G. i wsp.:
European Association of Urology guidelines on Male Infertility: the. 2012,
update. Eur Urol. 2012, 62 (2), 324–332.
Jungwirth A., Gögüs C., Hauser G., Gomahr A., Schmeller N., Aulitzky W. i wsp.:
Clinical outcome of microsurgical subinguinal varicocelectomy in infertile
men. Andrologia. 2001, 33 (2), 71–74.
Kim E.D., Gilbaugh J.H., Patel V.R., Turek P.J., Lipshultz L.I.: Testis biopsies
frequently demonstrate sperm in men with azoospermia and significantly
elevated follicle-stimulating hormone levels. J Urol. 1997, 157 (1), 144–146.
Kolettis P.N., Thomas A.J.: Vasoepididymostomy for vasectomy reversal:
a critical assessment in the era of intracytoplasmic sperm injection. J Urol.
1997, 158 (2), 467–470.
Kollin C., Stukenborg J.B., Nurmio M., Sundqvist E., Gustafsson T., Söder O. i wsp.:
Boys with undescended testes: endocrine, volumetric and morphometric
studies on testicular function before and after orchidopexy at nine months
or three years of age. J Clin Endocrinol Metab. 2012, 97 (12), 4588–4595.
Korthorst R.A., Consten D., van Roijen J.H.: Clearance after vasectomy with
a single semen sample containing < than 100 000 immotile sperm/mL:
analysis of. 1073, patients. BJU Int. 2010, 105 (11), 1572–1575.
Krausz C.: Genetic aspects of male infertility. European Urological Review.
2009, 3 (2).
Krausz C., Degl’Innocenti S.: Y chromosome and male infertility: update,
2006. Front Biosci. 2006, 11, 3049–3061.
Krausz C., Forti G., McElreavey K.: The Y chromosome and male fertility and
infertility. Int J Androl. 2003, 26 (2), 70–75.
Krausz C., Giachini C.: Genetic risk factors in male infertility. Arch Androl.
2007, 53 (3), 125–133.
Krausz C., Giachini C., Lo Giacco D., Daguin F., Chianese C., Ars E. i wsp.: High
resolution X chromosome-specific array-CGH detects new CNVs in infertile
males. PLoS One. 2012, 7 (10), e44887.
Krausz C., Hoefsloot L., Simoni M., Tüttelmann F.: EAA/EMQN best practice
guidelines for molecular diagnosis of Y-chromosomal microdeletions: stateof-
the-art 2013. Andrology. 2014, 2 (1), 5–19.
Krieger J.N., Berger R.E., Ross S.O., Rothman I., Muller C.H.: Seminal fluid
findings in men with nonbacterial prostatitis and prostatodynia. J Androl.
1996, 17 (3), 310–318.
Kuligowska E., Baker C.E., Oates R.D.: Male infertility: role of transrectal US
in diagnosis and management. Radiology. 1992, 185 (2), 353–360.
Lanfranco F., Kamischke A., Zitzmann M., Nieschlag E.: Klinefelter’s syndrome.
Lancet. 2004, 364 (9430), 273–283.
Le Bourhis C., Siffroi J.P., McElreavey K., Dadoune J.P.: Y chromosome microdeletions
and germinal mosaicism in infertile males. Mol Hum Reprod.
2000, 6 (8), 688–693.
Leib Z., Bartoov B., Eltes F., Servadio C.: Reduced semen quality caused by
chronic abacterial prostatitis: an enigma or reality? Fertil Steril. 1994, 61
(6), 1109–1116.
Lenk S., Fahlenkamp D., Gliech V., Lindeke A.: Comparison of different methods
of treating varicocele. J Androl. 1994, 15 Suppl: 34S–37S.
Li S.Q., Goldstein M., Zhu J., Huber D.: The no-scalpel vasectomy. J Urol.
1991, 145 (2), 341–344.
Liversedge N.H., Jenkins J.M., Keay S.D., McLaughlin E.A., Al-Sufyan H., Maile
L.A. i wsp.: Antibiotic treatment based on seminal cultures from asymptomatic
male partners in in-vitro fertilization is unnecessary and may be
detrimental. Hum Reprod. 1996, 11 (6), 1227–1231.
von der Maase H., Rørth M., Walbom-Jørgensen S., Sørensen B.L., Christophersen
I.S., Hald T. i wsp.: Carcinoma in situ of contralateral testis in patients with
testicular germ cell cancer: study of 27 cases in 500 patients. Br Med J (Clin
Res Ed). 1986, 293 (6559), 1398–1401.
Mangoli V., Dandekar S., Desai S., Mangoli R.: The outcome of ART in males
with impaired spermatogenesis. J Hum Reprod Sci. 2008, 1 (2), 73–76.
Manning M., Jünemann K.P., Alken P.: Decrease in testosterone blood concentrations
after testicular sperm extraction for intracytoplasmic sperm
injection in azoospermic men. Lancet. 1998, 352 (9121), 37.
Marconi M., Keudel A., Diemer T., Bergmann M., Steger K., Schuppe H.C. i wsp.:
Combined trifocal and microsurgical testicular sperm extraction is the best
technique for testicular sperm retrieval in “low-chance” nonobstructive
azoospermia. Eur Urol. 2012, 62 (4), 713–739.
Martin-du-Pan R.C., Bischof P.: Increased follicle stimulating hormone in
infertile men. Is increased plasma FSH always due to damaged germinal
epithelium? Hum Reprod. 1995, 10 (8), 1940–1945.
Martini E., Geraedts J.P., Liebaers I., Land J.A., Capitanio G.L., Ramaekers
F.C. i wsp.: Constitution of semen samples from XYY and XXY males as
analysed by in-situ hybridization. Hum Reprod. 1996, 11 (8), 1638–1643.
Matthews G.J., Schlegel P.N., Goldstein M.: Patency following microsurgical
vasoepididymostomy and vasovasostomy: temporal considerations. J Urol.
1995, 154 (6), 2070–2073.
Matthiesson K.L., McLachlan R.I.: Male hormonal contraception: concept
proven, product in sight? Hum Reprod Update. 2006, 12 (4), 463–482.
Maurer C.A., Z’Graggen K., Renzulli P., Schilling M.K., Netzer P., Büchler M.W.:
Total mesorectal excision preserves male genital function compared with
conventional rectal cancer surgery. Br J Surg. 2001, 88 (11), 1501–1505.
McMahon C.G., Porst H.: Oral agents for the treatment of premature ejaculation:
review of efficacy and safety in the context of the recent International
Society for Sexual Medicine criteria for lifelong premature ejaculation. J Sex
Med. 2011, 8 (10), 2707–2725.
McVicar C.M., O’Neill D.A., McClure N., Clements B., McCullough S., Lewis
S.E. i wsp.: Effects of vasectomy on spermatogenesis and fertility outcome
after testicular sperm extraction combined with ICSI. Hum Reprod. 2005,
20 (10), 2795–2800.
Miersch W.D., Schoeneich G., Winter P., Buszello H.: Laparoscopic varicocelectomy:
indication, technique and surgical results. Br J Urol. 1995, 76
(5), 636–638.
Miller F.N., Sidhu P.S.: Does testicular microlithiasis matter? A review. Clin
Radiol. 2002, 57 (10), 883–890.
Miller K.D., Coughlin M.T., Lee P.A.: Fertility after unilateral cryptorchidism.
Paternity, time to conception, pretreatment testicular location and
size, hormone and sperm parameters. Horm Res. 2001, 55 (5), 249–253.
Miyagawa Y., Tsujimura A., Matsumiya K., Takao T., Tohda A., Koga M. i wsp.:
Outcome of gonadotropin therapy for male hypogonadotropic hypogonadism
at university affiliated male infertility centers: a 30-year retrospective study.
J Urol. 2005, 173 (6), 2072–2025.
Nathanson K.L., Kanetsky P.A., Hawes R., Vaughn D.J., Letrero R., Tucker K.
i wsp.: The Y deletion gr/gr and susceptibility to testicular germ cell tumor.
Am J Hum Genet. 2005, 77 (6), 1034–1043.
National guideline for the management of epididymo-orchitis. Clinical
Effectiveness Group (Association of Genitourinary Medicine and the Medical
Society for the Study of Venereal Diseases). Sex Transm Infect. 1999, 75
(Suppl 1), 51–53.
Navarro-Costa P., Gonçalves J., Plancha C.E.: The AZFc region of the Y chromosome:
at the crossroads between genetic diversity and male infertility.
Hum Reprod Update. 2010, 16 (5), 525–542.
PIŚMIENNICTWO cz_2
Nieschlag E., Behre H.M., Nieschlag S.: Andrology. Male reproductive health
and dysfunction. Springer Verlag, Berlin 2010.
Nieschlag E., Wang C.C., Handelsman D.J., Swerdloff R.S., Wu F.C.: Guidelines
for the use of androgens in men. WHO, Geneva 1992.
Nirapathpongporn A., Huber D.H., Krieger J.N.: No-scalpel vasectomy at the
King’s birthday vasectomy festival. Lancet. 1990, 335 (8694), 894–895.
Nord C., Bjøro T., Ellingsen D., Mykletun A., Dahl O., Klepp O. i wsp.: Gonadal
hormones in long-term survivors 10 years after treatment for unilateral
testicular cancer. Eur Urol. 2003, 44 (3), 322–328.
Nuti F., Krausz C.: Gene polymorphisms/mutations relevant to abnormal
spermatogenesis. Reprod Biomed Online. 2008, 16 (4), 504–513.
Oates R.D., Amos J.A.: The genetic basis of congenital bilateral absence of
the vas deferens and cystic fibrosis. J Androl. 1994, 15 (1), 1–8.
O’Connell M., McClure N., Lewis S.E.: The effects of cryopreservation on
sperm morphology, motility and mitochondrial function. Hum Reprod.
2002, 17 (3), 704–709.
Palomo A.: Radical cure of varicocele by a new technique; preliminary report.
J Urol. 1949, 61 (3), 604–607.
Pang M.G., Kim Y.J., Lee S.H., Kim C.K.: The high incidence of meiotic errors
increases with decreased sperm count in severe male factor infertilities.
Hum Reprod. 2005, 20 (6), 1688–1694.
Parra B.L., Venable D.D., Gonzalez E., Eastham J.A.: Testicular microlithiasis
as a predictor of intratubular germ cell neoplasia. Urology. 1996, 48
(5), 797–799.
Patsalis P.C., Sismani C., Quintana-Murci L., Taleb-Bekkouche F., Krausz C.,
McElreavey K. i wsp.: Effects of transmission of Y chromosome AZFc deletions.
Lancet. 2002, 360 (9341), 1222–1224.
Pavlovich C.P., Schlegel P.N.: Fertility options after vasectomy: a cost-effectiveness
analysis. Fertil Steril. 1997, 67 (1), 133–141.
van Peperstraten A., Proctor M.L., Johnson N.P., Philipson G.: Techniques for
surgical retrieval of sperm prior to ICSI for azoospermia. Cochrane Database
Syst Rev. 2006, (3), CD002807.
Petersen P.M., Skakkebaek N.E., Rørth M., Giwercman A.: Semen quality and
reproductive hormones before orchiectomy in men with testicular cancer.
J Clin Oncol. 1999, 17 (3), 941–947.
Peterson A.C., Bauman J.M., Light D.E., McMann L.P., Costabile R.A.: The prevalence
of testicular microlithiasis in an asymptomatic population of men
18 to 35 years old. J Urol. 2001, 166 (6), 2061–2064.
Pettersson A., Richiardi L., Nordenskjold A., Kaijser M., Akre O.: Age at surgery
for undescended testis and risk of testicular cancer. N Engl J Med. 2007,
356 (18), 1835–1841.
Pierik F.H., Dohle G.R., van Muiswinkel J.M., Vreeburg J.T., Weber R.F.: Is
routine scrotal ultrasound advantageous in infertile men? J Urol. 1999,
162 (5), 1618–1620.
Pierik F.H., van Ginneken A.M., Dohle G.R., Vreeburg J.T., Weber R.F.: The
advantages of standardized evaluation of male infertility. Int J Androl.
2000, 23 (6), 340–346.
Pierik F.H., Vreeburg J.T., Stijnen T., de Jong F.H., Weber R.F.: Serum inhibin
B as a marker of spermatogenesis. J Clin Endocrinol Metab. 1998, 83 (9),
3110–3114.
Pryor J.: Erectile and ejaculatory problems in infertility. W: Male fnfertility.
Red. T.B. Hargreave. Springer Verlag, Berlin 1997, 319–336.
Purvis K., Christiansen E.: Infection in the male reproductive tract. Impact,
diagnosis and treatment in relation to male infertility. Int J Androl. 1993,
16 (1), 1–13.
Rajender S., Singh L., Thangaraj K.: Phenotypic heterogeneity of mutations in
androgen receptor gene. Asian J Androl. 2007, 9 (2), 147–179.
Repping S., Skaletsky H., Brown L., van Daalen S.K., Korver C.M., Pyntikova T.
i wsp.: Polymorphism for a 1.6-Mb deletion of the human Y chromosome
persists through balance between recurrent mutation and haploid selection.
Nat Genet. 2003, 35 (3), 247–251.
Ritzen E.M.: Undescended testes: a consensus on management. Eur J
Endocrinol. 2008, 159, Suppl 1, S87–90.
Robinson A.J., Grant J.B., Spencer R.C., Potter C., Kinghorn G.R.: Acute
epididymitis: why patient and consort must be investigated. Br J Urol.
1990, 66 (6), 642–645.
Ross C., Morriss A., Khairy M., Khalaf Y., Braude P., Coomarasamy A. i wsp.:
A systematic review of the effect of oral antioxidants on male infertility.
Reprod Biomed Online. 2010, 20 (6), 711–723.
Rowe T.: Fertility and a woman’s age. J Reprod Med. 2006, 51 (3), 157–163.
Rudkin L., Taylor M.J., Hawton K.: Strategies for managing sexual dysfunction
induced by antidepressant medication. Cochrane Database Syst Rev.
2004, (4), CD003382.
Ruiz-Romero J., Sarquella J., Pomerol J.M.: A new device for microsurgical
sperm aspiration. Andrologia. 1994, 26 (2), 119–120.
Saito K., Suzuki K., Iwasaki A., Yumura Y., Kubota Y.: Sperm cryopreservation
before cancer chemotherapy helps in the emotional battle against cancer.
Cancer. 2005, 104 (3), 521–524.
Sawada Y., Ackerman D., Behrman S.J.: Motility and respiration of human
spermatozoa after cooling to various lowtemperatures. Fertil Steril. 1967,
18 (6), 775–781.
Schaeffer A.J.: Clinical practice. Chronic prostatitis and the chronic pelvic
pain syndrome. N Engl J Med. 2006, 355 (16), 1690–1698.
Schill W.B.: Pregnancy after brompheniramine treatment of a diabetic with
incomplete emission failure. Arch Androl. 1990, 25 (1), 101–104.
Schlegel P.N.: Testicular sperm extraction: microdissection improves sperm
yield with minimal tissue excision. Hum Reprod. 1999, 14 (1), 131–135.
Schlegel P.N., Shin D., Goldstein M.: Urogenital anomalies in men with congenital
absence of the vas deferens. J Urol. 1996, 155 (5), 1644–1648.
Schopohl J., Mehltretter G., von Zumbusch R., Eversmann T., von Werder K.:
Comparison of gonadotropin-releasing hormone and gonadotropin therapy
in male patients with idiopathic hypothalamic hypogonadism. Fertil
Steril. 1991, 56 (6), 1143–1150.
Schoysman R.: Vaso-epididymostomy – a survey of techniques and results
with considerations of delay of appearance of spermatozoa after surgery.
Acta Eur Fertil. 1990, 21 (5), 239–245.
Schrader M., Müller M., Sofikitis N., Straub B., Krause H., Miller K.: “Oncotese”:
testicular sperm extraction in azoospermic cancer patients before
chemotherapy-new guidelines? Urology. 2003, 61 (2), 421–425.
Schroeder-Printzen I., Diemer T., Weidner W.: Vasovasostomy. Urol Int. 2003,
70 (2), 101–107.
Schroeder-Printzen I., Ludwig M., Köhn F., Weidner W.: Surgical therapy in
infertile men with ejaculatory duct obstruction: technique and outcome of
a standardized surgical approach. Hum Reprod. 2000a, 15 (6), 1364–1368.
Schroeder-Printzen I., Zumbé J., Bispink L., Palm S., Schneider U., Engelmann U.
i wsp.: Microsurgical epididymal sperm aspiration: aspirate analysis and
straws available after cryopreservation in patients with non-reconstructable
obstructive azoospermia. MESA/TESE Group Giessen. Hum Reprod.
2000b, 15 (12), 2531–2535.
Schuhrke T.D., Kaplan G.W.: Prostatic utricle cysts (mullerian duct cysts).
J Urol. 1978, 119 (6), 765–767.
Schwarzer J.U., Fiedler K., Hertwig I., Krüsmann G., Würfel W., Schleyer M. i wsp.:
Sperm retrieval procedures and intracytoplasmatic spermatozoa injection
withepididymal and testicular sperms. Urol Int. 2003, 70 (2), 119–123.
Schwarzer J.U., Steinfatt H., Schleyer M., Köhn F.M., Fiedler K., von Hertwig I.
i wsp.: No relationship between biopsy sites near the main testicular vessels
or rete testis and successful sperm retrieval using conventional or microdissection
biopsies in 220 nonobstructive azoospermic men. Asian J Androl.
2013, 15 (6), 795–798.
Schwingl P.J., Guess H.A.: Safety and effectiveness of vasectomy. Fertil Steril.
2000, 73 (5), 923–936.
Seyferth W., Jecht E., Zeitler E.: Percutaneous sclerotherapy of varicocele.
Radiology. 1981, 139 (2), 335–340.
Sherman J.K., Bunge R.G.: Observations on preservation of human spermatozoa
at low temperatures. Proc Soc Exp Biol Med. 1953, 82 (4), 686–688.
Shimonovitz S., Barak V., Zacut D., Ever-Hadani P., Ben Chetrit A., Ron M. i wsp.:
High concentration of soluble interleukin-2 receptors in ejaculate with low
sperm motility. Hum Reprod. 1994, 9 (4), 653–655.
Shin D., Lipshultz L.I., Goldstein M., Barmé G.A., Fuchs E.F., Nagler H.M. i wsp.:
Herniorrhaphy with polypropylene mesh causing inguinal vasal obstruction:
a preventable cause of obstructive azoospermia. Ann Surg. 2005, 241
(4), 553–558.
Showell M.G., Brown J., Yazdani A., Stankiewicz M.T., Hart R.J.: Antioxidants
for male subfertility. Cochrane Database Syst Rev. 2011, 1, CD007411.
Siffroi J.P., Le Bourhis C., Krausz C., Barbaux S., Quintana-Murci L., Kanafani S.
i wsp.: Sex chromosome mosaicism in males carrying Y chromosome long
arm deletions. Hum Reprod. 2000, 15 (12), 2559–2562.
Sigmund G., Bähren W., Gall H., Lenz M., Thon W.: Idiopathic varicoceles: feasibility
of percutaneous sclerotherapy. Radiology. 1987, 164 (1), 161–168.
Silber S.J., Balmaceda J., Borrero C., Ord T., Asch R.: Pregnancy with sperm
aspiration from the proximal head of the epididymis: a new treatment for
congenital absence of the vas deferens. Fertil Steril. 1988, 50 (3), 525–528.
Silber S.J., Grotjan H.E.: Microscopic vasectomy reversal 30 years later: a summary
of. 4010, cases by the same surgeon. J Androl. 2004, 25 (6), 845–859.
Simoni M., Bakker E., Krausz C.: EAA/EMQN best practice guidelines for
molecular diagnosis of y-chromosomal microdeletions. State of the art
2004. Int J Androl. 2004, 27 (4), 240–249.
Skakkebaek N.E.: Carcinoma in situ of the testis: frequency and relationship
to invasive germ cell tumours in infertile men. Histopathology. 1978,
2 (3), 157–170.
Skakkebaek N.E., Rajpert-De Meyts E., Main K.M.: Testicular dysgenesis syndrome:
an increasingly common developmental disorder with environmental
aspects. Hum Reprod. 2001, 16 (5), 972–978.
Skaletsky H., Kuroda-Kawaguchi T., Minx P.J., Cordum H.S., Hillier L., Brown
L.G. i wsp.: The male-specific region of the human Y chromosome is a mosaic
of discrete sequence classes. Nature. 2003, 423 (6942), 825–837.
Smith K.D., Steinberger E.: Survival of spermatozoa in a human sperm bank.
Effects of long-term storage in liquid nitrogen. JAMA. 1973, 223 (7), 774–777.
Snick H.K., Snick T.S., Evers J.L., Collins J.A.: The spontaneous pregnancy
prognosis in untreated subfertile couples: the Walcheren primary care study.
Hum Reprod. 1997, 12 (7), 1582–1588.
Sokal D., Irsula B., Chen-Mok M., Labrecque M., Barone M.A.: A comparison
of vas occlusion techniques: cautery more effective than ligation and excision
with fascial interposition. BMC Urol. 2004a, 4 (1), 12.
Sokal D., Irsula B., Hays M., Chen-Mok M., Barone M.A.: Vasectomy by ligation
and excision, with or without fascial interposition: a randomized controlled
trial [ISRCTN77781689]. BMC Med. 2004b, 2, 6.
Staessen C., Tournaye H., van Assche E., Michiels A., van Landuyt L., Devroey
P.: PGD in 47,XXY Klinefelter’s syndrome patients. Hum Reprod Update.
2003, 9 (4), 319–330.
van Steirteghem A., Bonduelle M., Devroey P., Liebaers I.: Follow-up of children
born after ICSI. Hum Reprod Update. 2002, 8 (2), 111–116.
Stouffs K., Lissens W., Tournaye H., Haentjens P.: What about gr/gr deletions
and male infertility? Systematic review and metaanalysis. Hum Reprod
Update. 2011, 17 (2), 197–209.
Stouffs K., Tournaye H., Liebaers I., Lissens W.: Male infertility and the involvement
of the X chromosome. Hum Reprod Update. 2009, 15 (6), 623–637.
Stuppia L., Gatta V., Calabrese G., Guanciali Franchi P., Morizio E., Bombieri C.
i wsp.: A quarter of men with idiopathic oligo-azoospermia display chromosomal
abnormalities and microdeletions of different types in interval
6 of Yq11. Hum Genet. 1998, 102 (5), 566–570.
Surya B.V., Washecka R., Glasser J., Johanson K.E.: Cysts of the seminal vesicles:
diagnosis and management. Br J Urol. 1988, 62 (5), 491–493.
Tan S.M., Ng F.C., Ravintharan T., Lim P.H., Chng H.C.: Laparoscopic varicocelectomy:
technique and results. Br J Urol. 1995, 75 (4), 523–528.
Tauber R., Johnsen N.: Antegrade scrotal sclerotherapy for the treatment
of varicocele: technique and late results. J Urol. 1994, 151 (2), 386–390.
Taylor-Robinson D.: Evaluation and comparison of tests to diagnose Chlamydia
trachomatis genital infections. Hum Reprod. 1997, 12 (11 Suppl), 113–120.
Taylor-Robinson D.: Infections due to species of Mycoplasma and Ureaplasma:
an update. Clin Infect Dis. 1996, 23 (4), 671–682.
Tempest H.G., Martin R.H.: Cytogenetic risks in chromosomally normal infertile
men. Curr Opin Obstet Gynecol. 2009, 21 (3), 223–227.
Thomas K., Wood S.J., Thompson A.J., Pilling D., Lewis-Jones D.I.: The incidence
and significance of testicular microlithiasis in a subfertile population. Br J
Radiol. 2000, 73 (869), 494–497.
Tincello D.G., Saunders P.T., Hargreave T.B.: Preliminary investigations on
androgen receptor gene mutations in infertile men. Mol Hum Reprod. 1997,
3 (11), 941–943.
Trum J.W., Mol B.W., Pannekoek Y., Spanjaard L., Wertheim P., Bleker O.P i wsp.:
Value of detecting leukocytospermia in the diagnosis of genital tract infection
in subfertile men. Fertil Steril. 1998, 70 (2), 315–319.
Tuttelmann F., Rajpert-De Meyts E., Nieschlag E., Simoni M.: Gene polymorphisms
and male infertility – a meta-analysis and literature review. Reprod
Biomed Online. 2007, 15 (6), 643–658.
Tuttelmann F., Simoni M., Kliesch S., Ledig S., Dworniczak B., Wieacker P. i wsp.:
Copy number variants in patients with severe oligozoospermia and Sertolicell-
only syndrome. PLoS One. 2011, 6 (4), e19426.
Tyler-Smith C., Krausz C.: The will-o’-the-wisp of genetics – hunting for the
azoospermia factor gene. N Engl J Med. 2009, 360 (9), 925–927.
Verhulst A.P., Hoekstra J.W.: Paternity after bilateral vasectomy. BJU Int.
1999, 83 (3), 280–282.
Vernaeve V., Tournaye H., Osmanagaoglu K., Verheyen G., van Steirteghem A.,
Devroey P.: Intracytoplasmic sperm injection with testicular spermatozoa is
less successful in men with nonobstructive azoospermia than in men with
obstructive azoospermia. Fertil Steril. 2003, 79 (3), 529–533.
Vincent M.C., Daudin M., De M.P., Massat G., Mieusset R., Pontonnier F. i wsp.:
Cytogenetic investigations of infertile men with low sperm counts: a 25-year
experience. J Androl. 2002, 23 (1), 18–22
Vogt P.H., Edelmann A., Kirsch S., Henegariu O., Hirschmann P., Kiesewetter F.
i wsp.: Human Y chromosome azoospermia factors (AZF) mapped to different
subregions in Yq11. Hum Mol Genet. 1996, 5 (7), 933–943.
Wagenlehner F.M., Diemer T., Naber K.G., Weidner W.: Chronic bacterial prostatitis
(NIH type II), diagnosis, therapy and influence on the fertility status.
Andrologia. 2008, 40 (2), 100–104.
Waldinger M.D.: The neurobiological approach to premature ejaculation. J
Urol. 2002, 168 (6), 2359–2367.
Wang P.J.: X chromosomes, retrogenes and their role in male reproduction.
Trends Endocrinol Metab. 2004, 15 (2), 79–83.
Wang C., Baker H.W., Burger H.G., De Kretser D.M., Hudson B.: Hormonal studies
in Klinefelter’s syndrome. Clin Endocrinol (Oxf). 1975, 4 (4), 399–411.
Wang R., Monga M., Hellstrom W.J.: Ejaculatory dysfunction. W: Male infertility:
clinical investigation. Cause, evaluation and treatment. Red. F.H.
Comhaire. Chapman Hall, London 1996, 205–221.
Watson P.F.: Recent developments and concepts in the cryopreservation of
spermatozoa and the assessment of their post-thawing function. Reprod
Fertil Dev. 1995, 7 (4), 871–891.
Weidner W., Jantos C., Schiefer H.G., Haidl G., Friedrich H.J.: Semen parameters
in men with and without proven chronic prostatitis. Arch Androl.
1991, 26 (3), 173–183.
Weidner W., Krause W.: Orchitis. W: Encyclopedia of reproduction. Red. E.
Knobil, J.D. Neill. Academic Press, San Diego 1999, 92–95.
Weidner W., Krause W., Ludwig M.: Relevance of male accessory gland infection
for subsequent fertility with special focus on prostatitis. Hum Reprod
Update. 1999, 5 (5), 421–432.
Weidner W., Krause W., Schiefer H.G., Brunner H., Friedrich H.J.: Ureaplasmal
infections of the male urogenital tract, in particular prostatitis, and semen
quality. Urol Int. 1985, 40 (1), 5–9.
Weidner W., Ludwig M., Miller J.: Therapy in male accessory gland infection
– what is fact, what is fiction? Andrologia. 1998, 30, Suppl 1, 87–90.
Weidner W., Schiefer H.G., Garbe C.: Acute nongonococcal epididymitis.
Aetiological and therapeutic aspects. Drugs. 1987, 34 Suppl 1, 111–117.
Wilkerson M.L., Bartone F.F., Fox L., Hadziselimovic F.: Fertility potential:
a comparison of intra-abdominal and intracanalicular testes by age groups
in children. Horm Res. 2001, 55 (1), 18–20.
Willemse P.H., Sleijfer D.T., Sluiter W.J., Schraffordt Koops H., Doorenbos H.:
Altered Leydig cell function in patients with testicular cancer: evidence for
bilateral testicular defect. Acta Endocrinol (Copenh). 1983, 102 (4), 616–624.
Wolff H.: The biologic significance of white blood cells in semen. Fertil Steril.
1995, 63 (6), 1143–1157.
Wolff H., Bezold G., Zebhauser M., Meurer M.: Impact of clinically silent inflammation
on male genital tract organs as reflected by biochemical markers in
semen. J Androl. 1991, 12 (5), 331–334.
Woolley D.M., Richardson D.W.: Ultrastructural injury to human spermatozoa
after freezing and thawing. J Reprod Fertil. 1978, 53 (2), 389–394.
WHO. Reproductive health strategy. Reproductive Health Research World
Health Organisation, Geneva. Adopted at the 57th World Health Assembly. 2004
WHO. The influence of varicocele on parameters of fertility in a large group
of men presenting to infertility clinics. World Health Organization. Fertil
Steril. 1992, 57 (6), 1289–1293.
WHO. WHO Laboratory Manual for the Examination and Processing of
Human Semen, in 5th edn. 2010.
WHO. WHO Manual for the Standardized Investigation, Diagnosis and
Management of the Infertile Male. Cambridge University Press, Cambridge 2000.
Yachia D.: Our experience with penile deformations: incidence, operative
techniques, and results. J Androl. 1994, 15, Suppl., 63S–68S.
Yavetz H., Harash B., Paz G., Yogev L., Jaffa A.J., Lessing J.B. i wsp.:
Cryptorchidism: incidence and sperm quality in infertile men. Andrologia.
1992, 24 (5), 293–297.
Zalata A., Hafez T., van Hoecke M.J., Comhaire F.: Evaluation of beta-endorphin
and interleukin-6 in seminal plasma of patients with certain andrological
diseases. Hum Reprod. 1995, 10 (12), 3161–3165.
Zhang F., Lu C., Li Z., Xie P., Xia Y., Zhu X. i wsp.: Partial deletions are associated
with an increased risk of complete deletion in AZFc: a new insight
into the role of partial AZFc deletions in male infertility. J Med Genet.
2007, 44 (7), 437–444.
Zini A., Dohle G.: Are varicoceles associated with increased deoxyribonucleic
acid fragmentation? Fertil Steril. 2011, 96 (6), 1283–1287.
Zini A., Sigman M.: Are tests of sperm DNA damage clinically useful? Pros
and cons. J Androl. 2009, 30 (3), 219–229.Vogt P.H., Edelmann A., Kirsch S., Henegariu O., Hirschmann P., Kiesewetter F.
i wsp.: Human Y chromosome azoospermia factors (AZF) mapped to different
subregions in Yq11. Hum Mol Genet. 1996, 5 (7), 933–943.
Wagenlehner F.M., Diemer T., Naber K.G., Weidner W.: Chronic bacterial prostatitis
(NIH type II), diagnosis, therapy and influence on the fertility status.
Andrologia. 2008, 40 (2), 100–104.
Waldinger M.D.: The neurobiological approach to premature ejaculation. J
Urol. 2002, 168 (6), 2359–2367.
Wang P.J.: X chromosomes, retrogenes and their role in male reproduction.
Trends Endocrinol Metab. 2004, 15 (2), 79–83.
Wang C., Baker H.W., Burger H.G., De Kretser D.M., Hudson B.: Hormonal studies
in Klinefelter’s syndrome. Clin Endocrinol (Oxf). 1975, 4 (4), 399–411.
Wang R., Monga M., Hellstrom W.J.: Ejaculatory dysfunction. W: Male infertility:
clinical investigation. Cause, evaluation and treatment. Red. F.H.
Comhaire. Chapman Hall, London 1996, 205–221.
Watson P.F.: Recent developments and concepts in the cryopreservation of
spermatozoa and the assessment of their post-thawing function. Reprod
Fertil Dev. 1995, 7 (4), 871–891.
Weidner W., Jantos C., Schiefer H.G., Haidl G., Friedrich H.J.: Semen parameters
in men with and without proven chronic prostatitis. Arch Androl.
1991, 26 (3), 173–183.
Weidner W., Krause W.: Orchitis. W: Encyclopedia of reproduction. Red. E.
Knobil, J.D. Neill. Academic Press, San Diego 1999, 92–95.
Weidner W., Krause W., Ludwig M.: Relevance of male accessory gland infection
for subsequent fertility with special focus on prostatitis. Hum Reprod
Update. 1999, 5 (5), 421–432.
Weidner W., Krause W., Schiefer H.G., Brunner H., Friedrich H.J.: Ureaplasmal
infections of the male urogenital tract, in particular prostatitis, and semen
quality. Urol Int. 1985, 40 (1), 5–9.
Weidner W., Ludwig M., Miller J.: Therapy in male accessory gland infection
– what is fact, what is fiction? Andrologia. 1998, 30, Suppl 1, 87–90.
Weidner W., Schiefer H.G., Garbe C.: Acute nongonococcal epididymitis.
Aetiological and therapeutic aspects. Drugs. 1987, 34 Suppl 1, 111–117.
Wilkerson M.L., Bartone F.F., Fox L., Hadziselimovic F.: Fertility potential:
a comparison of intra-abdominal and intracanalicular testes by age groups
in children. Horm Res. 2001, 55 (1), 18–20.
Willemse P.H., Sleijfer D.T., Sluiter W.J., Schraffordt Koops H., Doorenbos H.:
Altered Leydig cell function in patients with testicular cancer: evidence for
bilateral testicular defect. Acta Endocrinol (Copenh). 1983, 102 (4), 616–624.
Wolff H.: The biologic significance of white blood cells in semen. Fertil Steril.
1995, 63 (6), 1143–1157.
Wolff H., Bezold G., Zebhauser M., Meurer M.: Impact of clinically silent inflammation
on male genital tract organs as reflected by biochemical markers in
semen. J Androl. 1991, 12 (5), 331–334.
Woolley D.M., Richardson D.W.: Ultrastructural injury to human spermatozoa
after freezing and thawing. J Reprod Fertil. 1978, 53 (2), 389–394.
WHO. Reproductive health strategy. Reproductive Health Research World
Health Organisation, Geneva. Adopted at the 57th World Health Assembly. 2004
WHO. The influence of varicocele on parameters of fertility in a large group
of men presenting to infertility clinics. World Health Organization. Fertil
Steril. 1992, 57 (6), 1289–1293.
WHO. WHO Laboratory Manual for the Examination and Processing of
Human Semen, in 5th edn. 2010.
WHO. WHO Manual for the Standardized Investigation, Diagnosis and
Management of the Infertile Male. Cambridge University Press, Cambridge 2000.
Yachia D.: Our experience with penile deformations: incidence, operative
techniques, and results. J Androl. 1994, 15, Suppl., 63S–68S.
Yavetz H., Harash B., Paz G., Yogev L., Jaffa A.J., Lessing J.B. i wsp.:
Cryptorchidism: incidence and sperm quality in infertile men. Andrologia.
1992, 24 (5), 293–297.
Zalata A., Hafez T., van Hoecke M.J., Comhaire F.: Evaluation of beta-endorphin
and interleukin-6 in seminal plasma of patients with certain andrological
diseases. Hum Reprod. 1995, 10 (12), 3161–3165.
Zhang F., Lu C., Li Z., Xie P., Xia Y., Zhu X. i wsp.: Partial deletions are associated
with an increased risk of complete deletion in AZFc: a new insight
into the role of partial AZFc deletions in male infertility. J Med Genet.
2007, 44 (7), 437–444.
Zini A., Dohle G.: Are varicoceles associated with increased deoxyribonucleic
acid fragmentation? Fertil Steril. 2011, 96 (6), 1283–1287.
Zini A., Sigman M.: Are tests of sperm DNA damage clinically useful? Pros
and cons. J Androl. 2009, 30 (3), 219–229.
5. KONFLIKT INTERESÓW
Wszyscy członkowie Panelu Ekspertów EAU opracowującego
„Rekomendacje dotyczące męskiej niepłodności”
dostarczyli oświadczenia na temat wszystkich
relacji, które mogłyby być odebrane jako konflikt interesów.
Informacja ta jest oficjalnie dostępna na stronie
internetowej EAU. Przygotowanie rekomendacji było
finansowane przez EAU. Nie były zaangażowane żadne
zewnętrzne środki finansowania i wsparcia. EAU jest
organizacją non-profit, a finansowanie zostało ograniczone
do wydatków na działalność administracyjną,
koszty podróży i spotkań. Nie opłacano honorariów, ani
innych wydatków.
5. KONFLIKT INTERESÓW
Wszyscy członkowie Panelu Ekspertów EAU opracowującego
„Rekomendacje dotyczące męskiej niepłodności”
dostarczyli oświadczenia na temat wszystkich
relacji, które mogłyby być odebrane jako konflikt interesów.
Informacja ta jest oficjalnie dostępna na stronie
internetowej EAU. Przygotowanie rekomendacji było
finansowane przez EAU. Nie były zaangażowane żadne
zewnętrzne środki finansowania i wsparcia. EAU jest
organizacją non-profit, a finansowanie zostało ograniczone
do wydatków na działalność administracyjną,
koszty podróży i spotkań. Nie opłacano honorariów, ani
innych wydatków.
KONFERENCJA POLSKIEGO TOWARZYSTWA ANDROLOGICZNEGO 18. DZIEŃ ANDROLOGICZNY Gdańsk 30.09.–01.10.2016 www.pta2016.pl
Sprawozdanie
W dniach 30. września do 01. października 2016 r.
w Hotelu Novotel Marina w Gdańsku odbyła się Konferencja
18. Dzień Andrologiczny organizowana przez
Polskie Towarzystwo Andrologiczne (PTA). Organizacją
tego wydarzenia zajęło się Biuro Organizacji Konferencji
Uniwersytetu Medycznego im. Karola Marcinkowskiego
w Poznaniu przy współpracy Komitetu Organizacyjnego
Sympozjum pod przewodnictwem dr n. med. Mariusza
Łukaszuka i Komitetu Naukowego pod przewodnictwem
prof. dr hab. n. med. Jolanty Słowikowskiej‑Hilczer.
Spotkanie poprzedziły warsztaty pt. „Kryteria zasadności
interwencji seksuologicznej: między normą a patologią”
prowadzone przez dr n. med. Roberta Kowalczyka
kierownika Zakładu Seksuologii Wydziału Psychologii
i Nauk Humanistycznych Krakowskiej Akademii im.
Andrzeja Frycza Modrzewskiego.
Konferencję rozpoczęło powitanie wygłoszone przez
Przewodniczącą Polskiego Towarzystwa Andrologicznego
prof. Jolantę Słowikowską-Hilczer.
Wręczono statuetkę
i dyplom Członka Honorowego Polskiego Towarzystwa
Andrologicznego prof. Ewie Rajpert-DeMeyts
z Department
of Growth and Reproduction, Copenhagen University Hospital
(Rigshospitalet), Denmark. Wręczono również Nagrodę
Młodych Polskiego Towarzystwa Andrologicznego
im. Prof. Michała Bokińca, którą w tym roku otrzymała
dr Marta Olszewska z Zakładu Biologii Rozrodu
i Komórek Macierzystych Instytutu Genetyki Człowieka
PAN w Poznaniu. Ze względu na to, że Laureatka nie
mogła osobiście uczestniczyć w Konferencji, przedstawiła
pracę za pośrednictwem Skype’a. Dr hab. n. med. Renata
Walczak‑Jędrzejowska
poinformowała o zakończeniu prac
nad Rekomendacjami PTA i Krajowej Izby Diagnostów
Laboratoryjnych (KIDL) pt. „Podstawowe badanie
nasienia wg standardów Światowej Organizacji Zdrowia
z roku 2010”. Prof. Jolanta Słowikowska‑Hilczer
przedstawiła
lekarzy, którzy w 2016 r. uzyskali tytuł androloga
klinicznego Europejskiej Akademii Andrologicznej (EAA,
ang. European Academy of Andrology) oraz poinformowała
o ukazaniu się polskiej wersji rekomendacji Europejskiego
Towarzystwa Urologicznego (EAU, ang. European
Association of Urology) na temat hipogonadyzmu męskiego
i zaburzeń seksualnych u mężczyzn w czasopiśmie
„Postępy Andrologii Online”. Prof. dr hab. n. med. Piotr
Jędrzejczak przedstawił zasady przyznawania Certyfikatu
PTA z andrologii klinicznej. Dr hab. n. med., prof nadzw.
PUM Małgorzata Piasecka omówiła aktualną sytuację
czasopisma „Postępy Andrologii Online”.
Oprócz wykładowców z Polski część naukową
Konferencji uhonorowali swoją obecnością goście zagraniczni
prof. Ewa Rajpert-DeMeyts
z Danii, prof. Gerhard
Van der Horst i prof. Stefan Du Plessiss z RPA,
prof. Aleksander Giwercman ze Szwecji, prof. Frederick
Wu i dr Gulam Bahadur z Wlk. Brytanii. Tematyka
Konferencji obejmowała problemy męskiej niepłodności
oraz zagadnienia urologiczne i endokrynologiczne istotne
w andrologii, a także osiągnięcia w badaniach podstawowych
dotyczących fizjologii i patologii męskiego układu
płciowego. Przedstawiano także wyniki własnych badań
w postaci krótkich prezentacji.
Spotkanie zakończyło się zaproszeniem dr hab.
Małgorzaty Kotuli-Balak
i dr Leszka Bergiera na Konferencję
– 19. Dzień Andrologiczny Polskiego Towarzystwa
Andrologicznego w 2017 r. w Krakowie.
Streszczenia wykładów
Katarzyna Dziendzikowska1, Agata Krawczyńska2,
Michał Oczkowski1, Tomasz Królikowski1,
Andrzej P. Herman2, Joanna Bochenek2, Anna Lankoff 3, 4,
Marcin Kruszewski4, 5, Joanna Gromadzka-Ostrowska1
WPŁYW NANOCZĄSTEK SREBRA NA PARAMETRY
OBRONY ANTYOKSYDACYJNEJ W GONADACH
SAMCÓW SZCZURÓW WISTAR
Szkoła Główna Gospodarstwa Wiejskiego w Warszawie; 2 Instytut
Fizjologii i Żywienia Zwierząt im. Jana Kielanowskiego PAN
w Jabłonnie; 3 Instytut Chemii i Techniki Jądrowej w Warszawie;
4 Zakład Radiobiologii i Immunologii, Uniwersytet Jana
Kochanowskiego w Kielcach; 5 Zakład Biologii Molekularnej i Badań
Translacyjnych, Instytut Medycyny Wsi im. Witolda Chodźki
w Lublinie; katarzyna_dziendzikowska@sggw.pl
Nanocząstki metali, w tym w szczególności nanocząstki
srebra (AgNPs, ang. silver nanoparticles), są jednymi z najpowszechniej
wykorzystywanych nanomateriałów.
Nanocząstki srebra ze względu na silne działanie antybakteryjne
są szeroko stosowane w procesie wytwarzania
produktów higieny osobistej, urządzeń służących do przechowywania
i przetwarzania żywności, czy też w narzędziach
medycznych. Ze względu na coraz większe rozpowszechnienie
AgNPs w codziennym życiu konieczne jest
sprawdzenie efektów ich oddziaływania na organizmy
żywe. Celem badań było określenie wpływu jednorazowego
podania AgNPs na wybrane parametry obrony
antyoksydacyjnej w gonadach samców szczurów Wistar.
Doświadczenie przeprowadzono na 84 dorosłych
samcach szczurów Wistar podzielonych na cztery grupy:
grupę kontrolną oraz 3 grupy eksperymentalne otrzymujące
dożylnie AgNPs o średnicy 20 nm odpowiednio
w dawce 5 mg/kg m.c. (grupa AgI), 10 mg/kg m.c. (grupa
AgII) lub 200 nm AgNPs w dawce 5 mg/kg m.c. (grupa
AgIII). Po 24 godzinach oraz 7 i 28 dniach od iniekcji
zwierzęta usypiano i po skrwawieniu pobierano gonady.
Ekspresję genów enzymów obrony antyoksydacyjnej,
w tym dysmutazy ponadtlenkowej (Sod1, ang. superoxide
dysmutase), peroksydazy glutationowej 1 i 4 (Gpx1,
Gpx4, ang. glutathione peroxidase 1 and 4), katalazy (Cat,
ang. catalase), transferazy S-glutationowej
pi1 (Gstp1, ang.
glutathione S-transferase
pi 1) oraz ekspresję genu oksygenazy
hemowej 1 (Ho1, ang. heme oxygenase 1) z wyizolowanego
materiału oznaczano metodą z wykorzystaniem
łańcuchowej reakcji polimerazy w czasie rzeczywistym
(real-time
PCR, ang. polymerase chain reaction).
U zwierząt narażonych na działanie AgNPs po 28
dniach od ekspozycji, w porównaniu do grupy kontrolnej,
stwierdzono wzrost ekspresji badanych genów, w tym
Ho1 w grupach AgI, AgII i AgIII (p ≤ 0,01), Cat w grupie
AgIII (p ≤ 0,05), Gpx4 w grupie AgI i AgIII (p ≤ 0,01), Gstp1
w grupie AgII i AgIII (p ≤ 0,05) oraz Sod1 w grupie AgI
i AgIII (p ≤ 0,05). Uzyskane wyniki wskazują, że cząstki
srebra mogą zaburzać równowagę oksydacyjną w gonadach,
co z kolei może mieć wpływ na procesy regulujące
funkcje reprodukcyjne samców.
Badania zostały sfinansowane przez Polsko-Norweski
Fundusz
Badań, Nr projektu PNRF-122-AI-1/.
Monika Frączek1, Magdalena Hryhorowicz2, Kamil Gill3,
Marta Zarzycka4, Dariusz Gączarzewicz5, Piotr Jędrzejczak6,
Barbara Bilińska4, Małgorzata Piasecka3, Maciej Kurpisz1
WPŁYW BAKTERIOSPERMII
I LEUKOCYTOSPERMII
NA KONWENCJONALNE
I NIEKONWENCJONALNE PARAMETRY
SEMINOLOGICZNE
1 Instytut Genetyki Człowieka, Polska Akademia Nauk w Poznaniu;
2 Zakład Biochemii i Biotechnologii, Uniwersytet Przyrodniczy
w Poznaniu; 3 Katedra i Zakład Histologii i Biologii Rozwoju, Pomorski
Uniwersytet Medyczny w Szczecinie; 4 Zakład Endokrynologii,
Uniwersytet Jagielloński w Krakowie; 5 Zakład Biotechnologii
i Hodowli Zwierząt, Zachodniopomorski Uniwersytet Technologiczny
w Szczecinie; 6 Klinika Niepłodności i Endokrynologii Rozrodu,
Uniwersytet Medyczny w Poznaniu; monika.fraczek@igcz.poznan.pl
Zakażenia układu moczowo-płciowego
są narastającym
problemem w andrologii klinicznej. Najnowsze doniesienia
potwierdzają znaczne rozpowszechnienie występowania
drobnoustrojów w nasieniu (mimo braku klinicznych
wykładników infekcji) w liczbie patologicznej
przekraczającej 1×104 CFU – colony-forming
unit/mL (Hou
i wsp.: Fertil Steril. 2013, 100, 1261–1269). W ostatnich
latach wzrosła też liczba prac eksperymentalnych
potwierdzających szkodliwy wpływ poszczególnych
szczepów bakteryjnych, zarówno patogennych, jak
i potencjalnie patogennych, na dojrzałe gamety męskie
(Fraczek i Kurpisz: Folia Histochem Cytobiol. 2015, 53,
201–217). Wniknięcie czynnika infekcyjnego zwykle
indukuje odpowiedź immunologiczną i migrację leukocytów
do miejsca stanu zapalnego. Jednakże rola i konsekwencje
kliniczne wysokiej liczby leukocytów w nasieniu,
w obecności czynnika infekcyjnego (leukocytospermia
współwystępująca z bakteriospermią) bądź jego braku
(izolowana leukocytospermia), wciąż pozostają niewyjaśnione.
Celem badań była analiza wpływu bezobjawowej
bakteriospermii i/lub leukocytospermii na konwencjonalne
(standardowa analiza nasienia) i niekonwencjonalne
(struktury subkomórkowe plemników) parametry
nasienia zdrowych mężczyzn w wieku reprodukcyjnym.
Badania wykazały obniżenie standardowych parametrów
nasienia, dotyczących koncentracji plemników,
ich ruchliwości i budowy morfologicznej, zarówno w ejakulatach
z bakteriospermią, jak i leukocytospermią.
Ponadto, analiza parametrów subkomórkowych ujawniła,
że główny mechanizm toksycznego działania bakterii
na gamety męskie związany jest z indukcją procesu apoptozy.
Świadczą o tym liczne nieprawidłowości w plemnikach,
obejmujące jednocześnie wzrost błonowej translokacji
fosfatydyloseryny i fragmentacji DNA oraz spadek
potencjału mitochondrialnego w plemnikach żywych,
u mężczyzn z bakteriospermią. Badania wykazały
również negatywny wpływ leukocytospermii na inne
niekonwencjonalne parametry plemników, zwłaszcza
procesy peroksydacyjne błon komórkowych i aktywność
oksydoredukcyjną mitochondriów, co mogło być związane
ze stresem oksydacyjnym w nasieniu.
Przedstawione wyniki badań wskazują na możliwość
bezpośredniego oddziaływania mediatorów zapalnych
w nasieniu na parametry subkomórkowe gamety męskiej,
ważne dla jej funkcji biologicznej. Wartość tych badań
może być istotna dla opracowania nowych algorytmów
diagnostyczno-terapeutycznych
infekcji bakteryjnych
w układzie moczowo-płciowym
mężczyzn.
Piotr Jędrzejczak
ANTYKONCEPCJA MĘSKA – AKTUALNE PROBLEMY
Klinika Niepłodności i Endokrynologii Rozrodu, Uniwersytet
Medyczny w Poznaniu; piotrjedrzejczak@gmail.com
Wraz z dynamicznym wzrostem populacji światowej
oraz liczby niepożądanych ciąż istnieje pilna potrzeba
wprowadzenia skutecznych środków antykoncepcji dla
mężczyzn. Prowadzone dotychczas badania nad zastosowaniem
środków hormonalnych, głównie opartych
o testosteron wraz z gestagenami, dają podstawę opracowania
skutecznego, w pełni odwracalnego i akceptowalnego
leku antykoncepcyjnego. Działanie tych dwóch
składników opiera się na hamowaniu wydzielania obu
gonadotropin, zapewniając skuteczne hamowanie spermatogenezy,
jednocześnie systemowa aktywność androgenna
jest zapewniane przez składnik testosteronowy
badanych preparatów. Na przeszkodzie zastosowania
środków antykoncepcyjnych dla mężczyzn stoi jednak
zmniejszone zainteresowanie koncernów farmakologicznych
wspieraniem powyższych badań.
W chwili obecnej czynione są intensywne próby zastosowania
substancji farmakologicznych blokujących etapy
spermatogenezy, aktywności plemników lub ich zdolności
do połączenia się z komórką jajową. Wśród tych badań
na uwagę zasługuje zastosowanie JQ1 (tieno-triazolo-1,4-diazepina)
hamującego dojrzewanie plemników na etapie
spermatocytów/spermatyd. Potencjalne szanse na użycie
u mężczyzn w celu zahamowania tworzenia gamet ma
antagonista (BMS-189453)
receptora kwasu retinowego
(RAR, ang. retinoic acid receptor). Z kolei adjudyna ma
szanse zastosowania z uwagi na jej efekt hamujący dojrzewanie
gamet w jądrze. Warto także wspomnieć o badaniach
nad znalezieniem inhibitorów podjednostek CatSper
(specyficzny dla plemników kanał Ca2+) zapewniających
hamowanie kapacytacji plemników. Wyzwania, jakie
stoją przed wprowadzeniem niehormonalnych środków
antykoncepcyjnych u mężczyzn, to przede wszystkim
dopracowanie odpowiedniej aplikacji leku oraz zapewnienie
bezpieczeństwa stosowania preparatów. Niemniej
jednak gotowość do zastosowania antykoncepcji przez
mężczyzn oceniana w różnych krajach świata jest wysoka,
stąd też jest głęboki sens kontynuowanie tych badań.
Grzegorz Jakiel
ROLA ANDROLOGA W KLINICE LECZENIA
NIEPŁODNOŚCI
I Klinika Położnictwa i Ginekologii CMKP, Samodzielny Publiczny
Szpital Kliniczny im. prof. W. Orłowskiego, Warszawa; grzegorz.
jakiel1@o2.pl
Andrologia zgodnie z definicją przyjętą przez Polskie
Towarzystwo Andrologiczne (PTA, ang. Polish Society of
Andrology) jest dziedziną nauk medycznych, która zajmuje
się fizjologią i zaburzeniami męskiego układu płciowego
w aspekcie nauk podstawowych, diagnostyki i terapii.
Określenie androlog oznacza osobę prowadzącą badania
lub po prostu posiadającą wiedzę w zakresie andrologii.
Praca w klinice leczenia niepłodności wymaga uprawnień
zawodowych w dziedzinie leczenia lub diagnostyki
laboratoryjnej. Osoby mające te uprawnienia wykonują
jeden z dwóch koncesjonowanych zawodów – lekarza
lub diagnosty laboratoryjnego. Niezależnie od posiadanej
wiedzy lub uprawnień nadanych przez towarzystwa
krajowe lub zagraniczne, np. PTA czy Europejską
Akademię Andrologii (EAA, ang. European Academy of
Andrology) – warunek przynależności zawodowej w rozumieniu
polskich przepisów jest niezbędny.
Diagnosta laboratoryjny zatrudniony w specjalistycznym
centrum leczenia niepłodności powinien wykonywać
badanie nasienia w sposób zgodny z instrukcją
Światowej Organizacji Zdrowia (WHO, ang. Word Health
Organization) z 2010 r. oraz dodatkowe testy specjalistyczne,
takie jak ocena fragmentacji DNA plemników,
ocena zdolności wiązania hialuronianów, ocena obecności
autoprzeciwciał w ejakulacie. Praca w klinice leczenia
niepłodności wymaga zwykle znajomości różnorodnych
technik selekcji plemników, które wykonuje się w trakcie
zaawansowanych technik zapłodnienia in vitro: np. precyzyjna
selekcja plemnika uwzgledniająca kryteria morfologiczne
– technika IMSI (docytoplazmatyczna iniekcja
plemnika wybranego pod względem morfologicznym,
ang. intracytoplasmic morphologically selected sperm injection)
lub selekcja męskich komórek rozrodczych z wykorzystaniem
aneksyny lub kwasu hialuronowego (HBA,
ang. hyaluronan binding assay). Rola diagnosty laboratoryjnego
jest komplementarna, ale nie jest wymienna
w stosunku do lekarza androloga, a szczegółowe umiejętności
z zakresu diagnostyki laboratoryjnej nie są lekarzowi
niezbędne w codziennej pracy.
Lekarz androlog jest członkiem zespołu terapeutycznego
kliniki i w chwili obecnej zwykle posiada kwalifikacje
opisane w programie specjalizacji w zakresie endokrynologii
ginekologicznej i rozrodczości. Kwalifikacje
te powinny zostać poszerzone o specjalistyczną wiedzę
andrologiczną.
Czynnik męski według współczesnej wiedzy odpowiada
za połowę przypadków niepłodności. Do zadań
lekarza androloga pracującego w zespole kliniki leczenia
niepłodności należy ocena płodności mężczyzny
w oparciu o dostępne techniki diagnostyczne oraz zaplanowanie leczenia. Pierwszym krokiem jest ocena
możliwości leczenia przyczynowego. Obok czynników
andrologicznych wymagana jest tutaj ocena potencjału
płodnościowego partnerki. W przypadku braku takiej
możliwości lub niepowodzenia leczenia przyczynowego
lekarz androlog powinien zaproponować metodę wspomagania
rozrodu dostosowaną do potrzeb leczonej pary.
W proponowanym planie leczenia powinien zostać bezwzględnie
uwzględniony potencjał płodnościowy partnerki
oraz odpowiedź na następujące pytania:
1. Czy konieczne jest zapłodnienie in vitro lub być
może metoda inseminacji domacicznej daje wystarczającą
szansę sukcesu?
2. Czy konieczna jest mikromanipulacja (metoda
wprowadzona przez Palermo do leczenia czynnika
męskiego)?
3. Czy konieczna jest selekcja plemników?
4. Czy możliwe jest użycie plemników ejakulowanych
(czy konieczne jest pobranie gamet z jądra lub najądrza)?
5. Czy należy pacjenta przygotować farmakologicznie
przed ewentualną punkcją?
6. Czy kondycja pacjenta stanowi wskazanie
do przedimplantacyjnej diagnostyki genetycznej (PGD,
ang. preimplantation genetic diagnosis)?
Udział androloga pozwala na indywidualizację postępowania
i w konsekwencji poprawę efektywności leczenia.
Wydaje się, że optymalne jest łączenia wiedzy andrologicznej
z ginekologiczną, stąd idea specjalizacji w zakresie
endokrynologii ginekologicznej i andrologii jest niewątpliwie
warta rozważenia. Sekcja Andrologii Polskiego
Towarzystwa Ginekologicznego będzie współdziałała
z PTA na rzecz szerokiego wprowadzania przedstawionego
powyżej modelu w życie.
Joanna Jurewicz1, Michał Radwan2, Danuta Ligocka3,
Wojciech Hanke1
WPŁYW EKSPOZYCJI NA FTALANY
NA PŁODNOŚĆ MĘŻCZYZN
1Zakład Epidemiologii Środowiskowej, Instytut Medycyny Pracy
w Łodzi; 2Klinika Leczenia Niepłodności, Szpital “Gameta”, Rzgów;
3Biuro Zapewnienia Jakości, Instytut Medycyny Pracy w Łodzi;
joannaj@imp.lodz.pl
Na początku XXI w. niepłodność dotyczyła 15–20%
par w krajach rozwiniętych w porównaniu do 7–8%
w latach 60. XX w. Czynnik męski miał udział w ponad
połowie przyczyn niepłodności. Przeprowadzona przez
Carlsen i wsp. (Carlsen i wsp.: BMJ. 1992, 305, 609–613)
analiza 61 badań prowadzonych w latach 1938–1991
dowiodła, że jakość i liczba plemników ulegały przez
kolejne lata zmniejszeniu. Na podstawie wyżej opisanych
analiz sformułowano hipotezy, że obserwowane obniżenie
płodności mężczyzn może być związane z czynnikami
środowiskowymi powszechnie występującymi
w życiu człowieka, m.in. takimi jak: ftalany, parabeny
czy bisfenol A. Celem badania była ocena wpływu narażenia
na ftalany na jakość nasienia.
Do badania kwalifikowani byli mężczyźni, którzy zgłosili
się do poradni leczenia niepłodności w celach diagnostycznych
z prawidłową liczbą plemników (>15 mln/mL)
(WHO z 2010 r., ang. World Health Organization). Wśród
badanych został przeprowadzony wywiad, który obejmował
dane dotyczące cech społeczno-demograficznych,
stylu życia i pracy zawodowej. Kwestionariusz zawierał
również szczegółowe pytania na temat zdrowia pacjenta,
które mogą mieć potencjalny wpływ na jakość nasienia
oraz przebyte choroby. W próbkach moczu badanych
mężczyzn oznaczane były pierwszo i/lub drugorzędowe
metabolity ftalanów, których stężenie w moczu odzwierciedlało
narażenie na następujące ftalany: dietylu (DEP),
monoetylu (MEP), ftalanu di(2-etylo-
heksylu (DEHP),
5-OH-mono(
2-etyloheksylu)
(5-OH-MEHP),
mono(2-etyloheksylu)
(MEHP), diizobutylu (DBP), monobutylu
(MBP), benzylobutylu (BBzP), monobenzylu (MBzP), diizononylu
(DINP) oraz monoizononylu (MINP). Analiza
została wykonana metodą chromatografii cieczowej z tandemową
spektrometrią mas (LC–MS/MS, ang. tandem
mass spectrometry).
W prezentowanym badaniu wykazano negatywny
wpływ metabolitów ftalanów w moczu na ruchliwość
plemników (5-OH-MEHP,
MEHP, MINP), parametry
ruchu weryfikowane komputerową analizą (CASA, ang.
computer aided sperm analysis) (MBP), stężenie testosteronu
(MEHP). Ekspozycja na ftalany wpływała również
na wzrost nieprawidłowości w morfologii plemników, np.
nieprawidłowości wstawki (5OH MEHP, MBzP), odsetek
plemników z uszkodzeniami DNA (MBP, MEHP) oraz
aneuploidii w plemnikach (MBP, MEP, MBzP). Ekspozycja
na ftalany może wpływać na płodność mężczyzn. Jednak
konieczne jest potwierdzenie tej zależności w większych
badaniach kohortowych.
WPŁYW EKSPOZYCJI NA FTALANY NA PŁODNOŚĆ MĘŻCZYZN
Joanna Jurewicz1, Michał Radwan2, Danuta Ligocka3,
Wojciech Hanke1
1Zakład Epidemiologii Środowiskowej, Instytut Medycyny Pracy
w Łodzi; 2Klinika Leczenia Niepłodności, Szpital “Gameta”, Rzgów;
3Biuro Zapewnienia Jakości, Instytut Medycyny Pracy w Łodzi;
joannaj@imp.lodz.pl
Na początku XXI w. niepłodność dotyczyła 15–20%
par w krajach rozwiniętych w porównaniu do 7–8%
w latach 60. XX w. Czynnik męski miał udział w ponad
połowie przyczyn niepłodności. Przeprowadzona przez
Carlsen i wsp. (Carlsen i wsp.: BMJ. 1992, 305, 609–613)
analiza 61 badań prowadzonych w latach 1938–1991
dowiodła, że jakość i liczba plemników ulegały przez
kolejne lata zmniejszeniu. Na podstawie wyżej opisanych
analiz sformułowano hipotezy, że obserwowane obniżenie
płodności mężczyzn może być związane z czynnikami
środowiskowymi powszechnie występującymi
w życiu człowieka, m.in. takimi jak: ftalany, parabeny
czy bisfenol A. Celem badania była ocena wpływu narażenia
na ftalany na jakość nasienia.
Do badania kwalifikowani byli mężczyźni, którzy zgłosili
się do poradni leczenia niepłodności w celach diagnostycznych
z prawidłową liczbą plemników (>15 mln/mL)
(WHO z 2010 r., ang. World Health Organization). Wśród
badanych został przeprowadzony wywiad, który obejmował
dane dotyczące cech społeczno-demograficznych,
stylu życia i pracy zawodowej. Kwestionariusz zawierał
również szczegółowe pytania na temat zdrowia pacjenta,
które mogą mieć potencjalny wpływ na jakość nasienia
oraz przebyte choroby. W próbkach moczu badanych
mężczyzn oznaczane były pierwszo i/lub drugorzędowe
metabolity ftalanów, których stężenie w moczu odzwierciedlało
narażenie na następujące ftalany: dietylu (DEP),
monoetylu (MEP), ftalanu di(2-etylo-
heksylu (DEHP),
5-OH-mono(
2-etyloheksylu)
(5-OH-MEHP),
mono(2-etyloheksylu)
(MEHP), diizobutylu (DBP), monobutylu
(MBP), benzylobutylu (BBzP), monobenzylu (MBzP), diizononylu
(DINP) oraz monoizononylu (MINP). Analiza
została wykonana metodą chromatografii cieczowej z tandemową
spektrometrią mas (LC–MS/MS, ang. tandem
mass spectrometry).
W prezentowanym badaniu wykazano negatywny
wpływ metabolitów ftalanów w moczu na ruchliwość
plemników (5-OH-MEHP,
MEHP, MINP), parametry
ruchu weryfikowane komputerową analizą (CASA, ang.
computer aided sperm analysis) (MBP), stężenie testosteronu
(MEHP). Ekspozycja na ftalany wpływała również
na wzrost nieprawidłowości w morfologii plemników, np.
nieprawidłowości wstawki (5OH MEHP, MBzP), odsetek
plemników z uszkodzeniami DNA (MBP, MEHP) oraz
aneuploidii w plemnikach (MBP, MEP, MBzP). Ekspozycja
na ftalany może wpływać na płodność mężczyzn. Jednak
konieczne jest potwierdzenie tej zależności w większych
badaniach kohortowych.
Dariusz Kałka
MEDYCZNY POZYTYWIZM CZYLI SEKS
I SERCE W ŻYCIU MĘŻCZYZNY
Pracownia Kardioseksuologii, Katedra Patofizjologii, Uniwersytet
Medyczny we Wrocławiu; dariusz.kalka@gmail.com
Zgodnie z definicją mianem zaburzeń erekcji (ED, ang.
erectile dysfunction) określa się trwałą niezdolność
do osiągnięcia i/lub utrzymania erekcji wystarczającej
do prowadzenia satysfakcjonującej aktywności płciowej
(objawy muszą utrzymywać się przez minimum 3 miesiące,
chyba że ED jest powiązane z urazem lub zabiegiem
chirurgicznym). Szacuje się, że w Polsce problem
ten dotyczy 3 mln mężczyzn, a w populacji z chorobami
układu sercowo-naczyniowego
dotyka blisko 80%
pacjentów. Istnieją bezpośrednie związki pomiędzy ED
a chorobami sercowo-naczyniowymi
(CVD, ang. cardio-vascular
disease). Ponadto, ED wynikające z dysfunkcji
śródbłonka naczyniowego oraz miażdżycy tętnic prącia
mogą być pierwszym i jedynym objawem CVD z jej
ostrymi powikłaniami. Stan ten determinowany jest
przez średnicę naczyń krwionośnych, ponieważ tętnice
prącia są mniejsze i wcześniej dochodzi w nich do upośledzenia
przepływu krwi niż w większych naczyniach wieńcowych
(Montorsi i wsp.: Eur. Eurol. 2003; 44, 360–364).
Ponadto, zarówno ED, jak i CVD charakteryzują się wspólnymi
modyfikowalnymi czynnikami ryzyka, takimi jak:
nadciśnienie tętnicze, otyłość, cukrzyca, hiperlipidemia,
palenie tytoniu i siedzący tryb życia.
Aktywność seksualna, w szczególności u pacjentów
z CVD, postrzegana jest często jako zachowanie mogące
doprowadzić do powikłań groźnych dla życia. Przeczą
temu badania, które wykazują, że u większości chorych
po zawale serca aktywność seksualna niesie znikome
ryzyko powikłań i może być prowadzona praktycznie
bez żadnych ograniczeń. Wydatek energetyczny podczas
tego typu aktywności należy do grupy wydatków co najwyżej
średnich, które jedynie w stopniu umiarkowanym
mobilizują układ sercowo-naczyniowy
do pracy, dzięki
czemu ryzyko zgonu w jej trakcie jest względnie niskie
(Levine i wsp.: Circulation 2012; 125(8), 1058–1072).
Zgodnie z rekomendacjami Europejskiego Towarzystwa
Urologicznego z 2015 r. inhibitory fosfodiesterazy
typu 5 (PDE5, ang. phosphodiesterase type 5), obok
urządzeń podciśnieniowych i rokującego duże nadzieje,
leczenia zogniskowaną falą uderzeniową o niskiej energii
i niskiej częstotliwości (LESWT, ang. low energy shock‑wave
therapy), stanowią terapię pierwszego rzutu ED.
Terapia drugiego rzutu ED polega na bezpośrednim
podaniu leków rozkurczających naczynia do ciał jamistych,
a terapia trzeciego rzutu na implantacji protezy
prącia (Hatzimouratidis i wsp. 2015, http://uroweb.org/
guideline/male-sexual-dysfunction/).
Dominika Kochman1, Katarzyna Marchlewska1,
Renata Walczak-Jędrzejowska1,
Jolanta Słowikowska-Hilczer1,
Krzysztof Kula1, Stefan du Plessis2,
Renette Blignaut3, Gerhard van der Horst4
PORÓWNANIE OCENY MORFOLOGII
PLEMNIKÓW METODĄ MANUALNĄ
I WSPOMAGANĄ KOMPUTEROWO
1Katedra Andrologii i Endokrynologii Płodności, Uniwerystet
Medyczny w Łodzi; 2Division of Medical Physiology, Stellenbosch
University; 3Department of Statistics and Population Studies;
4Department of Medical Bioscience, University of the Western
Cape, Republika Południowej Afryki; kochmandominika@gmail.com
Ocenę morfologii plemników można wykonać za pomocą
dwóch metod: manualnej oraz wspomaganej komputerowo
(CASMA, ang. computer aided sperm morphology
analysis). Oprócz odsetka plemników nieprawidłowych
w nasieniu można wyliczyć wskaźniki wielokrotnych
defektów plemnika. Należą do nich: 1) wskaźnik teratozoospermii
(TZI, ang. teratozoospermia index), który
określa współistnienie defektów główki, wstawki, witki
oraz obecności nadmiaru resztkowej cytoplazmy w nieprawidłowym
plemniku (uśredniona liczba defektów);
2) wskaźnik deformacji plemnika (SDI, ang. sperm deformity
index), który określa średnią liczbę defektów strukturalnych
plemnika przypadającą na plemnik niezależnie
od jego budowy morfologicznej (nieprawidłowy i prawidłowy),
oraz 3) wskaźnik anomalii wielokrotnych (MAI,
ang. multiple anomalies index), czyli średnia liczba defektów
główki, wstawki i witki plemnika przypadająca na nieprawidłowy
plemnik. Celem pracy była analiza zgodności
dwóch metod oceny morfologii plemników, manualnej
i CASMA, oraz ocena wskaźników wielokrotnych defektów
plemnika jako czynników predykcyjnych jakości nasienia.
W badaniu oceniono nasienie 76 pacjentów wg WHO
(ang. World Health Organization) z 2010 r. Preparaty
do oceny morfologii plemników wybarwione metodą
Papanicolaou oceniane były manualnie oraz za pomocą
CASMA (w każdym przypadku 300 plemników).
Dodatkowo w 51 przypadkach przeprowadzono szczegółową
analizę wskaźników wielokrotnych defektów
plemnika. Wyliczane wskaźniki korelowano z innymi
parametrami nasienia (odsetek plemników z prawidłową
morfologią, żywych, z ruchem postępowym i całkowitym).
Analizy Blanda i Altmana, a także regresji Passinga
i Babloka wykazały statystyczną zgodność wyników oceny
morfologii plemników uzyskanych metodą manualną
i CASMA (p = 0,48). Wykazano wysoce istotne ujemne
korelacje (rs, współczynnik korelacji rang Spearmana)
między analizowanymi wskaźnikami a odsetkiem plemników
o prawidłowej morfologii (p < 0,0005, rs = −0,47 dla
TZI; p < 0,0000, rs = −0,76 dla SDI; p < 0,0001, rs = −0,53
dla MAI) przy zastosowaniu CASA, jak i metody manualnej
(p < 0,008, rs = −0,37 dla TZI; p < 0,0001, rs = −0,52
dla SDI; p < 0,0002, rs = −0,50 dla MAI). Podobnie istotne
ujemne korelacje uzyskano między wskaźnikami a odsetkami
ruchliwych plemników.
Rodzaj stosowanej metody oceny (manualna lub
CASMA) nie ma wpływu na wynik badania morfologii
plemników. Odwrotnie proporcjonalna zależność
występuje pomiędzy wartościami analizowanych wskaźników
wielokrotnych defektów plemnika a odsetkami
plemników z prawidłową morfologią i ruchliwością.
Wyliczanie tych wskaźników podczas podstawowego
badania nasienia wydaje się zasadne.
KOMÓRKI LEYDIGA W ŚWIETLE NAJNOWSZYCH BADAŃ
Małgorzata Kotula-Balak,
Laura Pardyak,
Alicja Kamińska, Anna Hejmej, Barbara Bilińska
Zakład Endokrynologii, Instytut Zoologii, Uniwersytet Jagielloński
w Krakowie; malgorzata.kotula-balak@uj.edu.pl
W gonadach ssaków rozwijają się dwie populacje komórek
Leydiga: populacja płodowa oraz populacja dorosła, która funkcjonuje przez całe życie samca. Co ciekawe, u knura
opisano dodatkową populację komórek Leydiga tzw. perinatalną
(Geiger i wsp.: Reprod Domest Anim. 1999, 17,
65–67). U tego gatunku liczba komórek Leydiga oraz
poziom produkowanych przez nie estrogenów są znacząco
wyższe niż u innych ssaków. Poszczególne
populacje komórek różnią się pod względem morfologicznym,
biochemicznym, a także pełnią odrębne
funkcje. Estrogeny produkowane w komórkach Leydiga
oddziałują na tkanki poprzez jądrowe receptory estrogenowe
(ER; ang. estrogen receptors). Badania z ostatnich
lat wskazują na zaangażowanie położonego na błonie
komórkowej receptora estrogenowego związanego z białkiem
G (GPER, ang. G protein‑
coupled estrogen receptor)
w przekaz sygnału przez estrogeny. Natomiast nierozwiązany
pozostaje problem udziału receptorów pokrewnych
do receptorów estrogenowych (ERR, ang. estrogen‑related
receptors) w kontroli działania męskiego układu
rozrodczego i poszczególnych komórek gonady. Rola
estrogenów w funkcjonowaniu komórek Leydiga także
nie jest w pełni poznana. Badania wskazują, iż hormony
te regulują takie procesy komórkowe, jak: różnicowanie,
proliferacja, apotoza czy transformacja nowotworowa.
Rozwój Leydigiomy może zostać zahamowany przez
podanie steroidów, które hamują proliferację i obniżają
aktywność aromatazy w tych komórkach (Panza
i wsp.: Am J Pathol. 2016, 186, 1328–1339). W ostatnich
latach podejmowane są próby wyjaśnienia podstawowych
mechanizmów działania środowiskowych estrogenów
(ksenoestrogenów) i ich udziału w endogennej sygnalizacji
estrogenowej. W komórce Leydiga ksenoestrogeny
mogą modyfikować aktywność receptorów wiążących
estrogeny na drodze genowej i niegenowej przez modulację
działania różnych czynników transkrypcyjnych oraz
białek kluczowych w syntezie steroidów. Możliwe jest też
oddziaływanie związków estrogennych z receptorami dla
innych ligandów, np. receptorem węglowodorów aromatycznych
(AHR, ang. aryl hydrocarbon receptor) (Zarzycka
i wsp.: Theriogenology. 2016, 86, 674–686). W wyniku
wymienionych oddziaływań dochodzi do zakłócenia
równowagi hormonalnej wymaganej do prawidłowego
funkcjonowania układu rozrodczego.
Badania finansowane z projektu SONATA BIS5 2015/18/E/
NZ4/00519 z Narodowego Centrum Nauki
Michał Kunicki
PRZEBIEG ZAPŁODNIENIA
POZAUSTROJOWEGO U PAR
Z CZYNNIKIEM MĘSKIM
Klinika Leczenia Niepłodności INVICTA, Warszawa; mkunicki@op.pl
Klinika Leczenia Niepłodności INVICTA, Warszawa; mkunicki@op.pl
Zgodnie z definicją Światowej Organizacji Zdrowia
(WHO, World Health Organization) niepłodność definiowana
jest jako brak ciąży po okresie roku współżycia bez
stosowania jakiejkolwiek metody antykoncepcji. Dane
epidemiologiczne szacują, że może dotyczyć ok. 15% par.
Wśród przyczyn niepłodności znaczącą role przypisuje
się czynnikowi męskiemu. Według niektórych źródeł
może on stanowić 25–50% przyczyn. Najważniejsze
4 grupy niepłodności męskiej można określić jako: pierwotne
(jądrowe), wtórne (przedjądrowe), obstrukcyjne
(pozajądrowe) i idiopatyczne. Niepłodność męska ma
często złożoną etiologię, a blisko połowa przyczyn pozostaje
nierozpoznana mimo wykonania badań hormonalnych,
immunologicznych, obrazowych oraz przeprowadzenia
badania andrologicznego. Jakość nasienia nadal
jest podstawową metodą służącą do oceny męskiej płodności
i jednym z czynników pozwalających przewidywać
szansę na zajście w ciążę. Obecnie w ocenie nasienia
stosuje się kryteria WHO z 2010 r. Nieprawidłowe wyniki
seminogramu są klasyfikowane jako oligozoospermia (O),
astenozoospermia (A), teratozoospermia (T), kombinacja
tych nieprawidłowości oraz brak plemników w ejakulacie
– azoospermia. W przypadku obecności czynnika
męskiego zastosowanie opisanej w 1992 r. docytoplazmatycznej
iniekcji plemnika do komórki jajowej (ICSI,
ang. intracytoplasmatic sperm injection) ma przewagę nad
zastosowaniem konwencjonalnej/klasycznej procedury
zapłodnienia pozaustrojowego (IVF, ang. in vitro fertilization).
Zastosowanie tej metody w przypadkach azoospermii,
kryptozoospermii czy teratozoospermi pozwoliło
na uzyskanie maksymalnych szans na zapłodnienie.
Przyjmuje się, że ICSI jest wskazane, jeśli całkowita liczba
ruchliwych plemników wynosi <1 mln/mL. ICSI jest
wykonywane również wtedy, gdy plemniki uzyskiwane
są z jąder/najądrzy w przypadku braku ich w ejakulacie
(azoospermia). Należy jednak podkreślić, że wyniki
porównujące klasyczne IVF z ICSI w przypadku obecności
izolowanej teratozoospermi (wg ścisłych kryteriów
Krugera <4% form prawidłowych plemników)
są sprzeczne. W ostatnim okresie uważa się, że lepszym
czynnikiem predykcyjnym w uzyskaniu ciąży klinicznej
niż ocena parametrów zgodnie z klasyfikacją WHO jest
całkowita liczba ruchliwych plemników (TMSC, ang.
total motile sperm count). Parametr ten ma również być
korzystniejszy w przypadku stosowania procedury ICSI.
Maria Laszczyńska, Aleksandra Rył, Katarzyna
Kaczmarczyk
CZY NARZĄDY UKŁADU PŁCIOWEGO
MĘŻCZYZN I KOBIET STARZEJĄ SIĘ
PODOBNIE?
Katedra i Zakład Histologii i Biologii Rozwoju, Pomorski Uniwersytet
Medyczny w Szczecinie; maria@laszczynska.pl
Narządy układu płciowego żeńskiego, w warunkach fizjologicznych,
starzeją się inaczej aniżeli narządy układu
płciowego męskiego. U kobiet fizjologiczna menopauza,
wyznaczona hormonalnie, jest granicą, po której
obserwuje się postępujące w czasie zmiany zachodzące
w jajnikach, jajowodach i w macicy. W jajnikach kobiet
po menopauzie zmienia się morfologia i funkcja. Nie
mogą one już pełnić swojej funkcji rozrodczej i w pełni
hormonalnej. Obserwuje się w nich brak pęcherzyków
jajnikowych oraz brak podziału na korę i rdzeń. W jajnikach
występują ciała białawe, jak również pojawiają
się nabłonkowe cysty inkluzyjne. W jajowodach kobiet
po menopauzie obserwowane zmiany morfologiczne
dotyczą głównie komórek nabłonka, które są niższe,
mniej urzęsione i atroficzne. Zmiany te mogą wskazywać
na występowanie w jajowodach zmian wstecznych
i stopniową utratę funkcji narządu. Z kolei w macicy
kobiet po menopauzie zachodzą zmiany morfologiczne
w postaci zaników w endometrium i miometrium. Jednak
indeks proliferacyjny komórek ściany trzonu macicy
(Ki‑67)
pozostaje niezmienny, co pozwala wnioskować,
że endometrium w procesie starzenia się kobiety jest
nadal tkanką gotową do pełnienia swojej roli w procesie
rozrodu, np. po stymulacji hormonalnej. U mężczyzn
termin andropauza został wprowadzony na zasadzie analogii
do menopauzy występującej u kobiet. Termin ten
jest jednak w świecie naukowym krytykowany i odrzucany.
U mężczyzn, w warunkach fizjologicznych, starzenie
się jądra, najądrza i prostaty przebiega stopniowo.
Mężczyzna może zachować płodność do późnej starości,
chociaż z wiekiem dochodzi do upośledzenia czynności
hormonalnej jąder i do zaburzenia spermatogenezy oraz
płodności. W jądrach starzejących się mężczyzn dochodzi
do zmian morfologicznych w komórkach nabłonka plemnikotwórczego
i w komórkach Leydiga. W najądrzu
również obserwuje się zmiany w nabłonku. W prostacie
mężczyzn po 45. r.ż. może dochodzić do łagodnego rozrostu
prostaty, wzrasta również ryzyko zachorowania
na raka tego narządu. Nie można również zapomnieć,
że na fizjologiczne starzenie się narządów układu płciowego
męskiego i żeńskiego mogą mieć wpływ choroby
wynikające z genetycznych predyspozycji, określonego
stylu życia oraz oddziaływania czynników środowiskowych
w minionych fazach życia.
Mariola Marchlewicz1, Ewa Duchnik2, Magdalena Boer2,
Małgorzata Piasecka3
ZRÓŻNICOWANE DZIAŁANIE ANDROGENÓW
NA WŁOSY MĘŻCZYZN
1 Zakład Dermatologii Estetycznej, 2 Katedra i Klinika Chorób
Skórnych i Wenerycznych, 3 Katedra i Zakład Histologii i Biologii
Rozwoju, Pomorski Uniwersytet Medyczny w Szczecinie; mariola.
marchlewicz@pum.edu.pl
Utrata włosów i ich siwienie są wiązane z zaawansowanym
wiekiem i bywają źródłem obniżenia jakości życia
mężczyzn. Mieszki włosowe stanowią unikalną strukturę
podlegającą ciągłemu procesowi wzrostu, inwolucji
i spoczynku (Rossi i wsp.: Dermatol Ther. 2016, online;
Mirmirani i wsp.: Mauritas. 2015, 80, 58–62). Procesy
wzrostu włosów i ich wymiany podlegają regulacji przez
wiele hormonów, w tym androgeny (A, ang. androgen),
przy czym efekty ich działania różnią się w zależności
od okolicy ciała (Inoue i wsp.: Mol Cell Endocrinol. 2012,
362, 19–28, Inui i wsp.: Exp Dermatol. 2013, 22, 168–
171). U mężczyzn A, obecne w wysokich stężeniach, stymulują
wzrost włosów na twarzy, w okolicy nadłonowej
i na klatce piersiowej. Natomiast w obrębie skóry głowy
mogą wywoływać łysienie. Niższe stężenia A, u obu płci,
pobudzają mieszki włosowe okolicy pachowej i dolnej
okolicy łonowej (Elsner i wsp.: Br J Dermatol. 2012, 166,
2–5). Badania ostatnich lat wskazują, że mieszki włosowe
różnych regionów ciała człowieka reagują na A, dzięki
ekspresji receptorów androgenowych (AR, ang. androgen
receptor) w komórkach brodawki włosa (DPC, ang. dermal
papilla cells) (Yip i wsp.: Australas J Dermatol. 2011, 52,
81–88). Ekspresja AR oraz aktywność 5α‑reduktazy
typu II jest znacznie wyższa w komórkach brodawki
włosów brody oraz okolic podlegających łysieniu androgenowemu
(Slominski i wsp.: J Steroid Biochem Mol Biol.
2013, 137, 107–123, Westagate i wsp.: Intern J Cosmet Sci.
2013, 35, 329–336). Łysienie androgenowe (AGA, ang.
androgenic alopecia) występuje u większości mężczyzn rasy
kaukaskiej po 40. r.ż. Istotą schorzenia jest miniaturyzacja
mieszków włosowych pod wpływem A, u osób predysponowanych
genetycznie. W AGA dochodzi, w obrębie
mieszka włosowego, do zmiany interakcji między DPC
a keratynocytami (Lai i wsp.: Arch Dermatol Res. 2012,
304, 499–510). Wysokie poziomy A indukują utratę właściwości
proliferacyjnych i apoptozę DPC, zwiększoną
ekspresję markerów stresu oksydacyjnego, np. białko
szoku termicznego-27
(HSP-27,
ang. heat shock protein-27),
dysmutazę ponadtlenkową, katalazę (Bathta i wsp.:
J Invest Dermatol. 2008, 128, 1088–1094). Następuje
skrócenie fazy anagenu i przekształcenie mieszków
włosów ostatecznych do mieszków włosów pierwotnych
(meszkowych) i tworzenia włosów krótszych, cieńszych
i odbarwionych (Bathta i wsp.: J Invest Dermatol. 2008,
128, 1088–1094).
Urszula Marzec-Wróblewska1,
Paweł Łakota2, Grzegorz
Ludwikowski3, Adam Buciński1
AFLATOKSYNY W NASIENIU POLSKICH
MĘŻCZYZN
1 Katedra i Zakład Biofarmacji, Uniwersytet Mikołaja Kopernika
w Toruniu, Collegium Medicum w Bydgoszczy; 2 Katedra Biochemii
i Biotechnologii Zwierząt, Pracownia Inżynierii Komórki, Uniwersytet
Technologiczno-Przyrodniczy
w Bydgoszczy; 3 Zakład Medycyny
Rozrodu i Andrologii, Uniwersytet Mikołaja Kopernika w Toruniu,
Collegium Medicum w Bydgoszczy; u.marzec@cm.umk.pl
W przeprowadzonym badaniu określono zawartość aflatoksyn
w nasieniu polskich mężczyzn. Z pięciu przebadanych
aflatoksyn (AF) obecność co najmniej jednej z nich
stwierdzono w 58 z 60 prób nasienia: AFB1 – w 80%,
AFB2 – w 10%, AFG1 – w 72%, AFG2 i AFM1 – w blisko
40% prób. Koncentracja wszystkich przebadanych aflatoksyn
w nasieniu mężczyzn zdrowych była niższa
niż w próbach nasienia pochodzących od mężczyzn
ze stwierdzoną obniżoną jakością nasienia, choć statystyczne
istotnie różnice stwierdzono tylko dla aflatoksyn
G1 i G2. W ramach badania stwierdzono również
wyższy poziom aflatoksyn w nasieniu mężczyzn spożywających
kawę, palących wyroby tytoniowe i mieszkających
na terenach wiejskich. Zgodnie z naszą wiedzą
jest to pierwsze badanie określające poziom aflatoksyn
w nasieniu europejskich mężczyzn. Na jego podstawie
można stwierdzić, że aflatoksyny mogą niekorzystnie
wpływać na męską płodność, nawet w niewielkich stężeniach.
Marcin Matuszewski, Wojciech Połom
LECZENIE NIEPŁODNOŚCI –
UDZIAŁ UROLOGA
Klinika Urologii, Gdański Uniwersytet Medyczny; matmar@gumed.
edu.pl
Leczenie niepłodności optymalnie powinno odbywać
się w ramach wielospecjalistycznych zespołów. W Polsce
tradycyjnie ich tworzenie opiera się na pracy andrologów,
ginekologów i endokrynologów. W takich zespołach
urolog może pełnić wartościową rolę pomocniczą,
zwłaszcza w zakresie zabiegów diagnostycznych i leczniczych.
Jednak ze względu na ugruntowane przekonanie
w pacjentach, ale też i w lekarzach rodzinnych, że mężczyzna
w razie problemów zdrowotnych związanych
z narządami płciowymi powinien udać się do urologa,
lekarze urolodzy mają ogromne znaczenie w ramach
wstępnej analizy możliwych przyczyn osłabienia płodności
i w ukierunkowaniu pacjentów na dalsze etapy
leczenia. Co więcej, należy brać pod uwagę, że w Polsce
ze względu na uwarunkowania ekonomiczne i polityczno‑światopoglądowe
po pomoc do urologa zgłaszają się
także pacjenci, u których nie można zastosować technik
wspomaganego zapłodnienia.
W wykładzie zostaną omówione zagadnienia –
na podstawie rekomendacji Europejskiego Towarzystwa
Urologicznego z 2016 r. (EAU, ang, European Association of
Urology) – które mogą i powinny być przedmiotem analizy
urologa w trakcie badania i konsultacji pacjenta w kierunku
zaburzeń płodności: 1) dysgenezja jąder z uwzględnieniem
obecności mikrozapnień w jądrach, 2) żylaki
powrózka nasiennego, 3) infekcje gruczołów dodatkowych
w męskim układzie płciowym, 4) zaburzenia drożności
dróg nasiennych – wrodzony brak nasieniowodów
(CBAVD, ang. congenital bilateral absence of the vas deferens),
CUAVD (ang. congenital unilateral absence of the vas
deferens), torbiel przewodu Mullera, torbiel przewodów
wytryskowych), 5) technika TURED (ang. transurethral
resection of ejaculatory duct), 6) postępowanie z chorymi
z guzem jądra i 7) zaburzenia wytrysku.
Marek Mędraś
SUBSTANCJE WSPOMAGAJĄCE WYSIŁEK
FIZYCZNY A UKŁAD PODWZGÓRZE –
PRZYSADKA MÓZGOWA – GONADY
Katedra i Klinika Endokrynologii, Diabetologii i Leczenia Izotopami,
Uniwersytet Medyczny we Wrocławiu; Zakład Medycyny Sportu,
Akademia Wychowania Fizycznego, Wrocław; m.medras@gmail.com
Osoby uprawiające sport wyczynowy, a także rekreacyjnie
zaangażowane w aktywność fizyczną często stosują preparaty
mające na celu zwiększenie wydolności i siły mięśniowej.
W większości są to związki hormonalne, które
bezpośrednio lub pośrednio modyfikują czynność układu
podwzgórze–przysadka mózgowa–gonady. Najczęściej
stosowany jest testosteron i jego pochodne. W wykładzie
analizowany będzie problem powstającego w tej sytuacji
hipogonadyzmu w kontekście oceny czynności układu podwzgórze–
przysadka mózgowa–gonady, funkcji egzo-
i endokrynnej
gonad oraz ewentualnego postępowania lekarskiego.
Michał Oczkowski1, Katarzyna Dziendzikowska,
Joanna Gromadzka-Ostrowska1,
Małgorzata
Stachoń1, Jacek Wilczak1, Tomasz Królikowski1,
Remigiusz Mruk1, Johan Øvrevik2, Magdalena Kowalska3,
Marcin Kruszewski4, Anna Lankoff3,4
WPŁYW SPALIN BIOPALIW DRUGIEJ
GENERACJI NA WYBRANE PARAMETRY
HORMONELNEJ REGULACJI ROZRODU
U ZWIERZĄT MODELOWYCH
1 Szkoła Główna Gospodarstwa Wiejskiego w Warszawie (SGGW);
2 Norwegian Institute of Public Health, Oslo, Norway; 3 Uniwersytet
Jana Kochanowskiego w Kielcach; 4 Instytut Chemii i Techniki
Jądrowej w Warszawie; michal_oczkowski@sggw.pl
Spaliny powstałe w wyniku spalania olejów napędowych
są istotnym źródłem zanieczyszczeń powietrza, a silniki
wysokoprężne są największym źródłem cząstek stałych
obecnych w atmosferze. W związku z ograniczaniem
emisji zanieczyszczeń przez silniki Diesla zwiększa się
zainteresowanie stosowaniem biopaliw. Celem badań było
określenie wpływu biopaliwa drugiej generacji SHB20
(z 20% dodatkiem biokomponentów) na wybrane parametry
hormonalne zaangażowane w regulację funkcji
rozrodczych u zwierząt modelowych.
Doświadczenie przeprowadzono na 42 dorosłych
szczurach samcach Fischer 344, które podzielono na 3
grupy: kontrolną oraz dwie eksperymentalne: SHB20+
DPF (DPF, filtr cząstek stałych, ang. diesel particulate filter)
i SHB20-DPF
(bez filtra). Zwierzęta grup eksperymentalnych
poddawano inhalacji powietrzem zawierającym
spaliny z paliwa SHB20 (1,5% v/v) w komorach inhalacyjnych
zawierających (lub nie) filtr DPF. Po 7 i 28 dniach
doświadczenia połowę zwierząt z każdej grupy poddano
eutanazji i pobrano krew oraz gonady do dalszych analiz.
Metodą ELISA (ang. enzyme-linked
immunosorbent assay) wykonano oznaczenia hormonów w osoczu krwi: testosteronu
(T, ang. testosterone), dihydrotestosteronu (DHT,
ang. dihydrotestosterone) i hormonu luteinizującego (LH,
ang. luteinizing hormone). W gonadach oznaczono poziom
17β‑estradiolu
(E2), T, DHT oraz poziom białek: receptora
androgenowego (AR, ang. androgen receptor), estrogenowego
typu α i β (ERα, ERβ, ang. estrogen receptor type α
and β ) oraz aromatazy (Aro, ang. aromatase).
Zaobserwowano istotny wzrost stężenia T i DHT
w osoczu, DHT w gonadach oraz stężenia białek Aro
i Erα po 7 dniach inhalacji w grupie SHB20‑DPF
w porównaniu
do grupy kontrolnej. Nie wykazano zmian w badanych
parametrach po 28-dniowej
ekspozycji zwierząt
na spaliny.
Narażenie zwierząt na emisję spalin z biopaliwa
drugiej generacji ma wpływ na zaburzenie wewnątrzwydzielniczej
funkcji gonad, co może być związane z oddziaływaniem
węglowych nanocząstek oraz/lub związków
chemicznych zawartych w gazowej frakcji spalin.
Projekt finansowany z programu Polsko‑Norweska
Współpraca
Badawcza Pol-Nor
/ 201040/72/2013.
Paweł Osemlak1,2
ZASTOSOWANIE PROTEZ JĄDROWYCH
U CHŁOPCÓW
1 Katedra i Klinika Chirurgii i Traumatologii Dziecięcej, Uniwersytet
Medyczny w Lublinie; 2 Uniwersytecki Szpital Dziecięcy im.
Prof. Antoniego Gębali w Lublinie; posem1@poczta.onet.pl
Brak jądra może być spowodowany w okresie rozwojowym
wadą w postaci agenezji, aplazji lub atrofii, albo koniecznością
usunięcia jądra z powodu skrętu i martwicy, pourazowego
uszkodzenia lub nowotworu. Brak jądra lub jąder
u chłopca stanowi wskazanie do implantacji protezy oraz ścisłego
nadzoru urologa i endokrynologa dziecięcego. Problem
stosowania implantów u chłopców z brakiem jądra jest
sporadycznie poruszany w piśmiennictwie (w przeciwieństwie
do wieku dorosłego), dlatego celem badań autorskich
było odpowiedzenie na pytanie: jakie są odległe wyniki
leczenia i w jakim wieku należy wykonywać operacje?
Analizie poddano materiał Kliniki Chirurgii i Traumatologii
Dziecięcej w Lublinie obejmujący chłopców,
którym implantowano protezy jąder od 2000 do 2010 r.
Określono wiek, w którym wykonywano operację, przyczynę
braku jądra oraz wynik kosmetyczny we wspólnej
ocenie lekarza, pacjenta i rodziców.
W okresie 11 lat w Klinice wykonano operację wszczepienia
protezy jądra u 245 chłopców. W ponad 70% przypadków
byli oni w okresie niemowlęcym i przedszkolnym.
Wskazaniem do operacji u 65% badanych był brak jądra
spowodowany wadą rozwojową, a u 20% usunięcie skręconej
i martwiczej gonady. Pozostali chłopcy mieli usunięte
jądro z powodu urazu lub nowotworu. Protezę
implantowaną we wczesnym dzieciństwie wymieniano
1 raz (na ostateczną) po zakończeniu wzrostu drugiego
jądra, a w części przypadków 2-krotnie
– przed i po ukończeniu
okresu dojrzewania ze względu na dużą dysproporcję
wielkości jądra i protezy. Dobry wynik leczenia
(proteza położona nisko w mosznie, porównywalna wielkością
z jądrem) uzyskano w 97% przypadków. U pozostałych
3% pacjentów proteza była położona w górnej
części moszny albo uległa uszkodzeniu w wyniku urazu.
Na podstawie przeprowadzonej analizy wyciągnięto
wniosek, że możliwie wczesna implantacja protezy jądra
(przy jego braku – w okresie niemowlęco-przedszkolnym,
a po jego utracie – w ciągu kilku miesięcy) daje dobre
wyniki odległe, ponieważ implant działa w sposób pozytywny,
stymulując worek mosznowy do wzrostu.
Ewa Pastuszek 1,2, Mariusz Łukaszuk 2, Krzysztof Łukaszuk 1,2
METODY OZNACZANIA FRAGMENTACJI DNA
PLEMNIKÓW
1 Zakład Pielęgniarstwa Położniczo-Ginekologicznego,
Gdański
Uniwersytet Medyczny; 2 Kliniki i Medyczne Laboratoria
Diagnostyczne INVICTA, Gdańsk; ewa_pastuszek@gumed.edu.pl
Podstawowa diagnostyka męskiej niepłodności opiera
się na analizie mikroskopowej nasienia, jednakże żaden
z badanych w ten sposób parametrów nie odnosi się bezpośrednio
do jakości DNA plemników, przez co przewidywanie
potencjału płodności może być utrudnione. Szacuje
się, że aż ok. 15% pacjentów z prawidłowym wynikiem
standardowej oceny seminologicznej może wykazywać
obniżony potencjał do zapłodnienia.
Integralność DNA plemników warunkuje właściwe
przekazywanie informacji genetycznej potomstwu,
w związku z czym parametr ten wydaje się być obiecującym
markerem męskiej niepłodności oraz dobrym czynnikiem
prognostycznym w metodach rozrodu wspomaganego.
Podwyższony poziom fragmentacji DNA plemników
może być związany z apoptozą, zaburzeniami na etapie
spermatogenezy, stresem oksydacyjnym, infekcjami oraz
narażeniem na działanie substancji chemicznych bądź
czynniki fizyczne (promieniowanie elektromagnetyczne
lub podwyższeniem temperatury w okolicach jąder).
Dotychczas opracowano wiele metod służących
do oceny stopnia fragmentacji DNA plemników, które
znalazły zastosowanie w praktyce klinicznej. Metody
te cechują się różną czułością i umożliwiają badanie
wielu aspektów uszkodzeń DNA. Najczęściej stosowanymi
metodami są badanie chromatyny plemnikowej
za pomocą testu SCSA (ang. sperm chromatin structure
assay), badanie metodą TUNEL (ang. terminal deoxynucleotidyl
transferase-mediated
dUTP nick end labeling), test
kometkowy (COMET, ang. the single cell gel electrophoresis
assay) oraz Halo-test
(SCD, ang. sperm chromatin dispersion
test). Każdy z tych testów umożliwia oszacowanie półilościowego
ogólnego stanu DNA, lecz nie jest w stanie
wskazać specyficznej sekwencje DNA, która uległa
zmianie. Techniki te zapewniają ograniczone informacje
na temat charakteru uszkodzeń DNA i nie obrazują
w pełni dokładnej etiologii i patogenezy utraty integralności
DNA. Niemniej jednak, wiele badań pokazuje,
że istnieje istotny związek między skutecznością zapłodnienia
a wynikami badania fragmentacji DNA plemników.
Zaburzenia w DNA plemników mogą uniemożliwić
proces zapłodnienia, powodować degeneracje zarodka,
prowadzić do poronienia lub przyczyniać się do rozwoju
wad wrodzonych oraz nowotworów u potomstwa.
NAJNOWSZE ZALECENIA DOTYCZĄCE HIPOGONADYZMU U MĘŻCZYZN
Michał Rabijewski
NAJNOWSZE ZALECENIA DOTYCZĄCE
HIPOGONADYZMU U MĘŻCZYZN
Klinika Chorób Wewnętrznych, Diabetologii i Endokrynologii,
Warszawski Uniwersytet Medyczny; mrabijewski@wum.edu.pl
Hipogonadyzm u mężczyzn jest spowodowany
obniżeniem wydzielania i działania testosteronu.
Hipogonadyzm dzielimy na pierwotny (spowodowany
zaburzeniami funkcji jąder), wtórny (choroby układu
podwzgórzowo‑przysadkowego)
oraz obwodowy (spowodowany
polimorfizmem genu dla receptora androgenowego).
W ostatnich latach rozróżnia się również
hipogonadyzm późny (LOH, ang. late onset hypogonadism),
obserwowany u starszych mężczyzn i związany
z nieznacznym obniżaniem się stężenia testosteronu
z wiekiem, wobec czego jego objawy uważane są często
za element starzenia. Objawy niedoboru testosteronu
zależą od wieku chorych, przyczyny i jego nasilenia.
U młodych mężczyzn hipogonadyzm należy różnicować
z opóźnionym dojrzewaniem, natomiast u starszych
pacjentów charakterystycznymi objawami LOH jest brak
myśli seksualnych, brak porannych wzwodów i zaburzenia
wzwodu. Niedobór testosteronu wpływa negatywnie
na jakość życia, aspekty seksualne oraz powoduje
i nasila zaburzenia metaboliczne (cukrzyca, otyłość,
miażdżyca i osteoporoza). Wiąże się też z 3‑krotnie
wyższą ogólną śmiertelnością, spowodowaną także
chorobami układu krążenia. W leczeniu hipogonadyzmu
należy uwzględnić wiek chorych i jego przyczynę.
U młodych pacjentów priorytetem jest uzyskanie lub
utrzymanie prawidłowej spermatogenezy, natomiast
u starszych mężczyzn stosuje się leczenie zastępcze
testosteronem, które jest bezpieczne, dobrze tolerowane,
zmniejsza objawy hipogonadyzmu i poprawia jakość
życia. Opublikowane niedawno zalecenia Europejskiego
Towarzystwa Urologicznego (EAU, European Association
of Urology) dotyczące rozpoznawania i leczenia hipogonadyzmu
u mężczyzn dostarczają praktycznych rekomendacji,
jak postępować w przypadku pierwotnego
oraz związanego z wiekiem niedoboru testosteronu.
Omawiają one dokładnie wskazania, przeciwwskazania
i objawy uboczne terapii oraz kładą szczególny
nacisk na potencjalny wpływ testosteronu na gruczoł
krokowy i ryzyko chorób serca. Jest to szczególnie
istotne u mężczyzn z LOH, ponieważ u tych chorych
obserwujemy niespecyficzne objawy kliniczne, brakuje
również powszechnie akceptowanej dolnej normy stężenia
testosteronu.
Ewa Rajpert-De
Meyts
ZABURZENIA FUNKCJI KOMÓREK LEYDIGA
W ZESPOLE DYSGENEZJI JĄDER
Department of Growth and Reproduction and EDMaRC, Copenhagen
University Hospital (Rigshospitalet), Kopenhaga, Dania; erm@rh.dk
Komórki Leydiga (KL) są głównym źródłem androgenów
u mężczyzn od rozwoju płodowego do starości. W ludzkich
jądrach KL występują jako trzy odrębne populacje:
płodowe KL, które są niezbędne do maskulinizacji rozwijającego
się płodu, niemowlęce KL podczas „mini‑puberty”
oraz dojrzale KL u doroslych, odpowiedzialne
za utrzymanie funkcji rozrodczych w okresie dorosłości.
Ciężkie zaburzenia sygnalizacji androgenów (np. mutacje
receptora androgenowego) często prowadzą do zaburzeń
rozwoju płci (DSD), natomiast bardziej łagodne zaburzenia
funkcji KL odgrywają ważną rolę w patogenezie
zespołu dysgenezji jąder (TDS). Do tego zespołu zalicza
się zaburzenia sytemu rozrodczego, które są związane
z nieprawidłowym wczesnym rozwojem jąder, w tym
nowotwory komórek rozrodczych występujące u młodych
mężczyzn (seminoma albo nonseminoma, wywodzące się
z tzw. neoplazji komórek rozrodczych in situ/carcinoma
in situ), wnętrostwo, łagodne typy spodziectwa oraz
zaburzenia spermatogenezy z atrofią jądra i obecnością
zmian dysgenetycznych (Skakkebæk i wsp.: Hum Reprod.
2001, 16, 972–978; Hoei-Hansen
i wsp.: J Pathol. 2003,
200, 370–374). U pacjentów z zaburzeniami TDS bardzo
często występują duże skupiska KL (micronodules) oraz
towarzyszący im wzrost stosunku hormonu luteinizującego/
testosteronu. Występowanie KL jest szczególnie
zaznaczone u pacjentów z guzami wydzielającymi hCG
(ludzka gonadotropina kosmówkowa, ang. human chorionic
gonadotropin) (Holm i wsp.: J Pathol. 2003, 199, 378–386).
Obecność hiperplazji KL w biopsjach jąder u pacjentów
z jednostronnymi guzami jądra, w połączeniu z ich profilami
hormonów (testosteron i hormon luteinizujący),
pomaga przewidzieć wcześniejsze występowanie hipogonadyzmu
u tych pacjentów (Tarsitano i wsp.: nowe dane).
Hiperplastyczne mikroskupiska KL są heterogenne
i zawierają komórki w różnych etapach dojrzewania,
różniące się ekspresją DLK1 (ang. delta-like
homolog 1 –
marker komórek progenitorowych i niedojrzałych) lub
INSL3 (insulinopodobny peptyd 3, ang. insulin-like
peptide
3 – marker prawidłowych dojrzałych KL) (Lottrup i wsp.:
Hum Reprod. 2014, 29, 1637–1650). Hiperplastyczne KL
zawierają również znamiennie mniej kryształów Reinke
(Sorensen i wsp.: nowe dane). Nasze badania globalnej
ekspresji genów w microdissekowanych hiperplastycznych
KL w porównaniu z płodowymi i dojrzałymi KL
ujawniły nowe markery dojrzewania KL, analiza ich
profilu ekspresji wskazuje, że zmiany w funkcji i morfologii
KL zaobserwowane u pacjentów z TDS są związane
ze zwiększoną odnową KL typu dorosłego niż z przetrwaniem
populacji płodowej KL (Lottrup i wsp.: nowe dane).
Aleksandra Rosiak1,4, Kamil Gill1, Monika Frączek3,
Joanna Jakubik1, Maciej Kurpisz3, Rafał Kurzawa2,4,
Małgorzata Piasecka1
DOJRZAŁOŚĆ CHROMATYNY PLEMNIKÓW
W ZALEŻNOŚCI OD WIEKU MĘŻCZYZN
1 Katedra i Zakład Histologii i Biologii Rozwoju; 2 Zakład Zdrowia
Prokreacyjnego, Pomorski Uniwersytet Medyczny w Szczecinie; 3
Instytut Genetyki Człowieka, Polska Akademia Nauk w Poznaniu;
4 VitroLive Centrum Ginekologii i Leczenia Niepłodności, Szczecin;
rosiak.aleksandra@yahoo.com
Po 35. r.ż. mężczyzn obniżają się standardowe parametry
seminologiczne oraz wzrasta liczba zmian molekularnych
chromatyny plemnika (np. zaburzenia integralności,
protaminacji i kondensacji chromatyny). Opinie jednak
na temat wpływu wieku mężczyzn na parametry plemników
są niejednoznaczne i kontrowersyjne (Sharma i wsp.:
Reprod Biol Endocrinol. 2015, 13, 35). Celem pracy była
ocena dojrzałości chromatyny ejakulowanych plemników
mężczyzn (n = 1042) za pomocą testu z chromomycyną
A3 (CMA3), błękitem aniliny (AB), błękitem toluidyny
(TB) oraz metodą TUNEL (ang. terminal deodeoxynucleotidyl
transferase‑mediated
dUTP nick end labeling assay).
Mężczyźni ≥40. r.ż. nie różnili się istotnie (p > 0,05)
od mężczyzn <40. r.ż. koncentracją plemników (mediana:
40,30 vs. 35,35 mln/mL), całkowitą liczbą plemników
w ejakulacie (mediana: 115,20 vs. 115,50 mln), ruchem
całkowitym (mediana: 57,50 vs. 59,00%), morfologią
(mediana: 4,00 vs. 4,00%), żywotnością (mediana: 69,00
vs. 68,00%), koncentracją leukocytów (mediana: 0,00 vs.
0,00 mln/mL) i komórek okrągłych (mediana: 0,10 vs.
0,16 mln/mL) (wg WHO, 2010). Natomiast badani różnili
się objętością ejakulatu (mediana: 3,00 vs. 3,5 mL) oraz
odsetkiem komórek TUNEL‑pozytywnych,
(mediana:
20,25 vs. 12,30%), AB‑pozytywnych,
(mediana: 15,00
vs. 13,00%) oraz TB‑pozytywnych
(mediana: 17,00
vs 14,00%). Nie stwierdzono istotnych różnic między
badanymi grupami w przypadku odsetka komórek
CMA3‑pozytywnych
(mediana: 16,00 vs. 17,00%).
Wiek badanych korelował ujemnie istotnie z całkowitą
liczbą plemników w ejakulacie, morfologią plemników,
ruchliwością oraz koncentracją leukocytów (odpowiednio,
rs = −0,092, rs = −0,163, rs = −0,106, rs = −0,096), natomiast
dodatnio z indeksem teratozoospermii, komórkami
AB, TB oraz TUNEL-pozytywnymi
(odpowiednio,
rs = 0,116, rs = 0,088, rs = 0,148, rs = 0,229). Z kolei protaminacja
chromatyny plemników nie korelowała istotnie
z wiekiem badanych.
Uzyskane wyniki sugerują, że w badanej grupie mężczyzn
po 40. r.ż. występuje brak istotnych zmian w standardowych
parametrach seminologicznych, natomiast
może dochodzić do zaburzeń molekularnych chromatyny
plemników wyrażających się nieprawidłowościami
jej struktury i kondensacji.
Iwona Rotter1, Aleksandra Rył2, Katarzyna Kaczmarczyk2
CZY MĘŻCZYZNA 50+ POWINIEN PRZYJMOWAĆ
SUPLEMENTACJĘ MAGNEZU I CYNKU?
1 Samodzielna Pracownia Rehabilitacji Medycznej; 2 Katedra i Zakład
Histologii i Biologii Rozwoju, Pomorski Uniwersytet Medyczny
w Szczecinie; iwrot@wp.plb
Magnez (Mg) jest kofaktorem ponad 300 różnej klasy
enzymów w organizmie człowieka. Głównym rezerwuarem
Mg są kości, gdzie zgromadzone jest 64% całkowitego
Mg. Niedobór Mg sprzyja powstawaniu insulinooporności
i cukrzycy typu 2, zaburzeń gospodarki lipidowej,
nadciśnienia tętniczego, a także zespołu metabolicznego
(Swaninathan: Clin Biochem Rev. 2003, 24,47–66;
Huang i wsp.: Nutr J. 2012, 13, 41). Biorąc pod uwagę fakt,
że hipogonadyzm związany z wiekiem częściej występuje
u mężczyzn z zaburzeniami metabolicznymi, wydaje
się, że hipomagnezemia może sprzyjać wystąpieniu niedoboru
testosteronu. Maggio i wsp. (Int J Androl. 2011,
34, 594–600) badając starszych mężczyzn, wykazali
dodatnią korelację między stężeniem Mg a stężeniem
hormonów anabolicznych, w tym testosteronu całkowitego
(TT). Badania Cinar i wsp. (Biol Trace Elem Res.
2011, 149, 18–23) udowadniają, że suplementacja Mg
korzystnie wpływa na stężenie TT i wolnego testosteronu
(FT). Wzrost stężenia testosteronu związany ze wzrostem
stężenia Mg jest intensywniejszy u osób, które jednocześnie
z suplementacją Mg podejmują aktywność fizyczną
(Maggio i wsp.: Int J Endocrinol. 2014, 2014, 525249).
Cynk (Zn) bierze udział w steroidogenezie, sprzyja
dojrzewaniu plemników, a jako inhibitor 5α‑reduktazy
reguluje stężenie powstającego z testosteronu dihydrotestosteronu,
którego nadmiar przyczynia się do rozrostu
prostaty (Fahim i wsp.: Andrology. 1993, 25, 369–775;
Croxford i wsp.: J Nutr. 2011, 141, 359–365). Publikowane
badania wykazują, że niedobór Zn sprzyja obniżeniu
stężenia testosteronu, zaburzeniom płodności, zmniejszeniu
liczby i spadkowi żywotności plemników (Prasad:
Mol Med. 2008, 14, 353–357; Yamaguchi i wsp.: Proc Natl
Sci USA. 2009, 30, 10859–10864). Prasad (2008) zaobserwował,
że suplementacja Zn u starszych mężczyzn
z niewielkim niedoborem TT przyczyniła się do wzrostu
stężenia TT.
W badaniach autorskich u mężczyzn między 50.
a 75. r.ż wykazano statystycznie istotne związki
między stężeniem Mg a TT, natomiast dla cynku takich
związków nie stwierdzono. Wydaje się, że u mężczyzn
powyżej 50. r.ż suplementacja Mg może być uzasadniona,
zwłaszcza w przypadku występowania zaburzeń metabolicznych,
natomiast zasadność suplementacji Zn wymaga
pogłębienia badań.
WŁASNE DOŚWIADCZENIA W IMPLANTACJI PROTEZ CIAŁ JAMISTYCH PRĄCIOWYCH
Waldemar Różański
II Klinika Urologii, Uniwersytet Medyczny w Łodzi; waldemar.
rozanski@umed.lodz.pl
Zaburzenia erekcji (ED, ang. erectile dysfunction) to utrzymująca
się niezdolność do uzyskania i utrzymania pełnego
wzwodu prącia pozwalającego na satysfakcjonujące odbycie
stosunku. Zaburzenia erekcji to druga po przedwczesnym
wytrysku seksualna dolegliwość zgłaszana przez
mężczyzn (Lindan: N Engl. J Med. 2007, 357, 762–774).
Porst i Sharlip (Standard Practice in Sexual Medicine.
2006, 43–48) donoszą, że zaburzenia erekcji w zależności
od wieku chorego występują z różnym nasileniem:
u mężczyzn między 30–39 r.ż. dotyczą 2–28,9% badanych,
z kolei między 70–80 r.ż. aż 41,9–83% mężczyzn.
Lekami doustnymi pierwszego rzutu w leczeniu zaburzeń
wzwodu prącia u mężczyzn są inhibitory fosfodiesterazy
typu 5 (PDE5, ang. phosphodiesterase type 5): sildenafil
(Viagra), Vardenafil (levitra), tadalafil (Cialis).
Inne obecnie stosowane sposoby leczenia zaburzeń
wzwodu prącia to: podawanie do ciał jamistych preparatów
Caverject (Alprostadil), stosowanie urządzeń
próżniowych w celu wywołania wzwodu prącia, w przypadku
nieskutecznego leczenia farmakologicznego zaburzeń
erekcji metodą z wyboru jest wszczepienie protezy
ciał jamistych (Bettolchi: J Sex Med. 2010, 7, 304–309;
Minervini: BJU Int. 2006, 97, 129–133). Powikłania
mogące wystąpić po wszczepieniu protez ciał jamistych
to: zakażenie/zropienie i konieczność wymiany protezy,
uszkodzenie techniczne protezy, nieszczelność protezy,
uszkodzenie podczas przelotów samolotem z prędkością
ponaddźwiękową, dostanie się do protezy pęcherzyków
powietrza, erozja ciał jamistych, erozja cewki moczowej
(Henry: J Urol. 2005, 173, 89–92; Carson: Int J Impot
Res. 2003, 15, 139–146).
Do oceny funkcji seksualnych u chorych z zaburzeniami
erekcji stosowane są standaryzowane kwestionariusze:
IIEF‑5
(ang. International Index of Erectile
Function) lub SHIM (ang. Sexual Health Inventory for Men).
Porównano długość prącia u chorych leczonych iniekcjami
(papaweryna, fentolamina, prostaglandyna E1) z chorymi,
u których wszczepiono protezę ciał jamistych po 6 tygodniach,
6 i 12 miesiącach od zabiegu. Zaobserwowano
skrócenie długości prącia u chorych ze wszczepionymi
protezami ciał jamistych w porównaniu z leczonymi
iniekcjami. Długość prącia po iniekcjach wynosiła 13,2
±0,4 cm, z kolei długość prącia po wszczepieniu protezy:
po 6 tygodniach wynosiła 12,4 ±0,3 cm, po 6 miesiącach
12,5 ±0,3 cm, po 12 miesiącach 12,5 ±0,4 cm. W ocenie
według formularza SHIM jakość życia seksualnego
po wszczepieniu protezy ciał jamistych pomimo skrócenia
długości prącia jest zadawalająca. Porównywano chorych
leczonych z powodu cukrzycy (n = 84) i poddanych prostatektomii
radykalnej (n = 96). Obserwacje 12‑miesięczne
były następujące: u trzech chorych wystąpiło zakażenie
protezy, u jednego chorego miała miejsce erozja protezy
do cewki i u jednego chorego wystąpiły problemy z wypełnianiem
protezy, niestwierdzane podczas wszczepiania
do ciał jamistych. Średnie długości prącia dla wszystkich
chorych, podane na podstawie kwestionariuszy,
były następujące: IIEF‑5
przed zabiegiem 8,2 ±4,0 cm,
po zabiegu 20,6 ±2,7 cm; EDITS po zabiegu 72,2 ±20,7
cm (Antonini i wsp.: Int J Impot Res. 2016, 28, 2–8).
Od 2013 r. do 2015 r. w II Klinice Urologii Uniwersytetu
Medycznego w Łodzi wszczepiono protezy trzem
chorym, u których wcześniej wykonano prostatektomie
radykalną. Ocenę jakości życia seksualnego u tych
chorych przeprowadzono z zastosowaniem kwestionariusza
IIEF‑5
oraz SHIM. Odpowiadając na pytania
zawarte w kwestionariuszu IIEF, wszyscy chorzy podawali
brak lub sporadyczne występowanie erekcji oraz
brak możliwości odbycia stosunku płciowego z partnerką.
Po wszczepieniu protezy tylko jeden chory podał, że odbywane
stosunki są satysfakcjonujące w ponad połowie razy.
Dwaj pozostali po wszczepieniu protez ciał jamistych
są w pełni usatysfakcjonowani z odbywanych stosunków
płciowych z partnerkami. Odpowiadając na pytania
zawarte w kwestionariuszu SHIM, dwaj chorzy podali
pełną satysfakcję z odbywanych stosunków płciowych.
Jeden chory stwierdził, że stosunek po wszczepieniu
protezy ciał jamistych przynosi większą satysfakcję
partnerce niż jemu.
Jolanta Słowikowska-Hilczer
REKOMENDACJE DOTYCZĄCE
POSTĘPOWANIA W ZESPOLE KLINEFELTERA
Zakład Endokrynologii Płodności, Katedra Andrologii
i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi; Jolanta.
slowikowska-hilczer@umed.lodz.pl
Najpowszechniejszą (0,1–0,2% noworodków płci męskiej)
uwarunkowaną genetycznie przyczyną niepłodności oraz
hipogonadyzmu hipergonadotropowego u mężczyzn jest
zespół Klinefeltera. Rozwija się na skutek aberracji liczbowej
chromosomów X (najczęściej 47,XXY). W dzieciństwie
i we wczesnym okresie dojrzewania płciowego czynność
układu podwzgórze–przysadka–jądra jest zwykle
prawidłowa. Od środkowego okresu dojrzewania (stadium
GIII wg klasyfikacji Tannera) rozwija się obraz kliniczny
hipogonadyzmu hipergonadotropowego na skutek postępującej
degeneracji struktury i upośledzenia czynności
jąder (Wikström i Dunkel: Horm Res. 2008, 69, 317–326).
Fenotyp jest zróżnicowany, począwszy od niemalże
prawidłowego do znacznie odbiegającego od normy.
Fenotyp u noworodków z zespołem Klinefeltera jest
z reguły prawidłowy męski. Często jedyną kliniczną
cechą są małe jądra, które najczęściej są identyfikowane
dopiero po okresie dojrzewania płciowego. Pacjenci
z tym zespołem są najczęściej niepłodni, jednakże
w około połowie przypadków możliwe jest znalezienieplemników w jądrach (Rohayem i wsp.: Andrology. 2015, 3,
5, 868–875), a także mają większe ryzyko zachorowania
m.in. na raka piersi, zespół metaboliczny, choroby układu
krążenia, osteopenię/osteoporozę, choroby autoimmunologiczne.
Dodatkowo występują w zróżnicowanym
stopniu zaburzenia poznawcze, społeczne, behawioralne
oraz trudności w nauce. Rekomendowana jest wczesna
diagnostyka w kierunku tego zespołu, aby odpowiednio
wcześnie wdrożyć postępowanie terapeutyczne i prewencyjne
przeciwko chorobom towarzyszącym (Aksglaede
i wsp.: Am J Med Genet C Semin Med Genet. 2013,
163C, 1, 55–63; Purwin i Słowikowska-Hilczer:
Postępy
Andrologii Online. 2015, 2, 2, 12–24; Nieschlag i wsp.:
Andrology. 2016, 4, 3, 545–549).
Paweł Wiechno
NISKIE STĘŻENIE TESTOSTERONU
U MĘŻCZYZN Z CHOROBĄ NOWOTWOROWĄ
Klinika Nowotworów Układu Moczowego, Centrum Onkologii –
Instytut im. Marii Skłodowskiej-Curie,
Warszawa; wiechno@gmail.com
Zachorowanie na nowotwór złośliwy i proces jego leczenia
mogą prowadzić do wystąpienia niedoboru testosteronu
z towarzyszącymi objawami. Przeanalizowano
dane z piśmiennictwa oraz dane autorskie dotyczące
rozpowszechnienia niedoboru testosteronu u mężczyzn
leczonych z powodu nowotworu złośliwego oraz skutków
zdrowotnych tego stanu.
Ryzyko niedoboru testosteronu u pacjentów w wiele
lat po leczeniu nowotworu zarodkowego jądra wynosi
5–25%, jednak ponad 10 lat od orchidektomii stężenia
testosteronu nie odbiegają od typowych dla zdrowej populacji.
Wyższe są odsetki hipogonadyzmu po uwzględnieniu
hipogonadyzmu skompensowanego, a zaburzenie
to utrzymuje się przewlekle (Nord i wsp.: Eur
Urol. 2003, 44, 322–328). W skład obrazu klinicznego
wchodzi, poza zmniejszeniem objętości tkanki hormonalnie
czynnej, także uszkodzenie komórek Leydiga
przez cisplatynę (Berger i wsp.: Br J Cancer. 1996, 73,
1108–1114). Negatywny wpływ hipogonadyzmu na stan
pacjenta poddanego jednostronnej orchidektomii został
potwierdzony. Brak jest badań oceniających efekty
suplementacji testosteronu w tej grupie mężczyzn. Rak
stercza to przykład nowotworu zależnego od androgenów.
Wskazaniem do kastracji chirurgicznej bądź farmakologicznej
jest przerzutowy rak stercza (Parker i wsp.: Ann
Oncol. 2015, 26, suppl. 5, 69–77). Ponadto dołączenie
hormonoterapii do radioterapii radykalnej u mężczyzn
o wysokim ryzyku progresji przynosi korzyści w przeżyciach
całkowitych (D’Amico i wsp.: JAMA. 2008, 299,
289–295). Leczenie wiąże się jednak z ryzykiem wystąpienia
zaburzeń gospodarki lipidowej, cukrzycy, utraty
masy kostnej oraz incydentów sercowo‑naczyniowych
(Mottet i wsp.: Guidelines on Prostate Cancer. European
Association of Urology, 2015). Odsetek mężczyzn z niedoborem
testosteronu w schyłkowej fazie choroby ocenia
się na 40–90%. Niedobór testosteronu u tych pacjentów
jest elementem zespołu wyniszczenia nowotworowego
(Fuoco: Ecancermedicalscience. 2015, 9, 561).
Niedobory testosteronu oraz zaburzenia osi przysadka–
gonada są częste u mężczyzn chorych na nowotwory
złośliwe. Niedobory androgenów wiążą się z istotnymi
efektami klinicznymi upośledzającymi jakość życia
mężczyzny.
Jan Karol Wolski1,2, Grzegorz Kapuściński1,
Katarzyna Kozioł1, Adriana Strzałkowska1,
Martyna Ignaszak1, Jan Lewandowski1, Robert
Wyban1, Marta Izdebska-Książek1,
Marta Radziewicz-Pigiel1,
Ewa Stachowiak1, Karina Gawron1,
Katarzyna Klimczewska1, Karolina Kubiak1,
Karolina Leśniewska1, Sylwia Trubacz1, Hanna Marszał1,
Marcin Ligaj3, Dariusz Starczewski1, Bogdan Biarda1,
Piotr Lewandowski1
M-TESE
– NASZE DOŚWIADCZENIE W LATACH
2012–2016
1 Przychodnia Lekarska Novum, Warszawa; 2 Klinika Nowotworów
Układu Moczowego, Centrum Onkologii – Instytut im. Marii
Skłodowskiej-Curie,
Warszawa; 3 Zakład Patologii, Centrum
Onkologii – Instytut im. Marii Skłodowskiej-Curie,
Warszawa;
jkwolski@op.pl
W 1999 r. Schlegel po raz pierwszy opisał biopsję jąder
z wykorzystaniem mikroskopu operacyjnego (M‑TESE,
ang. microsurgical testicular sperm extraction) u mężczyzn
z azoospermią nieobstrukcyjną (NOA, ang. nonobstructive
azoospermia), z negatywnymi biopsjami w przeszłości,
z intencją pozyskania plemników do wspomaganego
rozrodu (IVF‑ICSI,
ang. in vitro fertilization‑intracytoplasmic
sperm injection). Autorzy zastosowali tę technikę z sukcesem
po raz pierwszy w Polsce w październiku 2012 r.
Celem przeprowadzonych badań była ocena skuteczności
biopsji M-TESE
– pozyskanie plemników do procedury
IVF‑ICSI.
Biopsje M-TESE
wykonano u niehomogennej
grupy 108 mężczyzn z NOA; wiek 17–44 (średnia:
32. r.ż.). Dla 14 mężczyzn M-TESE
była pierwszą biopsją.
Spośród nich 11 prezentowało zespół Klinefeltera 47,
XXY; 2 zaburzenia rozwoju płciowego 46, XY (DSD, ang.
disorders of sex development) i 1 niedrożność przewodów
wytryskowych (post-TURED,
ang. transurethral resection
of ejaculatory duct). U 89 mężczyzn M-TESE
była
drugą biopsją, a u 5 trzecią. U wszystkich pacjentów
przed biopsją przeprowadzano hormonalną stymulację
spermatogenezy (6–12 tygodni, androgen + antyestrogen
z dodatkiem wazodilatatorów oraz pierwiastków śladowych
i witamin) (Adamopulous i wsp.: Fertil Steril. 1995,
64, 818–824). Monitorowano poziomy hormonu luteinizującego
(LH, ang. luteinizing hormone), folikulotropowego
(FSH, ang. follicle-stimulating
hormone) i testosteronu.
Wszystkie procedury M-TESE
były wykonywane w znieczuleniu ogólnym, jako „chirurgia jednego dnia”.
Wykorzystano mikroskopy operacyjne Seiler Evolution
XR6, Carl Zeiss S7, Leica M860 2×2, zastosowano 20–25‑krotne
powiększenie. Z obu gonad pobierano wycinki
z 3 poziomów. Każdy wycinek umieszczano w ciekłym
azocie (−196oC) do ewentualnego przyszłego IVF z poprzedzającą
oceną doraźną pod kątem obecności plemników.
Ponadto wykonywano rutynowe badanie histologiczne.
Plemniki stwierdzono u 28 z 95 pacjentów (29,5%),
natomiast nie znaleziono ich w przypadku zespołu
Klinefeltera i DSD. Uzyskano 16 ciąż, zanotowano 6
poronień i urodziło się 6 dzieci z wykonanych 37 procedur
IVF. Uzyskane wyniki wskazują, że biopsja jąder
przy użyciu mikroskopu operacyjnego zwiększa szansę
na znalezienie plemników u mężczyzn z nieobstrukcyjną
azoospermią i pozwala na włączenie ich do protokołu
IVF-ICSI.
Jan Karol Wolski
PREPARATY WITAMINOWE
I MIKROELEMENTY W TERAPII
NIEPŁODNOŚCI MĘSKIEJ
Przychodnia Lekarska Novum, Warszawa; jkwolski@op.pl
W ciągu ostatniego półwiecza obserwuje się wzrastający
udział czynnika męskiego w bezdzietności pary. Ocenia się,
że do 50% niepowodzeń w rozrodzie leży po stronie mężczyzny.
Obok wad rozwojowych układu moczowo-płciowego,
żylaków
powrózka nasiennego, niedrożności dróg wyprowadzających
nasienie, neurogennych zaburzeń ejakulacji większość przypadków
męskiej niepłodności stanowią zaburzenia spermatogenezy
i czynności plemników. Czynniki zewnętrze, jak palenie
tytoniu, otyłość prosta, zanieczyszczenie środowiska, stany
zapalne w obrębie układu moczowo-płciowego,
sprzyjają występowaniu
stresu oksydacyjnego. Jest to znacząca przyczyna
uszkadzająca plemniki, oceniana na 30–80%. Męskie komórki
rozrodcze są bardzo wrażliwe na działanie reaktywnych form
tlenu, które są efektem stresu oksydacyjnego. Błona komórkowa
plemnika zawiera duże ilości nienasyconych kwasów
tłuszczowych, które podlegają procesowi utleniania, a w cytoplazmie
znajduje się małe stężenie enzymów neutralizujących
reaktywne formy tlenu. Podaż doustna witamin i mikroelementów
(witaminy A, E, C, B; selen, cynk, miedź, chrom) może
wpływać na poprawę jakości nasienia poprzez redukcję stresu
oksydacyjnego, związanego z poziomem reaktywnych form
tlenu. Liczne publikacje wykazują korzyść z zastosowania
takiej terapii. Ostatnia analiza Cochrane z 2014 r. (Showell
i wsp.: Cochrane Database Syst Rev. 2014) stwierdza, że istnieją
dowody choć relatywnie niskiej jakości w przypadku
czterech małych randomizowanych kontrolowanych badań.
Sugerują one, że suplementacja antyoksydantów u mężczyzn
z obniżoną płodnością wpływa korzystnie na jakość nasienia
i może poprawić liczbę żywych urodzeń. Potrzebne są zatem
dalsze, duże, dobrze zaprojektowane badania randomizowane
z kontrolą placebo preparatów specjalnie skonstruowanych
do leczenia niepłodności męskiej.
SYMPOSIUM OF SCIENTIFIC TRANINING OF THE POLISH SOCIETY OF ANDROLOGY – 18th DAY OF ANDROLOGY
Gdansk 30.09.–01.10.2016
www.pta2016.pl
Report
The Conference of the Polish Society of Andrology –
18th Day of Andrology took place on September 30th –
October 1st, 2016 in the Hotel Novotel Marina in Gdansk.
The event was organized by the Conference Office from
the Karol Marcinkowski Medical University in Poznan
in cooperation with the Local Organizing Committee
chaired by Dr. Mariusz Łukaszuk and the Scientific
Committee chaired by Prof. Jolanta Słowikowska‑Hilczer.
The Conference was preceded by a workshop entitled:
“The criteria for the legitimacy of sexological intervention:
between norm and pathology” conducted by Dr. Robert
Kowalczyk, head of the Department of Sexology at the
Faculty of Psychology and Human Sciences of the Andrzej
Frycz Modrzewski Academy in Cracow.
The Conference was started by the greeting delivered
by the Polish Society of Andrology President Prof.
Jolanta Słowikowska-Hilczer.
Prof. Ewa Rajpert-DeMeyts
from the Department of Growth and Reproduction,
Copenhagen University Hospital (Rigshospitalet) in
Denmark was awarded a statuette and a diploma of the
Polish Society of Andrology Honorary Member. Dr. Marta
Olszewska from the Department of Reproductive Biology
and Stem Cells, Institute of Human Genetics, Polish
Academy of Sciences in Poznan, was awarded the Polish
Society of Andrology Prize of Young Scientists named by
Prof. Michał Bokiniec. Due to the fact that the winner
could not attend the Conference, she presented her work
through the Skype.
Dr. hab. Renata Walczak-Jędrzejowska
announced
the completion of work by Polish Society of Andrology
and the National Chamber of Laboratory Diagnosticians
on Polish Recommendations: “The basic semen analysis
according to the standards of the World Health
Organization in 2010”. Prof. Jolanta Słowikowska‑Hilczer
presented medical doctors, who in 2016 received the title
of clinical andrologist from the European Academy of
Andrology (EAA). She announced also publication of the
Polish version of the European Association of Urology
(EAU) recommendations on male hypogonadism and
male sexual dysfunction in the journal “Advances in
Andrology Online”. Prof. Piotr Jedrzejczak introduced
the rules of the Polish Society of Andrology Certificate
of clinical andrology. Prof. Malgorzata Piasecka discussed
the current situation of the journal “Advances
in Andrology Online”.
Apart from the Polish lecturers the scientific part of
the Conference was honored with the presence of foreign
guests: Prof. Ewa Rajpert-DeMeyts
from Denmark,
Prof. Gerhard van der Horst and Prof. Stefan Du Plessiss
from South Africa, Prof. Aleksander Giwercman from
Sweden, Prof. Frederick Wu and Dr. Gulam Bahadur
from the United Kingdom. The topics of the Conference
included problems of male infertility, urological and endocrinological
issues important in andrology, as well as
achievements in the basic research on physiology and
pathology of the male reproductive system. The results
of current andrological research were presented in the
form of short oral presentations.
The meeting ended with the invitation to the Polish
Society of Andrology Conference – 19th Day of Andrology
in 2017 in Krakow given by Dr. hab. Małgorzata Kotula‑Balak
and Dr. Leszek Bergier.
Abstracts of lectures
Dennis S. Arokoyo1, Ibukun P. Oyeyipo2, Stefan S. Du
Plessis2, Yapo . G Aboua1
REPRODUCTIVE PARAMETERS IN STZ‑INDUCED
DIABETIC MALE WISTAR RATS:
BENEFICIAL ROLE OF AQUEOUS LEAVE
EXTRACT OF BASELLA ALBA
1 Faculty of Health and Wellness Sciences, Cape Peninsula University
of Technology; 2 Division of Medical Physiology, Faculty of Medicine
and Health Sciences, Stellenbosch University, Tygerberg, Republic
of South Africa; abouay@cput.ac.za
The aim of this study was to investigate the effects of
streptozotocin-induced
diabetes mellitus on Wistar rat
sperm parameters and the possible role and mechanism
of aqueous Basella alba leave extract on such effects.
Forty mature male Wistar rats between 8–10 weeks of
age were divided in four experimental groups (n = 10),
namely; Healthy Control (Group A, oral normal saline
0.5 mL/100g daily), Diabetic Control (Group B, oral
normal saline 0.5 mL/100 g daily), Healthy Treatment
(Group C, Extract 200 mg/kg daily by gavage) and
Diabetic Treatment (Group D, Extract 200 mg/kg daily
by gavage). Diabetes was induced in groups B and D
with a single intraperitoneal injection of streptozotocin
(55 mg/kg). Fasting blood sugar and body weights
were recorded during the 4 weeks treatment period.
All animals were sacrificed at the end of treatment and
blood samples, testes, and epididymis were collected
and assayed. Weights (body, testes, epididymis) were
measured, a semen analysis performed and serum
gonadal hormone levels assessed. The results showed
a significant (p < 0.05) decrease in body weight as well
as testicular and epididymal weight in the untreated
diabetic rats when compared to the healthy control.
However, the relative organ weight of the epididymis
(expressed as a % of bodyweight) was not affected by
diabetes. There was a significant (p < 0.0001) increase
in the relative testicular weights of both diabetic
groups when compared to healthy controls. Likewise,
sperm concentration, percentage viability and morphology,
were all significantly (p < 0.0001) reduced
in the untreated diabetic rats compared to the control
rats. This improved significantly (p < 0.05) in the diabetic
rats treated with the plant extract. The effect
of diabetes and treatment with Basella alba on sperm
motility was not statistically significant. However, the
untreated diabetic group showed significant increases
in serum testosterone (p = 0.0002) and luteinizing
hormone (p < 0.0001) when compared to any of the
other three groups. There was no significant effect
on serum follicle stimulating hormone levels. We concluded
from these findings that an aqueous extract of
Basella alba played a major role in ameliorating some
of the male reproductive complications caused by diabetes
mellitus.
Gulam Bahadur
IMPROVING IUI PREGNANCY RATES WHILE
OVERCOMING MALE FACTOR INFERTILITY
Reproductive Medicine Unit, North Middlesex University Hospital,
London, United Kingdom; bahadur.g@gmail.com
Intrauterine insemination (IUI) has been a poorly practised
and preferentially in favour of more expensive IVF
(in vitro fertilization) treatment, which have greater associated
risks and complexity. It is becoming more apparent
that IUI if practised efficiently can provide equally good
pregnancy rates, and benefit a global subfertile population
who cannot access IVF facilities. The added costs
necessary to achieve one additional healthy child in the
IVF-SET
(IVF-single
embryo transfer) group compared
with IUI-COH
(IVF-
controlled ovarian hyperstimulation)
was €43,375 while the Cochrane reviews dismiss
multiple birth rate concerns in the IUI procedure.
Often the limitation of IUI is defined by the availability
of motile progressive sperm and the field has
been severely restricted, thereby allowing the liberal
use of ICSI procedures. In clinical settings one of the
most patient requests is for improving the man’s semen
quality for which there is no established or tangibly
proven procedure. There never has been consensus
on optimal abstinence for subfertile men because the
WHO 2010 reference range if 2–7 days is derived from
fertile males in a number of countries over three continents.
We introduced the concept of ‘consecutive ejaculate’
as a way of profiling subfertile men treatment and
with a view to increasing the number of motile progressive
sperm for insemination. We concluded, there was
a significant improvement in the sperm motility, progression
and morphology associations with no detriment
to the sperm concentration in the consecutive ejaculate.
Concentrations of rapid grade (Grade A) spermatozoa
were significantly higher in the consecutive ejaculate.
Favourable semen characteristics in consecutive ejaculates
with short abstinence in subfertile men suggests
this needs to be routinely investigated, as it could have
a profound alteration in the management of the couple’s
subfertility investigation. While some clinics occasionally
ask for a consecutive ejaculate it was surprising that
semen parameters with very short abstinence were never
published. In our work we introduced the idea of ‘consecutive
ejaculates’ having an abstinence of under 30
minutes. Newer data elsewhere on sperm with shorter
abstinence times suggest lowered DNA fragmentation
rates along with other favourable molecular markers,
although it would be early to speculate of the clinical
benefits of a pregnancy outcome (Bahadur et al.: Reprod
Biomed Online. 2016, 32, 323–328).
Following a number of changes such as IUI stimulation
protocols away from clomid towards hMG (human
menopausal gonadotropin), coupled with the use of `consecutive
ejaculates’ our clinics have made progressive
improvements over the years to shift pregnancy rates from around 7% per cycle to around 20% per cycle, with
almost 25–33% of the cohort becoming pregnant. It
appears the biggest determinant in the success of IUI
is the clinical management of the patient. Generally
clinics need a database to allow a real time monitoring
of the progress of the IUI programme. We assert that
the male patient be exhaustively assessed on a case by
case basis to enable simpler low cost treatment option
IUI treatment to be realistic and effective (Bahadur et al.:
Hum Reprod. 2016, 31, 1141–1146).
Katarzyna Dziendzikowska1, Agata Krawczyńska2,
Michał Oczkowski1, Tomasz Królikowski1, Andrzej
P. Herman2, Joanna Bochenek2, Anna Lankoff 3, 4,
Marcin Kruszewski4, 5, Joanna Gromadzka-Ostrowska1
IMPACT OF SILVER NANOPARTICLES ON THE
PARAMETERS OF ANTIOXIDANT DEFENSE IN
THE GTESTIS OF MALE WISTAR RATS
1 Warsaw University of Life Sciences – SGGW, Faculty of Human
Nutrition and Consumer Science, Department of Dietetics, Division of
Nutrition Physiology, Warsaw; 2 The Kielanowski Institute of Animal
Physiology and Nutrition of Polish Academy of Sciences, Laboratory
of Molecular Biology, Jabłonna; 3 Institute of Nuclear Chemistry
and Technology, Centre for Radiobiology and Biological Dosimetry,
Warsaw; 4 Jan Kochanowski University, Institute of Biology,
Department of Radiobiology and Immunology, Kielce; 5 Institute
of Rural Health, Department of Molecular Biology and Translational
Research, Lublin, Poland; katarzyna_dziendzikowska@sggw.pl
Metal nanoparticles, in particular silver nanoparticles
(AgNPs) are among the most widely used nanomaterials.
Silver nanoparticles because of its strong antibacterial
effect are extensively used in personal care products,
storing and processing of foods or in medical utilities.
Due to the increasing prevalence of AgNPs in everyday
life it is necessary to examine the effects of their impact
on living organisms. The aim of the study was to determine
the effect of a single administration of AgNPs
on selected parameters of antioxidant defense in the
testis of male Wistar rats.
The experiment was conducted on 84 adult male
Wistar rats were divided into four groups: a control
group and 3 experimental groups receiving intravenously
AgNPs (20 nm of dimeter) at a dose of 5 mg/kg body
weight (AgI group) or 10 mg/kg body weight (AgII group),
or AgNPs (200 nm of diameter) at a dose of 5 mg/kg body
weight (AgIII group). 24 hours, 7 days, and 28 days after
the single injection, the animals were anesthetized and
the testis were dissected. The antioxidant defense genes
expression: superoxide dismutase (Sod1), glutathione
peroxidase 1 and 4 (Gpx1, Gpx4), catalase (Cat), glutathione
S‑transferase
pi 1 (Gstp1) and gene expression
of heme oxygenase 1 (Ho1) in the testis were determined
using polymerase chain reaction (real-time
PCR) method.
The results indicated increase of gene expression
(when comparing with control groups), including Ho1
in AgI, AgII and AgIII groups (p ≤ 0,01), Cat in AgIII
group (p ≤ 0.05) Gpx4 in AgI and AgIII groups (p ≤ 0,01),
Gstp1 in AgII and AgIII groups (p ≤ 0.05) and Sod1 in
AgI and AgIII groups (p ≤ 0.05).
The work was funded by the Polish-Norwegian
Research Fund,
Project No PNRF-122-AI-1/.
Monika Frączek1, Magdalena Hryhorowicz2,
Kamil Gill3, Marta Zarzycka4, Dariusz
Gączarzewicz5, Piotr Jędrzejczak6, Barbara Bilińska4,
Małgorzata Piasecka3, Maciej Kurpisz1
INFLUENCE OF BACTERIOSPERMIA AND
LEUKOCYTOSPERMIA ON CONVENTIONAL
AND NONCONVENTIONAL SEMEN
PARAMETERS
1 Institute of Human Genetics, Polish Academy of Sciences, Poznań;
2 Department of Biochemistry and Biotechnology, Poznan University
of Life Sciences; 3 Department of Histology and Developmental
Biology, Pomeranian Medical University, Szczecin; 4 Department
of Endocrinology, Institute of Zoology, Jagiellonian University,
Cracow; 5 Department of Animal Reproduction, Biotechnology and
Environmental Hygiene, West Pomeranian University of Technology,
Szczecin; 6 Division of Infertility and Reproductive Endocrinology,
Poznan University of Medical Sciences, Poland; monika.fraczek@
igcz.poznan.pl
Urogenital tract infections are a growing problem in clinical
andrology. Recent reports have demonstrated a wide
range of microorganisms detected at the level of significant
bacteriospermia (>104 CFU – colony‑forming
unit/
mL) without clinical symptoms (Hou et al.: Fertil Steril.
2013, 100, 1261–1269). There are an increasing number of
experimental studies which confirm the harmful effect of
individual bacterial strains, both pathogenic and potentially
pathogenic, on mature male gametes (Fraczek and
Kurpisz: Folia Histochem Cytobiol. 2015, 53, 201–217).
Invasion of bacteria into the male genital tract is associated
with massive infiltration of activated leukocytes.
However, clinical consequences of an increased number of
seminal leukocytes in the presence or absence of an infectious
agent (leukocytospermia coexisting with bacteriospermia
and isolated leukocytospermia, respectively) still
remain unexplained. The aim of the study was to analyse
the influence of asymptomatic bacteriospermia and/or
leukocytospermia on conventional (standard semen analysis)
and nonconventional (subcellular changes of sperm)
semen parameters in heathy males at the reproductive age.
Both bacteriospermia and leukocytospermia had
a deleterious effect on standard semen parameters
including sperm cells concentration, motility and
morphology. The results of sperm membrane integrity,
mitochondrial activity and DNA fragmentation
have revealed that bacteria mainly participate in the
intrinsic apoptotic sperm death mechanisms. This was
evidenced by simultaneous increase in phosphatidylserine
externalization, decrease in mitochondrial transmembrane
potential, and increase in DNA fragmentation,
in semen samples with bacteriospermia. Results also showed a negative influence of leukocytes on sperm
membrane lipid peroxidation and oxidoreductive capability
of sperm mitochondria. In this context, oxidative
stress may play a relevant role in diminished sperm
conventional parameters during leukocytospermia.
In summary, the obtained results indicate the possibility
of direct effect of both inflammatory mediators,
bacteria and leukocytes, on subcellular parameters of
male gamete, important for its biological function. The
value of these observations may be important for the
development of new algorithms for diagnosis and treatment
of bacterial infections in the urogenital tract.
Aleksander Giwercman1, Sigrid Isaksson1,
Carolina Bogefors1, Mariusz Kitlinski2
YOUNG MALE CANCER SURVIVORS – CURED
BUT NOT HEALTHY
1Department of Translational Medicine, Lund University, Malmö;
2Department of Cardiology, Skane University Hospital, Malmö,
Sweden; aleksander.giwercman@med.lu.se
Thanks to the improvements of cancer therapy the survival
rates for some of the most common malignant diseases
of young age have increased significantly exceeding
95% for testicular germ cell cancer (TC) patients and
80% of childhood cancer (CC). However, recent data
indicate that both TC and CC survivors (TCS, CCS) are
at increased risk of long term morbidity and mortality.
These adverse long term effects might be caused by a negative
effect of cancer and its treatment on testicular function
leading to hypogonadism (HG) and subsequently
to serious diseases linked HG. The aim of our study was
to: a) Estimate the prevalence of biochemical signs of
HG among TCS and CCS; b) Identify disease – and treatment
related factors predicting increased risk of HG; c)
Elucidate whether there was an association between HG
and signs of low bone mineral density, metabolic and
cardiovascular disease.
Ninety‑two
TCS, 131 CCS (mean age 40 and 36 years,
respectively; mean follow‑up
time 9.2 and 25 years,
respectively) and a corresponding number of age‑matched
controls were included. Fasting morning blood samples
were analyzed for total testosterone (TT) and luteinizing
hormone (LH). The odds ratios (OR) for hypogonadism,
defined as ongoing androgen replacement or TT <10
nmol/L and/or LH >10 IU/L, were calculated for TCS
and CCS, and for subgroups defined by diagnosis and
treatment. Bone mineral density was assessed by means
of DEXA scan. Fasting plasma glucose and insulin were
determined and in a selected subgroup of not anthracycline
treated CCS and controls, two dimensional echocardiography
was performed. HG was found in 25% of CCS
and 36% of TCS, and was related to treatment modality.
The risk of impaired insulin sensitivity and low bone
mineral density were increased in patients with HG. Even
those CCS who were not given anthracyclines, presented
with signs of impaired cardiac function.
Follow-up
of TCS and CCS should include assessment
of endocrine and metabolic function as well as investigation
of bone mineral density. Measures to treat and
prevent long term morbidity may be warranted in significant
proportion of these young men.
Gerhard van der Horst1, Eduard Sanchez2
TRACKING SPERM MOVEMENT IN FOUR
DIMENSIONS AND MODELS FOR SPERM
FUNCTIONALITY
1Department of Medical Bioscience, University of the Western
Cape, Republic of South Africa; 2Microptic SL, Barcelona, Spain;
gvdhorst7@gmail.com
Basic semen analysis performed by means of either
manual or Computer Aided Semen Analysis (CASA) is
the first step in evaluating the quality of a semen sample
but neither predict fertility outcome. The emphasis in
male fertility research during the last decade has shifted
to relate sperm function to both fertilization outcome as
well as live birth outcome. The aim of our research was,
firstly, to demonstrate the development and application of
new quantitative, objective automated sperm functional
tests such as sperm cervical mucous penetration (SCMP),
hyperactivation (HA), vitality (Vit), hypo‑osmotic
swelling
(HOS), and the acrosome reaction (AR) assay using
CASA technology. Secondly, it is important to develop
new approaches to contribute to our understanding of
sperm function and its relationship to fertility. Laser
based studies showed that sperm of most species swim
in a helix. Our hypothesis is that reconstructed 3D/4D
tracks from 2D tracks will provide new insights on sperm
motility patterns and their relationship to fertility.
All the above sperm functional tests (SCMP, HA,
VIT, HOS, AR) were tested/performed on human sperm
using standard or modified protocols. SCA (Sperm Class
Analyzer) CASA software was developed to accurately
measure the different sperm parameters for each test
objectively for potential fertility as obtained in the relevant
literature (SCMP >5 mln sperm/ejaculate; HA >
20% of motile population; Vit and HOS >58% and for
AR at least a difference of 15% between initial acrosome
intact and acrosome reacted). Application of these newly
developed CASA sperm functional tests showed good
discrimination between good and poor sperm samples.
The most applicable kinematic parameters to formulate
the 3D helix construction are amplitude of lateral
head displacement (ALH, radius of helix), straight line
velocity (VSL, distance from the first point to last point
of track) and beat cross frequency (BCF, frequency of
average path velocity/curvilinear velocity – VAP/VCL).
This will describe the “distance between the 2D peaks”
and as a first approximation we used VSL/(BCF/2).
The results obtained from this initial modelling
showed that it is possible to construct 3D tracks from
2D CASA tracks. By simply changing any of the kinematic
parameters ALH, BCF or VSL we can model spherical
helices of almost any type. Furthermore, three new
parameters derived from the helix model relate to length
as a function of speed and curvature and torsion as components
of the helix.
In conclusion, it is possible to measure several important
sperm functional aspects objectively and routinely
using CASA. In addition construction of 3D/4D sperm
motility tracks may add important new perspectives
to the meaning of sperm motility patterns. The important
challenge in future is that we need to relate all these
aspects to live birth outcome.
Piotr Jędrzejczak
MALE CONTRACEPTION – CURRENT PROBLEMS
Department of Infertility and Reproductive Endocrinology, Medical
University in Poznań, Poznań, Poland; piotrjedrzejczak@gmail.com
Unwanted pregnancy is a major global problem and
with increasing world population there is a tremendous
need for the development of effective male contraceptive
method. Among all the approaches undertaken for
the development of new male contraceptives, hormonal
methods are potentially closest to a possible clinical application.
The hormonal approach to male contraception
is based on the suppression of gonadotropins leading
to reversible inhibition of the spermatogenetic process.
Supplementation with androgen is required to maintain
physiological levels of testosterone and consequently
androgen-dependent
physiological functions.
Current strategy focuses on the administration of
testosterone with a progestin. It was confirmed that
sperm suppression achieved through such regimens
may provide efficient contraceptive protection. One of
the main obstacle for the development of hormonal male
contraception is, that no major drug company has shown
interest in leading this project to a market that does not
seem profitable. In addition to approaches based on the
hormonal compounds, there is a need to develop non-hormonal
methods by identifying novel targets for contraceptive
intervention. The goal may be either to inhibit
spermatogenesis or to render sperm non-functional.
The
small molecule JQ1 (thieno-triazolo-1,4-diazepine)
was
designed as a prototype that effects at the level of spermatocyte
to spermatid maturation. Vitamin A metabolism
has long been considered as a target for male contraception.
Retinoic acid receptor (RAR) antagonist
(BMS-189453)
causes a failure of spermatid alignment
and sperm release. Adjudin is another potential compound
for inhibiting sperm maturation at the testicular
level. CatSper (sperm-specific
Ca2+ channel) is essential
for sperm capacitation. Studies for the development of
pharmaceutical CatSper antagonist have been reported.
Many observations would suggest that if new contraceptives
for men were available, many couples worldwide
would use them, so there is a need for future research.
Grzegorz Jakiel
THE ROLE OF ANDROLOGIST IN THE
INFERTILITY CLINIC
Department of Obstetrics and Gynecology, Medical Centre for
Postgraduate Education, Clinical Hospital named prof. W. Orłowski,
Warsaw, Poland; grzegorz.jakiel1@o2.pl
According to Polish Society of Andrology (PTA) definition,
andrology is the area of the medical science responsible
for the physiology and the pathology of male reproductive
system in aspects of basic science, diagnostics and
therapy. The andrologist is defined as a person conducting
researches or simply having knowledge in the area of
andrology.
Person working in the infertility clinics must be
licensed in the one of two regulated by law professions:
medical doctor or laboratory diagnostician. The law
regulation is obligatory and completely independent
from different certification: Polish one e.g, PTA certificate,
as well as international e.g. European Academy of
Andrology (EAA).
The laboratory diagnostician working in the infertility
clinic should be able to perform the semen investigation
according to Word Health Organization (WHO 2010)
recommendations and concomitant specialty tests as
hyaluronan binding assay (HBA), MAR test and DNA
sperm fragmentation test. The sperm selection methods
for assisted reproductive technologies (ART) as intracytoplasmic
morphologically selected sperm injection (IMSI),
the annexine selection and physiological intracytoplasmic
sperm injection (PISCI) are also necessary competencies.
The professional role of the laboratory diagnostician is
complementary to the medical doctor responsibility but
not exchangeable. The expertise in the laboratory practice
is not essential in daily medical practice.
The medical doctor – andrologist is the member of the
medical team of the infertility clinic and have the qualifications
according to requirements for gynecology endocrinology
and reproduction medicine. The qualifications
should be enlarge by the specialty andrology knowledge.
Male factor is responsible for the half of the cases of
the couple infertility in accordance to the actual data. The
andrologist should be able to predict the male fertility
based on diagnostic procedures and to manage the treatment
in case of infertility. The first step is the analysis
of the possibility for the casual treatment. The female
fertility potential should be also consider. In case of the
impossible causal treatment or the lack of success, the
andrologist should propose ART method adapted to the
needs of the treated couple. The proposed treatment plan need to be based on the female fertility potential and
answers of following questions:
1. Is the in vitro fertilization (IVF) necessary or
maybe intrauterine insemination (IUI) is adequate for
clinical status?
2. Is the micromanipulation necessary?
3. Is the sperm selection necessary?
4. Is the usage of the ejaculated sperms possible or
microsurgical epididymal sperm aspiration (MESA) or
testicular sperm aspiration (TESA) must be performed?
5. Is the pharmacological pretreatment necessary
before sperm retrieval?
6. Is the medical status of patient indication for preimplantation
genetic diagnosis (PGD)?
The presence of andrologist in the therapeutic team
allows to personalize the treatment and to reach the more
effective results. The optimal situation is the andrologist
with the gynecological background. The specialty
in gynecological endocrinology and andrology could be
considered.
Joanna Jurewicz1, Michał Radwan2, Danuta Ligocka3,
Wojciech Hanke1
PHTHALATE EXPOSURE AND MALE FERTILITY
1 Department of Environmental Epidemiology, Nofer Institute of
Occupational Medicine, Lodz, Poland; 2 Department of Gynecology
and Reproduction, “Gameta” Hospital, Rzgów, Poland; Bureau of
Quality Assurance, Nofer Institute of Occupational Medicine, Lodz,
Poland; joannaj@imp.lodz.pl
During the past decades a possible degradation in human
semen quality has been debated intensively and has
become an important public health issue. A controversial
review article of 61 studies analyzing sperm concentrations
in fertile men and in men of unknown fertility
published between 1938 and 1990 by Carlsen and coworkers
(Carlsen et al.: BMJ. 1992, 305, 609–613) showed
a significant decrease in sperm concentrations and in
semen volume. Although a tendency to decreasing semen
quality over time has not been firmly established to date,
such a possibility had raised new concerns about man
made environmental endocrine disrupting factors such
as phthalates, parabens, synthetic pyrethroids, bisphenol
A which might affect human fertility. The aim of the study
was to assess the association of phthalate metabolites
levels in urine with semen parameters (sperm concentration,
motility, morphology, CASA parameters – computer
aided sperm analysis), sperm chromatin structure,
sperm aneuploidy and reproductive hormones.
The study population consisted of 329 men who were
attending an infertility clinic and had normal semen
concentration (> 15 mln/mL) (WHO 2010, World
Health Organization). Participants were interviewed
and provided a semen sample. The phthalate metabolites
were analyzed in the urine using a procedure based
on the tandem mass spectrometry method (LC–MS/
MS). The analyzed metabolites provided information
about the exposure of men on the following phthalate:
diethyl phthalate (DEP), monoethyl phthalate (MEP),
di-(
2-ethylhexyl)
phthalate (DEHP), mono-(
2-ethyl-5-hydroxyhexyl)
phthalate (5-OH-MEHP),
mono-(
2-ethylhexenyl)
phthalate (MEHP), diisobutyl phthalate
(DBP), mono-n-butyl
phthalate (MBP), benzyl butyl
phthalate (BBzP), monobenzyl phthalate (MBzP), diisononyl
phthalate (DINP), monoisononyl phthalate (MINP).
Urinary phthalate metabolites levels were significantly
associated with a decrease in sperm motility
(5‑OH‑MEHP,
MEHP, MINP), CASA parameters (MBP),
testosterone level (MEHP) and with an increase in sperm
DNA damage (MBP) and sperm aneuploidy (MBzP, MBP,
MEHP, MEP). In view of the importance of human reproductive
health and the widespread usage of phthalates,
it is important to further investigate these correlations.
Dariusz Kałka
MEDICAL POSITIVISM – SEX AND HEART IN
A MAN´S LIFE
Cardiosexology Unit, Department of Pathophysiology Wrocław
Medical University, Poland; dariusz.kalka@gmail.com
Erectile dysfunction (ED) describes the prolonged inability
to obtain and/or keep an erection sufficient enough
to have satisfying sexual activity (the symptoms must
last for minimum three months, unless ED is linked
to trauma or a surgical procedure). It is estimated that 3
mln men in Poland are affected by ED and in the population
of patients suffering from cardiovascular diseases
(CVD) almost 80% are affected. Erectile dysfunction is
directly associated with and CVD. Moreover, ED caused
by dysfunction of the endothelium as well as atheroscleroris
of penile arteries can be the first and only symptom
of CVD with its severe complications. This situation is
determined by the diameter of vessels – penile arteries
are smaller and therefore blood flow impairment occurs
eralier than in larger coronary arteries (Montorsi et al.:
Eur. Eurol. 2003; 44: 360–364). Moreover, ED as well as
CVD are characterized by the same modifiable risk factors
such as: arterial hypertension, obesity, diabetes, hyperlipidemia,
tobacco smoking and a sedentary lifestyle.
Sexual activity, especially in patients with CVD is
often regarded as risky behaviour which could lead to life‑threatening
complications. However, opposed studies
revealed evidence that in the majority of patients after
myocardial infarction, sexual activity has a minimal
risk of complications and can be performed without
any limitations. The energetic input during this type of
activity belongs to the group of medium input, which
mobilize the cardiovascular system to moderate work,
what makes that the risk of death during sexual activity
is reasonably small (Levine et al.: Circulation 2012; 125
(8), 1058–1072). According to the guidelines of the European
Association of Urology from 2015, phosphodiesterase
inhibitors type 5 (PDE5) together with vacuum erection
devices and promising high hopes and treatment with
low energy shock-wave
therapy (LESWT), make up the
first line treatment of ED. The administration of vasorelaxing
agents directly into the corpus cavernosum belongs
to the second-line
treatment and third line treatment
is composed of the implantation of a penile prostehsis
(Hatzimouratidis et al.: 2015, http://uroweb.org/guideline/
male-sexual-dysfunction/).
Dominika Kochman1, Katarzyna Marchlewska1,
Renata Walczak-Jędrzejowska1,
Jolanta Słowikowska-Hilczer1,
Krzysztof Kula1, Stefan du Plessis2,
Renette Blignaut3, Gerhard van der Horst4
COMPARISON OF MANUAL AND COMPUTER
AIDED SPERM MORPHOLOGY ANALYSIS
1 Department of Andrology and Reproductive Endocrinology,
Medical University of Lodz, Poland 2 Division of Medical Physiology,
Stellenbosch University, South Africa 3 Department of Statistics and
Population Studies, University of the Western Cape, 4 Department
of Medical Bioscience, University of the Western Cape, South Africa;
kochmandominika@gmail.com
Sperm morphology assessment can be done in two ways:
manual and Computer Aided Sperm Morphology Analysis
(CASMA). During general semen analysis, both manual
sperm morphology and its indices are calculated: 1) teratozoospermia
index (TZI), which defines the coexistence
of head, midpiece, tail defects and excess residual
cytoplasm in abnormal spermatozoa (mean number of
defects), 2) sperm deformity index (SDI), the number of
the defects divided by the total number of normal and
abnormal spermatozoa (mean number of defects) and
3) multiple anomalies index (MAI), the mean number
of head, midpiece and tail defects per abnormal spermatozoon,
The aim of the research was to compare manual sperm
morphology analysis versus CASMA and to evaluate
sperm morphology indices as sperm quality predicting
factors.
During the research 76 semen samples were examined
according to WHO (World Health Organization)
2010. They were stained with the Papanicolau method
(modified for staining spermatozoa) and examined using
both manual and CASMA analysis (300 spermatozoa
per patient). A detailed analysis of morphology and its
indices was performed in 51 samples. Calculated indices
were also compared with other semen parameters, such
as vitality, progressive motility and total motility.
Bland and Altman analyses, as well as Passing and
Bablok regressions confirmed that there is no significant
differences between manual sperm morphology analysis
and CASMA (p = 0,48). Highly significant correlation
coefficients (rs, rank Spearman correlation coefficient)
between calculated indices versus the percentage normal
sperm morphology were respectively established (p <
0.0005, rs = −0,47 for TZI; p < 0.0000, rs = −0,76 for SDI;
p < 0.0001, rs = −0,53 for MAI) in CASMA and manual
analysis (p < 0.008, rs = −0,37 for TZI; p < 0.0001, rs =
ia0.52 for SDI; p < 0.0002, rs = −0.50 for MAI).. Similarly
significant, negative correlations were obtained between
measurements and sperm motility.
The choice of diagnostic method (manual vs. CASMA)
does not affect the outcome of sperm morphology evaluation.
There is inversely proportional correlation between
morphology sperm indices and percentages of sperm
cells with normal morphology and motility. According
to this, calculating the indices during general semen
analysis is recommended.
Małgorzata Kotula-Balak,
Laura Pardyak,
Alicja Kaminska, Anna Hejmej, Barbara Bilińska
LEIDIG CELLS IN THE LIGHT OF RECENT
RESEARCH
Department of Endocrinology, Institute of Zoology, Jagiellonian
University in Krakow, Poland; malgorzata.kotula‑balak@
uj.edu.pl
Two populations of Leydig cells develop in the gonads
of mammals: fetal Leydig cells population and adult
Leydig cells population that exists during the male lifetime.
Interestingly, in a boar the additional population
of Leydig cells, perinatal one, has been described (Geiger
et al.: Reprod Domest Anim. 1999, 17, 65–67). In that
species the number of Leydig cells as well as the level
of secreted estrogens are significantly higher in comparison
to other mammals. The particular populations
of Leydig cells have distinct morphology, biochemistry
and functions. Estrogens secreted by Leydig cells have
an effect on tissues by nuclear estrogen receptors (ER).
Recent studies indicate the involvement of membrane
estrogen receptor associated with G protein (GPER) in
the signal transmission by estrogens. On the other hand,
the involvement of estrogen‑related
receptors (ERR) in
estrogen signaling in the male reproductive system and
specific testicular cells is an unresolved issue. The role
of estrogens in the Leydig cell function is also not fully
understood. Research suggests that these hormones regulate
such cellular processes as differentiation, proliferation,
apoptosis and tumor transformation. The development
of Leydigioma can be inhibited by administration of
steroids, which inhibit proliferation and reduce aromatase
activity in these cells (Panza et al.: Am J Pathol. 2016,
186, 1328–1339). In recent years, attempts are made
to explain basic mechanisms of environmental estrogens
(xenoestrogens) action and their participation in endogenous
estrogen signaling. In Leydig cell, xenoestrogens
can modify the activity of receptors binding estrogens
through both genomic and non‑genomic
mechanisms
by modulation of action of transcription factors and proteins important for steroidogenesis. Also, the interaction
of estrogenic compounds with receptors for other
ligands such as aryl hydrocarbon receptor (AHR) is possible
(Zarzycka et al.: Theriogenology. 2016, 86, 674–686).
As a result, disturbances of hormonal balance required
for the proper functioning of reproductive system are
induced.
Supported by a grant project SONATA BIS5 2015/18/E/
NZ4/00519 from the National Science Centre
Michał Kunicki
THE IVF AND MALE FACTOR INFERTILITY
INVICTA Fertility and Reproductive Center, Warsaw, Poland; mkunicki@
op.pl
As defined by the World Health Organization (WHO),
infertility is defined as the absence of pregnancy after
a year of sexual intercourse without the use of any contraceptive
method. Epidemiological data estimate that
may affect approximately 15% of couples. Among the
causes of infertility significant role attributed to male
factor. According to some data may constitute from 25%
to 50% of the causes. The most important group of male
infertility can be defined as: primary secondary ,obstructive
and idiopathic. Male infertility is often a complex
etiology and nearly half of the causes are undiagnosed
despite performing, many hormonal, immunological,
tests and sonography examinations . Sperm quality is
still the primary method used to assess male fertility
and one of the factors for predicting the chance of pregnancy.
In 2010, the WHO defined new reference values for
sperm parameters to discriminate between normal and
abnormal semen samples. Abnormal semen are classified
as oligozoospermia (O), asthenozoospermia (A), teratozoospermia
(T), a combination of the these parameters
and lack of spermatozoa in ejaculate – azoospermia. In
the presence of male factor, described in 1992 intracytoplasmatic
sperm injection (ICSI), has an advantage over
the use of conventional /classical procedures of in vitro
fertilization (IVF) Application of this method in cases of
azoospermia, or cryptozoospermia, teratozoospermia
allowed to obtain the maximum chance of fertilization.
It is understood that ICSI is indicated when the total
number of motile sperm is <1 mln/mL. Additionally
ICSI is performed in cases where the spermatozoa are
derived from the testis/epididymis in azoospermia. It
should be emphasized, that the results of comparing
the classical IVF with ICSI in the presence of isolated
teratozoospermia (according Kruger’s strict criteria: 4%
normal sperm forms) are contradictory. In the last period,
it is believed that a better predictor of getting clinical
pregnancy is the total number of motile sperm count
(TMSC). This parameter is also better predictor for ICSI
outcomes than the parameters in accordance with the
WHO classification.
Maria Laszczyńska, Aleksandra Rył,
Katarzyna Kaczmarczyk
DO SEX ORGANS OF WOMEN AND MEN GROW
OLD IN A SIMILAR WAY?
Department of Histology and Developmental Biology, Pomeranian
Medical University in Szczecin, Poland; maria@laszczynska.pl
Female sex organs grow old in physiological conditions
in a different way than their male equivalents. In women
physiological menopause, determined by hormonal
decline, marks the beginning of progressive changes in
the ovaries, fallopian tubes and uterus. The ovarian morphology
and function alter in postmenopausal women.
The ovaries lose their ability to perform the reproductive
function. They lack ovarian follicles and the division into
cortex and medulla. Instead, corpora albicantia and epithelial
inclusion cysts can be observed. Morphological
changes in the fallopian tubes of postmenopausal women
mainly affect epithelial cells, which are shorter, less ciliated,
and atrophic. These changes may suggest that there
are retrograde lesions in the fallopian tubes, and that
this organ gradually loses its function. Morphological
changes in the uterus of postmenopausal women, on the
other hand, include atrophic lesions in the endometrium
and myometrium. However, the proliferation index of the
cells of the wall of the body of the uterus (Ki‑67)
remains
unchanged, which allows concluding that endometrium is
still ready to play its role in the reproductive process, e.g.
after hormonal stimulation. Male menopause is a term
introduced on the analogy of menopause in women. Still,
it is criticized and rejected by scientific circles. In men,
physiological aging of testes, epididymis and prostate
progresses gradually. Although, testes tend to lose their
hormonal function and spermatogenesis gets disturbed
with time, men can retain fertility to the old age. In the
testes of aging men, we observe morphological alterations
in the seminiferous epithelial and Leydig’s cells. In the
epididymis there are also epithelial changes. Men over
45 years of age can suffer from benign prostatic hyperplasia,
and are more likely to develop prostate cancer. We
should not forget that physiological ageing of male and
female sex organs may overlap with diseases resulting
from genetic predisposition, specific lifestyle and environmental
factors.
Yvonne Lundberg Giwercman
FSH‑TREATMENT
OF INFERTILE MEN
Department of Translational Medicine, Lund University, Malmö,
Sweden; yvonne.giwercman@med.lu.se
The adult testis has two functions – producing testosterone
and spermatogenesis. These processes are regulated
by the pituitary hormones follicle‑stimulating
hormone (FSH) and luteinizing hormone (LH). Apart
from its anabolic and extra gonadal actions, testosterone is also stimulating spermatogenesis via its action
on Sertoli cells. The cells are also the target of FSH,
and thus both hormones regulate spermatogenesis in
a similar indirect fashion (Huhtaniemi: Hormones, 2015,
14, 468–478). The isolated effect of FSH on human spermatogenesis
is largely unknown. While it is well known
that treatment with gonadotropins is effective in subjects
with hypogonadotroph hypogonadism, restoring
normal spermatogenesis, attempts to utilize FSH in men
with poor spermatogenesis have shown contradicting
results and since the classical biochemical picture in
male infertility is high FSH, treatment with FSH may be
regarded as of no use. However, recent placebo controlled
studies have shown that supra physiological doses (300
IU every 2nd day for 4–5 month) are needed to significantly
increase sperm counts instead of 75 or 150 IU for 3
months (Paradisi et al.: Andrologia 2014, 46, 1067–1072).
The question is if all men benefit from FSH‑treatment?
Genetic studies have shown that in men hypophysectomized
due to pituitary tumor, thus lacking FSH and
LH, but with an FSH receptor (FSHR) activating mutation,
spermatogenesis is normal (Gromoll et al.: J Clin
Endocrinol Metab. 1996, 81, 1367–1370). This finding
indicates that despite testosterone deficiency, as a consequence
of absent LH, spermatogenesis can be ongoing.
Nevertheless, also men with inactivating FSHR mutation
can have relatively normal spermatogenesis (Tapanainen
et al.: Nat Genet 1997;15:205–206). Thus, taken together,
strong FSH stimulation seems to be able to compensate
for the lack of testosterone and vice versa. Whether polymorphisms,
which by definition are genetic variants
found in at least 1% of the population can modify FSH
action and treatment is an exciting topic and could possibly
provide new insight into the role of FSH treatment of
male infertility. Two frequently studied polymorphisms
in the FSHR gene are A307T and N680S (Simoni et al.: J
Clin Endocrinol Metab. 1999, 84, 751–755). In a case‑
control study from Italy, 70 men with oligozoospermia
were treated with FSH for 3 months. Only those who
were carriers of S680 had improved sperm parameters
(Selice et al.: Int J Androl. 2011, 34, 306–312), indicating
that to be effective, FSH therapy would need stratification
according to genotype. Another study showed that
men with a certain rare FSH beta subunit could benefit
from FSH treatment (Grigorova et al.: J Clin Endocrinol
Metab 2011;96:E1534–1541). In conclusion, weather FSH
treatment of male infertility is efficient, and for whom, is
still an open question and prospective studies warranted.
Mariola Marchlewicz1, Ewa Duchnik2, Magdalena Boer2,
Małgorzata Piasecka3
DIFFERENTIATED ACTION OF ANDROGENS
ON MEN’S HAIR
Department of Aesthetic Dermatology, 2 Chair and Department
of Skin and Venereal Diseases, 3 Department of Histology and
Developmental Biology, Pomeranian Medical University, Szczecin,
Poland; mariola.marchlewicz@pum.edu.pl
Hair loss and their graying are associated with advanced
age and are supposed to be source of decreased quality
of live. Hair follicles are the unique structure that is
subject to a continuous process of growth, involution
and rest (Rossi et al.: Dermatol Ther. 2016, online;
Mirmirani et al.: Mauritas. 2015, 80, 58–62). The processes
of hair growth and their exchange are regulated
by many hormones, including androgens, wherein their
effects differ depending on the area of the body (Inoue
et al.: Mol Cell Endocrinol. 2012, 362, 19–28, Inui et al.:
Exp Dermatol. 2013; 22, 168–171). In men, androgens
present in high concentrations, stimulate hair growth
on the face, suprapubic area and chest. However, in the
skin of the head, they can cause alopecia. A lower concentrations
of androgens, in both sexes, stimulate hair
follicles of axillary and lower pubic regions (Elsner et al: Br
J Dermatol. 2012, 166, 2–5). Recent studies indicate that
the hair follicles of the various areas of the human body
react to androgens by the expression of the androgen
receptor (AR) in the hair papilla cells (DPC, dermal
papilla cells) (Yip et al.: Australas J Dermatol. 2011, 52,
81–88). AR expression and activity of 5α-reductase
type
II is much higher in the hair papilla cells of the beard
area and regions that are subject to androgenic alopecia
(Slominski et al.: J Steroid Biochem Mol Biol. 2013, 137,
107–123, Westagate et al.: Intern J Cosmet Sci. 2013,
35, 329–336). Androgenic alopecia (AGA) occurs in the
majority of Caucasian men over 40 years of age. The
essence of disease is the miniaturization of hair follicles
under the influence of androgens, in people genetically
predisposed. In the process of AGA in the hair follicle
occur the change of interaction between the DPC and
keratinocytes (Lai et al.: Arch Dermatol Res. 2012, 304,
499–510). High levels of androgens induce a loss of proliferative
properties and apoptosis of DPC, increased
expression of oxidative stress markers, like heat shock
protein-27
(HSP-27),
superoxide dismutase, catalase
(Bathta et al.: J Invest Dermatol. 2008, 128, 1088–1094).
The shorter anagen phase is observed as well as transforming
the final hair follicles to the primary hair follicles
and formation the shorter, thinner and discolored
hair (Makrantonaki et al.: Curr Opin Endocrinol Diabetes
Obes. 2009, 16, 240–245).
Urszula Marzec-Wróblewska1,
Paweł Łakota2,
Grzegorz Ludwikowski3, Adam Buciński1
AFLATOXINS IN THE SEMEN OF POLISH MEN
1Department of Biopharmacy, Nicolaus Cpernicus University
in Torun, Collegium Medicum in Bydgoszcz; 2Department of
Animal Biochemistry and Biotechnology, University of Science
and Technology, Bydgoszcz; 3Department of Clinical Andrology,Nicolaus Cpernicus University in Torun, Collegium Medicum in
Bydgoszcz, Poland; u.marzec@cm.umk.pl
The study veryfied the presence of aflatoxins in semen
of Polish men. Of the five examined aflatoxins (AF), the
presence of at least one was in 58 out of the 60 samples:
AFB1 – 80%, AFB2 – 10%, AFG1 – 72%, AFG2 and AFM1
– nearly 40% of samples. Concentrations of all examined
aflatoxins in the semen of fertile men were lower than
in semen of infertile men, but the difference was significant
only for AFG1 and AFG2. This study also indicated
that consumption of coffee, tobacco smoking and rural
domiciled might increase in concentration of aflatoxins
in human semen. For the first time, the concentrations
of aflatoxins in semen of European men were determined.
The obtained findings suggest that aflatoxins,
even at low concentrations, may have a detrimental effect
on male fertility.
Marcin Matuszewski, Wojciech Połom
MALE INFERTILITY – THE UOLOGIST
PERSPECTIVE
Department of Urology, Medical University in Gdańsk, Gdańsk,
Poland; matmar@gumed.edu.pl
Infertility treatment should be undertaken within a multidisciplinary
team. In Poland they are usually created by
efforts of andrologists, gynecologists and endocrynologists.
Urologist may play a vital additional role in such
a team, especially as far as diagnostic and therapeutic
surgical procedures are concern. What is more, due
to a very deeply based opinion among patients as well
as among family doctors about the crucial role of urology
in the medical issues connected with male reproductive
organ, doctors of this specialty are very often consulted
and their opinions are very important in the preliminary
stage of infertility consultation and treatment. It
should be also taken into account that in Poland some
political, religious and economic issues cause that some
patients coming to see the urologist are not able to count
on assisted fertilization techniques.
A lecture will include information about what should
be analyzed by the urologist when consulting an infertile
male patient. The following issues will be discussed on the
basis of European Association of Urology (ECA) guidelines,
2016: 1) testicular dysgenesis syndrome with an
importance of microcalcinosis of the testis, 2) varicocoele,
3) infections of the male accesory glands, 4) semen tract
obstruction (CBAVD – congenital bilateral absence of the
vas deferens, CUAVD – congenital unilateral absence
of the vas deferens, Muller duct cyst, ejaculatory duct
cyst), 5) TURED technique (transurethral resection of
ejaculatory duct), 6) strategy for testicle cancer patients
and 7) ejaculation disorders.
Marek Mędraś
ERGOGENIC AGENTS AND THE
HYPOTHALAMO‑PITUITARY‑GONADAL
AXIS
Department of Endocrinology, Diabetology and Isotope Therapy,
Medical University of Wroclaw; Department of Sports Medicine,
University of Physical Education, Wrocław, Poland; m.medras@
gmail.com
Professional and recreational athletes often use substances
that are to enhance sport performance. These are
mainly hormones that either directly or indirectly affect
the hypothalamo-pituitary-gonadal
axis. Testosteron and
its derivatives belong to the best known and the most
available agents for doping purposes. The problem of the
anabolic steroids-induced
hypogonadism and the medical
approach to such cases will be analysed in the lecture.
Michał Oczkowski1, Katarzyna Dziendzikowska,
Joanna Gromadzka-Ostrowska1,
Małgorzata Stachoń1,
Jacek Wilczak1, Tomasz Królikowski1, Remigiusz Mruk1,
Johan Øvrevik2, Magdalena Kowalska3,
Marcin Kruszewski4, Anna Lankoff3,4
INFLUENCE OF DIESEL ENGINE EXHAUST
FROM COMBUSTION OF SECOND
GENERATION BIODIESEL FUELS ON SELECTED
PARAMETERS OF HORMONAL REGULATION
OF REPRODUCTION IN ANIMAL MODEL
1Faculty of Human Nutrition and Consumer Science, Warsaw
University of Life Sciences (SGGW), Poland; 2Norwegian Institute
of Public Health, Oslo, Norway; 3Uniwersity named Jan Kochanowski
in Kielce; 4Institute of Nuclear Chemistry and Technique in Warsaw,
Poland; michal_oczkowski@sggw.pl
Exhaust emissions resulting from the combustion of
diesel fuels are an important source of air pollution,
and diesel engines are the largest source of solid particles
present in the atmosphere. Due to the necessity
to reduce emissions from diesel engines the interest in
the use of biofuels is increased. Therefore the aim of the
study was to determine the effect of second-generation
biofuels SHB20 (with a 20% addition of bio-components)
on selected hormonal parameters involved in the regulation
of reproductive function in animal model.
The experiment was conducted on 42 adult male
Fischer 344 rats. The animals were divided into three
groups: control and two experimental: SHB20+DPF (DPF,
with diesel particle filter) and SHB20‑DPF
(no filter).
Animals from experimental groups were inhaled air
with the exhaust from the SHB20 fuel (1.5% v/v) in
whole body inhalation chambers containing (or not) DPF.
After 7 and 28 days of experiment half of the animals
from each group were euthanized and blood and the
testis were taken for further analysis. Plasma hormone
levels of testosterone (T), dihydrotestosterone (DHT),
and luteinizing hormone (LH) were determined using
the enzyme-linked
immunosorbent assay (ELISA). In the testis 17β-estradiol
(E2), T, DHT levels and protein
levels of androgen receptor (AR), estrogen receptor type α
and β (ERα, ERβ) and aromatase (Aro) were also analyzed.
A statistically significant increase in the serum T
and DHT concentration as well as intratesticular DHT
and protein level of Aro and ERα were observed 7 days
after inhalation in SHB20-DPF
group compared with
the control group. There were no significant changes in
the analyzed parameters after 28-day
exposure.
The exposure of animals to diesel engine emission from
second generation biodiesel fuel influences on the hormonal
regulation of testicular function, which may be associated
with the action of carbon nanoparticles and/or chemical
compounds from the gaseous phase of diesel emission.
This work was supported by Polish-Norwegian
Research
Programme; Pol-Nor/
201040/72/2013.
Paweł Osemlak1,2
APPLICATION OF TESTICULAR PROSTHESES
IN BOYS
1The Chair and Clinical Department of Pediatric Surgery and
Traumatology, Medical University of Lublin; 2University Pediatric
Hospital named Prof. Antoni Gębala in Lublin, Poland; posem1@
poczta.onet.pl
Lack of the testis may be caused in developmental age by
anomaly in the form of agenesis, aplasia or atrophy, or
the necessity of removing the testis because of torsion
and necrosis, traumatic injury or tumor. Lack of the
testis or testes in a boy is an indication for implantation
of the prosthesis and the strict supervision of a pediatric
urologist and endocrinologist. The problem of the use of
implants in boys with a lack of testis is now rarely discussed
in the literature (in contrast to adulthood). The
aim of the studies was to answer to the question what
are the long-term
results of treatment and at what age
operations should be performed.
The author analyzed material of the Clinical
Department of Pediatric Surgery and Traumatology in
Lublin, which consisted of boys who were implanted
testicular prostheses from 2000 to 2010. The age at
which the operation was performed, the reason for the
absence of testis and cosmetic results (in the common
judgment of the physician, the patient and the parents)
were determined.
During 11 years in our Department 245 boys underwent
implantation of testicular prosthesis. In more than
70% they were in infant and pre‑school
age. Indications
for surgery resulted from lack of the testis caused by
anomaly in 65% of cases, and from removing the testis
because of torsion and necrosis in 20%. In the rest of
boys orchidectomy had been previously performed
because of injury or tumor. The prosthesis which had
been implanted in early childhood was exchanged one
time (for the final prosthesis) after completion of growth
of the second testis, and in some cases 2 times – before
and after puberty because of the large disparity in size
between the testis and the prosthesis. Good outcome
(prosthesis lies low in the scrotum, comparable in size
with the testis) was achieved in 97% of cases. In the rest
3% of patients prosthesis was located at the top of the
scrotum or was damage due to trauma.
The analysis gave conclusion that implantation of
the prosthesis as early as possible (i.e. in lack of testis
due to anomaly – during infant‑preschool
age, and due
to orchidectomy because of torsion or tumor – in a few
months) gives good long--term
results because the implant
works in a positive way, stimulating the scrotum to grow.
Ewa Pastuszek 1,2, Mariusz Łukaszuk 2,
Krzysztof Łukaszuk 1,2
METHODS FOR DETERMINATION OF SPERM
DNA FRAGMENTATION
1 Department of Obstetrics and Gynecological Nursing, Faculty of
Health Sciences, Medical University of Gdansk; 2 INVICTA Fertility
and Reproductive Center, Gdansk, Poland; ewa_pastuszek@gumed.
edu.pl
Diagnosis of male infertility has traditionally relied upon
microscopic assessment to determine human semen
quality. However, none of these parameters addresses
sperm DNA integrity and their clinical value in predicting
fertility is questionable. Moreover, approximately 15% of
patients with male factor infertility demonstrate normal
spermiograms.
Sperm DNA integrity is required for accurate transmission
of paternal genetic information and has been
increasingly recognized as a promising biomarker of male
infertility and a prognostic test for assisted reproductive
techniques (ART) outcomes. There are many possible
causes of sperm DNA damage including abortive
apoptosis, oxidative stress associated with male genital
tract infection, exposure to chemicals and defects of
spermiogenesis. Physical factors such as exposure to electromagnetic
radiation or scrotal heating can also induce
DNA damage in spermatozoa.
Multiple methods used to measure DNA strand breaks
have been developed and applied in clinical practice. The
current range of sperm DNA tests measure different
aspects of DNA damage and have different sensitivities.
The most common DNA integrity tests are the sperm
chromatin structure assay (SCSA), TUNEL method (the
terminal deoxynucleotidyl transferase-
mediated dUTP
nick end labeling assay), the single cell gel electrophoresis
assay (COMET), and Halo-test
(SCD, the sperm
chromatin dispersion test). Each of these tests provides
a semi-quantitative
estimate of the general state
of DNA but does not provide an indication of specific
DNA sequences that might be affected. These techniques
provide limited information on the nature of the DNA
lesions detected, and none of them can fully depict the
exact etiology and pathogenesis of impairment of sperm
DNA integrity. Nonetheless, numerous studies utilizing
the above techniques for assessing sperm DNA integrity
support the existence of a significant association
between sperm DNA damage and pregnancy outcomes.
DNA damage in the male germline is associated with
poor fertilization rates following in vitro fertilization,
defective preimplantation embryonic development, and
high rates of miscarriage and morbidity in the offspring,
including childhood cancer.
Michał Rabijewski
RECENT GUIDELINES ON MALE
HYPOGONADISM
Department of Internal Diseases, Diabetology and Endocrinology,
Warsaw Medcial University, Warsaw, Poland; mrabijewski@wum.edu.pl
Hypogonadism in men is caused by the reduced secretion
and action of testosterone, and is divided into primary
(disorders of gonadal function), secondary (hypothalamo‑pituitary
axis disorders), and peripheral (androgen receptors
polymorphism). in recent years it is also recognized
late onset hypogonadism (LOH) observed in older men,
becouse testosterone levels decrease slightly as a process
of ageing: signs and symptoms caused by this decline
can be considered a normal part of ageing. Testosterone
plays a crucial role in the development and maintenance
of male reproductive and sexual functions, body composition,
bone health, and behaviour. Signs of testosterone
deficiency depend on the age of patients, causes
and its severity. In young male hypogonadism should be
differentiated with delayed puberty while in older men
the most characteristic symptoms of testosterone deficiency
are: lack of sexual thoughts, no morning erections
and erectile dysfunctions. Testosterone deficiency negatively
affects the quality of life, sexuality and increases
metabolic disorders (diabetes, obesity, atherosclerosis
and osteoporosis). Hypogonadism is also associated
with a 3-fold
higher overall mortality and mortality
subsidiary of cardiovascular diseases. In the treatment
of hipogonadism we should take into account patients’
age and his cause. In young men is a priority to achieve
or maintain spermatogenesis while in older men we use
testosterone replacement therapy, which is safe, well
tolerated, reduces symptoms of hypogonadism, and
improves quality of life. Recently published guidelines
of the European Association of Urology (EAU) on the
diagnosis and treatment of male hypogonadism, with
the aim to provide practical recommendations on how
to deal with primary hypogonadism and ageing-related
decline in testosterone in male patients, as well as the
treatment of testosterone deficiencies. These recommendations
thoroughly discuss the indications for therapy,
contraindications, side effects, and pay special attention
to the potential impact of the therapy on the prostate and
cardiovascular risk. This is particularly important in men
with LOH because of the lack of specific symptoms, and
not established lower reference limit of testosterone level.
Ewa Rajpert-De
Meyts
IMPAIRED LEYDIG CELL FUNCTION IN
TESTICULAR DYSGENESIS SYNDROME
Department of Growth and Reproduction and EDMaRC, Copenhagen
University Hospital (Rigshospitalet), Copenhagen, Denmark; erm@rh.dk
Leydig cells (LC) are the main source of androgen in the
male throughout development and adult life. LC occur in
the human testis as three distinct populations: fetal LC
which are essential for masculinisation of the developing
fetus, neonatal LC during mini-puberty,
and adult LC,
which are responsible for maintenance of the reproductive
function in adulthood. Severe developmental disruption
of androgen signalling (e.g. androgen receptor
mutations) often leads to a disorder of sex development
(DSD), while milder impairments of the LC function
are suspected to play an important role in the pathogenesis
of testicular dysgenesis syndrome (TDS). This
syndrome comprises reproductive disorders that are
linked to poor development of the testis, including testicular
germ cell tumours (TGCT) of young adults (associated
with germ cell neoplasia in situ/carcinoma in situ,
cryptorchidism, mild hypospadias and impaired spermatogenesis,
with small testis size and presence of dysgenic
features (Skakkebæk et al.: Hum Reprod. 2001, 16,
972–978; Hoei-Hansen
et al.: J Pathol. 2003, 200, 370–
374). A very common feature in patients with TDS disorders
is LC hyperplasia and presence of large LC clusters
(micronodules), associated with increased luteinizing
hormone/testosterone ratio, which may be exacerbated
by hCG (human chorionic gonadotropin) secretion in
a subset of TGCT (Holm et al.: J Pathol. 2003, 199, 378–
386)). The presence of these nodules in testicular biopsies
of patients with unilateral TGCT, in combination with
their reproductive hormone profiles, can predict earlier
appearance of hypogonadism in these men (Tarsitano
et al.: new data). Micronodules are heterogeneous and
contain LC at different maturation stages, distinguished
by mutually exclusive expression of DLK1 (a marker of
progenitor and immature LCs) or INSL3 (insulin‑like
peptide 3 – a marker of normal adult LC) (Lottrup et al.:
Hum Reprod. 2014, 29, 1637–1650), and different content
of Reinke crystals (Sørensen et al., new data). Our analysis
of the global gene expression in microdissected LC
micronodules in comparison to fetal and adult LC populations
revealed several novel LC maturation markers, and
the profiles suggest that the changes in LC morphology
and function observed in patients with TDS are linked
to the increased adult LC renewal rather than the persistence
of foetal cell population (Lottrup et al., new data).
Stefan S. du Plessis
ROLE AND EFFECT OF REACTIVE OXYGEN
SPECIES IN MALE REPRODUCTION
Division of Medical Physiology, Faculty of Medicine and Health
Sciences, Stellenbosch University, Tygerberg, Republic of South
Africa; ssdp@sun.ac.za
Reactive oxygen species (ROS) play an important role in
male fertility. Overproduction of ROS has been associated
with a variety of male fertility complications, including
leukocytospermia, varicocele and idiopathic infertility.
The subsequent oxidative insult to spermatozoa can manifest
as insufficient energy metabolism, lipid peroxidation
and DNA damage, leading to loss of motility and
viability. However, various studies have demonstrated
that physiological amounts of ROS play important roles
in the processes of spermatozoa maturation, capacitation,
hyperactivation and acrosome reaction. It is therefore
crucial to realize and define the delicate redox balance
in order for a better understanding of both the positive
and negative effects of ROS production on fertilizing
ability. This presentation will discuss the role of ROS
in male reproduction and explore the impact and contribution
of various lifestyle factors. Finally, possible
treatment options, the latest in ROS diagnostics and
reference values will be alluded to.
Iwona Rotter1, Aleksandra Rył2, Katarzyna Kaczmarczyk2
SHOULD MEN OVER 50 YEARS OF AGE TAKE
MAGNESIUM AND ZINC SUPPLEMENTATION?
1Department of Medical Rehabilitation; 2Department of Histology
and Developmental Biology, Pomeranian Medical University in
Szczecin, Poland; iwrot@wp.pl
Magnesium (Mg) is a cofactor for over 300 various
enzymes in a human organism. It is mainly accumulated
in bones, which is where 64% of the total Mg can be
found. Mg deficiency favors the development of insulin
resistance and type 2 diabetes, as well as lipid metabolism
disorders, hypertension, and metabolic syndrome
(Swaninathan: Clin Biochem Rev. 2003, 24,47–66; Huang
et al.: Nutr J. 2012, 13, 41). Considering that age‑related
hypogonadism is more common in men with metabolic
disorders, hypomagnesemia seems to have the potential
of contributing to testosterone deficiency. In their
study of elderly men, Maggio et al. (Int J Androl. 2011, 34,
594–600) demonstrated a positive correlation between
the levels of Mg and anabolic hormones, including total
testosterone (TT). Cinar et al. (Biol Trace Elem Res. 2011,
149, 18 –23) found evidence for a positive impact of Mg
supplementation on TT and free testosterone (FT) levels.
The increase in the level of testosterone was higher in
those men who combined Mg supplementation with
physical activity (Maggio et al.: Int J Endocrinol. 2014,
2014-reductase
inhibitor, it regulates the concentration
of dihydrotestosterone – a derivative of testosterone –
whose surfeit plays a part in prostatic hyperplasia (Fahim
et al.: Andrology. 1993, 25, 369–775; Croxford et al.: J Nutr.
2011, 141, 359–365). Available studies show that Zn deficiency
is associated with a decrease in the testosterone
level, fertility problems, and the decline in the number
and vitality of spermatozoa (Prasad: Mol Med. 2008, 14,
353–357; Yamaguchi et al.: Proc Natl Sci USA. 2009, 30,
10859–10864). According to Prasad (2008), Zn supplementation
in elderly men with a slight TT deficiency
improves TT levels.
Our study of men between 50 and 75 years of age
revealed a statistically significant relationship between
Mg and TT levels, however, a similar connection between
Mg and Zn was not observed. Mg supplementation seems
justified in men over 50 years of age, especially those with
metabolic disorders. More in-depth
analysis is needed
to find out whether supplementation with Zn is equally
reasonable.
Waldemar Różański
OWN EXPERIENCE IN THE IMPLANTATION OF
PENILE PROTHESIS
II Department of Urology, Medical University of Lodz, Poland; waldemar.
rozanski@umed.lodz.pl
Erectile dysfunction (ED) is defined as persistent inability
to achieve and maintain a full erection of the penis
allowing for satisfactory intercourse. Erectile dysfunction
is the second, after the premature ejaculation, sexual
ailment reported by men (Lindan: N Engl. J Med. 2007,
357, 762–774). According to Porst and Sharlip (Standard
Practice in Sexual Medicine. 2006, 43–48) erectile dysfunction
intensity varies depending on the age of the
patient and is reported from 2% to 28.9% in the population
of males between 30–39 year and from 41.9%
to 83% in males between 70–80 year. The risk factors
for ED include cardiovascular disease, sedentary lifestyle,
obesity, smoking, hypercholesterolemia, metabolic
disorders, diabetes, and iatrogenic damage after surgery
on the pelvic organs (urological, surgical) (Lee: BJU Int.
2011, 107, 956–960).
First‑line
oral medications administered in erectile
dysfunction in men are phosphodiesterase type 5 (PDE5)
inhibitors: sildenafil (Viagra), vardenafil (Levitra), tadalafil
(Cialis). Other modes of treatment that are commonly
used include alprostadil (Caverject) injections into the
corpora cavernosa of the penis and the use of vacuum
to induce penile erection. In case of drug treatment insufficiency
the treatment of choice is the implantation of
corpora cavernosa prosthesis (Bettolchi: J Sex Med. 2010,7, 304–309; Minervini: BJU Int. 2006, 97, 129–133).
Complications that may occur after corpora cavernosa
prosthesis implantation are following: infection and
further need to replace the prosthesis, technical damage
of the prosthesis, leakage of prosthesis, damage during
aircraft flights at supersonic speed, getting bubbles to the
prosthesis, corpora cavernosa erosion, urethral erosion
(Henry: J Urol. 2005, 173, 89–92; Carson: Int J Impot
Res. 2003, 15, 139–146).
Two standardized questionnaires are commonly
used to assess the sexual quality of life in patients
with erectile dysfunction: IIEF-
5 (International Index
of Erectile Function) and SHIM (International Index
of Erectile Function). Comparison of the length of the
penis in patients treated with injections (papaverine,
phentolamine, prostaglandin E1) with the subjects
who underwent corpora cavernosa prosthesis implantation
was carried out after 6 weeks, 6 and 12 months
after surgery. Shortening of the penis in patients with
implanted corpora cavernosa prosthesis compared
to those treated with injections has been observed. The
length of the penis after injection was 13.2 +/-
0.4 cm.
The length of the penis after prosthesis implantation
was: after 6 weeks 12.4 +/-
0.3 cm; after 6 months
12.5 +/-
0.3 cm and after 12 months 12.5 +/-
0.4 cm.
According to the SHIM questionnaire the quality of
sexual life after implantation of the corpora cavernosa
prosthesis is satisfactory, despite penis shortening.
Patients with diabetes (n = 84) and after radical prostatectomy
(n = 96) were compared. The findings of 12
month‑observations
were following: prosthesis infection
took place in third patients, prosthesis erosion
occurred in one patient, problems with the filling of
the prosthesis (not observed during implantation) was
noted in one patient. The average length of the penis
of examined patients, obtained on the basis of questionnaires,
were following: IIEF-
5 – before surgery 8.2
+/-
4.0 cm, after treatment 20.6 +/-
2.7 cm; EDITS after
treatment 72.2 +/-
20.7 cm (Antonini et al.: Int J Impot
Res. 2016, 28, 2–8).
From 2013 to 2015 in the 2nd Department of Urology
of Medical University in Lodz prostheses were implanted
in three patients after radical prostatectomy. Evaluation
of the sexual quality of life in patients with erectile
dysfunction was performed on the basis of IIEF-
5 and
SHIM questionnaire. Responding to the IIEF questionnaire,
all patients reported no or sporadic occurrence of
erection and lack of sexual activity with a partner. After
prosthesis implantation, only one patient reported that
his relations are satisfactory in more than half times.
The other two patients were fully satisfied with sexual
intercourses with partners after prosthesis implantation.
Responding to the SHIM questionnaire, two
patients reported full satisfaction of intercourse to be
completed. One patient stated that the intercourse after
prosthesis implantation brings greater satisfaction his
partner than himself.
Aleksandra Rosiak1,4, Kamil Gill1, Monika Frączek3,
Joanna Jakubik1, Maciej Kurpisz3, Rafał Kurzawa2,4,
Małgorzata Piasecka1
EFFECTS OF INCREASED MALE AGE ON SPERM
CHROMATIN MATURITY
1Department of Histology and Developmental Biology, 2Department
of Procreative Health, Pomeranian Medical University, Szczecin;
3Institute of Human Genetics Polish Academy of Sciences, Poznan;
4VitroLive Fertility Clinic, Szczecin, Poland; rosiak.aleksandra@
yahoo.com
Abnormal standard semen parameters as well as molecular
changes of sperm chromatin can appear with
increasing male age (> 35 y). However, the influence of
paternal age on semen parameters are still unclear and
controversial (Sharma et al.: Reprod Biol Endocrinol. 2015,
13, 35). The study was designed to comprehensive evaluate
of sperm chromatin maturity (n = 1042) by means
of chromomycin A3 (CMA3), aniline blue (AB), toluidine
blue (TB) and TUNEL (terminal deodeoxynucleotidyl
transferase-mediated
dUTP nick end labeling) assay.
The men ≥ 40 and < 40 y did not differ significantly in
sperm concentration (median: 40.30 vs. 35.35 mln/mL),
total sperm count (median: 115.20 vs. 115.50 mln), its
total motility (mediana: 57.50 vs. 59.00%), morphology
(median: 4.00 vs. 4.00%), vitality (median: 69.00 vs.
68.00%), concentration of leucocytes (median: 0.00 vs.
0.00 mln/mL) and round cells (median: 0.10 vs. 0.16
mln/mL) (according to WHO, 2010). However, there were
differences in volume of ejaculate (median: 3.00 vs. 3.50
mL), percentages of TUNEL-positive
(median: 20.25 vs.
12.30%), AB‑positive,
(median: 15.00 vs. 13.00%) and
TB‑positive
(median: 17.00 vs 14.00%) sperm cells. There
was no difference in percentage of CMA3‑positive
sperm
cells (median: 16.00 vs. 17.00%). Total sperm count, sperm
morphology, motility and leucocyte concentration negatively
correlated with the male age (respectively, rs = −0.092,
rs = −0.163, rs = −0.106, rs = −0.096). Positive correlations
were found between teratozoospermia index, AB-positive
cells, TB-positive
cells and TUNEL-positive
cells
(respectively, rs = 0,116, rs = 0,088, rs = 0,148, rs = 0,229).
Although CMA3-postitive
cells did not correlate with age.
Obtained data suggest no significant changes in
standard semen characteristics of studied men ≥40
y, whereas molecular sperm chromatin abnormalities
expressing as its abnormal structure and condensation
can appear.
Bongekile Skosana, Suzel M. Hattingh, Ingrid Webster,
Amanda Lochner, Gerhard van der Horst,
Yapo Guillaume Aboua, Stefan S Du Plessis
OBESITY-RELATED
TESTICULAR
HISTOLOGICAL CHANGES EXPLAINED BY
PROTEOMICS
Division of Medical Physiology, Faculty of Medicine and Health Sciences,
Stellenbosch University, Republic of South Africa; bts@sun.ac.za
Obesity has become widespread (Cabler et al.: Asian J Androl.
2010, 12, 480–489) and has been linked to male infertility,
where it results in poor sperm quality (Du Plessis et al.: Nat
Rev Urol. 2010, 7, 153–161) and changes in the structure
and function of reproductive organs. Mechanisms
through which these changes occur are still open to further
explanation. By using proteomics, this study aims
to quantify differentially expressed proteins within the
testes of obese male rats, making it possible for mechanisms
of disease development to be further elucidated.
Forty male Wistar rats (200–220 g) were equally and
randomly divided into two groups: control animals fed
normal rat chow and a diet group fed a high caloric diet.
After sixty weeks, animals were sacrificed by euthanasia.
Testes were excised and prepared for histological and
proteomic analysis. Proteomics was performed using an
Orbitrap Mass Spectrometer (LC‑MS/
MS). Proteins with
≥ 2 unique peptides were quantified; a 1.5 fold change in
expression and p value < 0.05 were considered significant.
In histological sections, seminiferous tubules of obese
animals showed degeneration of the pseudostratified
epithelial layer, evidenced by reductions in epithelial
height (95.85 ±1.442 vs. 71.44 ±1.101; p < 0.0001) and
increased luminal diameter (147.7 ±2.976 vs. 196.3
±3.477, p < 0.0001). Proteomic data showed significant
fold increases in oxidative stress related proteins, namely
glutathione peroxidase 3 (2.2), and inflammation-related
proteins including Fibronectin 1 (3.3). Metallothionein-3,
a negative regulator of cell development, showed a 1.5 fold
increase compared to control. Histone H1.1, expressed
by pachytene spermatocytes, was overexpressed in obese
animals.
Structural changes in the testes of obese male rats can
be attributed oxidative stress, resulting in inflammatory
processes that lead to damage of cellular structures. Cell
development is dysregulated due to the overproduction
of Metallothionein-3,
prohibiting proper growth and
survival. The overexpression of Histone H1.1 may point
towards an arrest of some germ cells at the pachytene
spermatocyte stage, as histological observations show
less cells reaching spermatid stage.
Obesity causes structural changes within male testes,
which proteomic data shows to be related to oxidative
stress and inflammation, resulting in damage to organ
structures and male germ cells.
Jolanta Słowikowska-Hilczer
RECOMMENDATIONS CONCERNING
KLINEFELTER’S SYNDROME
Department of Andrology and Reproductive Endocrinology, Medical
University of Lodz, Lodz, Poland; jolanta.slowikowska‑hilczer@
umed.lodz.pl
The most common (0.1–0.2% male newborns) genetic
cause of infertility and hypergonadotropic hypogonadism
in men is Klinefelter’s syndrome. It develops as a result
of numerical aberrations of chromosome X (usually 47,
XXY). In childhood and early puberty function of the
hypothalamic-pituitary-testes
axis is usually correct.
From the middle of puberty (GIII stage by Tanner’s classification)
clinical hypergonadotrophic hypogonadism
develops due to the progressive degeneration of the
structure and impaired testicular function (Wikström and
Dunkel: Horm Res. 2008, 69, 317–326). The phenotype is
diverse, ranging from almost normal to far below normal.
Phenotype in neonates with Klinefelter’s syndrome are
usually normal male. Often the only clinical feature
are small testes, which are usually identified only after
puberty. Patients with this syndrome are mostly infertile,
but in about half the cases, it is possible to find spermatozoa
in the testes (Rohayem et al.: Andrology. 2015, 3, 5,
868–875). A higher risk includes also breast cancer, metabolic
syndrome, cardiovascular disease, osteopenia / osteoporosis,
autoimmune diseases. In addition there are in
varying degrees cognitive, social, behavioral and learning
difficulties. Early diagnosis is recommended to implement
early therapy and prevention against associated
diseases (Aksglaede et al.: Am J Med Genet C Semin Med
Genet. 2013 163C, 1, 55–63; Purwin and Słowikowska-Hilczer:
Advances in Andrology Online 2015 2, 2,
12–24; Nieschlag et al.: Andrology. 2016, 4, 3, 545–549).
Paweł Wiechno
LOW TESTOSTERONE LEVELS IN MEN WITH
CANCER
Uro-Oncology
Department, Memorial Cancer Centre named Maria
Skłodowska-Curie,
Warsaw, Poland; wiechno@gmail.com
Cancer and its treatment can lead to testosterone deficiency
with associated symptoms. Data from the literature
and our own data on prevalence of testosterone
deficiency in men treated for malignant disease and its
health effects were analyzed.
The risk of testosterone deficiency in patients after
the treatment of testicular cancer is between 5% and
25%, but more than 10. years after orchiectomy testosterone
levels do not differ from those for the healthy
population. Higher percentage of compensated hypogonadism
is observed and that state is quite chronic (Nord
et al.: Eur Urol. 2003, 44, 322–328). The clinical image
includes, in addition to obvious reduction of the volume
of hormonally active tissue, also damage of Leydig cells
caused by cisplatin (Berger et al.: Br J Cancer. 1996, 73,
1108–1114). It is confirmed, that hypogonadism affects
patient’s well-being
after unilateral orchiectomy. There
are no studies on the results of testosterone supplementation
in this group of men. Prostate cancer is an
example of the androgen dependent tumour. Indication
for surgical or pharmacological castration is metastatic
prostate cancer (Parker et al.: Ann Oncol. 2015, 26, suppl.
5, 69–77). Moreover, adjuvant hormonotherapy combined
with radical radiotherapy in men with high risk of
progression is beneficial regarding the overall survival
(D’Amico et al.: JAMA. 2008, 299, 289–295). However,
such a treatment is associated with the risk of lipid disorders,
diabetes, bone loss and cardiovascular events
(Mottet et al.: Guidelines on Prostate Cancer. European
Association of Urology, 2015). The percentage of men
with testosterone deficiency in end-stage
of cancer
is estimated at 40–90%. Testosterone deficiency in
these patients is a component of the cachexia (Fuoco:
Ecancermedicalscience. 2015, 9, 561).
Testosterone deficiency and disorders of the pituitary-gonadal
axis are common among men suffering from
cancer. Androgen deficiency is associated with significant
clinical effects impairing the men’s quality of life.
Jan Karol Wolski1,2, Grzegorz Kapuściński1, Katarzyna
Kozioł1, Adriana Strzałkowska1, Martyna Ignaszak1,
Jan Lewandowski1, Robert Wyban1, Marta Izdebska-Książek1,
Marta Radziewicz-Pigiel1,
Ewa Stachowiak1, Karina Gawron1,
Katarzyna Klimczewska1, Karolina Kubiak1, Karolina
Leśniewska1, Sylwia Trubacz1, Hanna Marszał1, Marcin Ligaj3,
Dariusz Starczewski1, Bogdan Biarda1, Piotr Lewandowski1
M-TESE
– OUR EXPERIENCE IN THE YEARS
2010–2016
1Medical Clinic Novum, Warsaw, Poland; 2 Uro-Oncology
Department, Memorial Cancer Center named Maria Sklodowska-Curie,
Warsaw, Poland; 3 Pathology Department, Memorial Cancer
Center named Maria Skłodowska-Curie, Warsaw, Poland; jkwolski@op.pl
In 1999 Schlegel was first described testicular biopsy with
the use of the operating microscope (M-TESA,
microsurgical
testicular sperm extraction) in men with nonobstructive
azoospermia (NOA), with negative biopsies
in the past, with the intention of obtaining sperm
to assisted reproduction IVF-ICSI
(fertilization in vitro-intracytoplasmic
sperm injection). The authors apply
this technique successfully for the first time in Poland
in October 2012. The objective of our studies was to evaluate
the effectiveness of a biopsy of the M-TESE
– sperm
obtaining for IVF-ICSI.
Biopsies M-TESE
was performed in nonhomogenic
group of 108 men suffering from the NOA; age 17–44
(average 32 yr). M-TESE
was the first biopsy for 14 men.
Klinefelter syndrome 47 XXY, disorders of sex development
46, XY (DSD) and post-transurethral
resection
of ejaculatory ducts (post-TURED)
were found in 11, 2
and 1 subject (respectively) out of these 14. M-TESE
was
the second biopsy in 89 men and was third biopsy in 5
subjects. In all patients, hormonal stimulation of spermatogenesis
(6–12 weeks, androgen + antiestrogen with
vasodilators, trace elements and vitamins) was carried out
before the biopsy (Adamopulous et al.: Fertil Steril. 1995,
64, 818–824). The levels of luteinizing hormone (LH),
follicle‑stimulating
hormone (FSH) and testosterone were
monitored. All M‑TESE
was performed under general
anesthesia, as a “one day surgery”. Microscopes Seiler
Evolution XR6, Carl Zeiss S7, Leica M860 2 x 2 (20–25x)
were used. From both gonads sampled slices with 3 levels.
Each slice was placed in liquid nitrogen (−196oC) to the
future IVF with prior ad hoc assessment for the presence
of sperm. Moreover, routine histological examination
was performed.
The sperm cells were found in 28 out of 95 patients
(29.5%) but were not observed in men with Klinefelter
syndrome and with DSD. Achieved 16 pregnancies,
6 miscarriages were recorded and 6 children were born
from 37 performed IVF procedures. Our results indicate,
that testicular biopsy by using the operating microscope
increases the chance of finding sperm in men with nonobstructive
azoospermia and allows for enrolling the
men in IVF-ICSI
procedure.
Jan Karol Wolski
VITAMINS AND MICRONUTRIENT IN THE
TREATMENT OF MALE INFERTILITY
Medical Clinic Novum, Warsaw, Poland; kwolski@op.pl
In the last 50 years is observed the increasing participation
of the male factor in childlessness. It is estimated
that up to 50% of the failures in reproduction lies with the
man. Next to the urogenital malformations, varicocele,
choked roads out semen, neurogenic ejaculation disorders
most cases of male infertility are abnormal spermatogenesis
and sperm. External factors, such as smoking,
obesity, simple, environmental pollution, inflammation
within the genitourinary system conducive to the occurrence
of oxidative stress. This is a significant cause of
the damaging sperm, estimated at 30–80%. The male
generative cells are very sensitive to the effects of reactive
oxygen species, which are associated with oxidative
stress. Sperm cell membrane contains high amounts
of unsaturated fatty acids, which are subject to oxidation,
and in the cytoplasm is low levels of neutralizing
enzymes.
Supply of oral vitamins and micronutrients (vitamins
A, E, C, B, selenium, zinc, copper, chromium) may
improve sperm quality by reducing oxidative stress associated
with the level of reactive oxygen species. Many
publications show a benefit from the use of this therapy.
Most recent Cochrane analysis of 2014 (Showell et al.:
Cochrane Database Syst Rev. 2014) states that there is
evidence though relatively low quality in the case of four
small randomized controlled trials. They suggest that
antioxidant supplementation in men with reduced fertility
beneficial effects on semen quality and can improve
the number of live births. We need therefore further
large, well designed, double randomized placebo control
trials using commercial products specially designed for
the treatment of male infertility.
Frederick C.W. Wu
FUNCTIONAL CHANGES IN THE
HYPOTHALAMIC-PITUITARY-TESTICULAR
(HPT) AXIS IN AGEING MEN – LONGITUDINAL
DATA FROM THE EUROPEAN MALE AGEING
STUDY (EMAS)
Andrology Research Unit, Division of Endocrinology, Diabetes &
Gastroenterology, School of Medical Sciences, Faculty of Biology,
Medicine and Health, University of Manchester, Manchester, United
Kingdom; frederick.wu@manchester.ac.uk
Ageing is associated with multi-level
alterations in the
hypothalamic-pituitary-testicular
(HPT) axis function
affecting both the steroidogenic and gametogenic compartments.
It is not clear how this aligns with the clinical
scenario of symptomatic older men presenting with
low or low normal testosterone. Whether the clinico‑pathological
constructs of hypogonadism, long established
in young patients, can be translated to underpin
the management of the burgeoning number of middle
aged and older men being referred for possible androgen
deficiency, is also uncertain.
I will present prospective follow-up
data in the observational
cohort of >3,000 men from the European Male Ageing
Study (EMAS), which describe the natural history of two
divergent tracks of HPT axis dysfunctional that underlie
the age-related
decline in testosterone (T), based on the
physiological classification of hypogonadotrophic (secondary)
or hypergondodotrophic (primary) ‘hypogonadism’.
The main findings are: the vast majority of men in the
general population do not become hypogonadal during
ageing. Obesity is associated with the development of
sexual symptoms with chronic but reversible hypothalamic/
pituitary suppression (equivalent to secondary
‘hypogonadism’) independent of age, commonly affecting
middle-aged
rather than elderly men. In contrast, the
less common equivalent of primary ‘hypogonadism’
found mainly in men over 70 year of age show a more
severe phenotype with sexual and physical symptoms,
insulin resistance and co-morbidity
compatible with
either androgen deficiency or general health deterioration.
It is also relatively common to encounter elevated
luteinizing hormone (LH) with normal testosterone in
ageing men – this can be considered to be a state of compensatory
‘eugonadism’ since they do not have definite
features of androgen deficiency, but amongst them will be
a small minority who eventually transitions to primary
‘hypogonadism’.
It is important to be reminded that epidemiological
associations cannot differentiate between the
co-
linear symptoms of androgen deficiency and the
non-
specific features of ageing-related
disability and
chronic illness or infer causality in the presence of
borderline low testosterone levels. Nevertheless, our
data can improve our understanding of the aetiology
and potential clinical significance of the age‑related
changes in the HPT axis thereby informing current
clinical practice.
KONFERENCJA POLSKIEGO TOWARZYSTWA ANDROLOGICZNEGO – 19. DZIEŃ ANDROLOGICZNY
KONFERENCJA POLSKIEGO TOWARZYSTWA
ANDROLOGICZNEGO – 19. DZIEŃ ANDROLOGICZNY
SYMPOSIUM OF SCIENTIFIC TRAINING OF THE POLISH
SOCIETY OF ANDROLOGY – 19th DAY OF ANDROLOGY
Kraków, 17–18.11.2017; www.pta2017.pl
Szanowni Państwo
Mamy zaszczyt i przyjemność zaprosić na Konferencję
Polskiego Towarzystwa Andrologicznego – 19. Dzień
Andrologiczny, która odbędzie się w dniach 17–18 listopada
2017 r. w Krakowie w hotelu Qubus.
Konferencja będzie kolejną okazją do spotkania
i wysłuchania polskich i zagranicznych ekspertów
w zakresie andrologii, ale także urologii, endokrynologii,
medycyny rozrodu, diagnostyki laboratoryjnej i biologii
rozrodu, co pozwoli na poszerzenie wiedzy i ułatwi zdobycie
umiejętności koniecznych w diagnostyce i leczeniu
chorych z problemami męskiego układu płciowego.
Myśl przewodnia konferencji koncentruje się wokół
zdrowia i płodności mężczyzn, dlatego poruszana będzie
problematyka etiopatogenezy, diagnostyki i leczenia
zaburzeń w tym zakresie.
Zapraszamy do udziału nie tylko członków Polskiego
Towarzystwa Andrologicznego, ale również wszystkich
zainteresowanych andrologią kliniczną i doświadczalną.
Intencją organizatorów jest wymiana doświadczeń i zainicjowanie
współpracy w środowisku interdyscyplinarnym.
Mamy nadzieję, że konferencja stworzy Państwu możliwości
płynące ze współpracy lekarzy klinicystów, diagnostów
i badaczy reprezentujących nauki podstawowe.
Bogaty program naukowo-szkoleniowy przyczynił się
do sukcesu poprzednich Dni Andrologicznych, których
coroczna organizacja stała się już tradycją.
Mamy nadzieję, że tak będzie i tym razem w Krakowie.
Prof. dr hab. Jolanta Słowikowska-Hilczer
Przewodnicząca Komitetu Naukowego
Prof. dr hab. Barbara Bilińska
Przewodnicząca Komitetu Organizacyjnego
Dear Sir or Madam,
We have the honour and pleasure to invite you to the
Conference of the Polish Society of Andrology – 19th Day
of Andrology, which will be held in November 17–18,
2017 in Cracow at the Qubus Hotel.
The conference will be the next opportunity to meet
and listen to Polish and foreign experts in the field of
andrology, but also urology, endocrinology, reproductive
medicine, laboratory diagnostics and reproductive
biology that will enhance your knowledge and help
acquire the necessary skills in the diagnosis and treatment
of patients with problems of the male reproductive
system.
The conference will focus on the health and fertility
of men, especially pathogenesis, diagnosis and treatment
of disorders in this regard.
We invite not only the members of the Polish Society
of Andrology but also anyone interested in clinical and
experimental andrology. The intention of the organizers
is to exchange experiences and initiate interdisciplinary
collaboration.
We hope that the conference will create the possibility
of cooperation among clinicians, diagnosticians
and researchers representing the basic sciences. A rich
scientific program contributed to the success of previous
Days of Andrology that annual organization has already
become a tradition.
We hope that it will be the same in Cracow.
Prof. Jolanta Słowikowska-Hilczer
President of Polish Society of Andrology
Prof. Barbara Bilińska
President of Organizing Committee

INSTRUKCJE DLA AUTORÓW_INSTRUCTIONS FOR AUTHORS
Informacje ogólne
Czasopismo „Postępy Andrologii Online” jest periodykiem
ukazującym się co 6 miesięcy (półrocznik) w wersji elektronicznej.
Czasopismo publikuje prace z zakresu fizjologii
i patologii męskiego układu płciowego. Tematyka
obejmuje zarówno zagadnienia kliniczne (etiopatogeneza,
diagnostyka i terapia zaburzeń), jak i wyniki
badań doświadczalnych. Czasopismo przyjmuje prace
oryginalne, poglądowe oraz kazuistyczne. Ponadto będą
zamieszczane listy do Redakcji, streszczenia i tłumaczenia
publikacji anglojęzycznych, informacje o działalności
Polskiego Towarzystwa Andrologicznego,
komunikaty informujące o konferencjach naukowych
oraz sprawozdania i streszczenia prezentacji z kongresów
i konferencji naukowych w Polsce i zagranicą.
Zasady recenzowania prac
Nadsyłane manuskrypty wstępnie ocenia Komitet
Redakcyjny czasopisma. Manuskrypty niekompletne
lub przygotowane w stylu niezgodnym z zasadami
podanymi poniżej Redakcja odsyła Autorom bez oceny
merytorycznej. Pozostałe artykuły zostają zarejestrowane
i są następnie przekazywane do oceny dwóm niezależnym
recenzentom, z zachowaniem anonimowości
autorów pracy i recenzentów. Przyjęcie pracy odbywa
się na podstawie pozytywnych opinii obydwóch recenzentów.
W przypadku rozbieżnych opinii Redakcja prosi
o opinię trzeciego recenzenta. Autorzy zobowiązani
są odnieść się do uwag recenzentów w ciągu 3 tygodni
od daty otrzymania recenzji. Wszelka korespondencja
z Autorami odbywa się drogą e-mailową.
Konflikt interesów
W pracy powinny być ujawnione wszelkie zobowiązania
finansowe między Autorami i firmą, której produkt ma
istotne znaczenie w nadesłanej pracy. Informacje te nie
będą ujawniane recenzentom i nie wpłyną na decyzję
o opublikowaniu pracy. Po akceptacji manuskryptu
informacje o źródłach finansowania powinny być umieszczone
w stopce na pierwszej stronie manuskryptu.
Informacje o prawach autorskich
Autor/autorzy przesyłając manuskrypt wraz z ilustracjami
i tabelami, automatycznie i nieodpłatnie przenosi/
przenoszą na „Postępy Andrologii Online” i Polskie
Towarzystwo Andrologiczne wszelkie prawa autorskie
do wydawania oraz rozpowszechniania nadesłanych
materiałów we wszystkich znanych formach i na wszystkich
znanych polach eksploatacji, bez ograniczeń terytorialnych
i językowych, pod warunkiem, że materiały
te zostaną zaakceptowane do publikacji. Publikacja
w całości ani żadna z jej części nie może być powielana,
ani upowszechniana w jakikolwiek mechaniczny lub
elektroniczny sposób bez pisemnej zgody Redaktora
Naczelnego.
Ochrona danych osobowych
Nazwiska i adresy e-mail
wprowadzane do serwisu czasopisma
„Postępy Andrologii Online” będą wykorzystywane
wyłącznie do celów publikacji ich prac i nie będą
udostępniane do żadnych innych celów.
Sposób przygotowania manuskryptu
Nadsyłane prace mogą być pisane w języku polskim
lub angielskim.
Wszystkie prace odnoszące się do badań na ludziach
lub zwierzętach muszą być zaakceptowane przez odpowiednią
Komisję Etyczną. Informacja o zgodzie właściwej
Komisji Etycznej na przeprowadzenie badania i świadomej
zgodzie pacjentów na udział w badaniu powinna
znaleźć się w rozdziale „Materiał i metody” w każdej
pracy. Autorzy opisów przypadków są zobowiązani
do nieujawniania personaliów opisywanych pacjentów,
a w przypadku fotografii umożliwiających identyfikację
pacjenta zawsze należy uzyskać pisemną zgodę pacjenta
na publikację jego wizerunku.
Liczbowe wartości i symbole wszystkich wielkości
winny być podane wg międzynarodowego układu jednostek
SI.
W manuskrypcie należy używać 12-punktowego
fontu
Times New Roman, z zachowaniem 1,5-punktowego
odstępu między wierszami i marginesami 2,5 cm
z każdej strony. Strony należy numerować kolejno,
zaczynając od tytułowej. Numery stron należy umieszczać
w dolnym, prawym rogu każdej strony. Należy
zachować następujący układ: strona tytułowa (osobna
strona), stosowane skróty (osobna strona), streszczenie
i słowa kluczowe (do 5) w języku polskim i angielskim
(osobna strona), tekst podstawowy, piśmiennictwo,
podpisy rycin i tabel, materiał ilustracyjny.
Strona tytułowa powinna zawierać: stopień
naukowy, imię i nazwisko autora (autorów) wraz z afiliacją,
adres e-mail,
kontaktowy numer telefonu każdego
autora (należy podkreślić nazwisko autora do korespondencji),
tytuł artykułu i skróconą wersję tytułu (w języku
polskim i angielskim) (40 znaków ze spacjami).
Spis skrótów należy podać w języku polskim
i angielskim w jednym akapicie, według kolejności alfabetycznej
np.:
hESC – ludzkie embrionalne komórki macierzyste
(ang. human embryonic stem cells); RFT – reaktywne
formy tlenu (ang. reactive oxygen species); RT‑PCR
–
łańcuchowa reakcja polimerazy z wykorzystaniem
odwrotnej transkryptazy (ang. reverse transcription
polymerase chain reaction); itd.
Skróty użyte w tekście podstawowym po raz pierwszy
należy podać w pełnym brzmieniu. Nie należy rozpoczynać
zdania od skrótu.
Streszczenie powinno zawierać najistotniejsze
informacje wprowadzające czytelnika w publikowaną
tematykę oraz wnioski końcowe (do 250 wyrazów). Nie
należy używać skrótów.
Tekst podstawowy
Artykuł poglądowy powinien zawierać przegląd informacji
z danej tematyki. Zaleca się uwzględnienie prac
publikowanych w ostatnich 5–10 latach (ok. 60%) oraz
w latach wcześniejszych (ok. 40%). Dopuszczalna liczba
pozycji piśmiennictwa to 70. W manuskrypcie autorzy
powinni zawrzeć własne przemyślenia, opinie i wnioski,
a istotne informacje przedstawić w postaci schematów,
tabel i rycin. Ponadto, artykuł mogą wzbogacić wyniki
badań autorskich. Liczba stron manuskryptu łącznie
z tabelami i rycinami nie powinna być większa niż 20.
Artykuł oryginalny powinien zawierać opis własnych
badań klinicznych lub doświadczalnych Autorów.
Powinien składać się z takich podrozdziałów jak: Wstęp,
Materiał i Metody, Wyniki, Dyskusja, Podsumowanie.
Dopuszczalna liczba pozycji piśmiennictwa to 20. Liczba
stron manuskryptu łącznie z tabelami i rycinami nie
powinna być większa niż 20.
Praca kazuistyczna to krótka forma publikacji prezentująca
ciekawe przypadki kliniczne i ich omówienie
oparte na własnych doświadczeniach praktyka klinicysty
i doświadczeniach innych autorów. Streszczenie
nie powinno przekraczać 150 wyrazów, Wstęp powinien
zawierać nie więcej niż dwa krótkie akapity, Materiał
i Metody nie powinny być podzielone na podrozdziały,
a Wyniki, Dyskusja i Podsumowanie powinny stanowić
jeden rozdział. Liczba rycin i tabel ograniczona do 2–3,
piśmiennictwa do 10. Liczba stron manuskryptu nie
powinna być większa niż 10.
Komunikat to krótka praca oryginalna zawierająca
wstępne, ale istotne wyniki badań. W tego typu publikacjach
streszczenie nie powinno przekraczać 150 wyrazów,
Wstęp powinien zawierać nie więcej niż dwa krótkie
akapity, Materiał i Metody nie powinny być podzielone
na podrozdziały, a Wyniki, Dyskusja i Podsumowanie
powinny stanowić jeden rozdział. Liczba rycin i tabel
ograniczona do 2–3, piśmiennictwa do 10. Liczba stron
manuskryptu nie powinna być większa niż 10.
Artykuł będący tłumaczeniem publikacji z języka
angielskiego powinien dotyczyć najnowszych i istotnych
pozycji piśmiennictwa anglojęzycznego. Należy dołączyć
zgodę redaktora naczelnego czasopisma, w którym
artykuł został opublikowany i autora na tłumaczenie
artykułu. Streszczenie artykułu powinno zawierać treść
istotną do przekazania dla czytelników polskich (do 250
wyrazów).
List do Redakcji jest formą wyrażenia swojej opinii,
a jednocześnie głosem w dyskusji na temat współczesnych
zjawisk w świecie medycyny i nauki. Dopuszczalna liczba
stron manuskryptu nie większa niż 3.
Piśmiennictwo należy podać w kolejności alfabetycznej,
nie wprowadzając kolejnych numerów. Każdą
pozycję piśmiennictwa należy zapisywać od nowej
linii. Należy podać nazwisko autora (autorów) pisane
kursywą z inicjałami imion, po których stawiana jest
kropka. Jeśli jest do sześciu autorów, należy przytoczyć
wszystkich. Powyżej tej liczby należy podać pierwszych
sześciu autorów z dopiskiem i wsp. Tytuły periodyków
powinny być skracane zgodnie ze sposobem przyjętym
w Index Medicus (Medline).
Oto przykłady, jak należy cytować książkę: 1) w całości,
2) fragment konkretnego rozdziału wraz z podaniem
numerów stron, 3), 4) oryginalną pracę naukową, 5) oryginalną
pracę naukową w czasopiśmie elektronicznymi
(data przeglądania i adres URL) i 6) stronę internetową
(nazwa strony – materiału źródłowego, adres URL i datę
wejścia na stronę):
1. Semczuk M., Kurpisz M. (red.): Andrologia. Wyd.
Lek. PZWL, Warszawa 2006.
2. Woźniak W., Bruska M., Kromer P.: Pęcherzyki nasienne,
gruczoł krokowy i gruczoły cewkowo‑opuszkowe.
W: Andrologia. Red. M. Semczuk, M. Kurpisz.
Wyd. Lek. PZWL, Warszawa 2006, 94–89.
3. Bungum M., Bungum L., Giwercman A.: Sperm chromatin
structure assay (SCSA): a tool in diagnosis
and treatment of infertility. Asian J Androl. 2011,
13, 69–75.
4. Kobori Y., Suzuki K., Iwahata T., Shin T., Sadaoka Y.,
Sato R. i wsp.: Improvement of seminal quality and
sexual function of men with oligoasthenoteratozoospermia
syndrome following supplementation
with L-arginine and Pycnogenol®. Arch Ital
Urol Androl. 2015, 87, 190–193. doi: 10.4081/
aiua.2015.3.190. PMID: 26428638
5. Walczak-Jędrzejowska R.: Stres oksydacyjny a niepłodność
męska. Część I: czynniki wywołujące
stres oksydacyjny w nasieniu / Oxidative stress
and male infertility. Part I: factors causing oxidative
stress in semen. Postępy Androl Online. 2015,
2, 5–15. [przeglądany: 07.10.2015 r.]. Dostępny
w: http://www.postepyandrologii.pl
6. Wiley Online Library http://onlinelibrary.wiley.
com/enhanced/doi/10.1111/andr.12051/, data
wejścia 07.10.2015 r.
Cytowane w tekście piśmiennictwo należy podać alfabetycznie
w okrągłych nawiasach, wymieniając pierwszego
autora i podając rok publikacji, np. (Bungum
i wsp., 2011; Cheng i wsp., 2011).
Nazwiska autorów prac wprowadzone w tekście
powinny być napisane kursywą, np.
„Według Bungum i wsp. (2011) należy wprowadzić
określony algorytm leczenia niepłodności męskiej
w zależności od standardowych parametrów seminologicznych
i wyników otrzymanych na podstawie
testu z wykorzystaniem oranżu akrydyny ujawniającego
zaburzenia kondensacji chromatyny plemników
(SCSA)…”
Materiał ilustracyjny obejmuje ryciny (wykresy,
diagramy, zdjęcia, schematy) oraz tabele opatrzone tytułami
i podpisami. W przypadku rycin zarówno tytuł, jak
i opis powinny być umieszczone pod rycinami, a w przypadku
tabel nad tabelami. Tytuł tabeli należy wytłuścić.
Podpisy rycin i tabel oraz ich tytuły, a także informacje
wewnętrzne na rycinach i w tabelach należy podać
w języku polskim i angielskim (dotyczy prac w języku
polskim). Ryciny i tabele powinny być opatrzone numerami
zgodnie z kolejnością odniesień w tekście. Osobną
numerację posiadają ryciny i osobną tabele (numery
arabskie). Skrót Ryc. (pisany kursywą) wprowadzamy
w podpisie pod rycinami, natomiast w tytule tabeli
nie stosujemy skrótu Tab., lecz Tabela. Nie stosujemy
w tekście podstawowym skrótów ryc. lub tab., lecz rycina
lub tabela.
Mikrofotografie mikroskopowe powinny posiadać
wewnętrzną skalę, a stosowane symbole, strzałki lub
litery muszą być wyraźnie uwidocznione na tle. Zdolność rozdzielcza mikrofotografii nie powinna być mniejsza niż
300 dpi. Stosowane znaki do opisu danej ryciny powinny
być ujednolicone w całym artykule.
Stosowane oznaczenia i skróty na rycinach i w tabelach
powinny być wyjaśnione w opisie rycin i tabel, niezależnie
do ich rozwinięcia w tekście podstawowym.
Uwaga: pojedyncze ryciny bądź ryciny złożone z kilku
zdjęć, wykresów, diagramów lub schematów należy zintegrować
z wewnętrznymi oznaczeniami.
Rozmiary rycin i tabel: szerokość rycin i tabel
powinna wynosić 17,3 cm lub 8,3 cm, natomiast ich
długość nie powinna przekraczać 24,5 cm. Tekst będzie
składany dwułamowo, dlatego też szerokość rycin i tabel
nie może przekraczać szerokości jednego lub dwóch
łamów, z kolei długość może być dowolna, ale nie większa
niż długość łamu; wielkość powierzchni zadrukowanej
na stronie formatu A4 będzie wynosiła 24,7 cm/17,5 cm.
Przesyłanie prac do Redakcji
Prace należy przesłać elektronicznie na adres redaktora
naczelnego
mpiasecka@ipartner.com.pl
Tekst podstawowy, piśmiennictwo oraz podpisy
rycin i tabel powinny być umieszczone w jednym pliku
(Word), natomiast każda rycina (format CDR, TIF, JPG)
i tabele (Word) w osobnych plikach. Tytuł pliku zawierający
tekst manuskryptu powinien zawierać nazwisko
autora do korespondencji oraz pierwsze słowa tytułu
artykułu, natomiast tytuły plików zawierające ryciny
i tabele, obok nazwiska autora, powinny zawierać numery
rycin i tabel.
Do pracy należy dołączyć oświadczenie, że m.n. praca
nie została opublikowana lub skierowana do publikacji
w innym czasopiśmie, została zaaprobowana przez
wszystkich współautorów (wymagane są podpisy
wszystkich autorów) oraz zostały ujawnione wszelkie
źródła finansowania (oświadczenie dostępne na stronie
internetowej
http://www.postepyandrologii.pl).
Inne uwagi
Prace będą publikowane w kolejności otrzymywania,
jednak redakcja zastrzega sobie prawo zmian uzasadnionych
treścią drukowanego numeru. Ponadto zastrzega
sobie prawo wprowadzenia poprawek stylistycznych
i dotyczących mianownictwa oraz stosowanych skrótów
bez uzgodnienia z autorem.
RECENZENCI PRAC OPUBLIKOWANYCH W 2016 R.
Katarzyna Bajszczak
Monika Frączek
Kamil Gill
Sylwia Głąbowska
Piotr Jędrzejczak
Agnieszka Kolasa
Michał Kupś
Marek Lipiński
Elżbieta Oszukowska
Małgorzata Piasecka
Mariusz Słojewski
Jan Karol Wolski
