Tom 3 • Numer 2 • Grudzień 2016
Volumin 3 • Number 2 • December 2016

KOMITET REDAKCYJNY
Redaktor naczelny:
dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego:
prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr hab. n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst, Republika Południowej Afryki
(Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga, Dania (Copenhagen, Denmark
)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Katedra i Zakład Histologii i Biologii Rozwoju
Wydział Nauk o Zdrowiu
Pomorski Uniwersytet Medyczny w Szczecinie
71-210 Szczecin ul. Żołnierska 48
tel. 91 48 00 917, 91 48 00 908
e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Agnieszka Hilczer
Waldemar Jachimczak
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Korekta języka polskiego:
Wojciech Markowski
Korekta języka angielskiego:
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI
O czasopiśmie / About Journal 4
Artykuły poglądowe / Review
Elżbieta Oszukowska, Renata Walczak-Jędrzejowska, Katarzyna Marchlewska,
Marek Lipiński, Waldemar Różański, Jolanta Słowikowska-Hilczer
Niedrożność dróg wyprowadzających plemniki jako przyczyna niepłodności
u mężczyzn
Obturation of seminal ducts as a cause of male infertility 6
Rekomendacje medyczne
Medical recommendation – Jolanta Słowikowska-Hilczer 16
A. Jungwirth (Przewodniczący), T. Diemer, G.R Dohle, B. A. Giwercman, Z. Kopa,
C. Krausz, H. Tournaye
Rekomendacje dotyczące postępowania w męskiej niepłodności
Guidelines on Male Infertility
Tłumaczenie i przygotowanie wersji polskiej
Translation and elaboration of Polish version:
Piotr Świniarski, Jan Karol Wolski, Jolanta Słowikowska-Hilczer 17
Sprawozdanie i streszczenia wykładów z Konferencji
Polskiego Towarzystwa Andrologicznego – 18. Dzień Andrologiczny 55
Report and abstracts of lectures from Symposium of scientific training
of the Polish Society of Andrology – 18th Day of Andrology 69
Konferencja Polskiego Towarzystwa Andrologicznego – 19. Dzień Andrologiczny
Symposium of scientific training of the Polish Society of Andrology –
19th Day of Andrology 86
Instrukcje dla autorów / Instructions for authors 87
Recenzenci prac opublikowanych w 2016 r. / Reviewers in 2016 93
O CZASOPIŚMIE
Wersja elektroniczna czasopisma jest wersją pierwotną. Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open
Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.
The electronic version of the journal is a original version. Access to scientific information published in the journal is free and
unlimited (Open Access).
Zaburzenia męskiego układu płciowego dotyczą osób
w różnym wieku i w większości przypadków prowadzą
do niepłodności, która nabrała już rangi choroby cywilizacyjnej.
Najczęściej identyfikowanymi nieprawidłowościami
są hipogonadyzm, zaburzenia seksualne, wady
rozwojowe narządów płciowych, nowotwory jąder i prostaty.
Ze względu na specyficzne i coraz bardziej zanieczyszczone
środowisko antropogeniczne dotyczą one
głównie społeczeństw rozwiniętych, w tym również
Polski, i stanowią istotny oraz narastający problem
medyczny, społeczny, demograficzny, a także zdrowia
publicznego. Nauka, która zajmuje się fizjologią i zaburzeniami
męskiego układu płciowego w aspekcie nauk
podstawowych i klinicznych, to andrologia. Ponieważ
jest to młoda dziedzina nauki, jeszcze do niedawna niezadowalający
stan wiedzy ograniczał możliwości diagnostyki
oraz leczenia zaburzeń męskiego układu płciowego.
Jednak w ostatnich latach obserwuje się niezwykle dynamiczny
rozwój andrologii, szczególnie molekularnej, spowodowany
wprowadzeniem nowych metod badawczych
z zakresu biochemii, biologii i genetyki molekularnej.
Andrologia staje się dziedziną interdyscyplinarną integrującą
wiedzę z różnych dyscyplin medycznych i naukowych.
Informacje związane z tymi zagadnieniami z trudem
docierają do lekarzy i osób zainteresowanych w naszym
kraju, ponieważ jest niewiele literatury w języku polskim,
a wykłady wygłaszane podczas konferencji nie zawsze
wyczerpująco wyjaśniają wątpliwości dotyczące m.in.
postępowania diagnostycznego, terapeutycznego, rekomendacji
czy też proponowanych algorytmów. Stąd też
potrzeba stworzenia czasopisma prezentującego wiedzę
andrologiczną lekarzom różnych specjalności, diagnostom
laboratoryjnym i przedstawicielom nauk podstawowych.
Czasopismo „Postępy Andrologii Online” powstało
z inicjatywy Polskiego Towarzystwa Andrologicznego,
które zainteresowane jest integracją środowiska osób
zajmujących się różnymi aspektami męskiego układu
płciowego, uzupełnieniem i poszerzeniem ich wiedzy,
a także poprawą opieki zdrowotnej nad mężczyznami
w naszym kraju.
Celem czasopisma jest: 1) dostarczenie istotnych
informacji na temat fizjologii i patologii męskiego układu
płciowego, 2) propagowanie praktycznej wiedzy andrologicznej
kierowanej do szerokich kręgów odbiorców,
3) wymiana poglądów i opinii na temat zagadnień klinicznych
oraz wyników badań doświadczalnych oraz
4) przekazywanie informacji dotyczących konferencji
i kursów o tematyce andrologicznej.
Proponowana tematyka czasopisma to: 1) andrologia
kliniczna z uwzględnieniem etiopatogenezy, diagnostyki
i leczenia m.in. zaburzeń rozwojowych, niepłodności
i procesów starzenia mężczyzn, 2) nowatorskie
metody diagnostyczne, 3) andrologia doświadczalna
rozwijająca się w oparciu o nauki podstawowe oraz
4) inne interdyscyplinarne tematy związane z dziedziną
andrologii.
Czasopismo kierowane jest do lekarzy specjalności
bezpośrednio lub pośrednio związanych z andrologią,
m.in. urologów, endokrynologów, ginekologów, pediatrów,
ale także do lekarzy rodzinnych spotykających się
z coraz częstszym problemem niepłodności partnerskiej
i problemami starzejących się mężczyzn. Ponadto naszą
intencją jest zdobycie zainteresowania diagnostów laboratoryjnych
odgrywających istotną rolę w prawidłowym
postępowaniu terapeutycznym opartym na szerokim
panelu testów i badań, których wdrożenie wciąż wymaga
odpowiednich i wyczerpujących szkoleń z diagnostyki
andrologicznej, w tym seminologicznej. Mamy nadzieję,
że nasze czasopismo wzbudzi również zainteresowanie
biologów zajmujących się czynnością męskiego układu
płciowego w ramach nauk podstawowych, a także lekarzy
weterynarii oraz innych osób, które znajdą informacje
poszerzające ich wiedzę i kształtujące opinię z zakresu
szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac oryginalnych,
kazuistycznych i krótkich komunikatów, jak
również prac poglądowych, opracowanych w kondensacyjnej,
dydaktycznej i przystępnej formie. W pracach
tych autorzy powinni przedstawiać aktualny stan wiedzy
światowej oraz swoje opinie. Chcemy, aby czasopismo
spełniało rolę informatora i przewodnika w dziedzinie
andrologii oraz stanowiło forum dyskusyjne. Ponadto,
zapraszamy do publikowania artykułów będących
tłumaczeniem publikacji ukazujących się w języku angielskim,
które przedstawiają istotne postępy w andrologii.
http://www.postepyandrologii.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska-Hilczer
przewodnicząca
Polskiego Towarzystwa Andrologicznego
NIEDROŻNOŚĆ DRÓG WYPROWADZAJĄCYCH PLEMNIKI JAKO PRZYCZYNA NIEPŁODNOŚCI U MĘŻCZYZN
Elżbieta Oszukowska1,2, Renata Walczak-Jędrzejowska3,
Katarzyna Marchlewska3,
Marek Lipiński1, Waldemar Różański1, Jolanta Słowikowska-Hilczer3
1Oddział Urologii Ogólnej, Onkologicznej i Czynnościowej, II Klinika Urologii Uniwersytetu Medycznego w Łodzi, Wojewódzki
Szpital Specjalistyczny im. M. Kopernika w Łodzi, 2Poradnia Andrologii i Endokrynologii Płodności, Uniwersytecki Szpital im.
Wojskowej Akademii Medycznej – Centralny Szpital Weteranów w Łodzi, 3Zakład Endokrynologii Płodności, Katedra Andrologii
i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Autor do korespondencji/corresponding author: Elżbieta Oszukowska, Oddział Urologii Ogólnej, Onkologicznej i Czynnościowej,
II Klinika Urologii Uniwersytetu medycznego w Łodzi, Wojewódzki Szpital Specjalistyczny im. M. Kopernika, 93–513 Łódź,
ul. Pabianicka 62, tel. 42 689 52 11, e.oszukowska@tlen.pl
Otrzymano/received: 12.10.2016 r. Zaakceptowano/accepted: 08.12.2016 r.
Elżbieta Oszukowska – dr n. med., absolwentka Akademii Medycznej w Łodzi, lekarz, specjalista
urolog Fellow of the European Board of Urology (FEBU) i androlog kliniczny certyfikowany przez
Europejską Akademię Andrologii (EAA, ang. European Academy of Andrology) i Polskie Towarzystwo
Andrologiczne (PTA). Lekarz Oddziału Urologii Ogólnej, Onkologicznej i Czynnościowej, II Kliniki
Urologii Uniwersytetu Medycznego w Łodzi, Wojewódzkiego Szpitala Specjalistycznego im.
M. Kopernika w Łodzi oraz Poradni Andrologii i Endokrynologii Płodności, Uniwersyteckiego
Szpitala im. Wojskowej Akademii Medycznej – Centralny Szpital Weteranów w Łodzi. Członek
zespołu Polskiego Centrum Kształcenia Klinicznego EAA w Łodzi. Współwykonawca polskich i europejskich projektów
badawczych. Pierwszy autor i współautor 40 publikacji naukowych. Członek PTA, Międzynarodowego
Towarzystwa Andrologicznego (ISA, ang. International Society of Andrology), EAA, Polskiego Towarzystwa Urologicznego
oraz Komisji Andrologii Komitetu Biologii Rozrodu Polskiej Akademii Nauk. Praca zawodowa i naukowa autorki
związana jest z badaniami nad spermatogenezą i płodnością męską.
Elżbieta Oszukowska – MD, PhD, graduated fom the Medical University in Lodz, is the specialist in urology, Fellow
of the European Board of Urology (EEBU) and clinical andrologist certified by the European Academy of Andrology
(EAA) and the Polish Society of Andrology. Works in Department of General, Oncologic and Functional Urology, II
Clinic of Urology Medical University in Łodz, Nicolaus Copernicus Hospital in Lodz and the Outpatient Clinic of
Andrology and Reproductive Endocrinology, University Hospital – Military Memorial Medical Academy – Central
Veterans’ Hospital in Lodz. Member of the Polish Society of Andrology, the International Society of Andrology (ISA),
the EAA, Polish Society of Urology and Commission of Andrology in the Reproductive Biology Sciences Committee
of the Polish Academy of Science. Her professional and scientific work is associated with research on spermatogenesis
and male fertility
Streszczenie
Obustronna, całkowita niedrożność dróg wyprowadzających nasienie jest jedną z przyczyn azoospermii i niepłodności mężczyzny.
U mężczyzn z niedrożnością jednostronną płodność może być niezaburzona lub mocno upośledzona z powodu znacznie obniżonej
liczby plemników w nasieniu. Przyczyny niedrożności dróg wyprowadzających nasienie mogą mieć podłoże genetyczne (mukowiscydoza,
aplazja nasieniowodów), wrodzone (zaburzenia rozwojowe gruczołu krokowego) lub nabyte (zmiany pozapalne w najądrzach,
gruczole krokowym, wazektomia, plastyka przepuklin pachwinowych). W diagnostyce niedrożności dróg wyprowadzających nasienie
wykorzystuje się ogólne badanie nasienia, badania biochemiczne plazmy nasienia (stężenie fruktozy, kwasu cytrynowego, aktywność
obojętnej α-glukozydazy),
diagnostykę genetyczną, obrazową oraz diagnostykę infekcji. Leczenie w zależności od przyczyny może
polegać na wykorzystaniu technik rozrodu wspomaganego, chirurgicznego odtworzenia ciągłości dróg nasiennych lub terapii infekcji.
Słowa kluczowe: płodność, nasienie, niepłodność męska, niedrożność dróg wyprowadzających nasienie, zapalenie gruczołu krokowego
Abstract
Bilateral seminal duct obstruction leads to azoospermia and male infertility. In men with unilateral obstruction fertility may be unaffected
or may be heavy impaired because of a reduced sperm cells number in the semen. Causes of seminal ducts obstruction may be
genetic (cystic fibrosis, aplasia of the vas deferens), congenital (malformations of the prostate gland) or acquired (post inflammatory
changes in the epididymis, prostate, vasectomy, inguinal hernia repair). Diagnosis of duct obstruction is made after semen analysis,
seminal plasma biochemical tests (fructose and citric acid concentration, neutral α‑glucosidase
activity), genetics test, imaging or diagnostics
of infection. Obstruction treatment depends on the cause and may involve the use of assisted reproduction techniques, surgical
restoration of ducts patency or infection therapy.
Key words: fertility, semen, male infertility, seminal ducts obstruction, prostate inflammation
Skróty / Abbreviations
CBAVD – wrodzony obustronny brak nasieniowodów (ang. congenital bilateral absence of the vas deferens), CF – zwłoknienie torbielowate –
mukowiscydoza (ang. cystic fibrosis), CFTR – gen odpowiedzialny za regulację przewodnictwa przezbłonowego w zwłóknieniu torbielowatym
(ang. cystic fibrosis transmembrane conductance regulator), CUAVD – wrodzony jednostronny brak nasieniowodu (ang. congenital unilateral
absence of the vas deferens), FSH – hormon folikulotropowy (ang. follicle-stimulating
hormone), ICSI – wstrzyknięcie plemnika do cytoplazmy
komórki jajowej (ang. intracytoplasmic sperm injection), i.m. – domięśniowo (łac. intramuscularis), IL – interleukina (ang. interleukin), IVF –
zapłodnienie pozaustrojowe (ang. in vitro fertilization), MESA – mikrochirurgiczna aspiracja plemników z najądrzy (ang. microsurgical
epididymal sperm aspiration), NAG – obojętna α‑glukozydaza
(ang. neutral α‑glucosidase),
PCR – łańcuchowa reakcja polimerazy (ang. polymerase
chain reaction), p.o. – doustnie (łac. per os), RFT – reaktywne formy tlenu (ang. reactive oxygen species), TESE – pobranie plemników
z jąder (ang. testicular sperm extraction), TURED – przezcewkowa elektroresekcja przewodów wytryskowych (ang. transurethral resection of
the ejaculatory ducts), USG – ultrasonografia (ang. ultrasonography), WHO – Światowa Organizacja Zdrowia (ang. World Health Organization)
Niedrożności dróg wyprowadzających
nasienie
Niepłodność pozajądrowa może być spowodowana
obustronną, przejściową lub stałą niedrożnością dróg
wyprowadzających nasienie, może mieć podłoże nabyte
lub wrodzone
(Behre i wsp., 2010).
W niniejszej pracy
przedstawiono etiologię niedrożności dróg wyprowadzających
nasienie jako przyczyny niepłodności u mężczyzn
wraz z postępowaniem diagnostycznym i terapeutycznym.
Niedrożność może mieć charakter jedno- lub obustronny,
wrodzony (np. aplazja nasieniowodów, zespół
Younga) lub nabyty (zapalenie najądrza, pęcherzyków
nasiennych, gruczołu krokowego). Niedrożność jatrogenna
może być następstwem operacji (plastyka przepukliny
pachwinowej, szczególnie w dzieciństwie),
zabiegów endoskopowych w okolicy wzgórka nasiennego
(przecięcie zastawki cewki tylnej), wazografii, zabiegów
pozyskiwania plemników z najądrzy, czy przypadkowego
przecięcia przewodu najądrza w czasie zabiegu wycięcia
torbieli nasiennej. Obustronna wazektomia jest zabiegiem
prowadzącym do zamierzonej obustronnej niedrożności
dróg wyprowadzających nasienie w celu antykoncepcji
)
(Engelmann i Gralla, 2010)
(tabela 1.).
Obraz kliniczny. Całkowita obustronna niedrożność
dróg wyprowadzających nasienie prowadzi do azoospermii
i niepłodności. Można ją podejrzewać u mężczyzny
z azoospermią i prawidłową objętością jąder oraz
prawidłowymi poziomami we krwi hormonu folikulotropowego
(FSH, ang. follicle-stimulating
hormone) i inhibiny
B
(Andersson i wsp., 2004).
Należy jednak pamiętać,
że u mężczyzn z prawidłową objętością jąder i prawidłowymi
poziomami FSH przyczyną azoospermii może
być zatrzymanie spermatogenezy prowadzące do braku
wytwarzania plemników.
Niedrożność jednostronna może przebiegać bezobjawowo,
gdy czynność plemnikotwórcza jądra i drożność
Przyczyny niedrożności.png
 dróg wyprowadzających nasienie po stronie przeciwnej
są prawidłowe. Natomiast częściowa obustronna niedrożność,
w zależności od nasilenia, może manifestować
się różnym nasileniem zmian w nasieniu aż do obecności
pojedynczych plemników w nasieniu (łac. cryptozoospermia).
Niedrożność przewodu najądrza i nasieniowodu
nie wpływa na objętość ejakulatu. Natomiast niedrożność
na poziomie przewodów wytryskowych zwykle łączy się
z obniżeniem objętości ejakulatu (objętość <1,5 mL – łac.
parvisemia). Zaburzenia struktury przewodów najądrzy
(ścieńczenie lub stwardnienie) oraz aplazję nasieniowodów
można rozpoznać podczas badania przedmiotowego.
W badaniu ultrasonograficznym (USG, ang.
ultrasonography) można uwidocznić zmiany torbielowate
najądrzy
(Isidori i Lenzi, 2008)
, zaburzenia morfologiczne
pęcherzyków nasiennych i niekiedy przewodów
wytryskowych.
W diagnostyce różnicowej duże znaczenie mają
badania biochemiczne plazmy nasienia. Markerem czynności
najądrzy jest obojętna α-glukozydaza
(NAG, ang.
neutral α-glucosidase),
pęcherzyków nasiennych – fruktoza,
gruczołu krokowego – kwas cytrynowy i cynk
(Björndahl,2010).
W przypadku obustronnej niedrożności dystalnej
części najądrzy lub nasieniowodów stężenie NAG
w nasieniu jest znacząco obniżone (norma >20 U/ejakulat),
a stężenia fruktozy (norma ≥13 μmoL/ejakulat) i kwasu
cytrynowego (norma ≥52 μmol/ejakulat) są w granicach
wartości prawidłowych. W przypadku niedrożności przewodów
wytryskowych znacząco obniżone będą stężenia
zarówno NAG, jak i fruktozy, a stężenie kwasu cytrynowego
będzie prawidłowe. Wyniki oznaczeń biochemicznych
plazmy nasienia są zwykle niejednoznaczne
w przypadkach częściowej lub jednostronnej niedrożności.
Ostateczne rozpoznanie niedrożności dróg wyprowadzających
nasienie można postawić u chorego z azoospermią
po potwierdzeniu pełnej prawidłowej spermatogenezy
w biopsji jądra
dróg wyprowadzających nasienie po stronie przeciwnej
są prawidłowe. Natomiast częściowa obustronna niedrożność,
w zależności od nasilenia, może manifestować
się różnym nasileniem zmian w nasieniu aż do obecności
pojedynczych plemników w nasieniu (łac. cryptozoospermia).
Niedrożność przewodu najądrza i nasieniowodu
nie wpływa na objętość ejakulatu. Natomiast niedrożność
na poziomie przewodów wytryskowych zwykle łączy się
z obniżeniem objętości ejakulatu (objętość <1,5 mL – łac.
parvisemia). Zaburzenia struktury przewodów najądrzy
(ścieńczenie lub stwardnienie) oraz aplazję nasieniowodów
można rozpoznać podczas badania przedmiotowego.
W badaniu ultrasonograficznym (USG, ang.
ultrasonography) można uwidocznić zmiany torbielowate
najądrzy
(Isidori i Lenzi, 2008)
, zaburzenia morfologiczne
pęcherzyków nasiennych i niekiedy przewodów
wytryskowych.
W diagnostyce różnicowej duże znaczenie mają
badania biochemiczne plazmy nasienia. Markerem czynności
najądrzy jest obojętna α-glukozydaza
(NAG, ang.
neutral α-glucosidase),
pęcherzyków nasiennych – fruktoza,
gruczołu krokowego – kwas cytrynowy i cynk
(Björndahl,2010).
W przypadku obustronnej niedrożności dystalnej
części najądrzy lub nasieniowodów stężenie NAG
w nasieniu jest znacząco obniżone (norma >20 U/ejakulat),
a stężenia fruktozy (norma ≥13 μmoL/ejakulat) i kwasu
cytrynowego (norma ≥52 μmol/ejakulat) są w granicach
wartości prawidłowych. W przypadku niedrożności przewodów
wytryskowych znacząco obniżone będą stężenia
zarówno NAG, jak i fruktozy, a stężenie kwasu cytrynowego
będzie prawidłowe. Wyniki oznaczeń biochemicznych
plazmy nasienia są zwykle niejednoznaczne
w przypadkach częściowej lub jednostronnej niedrożności.
Ostateczne rozpoznanie niedrożności dróg wyprowadzających
nasienie można postawić u chorego z azoospermią
po potwierdzeniu pełnej prawidłowej spermatogenezy
w biopsji jądra
(Dohle i wsp., 2012).
Mukowiscydoza
Mukowiscydoza – zwłóknienie torbielowate (CF, ang.
cystic fibrosis) jest to najczęstsza autosomalna recesywna
choroba populacji białej (częstość 1 : 3000)
(O’Sullivan i Freedman, 2009)
, a nosicielstwo mutacji
występuje u około 4% populacji
(Massie i Delatycki,2013).
Mukowiscydoza spowodowana jest przez mutację
w genie odpowiedzialnym za regulację przewodnictwa
przezbłonowego (CFTR, ang. cystic fibrosis transmembrane
conductance regulator). Gen ten zbudowany jest z 230 000
par zasad, 27 eksonów i znajduje się w chromosomie 7
(7q31.2). Od czasu poznania jego dokładnej budowy
w 1989 r. opisano ponad 2000 mutacji (http://www.
genet.sickkids.on.ca). Gen CFTR koduje białko zbudowane
z 1480 aminokwasów, które jest przezbłonowym
kanałem jonów chlorkowych. W Europie środkowej
najczęstszą mutacją prowadzącą do rozwoju mukowiscydozy
jest mutacja pF508del, która odpowiada za ok.
70% przypadków choroby. Mutacja ta polega na utracie
trzech par zasad, co powoduje brak w białku aminokwasu
fenyloalaniny
(Fraser-Pitt i O’Neil, 2015; Pizzo i wsp., 2014).
Za pozostałe 10–15% przypadków choroby
odpowiada ok. 10 innych mutacji (najczęściej R117H
i W1282X)
(Jalalirad i wsp., 2004; Kerem i wsp., 1997).
Z powodu wielkości genu i różnorodności mutacji
w rutynowej diagnostyce wykrywa się ok. 85% mutacji.
W przypadkach szczególnych można dokonać sekwencjonowania
całego genu. Niestety nie wykazano silnej
korelacji pomiędzy genotypem a kliniczną manifestacją
choroby
(Kerem i Kerem, 1996).
Prawdopodobnie
inne geny modyfikują obraz kliniczny w mutacji CFTR.
Białko kodowane przez gen CFTR jest obecne w największej
ilości w nabłonku dróg oddechowych. W przypadku
całkowitej dysfunkcji tego białka wydzielina
produkowana przez nabłonek dróg oddechowych jest nadmiernie
gęsta, co prowadzi do niedrożności oskrzelików
i oskrzeli, nawracających ciężkich zakażeń bakteryjnych,
postępującej dysfunkcji płuc oraz niewydolności
prawokomorowej
serca. Od nasilenia zaburzeń w układzie
oddechowym i krążenia zależy długość przeżycia
chorego. U 85% chorych jednocześnie występuje niewydolność
trzustki. Smółkowa niedrożność jelit jest ciężkim
objawem CF u noworodków
(Fraser-Pitt i O’Neil, 2015).
Obraz kliniczny. W mukowiscydozie wewnątrzmosznowy
odcinek nasieniowodu jest zwykle nieobecny lub
hipoplastyczny, pozbawiony światła, podobnie jak trzon
i ogon najądrza. Głowa najądrza jest zwykle powiększona,
może zawierać struktury torbielowate. Ponadto obserwuje
się zaburzenia struktury pęcherzyków nasiennych,
hipoplazję, poszerzenie, zmiany torbielowate. Zaburzona
czynność pęcherzyków nasiennych prowadzi u wszystkich
chorych mężczyzn z CF do występowania niskiej
objętości nasienia. Jednak u niektórych chorych nie
można jednoznacznie stwierdzić miejsca obturacji
(Wilschanski i wsp., 1996).
Większość chorych z CF ma prawidłowe jądra z niezaburzoną
spermatogenezą. Zwykle są to chorzy z łagodnym
przebiegiem choroby, bez niewydolności trzustki
i z nieznacznymi zaburzeniami płucnymi. Na ogół
chorzy ci są heterozygotami
(de Braekeleer i Férec, 1996).
Postępowanie diagnostyczne obejmuje badanie ogólne
nasienia oraz oznaczenie w plazmie nasienia stężeń NAG
i fruktozy. Obserwuje się niższą objętość nasienia, niższe
pH i niższe stężenia fruktozy i NAG w ejakulacie oraz
azoospermię. Aplazja nasieniowodu może być wykryta
podczas badania przedmiotowego. W badaniu USG
można stwierdzić zmiany w obrębie głowy i trzonu najądrza
czy pęcherzyków nasiennych
(Isidori i Lenzi, 2008).
Prawidłowa spermatogeneza może być potwierdzona
w badaniu histopatologicznym bioptatu z jądra. Biopsja
jądra może być wykonana jako biopsja terapeutyczna
z pozyskiwaniem i zamrażaniem plemników do procedur
zapłodnienia pozaustrojowego IVF (ang. in vitro fertilization)
po uprzedniej diagnostyce genetycznej partnerki.
Leczenie. Bardziej skuteczne metody leczenia i opieki
nad chorymi z CF spowodowały wydłużenie średniego
czasu przeżycia. Obecnie w Europie średni czas przeżycia
chorych wynosi ok. 30 lat, dlatego większy odsetek
chorych osiąga dojrzałość płciową i wykazuje chęć posiadania
potomstwa.
Mukowiscydoza jest chorobą autosomalną recesywną
i może pojawić się u potomstwa, gdy partnerka jest heterozygotą
(tj. zdrowym nosicielem mutacji). W populacji
białej bezobjawowe nosicielstwo mutacji CFTR zdarza się
często, wynosi ok. 4%
(Massie i Delatycki, 2013)
i dlatego
konieczna jest diagnostyka genetyczna partnerki przed
przystąpieniem pary do programu IVF. Jeżeli u kobiety
nie wykryto mutacji i w rodzinie nie ma przypadków
mukowiscydozy, to ryzyko pojawienia się tej choroby
u dziecka wynosi ok. 0,5%. Ryzyko to można określić
precyzyjnie po wykonaniu pełnego sekwencjonowania
genu CFTR. W przypadku gdy u partnerki obecna jest
mutacja CFTR, to ryzyko pojawienia się mukowiscydozy
u potomstwa wzrasta do 50% 1. Niepłodna para obciążona
mutacją w genie CFTR przed rozpoczęciem leczenia niepłodności
powinna zostać skonsultowana przez lekarza
genetyka wraz z rozważeniem wskazań do wykonania
badań prenatalnych. Trudną sytuacją jest żądanie przez
niepłodną parę leczenia niepłodności pomimo wysokiego
ryzyka pojawienia się u potomstwa mukowiscydozy
(Meschede i wsp., 1997b; Popli i Stewart, 2007).
Lekarz
zobowiązany jest do przedstawienia i wyjaśnienia ciężkich
następstw choroby dziedzicznej u potomstwa.
Wrodzony brak nasieniowodów
Wrodzony obustronny brak nasieniowodów (CBAVD,
ang. congenital bilateral absence of the vas deferens) występuje
u chorych z poronnymi postaciami CF i rzadziej
występującymi mutacjami. Wykazano także, że polimorfizm
w intronie 8 genu CFTR (IVS8-5T)
jest przyczyną
CBAVD w 13–44% przypadków. Polimorfizm ten polega
na obecności 5, 7 lub 9 reszt tymidynowych, opisywany
jest jako 5T, 7T lub 9T. Występowanie wariantu 7T lub
9T jest neutralne, natomiast wariant 5T jest przyczyną
utraty exonu 9 w nici mRNA
(Rave-Harel i wsp., 1997).
Prowadzi to do zmian konformacyjnych i powstania nieprawidłowego
funkcjonalnie białka. Ponadto znaczenie
takiego polimorfizmu jest „tkankowo” zależne i może
wywierać negatywny wpływ tylko w przewodzie najądrza
i nasieniowodzie. Penetracja 5T zależy dodatkowo od polimorfizmu
innego odcinka genu CFTR – powtórzeń TG,
których zwykle jest od 8 do 13. Wykazano, że u mężczyzn
z CBAVD i obecnością 5T częściej występuje większa
liczba powtórzeń TG (TG12 lub TG13) niż u zdrowych
(Disset i wsp., 2005; Yu i wsp., 2012).
Współwystępowanie
5T z 12 lub 13 powtórzeniami TG zwiększa ryzyko
rozwoju CBAVD. Dlatego coraz częściej 5T uważane jest
za „słabą” mutację, a nie za polimorfizm 2. Oznaczanie
tej mutacji powinno być zawsze wykonane w rutynowej
diagnostyce genetycznej. Chorzy z pełnoobjawową CF
zwykle są nosicielami dwu „ciężkich” mutacji, natomiast
chorzy z CBAVD zwykle są hetrozygotami, tj. nosicielami
„ciężkiej” i „lekkiej”. W grupie mężczyzn z CBAVD
u 75% wykazano występowanie dwóch mutacji (w tym
5T), a u pozostałych 15% stwierdzono tylko 5T
(Dörk i wsp., 1997;).
(Yu i wsp., 2012).).
Jednak w rutynowej diagnostyce
genetycznej częstość wykrywania mutacji jest
niższa. U ok. 10–20% chorych z CBAVD nie znajduje się
żadnej zmiany w genie CFTR
(Rave-Harel i wsp., 1995;).
(de Braekeleer i Férec, 1996).
Współwystępowanie zaburzeń
rozwoju nerek (jednostronny niedorozwój, ektopowe
....................................................................................................................................................................
1 Dziedziczenie wg praw Mendla; mężczyzna chory (homozygota recesywna),
kobieta zdrowa nosicielka (heterozygota); stosunek fenotypów
w pokoleniu F1 1:1: dwoje osobników zdrowych, którzy są nosicielami –
heterozygoty) i dwoje osobników chorych, którzy są homozygotami recesywnymi
(przyp. red.)
2 Polimorfizm ma miejsce wtedy, gdy częstość występowania wariantu
genu w populacji wynosi ponad 1%
(Karki i wsp.,).
Med Genom, 2015, 8:37.
doi: 10.1186/s12920-
015-
0115) (przyp. red.)
10
POS T ĘP Y ANDROLOGI I ONL INE , 2016 , 3 (2)
położenie, nerka podkowiasta) nie zwiększa ryzyka
nosicielstwa mutacji w genie CFTR.
Reasumując, CBAVD jest chorobą o heterogennej etiologii
i może wystąpić jako izolowane zaburzenie lub jako
jeden z objawów w przebiegu mukowiscydozy.
Obraz kliniczny. U mężczyzn z CBAVD zaburzenia anatomiczne
i parametry nasienia są podobne jak u mężczyzn
z CF. Obserwuje się niższą objętość nasienia,
niższe pH i niższe stężenia fruktozy i NAG w ejakulacie
oraz azoospermię. U ok. połowy chorych mężczyzn
objawy ze strony górnych dróg oddechowych (przewlekłe
zapalenia oskrzeli, zatok bocznych nosa, zapalenia płuc
w dzieciństwie) nie są nasilone i mają stabilny charakter.
Leczenie. Spermatogeneza u chorych z CBAVD
jest zwykle prawidłowa. Zakwalifikowanie chorego
do pobrania plemników z jądra lub najądrza i technik
rozrodu wspomaganego musi być poprzedzone badaniami
genetycznymi pary w celu oceny ryzyka wystąpienia
mukowiscydozy u potomstwa. Paradoksalnie
bardzo trudną jest sytuacja, gdy u mężczyzny z CBAVD
nie wykryto żadnej mutacji, a partnerka jest nosicielką
mutacji. Wówczas ryzyko rozwoju mukowiscydozy
u potomstwa nadal jest wysokie, gdyż mężczyzna prawdopodobnie
jest nosicielem mutacji, która nie została
wykryta. Większość laboratoriów europejskich wykonuje
badanie jedynie 30–50 najczęstszych mutacji CFTR powodujących
mukowiscydozę. Niestety w Polsce w warunkach
komercyjnych zwykle badane są jedynie 1–2 „najcięższe”
mutacje z najczęściej występujących (delta F508, R117H,
W1282X), co nie wyjaśnia przyczyny CBAVD, a chorych
utwierdza w przekonaniu o braku nosicielstwa mutacji
i pełnym zdrowiu. Natomiast konieczne wydaje się oprócz
badania najcięższych mutacji, także badanie polimorfizmu
5T/7T/9T oraz liczby powtórzeń TG.
Jednostronny brak nasieniowodu
Wrodzony jednostronny brak nasieniowodu (CUAVD, ang.
congenital unilateral absence of the vas deferens) zwykle nie
powoduje niepłodności i większość chorych nie zgłasza
się z tego powodu do lekarza. Przeważnie w CUAVD
dochodzi do jednostronnej aplazji części wewnątrzmosznowej
nasieniowodu i rozpoznanie może być przypadkowo
postawione w czasie wykonywania wazektomii.
U mężczyzn z CUAVD przyczyną azoospermii może być
niedrożność dróg wyprowadzających nasienie po stronie
przeciwnej. Niekiedy u mężczyzn z CUAVD występują
towarzyszące wady układu moczowego (najczęściej agenezja
nerki)
(Drake i Quinn, 1996).
Obustronna niedrożność przewodów
wytryskowych w gruczole krokowym
Przewód wytryskowy łączy pęcherzyk nasienny i nasieniowód
z ujściem na wzgórku nasiennym, przebiega
wewnątrz gruczołu krokowego i służy odprowadzaniu
wydzieliny pęcherzyków nasiennych i plemników
do cewki moczowej. Niedrożność przewodów wytryskowych
może wystąpić we wrodzonych wadach gruczołu
krokowego (torbiel z przewodów Müllera, torbiel pośrodkowa
stercza) lub zaburzeniach nabytych jako powikłanie
po zapaleniu gruczołu krokowego (zwapnienia, torbiele
pozapalne)
(Fisch i wsp., 2006).
(Fisch i wsp., 2006).
W przypadkach wrodzonych
przewody wytryskowe mogą uchodzić do zatoki
moczowo-płciowej
lub być całkowicie niedrożne z powodu
ucisku przez torbiel pośrodkową
(Elder i Mostwin, 1984).
U niektórych chorych mężczyzn występują także mutacje
w genie CFTR
(Meschede i wsp., 1997a).
Obraz kliniczny. W obustronnej niedrożności przewodów
wytryskowych obserwuje się charakterystyczny
obraz nasienia: azoospermia, objętość ejakulatu
<1,5 mL i kwaśne pH nasienia (<7). W przezodbytniczym
badaniu USG można zobaczyć poszerzone pęcherzyki
nasienne (zwykle o średnicy >15 mm) lub samą przyczynę
zablokowania przewodów wytryskowych
(Isidori i Lenzi, 2008).
Chorzy oprócz niepłodności mogą nie mieć
innych objawów, a w przyczynach nabytych mogą mieć
objawy obserwowane w zapaleniu gruczołu krokowego
(np. hematospermia).
Leczenie. Leczenie niedrożności przewodów wytryskowych
zależy od etiologii. Wykonanie przezcewkowej
resekcji wzgórka nasiennego (TURED ang. transurethral
resection of the ejaculatory ducts) może spowodować
otwarcie zatoki lub torbieli stercza i doprowadzić
do poprawy parametrów nasienia i odsetka uzyskanych
ciąż
(Kadioglu i wsp., 2001).
Powikłaniem po TURED może być wytrysk wsteczny
lub wsteczny refluks moczu do przewodów wytryskowych
i nasieniowodów. Jednak mimo to TURED
uważany jest za metodę z wyboru. Alternatywą dla
TURED może być przezodbytnicze nakłucie i opróżnienie
torbieli pod kontrolą USG lub pozyskanie plemników
z najądrza lub jadra.
Zespół Younga
Zespół Younga to współwystępowanie azoospermii obturacyjnej
i przewlekłego zapalenia oskrzeli. Pomimo podobieństwa
objawów zespół ten nie jest formą ani CF, ani
CBAVD
(Handelsman i wsp., 1984).
Azoospermia w zespole
Younga spowodowana jest zablokowaniem przewodów
najądrza poprzez masy białkowe. Niepłodność w tym
zespole rozwija się wraz z wiekiem i wielu młodych
chorych posiada potomstwo. Wydaje się, że początkowo
drożny przewód najądrza ulega stopniowemu zablokowaniu
poprzez zbyt gęstą wydzielinę. W zespole Younga
nie obserwuje się żadnych anomalii rozwojowych układu
moczowo-płciowego.
Poziomy gonadotropin we krwi,
fruktozy i NAG w nasieniu oraz wielkość jąder są prawidłowe.
U mężczyzn z zespołem Younga znacznie częściej
obserwuje się zaburzenia ruchliwości plemników oraz upośledzoną ruchliwość rzęsek w nabłonku rzęskowym
głowy i trzonu najądrza oraz dróg oddechowych
(Wilton i wsp., 1991).
Przyczyną tego zespołu jest zaburzenie
budowy centralnej pary centriol i ramion dyneinowych.
Prowadzi to do pogorszenia ruchliwości plemników in
vivo, mimo że w warunkach in vitro częstość wychyleń
bocznych witki jest prawidłowa. Ponadto stwierdza się
upośledzoną czynność nabłonka w najądrzu i drogach
oddechowych (zbyt powolne oczyszczanie ze śluzu),
co jest prawdopodobnie przyczyną zablokowania przewodu
najądrza masami białkowymi
(Wilton i wsp., 1991).
Mężczyźni z zespołem Younga zwykle skarżą się
na przewlekły kaszel, nadmierną produkcję wydzieliny
oskrzelowej i przewlekające się zapalenia oskrzeli
od wczesnego dzieciństwa. Natomiast ogólny stan
zdrowia oraz czynność płuc i trzustki są dobre. Nieznana
jest częstość występowania tego zespołu, jak i przyczyny
jego powstawania.
Leczenie chirurgiczne, polegające na wykonaniu
zespolenia omijającego miejsce niedrożności, przynosi
tylko czasową poprawę. Wykorzystanie plemników pobranych
z jądra lub najądrza do rozrodu wspomaganego
może być jedyną formą leczenia.
Inne niegenetyczne przyczyny niedrożności
dróg wyprowadzających nasienie
Do niedrożności dróg wyprowadzających nasienie może
prowadzić zamierzone przecięcie nasieniowodów (wazektomia
wykonywana w celach antykoncepcyjnych) lub
obustronne uszkodzenie nasieniowodów lub najądrzy
w przebiegu innych operacji. W takiej sytuacji należy
chorego przed leczeniem operacyjnym poinformować
o ryzyku utraty płodności i możliwości zamrożenia
plemników. Do niedrożności nasieniowodu może także
dojść po plastyce przepukliny pachwinowej, szczególnie
w dzieciństwie. Niedrożność może też występować
w sieci jądra (łac. rete testis) lub na poziomie kanalików
wyprowadzających jądra (łac. ductuli efferentes).
Najczęściej jest ona następstwem wad wrodzonych,
urazu lub zapalenia.
Leczenie. U mężczyzn z niedrożnością przewodu najądrza
i prawidłową spermatogenezą można wykonać
zespolenie nasieniowodowo-najądrzowe
(łac. vasoepididymostomia),
a u mężczyzn z niedrożnością nasieniowodu
zespolenie nasieniowodowo-nasieniowodowe
(łac.
vasovasostomia). Powodzenie operacji zależy od pierwotnej
przyczyny niepłodności oraz techniki operacyjnej
(Belker i wsp., 1991;).
( Elzanaty i wsp., 2012;).
(Schroeder-Printzen i wsp.,2003).
Techniki mikrochirurgiczne wykazują wyższość
nad technikami rozrodu wspomaganego pod względem
liczby uzyskanych ciąż i kosztów leczenia
(Pasqualotto i wsp., 2004;).
(Kolettis i wsp., 1997).
Chory przed zabiegiem
chirurgicznym powinien być poinformowany, że nawet
w przypadku odtworzenia drożności dróg wyprowadzających
nasienie płodność może być nadal ograniczona
z innych powodów (np. przeciwciał przeciwplemnikowych)
lub niedrożność może pojawić się ponownie.
Operacje odtwórcze powinny być wykonywane w technice
mikrochirurgicznej w wyspecjalizowanych ośrodkach,
które wykonują wiele tego typu operacji
(Elzanaty i wsp., 2012).
W przypadkach gdy odtworzenie ciągłości dróg wyprowadzających
nasienie jest niemożliwe, można pobrać
plemniki drogą nakłucia najądrza (MESA, ang. microsurgical
epididymal sperm aspiration) lub jądra (TESE, ang.
testicular sperm extraction) i wykorzystać je do zapłodnienia
pozaustrojowego metodą wstrzyknięcia plemnika
do cytoplazmy komórki jajowej (ICSI, ang. intracytoplasmic
sperm injection)
(Jungwirth i wsp., 2015).
Plemniki
uzyskane z najądrza lub jądra mogą zostać zamrożone
i przechowywane w celu wykonania kolejnej próby ICSI
(Kliesch i wsp., 2010).
Skuteczność w pozyskiwaniu plemników
za pomocą biopsji cienkoigłowej jądra lub najądrza
jest niska
(Tournaye, 1999).
Infekcje w męskim układzie płciowym
Infekcje w męskim układzie płciowym mogą prowadzić
do niepłodności nie tylko w mechanizmie powstawania
niedrożności dróg wyprowadzających nasienie.
Obecność infekcji i zapalenia w gruczołach płciowych
dodatkowych prowadzi do uszkodzenia plemników bezpośrednio
poprzez drobnoustroje lub ich toksyny
(Diemer i wsp., 2000).
(Tournaye, 1999Diemer i wsp., 2003b).
(Filipiak i wsp., 2015).
( de Francesco
i wsp., 2011).
(Jędrzejczak i wsp., 2005).
oraz dodatkowo
poprzez lokalnie produkowane cytokiny. Szkodliwe
działanie cytokin na ruchliwość i czynność plemników
oraz czynność komórek Leydiga w jądrach było obserwowane
w badaniach doświadczalnych i klinicznych
(Diemer i wsp., 2003a;).
( Pellati i wsp., 2008;).
(Sanocka i wsp., 2004).
W infekcji dochodzi także do zwiększonego wytwarzania
reaktywnych form tlenu (RFT, ang. reactive oxygen species),
które niekorzystnie wpływają na czynność plemników
(Aitken i wsp., 2010;).
(Frączek i wsp., 2007).
(Frączek i wsp., 2016;).
(Walczak-Jędrzejowska,
2015).
Choroby weneryczne, a szczególnie rzeżączka,
były w przeszłości główną przyczyną zakażeń układu
moczowo-płciowego
i niepłodności obturacyjnej.
Obecnie infekcje Chlamydia trachomatis, Mycoplasma spp
i Ureaplasma urealyticum oraz bakteriami gram ujemnymi
są najczęstszą przyczyną tego stanu
(Pickard i wsp., 2016;).
(Weidner i wsp., 1999a).
Zakażenie dróg wyprowadzających
nasienie zwykle zaczyna się od zakażenia cewki
moczowej (łac. urethritis), a następnie może objąć gruczoł
krokowy (łac. prostatitis) wraz z pęcherzykami nasiennymi
(łac. vesiculitis) oraz najądrze (łac. epididymitis)
i jądro (łac. orchitis).
W grupie młodych mężczyzn główną przyczyną zapalenia
najądrza są infekcje przenoszone drogą płciową –
Chlamydia trachomatis, Neisseria gonorrheae
(Weidner i wsp.,1999a).
Natomiast w grupie mężczyzn starszych częściej stwierdza się zakażenie Escherichia coli lub Pseudomonas
aeruginosa. Ostre zapalenia najądrza manifestuje się
obrzękiem najądrza, nasiloną bolesnością przy badaniu
palpacyjnym oraz gorączką. W badaniu USG zwykle
znajduje się powiększone, obrzęknięte najądrze
(Pilatz i wsp., 2013).
W przewlekłym zapaleniu najądrza, które
rozwija się u ok. 15% chorych, nasilone procesy włóknienia
mogą spowodować niedrożność przewodu najądrza
(Gimenes i wsp., 2014).
Niedrożność dróg wyprowadzających
nasienie po obustronnym zapaleniu najądrzy
obserwuje się u ok. 20% chorych z azoospermią obturacyjną
(Ludwig, 2008).
U chorych z zapaleniem najądrza
obserwuje się różnie nasilone zaburzenia budowy morfologicznej
plemników oraz zwiększoną liczbę makrofagów
w nasieniu. Dodatni wynik posiewu nasienia występuje
jedynie w ok. 50% przypadków
(Tracy i wsp., 2008).
Zapalenie jądra zwykle rozwija się jako następstwo
nieleczonego lub leczonego niewłaściwie zapalenia najądrza.
Manifestuje się nasilonym obrzękiem i bolesnością
jądra z najądrzem oraz gorączką. Natomiast przewlekłe
podostre zapalenie jądra u większości chorych
może przebiegać bezobjawowo i może spowodować włóknienie
i hialinizację kanalików plemnikotwórczych oraz
zatrzymanie spermatogenezy. Następstwem może być
także niedrożność kanalików wyprowadzających jądra.
W bioptatach jąder od niepłodnych mężczyzn często
obserwowano lokalne nacieki limfocytarne wokół kanalików,
w których obecna była uszkodzona spermatogeneza
(Schuppe i wsp., 2008).
Zapalenie najądrza i/lub jądra zwykle poprzedzane
jest przez zapalenie gruczołu krokowego. Zapalenie
stercza może przebiegać jako ostre bakteryjne zapalenie
(typ I – leukocyty i bakterie obecne są w moczu, występuje
gorączka i nasilone dolegliwości bólowe, zaburzenia
oddawania moczu); przewlekłe zapalenie (typ II – stan
przewlekły, z okresami zaostrzeń i remisji, bez nasilonych
objawów klinicznych, leukocyty i drobnoustroje
występują w wydzielinie i moczu po masażu stercza oraz
w nasieniu); przewlekłe niebakteryjne zapalenie (typ IIIa –
leukocyty obecne w wydzielinie po masażu stercza
i nasieniu, brak bakterii w nasieniu i moczu; typ IIIb –
zapalenie widoczne tylko w badaniu histopatologicznym)
lub bezobjawowe zapalenie (typ IV – leukocyty i bakterie
obecne w wydzielinie po masażu stercza i w nasieniu,
brak objawów klinicznych)
((Nickel, 1998).).
Obecność
w wydzielinie po masażu stercza powyżej 10–15 leukocytów
w polu widzenia lub w moczu po masażu powyżej
3 leukocytów w polu widzenia uważa się za wystarczające
do postawienia rozpoznania zapalenia gruczołu krokowego
(Weidner i wsp., 1999b).
Ostremu, jak i przewlekłemu
zapaleniu gruczołu krokowego może towarzyszyć
zapalenie pęcherzyków nasiennych. W badaniu przedmiotowym
zwraca uwagę obniżenie spoistości i „ciastowata”
konsystencja gruczołu krokowego i pęcherzyków
nasiennych. W przewlekłym stanie zapalnym w ultrasonografii
często obserwuje się w gruczole krokowym niehomogenną
strukturę i zwapnienia o różnym nasileniu
i wielkości, torbiele wewnątrz gruczołu, powiększenie
i asymetrię gruczołu, powiększenie lub torbiele pęcherzyków
nasiennych. Charakterystycznym objawem
zapalenia pęcherzyków nasiennych jest obecność erytrocytów
w nasieniu (ang. hematospermia)
(Furuya i wsp.,1999; ).
(Munkelwitz i wsp., 1997).
W każdym przypadku
w nasieniu występuje zwiększona liczba leukocytów
i/lub bakterii.
U chorych z zaburzeniem płodności zakażenie
w układzie płciowym często przebiega ze skąpymi objawami
podmiotowymi lub bezobjawowo. W wywiadzie
chorzy czasem podają przebytą infekcję lub zakażenie
chorobą przenoszoną drogą płciową. Badaniem stawiającym
ostateczne rozpoznanie jest badanie mikrobiologiczne
ejakulatu, wydzieliny gruczołu krokowego
po masażu i/lub wymazu z cewki moczowej. Obecność
w nasieniu powyżej 1000 kolonii bakterii gram ujemnych
w 1 mL lub obecność Ureaplasma urealyticum pozwala
na postawienie rozpoznania zapalenia o podłożu bakteryjnym
(Weidner i wsp., 1999b).
Należy pamiętać,
że nie ma możliwości wykrycia w posiewie nasienia
infekcji Chlamydia trachomatis. W celu potwierdzenia
takiej infekcji można badać występowanie specyficznych
przeciwciał IgA w plazmie nasienia
(Mazzoli i wsp.,2007)
lub wykrywać DNA bakterii za pomocą reakcji
łańcuchowej polimerazy (PCR, ang. polymerase chain reaction).
Wykazano jednak, że występowanie przeciwciał
anty-
chlamydiowych nie zawsze towarzyszy aktualnej
infekcji wykrywanej za pomocą PCR. Dlatego diagnostyka
genetyczna uważana jest obecnie za „złoty standard”.
Niezależnie od badań mikrobiologicznych, immunologicznych
i genetycznych występowanie w nasieniu powyżej
1 mln/mL leukocytów uważa się za patognomoniczne
dla infekcji dróg wyprowadzających nasienie
((WHO,2010).)
Ostatnio wprowadzono oznaczanie w plazmie
nasienia nowych markerów zapalenia takich jak stężenie
elastazy granulocytarnej czy interelukiny 8 (IL-8, ang.
interleukin 8)
(Jungwirth i wsp., 2015;).
( Penna i wsp., 2007).
W infekcjach układu płciowego zwykle obserwuje się
zwiększoną lepkość, zmniejszenie objętości i zwiększone
pH ejakulatu oraz obniżenie stężenia markerów biochemicznych
czynności dodatkowych gruczołów płciowych
w plazmie nasienia. W zapaleniu najądrzy obserwuje się
obniżenie stężenia obojętnej α-glukozydazy,
przy zapaleniu
gruczołu krokowego obniża się stężenie kwasu
cytrynowego i cynku, a przy zapaleniu pęcherzyków
nasiennych obniża się stężenie fruktozy w plazmie
nasienia
(WHO, 2010).
W przewlekłych zapaleniach
gruczołu krokowego, które zwykle łączą się z upośledzeniem
jego funkcji sekrecyjnej, obserwuje się wydłużenie
czasu upłynnienia nasienia. Czas upłynniania nasienia
zwykle wynosi ok. 15–30 min i nie powinien przekraczać
60 min
(WHO, 2010).
Proces upłynniania nasienia jest
zależny od aktywności endogennych enzymów proteolitycznych
wydzielanych głównie przez gruczoł krokowy.
Wydłużenie czasu upłynnienia nasienia może być przyczyną
zaburzenia ruchliwości plemników. Ruchliwośći czynność plemników obniża się, gdy w plazmie nasienia
występują podwyższone stężenia cytokin prozapalnych,
szczególnie IL-6 i IL-8
(Walczak-Jędrzejowska i wsp., 2015)
Lekocytospermia powoduje obniżenie odsetka
prawidłowo zbudowanych plemników
(Aziz i wsp.,2004;)
(Menkveld i Kruger, 1998;)
(Sharma i wsp., 2001)
Obserwuje się nieprawidłową strukturę plemników,
zaburzenie budowy i czynności akrosomu oraz integralności
chromatyny plemnikowej, a także zwiększenie
odsetka plemników z resztkową cytoplazmą.
Zaburzenia kształtu główki plemnika, jak i obecność
dużych kropli cytoplazmatycznych, prawdopodobnie
związane jest z zaburzoną funkcją komórek
Sertoliego oraz uszkodzeniami DNA
(Aziz i wsp.,2004;)
(Menkveld i Kruger, 1998;)
(Menkveld i wsp., 2003)
Leczenie. Celem leczenia infekcji jest eradykacja patogenu,
obniżenie koncentracji leukocytów i cytokin
w plazmie nasienia oraz poprawa parametrów nasienia
(Hamada i wsp., 2011;)
(Pajovic i wsp., 2013)
Leczenie
zakażeń w męskim układzie płciowym powinno być
celowane w oparciu o antybiogram
(Pickard i wsp., 2016).
Długość leczenia uzależniona jest od miejsca zakażenia
(najkrócej trwa w izolowanym zakażeniu cewki
moczowej, najdłużej w zakażeniu gruczołu krokowego).
W zakażeniu Chlamydia trachomatis lekami z wyboru
są makrolidy (azytromycyna) lub teracykliny (doksycyklina
2 × 100 mg/dz p.o.). Infekcje Ureaplasma urealyticum
mogą być leczone tetracycliną (dawkowanie jak powyżej)
lub erytromycyną (2 g/dz p.o.). Zakażenie Neisseria
gonorrhoeae może być leczone cefalosporynami III generacji:
cefiksym (400 mg p.o.) lub ceftriakson (500 mg
i.m. jednorazowo) lub azytromycyną. Skuteczność
leczenia fluorochinolonami jest niepewna ze względu
na zwiększającą się oporność bakterii. Niepowikłane
zapalenie najądrza może być leczone ceftriaksonem
(500 mg i.m. jednorazowo) w połączeniu z doksycykliną
(2 × 100 mg/dz p.o. przez 10 dni) lub fluorochinolonami:
ofloksacyną (300 mg 2 × dz przez 10 dni) lub lewofloksacyną
(500 mg/dz p.o. przez 10 dni).
Ostre zapalenie stercza powinno być leczone przez
co najmniej 4 tygodnie szerokowidmowymi penicylinami,
cefalosorynami III generacji lub fluorochinolonami
w połączeniu z aminoglikozydami. W najcięższych
przypadkach leczenie musi być uzupełnione nadłonowym
odprowadzeniem moczu
(Jungwirth i wsp., 2015;).
(Weidner i wsp., 2008).
Przewlekłe zapalenie stercza może
być leczone fluorochinolonami przez 4–6 tyg.
(
(Weidner i wsp. 1999b,).
(Weidner i wsp., 2008).
W przypadkach niepowodzenia
leczenia można zastosować długotrwałe podawanie
trimetoprimu (50 mg/dz) lub nitrofurantoiny przez
3–6 miesięcy. W przypadku przewlekłego zapalenia
typu III (niebakteryjnego) nie ma leczenia przyczynowego.
W 4 do 8 tyg. po zakończenia leczenia należy ocenić
jego skuteczność. Samo zastosowanie antybiotyków
w wielu przypadkach nie jest wystarczająco skuteczne
i często łączone jest z lekami immunomodulującymi,
fitoterapią czy lekami przeciwzapalnymi w zależności
od indywidualnego stanu mężczyzn
(Magistro i wsp.,2016).
Należy pamiętać, że antybiotykoterapia może
prowadzić do przejściowego pogorszenia parametrów
nasienia i płodności poprzez bezpośredni negatywny
wpływ na proces spermatogenezy i czynność plemników
(Khaki, 2015).
Ponadto konieczna jest jednoczesna diagnostyka
infekcji u partnerki i ewentualne jej leczenie.
Piśmiennictwo
Aitken R.J., De Iuliis G.N., Finnie J.M., Hedges A., McLachlan R.I.: Analysis of
the relationships between oxidative stress, DNA damage and sperm vitality
in a patient population: development of diagnostic criteria. Hum Reprod.
2010, 25, 2415–2426. doi: 10.1093/humrep/deq214. PMID: 20716559
.
Andersson A.M., Petersen J.H., Jorgensen N., Jensen T.K., Skakkebaek N.E.:
Serum inhibin B and follicle-
stimulating hormone levels as tools in the
evaluation of infertile men: significance of adequate reference values from
proven fertile men. J Clin Endocrinol Metab. 2004, 89, 2873–2879. doi:
10.1210/jc.2003-
032148. PMID: 15181071
.
Aziz N., Agarwal A., Lewis-Jones
I., Sharma R.K, Thomas A.J. Jr: Novel association
between specific sperm morphological defects and leukocytospermia.
Fertil Steril. 2004, 82, 621–627. doi: 10.1016/j.fertnstert.2004.02.112.
PMID: 15374705.
Behre H.M., Nieschlag E., Weidner W., Wieacker P.: Diseases of seminal ducts.
W: Andrology. Male reproductive health and dysfunction. Nieschlag E., Behre
H.M., Nieschlag S. (red.) Springer-Verlag,
Heidelberg, Berlin 2010, 273–288.
Belker A.M., Thomas A.J., Fuchs E.F.: Results of 1,469 microsurgical reversals
by vasovasostomy study group. J Urol. 1991, 145, 505–511. PMID: 1997700.
Björndahl L.: Basic semen analysis and laboratory quality for clinicians. W:
Clinical Andrology. EAU/ESAU Course Guidelines. Björndahl L., Giwercman
A., Tournaye H., Weidner W. (red). Informa UK, 2010, 28–38.
de Braekeleer M., Férec C.: Mutations in the cystic fibrosis gene in men with
congenital bilateral absence of the vas deferens. Mol Hum Reprod. 1996,
2, 669–677. doi: 10.1093/molehr/2.9.669 PMID: 9239681.
Diemer T., Hales D.B., Weidner W.: Immuno-
endocrine interactions and
Leydig cell function: the role of cytokines. Andrologia 2003a, 35, 55–63.
PMID: 12558529.
Diemer T., Huwe P., Ludwig M., Hauck E.W., Weidner W.: Urogenital infections
sperm motility. Andrologia, 2003b, 35, 283–287. doi: 10.1046/j.1439-
- 0272.2003.00556.x. PMID: 14535856.
Diemer T., Huwe P., Michelmann H.W., Mayer F., Schiefer H.G., Weidner W.: E. coli
induced alterations of human spermatozoa: an electron microscopy analysis.
Int J Androl. 2000, 23, 178–186. doi: 10.1046/j.1365-2605.2000.00224.
x.
PMID: 10844544.
Disset A., Michot C., Harris A., Buratti E., Claustres M., Tuffery-Giraud
S.: A T3
allele in the CFTR gene exacerbates exon 9 skipping in vas deferens and
epididymal cell lines and is associated with Congenital Bilateral Absence
of Vas Deferens (CBAVD). Hum Mutat. 2005, 25, 1, 72–81. doi: 10.1002/
humu.20115. PMID: 15580565
Dohle G.R., Elzanaty S., van Casteren N.J.: Testicular biopsy: clinical practice
and interpretation. Asian J Androl. 2012, 14, 88–93. doi: 10.1038/
aja.2011.57. PMID: 22157985.
Dörk T., Dworniczak B., Aulehla-Scholz
C., Wieczorek D., Böhm I., Mayerova
A. i wsp.: Distinct spectrum of CFTR gene mutations in congenital absence
of vas deferens. Hum Genet, 1997, 100, 365–377. PMID: 9272157.
Drake M.J., Quinn F.M.: Absent vas deferens and ipsilateral multicystic dysplastic
kidney in a child. Br J Urol 1996, 77, 756–757. PMID: 8689131.
Elder J.S., Mostwin J.L.: Cyst of the ejaculatory duct/urogenital sinus. J Urol.
1984, 132,768–771. PMID: 6471229.
Elzanaty S., Dohle G.R.: Vasovasostomy and predictors of vasal patency:
a systematic review. Scand J Urol Nephrol. 2012, 46(4), 241–246. doi:
10.3109/00365599.2012.669790. PMID: 22452615.
Engelmann U., Gralla O.: Vasectomy and refertilization. W: Andrology. Male
reproductive health and dysfunction. Nieschlag E., Behre H.M., Nieschlag S.
(red.). Springer-Verlag,
Heidelberg, Berlin, 2010, 565–576.
Filipiak E., Marchlewska K., Oszukowska E., Walczak-Jedrzejowska
R.,
Swierczynska-Cieplucha
A. i wsp.: Presence of aerobic microorganisms and
their influence on basic semen parameters in infertile men. Andrologia
2015, 47, 826–831. doi: 10.1111/and.12338. PMID: 25209133.
Fisch H., Lambert S.M., Goluboff E.T.: Management of ejaculatory duct obstruction:
etiology, diagnosis, and treatment. World J Urol. 2006, 24, 604–610.
doi: 10.1007/s00345-006-0129-4.
PMID: 17077974.
de Francesco M.A., Negrini R., Ravizzola G., Galli P., Manca N.: Bacterial
species present in the lower male genital tract: a five-year
retrospective
study. Eur J Contracept Reprod Health Care. 2011, 16, 47–53. doi:
10.3109/13625187.2010.533219. PMID: 21091298.
Fraser-Pitt D., O’Neil D.: Cystic fibrosis - a multiorgan protein misfolding
disease. Future Sci OA. 2015, 1(2). doi: 10.4155/fso.15.57. PMID: 28031875.
Frączek M., Hryhorowicz M., Gill K., Zarzycka M., Gaczarzewicz D., Jedrzejczak P.
i wsp.: The effect of bacteriospermia and leukocytospermia on conventional
and nonconventional semen parameters in healthy young normozoospermic
males. J Reprod Immunol. 2016, 118, 18–27. doi: 10.1016/j.jri.2016.08.006.
PMID: 27606568.
Frączek M., Szumala-Kakol
A., Jedrzejczak P., Kamieniczna M., Kurpisz M.:
Bacteria trigger oxygen radical release and sperm lipid peroxidation in in
vitro model of semen inflammation. Fertil Steril. 2007, 88(4 Suppl), 1076–
1085. DOI: 10.1016/j.fertnstert.2006.12.025. PMID: 17383646.
Furuya S., Ogura H., Saitoh N., Tsukamoto T., Kumamoto Y., Tanaka Y.:
Hematospermia: an investigation of the bleeding site and underlying lesions.
Int J Urol, 1999, 6, 539–547. doi: 10.1046/j.1442-2042.1999.611110.
x.
PMID: 10585119.
Gimenes F., Souza R.P., Bento J.C., Teixeira J.J., Maria-Engler
S.S., Bonini M.G.,
Consolaro M.E.: Male infertility: a public health issue caused by sexually
transmitted pathogens. Nat Rev Urol. 2014, 11, 672–87. doi: 10.1038/nrurol.
2014.285. PMID: 25330794.
Hamada A., Agarwal A., Sharma R., French D.B., Ragheb A., Sabanegh E.S. Jr.:
Empirical treatment of low-
level leukocytospermia with doxycycline in
male infertility patients. Urology 2011, 78, 1320–1325. doi: 10.1016/j.urology.
2011.08.062. PMID: 22137697.
Handelsman D.J., Conway A.J., Boylan L.M., Turtle J.R.: Young’s syndrome.
Obstructive azoospermia and chronic sinopulmonary infections. N Engl
J Med. 1984, 10, 3–9. doi: 10.1056/NEJM198401053100102. PMID: 6689737.
Isidori A.M., Lenzi A.: Scrotal ultrasound: morphological and functional
atlas. Forum Service Editore s.r.l., Genua, 2008.
Jalalirad M., Houshmand M., Mirfakhraie R., Goharbari M.H., Mirzajani F.:
First study of CF mutations in the CFTR gene of Iranian patients: detection
of DeltaF508, G542X, W1282X, A120T, R117H, and R347H mutations.
J Trop Pediatr. 2004, 50(6), 359–361. DOI: 10.1093/tropej/50.6.359.
PMID: 15537723.
Jędrzejczak P., Frączek M., Szumała‑Kąkol
A., Taszarek-Hauke
G., Pawelczyk
L., Kurpisz M.: Consequences of semen inflammation and lipid peroxidation
on fertilization capacity of spermatozoa in in vitro conditions. Int
J Androl. 2005, 28, 275–283. doi: 10.1111/j.1365‑2605.2005.00547.
x.
PMID: 16128987.
Jungwirth A., Diemer T., Dohle G.R., Giwercman A., Kopa Z., Krausz C. i wsp.:
Guidelines on Male Infertility. Tournaye H. European Association of Urology
(EAU), 2015.
Kadioglu A., Cayan S., Tefekli A., Orhan I., Engin G., Turek P.J.: Does response
to treatment of ejaculatory duct obstruction in infertile men vary with
pathology? Fertil Steril. 2001, 76(1), 138–142. PMID: 11438332.
Kerem B., Chiba-Falek
O., Kerem E.: Cystic fibrosis in Jews: frequency and mutation
distribution. Genet Test. 1997, 1(1), 35–39. DOI: 10.1089/gte.1997.1.35.
PMID: 10464623.
Kerem B., Kerem E.: The molecular basis for disease variability in cystic fibrosis.
Eur J Hum Genet. 1996, 4, 65–73. PMID: 8744024.
Khaki A.: Assessment on the adverse effects of Aminoglycosides and
Flouroquinolone on sperm parameters and male reproductive tissue: A systematic
review. Iran J Reprod Med. 2015, 13 (3), 125–134. PMID: 26000002.
Kliesch S., Kamischke A., Cooper T.G., Nieschlag E.: Cryopreservation of human
spermatozoa. W: Andrology. Male reproductive health and dysfunction.
Nieschlag E, Behre HM, Nieschlag S (red.). Springer-Verlag,
Heidelberg,
Berlin, 2010, 505–520.
Kolettis P.N., Thomas A.J. Jr: Vasoepididymostomy for vasectomy reversal:
a critical assessment in the era of intracytoplasmic sperm injection J Urol,
1997, 158, 467–470. PMID: 9224325.
Ludwig M.: Diagnosis and therapy of acute prostatitis, epididymitis and orchitis.
Andrologia 2008, 40, 76–80. doi: 10.1111/j.1439-
0272.2007.00823.x.
PMID: 18336454.
Magistro G., Wagenlehner F.M., Grabe M., Weidner W., Stief C.G., Nickel
J.C.: Contemporary Management of Chronic Prostatitis/Chronic
Pelvic Pain Syndrome. Eur Urol. 2016, 69(2), 286–297. doi: 10.1016/j.
eururo.2015.08.061. PMID: 26411805.
Massie J., Delatycki M.B.: Cystic fibrosis carrier screening. Paediatric respiratory
reviews. 2013, 14 (4), 270–275. doi: 10.1016/j.prrv.2012.12.002.
PMID: 23466339.
Mazzoli S., Cai T., Rupealta V., Gavazzi A., Castricchi Pagliai R., Mondaini
N., Bartoletti R.: Interleukin 8 and anti-
chlamydia trachomatis mucosal
IgA as urogenital immunologic markers in patients with C. trachomatis
prostatic infections. Eur Urol, 2007, 51, 1385–1393. doi: 10.1016/j.
eururo.2006.10.059. PMID: 17107749.
Menkveld R., Huwe P., Ludwig M.,Weidner W.: Morphological sperm alternations
in different types of prostatitis. Andrologia 2003, 35, 288–293. doi:
10.1046/j.1439-
0272.2003.00574.x. PMID: 14535857.
Menkveld R., Kruger T.F.: Sperm morphology and male urogenital infections.
Andrologia 1998, 30 (suppl 1), 49–53. doi: 10.1111/j.1439‑0272.1998.
tb01382.x. PMID: 9629443.
Meschede D., Dworniczak B., Behre H.M., Kliesch S., Claustres M., Nieschlag E.,
Horst J.: CFTR gene mutations in men with bilateral ejaculatory‑duct
obstruction
and anomalies of the seminal vesicles. Am J Hum Genet. 1997a, 61,
1200–1202. doi: 10.1086/301606. PMID: 9345100.
Meschede D., Nieschlag E., Horst J.: Assisted reproduction for infertile couples
at high genetic risk: An ethical consideration. Bμiomedical Ethics. 1997b,
2, 4–6. PMID: 9572415.
Munkelwitz R., Krasnokutsky S., Lie J., Shah S.M., Bayshtok J., Khan S.A.: Current
perspectives on hematospermia: A review. J Androl, 1997, 18, 6–14. doi:
10.1002/j.1939-4640.1997.
tb01870.x. PMID: 9089062.
Nickel J.C.: Prostatitis: Myths and realities. Urology. 1998, 51, 362–366.
PMID: 9510337.
O’Sullivan B.P., Freedman S.D.: Cystic fibrosis. Lancet. 2009, 373, 1891–904.
doi: 10.1016/S0140-
6736(09)60327-5.
PMID: 19403164.
Pajovic B., Radojevic N., Vukovic M., Stjepcevic A.: Semen analysis before and
after antibiotic treatment of asymptomatic chlamydia-
and ureaplasma-related
pyospermia. Andrologia. 2013, 45, 266–271. doi: 10.1111/and.12004.
PMID: 22897222.
Pasqualotto F.F., Lucon A.M., Sobreiro B.P., Pasqualotto E.B., Arap S.: The best
infertility treatment for vasectomized men: assisted reproduction or vasectomy
reversal?. Rev. Hosp. Clin. Fac Med Sao Paulo. 2004, 59(5), 312–315.
doi: /S0041-87812004000500016. PMID: 15543406.
Pellati D., Mylonakis I., Bertoloni G., Fiore C., Andrisani A., Ambrosini G.. i wsp.:-
Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol.
2008, 140(1), 3–11. doi: 10.1016/j.ejogrb.2008.03.009. PMID: 18456385.
Penna G., Mondaini N., Amuchastegui S., Innocenti S., Carini M., Giubilei G. i wsp.:
Seminal plasma cytokines and chemokines in prostate inflammation: Interleukin
8 as a predictive biomarker in CP/CPPS and benign prostatic hyperplasia. Eur
Urol, 2007, 51, 524–533. doi: 10.1016/j.eururo.2006.07.016. PMID: 16905241.
Pickard R., Bartoletti R, Bjerklund-Johansen
T.E., Bonkat G., Bruyère F., Çek
M. i wsp.: EAU guidelines on urological infections. European Association
of Urology (EAU), 2016.
Pilatz A., Wagenlehner F., Bschleipfer T., Schuppe H.C., Diemer T., Linn T. i wsp.:
Acute epididymitis in ultrasound: results of a prospective study with baseline
and follow-up
investigations in 134 patients. Eur J Radiol.2013, 82,
762–768. doi: 10.1016/j.ejrad.2013.08.050PMID: 24094645.
Pizzo L., Fariello M.I., Lepanto P., Aguilar PS., Kierbel A.: An image analysis
method to quantify CFTR subcellular localization. Mol Cell Probes. 2014,
28(4), 175–180. doi: 10.1016/j.mcp.2014.02.004. PMID: 24561544.
Popli K., Stewart J.: Infertility and its management in men with cystic
fibrosis: review of literature and clinical practices in the UK. Hum Fertil
(Camb). 2007, 10, 217–21. doi: 10.1080/14647270701510033. PMID:
18049957.
Rave-Harel
N., Kerem E., Nissim-Rafinia
M., Madjar I., Goshen R., Augarten A.
i wsp.: The molecular basis of partial penetrance of splicing mutations in
cystic fibrosis. Am J Hum Genet. 1997, 60, 87–94. PMID: 8981951.
Rave-Harel
N., Madgar I., Goshen T., Nissim-Rafinia
M., Zaidni A., Rahat A. i wsp.:
CFTR haplotype analysis reveals genetic heterogeneity in the etiology of
congenital bilateral aplasia of the vas deferens. Am J Hum Genet, 1995,
56, 1359–1366. PMID: 8981951.
Sanocka D., Fraczek M., Jedrzejczak P., Szumała-Kakol
A., Kurpisz M.: Male
genital tract infection: an influence of leukocytes and bacteria on semen.
J Reprod Immunol. 2004, 62, 111–124. doi: 10.1016/j.jri.2003.10.005.
PMID: 15288187.
Schroeder-Printzen
I., Diemer T., Weidner W.: Vasovasostomy. Urol Int, 2003,
70(2), 101–107. doi: 68182. PMID: 12592037.
Schuppe H.C., Meinhardt A., Allam J.P., Bergmann M., Weidner W., Haidl G.:
Chronic orchitis a neglected cause of male infertility? Andrologia 2008, 40,
84–91. doi: 10.1111/j.1439-
0272.2008.00837.x.
Sharma R.K., Pasqualotto E.A., Nelson D.R., Thomas A.J. Jr, Agarwal A.:
Relationship between seminal white blood cell counts and oxidative stress
in men treated at an infertility clinic. J Androl 2001, 22, 575–583. doi:
10.1002/j.1939-4640.2001.
tb02217.x. PMID: 11451354.
Tournaye H.: Surgical sperm recovery for intracytoplasmic sperm injection:
which method is to be preferred? Hum Reprod. 1999, Suppl 1, 71–81.
PMID: 10573025.
Tracy C.R., Steers W.D., Costabile R.D.: Diagnosis and management of epididymitis.
Urol Clin North Am, 2008, 35:101–108. doi: 10.1016/j.ucl.2007.09.013.
PMID: 18061028.
Walczak-Jędrzejowska
R.: Stres oksydacyjny a niepłodność męska. Część I:
czynniki wywołujące stres oksydacyjny w nasieniu / Oxidative stress and
male infertility. Part I: factors causing oxidative stress in semen. Postępy
Androl Online. 2015, 2, 5–15. [przeglądany: 20/05/2016 r.]. Dostępny w:
http://www.postepyandrologii.pl
Weidner W., Krause W., Ludwig M.: Relevance of male accessory gland infection
for subsequent fertility with special focus on prostatitis. Hum Reprod
Update, 1999a, 5, 421–432. doi: 10.1093/humupd/5.5.421. PMID: 10582781.
Weidner W., Ludwig M., Brähler E., Schiefer H.G.: Outcome of antibiotic therapy
with ciprofloxacin in chronic bacterial prostatitis. Drugs. 1999b, 58
Suppl 2, 103–106. PMID: 10553717.
Weidner W., Wagenlehner F.M.E., Marconi M., Pilatz A., Pantke K.H., Diener T.:
Acute bacterial prostatitis and chronic prostatitis/chronic pelvic pain syndrome:
Andrological implications. Andrologia, 2008, 40, 105–112. doi:
10.1111/j.1439-
0272.2007.00828.x. PMID: 18336460.
World Health Organization. WHO Laboratory Manual for the Examination and
Processing of Human Semen. 5th ed. World Health Organization Press, Geneva 2010.
Wilschanski M., Corey M., Durie P., Tullis E., Bain J., Asch M. i wsp.: Diversity of
reproductive tract abnormalities in men with cystic fibrosis. JAMA, 1996,
276, 607–608. doi:10.1001/jama.1996.03540080029022. PMID: 8773631.
Wilton L.J., Teichtahl H., Temple-Smith
P.D., Johnson J.L., Southwick G.J.,
Burger H.G. i wsp.: Young’s syndrome (obstructive azoospermia and chronic
sinobronchial infection): A quantitative study of axonemal ultrastructure
and function. Fertil Steril, 1991, 55, 144–151. PMID: 1986955.
Yu J., Chen Z., Ni Y., Li Z.: CFTR mutations in men with congenital bilateral
absence of the vas deferens (CBAVD): a systemic review and meta-analysis.
Hum
Reprod. 2012, 27(1), 25–35. doi: 10.1093/humrep/der377. PMID: 22081250.
REKOMENDACJE DOTYCZĄCE POSTĘPOWANIA W MĘSKIEJ NIEPŁODNOŚCI
REKOMENDACJE DOTYCZĄCE
POSTĘPOWANIA W MĘSKIEJ NIEPŁODNOŚCI
GUIDELINES ON MALE INFERTILITY
A. Jungwirth (Przewodniczący), T. Diemer, G.R. Dohle, B. A. Giwercman, Z. Kopa, C. Krausz, H. Tournaye
Tłumaczenie i przygotowanie wersji polskiej/Translation and elaboration of Polish version:
Piotr Świniarski1, Jan Karol Wolski2, Jolanta Słowikowska-Hilczer3
1 Kliniczny Oddział Urologii i Onkologii Urologicznej, 10 Wojskowy Szpital Kliniczny z Polikliniką w Bydgoszczy; 2 Przychodnia
Lekarska „Novum” w Warszawie, Klinika Nowotworów Układu Moczowego, Centrum Onkologii – Instytut im. Marii Skłodowskiej-
Curie w Warszawie; 3 Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi
Autor do korespondencji/corresponding author: Jolanta Słowikowska-Hilczer, Zakład Endokrynologii Płodności,
Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. Sterlinga 5, 91-425 Łódź,
tel.: 42 633 07 05, jolanta.slowikowska-hilczer@umed.lodz.pl
Otrzymano/received: 29.07.2016 r. • Zaakceptowano/accepted: 15.11.2016 r.
© European Association of Urology 2015
Skróty / Abbreviations
AR – receptor androgenowy (ang. androgen receptor), ART – technika rozrodu wspomaganego medycznie (ang. assisted reproductive technique),
AZF – czynnik ulegający delecji w azoospermii (ang. azoospermic factor), CAIS – zespół całkowitej niewrażliwości na androgeny
(ang. complete androgen insensitivity syndrome), CBAVD – wrodzony obustronny brak nasieniowodów (ang. congenital bilateral absence of
the vas deferens), CF – zwłóknienie torbielowate – mukowiscydoza (ang. cystic fibrosis), CFTR – gen odpowiedzialny za regulację przewodnictwa
przezbłonowego w zwłóknieniu torbielowatym (ang. cystic fibrosis transmembrane conductance regulator), CFU – jednostka tworząca
kolonię (ang. colony forming unit), CIS – rak in situ (łac. carcinoma in situ), CMV – wirus cytomegalii (łac. Cytomegalovirus), CNV – liczba
kopii określonej sekwencji DNA (ang. copy number variants), CPPS – przewlekły zespół bólowy miednicy (ang. chronic pelvic pain syndrome),
CT – tomografia komputerowa (ang. computed tomography), EAA – Europejska Akademia Andrologii (ang. European Academy of Andrology),
EAU – Europejskie Towarzystwo Urologiczne (ang. European Association of Urology), EMB – medycyna oparta na faktach (ang. evidence‑based
medicine), EMQN – europejska sieć do spraw jakości molekularnych badań genetycznych (ang. European Molecular Genetics Quality Network),
EPS – wydzielina prostaty po masażu (ang. expressed prostatic secretion), FISH – fluorescencyjna hybrydyzacja in situ (ang. fluorescence in situ
hybridization), FSH – hormon folikulotropowy (ang. follicle-stimulating hormone), GnRH – hormon uwalniający gonadotropiny (ang. gonadotropin-
releasing hormone), GR – stopień rekomendacji (ang. grade of recommendation), hCG – ludzka gonadotropina kosmówkowa (ang. human
chorionic gonadotropin), HIV – ludzki wirus niedoboru odporności immunologicznej (ang. human immunodeficiency virus), hMG – ludzka
gonadotropina menopauzalna (ang. human menopausal gonadotropin), ICSI – wstrzyknięcie plemnika do cytoplazmy komórki jajowej (ang.
intracytoplasmatic sperm injection), IHH – idiopatyczny hipogonadyzm hipogonadotropowy (ang. idiopathic hypogonadotrophic hypogonadism),
IL – interleukina (ang. inerleukin), ISSM – Międzynarodowe Towarzystwo Medycyny Seksualnej (ang. International Society for Sexual Medicine),
ITGCN – wewnątrzkanalikowy nowotwór z komórek płciowych (ang. intratubular germ cell neoplasia), ITGCNU – wewnątrzkanalikowy
nowotwór jądra z komórek płciowych typu niesklasyfikowanego (ang. intratubular germ cell neoplasia of unclassified type), IVF – zapłodnienie
pozaustrojowe (ang. in vitro fertilization), LE – poziom wiarygodności dowodu naukowego (ang. level of evidence), LH – hormon luteinizujący
(ang. luteinizing hormone), LOH – hipogonadyzm późny (ang. late onset hypogonadism), MAGI – infekcja męskich gruczołów dodatkowych
(ang. male accessory gland infection), MAIS – zespół łagodnej niewrażliwości na androgeny (ang. mild androgen insensitivity syndrome), MAR –
mieszana rekcja z przeciwciałami przeciwko globulinie (ang. mixed antiglobulin reaction), MESA – mikrochirurgiczna aspiracja plemników
z najądrzy (ang. microsurgical epididymal sperm aspiration), MeSH – główne tytuły medyczne (ang. Medical Subject Headings), MRI – rezonans
magnetyczny (ang. magnetic resonance imaging), m-TESE – mikrochirurgiczne pobranie plemników z jąder (ang. microsurgical testicular
sperm extraction), NAT – test kwasów nukleinowych (ang. nucleic acid testing), NGS – sekwencjonowanie nowej generacji (ang. next
generation sequencing), NIH – Narodowy Instytut Zdrowia (ang. National Institute of Health), NOA – azoospermia nieobturacyjna (ang. non‑
-obstructive azoospermia), OA – azoospermia obturacyjna (ang. obstructive azoospermia), OAT – oligoastenoteratozoospermia: zaburzenie
liczby, ruchliwości i morfologii plemników (ang. oligoasthenoteratozoospermia), PAIS – zespół częściowej niewrażliwości na androgeny (ang.
partial androgen insensitivity syndrome), PE – przedwczesny wytrysk (ang. premature ejaculation), PESA – przezskórna aspiracja plemników
z najądrzy (ang. percutaneous epididymal sperm aspiration), PGD – przedimplantacyjna diagnostyka genetyczna (ang. preimplantation genetic
diagnosis), RCT – randomizowane, kontrolowane badania kliniczne (ang. randomised controlled trial), RN – ruch niepostępowy plemników
(ang. non-progressive sperm motility), RP – ruch postępowy plemników (ang. progressive sperm motility), SHBG – globulina wiążąca hormony
płciowe (ang. sex hormone binding globulin), SSRI – selektywne inhibitory zwrotnego wychwytu serotoniny (ang. selective serotonin reuptake
inhibitor), TDS – zespół dysgenezji jąder (ang. testicular dysgenesis syndrome), TGCT – guz jądra z komórek płciowych (ang. testicular
germ cell tumour), TESE – pobranie plemników z jąder (ang. testicular sperm extraction), TM – mikrozwapnienia w jądrach (ang. testicular
microlithiasis), TRUS – ultrasonografia przezodbytnicza (ang. transrectal ultrasound), TURED – przezcewkowa elektroresekcja przewodów
wytryskowych (ang. transurethral resection of the ejaculatory ducts), WHO – Światowa Organizacja Zdrowia (ang. World Health Organization)
Spis treści
1. WPROWADZENIE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
1.1. Cel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
1.2. Historia publikacji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
1.3. Skład Panelu Ekspertów . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
2. METODOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21
3. REKOMENDACJE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
3A. MĘSKA NIEPŁODNOŚĆ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
3A.1. Epidemiologia i etiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
3A.1.1. Czynniki prognostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22
3A.1.2. Rekomendacje dotyczące epidemiologii i etiologii niepłodności u mężczyzn . . . . . . . . . . . . . . . . . . . . . 23
3A.2. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23
3A.2.1. Badanie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23
3A.2.1.1. Częstość wykonywania badania nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24
3A.2.2. Rekomendacje dotyczące diagnostyki męskiej niepłodności . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24
3B. PIERWOTNE USZKODZENIE SPERMATOGENEZY . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24
3B.1. Etiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24
3B.2. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
3B.2.1. Badanie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
3B.2.2. Badania hormonalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
3B.2.3. Biopsja jądra . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
3B.3. Wnioski i rekomendacje dotyczące postępowania w niewydolności jąder . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25
3C. ZABURZENIA GENETYCZNE W NIEPŁODNOŚCI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
3C.1. Zaburzenia chromosomalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26
3C.1.1. Zaburzenia chromosomów płciowych
(zespół Klinefeltera i jego warianty (47,XXY; mozaicyzm 46,XY/47,XXY)) . . . . 26
3C.1.2. Zaburzenia autosomalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
3C.1.3. Zaburzenia chromosomalne plemników . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
3C.2. Wady genetyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
3C.2.1. Zaburzenia genetyczne związane z chromosomem X a męska niepłodność . . . . . . . . . . . . . . . . . . . . . . 27
3C.2.2. Zespół Kallmanna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
3C.2.3. Łagodna forma niewrażliwości na androgeny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 27
3C.2.4. Inne zaburzenia chromosomu X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
3C.3. Chromosom Y a męska niepłodność . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
3C.3.1. Kliniczne implikacje mikrodelecji chromosomu Y . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28
3C.3.1.1. Badania diagnostyczne w kierunku mikrodelecji chromosomu Y . . . . . . . . . . . . . . . . . . . . . . 28
3C.3.1.2. Poradnictwo genetyczne dla pacjentów z delecjami regionu AZF chromosomu Y . . . . . . . . . . . . . 28
3C.3.1.3. Chromosom Y: delecja gr/gr . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
3C.3.1.4. Defekty autosomalne z ciężkimi zaburzeniami fenotypowymi i niepłodnością . . . . . . . . . . . . . . 29
3C.4. Mutacje prowadzące do mukowiscydozy a niepłodność męska . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29
3C.4.1. Jednostronny lub obustronny brak/nieprawidłowości nasieniowodów i wady nerek . . . . . . . . . . . . . . . . . 30
3C.4.2. Nieznane zaburzenia genetyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
3C.4.3. Fragmentacja DNA w plemnikach . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
3C.4.4. Poradnictwo genetyczne przy procedurze ICSI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
3C.5. Wnioski i zalecenia dotyczące postępowania w zaburzeniach genetycznych
w męskiej niepłodności . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30
3D. AZOOSPERMIA OBTURACYJNA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3D.1. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3D.1.1. Niedrożność przewodów wewnątrzjądrowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3D.1.2. Niedrożność przewodów najądrzy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3D.1.3. Niedrożność nasieniowodów . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3D.1.4. Niedrożność przewodów wytryskowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31
3D.1.5. Niedrożność czynnościowa dystalnych części przewodów wyprowadzających plemniki . . . . . . . . . . . . . . . 32
3D.2. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.2.1. Wywiad kliniczny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.2.2. Badanie przedmiotowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.2.3. Badanie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.2.4. Poziomy hormonów . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.2.5. Ultrasonografia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.2.6. Biopsja jądra . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.3. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.3.1. Niedrożność przewodów wewnątrzjądrowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.3.2. Niedrożność przewodów najądrzy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
3D.3.3. Niedrożność części proksymalnej nasieniowodu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3D.3.4. Niedrożność części dystalnej nasieniowodu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3D.3.5. Niedrożność przewodów wytryskowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3D.4. Wnioski i rekomendacje w azoospermii obturacyjnej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3E. ŻYLAKI POWRÓZKA NASIENNEGO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3E.1. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 33
3E.2. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
3E.3. Podstawowe informacje . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
3E.3.1. Żylaki powrózka nasiennego a płodność . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
3E.3.2. Warikocelektomia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
3E.4. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
3E.5. Wnioski i rekomendacje dotyczące postępowania w żylakach powrózka nasiennego . . . . . . . . . . . . . . . . . . . . . . 35
3F. HIPOGONADYZM . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
3F.1. Epidemiologia i etiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 35
3F.2. Idiopatyczny hipogonadyzm hipogonadotropowy: etiologia, diagnostyka i leczenie . . . . . . . . . . . . . . . . . . . . . . 35
3F.3. Hipogonadyzm hipergonadotropowy: etiologia, diagnostyka i leczenie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36
3F.4. Wnioski i rekomendacje dotyczące postępowania w hipogonadyzmie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36
3G. WNĘTROSTWO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36
3G.1. Etiologia i patofizjologia wnętrostwa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36
3G.1.1. Częstość występowania wnętrostwa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.1.2. Patofizjologia zaburzeń zstępowania jąder . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.1.2.1. Degeneracja komórek płciowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.1.2.2. Wnętrostwo a męska płodność . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.1.2.3. Nowotwory z komórek płciowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.2. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.2.1. Leczenie hormonalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.2.2. Leczenie chirurgiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37
3G.3. Wnioski i rekomendacje dotyczące postępowania we wnętrostwie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
3H. IDIOPATYCZNA NIEPŁODNOŚĆ MĘSKA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
3H.1. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
3H.1.1. Leczenie empiryczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
3H.2. Rekomendacje dotyczące postępowania w idiopatycznej męskiej niepłodności . . . . . . . . . . . . . . . . . . . . . . . . . 38
3I. MĘSKA ANTYKONCEPCJA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38
3I.1. Wazektomia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.1.1. Techniki chirurgiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.1.2. Powikłania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.1.3. Niepowodzenie wazektomii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.1.4. Poradnictwo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.2. Odwrócenie wazektomii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.2.1. Czas od wazektomii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.2.2. Tubulo-wazo-wazostomia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.2.3. Mikrochirurgiczne odwrócenie wazektomii a zabiegowe pobranie plemników z najądrzy lub jąder
i procedura ICSI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39
3I.3. Wnioski i zalecenia w męskiej antykoncepcji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3J. INFEKCJE MĘSKICH GRUCZOŁÓW DODATKOWYCH A NIEPŁODNOŚĆ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3J.1. Badania diagnostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3J.1.1. Badanie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3J.1.1.1. Badania mikrobiologiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3J.1.1.2. Leukocyty . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40
3J.1.1.3. Jakość plemników . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.1.1.4. Zmiany w plazmie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.1.1.5. Dysfunkcja wydzielnicza dodatkowych gruczołów płciowych . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.1.1.6. Wolne rodniki tlenowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.1.2. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.2. Zapalenie najądrzy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.2.1. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.2.1.1. Badanie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.2.2. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 41
3J.3. Wnioski i rekomendacje dotyczące postępowania w infekcjach męskich gruczołów dodatkowych . . . . . . . . . . . . . . 42
3K. ZMIANY NOWOTWOROWE Z KOMÓREK PŁCIOWYCH I MIKROZWAPNIENIA W JĄDRACH . . . . . . . . . . . . . . . . . 42
3K.1. Zmiany nowotworowe z komórek płciowych a męska niepłodność . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
3K.2. Rak jądra z komórek płciowych a funkcja reprodukcyjna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
3K.3. Mikrozwapnienia w jądrach . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
3K.4. Rekomendacje dotyczące postępowania w zmianach nowotworowych z komórek płciowych
i mikrozwapnieniach w jądrach . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L. ZABURZENIA WYTRYSKU . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1. Klasyfikacja i etiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1.1. Brak wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1.2. Brak orgazmu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1.3. Wytrysk opóźniony . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1.4. Wytrysk wsteczny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1.5. Wytrysk osłabiony . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.1.6. Wytrysk przedwczesny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3L.2. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.2.1. Wywiad kliniczny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.2.2. Badanie fizykalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.2.3. Badanie moczu po wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.2.4. Badania mikrobiologiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.2.5. Dodatkowe testy diagnostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.3. Postępowanie terapeutyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3L.3.1. Leczenie przyczynowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3L.3.2. Leczenie objawowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3L.3.2.1. Wytrysk przedwczesny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3L.3.2.2. Wytrysk wsteczny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3L.3.2.3. Brak wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3L.4. Wnioski i rekomendacje dotyczące postępowania w zaburzeniach wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3M. KRIOPREZERWACJA NASIENIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3M.1. Wskazania do przechowywania nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3M.2. Środki ostrożności i techniki krioprezerwacji nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3M.2.1. Proces zamrażania i rozmrażania nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3M.2.2. Krioprezerwacja nasienia z małą liczbą plemników . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3M.2.3. Badanie w kierunku infekcji i zapobieganie krzyżowej kontaminacji . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3M.2.4. Środki ostrożności w celu zapobiegania utracie przechowywanego materiału . . . . . . . . . . . . . . . . . . . . . 47
3M.2.5. Pozostawione próbki nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3M.3. Aspekty biologiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3M.4. Wnioski i rekomendacje dotyczące krioprezerwacji nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
4. PIŚMIENNICTWO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
5. KONFLIKT INTERESÓW . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
WPROWADZENIE
1.1. Cel
Grupa ekspertów ds. męskiej niepłodności Europejskiego
Towarzystwa Urologicznego (EAU, ang. European Association
of Urology) przygotowała niniejsze Rekomendacje,
aby pomóc urologom i innym specjalistom z pokrewnych
dziedzin w leczeniu męskiej niepłodności. Urolodzy są
specjalistami, którzy zwykle początkowo są odpowiedzialni
za ocenę mężczyzny, gdy podejrzewa się niepłodność,
niemniej jednak niepłodność może być wieloczynnikowym
schorzeniem wymagającym multidyscyplinarnej
oceny.
1.2. Historia publikacji
Po raz pierwszy wytyczne EAU dotyczące męskiej niepłodności
zostały opublikowane w 2001 r., następnie uaktualniono
cały tekst w 2004, 2007, 2010, 2013 i 2014 r.
W wersji z 2015 r. tekst wytycznych został znacząco
zredukowany, tak że tylko kluczowe informacje są włączone
i przeredagowane zgodnie z wzorem nieonkologicznych
wytycznych EAU, dzięki czemu wszystkie wytyczne
mają podobny format.
Dostępna jest krótka wersja wytycznych w formie
kieszonkowej (ang. Pocket Guidelines), zarówno w formie
drukowanej, jak i elektronicznej w postaci aplikacji na
urządzenia mobilne, zawierająca kluczowe zalecenia
w „Rekomendacjach dotyczących postępowania w męskiej
niepłodności”. Ta skrócona wersja może wymagać od
użytkownika porównania z wersją pełnotekstową. Panel
Ekspertów ds. męskiej niepłodności opublikował serię
artykułów naukowych w periodyku EAU „European
Urology”
(Dohle i wsp., 2005, 2012b; Jungwirth i wsp.,
2012).
Osobne rekomendacje dotyczące wazektomii
zostały opublikowane w 2012 r. Wszystkie powyższe
artykuły są dostępne do wglądu i pobrania do osobistego
użytku na stronie internetowej EAU: http://www.
uroweb.org/guidelines/online-guidelines/.
Niniejszy dokument był recenzowany przed publikacją.
1.3. Skład Panelu Ekspertów
Panel Ekspertów tworzących wytyczne EAU w zakresie
męskiej niepłodności (ang. The Male Infertility Guidelines
Panel) składa się z urologów, endokrynologów i ginekologów
specjalizujących się w andrologii i posiadających
doświadczenie w diagnostyce i leczeniu męskiej
niepłodności.
2. METODOLOGIA
Wykorzystane źródła piśmiennictwa zostały ocenione
w zależności od poziomu wiarygodności dowodu naukowego
(LE, ang. level of evidence) (tabela A), dzięki czemu
zalecenia zawierają także stopień rekomendacji (GR, ang.
grade of recommendation) (tabela B). W obecnej wersji
anglojęzycznej „Rekomendacji dotyczących postępowania
w męskiej niepłodności” EAU z 2015 r. wszystkie informacje
na temat LE i GR zostały usunięte dla zachowania
zwięzłości tekstu. Znajdują się one na początku pełnej
wersji Rekomendacji EAU i zostały utworzone zgodnie
z klasyfikacją Oksfordzkiego Centrum do spraw oceny
poziomu dowodów naukowych w medycynie (ang. Oxford
Centre for Evidence-based Medicine Levels of Evidence)1.
Zalecenia zawarte w tych wytycznych są oparte
na systemowym przeglądzie literatury przeprowadzonym
przez członków Panelu Ekspertów. Słownictwo z bazy
z głównych tytułów medycznych (MeSH, ang. Medical
Subject Headings, nagłówki dotyczące tematyki medycznej)
zostało użyte wraz z przeglądem tekstów zawierających
kombinację terminów „męska niepłodność” (ang. male
infertility) i takich jak: „diagnoza” (ang. diagnosis), „epidemiologia”
(ang. epidemiology), „badania” (ang. investigations),
„leczenie” (ang. treatment), „uszkodzenie spermatogenezy”
(ang. spermatogenic failure), „zaburzenia
genetyczne” (ang. genetic abnormalities), „niedrożność”
(ang. obstruction), „hipogonadyzm” (ang. hypogonadism),
„żylaki powrózka nasiennego” (ang. varicocele), „wnętrostwo”
(ang. cryptorchidism), „rak jądra” (ang. testicular
cancer), „zakażenie męskich gruczołów dodatkowych”
(male accessory gland infection), „idiopatyczny” (ang. idiopathic),
„antykoncepcja” (ang. contraception), „zaburzenia
wytrysku” (ang. ejaculatory dysfunction) i „krioprezerwacja”
(ang. cryopreservation).
Dla wersji z 2014 r. poszukiwaniami objęto lata 2012
i 2013 z datą odcięcia na wrzesień 2013 r. Bazy Embase,
Medline i Cochrane Central Register of Controlled Trials
zostały przeszukane z ograniczeniem do artykułów
o charakterze przeglądowym (ang. review), metaanaliz
i metaanaliz randomizowanych, kontrolowanych badań
klinicznych (RCT, ang. randomised controlled trial). Po
usunięciu danych zduplikowanych zidentyfikowano 447
pozycji, z których 5 publikacji zostało wyselekcjonowanych
do włączenia.
Celem podawania GR jest zapewnienie przejrzystego
związku pomiędzy odpowiednimi dowodami naukowymi
a daną rekomendacją.
Tabela A. Poziomy wiarygodności dowodu naukowego
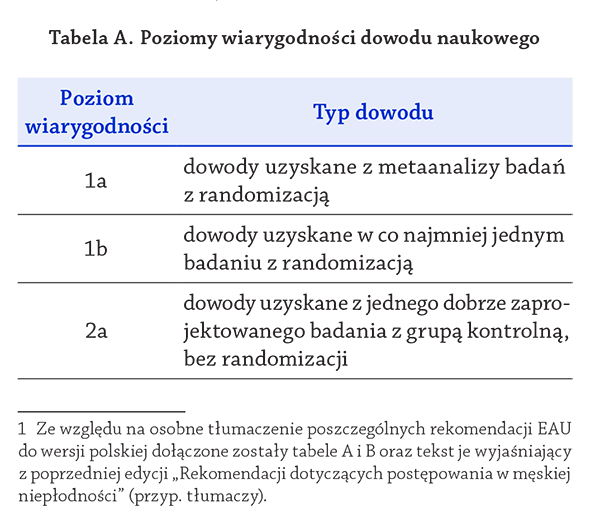
 Trzeba zaznaczyć, że kiedy rekomendacje są przygotowywane,
nie istnieje ustalony związek pomiędzy LE
a GR. W szczególności dostępność badań randomizowanych
będących podstawą rekomendacji nie musi automatycznie
oznaczać, że ta rekomendacja otrzyma stopień A,
jeśli w tych badaniach znajdują się ograniczenia metodologiczne
lub badania nie mają zgodnych wyników.
Odwrotnie, brak popierających badań o wysokim LE
nie musi od razu wykluczać rekomendacji z poziomu A,
w sytuacji gdy rekomendacja wynika z niepodważalnych
wyników badań klinicznych. Ponadto mogą mieć miejsce
sytuacje wyjątkowe, w których rekomendacja nie może
zostać poparta badaniami, ponieważ badania takie nie
mogą zostać przeprowadzone, na przykład z powodów
etycznych lub innych. W takich przypadkach uważa się,
że jednoznaczne rekomendacje są pomocne czytelnikowi.
Jeśli kiedykolwiek taka sytuacja ma miejsce, to
zaznaczono to w tekście z uwagą ,,uaktualnione na podstawie
zgody zespołu”. Jakość LE jest bardzo istotnym
czynnikiem, ale musi uwzględniać równowagę między
korzyściami i stratami, wartościami i preferencjami oraz
kosztami, kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza analiz
kosztów, ani nie zawsze może uwzględniać lokalne czy
narodowe warunki. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod uwagę.
Trzeba zaznaczyć, że kiedy rekomendacje są przygotowywane,
nie istnieje ustalony związek pomiędzy LE
a GR. W szczególności dostępność badań randomizowanych
będących podstawą rekomendacji nie musi automatycznie
oznaczać, że ta rekomendacja otrzyma stopień A,
jeśli w tych badaniach znajdują się ograniczenia metodologiczne
lub badania nie mają zgodnych wyników.
Odwrotnie, brak popierających badań o wysokim LE
nie musi od razu wykluczać rekomendacji z poziomu A,
w sytuacji gdy rekomendacja wynika z niepodważalnych
wyników badań klinicznych. Ponadto mogą mieć miejsce
sytuacje wyjątkowe, w których rekomendacja nie może
zostać poparta badaniami, ponieważ badania takie nie
mogą zostać przeprowadzone, na przykład z powodów
etycznych lub innych. W takich przypadkach uważa się,
że jednoznaczne rekomendacje są pomocne czytelnikowi.
Jeśli kiedykolwiek taka sytuacja ma miejsce, to
zaznaczono to w tekście z uwagą ,,uaktualnione na podstawie
zgody zespołu”. Jakość LE jest bardzo istotnym
czynnikiem, ale musi uwzględniać równowagę między
korzyściami i stratami, wartościami i preferencjami oraz
kosztami, kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza analiz
kosztów, ani nie zawsze może uwzględniać lokalne czy
narodowe warunki. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod uwagę.
REKOMENDACJE
Definicja
Według Światowej Organizacji Zdrowia (WHO, ang. World
Health Organization): „niepłodność to niemożność uzyskania
spontanicznej ciąży w ciągu jednego roku przez
seksualnie aktywną, niestosującą antykoncepcji parę”
(WHO, 2000).
3A.1. Epidemiologia i etiologia
Około 15% par nie uzyskuje ciąży w ciągu jednego roku
i szuka pomocy medycznej w zakresie leczenia niepłodności.
Jedna na osiem par ma trudności w poczęciu
pierwszego dziecka, zaś jedna na sześć par ma trudności
w poczęciu kolejnego dziecka; 3% kobiet pozostaje mimowolnie
bezdzietnych, podczas gdy 6% kobiet posiadających
przynajmniej jedno dziecko nie może mieć tyle dzieci, ile
by pragnęła
(Greenhall i Vessey, 1990).
Niepłodność dotyczy
zarówno mężczyzn, jak i kobiet. W 50% par mimowolnie
bezdzietnych męski czynnik niepłodności jest diagnozowany
razem z nieprawidłowymi parametrami nasienia.
Płodna partnerka może kompensować zaburzenia płodności
mężczyzny, więc niepłodność zwykle manifestuje
się, jeśli oboje partnerzy mają obniżoną płodność. Męska
płodność może być efektem:
yy wrodzonych lub nabytych zaburzeń układu moczowo-
-płciowego,
yy nowotworów,
yy zakażeń układu moczowo-płciowego,
yy podwyższonej temperatury moszny (np. jako wynik
żylaków powrózka nasiennego),
yy zaburzeń endokrynnych,
yy zaburzeń genetycznych,
yy czynników immunologicznych.
W ok. 30–40% przypadków nie stwierdza się czynników
męskiej niepłodności (męska niepłodność idiopatyczna).
U mężczyzn tych nie stwierdza się w wywiadzie
schorzeń wpływających na płodność i mają oni prawidłowe
wyniki badania fizykalnego oraz badań endokrynologicznych,
genetycznych i biochemicznych, chociaż
badanie nasienia może ujawnić patologiczne wyniki
w spermiogramie (patrz rozdział 3A.2.1). Tabela 1 podsumowuje
główne przyczyny męskiej niepłodności. Męska
niepłodność idiopatyczna jest prawdopodobnie powodowana
przez kilka czynników, włączając w to zaburzenia
endokrynologiczne jako wynik działania zanieczyszczeń
środowiska, reaktywnych form tlenu lub genetycznych
i epigenetycznych anomalii.
3A.1.1. Czynniki prognostyczne
Czynniki prognostyczne dla męskiej niepłodności to:
yy czas trwania niepłodności,
yy pierwotna lub wtórna niepłodność,
yy wyniki badania nasienia,
yy wiek i stan płodności partnerki.
Tabela 1. Przyczyny męskiej niepłodności
i czynniki z nią związane oraz ich procentowy rozkład
u 10 469 pacjentów
(Nieschlag i wsp., 2010)
 Kumulacyjny wskaźnik ciąż wynosi 27% u niepłodnych
par w ciągu 2 lat obserwacji, gdy oligozoospermia
jest pierwotną przyczyną niepłodności
(Snick i wsp., 1997).
Wiek partnerki jest najważniejszą pojedynczą zmienną
wpływającą na wynik procedury rozrodu wspomaganego
(Rowe, 2006).
W porównaniu z kobietą w wieku
25 lat potencjał płodności kobiety w wieku 35 lat jest
obniżony do 50%, w wieku 38 lat do 25% i mniej niż
5% w wieku powyżej 40 lat. Jednak w wielu zachodnich
krajach kobiety odkładają pierwszą ciążę do czasu
zakończenia edukacji i rozpoczęcia pracy zawodowej2.
Kumulacyjny wskaźnik ciąż wynosi 27% u niepłodnych
par w ciągu 2 lat obserwacji, gdy oligozoospermia
jest pierwotną przyczyną niepłodności
(Snick i wsp., 1997).
Wiek partnerki jest najważniejszą pojedynczą zmienną
wpływającą na wynik procedury rozrodu wspomaganego
(Rowe, 2006).
W porównaniu z kobietą w wieku
25 lat potencjał płodności kobiety w wieku 35 lat jest
obniżony do 50%, w wieku 38 lat do 25% i mniej niż
5% w wieku powyżej 40 lat. Jednak w wielu zachodnich
krajach kobiety odkładają pierwszą ciążę do czasu
zakończenia edukacji i rozpoczęcia pracy zawodowej2.
3A.1.2. Rekomendacje dotyczące epidemiologii
i etiologii niepłodności u mężczyzn
 3A.2. Diagnostyka
3A.2. Diagnostyka
3A.2.1. Badanie nasienia
Wywiad chorobowy i badanie fizykalne są standardowym
postępowaniem u wszystkich mężczyzn, włączając w to
podstawowe badanie nasienia. Kompleksowe badanie
andrologiczne jest wskazane, jeśli badanie nasienia
wykazało nieprawidłowości w porównaniu do wartości
referencyjnych (tabela 2). Ważne decyzje lecznicze są
oparte na wyniku badania nasienia, dlatego tak istotne
jest wystandaryzowanie całej procedury laboratoryjnej.
Analiza nasienia została wystandaryzowana przez WHO
i rozpowszechniona poprzez publikację 5. edycji podręcznika
WHO Laboratory Manual for the Examination and
Processing of Human Semen (podręcznik WHO na temat
oceny i procedur badania ludzkiego nasienia)
(WHO,2010)3.
Istnieje powszechny konsensus, że współczesna
seminologia musi być przeprowadzana zgodne z powyższymi
wytycznymi.
2 Obecnie należy również brać pod uwagę wiek mężczyzny, który może
mieć wpływ na płodność partnerską. Sugerowany advanced paternal age:
>35 r.ż. lub >45 r.ż. (Sharma i wsp.: Reprod Biol Endocrynol. 2015, 13:35.
doi: 10.1186/s12958-015-0028-x. PMID: 25928123 (przyp. red.)
3 Rekomendacje dotyczące podstawowej oceny seminologicznej na
podstawie WHO, 2010 ukazały się w języku polskim: Walczak-Jędrzejowska
R. (red): Podstawowe badanie nasienia wg standardów Światowej
Organizacji Zdrowia z roku 2010. Rekomendacje Polskiego Towarzystwa
Andrologicznego i Krajowej Izby Diagnostów Laboratoryjnych. Krajowa
Izba Diagnostów Laboratoryjnych, Warszawa 2016 (przyp. red.)
Tabela 2. Dolne granice wartości referencyjnych
(5. centyl i 95% przedział ufności) dla parametrów nasienia
 3A.2.1.1. Częstość wykonywania badania nasienia
Jeśli wyniki badania nasienia są prawidłowe, zgodnie
z kryteriami WHO jeden test jest wystarczający. Jeśli
wyniki są nieprawidłowe w co najmniej dwóch badaniach,
wskazana jest dalsza diagnostyka andrologiczna.
To ważne, aby dokonać różnicowania pomiędzy poniższymi
stanami:
yy oligozoospermia: koncentracja plemników <15 mln/mL,
yy astenozoospermia: <32% plemników wykazujących
ruch postępowy,
yy teratozoospermia: <4% plemników o prawidłowej
budowie.
Często występują jednoczasowo wszystkie trzy zaburzenia,
co definiuje się jako oligoastenoteratozoospermię
(OAT, ang. oligoasthenoteratozoospermia). W przypadku
azoospermii, jak i w ekstremalnych przypadkach oligozoospermii
(koncentracja plemników <1 mln/mL)
istnieje większa częstość występowania niedrożności
dróg wyprowadzających plemniki i wad genetycznych.4
3A.2.1.1. Częstość wykonywania badania nasienia
Jeśli wyniki badania nasienia są prawidłowe, zgodnie
z kryteriami WHO jeden test jest wystarczający. Jeśli
wyniki są nieprawidłowe w co najmniej dwóch badaniach,
wskazana jest dalsza diagnostyka andrologiczna.
To ważne, aby dokonać różnicowania pomiędzy poniższymi
stanami:
yy oligozoospermia: koncentracja plemników <15 mln/mL,
yy astenozoospermia: <32% plemników wykazujących
ruch postępowy,
yy teratozoospermia: <4% plemników o prawidłowej
budowie.
Często występują jednoczasowo wszystkie trzy zaburzenia,
co definiuje się jako oligoastenoteratozoospermię
(OAT, ang. oligoasthenoteratozoospermia). W przypadku
azoospermii, jak i w ekstremalnych przypadkach oligozoospermii
(koncentracja plemników <1 mln/mL)
istnieje większa częstość występowania niedrożności
dróg wyprowadzających plemniki i wad genetycznych.4
3A.2.2. Rekomendacje dotyczące diagnostyki
męskiej niepłodności

3B. PIERWOTNE USZKODZENIE SPERMATOGENEZY
Niewydolność jąder może być konsekwencją pierwotnego
uszkodzenia spermatogenezy spowodowanego przez
inne przyczyny niż schorzenia podwzgórza i przysadki
lub niedrożność dróg wyprowadzających plemniki. Jest
to najczęściej występująca forma obniżonej płodności
męskiej. Niedomoga czynności jąder może mieć różne
przyczyny i klinicznie przyjmuje formy ciężkiej postaci
OAT lub azoospermii nieobturacyjnej (NOA, ang. non‑
-obstructive azoospermia).
3B.1. Etiologia
Przyczyny niewydolności jąder są przedstawione w tabeli 3.
 3B.2. Diagnostyka
Rutynowa diagnostyka składa się z badania nasienia
i oceny hormonalnej pacjenta. Inne badania mogą być
wymagane zależnie od indywidualnych okoliczności.
Typowe informacje uzyskane z wywiadu i badania
fizykalnego pacjenta z niewydolnością jąder to:
3B.2. Diagnostyka
Rutynowa diagnostyka składa się z badania nasienia
i oceny hormonalnej pacjenta. Inne badania mogą być
wymagane zależnie od indywidualnych okoliczności.
Typowe informacje uzyskane z wywiadu i badania
fizykalnego pacjenta z niewydolnością jąder to:
wnętrostwo (jedno- lub obustronne),
skręt jądra,
infekcje układu moczowo-płciowego,
uraz jąder,
ekspozycja na toksyny środowiskowe,
leki działające toksycznie na jądra,
w tym anaboliki,
ekspozycja na promieniowanie lub środki
cytotoksyczne,
rak jądra,
brak jąder,
nietypowe wtórne cechy płciowe,
ginekomastia,
nieprawidłowa objętość jąder i/lub ich konsystencja,
żylaki powrózków nasiennych.
3B.2.1. Badanie nasienia
W NOA badanie nasienia wykazuje prawidłową objętość
ejakulatu i azoospermię po odwirowaniu. Zalecane jest
odwirowanie nasienia przy 3000 g przez 15 min i ocena
w mikroskopie z kontrastem fazowym w powiększeniu
200-krotnym. Wszystkie próbki nasienia powinny być
wybarwione i powtórnie sprawdzone pod mikroskopem(WHO, 2010).
(WHO, 2010).
3B.2.2. Badania hormonalne
U pacjentów z niewydolnością jąder zwykle obecny
jest hipogonadyzm hipergonadotropowy, z wysokim
poziomem hormonu folikulotropowego (FSH, ang. follicle-
stimulating hormone) i hormonu luteinizującego (LH,
ang. luteinizing hormone) oraz czasem z niskim poziomem
testosteronu we krwi. Generalnie poziom FSH koreluje
z liczbą spermatogonii. Gdy spermatogonia są nieobecne
lub ich liczba jest znacznie zmniejszona, wówczas poziom
FSH jest zwykle podwyższony. Jeśli natomiast liczba
spermatogonii jest prawidłowa, ale występuje zatrzymanie
dojrzewania (ang. maturation arrest) na poziomie
spermatocytów lub spermatyd, wtedy poziom FSH
jest w granicach normy. Jednakże dla poszczególnych
pacjentów poziom FSH nie może dokładnie prognozować
stanu spermatogenezy, gdyż mężczyźni z histologicznie
potwierdzonym zatrzymaniem spermatogenezy mogą
mieć prawidłowe wartości FSH i jądra o prawidłowej
objętości, wciąż mając azoospermię
(Hauser i wsp., 1995;
Martin-du-Pan i Bischof, 1995).
(Hauser i wsp., 1995;
Martin-du-Pan i Bischof, 1995).
3B.2.3. Biopsja jądra
Biopsja jądra może być częścią procedury wstrzyknięcia
plemnika do cytoplazmy komórki jajowej (ICSI, ang.
intracytoplasmatic sperm injection) u pacjentów z potwierdzonym
NOA. Pobranie plemników z jąder (TESE, ang.testicular sperm extraction)
jest techniką z wyboru.
Spermatogeneza może być zlokalizowana ogniskowo, co
oznacza, że u ok. 50% mężczyzn z NOA plemniki mogą
być znalezione i użyte w procedurze ICSI. Większość
autorów rekomenduje pobranie kilku próbek tkanki
jądrowej. Istnieje dodatnia korelacja pomiędzy obrazem
histologicznym tkanki pobranej w biopsji diagnostycznej
jądra a szansą na znalezienie dojrzałych komórek spermatogenezy
podczas zabiegowego pobrania plemników
z jąder i ICSI
(Abdel-Meguid, 2012;
Colpi i wsp., 2005;
(Kim
i wsp., 1997).
Nie ustalono jednakże dotychczas wartości
referencyjnych dla poziomów FSH i inhibiny B
oraz wielkości jąder, które wskazywałyby na obecność
plemników w jądrach (skuteczne pobranie plemników
z jąder). Gdy mamy do czynienia z całkowitą mikrodelecją
regionu AZFa i AZFb – czynnika ulegającego delecji
w azoospermii (ang. azoospermic factor) chromosomu Y,
prawdopodobieństwo zabiegowego wydobycia plemników
wynosi prawie zero, dlatego wówczas zabieg TESE jest
przeciwwskazany. Mikrochirurgiczne TESE (m-TESE)
podnosi skuteczność pobrań w stosunku do klasycznego
TESE i dlatego powinno być preferowane w ciężkich
przypadkach NOA
(Deruyver i wsp., 2014;
(Marconi
i wsp., 2012;).
(; Schlegel, 1999;).
( Schwarzer i wsp., 2013).
Istnieją
doniesienia o skutecznym zabiegowym wydobyciu plemników
nawet w takich przypadkach jak zespół samych
komórek Sertoliego typu II
(WHO, 2000).
Wyniki ICSI są gorsze, gdy stosuje się plemniki
pobrane z jąder mężczyzn z NOA w porównaniu do
zastosowania plemników z nasienia uzyskanego na
drodze ejakulacji, a także plemników pobranych od
mężczyzn z azoospermią obturacyjną spowodowaną
niedrożnością przewodów wyprowadzających plemniki
(OA, ang. obstructive azoospermia)
(Ben-Yosef i wsp., 1999;
Borges i wsp., 2002; Ghanem i wsp., 2005; Gil Salom, 2004;
Schwarzer i wsp., 2003).
(Ben-Yosef i wsp., 1999;).
(Borges i wsp., 2002;).
(Ghanem i wsp., 2005; ).
(Gil Salom, 2004;).
(Schwarzer i wsp., 2003).
Współczynnik urodzeń jest niższy
w NOA vs OA (19% vs 28%)
(Vernaeve i wsp., 2003).
ICSI ma znacząco niższy współczynnik zapłodnień
i implantacji zarodków.
Zdrowie noworodków oceniane parametrami okołoporodowymi,
występowanie większych wad i aberracji
chromosomalnych w dużej grupie dzieci urodzonych
po zastosowaniu plemników nieuzyskanych z ejakulatu
są porównywalne do dzieci urodzonych po
zastosowaniu plemników uzyskanych z ejakulatu
(Belva i wsp., 2011).
3B.3. Wnioski i rekomendacje dotyczące postępowania w niewydolności jąder


3C. ZABURZENIA GENETYCZNE W NIEPŁODNOŚCI
Wszyscy urolodzy zajmujący się andrologią muszą znać
zaburzenia genetyczne powiązane z niepłodnością,
dzięki czemu mogą udzielać właściwych porad parom
poszukującym leczenia niepłodności. Mężczyznom ze
znacznie obniżoną liczebnością plemników może być
zaoferowana realna szansa na ojcostwo poprzez wykorzystanie
technik zapłodnienia pozaustrojowego (IVF,
ang. in vitro fertilization), ICSI oraz zabiegowego pobrania
plemników z jąder w przypadku azoospermii. Jednakże
plemniki niepłodnych mężczyzn wykazują wyższą częstość
aneuploidii, strukturalnych zaburzeń chromosomalnych
i uszkodzeń DNA, co niesie ryzyko przeniesienia
zaburzeń genetycznych na następne pokolenie.
Wprawdzie obecna rutynowa praktyka kliniczna obejmuje
skrining genomu DNA z próbek krwi obwodowej,
to możliwe jest badanie zaburzeń chromosomalnych
w plemnikach i może być ono przeprowadzane w wybranych
przypadkach
(Carrell, 2008).
3C.1. Zaburzenia chromosomalne
Zaburzenia chromosomalne mogą być ilościowe (np. trisomia)
lub strukturalne (np. inwersja lub translokacja).
W badaniu opartym na 11 publikacjach, w których oceniano
9766 niepłodnych mężczyzn, częstość występowania
zaburzeń chromosomalnych wynosiła 5,8%
(Johnson,1998).
Z tego zaburzenia chromosomów płciowych stanowiły
4,2%, a chromosomów autosomalnych 1,5%. W 3
innych badaniach częstość tych zaburzeń wynosiła 0,38%
u 94 465 męskich noworodków, z czego u 131 (0,14%)
wystąpiły zaburzenia chromosomów płciowych, a u 232
(0,25%) chromosomów autosomalnych
(Johnson,1998).
Częstość występowania zaburzeń chromosomalnych wzrasta wraz z nasileniem niewydolności jąder. Pacjenci
z liczbą plemników <5 mln/mL wykazują 10-krotnie
wyższą częstość występowania (4%) głównie autosomalnych
zaburzeń strukturalnych w porównaniu
z populacją ogólną
(Clementini i wsp., 2005; Vincent i wsp.,
2002).
(Clementini i wsp., 2005;).
(Vincent i wsp.,2002).
Mężczyźni z NOA są w grupie najwyższego ryzyka,
zwłaszcza zaburzeń dotyczących chromosomów płciowych.
Opierając się na częstości występowania zaburzeń
chromosomalnych u pacjentów z różną koncentracją
plemników, należy stwierdzić, że badanie kariotypu
jest wskazane u pacjentów z azoospermią lub oligozoospermią
(koncentracja plemników <10 mln/mL)
(Vincent i wsp.,2002).
Ostatnie doniesienia sugerują ograniczenie
badania kariotypu do mężczyzn z NOA celem zapobiegania
niepomyślnym wynikom ciąży
(Dul i wsp., 2012).
Jeśli w rodzinie występowały spontaniczne poronienia,
niedorozwój lub upośledzenie umysłowe, badanie kariotypu
powinno zostać wykonane niezależnie od wyników
koncentracji plemników.
3C.1.1. Zaburzenia chromosomów płciowych
(zespół Klinefeltera i jego warianty
(47,XXY; mozaicyzm 46,XY/47,XXY))
Zespół Klinefeltera5 jest najczęstszym zaburzeniem
chromosomów płciowych
(Davila Garza i Patrizio, 2013;).
( Johnson, 1998).
Dorośli mężczyźni z zespołem
Klinefeltera mają małe, twarde jądra pozbawione komórek
rozrodczych. Fenotyp jest zróżnicowany od prawidłowej
wirylizacji do objawów niedoboru androgenów, włączając
w to żeński typ owłosienia, skąpe owłosienie ciała oraz
długie kończyny górne i dolne z powodu opóźnionego
zamknięcia nasad kości długich. U pacjentów z zespołem
Klinefeltera czynność komórek Leydiga jest zwykle uszkodzona
(Wang i wsp., 1975).
(Wang i wsp., 1975).
Poziom testosteronu może być
prawidłowy lub niski, poziom estradiolu prawidłowy lub
podwyższony, zaś poziom FSH podwyższony. Libido jest
często prawidłowe pomimo niskiego poziomu testosteronu,
ale suplementacja androgenów może być konieczna
wraz z postępującym wiekiem.
Obecność komórek rozrodczych i produkcja plemników
są zróżnicowane u mężczyzn z zespołem Klinefeltera
i mozaicyzmem (46,XY/47,XXY). W plemnikach uzyskanych
od tych osób wykazano metodą fluorescencyjnej
hybrydyzacji in situ (FISH, ang. fluorescence in situ hybridization)
większą częstość zaburzeń chromosomów płciowych
i autosomalnej aneuploidii (disomia 13, 18 lub 21
chromosomu), a w związku z tym podniesiono kwestię
prawidłowości chromosomalnej zarodków powstałych
w wyniku procedury ICSI
(Staessen i wsp., 2003).
Plemniki 24,XY stwierdzono u 0,9% i 7,0% pacjentów
z zespołem Klinefeltera i mozaicyzmem
(Chevret i wsp.,1996;).
( Martini i wsp., 1996).
oraz u 1,36–25% mężczyzn
z kariotypem 47,XXY
(Cozzi i wsp., 1994;).
(Estop i wsp.,1998;).
(Foresta i wsp., 1998;).
(Guttenbach i wsp., 1997).
U pacjentów z azoospermią TESE (lub m-TESE) może
być zaproponowane jako opcja terapeutyczna, gdyż
plemniki mogą być uzyskane w ok. 30% przypadków.
Wiele zdrowych dzieci zostało urodzonych po zastosowaniu
metody ICSI bez przedimplantacyjnej diagnostyki
genetycznej (PGD, ang. preimplantation genetic diagnosis),
a o poczęciu płodu 47,XXY doniesiono raz
(Davila Garza i Patrizio, 2013).
Jednakże w badaniu 113 zarodków uzyskanych
z procedury ICSI w połączeniu z PGD u par,
gdzie mężczyzna miał zespół Klinefeltera, wykazano znacząco
mniejszą liczbę prawidłowych zarodków w porównaniu
z grupą kontrolną (54% vs 77,2%)
(Guttenbach i wsp., 1997).
Z powodu znaczącego wzrostu zaburzeń
chromosomów płciowych i autosomalnych w zarodkach
pacjentów z zespołem Klinefeltera powinno się rozważać
PGD lub amniocentezę.
U mężczyzn z zespołem Klinefeltera wymagana jest
kontrola lekarska (w miarę możliwości co rok) i terapia
zastępcza androgenami, która powinna się rozpocząć,
kiedy tylko zostaną rozwiązane kwestie płodności i gdy
poziom testosteronu znajduje się w zakresie typowym
dla hipoandrogenizmu.
3C.1.2. Zaburzenia autosomalne
Poradnictwo genetyczne powinno być zaproponowane
wszystkim parom poszukującym terapii z powodu niepłodności
(włączając IVF/ICSI), gdy partner ma zaburzenia
autosomalne w kariotypie. Najczęstszymi zaburzeniami
autosomalnymi diagnozowanymi w kariotypie są
translokacje robertsonowskie6, translokacje wzajemne7,
inwersje paracentryczne8 i chromosomy markerowe9.
Ważne jest, aby szukać zmian strukturalnych chromosomów,
ponieważ istnieje wówczas większe ryzyko
wystąpienia aneuploidii lub niezrównoważonych zaburzeń
chromosomalnych u płodu. Podobnie jak w zespole
Klinefeltera, analiza plemników metodą FISH dostarcza
dokładniejszej oceny ryzyka przeniesienia wady na
potomka, chociaż rozpowszechnienie tego testu genetycznego
jest znacznie ograniczone z powodu niewielkiej
dostępności do laboratoriów wykonujących tę analizę.
Kiedy IVF/ICSI jest przeprowadzane u mężczyzn z translokacjami,
powinny być wykonane PGD lub amniocenteza.
..................................................................................
6 Translokacja robertsonowska polega na przemieszczeniu się ramienia
długiego jednego chromosomu na ramię długie innego chromosomu
w miejscu centromeru, ma miejsce utrata ramion krótkich chromosomów
pomiędzy którymi nastąpiła translokacja, całkowita liczba chromosomów
zmniejsza się o jeden (przyp. red.)
7 Translokacja wzajemna polega na wzajemnej wymianie odcinków pomiędzy
dwoma chromosomami, struktura tych dwóch chromosomów po
translokacji zmienia się, natomiast całkowita liczba chromosomów pozostaje
niezmieniona (przyp. red.)
8 Inwersja chromosomowa paracentryczna ma miejsce podczas pęknięcia
chromosomu w dwóch miejscach, następnie powstały fragment chromosomu
nie zawierający centromeru zostaje ponownie wbudowany do
chromosomu ale w formie odwróconej o 180° (przyp. red.)
9 Chromosom markerowy jest małym, dodatkowym chromosomem odmiennym
morfologiczne od pozostałych, identyfikacja tego chromosomu
odbywa się za pomocą klasycznego badania cytogenetycznego, z kolei jego
pochodzenie i znaczenie kliniczne związane z fenotypem badanego wymaga
diagnostyki molekularnej, np. fluorescencyjnej hybrydyzacji in situ (FISH)
..................................................................................
3C.1.3. Zaburzenia chromosomalne plemników
Plemniki mogą być zbadane pod kątem stanu ich chromosomów
przy użyciu wielobarwnego FISH, zarówno
u mężczyzn z prawidłowym kariotypem, jak i zaburzonym.
Aneuploidia plemnika, zwłaszcza aneuploidia chromosomów
płciowych, jest związana z poważnym uszkodzeniem
spermatogenezy
(Gianaroli i wsp., 2005;).
(Johnson, 1998;).
(Pang i wsp., 2005;).
(Tempest i Martin, 2009).
jak i z translokacjami
(Baccetti i wsp., 2005).
Analiza FISH plemnika jest
wskazana tylko w wyjątkowych przypadkach andrologicznych,
takich jak np. duże główki plemników (ang. macrocephalic
sperm head syndrome)
(Tempest i Martin, 2009).
3C.2. Wady genetyczne
3C.2.1. Zaburzenia genetyczne związane
z chromosomem X a męska niepłodność
Każdy mężczyzna ma tylko jeden chromosom X.
Schorzenia recesywne związane z chromosomem X ujawniają
się u mężczyzn. Wada będzie przekazana córkom,
ale nie synom.
3C.2.2. Zespół Kallmanna
U pacjentów z zespołem Kallmanna występuje hipogonadyzm
hipogonadotropowy i brak węchu (łac., ang.
anosmia), ale mogą oni prezentować także inne objawy
kliniczne, włączając w to asymetrię twarzy, rozszczep
podniebienia, daltonizm, głuchotę, wnętrostwo i jednostronną
aplazję nerki. Ten zespół może być spowodowany
mutacją w genie Kalig-1 (na chromosomie X) lub
w kilku innych genach autosomalnych i powinien być
wykryty badaniem genetycznym
(Baccetti i wsp., 2005;
(Tempest i Martin, 2009).
Spermatogeneza może być względnie łatwo wywołana
za pomocą terapii hormonalnej
(Miyagawa i wsp.,2005).
, dlatego zalecane jest przesiewowe badanie genetyczne
przed tą terapią, chociaż jest ono ograniczone
niedoborem specjalistycznych laboratoriów genetycznych
oferujących takie testy. Leczenie gonadotropinami
w większości przypadków pozwala na naturalne poczęcie,
nawet u mężczyzn ze względnie małą liczbą plemników
w nasieniu. Dlatego identyfikacja odpowiedniego genu
(powiązanego z chromosomem X, autosomalnego dominującego
lub recesywnego) może pomóc w zapewnieniu
lepszego poradnictwa genetycznego oraz w lepszej ocenie
ryzyka transmisji wady na potomka.
3C.2.3. Łagodna forma niewrażliwości
na androgeny
Gen receptora androgenowego (AR, ang. androgen receptor)
znajduje się na długim ramieniu chromosomu X. Mutacje
w genie AR mogą skutkować zespołem częściowej (PAIS,
ang. partial androgen insensitivity syndome) lub całkowitej
niewrażliwości na androgeny (CAIS, ang. complete androgen
insensitivity syndrome). Cechy fenotypowe CAIS to żeńskie
zewnętrzne narządy płciowe i brak owłosienia łonowego
(tzw. zespół Morrisa). W PAIS fenotypy kształtują się od
dominującego fenotypu żeńskiego, poprzez obojnacze
narządy płciowe, do dominującego fenotypu męskiego
z małym prąciem (ang. micropenis), spodziectwem kroczowym
i wnętrostwem. Ten ostatni fenotyp jest także
nazywany zespołem Reifensteina. W skrajnych formach
niewrażliwości na androgeny nie ma ryzyka transmisji
schorzenia, gdyż dotknięci nim mężczyźni nie mogą mieć
własnych biologicznie dzieci przy zastosowaniu współczesnych
technologii. U pacjentów z łagodną formą niewrażliwości
na androgeny (MAIS, ang. mild androgen insensitivity
syndrome) niepłodność jest pierwszym, a nawet
jedynym objawem. Zaburzenia AR powodujące niepłodność
w przypadku nieobecności jakichkolwiek zaburzeń
genitalnych zdarzają się rzadko i tylko kilka mutacji
genu AR opisano u niepłodnych
(Ferlin i wsp., 2006;)
(Gottlieb i wsp., 2005;)
(Rajender i wsp., 2007)
( Tincello i wsp.,1997)
i płodnych mężczyzn
(Giwercman i wsp., 2000b).
3C.2.4. Inne zaburzenia chromosomu X
Nadspodziewanie duża liczba genów specyficznych dla
jąder lub z wzbogaconym wzorcem ekspresji została
zidentyfikowana na chromosomie X w porównaniu do
chromosomów autosomalnych, a w szczególności nadmierna
jest reprezentacja genów premejotycznych
(Wang,2004).
(Wang,2004).
Jednakże do tej pory tylko kilka genów zostało
zbadanych w badaniach przesiewowych małych populacji
i żaden z nich nie wydaje się być znaczącym w męskiej
niepłodności
(Nuti i Krausz, 2008;).
(Stouffs i wsp., 2009).
Z drugiej strony, ostatnie dwa niezależne badania wykazały
znacząco wyższy poziom delecji w chromosomie X
u mężczyzn z defektem spermatogenezy w stosunku
do mężczyzn z normozoospermią
(Krausz i wsp., 2012;Tuttelmann i wsp., 2011).
(Krausz i wsp., 2012;).
(Tuttelmann i wsp., 2011).
3C.3. Chromosom Y a męska niepłodność
Mikrodelecje na chromosomie Y 10 obejmują regiony AZFa,
AZFb i AZFc (czynnik ulegający delecji w azoospermii,
ang. azoospermic factor)
(Vogt i wsp., 1996).
Klinicznie
istotne delecje polegają na częściowym lub w większości
przypadków całkowitym braku jednego lub więcej
regionów AZF i są najczęściej występującą genetyczną
molekularną przyczyną krytycznej oligozoospermii
i azoospermii
(Krausz i Degl’Innocenti, 2006).
W każdym
regionie AZF jest kilka potencjalnych genów spermatogenezy
(Skaletsky i wsp., 2003).
Delecje powstają en bloc (m.in.
usuwają więcej niż jeden gen), dlatego nie jest możliwe
określenie roli pojedynczego genu w regionie AZF oraz
nie jest jasne, czy wszystkie geny tego regionu uczestniczą
w spermatogenezie. Delecje, które usuwają tylko jeden
gen, były stwierdzane tylko w regionie AZFa i dotyczą
genu USP9Y. Badania te sugerują, że gen USP9Y jest najprawdopodobniej
„regulatorem” (ang. fine tuner) produkcji
plemników, ale badanie przesiewowe ukierunkowane
na ten gen nie jest zalecane
(Tyler-Smith i Krausz, 2009).
(Tyler-Smith i Krausz, 2009).
................................................................................................................................................................
10 Patrz Wiland i Kurpisz. W: Układ płciowy męski. Badania kliniczne
i doświadczalne. Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego
w Szczecinie, Szczecin 2013, 48–57 (przyp. red.)
.............................................................................................................................................
3C.3.1. Kliniczne implikacje mikrodelecji
chromosomu Y
3C.3.1. Kliniczne implikacje mikrodelecji
chromosomu Y
Kliniczne znaczenie mikrodelecji na ramieniu długim
chromosomu Y (Yq) można podsumować następująco:
mikrodelecje Yq nie są stwierdzane u mężczyzn z normozoospermią,
co dowodzi, że istnieje jasna relacja
przyczynowo-skutkowa pomiędzy delecjami chromosomu
Y a uszkodzeniem spermatogenezy
(Krausz i wsp., 2003),
największa częstość występowania delecji w chromosomie
Y jest stwierdzana u mężczyzn z azoospermią
(8–12%) oraz oligozoospermią (3–7%),
delecje są niezwykle rzadkie (ok. 0,7%), gdy koncentracja
plemników jest >5 mln/mL,
delecje AZFc są najbardziej powszechne (65–70%),
następnie delecje regionów AZFb, AZFb+c i AZFa+b+c
(25–30%), z kolei delecje AZFa są rzadkie (5%),
całkowite usunięcie regionu AZFa jest związane
z poważnymi zmianami w jądrach (zespół samych
komórek Sertoliego), podczas gdy całkowite usunięcie
regionu AZFb jest związane z zatrzymaniem
spermatogenezy. Całkowite usunięcie regionu AZFc
powoduje zróżnicowany fenotyp od azoospermii do
oligozoospermii,
klasyczna (całkowita) delecja AZF nie powoduje ryzyka
wnętrostwa lub raka jądra
(Krausz i Degl’Innocenti,2006).
Swoistość wspomnianej powyżej korelacji genotypu
z fenotypem oznacza, że analiza delecji chromosomu Y
ma podwójną wartość diagnostyczną i prognostyczną
dla możliwości uzyskania plemników z jąder
(Krausz i Degl’Innocenti, 2006).
3C.3.1.1. Badania diagnostyczne
w kierunku mikrodelecji chromosomu Y
Wskazania do przeprowadzenia badań przesiewowych
w kierunku delecji regionu AZF są oparte na liczbie plemników:
azoospermia i ciężka oligozoospermia (liczba
pleminków <5 mln/mL). Dzięki wytycznym Europejskiej
Akademii Andrologii (EAA, ang. European Academy
of Andrology)
(
Krausz i wsp., 2014)
oraz programowi
zewnętrznej kontroli jakości EAA/EMQN – europejskiej
sieci do spraw jakości molekularnych badań genetycznych
(ang. European Molecular Genetics Quality Network)
(http://www.emqn.org/emqn/) badanie Yq stało się bardziej
rzetelne i wiarygodne w laboratoriach ze zróżnicowanymi
standardami badań genetycznych. Wytyczne
EAA podają zestaw starterów (ang. set of primers) pozwalający
na wykrywanie >95% klinicznie istotnych delecji.
3C.3.1.2. Poradnictwo genetyczne dla pacjentów
z delecjami regionu AZF chromosomu Y
Po poczęciu jakakolwiek delecja chromosomu Y jest
automatycznie przekazywana męskiemu potomkowi
i dlatego poradnictwo genetyczne jest wówczas obowiązkowe.
W większości przypadków ojciec i syn mają tą
samą mikrodelecję
(Krausz i wsp., 2014)
, ale wyjątkowo
syn może mieć ją w większej skali
(Stuppia i wsp., 1998).
Zakres uszkodzenia spermatogenezy (pomiędzy azoospermią
a oligozoospermią) nie może być całkowicie
przewidziany u syna z powodu różnorodnego tła genetycznego
i możliwości wpływu potencjalnie toksycznych
czynników środowiskowych na funkcje reprodukcyjne.
Znacząca liczba plemników mężczyzny z całkowitą
delecją AZFc jest nullisomiczna w zakresie chromosomów
płciowych
(le Bourhis i wsp., 2000;).
(Siffroi i wsp., 2000).
co
wskazuje na potencjalne ryzyko rozwinięcia u potomka
zespołu Turnera 45,X0 i innych fenotypowych anomalii
związanych z mozaicyzmem chromosomów płciowych,
w tym także obojnaczych narządów płciowych
(Patsalis i wsp., 2002).
Pomimo teoretycznego ryzyka zaburzeń
dzieci mężczyzn dotkniętych mikrodelecją Yq są fenotypowo
normalne
(Krausz i wsp., 2012;).
(Simoni i wsp.,2004).
Może to być spowodowane obniżonym wskaźnikiem
implantacji i wyższym ryzykiem spontanicznego
poronienia zarodka zawierającego kariotyp 45,X0. Gdy
zastosowane jest ICSI z użyciem plemników mężczyzny
z mikrodelecją chromosomu Y, konieczna jest długotrwała
obserwacja męskich potomków ze szczególnym uwzględnieniem
stanu ich płodności, rozważona powinna być
również krioprezerwacja ich plemników w młodym wieku.
3C.3.1.3. Chromosom Y: delecja gr/gr
Nowy typ delecji Yq, znany jako delecja gr/gr, został
opisany w regionie AZFc
(Repping i wsp., 2003).
Delecja
ta usuwa połowę genów zawartych w region AZFc,
wpływając na liczbę genów wielokrotnie powtórzonych
w mapie tego regionu. Ten typ delecji skutkuje
2,5–8-krotnie większym ryzykiem wystąpienia oligozoospermii
(Krausz i wsp., 2014;).
(2014; Giachini i wsp., 2008;).
(Navarro-Costa i wsp., 2010;).
(Stouffs i wsp., 2011).
Częstość
delecji gr/gr u pacjentów z oligozoospermią wynosi ok. 4%.
Według czterech metaanaliz delecja gr/gr jest istotnym
czynnikiem ryzyka upośledzonej produkcji plemników
(Navarro-Costa i wsp., 2010;).
(Stouffs i wsp., 2011).
Warto
podkreślić, że zarówno częstość delecji gr/gr, jak i ich ekspresja
fenotypowa różnią się pomiędzy różnymi grupami
etnicznymi, w zależności od struktury chromosomu Y.
Na przykład, w niektórych grupach haploidalnych delecja
Y jest stała i wydaje się, że nie ma negatywnego wpływu
na spermatogenezę. W rezultacie rutynowe badania przesiewowe
w kierunku delecji gr/gr są wciąż kwestią dyskusyjną,
zwłaszcza w tych laboratoriach, które obsługują
zróżnicowane etnicznie i geograficznie populacje. Duże,
wieloośrodkowe badanie wykazało, że delecja gr/gr jest
potencjalnym czynnikiem ryzyka nowotworów jądra
wywodzących się z komórek płciowych
(Nathanson i wsp.,2005).
Dane te jednak wymagają dalszego potwierdzenia
w badaniach klinicznych z grupą kontrolną na etnicznie
i geograficznie powiązanych populacjach. Dla poradnictwa
genetycznego warto wspomnieć, że częściowa
delecja AZFc (gr/gr i b2/b3) może predysponować do
całkowitej delecji AZFc w kolejnym pokoleniu
((Zhang i wsp., 2007).
3C.3.1.4. Defekty autosomalne z ciężkimi
zaburzeniami fenotypowymi i niepłodnością
Kilka dziedzicznych defektów autosomalnych jest związanych
z ciężkimi lub znaczącymi nieprawidłowościami
ciała i niepłodnością. Należą do nich m.in. zespół Pradera–
Williego, zespół Bardeta–Biedla, zespół Noonan, dystrofia
miotoniczna, dominujący zespół wielotorbielowatości
nerek, niedobór 5-α-reduktazy itd. Pacjenci z tymi
wadami są dobrze znani lekarzom zwykle już od dzieciństwa.
Problem płodności musi być prowadzony w kontekście
całościowej opieki nad takim mężczyzną i po rozważeniu,
czy taka para ma możliwość opieki nad dzieckiem.
3C.4. Mutacje prowadzące do mukowiscydozy
a niepłodność męska
Zwłóknienie torbielowate – mukowiscydoza (CF, ang.
cystic fibrosis) jest śmiertelnym autosomalnym, recesywnym
schorzeniem. Jest najczęstszą genetyczną
chorobą rasy kaukaskiej; 4% populacji jest nosicielem
mutacji genu odpowiedzialnego za regulację przewodnictwa
przezbłonowego w mukowiscydozie (CFTR, ang.
cystic fibrosis transmembrane conductance regulator) zlokalizowanego
na ramieniu krótkim chromosomu 7 (7p).
Gen ten koduje białko błonowe, które funkcjonuje jako
kanał jonowy oraz wpływa na powstawanie przewodów
wytryskowych, pęcherzyków nasiennych, nasieniowodów
i ⅔ dystalnej części przewodu najądrza.
Wrodzony obustronny brak nasieniowodów (CBAVD,
ang. congenital bilateral absence of vas deferens) jest związany
z mutacją genu CFTR i występuje u ok. 2% mężczyzn
z OA zgłaszających się do kliniki w Edynburgu w Wielkiej
Brytanii
(Donat i wsp., 1997).
Częstość występowania
CBAVD wśród mężczyzn z OA różni się w poszczególnych
krajach. Kliniczna diagnoza braku nasieniowodów
jest łatwa do przeoczenia i wszyscy mężczyźni z azoospermią
powinni być bardzo szczegółowo przebadani, by
wykluczyć CBAVD, zwłaszcza u tych z objętością nasienia
<1,5 mL i pH <7,0. Około 1500 mutacji jest w wykazie bazy
CFTR (http://www.genetsickkids.on.ca/cftr/). Najczęściej
znajdywanymi są mutacje F508, R117H, W1282X, ale
częstość ich występowania oraz obecność innych mutacji
zależą w dużym stopniu od pochodzenia etnicznego
pacjenta (Chillon i wsp., 1995; de Braekeleer i Ferec, 1996).
Biorąc pod uwagę znaczenie funkcjonalne wariantów DNA
(allel 5T) w niekodującym regionie CFTR
(Chillon i wsp.,1995)
uważa się je obecnie raczej za umiarkowanie nasilone
mutacje genu CFTR niż polimorfizm, a także sugeruje
się, że powinny być badane u każdego pacjenta z CBAVD.
Ponieważ coraz więcej mutacji jest zdefiniowanych i poszukiwanych,
prawdopodobnie u prawie wszystkich mężczyzn
z CBAVD znajdzie się jakąś mutację. Testowanie
w kierunku wszystkich znanych mutacji nie jest jednak
uzasadnione, ponieważ wiele z nich ma znikomą częstość
występowania w poszczególnych populacjach.
Rutynowe badanie poprzez analizę panelu mutacji jest
zwykle ograniczone do najbardziej popularnych mutacji
występujących w danych populacjach. Jeśli druga z kolei
mutacja z rutynowego panelu dla danej populacji nie
jest potwierdzona, to – ponieważ jest to choroba recesywna
– zaleca się, aby kolejnym krokiem analizy było
bezpośrednie sekwencjonowanie całego genu. Mężczyźni
z CBAVD zwykle mają umiarkowanie nasilone objawy
kliniczne CF (np. w wywiadzie infekcje układu oddechowego).
Kiedy mężczyzna ma CBAVD, wtedy ważnym jest
zbadanie również jego partnerki w kierunku mutacji CF.
Jeśli kobieta ma potwierdzone nosicielstwo mutacji CFTR,
para powinna bardzo starannie rozważyć, czy w procedurze
ICSI korzystać z plemników partnera, jako że ryzyko
posiadania potomstwa z CF lub CBAVD będzie wynosiło
50% zależnie od typu mutacji występujących u rodziców.
Jeśli partnerka nie jest nosicielem znanych mutacji, ryzyko
bycia nosicielem nieznanych mutacji wynosi ok. 0,4%.
3C.4.1. Jednostronny lub obustronny brak/
nieprawidłowości nasieniowodów
i wady nerek
Jednostronny brak nasieniowodu jest zwykle związany
z brakiem nerki po tej samej stronie i prawdopodobnie
ma inne uwarunkowanie genetyczne
(Augarten i wsp.,1994).
W związku z tym u tych pacjentów badanie przesiewowe
w kierunku mutacji genu CFTR nie jest wskazane.
Mężczyźni z jednostronnym brakiem nasieniowodu są
zwykle płodni i stan ten jest najczęściej stwierdzany
jako przypadkowe znalezisko w klinikach wykonujących
wazektomię. Badanie przesiewowe w kierunku mutacji
genu CFTR jest wskazane u mężczyzn z jednostronnym
brakiem nasieniowodu i prawidłowymi nerkami.
W przypadku jedno- i obustronnego braku nasieniowodów
powinno być wykonane badanie ultrasonograficzne
jamy brzusznej. Wyniki mogą się kształtować od
jednostronnego braku nasieniowodu z brakiem nerki po tej
samej stronie do obustronnych zaburzeń nasieniowodów
i nerek, takich jak np. nerka miednicza
(Drake i Quinn, 1996).
3C.4.2. Nieznane zaburzenia genetyczne
Biorąc pod uwagę olbrzymią liczbę genów zaangażowanych
w męską spermatogenezę, jest wysoce prawdopodobne,
że idiopatyczne formy zaburzeń spermatogenezy
są spowodowane mutacjami lub polimorfizmem
w tych genach
(Nuti i Krausz, 2008).
Jednakże pomimo
intensywnych badań nad nowymi czynnikami genetycznymi
żadne klinicznie istotne mutacje genów czy
polimorfizmy (z wyjątkiem tych związanych z chromosomem
Y) nie zostały dotychczas zidentyfikowane
(Krausz i Giachini, 2007;).
(Nuti i Krausz, 2008;).
(Tuttelmann
i wsp., 2007).
Wprowadzenie nowych metod analitycznych
dostarczyło dowodów na znaczenie wariantów liczby
kopii określonej sekwencji DNA (CNV, ang. copy number
variants)
(Krausz i wsp., 2012;).
(Tuttelmann i wsp., 2011).
Oczekuje się również dalszych postępów w diagnostyce
andrologicznej dzięki metodzie sekwencjonowania nowej
generacji (NGS, ang. next generation sequencing). Metoda
ICSI jest stosowana, aby umożliwić ojcostwo mężczyznom
z poważnie uszkodzoną spermatogenezą w sytuacjach
wcześniej uznawanych za beznadziejne, gdzie tylko kilka
plemników może być pozyskanych. Dało to asumpt do
rozważań, czy takie dzieci mogą rodzić się z wadami,
ponieważ ICSI umożliwia plemnikowi z defektem pominięcie
naturalnego procesu selekcyjnego w żeńskich
drogach rodnych i otoczce komórki jajowej.
U dzieci z ICSI istnieje większe ryzyko powstania
de novo aberracji chromosomów płciowych (ok. 3-krotnie
większe w stosunku do spontanicznego poczęcia) i dziedziczenia
od ojca zaburzeń strukturalnych chromosomów.
Leczenie z wykorzystaniem techniki rozrodu
wspomaganego medycznie (ART, ang. assisted reproductive
technique) jest związane z większym ryzykiem wad
układu sercowo-naczyniowego, mięśniowo-szkieletowego,
moczowo-płciowego i pokarmowego oraz porażenia
mózgowego
(Eshre, 2007; Davies i wsp., 2012; van
Steirteghem i wsp., 2002).
(Eshre, 2007;).
(Davies i wsp., 2012;).
(van
Steirteghem i wsp., 2002).
