POSTĘPY ANDROLOGII ONLINE , 2017, 4 (2) , 1–10

KOMITET REDAKCYJNY
Redaktor naczelny:
dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego:
prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr hab. n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst, Republika Południowej Afryki
(Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga, Dania (Copenhagen, Denmark
)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Katedra i Zakład Histologii i Biologii Rozwoju
Wydział Nauk o Zdrowiu
Pomorski Uniwersytet Medyczny w Szczecinie
71-210 Szczecin ul. Żołnierska 48
tel. 91 48 00 917, 91 48 00 908
e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Agnieszka Hilczer
Waldemar Jachimczak
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Korekta języka polskiego:
Wojciech Markowski
Korekta języka angielskiego:
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI Tom 4 Volumin 4 Strony 1–81 Pages 1–81 Grudzień 2017 December 2017
O czasopiśmie / About Journal ....................................................................................................4
Artykuły poglądowe / Review
Katarzyna Chojnacka, Barbara Bilińska
Rola interleukiny 1α w procesie przebudowy bariery krew–jądro
The role of inteleukin 1α in blood–testis barrier remodeling .........................................................6
Iwona Rotter
Wpływ wybranych leków przeciwpadaczkowych na męski układ płciowy
The effect of selected anti-epileptic drugs on the male reproductive system ...............................16
Aleksandra Rosiak, Kamil Gill, Joanna Jakubik, Michał Kupś,
Łukasz Patorski, Rafał Kurzawa, Małgorzata Piasecka
Czy zaawansowany wiek ojcowski ma wpływ na sukces rozrodczy?
Część I: Ocena wybranych parametrów seminologicznych
Is advanced paternal age a reproductive risk?
Part I: Assessment of selected standard sperm characteristics...................................................... 23
Aleksandra Rosiak, Kamil Gill, Joanna Jakubik, Michał Kupś,
Łukasz Patorski, Rafał Kurzawa, Małgorzata Piasecka
Czy zaawansowany wiek ojcowski ma wpływ na sukces rozrodczy?
Część II: Rozwój zarodka, uzyskanie ciąży oraz zdrowie potomstwa
Is advanced paternal age a reproductive risk?
Part II: Embryo development, achieve pregnancy and health of off spring...................................... 33
Sprawozdanie i streszczenie wykładów z Konferencji
Polskiego Towarzystwa Andrologicznego – 19. Dzień Andrologiczny
Report and Abstract of lectures from Symposium of scientifi c training
of the Polish Society of Andrology – 19t Day of Andrology............................................................ 41
Andrologia Kliniczna – sprawozdanie z przebiegu szkolenia
w ramach Europejskiej Akademii Andrologii – Artur Pietrusa
Clinical Andrology – Report from European Academy of Andrology
educational course on andrology – Artur Pietrusa ..........................................................................75
Instrukcje dla autorów / Instructions for authors ............................................................................77
Recenzenci prac opublikowanych w 2017 r. / Reviewers in 2017................................................... 83
O CZASOPIŚMIE ABOUT THE JOURNAL
Wersja elektroniczna czasopisma jest wersją pierwotną. Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open
Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.
The electronic version of the journal is a original version. Access to scientific information published in the journal is free and
unlimited (Open Access).
Zaburzenia męskiego układu płciowego dotyczą osób
w różnym wieku i w większości przypadków prowadzą
do niepłodności, która nabrała już rangi choroby cywilizacyjnej.
Najczęściej identyfikowanymi nieprawidłowościami
są hipogonadyzm, zaburzenia seksualne, wady
rozwojowe narządów płciowych, nowotwory jąder i prostaty.
Ze względu na specyficzne i coraz bardziej zanieczyszczone
środowisko antropogeniczne dotyczą one
głównie społeczeństw rozwiniętych, w tym również
Polski, i stanowią istotny oraz narastający problem
medyczny, społeczny, demograficzny, a także zdrowia
publicznego. Nauka, która zajmuje się fizjologią i zaburzeniami
męskiego układu płciowego w aspekcie nauk
podstawowych i klinicznych, to andrologia. Ponieważ
jest to młoda dziedzina nauki, jeszcze do niedawna niezadowalający
stan wiedzy ograniczał możliwości diagnostyki
oraz leczenia zaburzeń męskiego układu płciowego.
Jednak w ostatnich latach obserwuje się niezwykle dynamiczny
rozwój andrologii, szczególnie molekularnej, spowodowany
wprowadzeniem nowych metod badawczych
z zakresu biochemii, biologii i genetyki molekularnej.
Andrologia staje się dziedziną interdyscyplinarną integrującą
wiedzę z różnych dyscyplin medycznych i naukowych.
Informacje związane z tymi zagadnieniami z trudem
docierają do lekarzy i osób zainteresowanych w naszym
kraju, ponieważ jest niewiele literatury w języku polskim,
a wykłady wygłaszane podczas konferencji nie zawsze
wyczerpująco wyjaśniają wątpliwości dotyczące m.in.
postępowania diagnostycznego, terapeutycznego, rekomendacji
czy też proponowanych algorytmów. Stąd też
potrzeba stworzenia czasopisma prezentującego wiedzę
andrologiczną lekarzom różnych specjalności, diagnostom
laboratoryjnym i przedstawicielom nauk podstawowych.
Czasopismo „Postępy Andrologii Online” powstało
z inicjatywy Polskiego Towarzystwa Andrologicznego,
które zainteresowane jest integracją środowiska osób
zajmujących się różnymi aspektami męskiego układu
płciowego, uzupełnieniem i poszerzeniem ich wiedzy,
a także poprawą opieki zdrowotnej nad mężczyznami
w naszym kraju.
Celem czasopisma jest: 1) dostarczenie istotnych
informacji na temat fizjologii i patologii męskiego układu
płciowego, 2) propagowanie praktycznej wiedzy andrologicznej
kierowanej do szerokich kręgów odbiorców,
3) wymiana poglądów i opinii na temat zagadnień klinicznych
oraz wyników badań doświadczalnych oraz
4) przekazywanie informacji dotyczących konferencji
i kursów o tematyce andrologicznej.
Proponowana tematyka czasopisma to: 1) andrologia
kliniczna z uwzględnieniem etiopatogenezy, diagnostyki
i leczenia m.in. zaburzeń rozwojowych, niepłodności
i procesów starzenia mężczyzn, 2) nowatorskie
metody diagnostyczne, 3) andrologia doświadczalna
rozwijająca się w oparciu o nauki podstawowe oraz
4) inne interdyscyplinarne tematy związane z dziedziną
andrologii.
Czasopismo kierowane jest do lekarzy specjalności
bezpośrednio lub pośrednio związanych z andrologią,
m.in. urologów, endokrynologów, ginekologów, pediatrów,
ale także do lekarzy rodzinnych spotykających się
z coraz częstszym problemem niepłodności partnerskiej
i problemami starzejących się mężczyzn. Ponadto naszą
intencją jest zdobycie zainteresowania diagnostów laboratoryjnych
odgrywających istotną rolę w prawidłowym
postępowaniu terapeutycznym opartym na szerokim
panelu testów i badań, których wdrożenie wciąż wymaga
odpowiednich i wyczerpujących szkoleń z diagnostyki
andrologicznej, w tym seminologicznej. Mamy nadzieję,
że nasze czasopismo wzbudzi również zainteresowanie
biologów zajmujących się czynnością męskiego układu
płciowego w ramach nauk podstawowych, a także lekarzy
weterynarii oraz innych osób, które znajdą informacje
poszerzające ich wiedzę i kształtujące opinię z zakresu
szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac oryginalnych,
kazuistycznych i krótkich komunikatów, jak
również prac poglądowych, opracowanych w kondensacyjnej,
dydaktycznej i przystępnej formie. W pracach
tych autorzy powinni przedstawiać aktualny stan wiedzy
światowej oraz swoje opinie. Chcemy, aby czasopismo
spełniało rolę informatora i przewodnika w dziedzinie
andrologii oraz stanowiło forum dyskusyjne. Ponadto,
zapraszamy do publikowania artykułów będących
tłumaczeniem publikacji ukazujących się w języku angielskim,
które przedstawiają istotne postępy w andrologii.
http://www.postepyandrologii.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska-Hilczer
przewodnicząca
Polskiego Towarzystwa Andrologicznego
ROLA INTERLEUKINY 1α W PROCESIE PRZEBUDOWY BARIERY KREW–JĄDRO
Katarzyna Chojnacka, Barbara Bilińska
Zakład Endokrynologii, Instytut Zoologii i Badań Biomedycznych, Uniwersytet Jagielloński w Krakowie, ul. Gronostajowa 9,
30-087 Kraków
autor do korespondencji/corresponding author: Katarzyna Chojnacka, Zakład Endokrynologii,
Instytut Zoologii i Badań Biomedycznych, Uniwersytet Jagielloński w Krakowie, ul. Gronostajowa 9, 30-087 Kraków;
tel. +48 12 664 5027, kasia.chojnacka87@gmail.com
Otrzymano/received: 17.12.2017. Zaakceptowano/accepted: 30.12.2017
Katarzyna Chojnacka – dr n. biol., absolwentka Uniwersytetu Jagiellońskiego w Krakowie.
Pierwszy autor i współautor 15 publikacji naukowych dotyczących hormonalnej i strukturalnej
kontroli czynności komórek męskiego układu rozrodczego. Laureatka licznych stypendiów i nagród,
m.in. stypendium Ministra Nauki i Szkolnictwa Wyższego (MNiSW) dla doktorantów i stypendium
MNiSW dla wybitnych młodych naukowców oraz laureatka nagrody dla młodych polskich
naukowców w andrologii im. Prof. Michała Bokińca, za osiągnięcia naukowe w 2016 r. Obecnie
naukowo związana z Centrum Nowych Technologii Uniwersytetu Warszawskiego, gdzie realizuje
własny projekt badawczy.
Katarzyna Chojnacka – PhD in biological sciences, graduated from the Jagiellonian University in Cracow. First
author and co-author of 15 original papers describing hormonal and structural regulation of male reproductive
system. Laureate of numerous scholarships and awards, including Minister of Science and Higher Education
scholarship for PhD students and Minister of Science and Higher Education scholarship for outstanding young
scientists as well as laureate of award named by prof. Michal Bokiniec for the young polish scientist in andrology
for 2016. Currently, she is scientifically connected with the Center of New Technologies at the University of
Warsaw, where she conducts her own research project.
Streszczenie
Interleukina 1α jest cytokiną prozapalną odgrywającą ważną rolę w utrzymaniu odporności wrodzonej, a także w utrzymaniu prawidłowej
homeostazy tkankowej. Interleukina 1α ulega konstytutywnej ekspresji w gonadzie męskiej i jest kluczowym regulatorem
funkcjonowania bariery krew–jądro. Głównym komponentem bariery krew–jądro jest zlokalizowany pomiędzy komórkami Sertoliego
kompleks połączeń międzykomórkowych, który chroni antygenowo obce haploidalne komórki germinalne przed układem immunologicznym
ustroju, uniemożliwiając w ten sposób produkcję przeciwciał przeciwplemnikowych. Mimo to, bariera krew–jądro musi
ulegać przejściowemu otwarciu, aby umożliwić pasaż komórek germinalnych do apikalnej części nabłonka plemnikotwórczego i ich
uwolnienie do światła kanalika plemnikotwórczego. Przedstawiona praca przeglądowa podsumowuje bieżącą wiedzę na temat roli
interleukiny 1α w gonadzie męskiej i podkreśla nowe interesujące odkrycia, które pokazują, że interleukina 1α jest kluczową cytokiną
w procesie przebudowy bariery krew–jądro.
Słowa kluczowe: Interleukina 1, bariera krew–jądro, połączenia międzykomórkowe
Abstract
Interleukin 1α is a pro-inflammatory cytokine with an important role in innate immunity, as well as in maintaining normal tissue
homeostasis. Interleukin 1α is constitutively expressed in the male gonad and plays key role in the regulation of blood–testis barrier
in the seminiferous epithelium. Blood-testis barrier is formed by cell junctions between adjacent Sertoli cells and protects developing
antigenic foreign germ cells against the immune system, thus preventing the production of antisperm antibodies. Still, the blood–testis
barrier must be transiently opened to allow the entry of spermatocytes into the adluminal compartment of the seminiferous epithelium
for further development and spermiation. This review summarizes current knowledge about the role of interleukin 1α in the male gonad
and highlights new interesting findings that show interleukin 1α as a key cytokine involved in the remodelling of the blood-testis barrier.
Key words: Interleukin 1, blood–testis barrier, cell junctions
Skróty / Abbreviations
Arp2/3 – białko związane z aktyną 2/3 (ang. actin related protein 2/3), bES – bazalne specjalizacje powierzchniowe (ang. basal ectoplasmic
specialization), BTB – bariera krew–jądro (ang. blood–testis barrier), CAPS – okresowe zespoły zależne od białka kriopiryny (ang. cryopyrin-associated
periodic syndromes), Eps8 – substrat 8 dla kinazy receptora naskórkowego czynnika wzrostu (ang. epidermal growth factor receptor
kinase substrate 8), ERK1/2 – kinaza 1 oraz kinaza 2 aktywowane sygnałami zewnątrzkomórkowymi (ang. extracellular signal-regulated
kinase 1/2), GJ – połączenia szczelinowe (ang. gap junctions), hCG – ludzka gonadotropina kosmówkowa (ang. human chorion gonadotropin),
IKK – kinaza inhibitora czynnika transkrypcyjnego NFκB (ang. inhibitor of NFκB kinase), IL-1 – interleukina 1 (ang. interleukin 1), IL-1α –
interleukina 1α (ang. interleukin 1α), IL-1α – gen kodujący interleukinę 1α (ang. interleukin 1α gene), IL-1β – interleukina 1β (ang. interleukin
1β), IL-1β – gen kodujący interleukinę 1β (ang. interleukin 1β gene), IL-1R1 – receptor IL-1 typu 1 (ang. IL-1 receptor type I), IL-1R2 – receptor
IL-1 typu 2 (ang. IL-1 receptor type II), IL-1Ra – antagonista receptora IL-1 (ang. IL-1 receptor antagonist), IL-1RAcP – cząsteczka zasocjowana
z receptorem IL-1 (ang. IL-1 receptor accessory protein), IL-6 – interleukina 6 (ang. interleukin 6), IL-8 – interleukina 8 (ang. interleukin 8),
IL-18 – interleukina 18 (ang. interleukin 18), IL-33 – interleukina 33 (ang. interleukin 33), IL-36α – interleukina 36α (ang. interleukin 36α),
IL-36β – interleukina 36β (ang. interleukin 36β), IL-36γ – interleukina 36γ (ang. interleukin 36γ), IL-36Ra – antagonista receptora IL-36 (ang.
IL-36 receptor antagonist), IL-37 – interleukina 37 (ang. interleukin 37), IL-38 – interleukina 38 (ang. interleukin 38), IRAK – kinaza zasocjowana
z receptorem IL-1 (ang. IL-1 receptor-associated kinase), IκB inhibitor czynnika jądrowego κB (ang. inhibitor of nuclear factor κB), JNK
– kinaza c-Jun N-terminalna (ang. cJun N‑terminal kinase); kDa – kilo daltony (ang. kilo dalton), LH – hormon luteinizujący (ang. luteinizing
hormone), MAPK – kinazy białkowe aktywowane mitogenem (ang. mitogen-activated protein kinases), MyD88 – białko rożnicowania szpiku
88 (ang. Myeloid differentiation primary response 88), NF-κB – czynnik jądrowy κB (ang. nuclear factor κB), NLS – sygnał lokalizacji jądrowej
(ang. nuclear localization signal), pro-IL-1 – prekursorowa postać interleukiny 1 (ang. pro-interleukin 1), pro-IL-1α – prekursorowa postać
interleukiny 1 (ang. pro-interleukin 1α), pro-IL-1β – prekursorowa postać interleukiny 1 (ang. pro-interleukin 1β), sIL-1R2 – rozpuszczalna
postać receptora IL-1 typu 2 (ang. soluble type 2 IL-1 receptor), sIL-1RAcP – rozpuszczalna postać cząsteczki zasocjowanej z receptorem
IL-1 (ang. soluble IL-1 receptor accessory protein), P – fosforylacja (ang. phosphorylation) TAK-1 – kinaza 1 aktywowana transformującym
czynnikiem wzrostu β (ang. transforming growth factor β activated protein kinase 1), TIR – domena receptora toll/interleukiny 1 (ang. toll/
Interleukin-1 receptor domain), TGF-β – transformujący czynnik wzrostu β (ang. transforming growth factor β); TJ – połączenia ścisłe (ang. tight
junctions), TNF-α – czynnik martwicy nowotworów α (ang. tumor necrosis factor α), TRAF-6 – czynnik 6 zasocjowany z receptorem TNF (ang.
TNF receptor-associated factor 6), Ub – ubikwityna (ang. ubiquitin), ZO-1 – białko-1 obwódki zamykającej (ang. zonula occludens-1 protein)
Wprowadzenie
Spermatogeneza jest złożonym, zsynchronizowanym
w czasie i precyzyjnie regulowanym procesem, którego
celem jest produkcja plemników, haploidalnych komórek
zawierających połowę materiału genetycznego spermatogonii.
Coraz liczniejsze badania prowadzone w ostatnich
latach wskazują na udział białek z rodziny cytokin
interleukiny 1 (IL-1, ang. interleukin 1) w lokalnej kontroli
czynności gonady męskiej. System IL-1 w jądrze obejmuje
prekursorową postać interleukiny 1 (pro-IL-1α, ang. pro-
-interleukin 1α), interleukinę 1α (IL-1α, ang. interleukin 1α),
prekursorową postać interleukiny 1β (pro-IL-1β, ang. pro-
-interleukin 1β), interleukinę 1β (IL1-β, ang. interleukin 1β),
receptor dla IL-1 typu 1 (IL-1R1, ang. IL-1 receptor type I),
oraz typu 2 (IL-1R2, ang. IL-1 receptor type 2), a także
antagonistę receptorów IL-1 (IL-1Ra, ang. IL-1 receptor
antagonist) (Dinarello, 1997).
Układ IL-1
Interleukina 1 jest centralnym mediatorem odporności
wrodzonej i stanu zapalnego. Wywołuje wiele procesów
fizjologicznych, takich jak stymulacja proliferacji limfocytów
T, różnicowanie limfocytów B, synteza białek
ostrej fazy, infiltracja leukocytów w miejscach zakażeń
i gorączka (.Dinarello, 1997, 2009; Garlanda i wsp., 2013)
Mnogość procesów, w których uczestniczy IL-1, wskazuje
na jej kluczowe znaczenie w regulacji odpowiedzi immunologicznej.
Do rodziny cytokin IL-1 obecnie zalicza się
11 białek obejmujących zarówno cząsteczki agonistyczne,
(IL-1α i IL-1β, IL-18, IL-33, IL-36α, IL-36β, IL-36γ), które
mogą aktywować sygnalizację za pośrednictwem receptora,
jak i cząsteczki antagonistyczne (IL-1Ra, IL-36Ra,
IL-38) oraz cytokinę przeciwzapalną, IL-37 (.(Dinarello, 2009) Najlepiej zbadanymi białkami z tej rodziny są IL-1α
i IL-1β. Ze względu na podobną aktywność biologiczną
i przekaz sygnału z udziałem tego samego receptora
dla IL-1, IL-1α i IL-1β początkowo opisywane były jako
jedna, ta sama cytokina. W późniejszym okresie białka te
okazały się być jednak kodowane przez dwa odrębne geny
(March i wsp., 1985). Obie cytokiny – IL-1α jak i IL-1β – są
produkowane w formie prekursorów białkowych o masie
cząsteczkowej 31-kDa (pro-IL-1) i wydzielane jako dojrzałe
17-kDa białka (Dinarello, 1996). W badaniach in vitro
z użyciem rekombinowanych dojrzałych białek udowodniono,
że IL-1α i IL-1β wykazują podobne efekty biologiczne,
jednak w badaniach in vivo wyrażają odmienne
role fizjologiczne i mechanizmy regulacyjne. Na przykład
IL-1β musi być przetwarzana w dojrzałe białko dla
uzyskania optymalnej aktywności, zaś IL-1α wykazuje
aktywność zarówno jako forma dojrzała, jak i prekursorowa,
co częściowo jest związane ze zdolnością pro-IL-1α
do wiązania z IL-1R1 (Mosley i wsp., 1987) (rycina 1).
Ponadto IL-1α posiada sygnał lokalizacji jądrowej (NLS,
ang. nuclear localisation signal), dzięki czemu może ulegać
translokacji do jądra komórkowego i działać jako czynnik
transkrypcyjny (Wessendorf i wsp., 1993). Obie cytokiny
różnią się również sposobem aktywacji. Prekursorowa
postać interleukiny 1α jest przetwarzana przez kalpainę
(Kobayashi i wsp., 1990),. podczas gdy w dojrzewaniu pro-
IL-1β zaangażowana jest kaspaza-1 (dawniej znana jako
enzym konwertujący IL-1β) (Thornberry i wsp., 1992).
Myszy pozbawione kaspazy-1 charakteryzuje brak dojrzewania
pro-IL-1β i IL-18 (Kuida i wsp., 1995; Li i wsp.,
1995).Wiadomo, że do aktywacji kaspazy-1 niezbędne
jest utworzenie wielobiałkowego kompleksu zwanego
inflamasomem (Franchi i wsp., 2009). Badania prowadzone
w ostatnich latach wykazały także, że aktywacja
inflamasomów indukuje nie tylko sekrecję IL-1β, lecz
również wydzielanie IL-1α (Fettelschoss i wsp., 2011;
Gross i wsp., 2012; Yazdi i Drexler, 2013). Obie cytokiny
różnią się także miejscem wytwarzania: IL-1α jest syntetyzowana
przez monocyty, makrofagi, neutrofile, limfocyty,
komórki glejowe, keratynocyty, komórki śródbłonka,
podczas gdy IL-1β głównie przez monocyty.
Co istotne IL-1α jest związana z błoną komórek produkujących
ją i działa lokalnie, podczas gdy IL-1β jest
wydzielana do krwi i ma działanie ogólnoustrojowe (Sims
i Smith, 2010). Ponieważ IL-1 jest cytokiną prozapalną,
została najlepiej zbadana i opisana w odniesieniu do
patologicznych stanów zapalnych takich jak ostre uszkodzenie
płuc (Ganter i wsp., 2008), zapalenie kości i stawów
(Novakofski i wsp., 2009) czy autoimmunologiczne choroby
tarczycy (Nilsson i wsp., 1998). Pomimo natury prozapalnej
IL-1 podtyp α tej cytokiny ma również pozytywne
funkcje fizjologiczne. W wielu tkankach, takich jak skóra
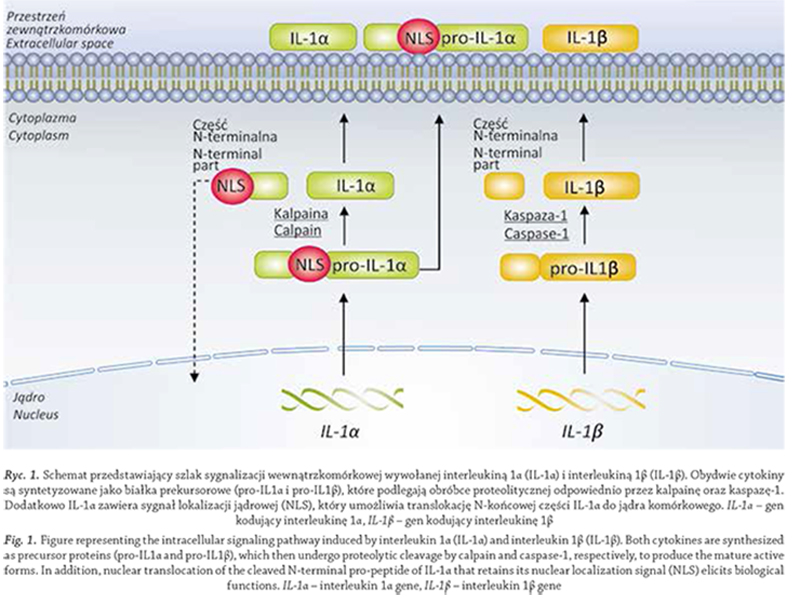
Ryc. 1. Schemat przedstawiający szlak sygnalizacji wewnątrzkomórkowej wywołanej interleukiną 1α (IL-1α) i interleukiną 1β (IL-1β). Obydwie cytokiny
są syntetyzowane jako białka prekursorowe (pro-IL1α i pro-IL1β), które podlegają obróbce proteolitycznej odpowiednio przez kalpainę oraz kaspazę-1.
Dodatkowo IL-1α zawiera sygnał lokalizacji jądrowej (NLS), który umożliwia translokację N-końcowej części IL-1α do jądra komórkowego. IL-1α – gen
kodujący interleukinę 1α, IL-1β – gen kodujący interleukinę 1β
Fig. 1. Figure representing the intracellular signaling pathway induced by interleukin 1α (IL-1α) and interleukin 1β (IL-1β). Both cytokines are synthesized
as precursor proteins (pro-IL1α and pro-IL1β), which then undergo proteolytic cleavage by calpain and caspase‑1, respectively, to produce the mature active
forms. In addition, nuclear translocation of the cleaved N‑terminal pro-peptide of IL-1α that retains its nuclear localization signal (NLS) elicits biological
functions. IL- i śródbłonek wykazano konstytutywną ekspresję IL-1α
(ale nie IL-1β), gdzie działa jako autokrynny czynnik
wzrostu, uczestnicząc w zachowaniu prawidłowej homeostazy
tkankowej .(Dinarello, 1996, 2009))
System IL-1 w gonadzie męskiej
Komórki gonady męskiej wykazują ekspresję IL-1α, IL-1β
(Gustafsson i wsp., 2002; Haugen i wsp., 1994; Jonsson i wsp.,
1999), dwóch typów receptorów dla tych cytokin (IL-1R1
i IL-1R2) (Gomez i wsp., 1997) oraz ich antagonisty IL-1Ra
(Rozwadowska i wsp., 2007). W nabłonku plemnikotwórczym
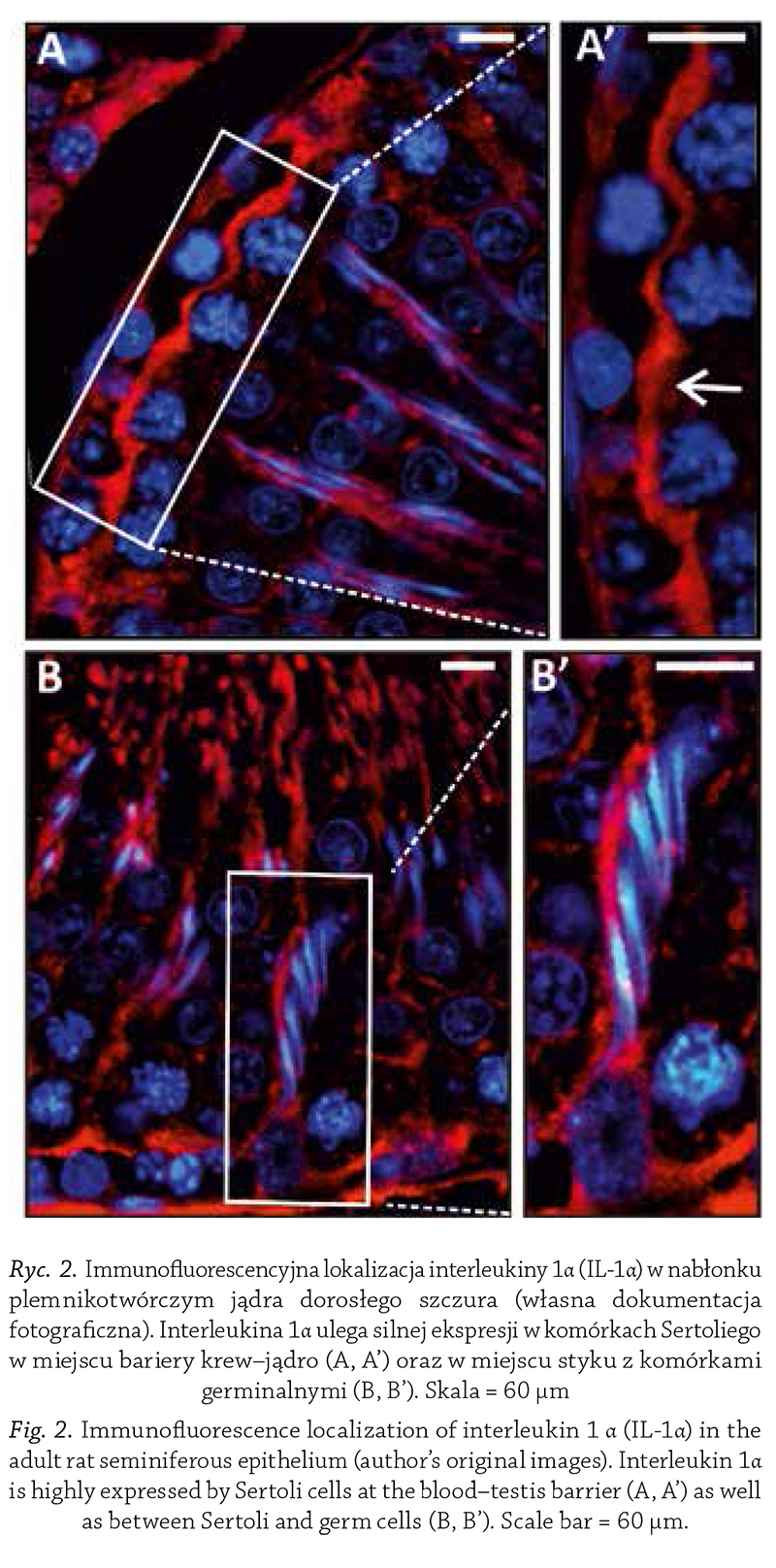
stwierdza się głównie ekspresję IL-1α (Sarkar i wsp.,
2008) (rycina 2), zaś w tkance interstycjalnej przeważa
IL-1β (Rozwadowska i wsp., 2007). Techniką hybrydyzacji
in situ wykazano zależną od wieku ekspresję IL-1α.
W komórkach Sertoliego zwierząt powyżej 20. dnia życia
Ryc. 2. Immunofluorescencyjna lokalizacja interleukiny 1α (IL-1α) w nabłonku
plemnikotwórczym jądra dorosłego szczura (własna dokumentacja
fotograficzna). Interleukina 1α ulega silnej ekspresji w komórkach Sertoliego
w miejscu bariery krew–jądro (A, A’) oraz w miejscu styku z komórkami
germinalnymi (B, B’). Skala = 60 μm
Fig. 2. Immunofluorescence localization of interleukin 1 α (IL-1α) in the
adult rat seminiferous epithelium (author’s original images). Interleukin 1α
is highly expressed by Sertoli cells at the blood–testis barrier (A, A’) as well
as between Sertoli and germ cells (B, B’). Scale bar = 60 μm.
transkrypty dla IL-1α wykryto we wszystkich stadiach
cyklu nabłonka plemnikotwórczego z wyjątkiem VII
(Jonsson i wsp., 1999; Wahab-Wahlgren i wsp., 2000).
Chociaż komórki Sertoliego stanowią główne źródło
ekspresji IL-1α, to również komórki germinalne pozostają
nie bez znaczenia. Wykazano bowiem, że u zwierząt
pozbawionych komórek germinalnych na skutek
eksperymentalnej ekspozycji na radiację lub bisulfan
w komórkach Sertoliego nie wykryto transkryptu dla
IL-1α (Jonsson i wsp., 1999), co wskazuje na ważną rolę
regulacyjną komórek germinalnych. W samych komórkach
germinalnych ekspresję IL-1α stwierdzili Haugen
i wsp. (1994). Zarówno forma prekursorowa jak i dojrzała
postać IL-1α są wykrywane w ekstraktach całych
jąder, w izolowanych kanalikach plemnikotwórczym oraz
w płynie kanalikowym (Gustafsson i wsp., 2002). Jest to
interesujące, gdyż IL-1α jest bardzo rzadko wydzielana
do ustroju (Dinarello, 1996), a niewielka ilość wykrywana
płynach ustrojowych jest następstwem uwalniania
zawartości ciałek apoptotycznych obumierającej
komórki (Berda-Haddad i wsp., 2011; Chen i wsp., 2007).
Wykazano, że w warunkach hodowli in vitro głównym
źródłem IL-1α kanalików krętych są komórki Sertoliego,
takiej aktywności nie wykazują natomiast komórki germinalne
czy Leydiga interstycjum (Gerard i wsp., 1991;
Syed i wsp., 1995). Poza dojrzałą 17 kDa formą oraz formą
prekursorową o masie 31 kDa w jądrach stwierdza się
również występowanie formy o masie 24 kDa, będącej
produktem alternatywnego składania genu, w wyniku
czego brakuje sekwencji kodujących aminokwasy procesowanych
przez kalpainę. W doświadczeniach in vitro
potwierdzono brak dojrzewania 24 kDa formy IL-1α do
formy 17 kDa. W przeciwieństwie do innych izoform
(31 kDa pro‑IL-1α oraz 17 kDa IL-1α) postać 24 kDa
nie hamuje indukowanej przez ludzką gonadotropinę
kosmówkową (hCG, ang. human chorion gonadotropin)
steroidogenezy w komórkach Leydiga (Sultana i wsp.,
2000). Jak wspomniano wcześniej, IL-1β ulega ekspresji
głównie w tkance interstycjalnej. Wykazano, że IL-1β
stymuluje proliferację komórek Leydiga w hodowli in
vitro (Svechnikov i wsp., 2003). Wczesne badania nad IL-1
i IL-1α wykazały, że hamuje ona produkcję testosteronu
przez komórki Leydiga (Hales, 1992; Lin i wsp., 1991;
Mauduit i wsp., 1992), odmiennie od IL-1β, która według
badań Verhoeven i wsp. (1988) stymuluje steroidogenezę
w komórkach Leydiga. Wyraźne rozbieżności w uzyskanych
danych mogą wynikać z odmiennych warunków
eksperymentalnych lub metodologicznych. W komórkach
Leydiga izolowanych od zwierząt 10–20‑dniowych IL-1β
prowadziła do zależnego od dawki nasilenia wbudowania
3H-tymidyny1 do DNA (Khan i wsp., 1992). Wykazano
także, że IL-1α wpływa na inkorporację 3H-tymidyny,
jednakże efekt ten był znacznie słabszy niż obserwowany
dla IL-1β. Z drugiej strony IL-1β nie ma wpływu
1 3H-tymidyna – radioaktywnie znakowana tymidyna wykorzystywana
do oceny proliferacji komórek (przyp. red.)
na wbudowywanie DNA do komórek Leydiga izolowanych
od starszych zwierząt, co sugeruje, że odgrywa
ona rolę w proliferacji komórek Leydiga u niedojrzałych
płciowo szczurów (Khan i wsp., 1992). W gonadzie
męskiej stwierdza się także ekspresję IL-1R1. Pomimo
licznych doniesień o ważnej roli IL-1 w gonadzie męskiej,
myszy z knock-outem genomowym receptora IL-R1 nie
wykazują odchyleń w poziomie stężenia testosteronu
w osoczu oraz liczby plemników w najądrzu (Cohen i wsp.,
1998). Nie wyklucza to jednak istotnej roli IL-1 w gonadzie
męskiej, mogą istnieć bowiem alternatywne szlaki
przekazu sygnału, uruchamiane jako mechanizm kompensacyjny
w przypadku braku IL1-R1.
Sygnalizacja poprzez receptor dla IL-1
Receptory z rodziny IL-1 mają podobną budowę i zawierają
charakterystyczną domenę TIR (ang. Toll/Il-IR
domain) (Barton i Medzhitov, 2003). Dotychczas zidentyfikowano
dwa receptory, które mają zdolność wiązania
IL-1. Receptor typu I (IL-1R1) jest odpowiedzialny za
przekazywanie efektów prozapalnych IL-1, podczas gdy
receptor typu II (IL-1R2) działa jako receptor pułapka
(ang. decoy receptor), tzn. wychwytuje IL-1, ale nie
powoduje transdukcji sygnału do wewnątrz komórki
i w efekcie hamuje odpowiedzi na wydzielaną IL-1. Co
więcej, pro-IL‑1α, IL-1α i IL-1β mają zdolność do wiązania
się z receptorem IL-1R1 na komórkach docelowych, co
skutkuje zmianami konformacyjnymi receptora umożliwiającymi
mu związanie koreceptora (IL-1RAcP, ang.
IL-1R accessory protein) (rycina 3) (Dower i wsp., 1986;
Vigers i wsp., 1997). Dalsza sygnalizacja wymaga ekspozycji
domen TIR obecnych w cytoplazmatycznych
ogonach IL-1R1 i IL-1RAcP, co prowadzi do rekrutacji
białka adaptorowego MyD88 (ang. Myeloid differentiation
primary response 88). Białko to rekrutuje kinazy związane
z receptorem IL-1 (IRAK, ang. interleukin-1 receptor-
-associated kinase) (Wesche i wsp., 1997). W obrębie kompleksu
sygnałowego IL-1R1 aktywność kinazy IRAK-4
promuje fosforylację i aktywację IRAK-1, która z kolei
rekrutuje czynnik związany z receptorem czynnika martwicy
nowotworu (TRAF-6, ang. TNF receptor-associated
factor 6) (Barton i Medzhitov, 2003). Późniejsza dysocjacja
tych kinaz z kompleksu receptorowego i rekrutacja dalszych,
końcowych cząsteczek sygnałowych skutkuje
aktywacją czynników jądrowych κB (NF-κB) i szlaków
MAPK (ang. mitogen-activated protein kinases). Sygnalizacja
poprzez receptor IL-1R jest modulowana przez inhibujące
działanie IL1Ra, IL1R2, sIL-1R2 (ang. soluble type
2 IL-1R), sIL-1RAcP (ang. soluble IL-1 receptor accessory
protein) (rycina 3). IL-1Ra jest kompetycyjnym antagonistą
IL-1R1. Po przyłączeniu IL-1Ra do IL-1R1 nie jest
on zdolny do zmiany swojej konformacji niezbędnej do
rekrutowana koreceptora IL-1RAcP i dalszej transdukcji
sygnału (Sims, 2002). Hamujące właściwości IL-1Ra
zostały wykorzystane do leczenia pacjentów cierpiących
na reumatoidalne zapalenie stawów i choroby autoimmunologiczne,
takie jak okresowe zespoły zależne od
białka kriopiryny (CAPS, ang. Cryopyrin-Associated Periodic
Syndromes). Pacjentom podaje się rekombinowane białko
IL-1Ra, znane pod nazwą Anakinra (Kone-Paut i Galeoti,
2014, Mertens i Singh, 2009). Receptor IL-1R2 działa jako
receptor pułapka, który hamuje odpowiedzi zapalne
z udziałem IL-1. Dzieje się tak, gdyż w przeciwieństwie
do IL-1R1 o masie cząsteczkowej 80 kDa, IL-1R2 jest
mniejszym białkiem o wielkości 68 kDa, które zawiera
tylko krótki 29-aminokwasowy koniec cytoplazmatyczny
pozbawiony domeny TIR, a zatem jest niezdolny
do przekazywania sygnałów wewnątrzkomórkowych
(McMahan i wsp., 1991). Stąd też, IL-1R2 wiąże IL-1-α
i IL-1β z wysokim powinowactwem, zaś IL-1Ra z co najmniej
100-krotnie niższym powinowactwem niż IL-1R1
(Symons i wsp., 1995). To niskie powinowactwo IL-1Ra do
IL-1R2 powoduje, iż w krążeniu pozostaje więcej wolnego
antagonisty, który może być wiązany przez IL-1R1.
Istnieją więc dwa uzupełniające się mechanizmy hamowania
sygnału IL-1 – poprzez działanie receptora pułapki
oraz poprzez wiązanie antagonisty do IL-1R1. Oprócz
formy związanej z błoną IL-1R2 występuje również jako
rozpuszczalne białko (sIL-1R2). Jest ono wytwarzane
przez cięcie proteolityczne w bliższym regionie zewnątrzkomórkowym,
prowadząc do uwolnienia do krążenia
zewnątrzkomórkowej domeny receptora, która podobnie
jak postać dojrzała wiąże IL-1. Rozpuszczalny IL-1RAcP
(sIL-1RAcP), który jest generowany przez alternatywne
składanie zarówno u ludzi, jak i u myszy, zwiększa powinowactwo
krążącego w krwioobiegu sIL-1R2 do IL-1β
i IL-1α (Smith i wsp., 2003). Podsumowując, warto zaznaczyć,
iż wiedza o IL-1α pozostaje niekompletna, ponieważ
większość badań przeprowadzono na komórkach traktowanych
rekombinowanymi, dojrzałymi białkami.
W związku z tym udział sygnalizacji pro-IL-1α w pozostaje
nadal nieodkryty. Z tego powodu uzasadnione są
dalsze badania, które pozwolą lepiej zrozumieć szlak
dojrzewania IL-1α, aktywność prekursora i dojrzałej
IL-1α, jak również umożliwią identyfikację nowych białek
pośredniczących w regulowanej przez IL-1α sygnalizacji.
Rola IL-1α w nabłonku plemnikotwórczym
W nabłonku plemnikotwórczym jądra dorosłego ssaka,
spermatogeneza jest procesem, w którym diploidalne
komórki płciowe przechodzą podział, różnicowanie i morfogenezę,
w wyniku czego dochodzi do powstania haploidalnych
plemników (Clermont, 1972). Podczas rozwoju
komórek germinalnych są one strukturalnie i fizjologicznie
wspierane przez somatyczne komórki Sertoliego.
Jedną z najważniejszych ról przypisywanych komórkom
Sertoliego jest tworzenie bariery krew–jądro (BTB, ang.
blood–testis barier), której główną komponentą i najbardziej
szczelnym elementem bariery jest kompleks
połączeń międzykomórkowych zlokalizowany pomiędzy

sąsiadującymi komórkami Sertoliego w przypodstawnej
części nabłonka plemnikotwórczego. W kompleksie połączeń
BTB wyróżnia się koegzystujące połączenia ścisłe
(TJ, ang. tight junctions), bazalne specjalizacje powierzchniowe
(bES, ang. basal ectoplasmic specializations), połączenia
desmosomopodobne (ang. desmosome-like junctions)
i połączenia szczelinowe (GJ, ang. gap junctions),
które wspólnie utrzymują integralność bariery (Kopera
i wsp., 2010). Integralność BTB ma kluczowe znaczenie dla
funkcjonalnego dojrzewania, formowania, a następnie
uwalniania plemników, a jakiekolwiek zaburzenie funkcji
bariery może wyzwalać reakcję autoimmunologiczną,
ponieważ antygeny znajdujące się na powierzchni haploidalnych
komórek płciowych są rozpoznawane przez
układ odpornościowy gospodarza jako obce, gdyż tolerancja
immunologiczna rozwija się na długo przed dojrzałymi
plemnikami. Pomimo tego BTB musi ulegać przejściowemu
otwarciu (co u szczura ma miejsce między VIII
a XI stadium cyklu nabłonka plemnikotwórczego), aby
umożliwić przejście spermatocytów do apikalnej części
nabłonka plemnikotwórczego w celu dalszego rozwoju
(Russell, 1977). Ówczesne obserwacje morfologiczne sugerowały,
że „nowa” BTB tworzy się pod spermatocytami
podczas ich migracji w górę nabłonka plemnikotwórczego
(w kierunku światła kanalika), co umożliwia spermatocytom
przejście przez „starą” barierę krew–jadro,
znajdującą się nad nimi (rycina 4). W ten sposób nie
dochodzi do kontaktu dojrzewających komórek germinalnych
z układem immunologicznym. Uważa się, że
te skomplikowane, ale wysoce zsynchronizowane zdarzenia
przebudowy, które obejmują również cytoszkielet,
są koordynowane w dużej mierze przez czynniki (np.
cytokiny, androgeny i estrogeny) wydzielane przez
komórki jądra (Cheng i Mruk, 2010). W tym aspekcie
IL-1α wyłania się jako ważny regulator połączeń międzykomórkowych
oraz cytoszkieletu w nabłonku plemnikotwórczym.
IL-1α ulega silnej ekspresji podczas całego
cyklu nabłonka plemnikotwórczego, z wyjątkiem stadium
VII, gdy jej poziom jest najniższy (Jonsson i wsp., 1999;
Wahab-Wahlgren i wsp., 2000), po czym następuje ponad
3-krotny wzrost jej stężenia, począwszy od stadium VIII,
co może być skutkiem fagocytowania przez komórki
Sertoliego, ciałek resztkowych pochodzących z wydłużonych
spermatyd (Syed i wsp., 1995). Ponieważ wzrost
poziomu IL-1α zbiega się w czasie z przebudową BTB, jak
i spermiacją, postulowano możliwą rolę IL-1α w koordynowaniu
tych dwóch zdarzeń. Wyniki potwierdzające tę
koncepcję pojawiły się dzięki badaniom in vivo, w których
wykazano, że śródskórne wstrzyknięcie rekombinowanej
IL-1α zaburza zarówno adhezję komórek germinalnych
do komórek Sertoliego, jak i integralność BTB (Sarkar
i wsp., 2008). Również w badaniach in vitro podanie IL-1α
wpływało na zaburzenie integralności połączeń pomiędzy
komórkami Sertoliego (Chojnacka i wsp., 2016; Lie i wsp.,
2011). Interleukina 1α wpływa także na dynamikę połączeń
międzykomórkowych w nabłonku plemnikotwórczym.
Podawanie IL-1α komórkom Sertoliego w hodowli

prowadziło do wzrostu ekspresji białek BTB: okludyny
oraz białka-1 obwódki zamykającej (ZO-1, ang. zonula
occludens 1), a także N-kadheryny i β-kateniny, (Chojnacka
i wsp., 2016; Lie i wsp., 2011). Co ciekawe zwiększone
poziomy tych białek były częściowo spowodowane ich
akumulacją w cytoplazmie w wyniku ich endocytozy
(Lie i wsp., 2011). Obecnie uważa się, że IL-1α inicjuje
demontaż BTB poprzez wpływ na przebudowę cytoszkieletu
aktynowego komórek Sertoliego oraz poprzez
spowolnienie degradacji endocytozowanych białek
strukturalnych BTB, które mogą być potrzebne do złożenia
„nowej” BTB poniżej migrujących spermatocytów
(rycina 4). Wykazano, iż regulowana przez IL-1α przebudowa
cytoszkieletu aktynowego wymaga współdziałania
dwóch białek regulatorowych aktyny, które wpływają
na integralność BTB oraz na adhezję komórek germinalnych
do komórek Sertoliego, a mianowicie substratu
8 dla naskórkowego czynnika wzrostu (Eps8, ang. epidermal
growth factor receptor kinase substrate 8) (Lie i wsp.,
2009b) i białka związanego z aktyną (Arp2/3, ang. actin
related protein 2/3) (Lie i wsp., 2010b). Zależna od IL-1α
regulacja aktywności Eps8 i Arp2/3 prawdopodobnie
stanowi ważny mechanizm demontażu struktur określanych
jako specjalizacje powierzchniowe (ES, ang. ectoplasmic
specialization). Struktury te są specyficznym dla
jądra typem połączeń zakotwiczających, a ich usunięcie
jest konieczne dla przebudowy BTB i uwolnienia plemników
w stadium VIII szczurzego cyklu nabłonka plemnikotwórczego.
Stopniowy proces degeneracji specjalizacji
powierzchniowych wiąże się z przebudową charakterystycznych
wiązek aktyny w mocno rozgałęzioną sieć
(Lie i wsp., 2010a). Ponadto usunięcie kompleksów białek
zapewniających adhezję w miejscu bazalnych specjalizacji
powierzchniowych odbywa się, przynajmniej częściowo,
za pośrednictwem internalizacji szlakiem endocytozy
(Lie i wsp., 2009a; Su i wsp., 2010; Yan i wsp., 2008).
W tym kontekście IL-1α działa w połączeniu z innymi
cytokinami np. z transformującym czynnikiem wzrostu β
(TGF- β, ang. transforming growth factor) 2 i 3 oraz czynnikiem
martwicy nowotworów (TNF-α, ang. tumor necrosis
factor α) (Xia i wsp., 2009; Yan i wsp., 2008). Hipoteza ta
jest również zgodna z obserwacją, iż IL-1α przyspiesza
kinetykę endocytozy okludyny z powierzchni komórki
(Lie i wsp., 2011). Warto zauważyć, że sama IL-1α nie
może zainicjować utworzenia BTB de novo, ponieważ jej
główny komponent – połączenia ścisłe nie są w stanie
utworzyć szczelnej bariery po przedłużonym traktowaniu
IL-1α, zarówno in vivo, jak i in vitro (Lie i wsp., 2011).
Należy podkreślić, że w procesie przebudowy BTB IL-1a
wymaga działania z innymi czynnikami. Na przykład
endocytoza i recykling integralnych białek błonowych,
które mogły gromadzić się w cytoplazmie, z powrotem
na powierzchnię komórki, wymaga działania testosteronu
(Yan i wsp., 2008). Dlatego delikatna równowaga
między IL-1α i innymi czynnikami parakrynnymi oraz
hormonami (np. testosteronem, estrogenem) w stadiach
od VIII do XI cyklu nabłonka plemnikotwórczego ma
kluczowe znaczenie dla wywołania demontażu „starej”
BTB powyżej spermatocytów w trakcie ich przemieszczania
się w nabłonku plemnikotwórczym. Poza omówionym
wpływem na przebudowę BTB oraz spermiację
IL-1α stymuluje proliferację niedojrzałych komórek
Sertoliego oraz spermatogoniów (Petersen i wsp., 2002,
2005). Najniższy poziom ekspresji IL-1α w stadium VII
cyklu nabłonka plemnikotwórczego u dorosłego szczura
koreluje z brakiem proliferacji komórek rozrodczych na
tym etapie (Jonsson i wsp., 1999). Ponadto, IL-1α reguluje
także produkcję innych cytokin (IL-6) (Syed i wsp., 1995)
i czynników parakrynnych (aktywina A – białko z rodziny
TGF-β) (Okuma i wsp., 2005) oraz innych procesów komórkowych
w gonadzie takich jak regulacja steroidogenezy
w komórkach Leydiga (Calkins i wsp., 1988; Colon i wsp.,
2005; Verhoeven i wsp., 1988) regulacja steroidogenezy
w komórkach Leydiga (Calkins i wsp., 1988; Colon i wsp.,
2005; Verhoeven i wsp., 1988). Przedstawione powyżej
wyniki badań wskazują na istotną rolę IL-1α w procesie
przebudowy połączeń międzykomórkowych w nabłonku
plemnikotwórczym, co ma kluczowe znaczenie dla prawidłowego
przebiegu spermatogenezy.
Podziękowanie
Autorzy pracy dziękują doktor Dolores Mruk (Center for
Biomedical Research, Population Council, 1230 York Ave.,
New York, NY 10065, USA) za możliwość przeprowadzenia
badań i opiekę podczas stażu naukowego (K.Ch.)
w Center for Biomedical Research, Population Council, NY.
Finansowanie badań: grant HARMONIA3 (nr projektu
2012/06/M/NZ4/00146) przyznany przez Narodowe
Centrum Nauki.
Piśmiennictwo
Barton G.M., Medzhitov R.: Toll-like receptor signaling pathways. Science.
2003, 300, 1524–1525. doi: 10.1126/science.1085536. PMID: 12791976.
Berda-Haddad Y., Robert S., Salers P., Zekraoui L., Farnarier C., Dinarello C.A.
i wsp.: Sterile inflammation of endothelial cell-derived apoptotic bodies
is mediated by interleukin-1alpha. Proc Natl Acad Sci U S A. 2011, 108,
20684–20689. doi: 10.1073/pnas.1116848108PMID: 22143786.
Calkins J.H., Sigel M.M., Nankin H.R., Lin T.: Interleukin-1 inhibits Leydig
cell steroidogenesis in primary culture. Endocrinology. 1988, 123, 1605–
1610. doi: 10.1210/endo-123-3-1605. PMID: 3261237.
Chen C.J., Kono H., Golenbock D., Reed G., Akira S., Rock K.L.: Identification
of a key pathway required for the sterile inflammatory response triggered
by dying cells. Nat Med. 2007, 13, 851–856. doi: 10.1038/nm1603. PMID:
17572686.
Cheng C.Y., Mruk D.D.: A local autocrine axis in the testes that regulates
spermatogenesis. Nat Rev Endocrinol. 2010, 6, 380–395. doi: 10.1038/
nrendo.2010.71. PMID: 20571538.
Chojnacka K., Bilinska B., Mruk D.D.: Interleukin 1alpha-induced disruption of
the Sertoli cell cytoskeleton affects gap junctional communication. Cell Signal.
2016, 28, 469-480. doi: 10.1016/j.cellsig.2016.02.003. PMID: 26879129.
Clermont Y.: Kinetics of spermatogenesis in mammals: seminiferous epithelium
cycle and spermatogonial renewal. Physiol Rev. 1972, 52, 198–236.
doi: 10.1152/physrev.1972.52.1.198. PMID: 4621362.
Cohen P.E., Pollard J.W.: Normal sexual function in male mice lacking a
functional type I interleukin-1 (IL-1) receptor. Endocrinology. 1998, 139,
815–818. doi: 10.1210/endo.139.2.5914. PMID: 9449661.
Colon E., Svechnikov K.V., Carlsson-Skwirut C., Bang P., Soder O.: Stimulation
of steroidogenesis in immature rat Leydig cells evoked by interleukin-
1alpha is potentiated by growth hormone and insulin-like growth factors.
Endocrinology. 2005, 146, 221–230. doi: 10.1210/en.2004-0485. PMID:
15486223.
Dinarello C.A.: Biologic basis for interleukin-1 in disease. Blood. 1996, 87,
2095-2147. PMID: 8630372.
Dinarello C.A.: Immunological and inflammatory functions of the interleukin-
1 family. Annu Rev Immunol. 2009, 27, 519–550. doi: 10.1146/ annurev.
immunol. 021908.132612. PMID: 19302047.
Dinarello C.A.: Interleukin-1. Cytokine Growth Factor Rev. 1997, 8, 253–265.
PMID: 9620641.
Dower S.K., Kronheim S.R., Hopp T.P., Cantrell M., Deeley M., Gillis S. i wsp.: The
cell surface receptors for interleukin-1 alpha and interleukin-1 beta are identical.
Nature. 1986, 324, 266–268. doi: 10.1038/324266a0. PMID: 2946959.
Fettelschoss A., Kistowska M., Leibundgut-Landmann S., Beer H.D., Johansen
P., Senti G. i wsp.: Inflammasome activation and IL-1beta target IL-1alpha
for secretion as opposed to surface expression. Proc Natl Acad Sci U S A.
2011, 108, 18055–18060. doi: 10.1073/pnas.1109176108. PMID: 22006336.
Franchi L., Eigenbrod T., Munoz-Planillo R., Nunez G.: The inflammasome:
a caspase-1-activation platform that regulates immune responses and disease
pathogenesis. Nat Immunol. 2009, 10, 241–247. doi: 10.1038/ni.1703.
PMID: 19221555.
Ganter M.T., Roux J., Miyazawa B., Howard M., Frank J.A., Su G. i wsp.:
Interleukin-1beta causes acute lung injury via alphavbeta5 and alphavbeta6
integrin-dependent mechanisms. Circ Res. 2008, 102, 804–812. doi:
10.1161/CIRCRESAHA.107.161067. PMID: 18276918.
Garlanda C., Dinarello C.A., Mantovani A.: The interleukin-1 family: back
to the future. Immunity. 2013, 39, 1003–1018. doi: 10.1016/j.immuni.
2013.11.010. PMID: 24332029.
Gerard N., Syed V., Bardin W., Genetet N., Jegou B.: Sertoli cells are the site of
interleukin-1 alpha synthesis in rat testis. Mol Cell Endocrinol. 1991, 82,
13–16. PMID: 1761160.
Gomez E., Morel G., Cavalier A., Lienard M.O., Haour F., Courtens J.L. i wsp.:
Type I and type II interleukin-1 receptor expression in rat, mouse, and
human testes. Biol Reprod. 1997, 56, 1513–1526. PMID: 9166705.
Gross O., Yazdi A.S., Thomas C.J., Masin M., Heinz L.X., Guarda G. i wsp.:
Inflammasome activators induce interleukin-1alpha secretion via distinct
pathways with differential requirement for the protease function of caspase-
1. Immunity. 2012, 36, 388–400. doi: 10.1016/j.immuni.2012.01.018.
PMID: 22444631.
Gustafsson K., Sultana T., Zetterstrom C.K., Setchell B.P., Siddiqui A., Weber G.
i wsp.: Production and secretion of interleukin-1alpha proteins by rat
testis. Biochem Biophys Res Commun. 2002, 297, 492–497. PMID:
12270120.
Hales D.B.: Interleukin-1 inhibits Leydig cell steroidogenesis primarily by
decreasing 17 alpha-hydroxylase/C17-20 lyase cytochrome P450 expression.
Endocrinology. 1992, 131, 2165–2172. doi: 10.1210/endo.131.5.1425417.
PMID: 1425417.
Haugen T.B., Landmark B.F., Josefsen G.M., Hansson V., Hogset A.: The mature
form of interleukin-1 alpha is constitutively expressed in immature male
germ cells from rat. Mol Cell Endocrinol. 1994, 105, 19–23. PMID: 7859917.
Jonsson C.K., Zetterstrom R.H., Holst M., Parvinen M., Soder O.: Constitutive
expression of interleukin-1alpha messenger ribonucleic acid in rat Sertoli
cells is dependent upon interaction with germ cells. Endocrinology. 1999,
140, 3755–3761. doi: 10.1210/endo.140.8.6900. PMID: 10433236.
Khan S.A., Khan S.J., Dorrington J.H.: Interleukin-1 stimulates deoxyribonucleic
acid synthesis in immature rat Leydig cells in vitro. Endocrinology.
1992, 131, 1853–1857. doi: 10.1210/endo.131.4.1396331. PMID: 1396331.
Kobayashi Y., Yamamoto K., Saido T., Kawasaki H., Oppenheim J.J., Matsushima
K.: Identification of calcium-activated neutral protease as a processing
enzyme of human interleukin 1 alpha. Proc Natl Acad Sci U S A. 1990, 87,
5548–5552. PMID: 2115174.
Kone-Paut I., Galeotti C.: Anakinra for cryopyrin-associated periodic
syndrome. Expert Rev Clin Immunol. 2014, 10, 7–18. doi:
10.1586/1744666X.2014.861325. PMID: 24308832.
Kopera I.A., Bilinska B., Cheng C.Y., Mruk D.D.: Sertoli-germ cell junctions
in the testis: a review of recent data. Philos Trans R Soc Lond B Biol Sci.
2010, 365, 1593–1605. doi: 10.1098/rstb.2009.0251. PMID: 20403872.
Kuida K., Lippke J.A., Ku G., Harding M.W., Livingston D.J., Su M.S. i wsp.:
Altered cytokine export and apoptosis in mice deficient in interleukin-1
beta converting enzyme. Science. 1995, 267, 2000–2003. PMID: 7535475.
Li P., Allen H., Banerjee S., Franklin S., Herzog L., Johnston C. i wsp.: Mice
deficient in IL-1 beta-converting enzyme are defective in production of
mature IL-1 beta and resistant to endotoxic shock. Cell. 1995, 80, 401–
411. PMID: 7859282.
Lie P.P., Cheng C.Y., Mruk D.D.: Coordinating cellular events during spermatogenesis:
a biochemical model. Trends Biochem Sci. 2009a, 34, 366–373.
doi: 10.1016/j.tibs.2009.03.005. PMID: 19535250.
Lie P.P., Cheng C.Y., Mruk D.D.: Interleukin-1alpha is a regulator of the bloodtestis
barrier. FASEB J. 2011, 25, 1244–1253. doi: 10.1096/fj.10-169995.
PMID: 21191089.
Lie P.P., Mruk D.D., Lee W.M., Cheng C.Y.: Cytoskeletal dynamics and spermatogenesis.
Philos Trans R Soc Lond B Biol Sci. 2010a, 365, 1581–1592.
doi: 10.1098/rstb.2009.0261. PMID: 20403871.
Lie P.P., Mruk D.D., Lee W.M., Cheng C.Y.: Epidermal growth factor receptor
pathway substrate 8 (Eps8) is a novel regulator of cell adhesion and
the blood-testis barrier integrity in the seminiferous epithelium. FASEB
J. 2009b, 23, 2555–2567. doi: 10.1096/fj.06-070573. PMID: 19293393.
Lie P.P., Chan A.Y., Mruk D.D., Lee W.M., Cheng C.Y.: Restricted Arp3 expression
in the testis prevents blood-testis barrier disruption during junction
restructuring at spermatogenesis. Proc Natl Acad Sci U S A. 2010b, 107,
11411–11416. doi: 10.1073/pnas.1001823107. PMID: 20534520.
Lin T., Wang T.L., Nagpal M.L., Calkins J.H., Chang W.W., Chi R.: Interleukin-1
inhibits cholesterol side-chain cleavage cytochrome P450 expression in primary
cultures of Leydig cells. Endocrinology. 1991, 129, 1305–1311. doi:
10.1210/endo-129-3-1305. PMID: 1874173.
March C.J., Mosley B., Larsen A., Cerretti D.P., Braedt G., Price V. i wsp.: Cloning,
sequence and expression of two distinct human interleukin-1 complementary
DNAs. Nature. 1985, 315, 641–647. PMID: 2989698.
Mauduit C., Chauvin M.A., Hartmann D.J., Revol A., Morera A.M., Benahmed
M.: Interleukin-1 alpha as a potent inhibitor of gonadotropin action in
porcine Leydig cells: site(s) of action. Biol Reprod. 1992, 46, 1119–1126.
PMID: 1327201.
Mcmahan C.J., Slack J.L., Mosley B., Cosman D., Lupton S.D., Brunton L.L. i wsp.:
A novel IL-1 receptor, cloned from B cells by mammalian expression, is
expressed in many cell types. EMBO J. 1991, 10, 2821–2832. PMID: 1833184.
Mertens M., Singh J.A.: Anakinra for rheumatoid arthritis. Cochrane Database
Syst Rev. 2009, CD005121. doi:10.1002/14651858.CD005121.pub3 PMID:
19160248.
Mosley B., Urdal D.L., Prickett K.S., Larsen A., Cosman D., Conlon P.J. i wsp.:
The interleukin-1 receptor binds the human interleukin-1 alpha precursor
but not the interleukin-1 beta precursor. J Biol Chem. 1987, 262, 2941–
2944. PMID: 2950091.
Nilsson M., Husmark J., Bjorkman U., Ericson L.E.: Cytokines and thyroid
epithelial integrity: interleukin-1alpha induces dissociation of the junctional
complex and paracellular leakage in filter-cultured human thyrocytes.
J Clin Endocrinol Metab. 1998, 83, 945–952. doi: 10.1210/jcem.83.3.4626.
PMID: 9506754.
Novakofski K., Boehm A., Fortier L.: The small GTPase Rho mediates articular
chondrocyte phenotype and morphology in response to interleukin-
1alpha and insulin-like growth factor-I. J Orthop Res. 2009, 27, 58–64.
doi: 10.1002/jor.20717. PMID: 18634065.
Okuma Y., Saito K., O’connor A.E., Phillips D.J., De Kretser D.M., Hedger M.P.:
Reciprocal regulation of activin A and inhibin B by interleukin-1 (IL-1) and
follicle-stimulating hormone (FSH) in rat Sertoli cells in vitro. J Endocrinol.
2005, 185, 99–110. doi: 10.1677/joe.1.06053. PMID: 15817831.
Petersen C., Boitani C., Froysa B., Soder O.: Interleukin-1 is a potent growth
factor for immature rat sertoli cells. Mol Cell Endocrinol. 2002, 186, 37–47.
PMID: 11850120.
Petersen C., Svechnikov K., Froysa B., Soder O.: The p38 MAPK pathway mediates
interleukin-1-induced Sertoli cell proliferation. Cytokine. 2005, 32,
51–59. doi: 10.1016/j.cyto.2005.07.014. PMID: 16181786.
Rozwadowska N., Fiszer D., Jedrzejczak P., Kosicki W., Kurpisz M.: Interleukin-1 superfamily
genes expression in normal or impaired human spermatogenesis. Genes
Immun. 2007, 8, 100–107. doi: 10.1038/sj.gene.6364356. PMID: 17215863.
Russell L.: Movement of spermatocytes from the basal to the adluminal compartment
of the rat testis. Am J Anat. 1977, 148, 313–328. doi: 10.1002/
aja.1001480303. PMID: 857632.
Sarkar O., Mathur P.P., Cheng C.Y., Mruk D.D.: Interleukin 1 alpha (IL1A) is a
novel regulator of the blood-testis barrier in the rat. Biol Reprod. 2008, 78,
445–454. doi: 10.1095/biolreprod.107.064501. PMID: 18057314.
Sims J.E.: IL-1 and IL-18 receptors, and their extended family. Curr Opin
Immunol. 2002, 14(1), 117–122. PMID: 11790541.
Sims J.E., Smith D.E.: The IL-1 family: regulators of immunity. Nat Rev
Immunol. 2010, 10, 89–102. doi: 10.1038/nri2691. PMID: 20081871.
Smith D.E., Hanna R., Della F., Moore H., Chen H., Farese A.M. i wsp.: The soluble
form of IL-1 receptor accessory protein enhances the ability of soluble
type II IL-1 receptor to inhibit IL-1 action. Immunity. 2003, 18, 87–96.
PMID: 12530978.
Su L., Mruk D.D., Lee W.M., Cheng C.Y.: Differential effects of testosterone
and TGF-beta3 on endocytic vesicle-mediated protein trafficking events at
the blood-testis barrier. Exp Cell Res. 2010, 316, 2945–2960. doi: 10.1016/j.
yexcr.2010.07.018. PMID: 20682309.
Sultana T., Svechnikov K., Weber G., Soder O.: Molecular cloning and expression
of a functionally different alternative splice variant of prointerleukin-
1alpha from the rat testis. Endocrinology. 2000, 141, 4413–4418. doi:
10.1210/endo.141.12.7824. PMID: 11108249.
Svechnikov K., Stocco D.M., Soder O.: Interleukin-1alpha stimulates steroidogenic
acute regulatory protein expression via p38 MAP kinase in immature
rat Leydig cells. J Mol Endocrinol. 2003, 30, 59–67. PMID: 12580761.
Syed V., Stephan J.P., Gerard N., Legrand A., Parvinen M., Bardin C.W. i wsp.:
Residual bodies activate Sertoli cell interleukin-1 alpha (IL-1 alpha) release,
which triggers IL-6 production by an autocrine mechanism, through the
lipoxygenase pathway. Endocrinology. 1995, 136, 3070–3078. doi: 10.1210/
endo.136.7.7789334. PMID: 7789334.
Symons J.A., Young P.R., Duff G.W.: Soluble type II interleukin 1 (IL-1) receptor
binds and blocks processing of IL-1 beta precursor and loses affinity for
IL-1 receptor antagonist. Proc Natl Acad Sci U S A. 1995, 92, 1714–1718.
PMID: 7878046.
Thornberry N.A., Bull H.G., Calaycay J.R., Chapman K.T., Howard A.D., Kostura
M.J. i wsp.: A novel heterodimeric cysteine protease is required for interleukin-
1 beta processing in monocytes. Nature. 1992, 356, 768–774. doi:
10.1038/356768a0. PMID: 1574116.
Verhoeven G., Cailleau J., Van Damme J., Billiau A.: Interleukin-1 stimulates
steroidogenesis in cultured rat Leydig cells. Mol Cell Endocrinol. 1988, 57,
51–60. PMID: 3260876.
Vigers G.P., Anderson L.J., Caffes P., Brandhuber B.J.: Crystal structure of the
type-I interleukin-1 receptor complexed with interleukin-1beta. Nature.
1997, 386, 190–194. doi: 10.1038/386190a0. PMID: 9062193.
Wahab-Wahlgren A., Holst M., Ayele D., Sultana T., Parvinen M., Gustafsson K.
i wsp.: Constitutive production of interleukin-1alpha mRNA and protein in
the developing rat testis. Int J Androl. 2000, 23, 360–365. PMID: 11114982.
Wesche H., Henzel W.J., Shillinglaw W., Li S., Cao Z.: MyD88: an adapter that
recruits IRAK to the IL-1 receptor complex. Immunity. 1997, 7, 837–847.
PMID: 9430229.
Wessendorf J.H., Garfinkel S., Zhan X., Brown S., Maciag T.: Identification of
a nuclear localization sequence within the structure of the human interleukin-
1 alpha precursor. J Biol Chem. 1993, 268, 22100–22104. PMID:
8408068.
Xia W., Wong E.W., Mruk D.D., Cheng C.Y.: TGF-beta3 and TNFalpha perturb
blood-testis barrier (BTB) dynamics by accelerating the clathrin-mediated
endocytosis of integral membrane proteins: a new concept of BTB regulation
during spermatogenesis. Dev Biol. 2009, 327, 48–61. doi: 10.1016/j.
ydbio.2008.11.028. PMID: 19103189.
Yan H.H., Mruk D.D., Lee W.M., Cheng C.Y.: Blood-testis barrier dynamics are
regulated by testosterone and cytokines via their differential effects on the
kinetics of protein endocytosis and recycling in Sertoli cells. FASEB J. 2008,
22, 1945–1959. doi: 10.1096/fj.06-070342. PMID: 18192323.
Yazdi A.S., Drexler S.K.: Regulation of interleukin 1alpha secretion by inflammasomes.
Ann Rheum Dis. 2013, 72(2), 96–99. doi: 10.1136/annrheumdis-
2012-202252. PMID: 23253918
WPŁYW WYBRANYCH LEKÓW PRZECIWPADACZKOWYCH NA MĘSKI UKŁAD PŁCIOWY
THE EFFECT OF SELECTED ANTI-EPILEPTIC DRUGS ON THE MALE REPRODUCTIVE SYSTEM
Iwona Rotter
Zakład Rehabilitacji Medycznej i Fizjoterapii Klinicznej, Pomorski Uniwersytet Medyczny w Szczecinie, ul. Żołnierska 54, 71-210 Szczecin
Autor do korespondencji/corresponding author: Iwona Rotter, Zakład Rehabilitacji Medycznej i Fizjoterapii Klinicznej,
Pomorski Uniwersytet Medyczny w Szczecinie, ul. Żołnierska 54, 71– 210 Szczecin;
iwonarotter@pum.edu.pl
Otrzymano/received: 12.12.2017 r. Zaakceptowano/accepted: 30.12.2017 r.
Iwona Rotter – dr hab. n. med., absolwentka Pomorskiej Akademii Medycznej w Szczecinie (1994 r.),
lekarz ze specjalizacją I° w zakresie rehabilitacji medycznej, specjalista neurolog. Od 1998 r. zatrudniona
w Pomorskim Uniwersytecie Medycznym w Szczecinie (PUM). Pracuje jako konsultant
neurolog w Samodzielnym Publicznym Szpitalu Klinicznym nr 2 PUM. Pełni funkcję kierownika
Zakładu Rehabilitacji Medycznej i Fizjoterapii Klinicznej PUM. Autorka i współautorka licznych
publikacji naukowych. Członek Polskiego Towarzystwa Neurologicznego, Polskiego Towarzystwa
Andrologicznego, Polskiego Towarzystwa Rehabilitacji, Polskiego Towarzystwa Medycyny Rodzinnej.
Zainteresowania badawcze: rehabilitacja w chorobach neurologicznych, kardiologicznych i geriatrii, problematyka
starzenia się ze szczególnym uwzględnieniem procesu starzenia się mężczyzn.
Iwona Rotter
– MD, PhD, graduate of the Pomeranian Medical University in Szczecin (1994), doctor with I˚ specialization
in the fi eld of medical rehabilitation, specialist neurologist. From 1998 employed at the Pomeranian
Medical University in Szczecin. She works as a consultant in neurology at University Hospital No. 2 in Szczecin and
as a head of the Department of Medical Rehabilitation and Clinical Physiotherapy in Szczecin. First author and coauthor
of many scientifi c publications. She is a member of Polish Neurological Society, Polish Society of Andrology,
Polish Society of Rehabilitation, and Polish Society of Family Medicine. Research interests: rehabilitation in neurological
diseases, cardiology and geriatrics, the issue of aging with particular emphasis on the aging process of men.
Streszczenie
Padaczka jest jedną z częstszych chorób ośrodkowego układu nerwowego wymagającą często wieloletniego leczenia. Celem pracy jest
przedstawienie na podstawie przeglądu literatury wpływu wybranych leków przeciwpadaczkowych (LPP) na męski układ płciowy.
Opublikowane badania dowodzą, że tzw. stare LPP mogą wpływać negatywnie zarówno na funkcje seksualne, stężenie hormonów
płciowych, jak i parametry seminologiczne. Leki nowych generacji wydają się mieć mniej działań negatywnych w tym zakresie, aczkolwiek
istnieje mało badań oceniających ten problem, a te, które są dostępne, prowadzone były wśród małej liczby pacjentów. Stąd też
konieczne są dalsze badania oceniające wpływ LPP na męski układ płciowy.
Słowa kluczowe: padaczka, mężczyźni, leki przeciwpadaczkowe, hormony płciowe
Abstract
Epilepsy is one of the more frequent diseases of the central nervous system that often requires long-term treatment. Th e aim of the work is to
present, on the basis of literature review, the infl uence of selected anti-epileptic drugs (LPP) on the male reproductive system. Published research
proves that so-called „old” LPP may aff ect the sexual function, sex hormone levels and semen quality. New generation drugs appear to have not
much negative eff ects in this area, although there are only few studies assessing this problem, and those that are available have been conducted
among a small number of patients. Th erefore, further studies are needed to assess the relationships between LPP and male reproductive system.
Key words: epilepsy, men, anti-epileptic drugs, sex hormones
Skróty / Abbreviations
CBZ – karbamazepina (ang. carbamazepine), DHEA – siarczan dehydroepiandrosteronu (ang. dehydroepiandrosterone), FBM – felbamat
(ang. felbamate), FSH – hormon folikulotropowy, folikulotorpina (ang. follicle-stimulating hormone), GABA – kwas γ-aminomasłowy
(ang. γ-aminobutyric acid), GBP – gababentyna (ang. gabapentin), OCBZ – okskarbamazepina (ang. oxcarbazepine), LCM – lakozamid (ang.
lacosamide), LEV – lewetiracetam (ang. levetiracetam), LH – hormone lutenizujący, lutropina (ang. luteinizing hormone), LTG – lamotrygina
(ang. lamotrigine), LPP – leki przeciwpadaczkowe (ang. anti-epileptic drugs), PGB – pregabalina (ang. pregabalin), OR, iloraz ryzyka /
szans (ang. odds ratio), OUN – ośrodkowy układ nerwowy (łac. systema nervosum centrale), SHBG – białko wiążące hormony płciowe
(ang. sex hormone binding globulin), SUDEP – nagły niespodziewany zgon u osoby chorującej na padaczkę (ang. sudden unexpected death in
epilepsy), TGB – tiagabina (ang. tiagabine), TPM – topiramat (ang. topiramate), VGB – wigabatryna (ang. vigabatrin), VPA – walproiniany
(ang. valproate), ZNS – zonisamid (ang. zonisamide)
Padaczka jest jedną z częstszych przewlekłych chorób
ośrodkowego układu nerwowego (OUN, łac. systema
nervosum centrale). To wieloetiologiczny zespół chorobowy
charakteryzujący się występowaniem nawracających
spontanicznych napadów padaczkowych. Wskaźniki
umieralności u osób z padaczką są 2–4-krotnie wyższe
niż w populacji ogólnej, z tego 15% jest bezpośrednio
związanych z napadami padaczkowymi lub wypadkami
podczas tych napadów (Halczuk i wsp., 2015).
Dane epidemiologiczne wskazują, że wskaźnik rozpowszechnienia
tej choroby w populacji wynosi około 1%.
Szacuje się, że w Polsce na padaczkę choruje 300–400 tys.
osób. Średni wskaźnik zachorowalności ocenia się na
50–70/100 tys./rok. Zachorowalność jest związana
z wiekiem – najczęściej choroba zaczyna się przed 10. r.ż.,
drugi szczyt zachorowań przypada po 65. r.ż. W odniesieniu
do płci choroba ta występuje częściej u mężczyzn,
u których też statystycznie częściej występuje ryzyko
nagłego niespodziewanego zgonu (SUDEP ang. sudden
unexpected death in epilepsy) (Jędrzejczak, 2012).
Badania wskazują, że chorzy z padaczką charakteryzują
się wyraźnie niższą jakością życia, częstszym
występowaniem depresji, a także prób samobójczych
(Bosak i wsp., 2012; Jędrzejczak, 2012). Nierzadko mają
problemy z podjęciem aktywności zawodowej, nie mogą
realizować części swoich zainteresowań, uprawiać wielu
sportów, mają problemy z uzyskaniem amatorskiego
prawa jazdy, aczkolwiek znowelizowane w 2011 r.
Rozporządzenie Ministra Zdrowia (Dz U nr 88/2011)
pozwala na posiadanie takiego prawa jazdy u osób
z dobrze kontrolowaną padaczką. Choroba ta wiąże
się ze stygmatyzacją mimo wielu działań mających
na celu edukację społeczeństw. Badania wykazują, że
osoby z padaczką deklarują wyraźne niższą satysfakcję
z życia seksualnego, jak też i zmniejszoną płodność, na
co znaczący wpływ mają zarówno czynniki psychologiczne,
zmiany w OUN, jak też przyjmowanie leków
przeciwpadaczkowych (LPP, ang. anti-epileptic drugs)
(Isojärvi, 2008; Jędrzejczak, 2008).
Systematyczny postęp w medycynie i farmakoterapii
sprawił, że obecnie stosowane leczenie padaczki pozwala
większości chorych na uwolnienie się od napadów lub
przynajmniej na znaczną redukcję częstości napadów.
Bardzo istotny wpływ na efekt leczenia ma także styl
życia chorego, w tym przede wszystkim systematyczne
przyjmowanie leków, odpowiednia liczba godzin snu,
regularny tryb życia, unikanie sytuacji stresowych,
znaczne ograniczenie spożywania alkoholu. Jednym
z podstawowych problemów w epileptologii, któremu
wciąż poświęca się bardzo wiele uwagi, jest dobór właściwego
leczenia: skutecznego i zarazem bezpiecznego
dla kobiet w okresie rozrodczym. Natomiast stosunkowo
rzadko porusza się problem bezpieczeństwa leczenia
przeciwpadaczkowego w aspekcie męskich funkcji rozrodczych.
Dostępne publikacje dotyczące związków
LPP z zaburzeniami funkcjonowania męskiego układu
płciowego wskazują na niekorzystny efekt ich działania
w odniesieniu do stężenia testosteronu, libido, erekcji,
czy też parametrów nasienia, a w efekcie płodności
(Asadi-Pooya i wsp., 2015; Isojärvi, 2008; Jędrzejczak,
2008; Woroń i Kostka-Trąbka, 2005). Badania wskazują,
że znaczenie ma dawka leku, zestawienia LPP oraz czas
przyjmowania (Asadi-Pooya i wsp., 2015; Calabrò i wsp.,
2012; Isojärvi, 2008). Biorąc pod uwagę przewlekłość
choroby, należy zauważyć, że czas trwania leczenia
zazwyczaj jest długotrwały – chorzy przyjmują leki kilka,
kilkanaście, a nawet kilkadziesiąt lat. Wielu chorych
wymaga stosowania politerapii, która z jednej strony
przyczynia się do redukcji napadów, ale z drugiej wiąże
się z większym ryzykiem skutków ubocznych, w tym
tych, które dotyczą układu płciowego.
Obecnie w Polsce do leków pierwszego wyboru dobieranych
w zależności od rodzaju napadów należą walproiniany
(VPA, ang. valproate), karbamazepina (CBZ, ang.
carbamazepine), okskarbamazepina (OCBZ, ang. oxcarbazepine),
lamotrygina (LTG, ang. lamotrigine), lewetiracetam
(LEV, ang. levetiracetam). Do leków drugiego wyboru
stosowanych w kolejnej monoterapii lub w politerapii
należą: lakozamid (LCM, ang. lacosamide), topiramat
(TPM, ang. topiramate), pregabalina (PGB, ang. pregabalin),
zonisamid (ZNS, ang. zonisamide), gabapentyna
(GBP, ang. gabapentin), tiagabina (TGB, ang. tiagabine),
wigabatryna (VGB, ang. vigabatrin), felbamat (FBM, ang.
felbamate). Należy podkreślić, że niektóre z LPP znajdują
zastosowanie w leczeniu bólu neuropatycznego (np. karbamazepina,
gabapentyna, pregabalina), czy też w terapii
schorzeń psychiatrycznych (np. walproiniany, karbamazepina,
lamotrygina). Nieliczne publikacje przedstawiają
badania dotyczące ich wpływu na seksualność i płodność
u mężczyzn.
Walproiniany: kwas walproinowy i walproinian sodu
Mechanizm działania VPA polega na zwiększaniu stężenia
kwasu γ-aminomasłowego (GABA, ang. γ-aminobutyric
acid) w synapsach, co opóźnia reaktywację
kanałów sodowych, blokuje wyładowania i zmniejsza
pobudliwość błony neuronu. Walproiniany są inhibitorami
enzymów wątrobowych. Jako leki przeciwdrgawkowe
są bardzo dobrze oceniane, jednak ich stosowanie
wiążę się z ryzykiem skutków ubocznych. Nie zaleca się
podawania ich kobietom w wieku rozrodczym z uwagi na
możliwy niekorzystny wpływ na płód, poza sytuacjami,
gdy korzyści przewyższają ryzyko. U mężczyzn leczonych
VPA znacznie rzadziej niż w przypadku leczenia
karbamazepiną stwierdza się zaburzenia hormonalne.
Najczęściej obserwuje się zmniejszenie stężenia hormonu
folikulotropowego (FSH, ang. follicle-stimulating hormone)
i zwiększenie stężenia androstendionu (Jędrzejczak, 2012).
Badania seminologiczne wskazują, że VPA mogą zmniejszać
ruchliwość plemników, a ponadto w badaniu na
modelu zwierzęcym stwierdzono zmniejszenie masy
jąder i najądrzy (Nishimura i wsp., 2000). Isojärvi (2008)
wykazał w grupie 16 mężczyzn leczonych VPA w badaniu
ultrasonografi cznym istotnie mniejszą objętość jąder
w porównaniu z grupą kontrolną.
Karbamazepina
Lek jest induktorem enzymów wątrobowych. Działanie
CBZ polega na stabilizacji zależnych od potencjału
kanałów sodowych. U mężczyzn leczonych CBZ obserwuje
się zmniejszone stężenie siarczanu dehydroepiandrosteronu
(DHEA, ang. dehydroepiandrosterone),
podwyższone stężenie globuliny wiążącej hormony
płciowe (SHBG, ang. sex hormone binding globulin), zmniejszone
stężenie biodostępnego testosteronu, wyższe
stężenie hormonu luteinizującego (LH, ang luteinizing
hormone) i FSH (Asadi-Pooya i wsp., 2014; Isojarvi, 2008;
Najafi i wsp., 2012; Svalheim i wsp., 2015). Uważa się, że
zmiany w stężeniach hormonów i wzrost stężenia białka
wiążącego hormony płciowe (SHBG, ang. sex hormone
binding globulin) są związane z indukcją enzymów wątrobowych.
Karbamazepina wpływa na metabolizm witaminy
D, przyczyniając się do obniżania gęstości tkanki
kostnej i wzrostu ryzyka złamań (iloraz ryzyka – OR:1.18)
(Savlheim i wsp., 2015). Badania wykazują, że u mężczyzn
leczonych CBZ występuje obniżone libido i mniejsza
satysfakcja z życia seksualnego, co wiąże się z obniżonym
stężeniem biodostępnego testosteronu. Ponadto lek może
powodować zaburzenia erekcji (Woroń i Kostka-Trąbka,
2005). W krótkim okresie od rozpoczęcia leczenia już
u 13% mężczyzn pojawiają się problemy z funkcjami
seksualnymi (Svalheim i wsp., 2015). U leczonych CBZ
obserwuje się zmienione parametry nasienia: nieprawidłowości
w koncentracji plemników, ich morfologii
i ruchliwości (Asadi-Pooya i wsp., 2015).
Okskarbamazepina
Okskarbamazepina jest ketonowym analogiem karbamazepiny
charakteryzującym się większym profi
lem bezpieczeństwa. Mikkonen i wsp. (2004) badając
12 chłopców i młodych mężczyzn leczonych OCBZ, nie
stwierdzili wpływu leku na stężenie hormonów płciowych.
Badania prowadzone na modelu zwierzęcym wykazały
minimalnie negatywny wpływ na dojrzewanie jąder
(Cansu i wsp., 2011). Te nieliczne obserwacje sugerują
brak istotnego wpływu na męskie funkcje rozrodcze,
wobec tego lek wydaje się być zdecydowanie korzystniejszy
w leczeniu mężczyzn z epilepsją w porównaniu
z jego prekursorem CBZ.
Lamotrygina
Mechanizm przeciwpadaczkowego działania LTG
polega na stabilizacji zależnych od potencjału kanałów
sodowych. Lek jest bezpieczny dla kobiet ciężarnych.
W odniesieniu do mężczyzn nie stwierdzono jego negatywnego
wpływu na funkcje reprodukcyjne i stężenie
hormonów płciowych (Herzog i wsp., 2004; Svalheim i wsp.,
2009). W piśmiennictwie podkreśla się, że LTG wpływa
korzystnie na funkcje seksualne mężczyzn w postaci
wzrostu libido (u osób z padaczką jest często obniżone)
i większej satysfakcji z życia z seksualnego. Wobec tego
Bauer i Klingmüller (2008) stwierdzili, że terapia LTG jest
dobrym wyborem u mężczyzn z padaczką. Natomiast
badanie przeprowadzone na modelu zwierzęcym wykazało
pogorszenie parametrów nasienia oraz stężenia
hormonów płciowych u szczurów poddanych działaniu
LTG (Daoud i wsp., 2004).
Lewetiracetam
Lewetiracetam jest obecnie w Polsce jednym z częściej
stosowanych leków przeciwpadaczkowych, zarówno
w monoterapii, jak i politerapii. Lek wykazuje korzystny
poziom bezpieczeństwa, wchodzi w nieliczne interakcje
z innymi lekami. Uważany jest za lek bezpieczny u kobiet
ciężarnych. W 2016 r. opublikowano wyniki badania
oceniającego wpływ LEV stosowanego w monoterapii
na parametry nasienia i stężenie hormonów płciowych
u mężczyzn między 15. a 45. r.ż. (Ceylan i wsp., 2016).
Wyniki tego badania wskazują, że parametry nasienia
pogarszają się w ciągu pierwszych miesięcy leczenia, natomiast
nie stwierdza się istotnych zmian w stężeniu hormonów
płciowych. Autorzy tłumaczą ten fakt wpływem
leku na układ GABA-ergiczny, którego receptor – GABAA –
receptor A kwasu γ-aminomasłowego (ang. γ-aminobutyric
acid receptor A), znajduje się w jądrach. Calabrò i wsp.
(2012) opisali przypadki dwóch mężczyzn, u których
w trakcie leczenia LEV zaobserwowano zmniejszenie
libido, jednakże może to być raczej związane z wystąpieniem
depresji, która może występować u osób leczonych
tym lekiem jako objaw niepożądany (Calabrò i wsp., 2012).
Inne badania nie wykazały wpływu LEV na funkcje seksualne
i hormonalne u mężczyzn (Bauer i Klingmüller,
2008)

Lakozamid
Lek ten zyskał w Polsce dużą popularność z uwagi na
dobry efekt terapeutyczny w politerapii padaczki. Do tej
pory nie opublikowano żadnych badań dotyczących jego
możliwego wpływu na męski układ płciowy
Topiramat
W piśmiennictwie dostępne są nieliczne badania oceniające
związki TPM z męskimi funkcjami rozrodczymi.
Leczenie TPM nie wpływa na stężenie hormonów płciowych,
natomiast może przyczyniać się do wystąpienia
zaburzeń erekcji o podłożu naczyniowym (Civardi i wsp.,
2012). Badania na modelu zwierzęcym wykazały, że
podawanie TPM powoduje zaburzenia spermatogenezy
i ruchliwości plemników, zmniejszenie stężenia testosteronu
oraz zmniejszenie liczby ciąż (Otoom i wsp., 2004).
Pregabalina
Pregabalina obecnie znajduje przede wszystkim zastosowanie
w leczeniu bólu neuropatycznego. Skuteczna jest
też w terapii zaburzeń lękowych. Opublikowane w 2015 r.
badanie obejmujące 111 ochotników przyjmujących przez
12 tygodni pregabalinę PGB w dawce 600 mg/dobę nie
wykazało różnic w stężeniu testosteronu, FSH, jak
i nie wpływało na spermatogenezę (Sikka i wsp., 2015).
Zacytowane badanie jest jak dotąd jedynym weryfi -
kującym wpływ pregabaliny na męski układ płciowy.
Zonisamid
Z uwagi na wysoką cenę i brak refundacji w Polsce lek
ten jest rzadko stosowany. Mechanizm działania ZNS
polega na stabilizacji neuronalnych błon komórkowych
poprzez wpływ na kanały sodowe i wapniowe. Lek nasila
również transmisję dopaminergiczną i prawdopodobnie
działa neuroprotekcyjnie. Badanie przeprowadzone na
szczurach poddanych działaniu ZNS przez Khalil i wsp.
(2015) wykazało, że u zwierząt wystąpiły nieprawidłowości
morfologiczne gamet męskich i fragmentacja ich
DNA. Badacze ci wykazali, że zaburzenia te można zredukować,
podając melatoninę. Jest to badanie pionierskie
w tym zakresie. Badań prowadzonych wśród mężczyzn
obecnie nie ma w dostępnym piśmiennictwie.
Gabapentin
Gabapentin to strukturalny analog GABA charakteryzujący
się bardzo dobrą tolerancją i rzadko występującymi
objawami ubocznymi, który obecnie częściej znajduje
zastosowanie w leczeniu bólu neuropatycznego niż
padaczki. Badania prowadzone na szczurach Wistar
wykazały, że zwierzęta, którym podawano gabapentin,
prezentowały niższe stężenia testosteronu, zmniejszenie
masy jąder i najądrzy (Osuntokun i wsp., 2017).
Podobne wnioski wypływają z badań Daoud i wsp. (2004).
W odniesieniu do mężczyzn badania na niewielkiej liczbie
osób wskazują, że GBP może przyczyniać się do zaburzeń
erekcji i anorgazmii, ale dotyczy to osób starszych
(Perloff i wsp., 2011).
Tiagabina
Lek jest stosowany w politerapii padaczki. Jak dotąd nie
ma żadnych badań dotyczących jego wpływu na męski
układ płciowy.
Wigabatryna
Lek ten jest stosunkowo rzadko stosowany z uwagi na jego
możliwy negatywny wpływ na narząd wzroku. Stosuje
się go w kolejnych politerapiach padaczek lekoopornych
(gdy inne leki nie spełniają oczekiwań). W dostępnym
piśmiennictwie nie ma danych dotyczących wpływu VGB
na funkcje rozrodcze mężczyzn. Jedyna praca przedstawiająca
badania na modelu zwierzęcym wskazuje na
negatywne skutki podawania leku zarówno w odniesieniu
do jąder i najądrzy (zmniejszenie ich masy), nasienia
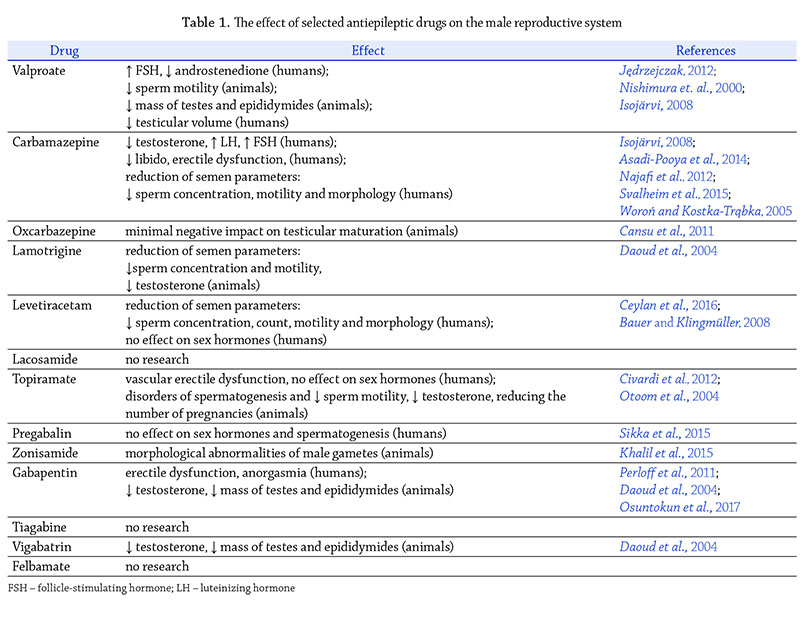
(pogorszenie parametrów morfologicznych), jak i hormonów
płciowych (Daoud i wsp., 2004).
Felbamat
Felbamat stosowany jest bardzo rzadko z uwagi na częste
i poważne skutki uboczne. Znajduje zastosowanie w ciężkich
zespołach padaczkowych np. w zespole Lennoxa-
Gastaut¹, w sytuacjach, gdy inne leki nie były skuteczne.
Nie ma obecnie badań, które oceniałyby jego wpływ na
męski układ płciowy
Podsumowanie
Pacjenci, u których rozpoczyna się wieloletnie leczenie
lekami przeciwpadaczkowymi, zawsze są informowani
przez lekarzy neurologów o możliwych skutkach ubocznych
terapii. Szczególnie dużą wagę przywiązuje się
do wyboru leku u kobiet w wieku rozrodczym, biorąc
pod uwagę możliwy negatywny wpływ terapii na płód.
Kobiety są szczegółowo informowane o ewentualnym
ryzyku. Poza tym prowadzi się edukacje mającą na
celu uświadomienie, że ciąża u kobiety z padaczką
powinna być zaplanowana. W odniesieniu do mężczyzn
stosunkowo rzadko informuje się pacjentów o możliwym
wpływie leku na funkcje seksualne. Może to
być wynikiem tego, że w charakterystyce produktów
leczniczych właściwie nie ma informacji o wpływie leku
na męskie funkcje rozrodcze, a w dostępnej literaturze
medycznej istnieje wyraźny defi cyt publikacji w tym
zakresie. Wciąż liczba badań, zwłaszcza prowadzona
wśród mężczyzn leczonych LPP, jest wysoce niezadowalająca.
Te, które są dostępne, często przeprowadzone
zostały na małej grupie badanej, nieraz bez randomizacji.
Nieco więcej jest badań na modelach zwierzęcych,
ale nie zawsze można je odnieść do człowieka. Ponadto
brak badań przed włączeniem leczenia, których wyniki
byłyby bardzo istotne, gdyż sama padaczka (w zależności
od jej przyczyny i lokalizacji ogniska padaczkorodnego)
może wiązać się z upośledzeniem funkcji seksualnych
i nieprawidłowościami w zakresie hormonów
płciowych.
Obecnie najwięcej informacji odnośnie wpływu LPP
na męski układ płciowy dotyczy tzw. „starych” LPP: CBZ,
VPA. Nowe LPP wymagają dalszych rzetelnych badań
w tym zakresie. Wskazane byłyby badania, które oceniają
stężenia hormonów płciowych oraz parametry nasienia
przed rozpoczęciem leczenia i następnie w trakcie terapii –
pozwoliłoby to zobiektywizować wiedzę o wpływie LPP
na męski układ płciowy i funkcje seksualne.
1 zespół ciężkich, niejednorodnych encefalopatii padaczkowych charakteryzujących
się często opóźnieniem rozwoju umysłowego, lekoopornymi
napadami padaczkowymi i zmianami w zapisie elektroencefalografi cznym
(przyp. red.)
Piśmiennictwo
Asadi-Pooya A.A., Dabbaghmanesh M.H., Ashjazadeh N.: Eff ects of carbamazepine
on male reproductive hormones. Med J Islam Repub Iran. 2014, 29,
139. PMID: 25694997.
Asadi-Pooya A., Farazdaghi M., Ashjazadeh N.: Eff ects of carbamazepine on
semen parameters in men with newly diagnosed epilepsy. Iran J Neurol.
2015, 14, 168–170. PMID: 26622983.
Bauer J., Klingmüller D.: Which antiepileptic drug for men with epilepsy?
A critical epileptological and andrological review. Nervenarzt. 2008, 79,
1407–1412. doi: 10.1007/s00115-008-2578-z. PMID: 19023554.
Bosak M., Dudek D., Siwek M.: Depresja u chorych z padaczką. Psych Pol.
2012, 5, 891–902.
Calabrò R.S., Italiano D., Militi D., Bramanti P.: Levetiracetam-associated loss
of libido and anhedonia. Epilepsy Behav. 2012, 24, 283–284. doi: 10.1016/j.
yebeh.2012.03.013. PMID: 22560189.
Cansu A., Ekinci O., Serdaroglu A., Gürgen S.G., Ekinci O., Erdogan D. i wsp.:
Eff ects of chronic treatment with valproate and oxcarbazepine on testicular
development in rats. Seizure. 2011, 20, 203–207. doi: 10.1016/j.seizure.
2010.11.019. PMID: 21169035.
Ceylan M., Yalcin A., Bayraktutan O.F., Karabulut I., Sonkaya A.R.: Eff ects
of levetiracetam monotherapy on sperm parameters and sex hormones:
Data from newly diagnosed patients with epilepsy. Seizure. 2016, 41, 70–74.
doi: 10.1016/j.seizure.2016.06.001. PMID: 27494618.
Civardi C., Collini A., Gontero P., Monaco F.: Vasogenic erectile dysfunction
Topiramate-induced. Clin Neurol Neurosurg. 2012, 114, 70–71. doi: 10.1016/j.
clineuro.2011.07.018. PMID: 21868149.
Daoud A.S., Bataineh H., Otoom S., Abdul-Zahra E.: Th e eff ect of Vigabatrin,
Lamotrigine and Gabapentin on the fertility, weights, sex hormones and
biochemical profi les of male rats. Neuro Endocrinol Lett. 2004, 25, 178–
183. PMID: 15349082.
Halczuk I., Bielniak E., Tynecka-Turowska M., Rejdak K.: Aktywność fi zyczna
i padaczka. Zdr Dobrostan. 2015, 1, 135–142.
Herzog A.G., Drislane F.W., Schomer D.L., Pennell P.B., Bromfi eld E.B., Kelly K.M.
i wsp.: Diff erential eff ects of antiepileptic drugs on sexual function and
reproductive hormones in men with epilepsy: interim analysis of a comparison
between lamotrigine and enzyme-inducing antiepileptic drugs.
Epilepsia. 2004, 45. 764–768. doi: 10.1111/j.0013-9580.2004.60703.x.
PMID: 15230699.
Isojärvi J.: Disorders of reproduction in patients with epilepsy: Antiepileptic
drug related mechanisms. Seizure. 2008, 17, 111–119. doi: 10.1016/j.seizure.
2007.11.007. PMID: 18164216.
Jędrzejczak J.: Leczenie padaczki u kobiet i mężczyzn w wieku rozrodczym.
Przew Lek. 2008, 5, 34–38.
Jędrzejczak J.: Padaczka-stare i nowe wyzwania. Post Nauk Med. 2012, 1,
45–50.
Khalil WK, Abdu F.: Protective eff ect of melatonin against zonisamide-induced
reproductive disorders in male rats. Arch Med Sci. 2015, 11, 660–669. doi:
10.5114/aoms.2013.39384. PMID: 26170862.
Mikkonen K., Tapanainen P., Pakarinen A.J., Päivänsalo M., Isojärvi J.I.,
Vainionpää L.K.: Serum androgen levels and testicular structure during
pubertal maturation in male subjects with epilepsy. Epilepsia. 2004, 45,
769–776. doi: 10.1111/j.0013-9580.2004.04604.x. PMID: 15230700.
Najafi M.R., Ansari B., Zare M., Fatehi F., Sonbolestan A.: Eff ects of antiepileptic
drugs on sexual function and reproductive hormones of male epileptic
patients. Iran J Neurol. 2012, 11, 37–41. PMID: 24250859.
Nishimura T., Sakai M., Yonezawa H.: Eff ects of valproic acid on fertility and
reproductive organs in male rats. J Tocicol Sci. 2000, 25, 85-93. doi: https://
doi.org/10.2131/jts.25.85. PMID: 10845186.
Osuntokun O.S., Olayiwola G., Oladele A., Ola I., AyokaAbiodun O.: Chronic
administration of gabapentin and a gabapentin-carbamazepine combination
reversibly suppress testicular function in male Wistar rats (Rattus
norvegicus). Pathophysiology. 2017, 24, 63–69. doi: 10.1016/j.pathophys.
2017.01.004. PMID: 28242287.
Otoom S., Batieneh H., Hassan Z., Daoud A.: Eff ects of long-term use Topiramate
on fertility and growth parameter in adult male rats. Neuro Endocrinol Lett.
2004, 25, 351–355. PMID: 15580169.
Perloff M.D, Th aler D.E, Otis J.A.: Anorgasmia with gabapentin may be common
in older patients. Am J Geriatr Pharmacother. 2011, 9, 199–203. doi:
10.1016/j.amjopharm.2011.04.007. PMID: 21602106.
Sikka S.C., Chen C., Almas M., Dula E., Knapp L.E., Hellstrom W.J.: Pregabalin
does not aff ect sperm production in healthy volunteers: a randomized, double-
blind, placebo-controlled, noninferiority study. Pain Pract. 2015, 15,
150–158. doi: 10.1111/papr.12171. PMID: 24450301.
Svalheim S., Sveberg L., Mochol M., Taubøll E.: Interactions between antiepileptic
drugs and hormones. Seizure. 2015, 28, 12–17. doi: 10.1016/j.seizure.
2015.02.022. PMID: 25797888.
Svalheim S., Taubøll E., Luef G., Lossius A., Rauchenzauner M., Sandvand F.,
Bertelsen M., Mørkrid L., Gjerstad L.: Diff erential eff ects of levetiracetam,
carbamazepine, and lamotrigine on reproductive endocrine function in
adults. Epilepsy Behav. 2009, 16, 281–287. doi: 10.1016/j.yebeh.2009.07.033.
PMID: 19716343.
Woroń J., Kostka-Trąbka E.: Zaburzenia erekcji jako wynik niepożądanego
działania leków. Seksuol Pol. 2005, 3, 18–22.
CZY ZAAWANSOWANY WIEK OJCOWSKI MA WPŁYW NA SUKCES ROZRODCZY? CZĘŚĆ I: OCENA WYBRANYCH PARAMETRÓW SEMINOLOGICZNYCH
IS ADVANCED PATERNAL AGE A REPRODUCTIVE RISK?
PART I: ASSESSMENT OF SELECTED STANDARD SPERM
CHARACTERISTICS
Aleksandra Rosiak¹,⁵, Kamil Gill¹, Joanna Jakubik¹, Michał Kupś⁴,⁵, Łukasz Patorski¹,³,
Rafał Kurzawa²,⁵, Małgorzata Piasecka¹
¹Katedra i Zakład Histologii i Biologii Rozwoju; ²Zakład Zdrowia Prokreacyjnego, Pomorski Uniwersytet Medyczny
w Szczecinie; ³Klinika Ginekologii, Endokrynologii i Onkologii Ginekologicznej, SPSK1, Pomorski Uniwersytet Medyczny
w Szczecinie; ⁴Oddział Urologii i Onkologii Urologicznej Samodzielnego Publicznego Wojewódzkiego Szpitala Zespolonego
w Szczecinie; ⁵VitroLive Centrum Ginekologii i Leczenia Niepłodności w Szczecinie
Autor do korespondencji/corresponding author: Małgorzata Piasecka, Katedra i Zakład Histologii i Biologii Rozwoju, Pomorski
Uniwersytet Medyczny w Szczecinie, 70-210 Szczecin, ul. Żołnierska 48, tel. 91 48 00 907, mpiasecka@ipartner.com.pl
Otrzymano/received: 19.11.2017 r. Zaakceptowano/accepted: 30.12.2017 r.
Aleksandra Rosiak
– mgr analityki medycznej, diagnosta laboratoryjny, absolwentka i doktorantka
Pomorskiego Uniwersytetu Medycznego w Szczecinie (PUM). Od 2015 r. pracownik
VitroLive Centrum Ginekologii i Leczenia Niepłodności w Szczecinie, a od 2017 r. również
Katedry i Zakładu Histologii i Biologii Rozwoju PUM. Współautorka prac naukowych i doniesień
zjazdowych w kraju i zagranicą. Aktywnie uczestniczy w projektach naukowych. Praca zawodowa
i naukowa związana jest z rozszerzeniem konwencjonalnej diagnostyki seminologicznej.
Aleksandra Rosiak
– master of Medical Analytics, laboratory diagnostician, graduate of the Pomeranian Medical
University in Szczecin (PUM). Currently she is PhD student at PUM. Since 2015 employed at VitroLive Fertility Clinic
in Szczecin and since 2017 at Department of Histology and Developmental Biology PUM. Author and co-author
of scientifi c publications and abstracts for national and international congresses. Actively participates in research
projects. Her professional and scientifi c work is associated with the extension of conventional semen diagnostics.
Streszczenie
Z licznych doniesień wynika, że istotnym czynnikiem wpływającym na potencjał płodności mężczyzny jest wiek. Sugeruje się, że >40.,
a nawet >35. r.ż. mężczyzny (tzw. advanced paternal age) zwiększa się ryzyko niepowodzeń w rozrodzie. Wraz z wiekiem mężczyzny
częściej pojawiają się infekcje układu moczowo-płciowego oraz choroby ogólnoustrojowe. Może dochodzić do zakłóceń czynności osi
podwzgórze–przysadka–jądra mogących obniżać funkcje seksualne oraz powodować zmiany w strukturze i funkcji jąder. Wskazuje się,
że podłożem tych zmian mogą być patomechanizmy związane z zaburzeniem równowagi pro- i antyoksydacyjnej, której konsekwencją
jest generowanie nadmiaru reaktywnych form tlenu powodujących niekorzystne skutki w przebiegu spermatogenezy i wzrost ryzyka
uszkodzeń ilościowych i jakościowych męskich komórek rozrodczych, w tym również molekularnych. Szczególną uwagę zwraca się
na dojrzałość chromatyny plemników, która może odgrywać istotną rolę w osiągnięciu sukcesu rozrodczego, zarówno w warunkach
naturalnej koncepcji, jak i wspomaganej medycznie.
Słowa kluczowe: wiek mężczyzny, płodność męska, plemniki, chromatyna plemnika
Abstract
Numerous reports indicate that the paternal age is an important factor aff ecting the fertility potential. Th e risk of reproductive failure
can increase in age >40 or even >35 years in men, commonly classifi ed as advanced age. Urogenital infections and systemic diseases
appear more often with advanced paternal age. Moreover disturbances in the hypothalamic-pituitary-testis axis which may aff ect
sexual function and cause changes in the structure and function of the testis can appear more frequently. Possible pathomechanism
for age depended alterations in the male reproductive system is associated with imbalance between pro- and antioxidative processes
which inevitably leads to an oxidative stress and to increase the production of reactive oxygen species. Finally, the disturbances of
spermatogenesis and the higher risk of quantitative and qualitative as well as molecular abnormalities of male gametes can appear.
Particular attention is paid to the maturity of sperm chromatin, which may play a key role in achieving reproductive success, both in
a natural and medically assisted conception.
Key words: male age, male fertility, spermatozoa, sperm chromatin
Skróty / Abbreviations
5mC – 5-metylocytozyna (ang. 5-methylcytosine), AB – błękit aniliny (AB, ang. aniline blue), ADAM – obniżenie stężenia androgenów
u starzejących się mężczyzn (ang. androgen deficiency of the aging men), AO – oranż akrydyny (ang. acridine orange), CMA3 – chromomycyna
A3 (ang. chromomycin A3), DHEA – dehydroepiandrostendion (ang. dehydroepiandrosterone), EMAS – europejskie badania nad starzeniem
się mężczyzn (ang. European Male Ageing Study), FSH – hormon folikulotropowy (ang. follicle-stimulating hormone), FT – wolna frakcja
testosteronu (ang. free testosterone), ICSI – docytoplazmatyczna iniekcja plemnika (ang. intracytoplasmic sperm injection), kpz – tysiąc par
zasad (ang. kilo base pairs), LH – hormon luteinizujący (ang. luteinizing hormone), LNV – plemniki z dużymi jądrowymi wakuolami (ang.
large nuclear vacuoles), LOH – późny hipogonadyzm (ang. late onset hypogonadyzm), MMAS – badania z Massachusetts nad starzeniem się
mężczyzn (ang. Massachusetts Male Aging Study), OAT – oligoastenoteratozoospermia (ang. oligoasthenoteratozoospermia), PADAM – częściowe
obniżenie stężenia androgenów u starzejących się mężczyzn (ang. partial androgen deficiency of the aging men), RFT – reaktywne form tlenu
(ang. reactive oxygen species), SCSA – test służący do oceny uszkodzeń DNA (ang. sperm chromatin structure assay), SHBG – białko wiążące
hormony płciowe (ang. sex hormone-binding globulin), TB – błękit toluidyny (ang. toluidine blue), TDS – zespół niedoboru testosteronu (ang.
testosterone deficiency syndrome), TGF-α – transformujący czynnik wzrostu α (ang. transforming growth factor α), TGF-β – transformujący
czynnik wzrostu β (ang. transforming growth factor β), TUNEL – znakowanie końców nacięć nici DNA przy użyciu termialnej transferazy
deoksynukleotydowej (ang. terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling), TZI – indeks teratozoospermii (ang.
teratozoosperia index)
Niektóre czynniki mające wpływ na decyzję
o posiadaniu potomstwa
Małżeństwo oraz chęć założenia rodziny (posiadanie
potomstwa) są silnie zakorzenione w tradycji i wartościach
Polaków. Od 2008 r. notuje się jednak spadek
liczby zawieranych związków małżeńskich, co jest
znacząco powiązane z liczbą urodzeń. Obecnie ludzie
młodzi inwestują w swoją edukację oraz rozwój zawodowy,
odsuwając na dalszy plan decyzję o ustatkowaniu
się i posiadaniu potomstwa. Chcą uzyskać odpowiedni
status ekonomiczny, by bez wyrzeczeń utrzymać rodzinę,
co przyczynia się do sukcesywnego wzrostu średniego
wieku kobiet i mężczyzn wstępujących w związek małżeński.
W 1990 r. mediana wieku mężczyzn wynosiła
24 lata, a w 2013 r. już 28 lat, z kolei w 2016 r. 29,5 lat.
Na świecie wartość mediany wynosi 29 lat. Od 1990 r.
współczynnik dzietności nie gwarantuje zastępowalności
pokoleń (poniżej 2), w 2016 r. wynosił 1,357. Nic nie
wskazuje na zmianę tej tendencji w najbliższych latach
(Herati i wsp., 2017; Stańczak i wsp., 2016; Główny Urząd
Statystyczny. Rocznik demografi czny, 2017).
Nie ulega wątpliwości fakt, że późne rodzicielstwo
staje się zjawiskiem socjologicznym, a decyzja o posiadaniu
potomstwa uwarunkowana jest zmianami struktury
zachowań ludzkich w wyniku zmian społecznych
i ekonomicznych kraju. W przypadku wieku partnerki
(35.–45. r.ż.) obserwuje się wzrastającą częstość pojawienia
się aberracji liczbowych zarówno chromosomów
płciowych (zespół Turnera, Klinefeltera, zespół Kobiety),
jak i somatycznych (zespół Downa, Edwardsa, Pataua)
(Luthardt i Keitge, 2001). Z kolei wpływ wieku mężczyzny
na jego potencjał płodności nie jest do końca wyjaśniony,
nie istnieje bowiem konkretny okres życia, po którym
mężczyzna nie będzie w stanie zostać ojcem. Dlatego też
zastanawiające jest, w jakim stopniu płodność męska jest
nieograniczona, czy do końca swojego życia mężczyzna
może dawać początek nowemu istnieniu, jak bardzo
wraz z upływającym czasem osłabiają się jego możliwości,
a także jakie są konsekwencje późnego ojcostwa.
Badacze poszukują wartości dla tzw. advanced paternal
age, powyżej której zwiększa się ryzyko niepowodzeń
w rozrodzie. Sugeruje się, że wartością graniczną może
być ukończony przez mężczyznę 35. lub 40. r.ż. (Belloc
i wsp., 2014b; Dubov i wsp., 2016; Harris i wsp., 2017;
Jennings i wsp., 2017; Nybo-Andersen i wsp., 2017; Priskorn
i wsp., 2014; Ramasamy i wsp., 2015; Sharma i wsp., 2015;
Sigman, 2017; Stone i wsp., 2013; Urhoj i wsp., 2017a, 2017b;
Vierck i Silverman, 2015).
Gospodarka hormonalna
Jednym z czynników odpowiadających za prawidłową
funkcję męskiego układu płciowego jest sprawne działanie
układu podwzgórze–przysadka–gonada. Wraz
z wiekiem mężczyzny dochodzi do zmian biomarkerów
hormonalnych. Według Gray i wsp. (1991) co roku średnio
o 1,9% wzrasta stężenie hormonu folikulotropowego (FSH,
ang. follicle-stimulating hormone), o 1,3% wzrasta poziom
hormonu luteinizującego (LH, ang. luteinizing hormone),
o 0,4% obniża się stężenie całkowitego testosteronu
oraz o 1,2% jego wolnej frakcji (FT, ang. free testosterone).
Co roku dochodzi również do wzrostu o 1,2% stężenia
białka wiążącego hormony płciowe (SHBG, ang. sex hormone-
binding globulin) w surowicy krwi, co według badaczy
i klinicystów prowadzi do spadku libido oraz zmniejszenia
częstości stosunków seksualnych (Eisenberg i Meldrum,
2017; Gray i wsp., 1991; Gunes i wsp., 2016; Ramasamy
i wsp., 2015; Sharma i wsp., 2015). Zmiany stężeń hormonów
zostały częściowo potwierdzone prospektywnymi
badaniami klinicznymi EMAS (ang. European Male Ageing
Study) (Wu i wsp., 2010) oraz MMAS (ang. Massachusetts
Male Aging Study) (Cabral i wsp., 2014) dotyczącymi starzenia
się mężczyzn. Obserwuje się również obniżenie produkcji
estrogenów pełniących funkcje regulatorowe (Gunes
i wsp., 2016). Po raz pierwszy, w 2006 r., do opisania tych
zmian, czyli wtórnego hipogonadyzmu, użyto terminu
LOH (ang. late onset hypogonadyzm, późny hipogonadism)
(Nieschlag i wsp., 2006), w piśmiennictwie anglojęzycznym
używa się również nazw ADAM (ang. androgen defi ciency
of the aging men, obniżenie stężenia androgenów u starzejących
się mężczyzn), PADAM (ang. partial androgen
defi ciency of the aging men, częściowe obniżenie stężenia
androgenów u starzejących się mężczyzn) oraz TDS (ang.
testosterone defi ciency syndrome, zespół niedoboru testosteronu)
(Gomuła i Rabijewski, 2010; Kula i wsp., 2015; Morales
i Lunenfeld, 2002; Wang i wsp., 2009). Do rozpoznania tej
jednostki chorobowej niezbędne jest stwierdzenie co najmniej
3 objawów klinicznych (m.in. uczucia zmęczenia,
braku energii, ospałości, obniżenia libido, drażliwości,
zwiększenia masy ciała, zmniejszenia masy mięśniowej
i kostnej) oraz obniżenia stężenia testosteronu we krwi
<12 nmol/L (<3,5 ng/mL) u mężczyzn >40. r.ż. (Jiann,
2017; Kula i Słowikowska-Hilczer, 2012; Kula i wsp., 2015;
Wu i wsp., 2010).
Obraz histologiczny męskiej gonady
Jądro jest organem parzystym o specyfi cznej oraz skomplikowanej
budowie. Odpowiada za produkcję plemników
(spermatogeneza) oraz wydzielanie męskich
hormonów płciowych (steroidogeneza). Na poprawną
czynność jądra wpływa zarówno prawidłowa organizacja
tkanki interstycjalnej, jego unerwienie, unaczynienie,
jak i zachowanie nienaruszonej bariery krew–
jądro (Bilińska i wsp., 2013; Kopera-Sobota i wsp., 2013;
Kotula-Balak i wsp., 2013; Łydka-Zarzycka i wsp., 2013;
Mruk i Cheng, 2015; Wenda-Różewicka i Piasecka, 2013;
Wenda-Różewicka i Wiszniewska, 2013). Wraz z wiekiem
mężczyzny może zmniejszać się liczba komórek Leydiga
(Gunes i wsp., 2016; Kühnert i Nieschlag, 2004; Mahmoud
i wsp., 2003; Ramasamy i wsp., 2015; Sharma i wsp., 2015;
Wenda-Różewicka i Wiszniewska, 2013) pełniących funkcję
endokrynną oraz neuroendokrynną. Komórki te regulują
funkcję jąder poprzez produkcję m.in.: testosteronu,
androstendionu, dehydroepiandrostendionu (DHEA, ang.
dehydroepiandrosterone), relaksyny, transformującego
czynnika wzrostu α (TGF-α, ang. transforming growth
factor α) oraz β (TGF-β, ang. transforming growth factor β),
endorfi n i oksytocyny (Bilińska i wsp., 2013; Kotula-Balak
i wsp., 2013; Martin, 2016; Wenda-Różewicka i Wiszniewska,
2013). Wraz z wiekiem obniża się także liczba komórek
Sertoliego (Gunes i wsp., 2016; Kühnert i Nieschlag, 2004;
Mahmoud i wsp., 2003; Ramasamy i wsp., 2015; Sharma
i wsp., 2015), które m.in. poprzez wytwarzanie specyfi cznych
(unikatowych), kompleksowych połączeń międzykomórkowych
¹, biorą udział w tworzeniu bariery krew–
jądro, odżywiają i podtrzymują komórki spermatogenezy,
fagocytują ciałka resztkowe, produkują płyn kanalikowy,
czynniki pobudzające i hamujące spermatogenezę, niewielkie
ilości estrogenów, czynniki wzrostu i różnicowania
oraz defensyny (Bilińska i wsp., 2013; Hejmej
i wsp., 2013; Iliadou i wsp., 2015; Kopera-Sobota i wsp.,
2013; Łydka-Zarzycka i wsp., 2013; Stanton, 2016; Wenda-
Różewicka i Wiszniewska, 2013). Zmniejsza się również
liczba komórek germinalnych. Może dochodzić do pogrubienia
blaszki właściwej (łac. lamina propria) kanalików
nasiennych, osłabia się unaczynienie jąder, komórki
stają się słabiej odżywione, ponieważ substancje transportowane
wraz z krwią trudniej przez nią przenikają.
Dlatego też może pojawiać się regresja nabłonka plemnikotwórczego
(Mahmoud i wsp., 2003; Ramasamy i wsp.,
2015; Sharma i wsp., 2015; Wenda-Różewicka i Wiszniewska,
2013). W konsekwencji obok zaburzeń endokrynnych
mogą powstawać lokalne zaburzenia interakcji międzykomórkowych
i struktur pozakomórkowych (parakrynne),
które w warunkach prawidłowych niezbędne są do funkcjonowania
nabłonka plemnikotwórczego. Niewątpliwie
opisywane zaburzenia prowadzą do nieprawidłowości
spermatogenezy i w konsekwencji do obniżenia standardowych
i molekularnych parametrów seminologicznych.
Patomechanizm wywołujący zaburzenia spermatogenezy
pojawiające się wraz z wiekiem może być związany
ze stresem oksydacyjnym i zaburzeniem równowagi proi
antyoksydacyjnej, co doprowadza do wzrostu reaktywnych
form tlenu (RFT, ang. reactive oxygen species), które
uszkadzają nabłonek plemnikotwórczy (Johnson i wsp.,
2015) (rycina 1).

Standardowe parametry seminologiczne
Rutynowa analiza seminologiczna to pierwsze badanie
oceniające potencjał płodności mężczyzny (WHO, 2010).
Wraz z upływającym czasem może dochodzić do obniżenia
podstawowych parametrów nasienia, jednakże
wyniki prac autorów nie są jednoznaczne. Większość
z nich wykazuje, iż z wiekiem mężczyzny zmniejsza
się objętość ejakulatu, odsetek plemników wykazujących
ruch postępowy czy też prawidłową budowę
morfologiczną (Dain i wsp., 2011; Eisenberg i Meldrum,
2017; Gunes i wsp., 2016; Huang i wsp., 2017; Kokkinaki
i wsp., 2010; Kovac i wsp., 2013; Li i wsp., 2016; Ramasamy
i wsp., 2015; Sharma i wsp., 2015; Stone i wsp., 2013).
Obniżać może się również żywotność plemników oraz
ich całkowita liczba w ejakulacie, przy czym nie obserwuje
się znaczącego obniżenia koncentracji plemników,
co może być maskowane poprzez spadek objętości ejakulatu
(Belloc i wsp., 2014b; Conti i Eisengerg, 2016; Dain
i wsp., 2011; Eisenberg i Meldrum, 2017; Johnson i wsp.,
2015; Molina i wsp., 2010; Plastira i wsp., 2007; Zitzmann,
2013).
Objętość ejakulatu
Objętość ejakulatu jest parametrem, którego spadek
wraz z wiekiem obserwowany jest najczęściej, szczególnie
po 50. r.ż. mężczyzny (Jenkins i wsp., 2014; Kidd
i wsp., 2001; Molina i wsp., 2010; Ng i wsp., 2004; Park
i wsp. 2014; Stone i wsp. 2013; Whitcomb i wsp., 2011).
Stone i wsp. (2013) wykazali, że objętość ejakulatu była
mniejsza u mężczyzn po 45. r.ż. Z kolei Ng i wsp. (2004)
stwierdzili spadek objętości ejakulatu u mężczyzn
między 52. a 79. r.ż. w porównaniu z mężczyznami
między 17. a 51. r.ż. Badając wpływ wieku mężczyzn
na rezultaty procedur wspomaganego rozrodu, Whitcomb
i wsp. (2011) ujawnili spadek objętości ejakulatu wraz
z wiekiem (<30. r.ż., 30.–34. r.ż., 35.–39. r.ż., 40.–44. r.ż.,
45.–49. r.ż., 50.–54. r.ż., ≥55. r.ż.). Badania przeprowadzone
przez Molina i wsp. (2010) na grupie 9168 badanych
w Kordobie pokazały, że objętość ejakulatu obniżała
się istotnie u mężczyzn >50. r.ż. Podobnie Jenkins
i wsp. (2014) wykazali istotny spadek objętości ejakulatu
między porównywanymi grupami mężczyzn (mediana
dla wieku: 37,7 vs. 50,3 r.ż.). W metaanalizie Kidd i wsp.
(2001) również stwierdzili istotne obniżenie objętości ejakulatu
u mężczyzn ≥50. r.ż. vs. <30. r.ż. Park i wsp. (2014),
sprawdzając, czy wraz z wiekiem mężczyzny zwiększa się
liczba wakuoli w główkach plemników, ustalili, iż u mężczyzn
między 41. a 45. r.ż. istotnie zmniejszała się objętość
ejakulatu, w porównaniu do mężczyzn z grup 26.–30.
r.ż., 31.–35. r.ż., 36.–40. r.ż. oraz 46.–50. r.ż. Natomiast
inni autorzy (Alshahrani i wsp., 2014; Brahem i wsp., 2011;
García-Ferreyra i wsp., 2015; Nijs i wsp., 2011; Rybar i wsp.,
2011; Schmid i wsp., 2013; Sloter i wsp., 2006) nie wykazali
spadku objętości ejakulatu w zależności od wieku
badanego.
Trudno ustalić patomechanizm odpowiedzialny
za zmniejszenie objętości ejakulatu wraz z wiekiem
mężczyzny. Belloc i wsp. (2014b) oraz Zitzmann (2013)
w opublikowanych pracach poglądowych wskazują,
że do tej zmiany dochodzi ze względu na: 1) niewydolność
naczyniową związaną z wiekiem, 2) choroby
współistniejące (np. cukrzyca, nadciśnienie tętnicze),
3) przewlekłe zakażenia (np. zapalenia gruczołu krokowego),
4) otyłość, 5) niewydolność hormonalną i 6) dysfunkcję
dodatkowych gruczołów płciowych.
Koncentracja plemników
i ich całkowita liczba w ejakulacie
Cardona Maya i wsp. (2009) zaobserwowali istotną różnicę
w koncentracji plemników tylko między mężczyznami
≤30. r.ż. vs. ≥40. r.ż. Z kolei różnicę w całkowitej liczbie
plemników w ejakulacie ci sami autorzy wykazali w przypadku
wszystkich porównywanych grup (≤30. r.ż. vs.
31.–40. r.ż.; ≤30. r.ż. vs. ≥40. r.ż.; 31.–40. r.ż. vs. ≥40. r.ż.).
Podobnie Ng i wsp. (2004) wykazali spadek całkowitej
liczby plemników w ejakulacie wraz z wiekiem (17.–51.
vs. 52.–79. r.ż.). Obniżenie koncentracji męskich komórek
rozrodczych zaobserwowali również Stone i wsp. (2013),
w ich badaniach parametr ten zmniejszał się istotnie
po 40. r.ż. mężczyzny. Badacze wyznaczyli 34. r.ż. mężczyzny
jako wiek krytyczny dla tego parametru. Z kolei
Molina i wsp. (2010), Park i wsp. (2014), Ng i wsp. (2004) nie
zaobserwowali różnic w koncentracji plemników między
mężczyznami z porównywanych grup.
Morfologia plemników
Badania przeprowadzone przez Molina i wsp. (2010) wskazują,
że odsetek plemników morfologicznie prawidłowych
obniżał się istotnie u mężczyzn >50. r.ż., porównywalne
wyniki uzyskali García-Ferreyra i wsp. (2015). Istotny
spadek komórek o prawidłowej morfologii oraz podwyższenie
indeksu teratozoospermii (TZI, ang. teratozoosperia
index)² między badanymi grupami wiekowymi mężczyzn
(19.–51. vs. 52.–79. r.ż.) wykazali również Ng i wsp. (2004).
Stone i wsp. (2013) stwierdzili, że prawidłowa morfologia
plemników obniżała się istotnie po 40. r.ż. mężczyzny.
Natomiast Park i wsp. (2014) u mężczyzn nie wykazali
istotnych różnic w przypadku tego parametru.
Ruchliwość plemników
Spadek ruchliwości plemników po 35. r.ż. wykazali Molina
i wsp. (2010), a po 43. r.ż. Stone i wsp. (2013). Podobnie
Cocuzza i wsp. (2008) oraz Cardona Maya i wsp. (2009) ujawnili
spadek ruchliwości plemników w grupie mężczyzn
≥40. r.ż. w porównaniu z badanymi <40. r.ż. lub ≤30. r.ż.
Również Schmid i wsp. (2013), Whitcomb i wsp. (2011)
oraz Sloter i wsp. (2006) zaobserwowali obniżenie ruchliwości
u mężczyzn wraz z wiekiem. Z kolei inni nie wykazali
istotnych różnic w przypadku tego parametru (Park
i wsp., 2014; García-Ferreyra i wsp., 2015; Ng i wsp., 2004).
Żywotność plemników
Park i wsp. (2014) stwierdzili, iż u mężczyzn między
41. a 45. r.ż. istotnie zmniejszał się odsetek plemników
żywych, w porównaniu z pozostałymi grupami badanych
(26.–30. r.ż., 31.–35. r.ż., 36.–40. r.ż. oraz 46.–50. r.ż.).
Molina i wsp. (2010) wykazali, że żywotność plemników
zmniejszała się istotnie już po ukończonym 35. r.ż.
Na spadek odsetka plemników żywych wraz z wiekiem
wskazują także badania Stone i wsp. (2013) oraz Ng
i wsp. (2004). Natomiast García-Ferreyra i wsp. (2015)
oraz Whitcomb i wsp. (2011) nie wykazali istotnych różnic
między porównywanymi grupami mężczyzn w przypadku
odsetka plemników żywych.
Zmiany w plazmie nasienia
Wraz z wiekiem dochodzi również do zmian stężenia
pierwiastków śladowych w plemniku i plazmie nasiennej.
Możemy zaobserwować wzrost stężenia miedzi, wapnia
i cynku w męskich komórkach rozrodczych oraz siarki
w plazmie nasienia. Obniża się również w plazmie nasienia
stężenie fruktozy i aktywność α-glukozydazy, ze względu
na dysfunkcje pęcherzyków nasiennych, prostaty oraz
najądrza (Molina i wsp., 2010; Schmid i wsp., 2013).
Molekularne zmiany chromatyny plemnika
Analiza dojrzałości chromatyny plemników jest ważnym
elementem oceny męskiej płodności i nie ulega wątpliwości,
iż powinna być kolejnym krokiem po standardowym
badaniu seminologicznym. Pozwala na weryfi -
kację jakości materiału genetycznego plemników oraz
ich przydatności do technik wspomaganego rozrodu.
Chromatyna plemnika wykazuje unikatową budowę.
Zawiera 2–15% histonów jądrowych oraz specyfi czne
dla niej protaminy (protamina 1 i protamina 2), bogate
w cysteinę i argininę. Pozwala to na wytworzenie stabilnego
kompleksu z DNA, a dalej utworzenie struktury
toroidu (ang. protamine toroid) (Oliva, 2006; Oliva i wsp.,
2009; Ward, 2017). Budowa toroidu jest wysoce odmienna
od struktury nukleosomowej materiału genetycznego
dzięki obecności protamin, które są bardziej zasadowe niż
białka histonowe charakterystyczne przede wszystkim
dla komórek somatycznych. Toroid zbudowany jest
ze ściśle upakowanych pętli (domeny 50 kpz – tysiąc par
zasad, ang. kilo base pairs), stabilizowanych jonami cynku.
Poszczególne toroidy powiązane są ze sobą za pomocą
łącznikowych pętli DNA (ang. toroid linker) wykazujących
budowę nukleosomową, które związane są z włóknami
macierzy jądrowej (ang. matrix attachment region).
Ścisłe przyleganie do siebie bocznymi powierzchniami
toroidów prowadzi do utworzenia prawidłowej struktury
materiału genetycznego gamety męskiej (Carrell i wsp.,
2007; Francis i wsp., 2014; Kazienko i wsp., 2012; Lewis
i wsp., 2004; Martin-Coello i wsp., 2011; Oliva, 2006; Oliva
i Castillo, 2011; Piasecka i wsp., 2013; Rathke i wsp., 2014;
Venkatesh i wsp., 2011; Ward, 2010, 2011, 2017).
W trakcie przebudowy chromatyny plemników
może dochodzić do wielu nieprawidłowości, szczególnie
u starszych mężczyzn. Zaburzenia te mogą pojawiać
się na różnych etapach i w konsekwencji prowadzić
do nieprawidłowej kondensacji chromatyny plemników.
Przyczyna może być związana z: 1) nadmiarem resztkowych
histonów jądrowych, gdy proces ich zastępowania
przez białka przejściowe jest upośledzony, 2) zaburzonym
procesem protaminacji, gdy białka przejściowe
nie są w prawidłowy sposób zastępowane protaminami,
co może zmieniać stosunek protaminy 1 do protaminy 2
i destabilizować strukturę chromatyny gamet męskich,
3) obecnością przetrwałych nacięć DNA, które w warunkach
fi zjologicznych pojawiają się podczas przebudowy
chromatyny (Belloc i wsp., 2014b; Bungum i wsp., 2011;
Das i wsp., 2013; Jenkins i wsp., 2014; Leach i wsp., 2015;
Ramasamy i wsp., 2015; Sharma i wsp., 2015). Dlatego też
tak ważne jest wykorzystanie różnych technik badawczych
weryfi kujących nieprawidłowości chromatyny
na różnych etapach jej przebudowy (Agarwal i wsp., 2016,
2017; van der Horst i du Plessis, 2017; Ward, 2017). Pozwoli
to ocenić, który z tych etapów jest szczególnie podatny
na działanie czasu.
Należy podkreślić, że fragmentacja DNA plemników,
która zdecydowanie zwiększa się wraz z wiekiem
(Alshahrani i wsp., 2014; Belloc i wsp., 2014a; Das i wsp.,
2013; García-Ferreyra i wsp., 2015; Johnson i wsp., 2015;
Katib i wsp., 2014; Plastira i wsp., 2007; Pourmasumi i wsp.,
2017; Sartorius i Nieschlag, 2010; Schmid i wsp., 2013;
Sharma i wsp., 2004, 2015; Vagnini i wsp., 2007), związana
jest również ze stresem oksydacyjnym i generowaniem
nadmiaru RFT, których źródłem obok niedojrzałych
form plemników powstałych w skutek zaburzeń
spermatogenezy i nieudanej apoptozy wysoce zróżnicowanych
komórek germinalnych (Agarwal i wsp.,
2016; Aitken 2013, 2017; Aitken i De Iuliis, 2007; Sakkas
i Alvarez, 2010) są stany zapalne oraz infekcje, szczególnie
w obrębie układu moczowo-płciowego (Avellino i wsp.,
2017; Belloc i wsp., 2014a; Bisht i Dada, 2017; Dorostghoal
i wsp., 2017; Gunes i wsp., 2016; Katib i wsp., 2014; Sabeti
i wsp., 2016). Zmianom tym towarzyszy zmniejszenie
rezerwy anty oksydacyjnej (Frączek i Kurpisz, 2005;
Walczak-Jędrzejowska, 2015). Wykazano pozytywną
korelację wieku mężczyzny z poziomem reaktywnych
form tlenu w nasieniu (r = 0,2) (Cocuzza i wsp., 2008).
Alshahrani i wsp. (2014) prowadzili badania dotyczące
wpływu wieku mężczyzny na standardowe parametry
seminologiczne, obecność reaktywnych form
tlenu oraz fragmentację DNA (metodą TUNEL, ang.
terminal deoxynucleotidyl transferase-mediated dUTP nick
end labeling). Wykazali, że plemniki mężczyzn >40. r.ż.
miały wyższą fragmentację materiału genetycznego
(średnia: 24,4 ±18,5%) w porównaniu mężczyznami
≤30. r.ż., 31.–40. r.ż. i <40. r.ż. (średnia odpowiednio:
16,7 ±11,2%; 19,1 ±14,6%; 18,7 ±14,1%)³. Podobnie
Vagnini i wsp. (2007) istotne różnice w odsetku plemników
z pofragmento wanym materiałem genetycznym zaobserwowali
między badanymi ≤35. r.ż. vs. 36.–39. r.ż. oraz
≤35. r.ż. vs. ≥40. r.ż. Z kolei Plastira i wsp. (2007) porównali
materiał genetyczny plemników pozyskany od mężczyzn
z oligoastenoteratozoospermią (OAT, ang. oligoasthenoteratozoospermia)
oraz mężczyzn z normozoospermią w dwóch
grupach wiekowych: 24.–34. r.ż. i 35.–45. r.ż. Badacze
wykazali istotnie wyższy odsetek komórek TUNELpozytywnych,
a także CMA3-pozytywnych z obniżoną
protaminacją, barwionych fl uorochromem chromomycyną
A3 (CMA3, ang. chromomycin A3), w grupie mężczyzn
starszych z OAT w porównaniu z młodszymi (odpowiednio
średnia: 33,7 ±6,7% vs. 26,3 ±5,3%; 35,4 ±8,2%
vs. 27,5 ±7,9%) oraz istotne korelacje wieku z odsetkiem
plemników z uszkodzoną chromatyną. Natomiast ci sami
autorzy nie wykazali tych różnic ani korelacji u mężczyzn
z normozoospermią. Również Winkle i wsp. (2009) istotne
różnice w integralności materiału genetycznego w zależności
od wieku badanych zanotowali tylko w przypadku
mężczyzn z nieprawidłowymi parametrami seminologicznymi.
Odsetek plemników z uszkodzonym DNA był
wyższy w grupie mężczyzn ≥40. r.ż. w porównaniu z badanymi
mającymi 36.–39. r.ż. (średnia: 25,00 ±21,04 vs.
18,58 ±15,00%). Z kolei inni badacze wykorzystując test
z oranżem akrydyny (AO, ang. acridine orange), weryfi kujący
komórki z pojedynczą i podwójną nicią DNA, stwierdzili
także związek między uszkodzeniem DNA plemników
a wiekiem mężczyzn (Das i wsp., 2013; Moskovtsev
i wsp., 2006; Schmid i wsp., 2013). Das i wsp. (2013) wykazali
istotnie wyższy odsetek komórek z nieprawidłowym
materiałem genetycznym u mężczyzn ≥40. r.ż. w porównaniu
z mężczyznami <40. r.ż. zarówno w grupie z normozoospermią
(średnia: 17,0 ±13,0 vs. 12,0 ±8,0%),
jak i nieprawidłowymi parametrami nasienia (średnia:
20,0 ±18,0 vs. 12,0 ±10,0%). Moskovtsev i wsp. (2006)
wykazali istotne różnice w odsetku plemników z pojedynczą
nicią DNA między mężczyznami z grup <30. r.ż.,
30.–34. r.ż., 35.–39. r.ż. i 40.–44. r.ż. (średnia odpowiednio:
15,2 ±8,4%; 19,4 ±12,1%; 20,1 ±10,9%; 26,4 ±16,0%)
a mężczyznami ≥45. r.ż. (średnia: 32,0 ±17,1%). Schmid
i wsp. (2013) porównując mężczyzn między 22.–28. r.ż.
z mężczyznami między 65.–80. r.ż., znaleźli istotne
różnice w odsetku plemników z pofragmentowanym
materiałem genetycznym (mediana: 2,4 vs. 4,1%), wykorzystując
test SCSA (ang. sperm chromatin structure assay).
Wpływ wieku na fragmentację DNA plemników ujawnili
również García-Ferreyra i wsp. (2015), wykorzystując
test dyspersji chromatyny plemników. Autorzy stwierdzili
istotnie wyższy odsetek plemników z pofragmentowanym
DNA u mężczyzn ≥50. r.ż. (średnia: 37,1 ±17,61%)
w porównaniu z mężczyznami ≤39. r.ż. oraz 40.–49. r.ż.
(średnia odpowiednio: 17,4 ±10,79%; 21,3 ±13,48%).
Nie zawsze jednak związek między integralnością
chromatyny a wiekiem badanego jest stwierdzany.
Brahem i wsp. (2011) badając płodnych i niepłodnych
mężczyzn, nie znaleźli asocjacji między fragmentacją
DNA a wiekiem w porównywanych grupach wiekowych
mężczyzn (20.–29. r.ż., 30.–39. r.ż., 40.–49. r.ż.,
50.–70. r.ż.). Kim i wsp. (2013) wykorzystując test z błękitem
aniliny (AB, ang. aniline blue), ujawniający plemniki
z nadmiarem resztkowych histonów oraz test z błękitem
toluidyny (TB, ang. toluidine blue), weryfi kujący zaburzenia
struktury chromatyny plemników, nie wykazali
istotnych różnic pomiędzy porównywanymi grupami
wiekowymi (≤34., 35.–39., ≥40.). Podobne wyniki uzyskali
Rybar i wsp. (2011), którzy oprócz testów z AB i TB
wykorzystali CMA3. Badanych podzielili na 3 grupy:
20.–30. r.ż., 31.–40. r.ż., 41.–61. r.ż., lecz między żadną
z nich nie stwierdzili istotnych różnic. Natomiast Virant-
Klun i wsp. (2002) ocenili wpływ odsetka plemników
z pojedynczą nicią DNA na jakość zarodka po zastosowaniu
docytoplazmatycznej iniekcji plemnika (ICSI,
ang. intracytoplasmic sperm injection). Badacze dzieląc
mężczyzn na grupy, ze względu na odsetek plemników
z nieprawidłowym materiałem genetycznym (0–55%,
56–100%), nie wykazali istotnych różnic w przypadku
ich wieku. Analogiczne rezultaty badań dotyczące obecności
w nasieniu plemników z pojedynczą nicią DNA
przedstawili Nijs i wsp. (2011). Autorzy badając mężczyzn
≤34. r.ż., 35.–40. r.ż. i >40. r.ż. nie stwierdzili
znaczących różnic między porównywanymi grupami.
Z kolei Kazerooni i wsp. (2009) wykorzystując test z AO,
nie stwierdzili istotnych korelacji między wiekiem mężczyzn
a wynikami zastosowanego testu.
Z wiekiem dochodzi również do intensyfi kacji procesów
metylacji materiału genetycznego plemników.
Wykazano pozytywną korelację (r = 0,475) wieku ze stężeniem
5-metylocytozyny (5mC, ang. 5-methylcytosine)
w męskich komórkach rozrodczych (Jenkins i wsp., 2013,
2014). Wraz z wiekiem mężczyzny wzrasta również liczba
plemników z dużymi jądrowymi wakuolami (LNV, ang.
large nuclear vacuoles) (de Almeida Ferreira Braga i wsp.,
2011; Perdrix i Rives, 2013). Dowiedziono, iż u mężczyzn
w grupach wiekowych 36.–40. r.ż. i >40. r.ż. zwiększa
się odsetek komórek z LNV w porównaniu do mężczyzn
<35. r.ż. (Silva i wsp., 2012).
Nie ulega wątpliwości fakt, że zdolność plemników
do zapłodnienia wyraźnie zmniejsza się wraz z wiekiem
mężczyzny, zarówno w warunkach naturalnej prokreacji,
jak i wspomaganej medycznie. Zaburzenia te mogą prowadzić
do problemów z uzyskaniem ciąży, jej donoszeniem,
a także rozwojem zarodka (Johnson i wsp., 2015;
Ramasamy i wsp., 2015; Zitzmann, 2013).
Piśmiennictwo
Agarwal A., Chak-Lam C., Majzoub A., Esteves S.: Th e society for translational
medicine: clinical practice guidelines for sperm DNA fragmentation testing
in male infertility. Transl Androl Urol. 2017, 6, 720–733. doi: 10.21037/
tau.2017.08.06. PMID: 29082206.
Agarwal A., Majzoub A., Esteves S.C., Ko E., Ramasamy R., Zini A.: Clinical utility
of sperm DNA fragmentation testing: practice recommendations based
on clinical scenarios. Transl Androl Urol. 2016, 5, 935–950. doi: 10.21037/
tau.2016.10.03. PMID: 28078226.
Aitken R.J.: DNA damage in human spermatozoa; important contributor
to mutagenesis in the off spring. Transl Androl Urol. 2017, S761–S764. doi:
10.21037/tau.2017.09.13. PMID: 29082208.
Aitken R.J.: Human spermatozoa: revelations on the road to conception.
F1000Prime Rep. 2013, 1, 5–39. doi: 10.12703/P5-39. PMID: 24167720.
Aitken R.J., De Iuliis G.N.: Origins and consequences of DNA damage in male
germ cells. Reprod Biomed Online. 2007, 14, 727–33. PMID: 17579989.
Alshahrani S., Agarwal A., Assidi M., Abuzenadah A.M., Durairajanayagam D.,
Ayaz A. i wsp.: Infertile men older than 40 years are at higher risk of sperm
DNA damage. Reprod Biol Endocrinol. 2014, 20, 12, 103. doi: 10.1186/1477-
7827-12-103. PMID: 25410314.
Avellino G., Th eva D., Oates R.D.: Common urologic diseases in older men and
their treatment: how they impact fertility. Fertil Steril. 2017, 107, 305–311.
doi: 10.1016/j.fertnstert.2016.12.008. PMID: 28073432.
Belloc S., Benkhalifa M., Cohen-Bacrie M., Dalleac A., Amar E., Zini A.: Sperm
deoxyribonucleic acid damage in normozoospermic men is related to age
and sperm progressive motility. Fertil Steril. 2014a, 101, 1588–1593. doi:
10.1016/j.fertnstert.2014.02.006. PMID: 24690240.
Belloc S., Hazout A., Zini A., Merviel P., Cabry R., Chahine H., Copin H. i wsp.:
How to overcome male infertility after 40: Infl uence of paternal age on fertility.
Maturitas. 2014b, 78, 22–29. doi: 10.1016/j.maturitas.2014.02.011.
PMID: 24680129.
Bilińska B., Hejmej A., Kopera-Sobota I., Kotula-Balak M., Łydka-Zarzycka M.,
Chojnacka K.: Regulacja spermatogenezy. W: Układ płciowy męski. Badania
kliniczne i doświadczalne. Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu
Medycznego, Szczecin 2013, 247–264.
Bisht S., Dada R.: Oxidative stress: Major executioner in disease pathology,
role in sperm DNA damage and preventive strategies. Front Biosci (Schol
Ed). 2017, 1, 420–447. PMID: 28410127.
Brahem S., Mehdi M., Elghezal H., Saad A.: Th e eff ects of male aging on semen
quality, sperm DNA fragmentation and chromosomal abnormalities in
an infertile population. J Assist Reprod Genet. 2011, 28, 425–432. doi:
10.1007/s10815-011-9537-5. PMID: 21287403.
Bungum M., Bungum L., Giwercman A.: Sperm chromatin structure assay
(SCSA): a tool in diagnosis and treatment of infertility. Asian J Androl.
2011, 13, 69–75. doi: 10.1038/aja.2010.73. PMID: 21057512.
Cabral R.D., Busin L., Rosito T.E., Koff W.J.: Performance of Massachusetts
Male Aging Study (MMAS) and androgen defi ciency in the aging male
(ADAM) questionnaires in the prediction of free testosterone in patients
aged 40 years or older treated in outpatient regimen. Aging Male. 2014, 17,
147–154. doi: 10.3109/13685538.2014.908460. PMID: 24739016.
Cardona Maya W., Berdugo J., Cadavid Jaramillo A.: Th e eff ects of male age
on semen parameters: analysis of 1364 men attending an andrology center.
Aging Male. 2009, 12, 100–103. doi: 10.3109/13685530903322841. PMID:
19883297.
Carrell D.T., Emery B.R., Hammoud S.: Altered protamine expression and
diminished spermatogenesis: what is the link? Hum Reprod Update. 2007,
13, 313–327. doi: 10.1093/humupd/dml057. PMID: 17208950.
Cocuzza M., Athayde K.S., Agarwal A., Sharma R., Pagani R., Lucon A.M. i wsp.:
Age-related increase of reactive oxygen species in neat semen in healthy fertile
men. Urology. 2008, 71, 490–494. doi: 10.1016/j.urology.2007.11.041.
PMID: 18342194.
Conti S.L., Eisenberg M.L.: Paternal aging and increased risk of congenital
disease, psychiatric disorders, and cancer. Asian J Androl. 2016, 18 (3),
420–424. doi: 10.4103/1008-682X.175097 PMID: 26975491.
Dain L., Auslander R., Dirnfeld M.: Th e eff ect of paternal age on assisted
reproduction outcome. Fertil Steril. 2011, 95 (1), 1–8. doi: 10.1016/j.fertnstert.
2010.08.029. PMID: 20932518.
Das M., Al.-Hathal N., San-Gabriel M., Phillips S., Kadoch I., Bissonnette F.
i wsp.: High prevalence of isolated sperm DNA damage in infertile men
with advanced paternal age. J Assist Reprod Genet. 2013, 30, 843–848.
doi: 10.1007/s10815-013-0015-0. PMID: 23722935.
de Almeida Ferreira Braga D.P., Setti A.S., Figueira R.C., Nichi M., Martinhago
C.D., Iaconelli A. Jr. i wsp.: Sperm organelle morphologic abnormalities: contributing
factors and eff ects on intracytoplasmic sperm injection cycles
outcomes. Urology. 2011, 78, 786–791. doi: 10.1016/j.urology.2011.06.018.
PMID: 21820702.
Dorostghoal M., Kazeminejad S.R., Shahbazian N., Pourmehdi M., Jabbari A.:
Oxidative stress status and sperm DNA fragmentation in fertile and infertile
men. Andrologia. 2017. doi: 10.1111/and.12762. PMID: 28124476.
Dubov T., Toledano-Alhadef H., Bokstein F., Constantini S., Ben-Shachar S.: Th e
eff ect of parental age on the presence of de novo mutations – Lessons from
neurofi bromatosis type I. Mol Genet Genomic Med. 2016, 4, 480–486. doi:
10.1002/mgg3.222. PMID: 27468422.
Eisenberg M.L., Meldrum D.: Eff ects of age on fertility and sexual function.
Fertil Steril. 2017, 107 (2), 301–304. doi: 10.1016/j.fertnstert.2016.12.018.
PMID: 28160919.
Evenson D.P.: Evaluation of sperm chromatin structure and DNA strand
breaks is an important part of clinical male fertility assessment. Transl
Androl Urol. 2017, 6, 495–500. doi: 10.21037/tau.2017.07.20. PMID:
29082168.
Francis S., Yelumalai S., Jones C., Coward K.: Aberrant protamine content
in sperm and consequential implications for infertility treatment.
Hum Fertil. (Camb.). 2014, 17, 80–89. PMID: 24869677. doi:
10.3109/14647273.2014.915347.
Frączek M., Kurpisz M.: System redoks w nasieniu męskim i peroksydacyjne
uszkodzenia plemników. Postepy Hig Med Dosw. [online]. 2005, 59, 523–534.
García-Ferreyra J., Luna D., Villegas L., Romero R., Zavala P., Hilario R. i wsp.:
High Aneuploidy Rates Observed in Embryos Derived from Donated
Oocytes are Related to Male Aging and High Percentages of Sperm DNA
Fragmentation. Clin Med Insights Reprod Health. 2015, 11, 9, 21–27. doi:
10.4137/CMRH.S32769. PMID: 26604851.
Główny Urząd Statystyczny. Rocznik Demografi czny. Red. D. Rozkrut. Wyd.
Zakład Wydawnictw Statystycznych, Warszawa 2017.
Gomuła A., Rabijewski M.: Zespół niedoboru testosteronu – rozpoznawanie
i leczenie na podstawie norm stężenia testosteronu należnych dla wieku.
Seksuol Pol. 2010, 8, 1–16.
Gray A., Feldman H.A., McKinlay J.B., Longcope C.: Age, disease, and changing
sex hormone levels in middle-aged men: results of the Massachusetts
Male Aging Study. J Clin Endocrinol Metab. 1991, 73, 1016–1025. doi:
10.1210/jcem-73-5-1016. PMID: 1719016.
Gunes S., Hekim G.N., Arslan M.A., Asci R.: Eff ects of aging on the male reproductive
system. J Assist Reprod Genet. 2016, 33, 441–454. doi: 10.1007/
s10815-016-0663-y. PMID: 26867640.
Harris B.S., Bishop K.C., Kemeny H.R., Walker J.S., Rhee E., Kuller J.A.: Risk
Factors for Birth Defects. Obstet Gynecol Surv., 2017, 72 (2), 123–135. doi:
10.1097/OGX.0000000000000405. PMID: 28218773.
Hejmej A., Kotula-Balak M., Górowska E., Bilińska B.: Regulacja steroidogenezy.
W: Badania nad rolą estrogenów w gonadzie męskiej. Red. M. Piasecka.
Wyd. Pomorskiego Uniwersytetu Medycznego, Szczecin 2013, 282–300.
Herati A.S., Zhelyazkova B.H., Butler P.R., Lamb D.J.: Age-related alterations
in the genetics and genomics of the male germ line. Fertil Steril. 2017, 107,
319–323. doi: 10.1016/j.fertnstert.2016.12.021. PMID: 28160920.
Huang C., Li B., Xu K., Liu D., Hu J., Yang Y. i wsp.: Decline in semen quality
among 30,636 young Chinese men from 2001 to 2015. Fertil Steril. 2017,
107, 83–88. doi: 10.1016/j.fertnstert.2016.09.035. PMID: 27793371.
Iliadou P.K., Tsametis C., Kaprara A., Papadimas I., Goulis D.G.: Th e Sertoli
cell: Novel clinical potentiality. Hormones (Athens). 2015, 14, 504–514.
doi: 10.14310/horm.2002.1648. PMID: 26859601.
Jenkins T.G., Aston K.I., Cairns B.R., Carrell D.T.: Paternal aging and associated
intraindividual alterations of global sperm 5-methylcytosine and
5-hydroxy methylcytosine levels. Fertil Steril. 2013, 100, 945–51. doi:
10.1016/j.fertnstert.2013.05.039. PMID: 23809503.
Jenkins T.G., Aston K.I., Pfl ueger C., Cairns B.R., Carrell D.T.: Age-associated
sperm DNA methylation alterations: possible implications in off spring
disease susceptibility. PLoS Genet. 2014, 10, 10. doi: 10.1371/journal.
pgen.1004458. PMID: 25010591.
Jennings M.O., Owen R.C., Keefe D., Kim E.D.: Management and counseling
of the male with advanced paternal age. Fertil Steril. 2017, 107, 324–328.
doi: 10.1016/j.fertnstert.2016.11.018. PMID: 28069174.
Jiann B.P.: Challenges in the diagnosis and treatment of testosterone defi -
ciency in men. Transl Androl Urol. 2017, 6 (3):AB017. doi: 10.21037/tau.2017.
s017.
Johnson S.L., Dunleavy J., Gemmell N.J., Nakagawa S.: Consistent age-dependent
declines in human semen quality: a systematic review and meta-analysis.
Ageing Res Rev. 2015, 19, 22–33. doi: 10.1016/j.arr.2014.10.007. PMID:
25462195.
Katib A.A., Al-Hawsawi K., Motair W., Bawa A.M.: Secondary infertility and
the aging male, overview. Cent European J Urol. 2014, 67, 184–188. doi:
10.5173/ceju.2014.02.art13. PMID: 25140235.
Kazerooni T., Asadi N., Jadid L., Kazerooni M., Ghanadi A., Ghaff arpasand F.
i wsp.: Evaluation of sperm’s chromatin quality with acridine orange test,
chromomycin A3 and aniline blue staining in couples with unexplained
recurrent abortion. J Assist Reprod Genet. 2009, 26, 591–596. doi: 10.1007/
s10815-009-9361-3. PMID: 19894107.
Kazienko A., Piasecka M., Rymaszewska A., Gaczarzewicz D., Kurzawa R., Fraczek
M. i wsp.: Molekularne markery niepłodności męskiej: zmiany polimorfi
czne genów białek chromatyny plemnika – część I. Post Biol Komórki.
2012, 39, 345–370.
Kidd S.A., Eskenazi B., Wyrobek A.J.: Eff ects of male age on semen quality
and fertility: a review of the literature. Fertil Steril. 2001, 75, 237–248.
PMID: 11172821.
Kim H.S., Kang M.J., Kim S.A., Oh S.K., Kim H., Ku S.Y. i wsp.: Th e utility of
sperm DNA damage assay using toluidine blue and aniline blue staining
in routine semen analysis. Clin Exp Reprod Med, 2013, 40, 23–28. doi:
10.5653/cerm.2013.40.1.23. PMID: 23614112.
Kokkinaki M., Lee T.L., He Z., Jiang J., Golestaneh N., Hofmann M.C. i wsp.:
Age aff ects gene expression in mouse spermatogonial stem/progenitor cells.
Reproduction. 2010, 139, 1011–1020. doi: 10.1530/REP-09-0566. PMID:
20371641.
Kopera-Sobota I., Łydka-Zarzycka M., Chojnacka K., Sadowska M.J., Bilińska B.:
Połączenia między komórkami nabłonka plemnikotwórczego. W: Układ
płciowy męski. Badania kliniczne i doświadczalne. Red. M. Piasecka. Wyd.
Pomorskiego Uniwersytetu Medycznego, Szczecin 2013, 214–222.
Kotula-Balak M., Chojnacka K., Górowska E., Bilińska B.: Regulacja steroidogenezy.
W: Układ płciowy męski. Badania kliniczne i doświadczalne. Red.
M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego, Szczecin 2013,
265–281.
Kovac J.R., Addai J., Smith R.P., Coward R.M., Lamb D.J., Lipshultz L.I.: Th e
eff ects of advanced paternal age on fertility. Asian J Androl. 2013, 15, 723–
728. doi: 10.1038/aja.2013.92. PMID: 23912310.
Kühnert B., Nieschlag E.: Reproductive functions of the ageing male. Hum
Reprod. 2004, 10, 327–339. doi: 10.1093/humupd/dmh030. PMID:
15192059.
Kula K., Słowikowska-Hilczer J.: Hipogonadyzm późny u mężczyzn.
Endokrynol. Pol, 2012, 63, 15–19.
Kula K., Walczak-Jędrzejowska R., Kula P., Marchlewska K., Oszukowska
E., Słowikowska-Hilczer J.: Postępy badań nad hipogonadyzmem u starszych
mężczyzn. Postępy Androl Online. 2015, 2 (2), 5–11. [przeglądany:
12.11.2017 r.]. Dostępny w: http://www.postepyandrologii.pl
Leach M., Aitken R.J., Sacks G.: Sperm DNA fragmentation abnormalities in
men from couples with a history of recurrent miscarriage. Aust N Z J Obstet
Gynaecol., 2015, 55 (4), 379–383. doi: 10.1111/ajo.12373. PMID: 26201831.
Lewis J.D., Saperas N., Song Y., Zamora M.J., Chiva M., Ausió J.: Histone H1
and the origin of protamines. Proc Natl Acad Sci U S A. 2004, 101, 4148–
4152. doi: 10.1073/pnas.0308721101. PMID: 15024099.
Li C.J., Tzeng C.R., Chen R.Y., Han B.C., Yeh C.Y., Chien L.C.: Decline in semen
quality in men in northern Taiwan between 2001 and 2010. Chin J Physiol.
2016, 31, 59, 355–365. doi: 10.4077/CJP.2016.BAF441. PMID: 27817197.
Luthardt F., Keitge E.: Chromosomal Syndromes and Genetic Disease. doi:
10.1038/npg.els.0001446
Łydka-Zarzycka M., Kopera-Sobota I., Chojnacka K., Sadowska M.J., Bilińska B.:
Bariera krew-jądro. W: Układ płciowy męski. Badania kliniczne i doświadczalne.
Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego,
Szczecin 2013, 208–213.
Mahmoud A.M., Goemaere S., El-Garem Y., Van Pottelbergh I., Comhaire F.H.,
Kaufman J.M.: Testicular volume in relation to hormonal indices of gonadal
function in community-dwelling elderly men. J Clin Endocrinol Metab. 2003,
88, 179–184. doi: 10.1210/jc.2002-020408. PMID: 12519849.
Martin L.J.: Cell interactions and genetic regulation that contribute to testicular
Leydig cell development and diff erentiation. Mol Reprod Dev. 2016,
83, 470–487. doi: 10.1002/mrd.22648 PMID: 27079813.
Martin-Coello J., Gomendio M., Roldan E.R.: Protamine 3 shows evidence of
weak, positive selection in mouse species (genus Mus) – but it is not a protamine.
Biol Reprod. 2011, 84, 320–326. doi: 10.1095/biolreprod.110.086454.
PMID: 20944085.
Molina R.I., Martini A.C., Tissera A., Olmedo J., Senestrari D., de Cuneo M.F.
i wsp.: Semen quality and aging: analysis of 9.168 samples in Cordoba.
Argentina. Androl Arch Esp Urol. 2010, 63, 214–221. PMID: 20431185.
Morales A., Lunenfeld B.: Investigation, treatment and monitoring of late-onset
hypogonadism in males. Offi cial recommendations of ISSAM. International
Society for the Study of the Aging Male. Aging Male. 2002, 5, 74–86. PMID:
12198738.
Moskovtsev S.I., Willis J., Mullen J.B.: Age-related decline in sperm deoxyribonucleic
acid integrity in patients evaluated for male infertility. Fertil Steril.
2006, 85, 496–499. doi: 10.1016/j.fertnstert.2005.05.075. PMID: 16595239.
Mruk D.D., Cheng C.Y.: Th e Mammalian Blood-Testis Barrier: Its Biology
and Regulation. Endocr Rev. 2015, 36, 564–91. doi: 10.1210/er.2014-1101.
PMID: 26357922.
Ng K.K., Donat R., Chan L., Lalak A., Di Pierro I., Handelsman D.J.: Sperm
output of older men. Hum Reprod. 2004, 19, 1811–1815. doi: 10.1093/
humrep/deh315. PMID: 15218002
Nieschlag E., Swerdloff R., Behre H.M., Gooren L.J., Kaufman J.M., Legros
J.J. i wsp.: Investigation, treatment, and monitoring of late-onset hypogonadism
in male: ISA, ISSAM, and EAU recommendations. J Androl. 2006,
27, 135–137. doi: 10.2164/jandrol.05047. PMID: 16474020.
Nijs M., De Jonge C., Cox A., Janssen M., Bosmans E., Ombelet W.: Correlation
between male age, WHO sperm parameters, DNA fragmentation, chromatin
packaging and outcome in assisted reproduction technology.
Andrologia. 2011, 43, 174–179. doi: 10.1111/j.1439-0272.2010.01040.x.
PMID: 21561463.
Nybo-Andersen A.M., Urhoj S.K.: Is advanced paternal age a health risk for
the off spring? Fertil Steril. 2017, 107, 312–318. doi: 10.1016/j.fertnstert.
2016.12.019. PMID: 28088314.
Oliva R.: Protamines and male infertility. Hum Reprod Update. 2006, 12,
417–435. doi: 10.1093/humupd/dml009. PMID: 16581810.
Oliva R., Castillo J.: Proteomics and genetics of sperm chromatin condensation.
Asian J. Androl. 2011, 13, 24–30. doi: 10.1038/aja.2010.65. PMID:
21042303.
Oliva R., de Mateo S., Estanyol M.: Sperm cell proteomics. Proteomics. 2009,
9, 1004–1017. doi: 10.1002/pmic.200800588. PMID: 19212950.
Park Y.S., Park S., Ko D.S., Park D.W., Seo J.T., Yang K.M.: Observation of
sperm-head vacuoles and sperm morphology under light microscope. Clin
Exp Reprod Med. 2014, 41, 132–136. doi: 10.5653/cerm.2014.41.3.132.
PMID: 25309858.
Perdrix A., Rives N.: Motile sperm organelle morphology examination
(MSOME) and sperm head vacuoles: state of the art in 2013. Hum Reprod
Update. 2013,19, 527–541. doi: 10.1093/humupd/dmt021. PMID: 23825157.
Piasecka M., Gill K., Gaczarzewicz D., Kazienko A., Rosiak A., Udała J. i wsp.:
Znaczenie morfologicznej oceny plemników w diagnostyce seminologicznej.
W: Układ płciowy męski. Piasecka M. (red.). Wyd. PUM w Szczecinie
2013, 97–123.
Plastira K., Msaouel P., Angelopoulou R., Zanioti K., Plastiras A., Pothos A. i wsp.:
Th e eff ects of age on DNA fragmentation, chromatin packaging and conventional
semen parameters in spermatozoa of oligoasthenoteratozoospermic
patients. J Assist Reprod Genet. 2007, 24, 437–443. doi: 10.1007/s10815-
007-9162-5. PMID: 17768675.
Pourmasumi S., Sabeti P., Rahiminia T., Mangoli E., Tabibnejad N., Talebi A.:
Th e etiologies of DNA abnormalities in male infertility: An assessment and
review. Int J Reprod Biomed (Yazd). 2017, 15, 331–344. PMID: 29177237.
Priskorn L., Jensen T.K., Lindahl-Jacobsen R., Skakkebæk N.E., Bostofte E.,
Eisenberg M.L.: Parental age at delivery and a man’s semen quality. Hum
Reprod. 2014, 29, 1097–102. doi: 10.1093/humrep/deu039. PMID: 24578474.
Ramasamy R., Chiba K., Butler P., Lamb D.J.: Male biological clock: a critical
analysis of advanced paternal age. Fertil Steril. 2015, 103 (6), 1402–1406.
doi: 10.1016/j.fertnstert.2015.03.011. PMID: 25881878.
Rathke C., Baarends W.M., Awe S., Renkawitz-Pohl R.: Chromatin dynamics
during spermiogenesis. Biochim Biophys Acta. 2014, 1839, 155–168. doi:
10.1016/j.bbagrm.2013.08.004. PMID: 24091090.
Rybar R., Kopecka V., Prinosilova P., Markova P., Rubes J.: Male obesity and
age in relationship to semen parameters and sperm chromatin integrity.
Andrologia. 2011, 43, 286–291. doi: 10.1111/j.1439-0272.2010.01057.x.
PMID: 21486403.
Sabeti P., Pourmasumi S., Rahiminia T., Akyash F., Talebi A.R.: Etiologies of
sperm oxidative stress. Int J Reprod Biomed (Yazd). 2016, 14, 231–240.
PMID: 27351024.
Sakkas D., Alvarez J.G.: Sperm DNA fragmentation: mechanisms of origin,
impact on reproductive outcome, and analysis. Fertil Steril. 2010, 1,
93, 1027–1036. doi: 10.1016/j.fertnstert.2009.10.046. PMID: 20080235.
Sartorius G.A., Nieschlag E.: Paternal age and reproduction. Hum Reprod
Update. 2010, 16, 65–79. doi: 10.1093/humupd/dmp027. PMID: 19696093.
Schmid T.E., Grant P.G., Marchetti F., Weldon R.H., Eskenazi B., Wyrobek A.J.:
Elemental composition of human semen is associated with motility and
genomic sperm defects among older men. Hum Reprod. 2013, 28, 274–282.
doi: 10.1093/humrep/des321. PMID: 23042799.
Sharma R.K., Agarwal A., Rohra V.K., Assidi M., Abu-Elmagd M., Turki R.F.:
Eff ects of increased paternal age on sperm quality, reproductive outcome
and associated epigenetic risks to off spring. Reprod Biol Endocrinol. 2015,
19, 13–35. doi: 10.1186/s12958-015-0028-x. PMID: 25928123.
Sharma R.K., Said T., Agarwal A.: Sperm DNA damage and its clinical relevance
in assessing reproductive outcome. Asian J Androl. 2004, 6, 139–
148. PMID: 15154089.
Sigman M.: Introduction: What to do with older prospective fathers: the risks
of advanced paternal age. Fertil Steril. 2017, 107, 299–300. doi: 10.1016/j.
fertnstert.2016.12.020. PMID: 28160918.
Silva L.F., Oliveira J.B., Petersen C.G., Mauri A.L., Massaro F.C., Cavagna M.
i wsp.: Th e eff ects of male age on sperm analysis by motile sperm organelle
morphology examination (MSOME). Reprod Biol Endocrinol. 2012, 19,
10–19. doi: 10.1186/1477-7827-10-19. PMID: 22429861.
Simon L., Zini A., Dyachenko A., Ciampi A., Carrell D.T.: A systematic review
and meta-analysis to determine the eff ect of sperm DNA damage on in vitro
fertilization and intracytoplasmic sperm injection outcome. Asian J Androl.
2017, 19 (1), 80–90. doi: 10.4103/1008-682X.182822. PMID: 27345006.
Sloter E., Schmid T.E., Marchetti F., Eskenazi B., Nath J., Wyrobek A.J.:
Quantitative eff ects of male age on sperm motion. Hum Reprod. 2006,
21 (11), 2868–2875. doi: 10.1093/humrep/del250. PMID: 16793993.
Stanton P.G.: Regulation of the blood-testis barrier. Sem Cell Dev Biol. 2016,
59, 166–173. doi: 10.1016/j.semcdb.2016.06.018. PMID: 27353840.
Stańczak J., Stelmach K., Urbanowicz M.: Decrease in the number of marriages
and live births in Poland. Eurostat. Dostępny w: http://ec.europa.eu/eurostat/
statistics-explained/pdfscache/46705.pdf, 24.08.2016.
Stone B.A., Alex A., Werlin L.B., Marrs R.P.: Age thresholds for changes in
semen parameters in men. Fertil Steril. 2013, 100, 952–958. doi: 10.1016/j.
fertnstert.2013.05.046. PMID: 23809502.
Urhoj S.K., Andersen P.K., Mortensen L.H., Davey Smith G., Nybo Andersen A.M.:
Advanced paternal age and stillbirth rate: a nationwide register-based cohort
study of 944,031 pregnancies in Denmark. Eur J Epidemiol. 2017a, 32 (3),
227–234. doi: 10.1007/s10654-017-0237-z. PMID: 28271174.
Urhoj S.K., Raaschou-Nielsen O., Hansen A.V., Mortensen L.H., Andersen P.K.,
Nybo Andersen A.M.: Advanced paternal age and childhood cancer in off -
spring: A nationwide register-based cohort study. Int J Cancer. 2017b, 140,
2461–2472. doi: 10.1002/ijc.30677. PMID: 28257590.
Vagnini L., Baruffi R.L., Mauri A.L., Petersen C.G., Massaro F.C., Pontes A. i wsp.:
Th e eff ects of male age on sperm DNA damage in an infertile population.
Reprod Biomed Online. 2007, 15, 514–519. PMID: 18028741.
van der Horst G., du Plessis S.S.: Not just the marriage of fi garo: But the marriage
of who/eshre semen analysis criteria with sperm functionality. Postępy
Androl Online. 2017, 4 (1), 6–22. [przeglądany: 12.11.2017 r.]. Dostępny w:
http://www.postepyandrologii.pl
Venkatesh S., Kumar R., Deka D., Deecaraman M., Dada R.: Analysis of sperm
nuclear protein gene polymorphisms and DNA integrity in infertile men. Syst
Biol Reprod Med. 2011, 57, 124–132. doi: 10.3109/19396368.2011.562960.
PMID: 21425891.
Vierck E., Silverman J.M.: Brief report: phenotypic diff erences and their relationship
to paternal age and gender in autism spectrum disorder. J Autism
Dev Disord. 2015, 45, 1915–1924. doi: 10.1007/s10803-014-2346-9. PMID:
25526953.
Virant-Klun I., Tomazevic T., Meden-Vrtovec H.: Sperm single-stranded DNA,
detected by acridine orange staining, reduces fertilization and quality of ICSIderived
embryos. J Assist Reprod Genet. 2002, 19, 319–328. PMID: 12168732.
Walczak-Jędrzejowska R.: Stres oksydacyjny a niepłodność męska. Część I:
Czynniki wywołujące stres oksydacyjny w nasieniu. Postępy Androl Online.
2015, 2 (1), 5–15. [przeglądany: 12.11.2017 r.]. Dostępny w: http://www.
postepyandrologii.pl
Wang C., Nieschlag E., Swerdloff R., Behre H.M., Hellstrom W.J., Gooren L.J.
i wsp.: Investigation, treatment and monitoring of late-onset hypogonadism
in males. Int J Androl. 2009, 32, 1–10. doi: 10.1530/EJE-08-0601. PMID:
18955511 PMCID: PMC2754.
Ward W.S.: Eight tests for sperm DNA fragmentation and their roles in the clinic.
Transl Androl Urol. 2017. doi: 10.21037/tau.2017.03.78. PMID: 29082163.
Ward W.S.: Function of sperm chromatin structural elements in fertilization
and development. Mol Hum Reprod. 2010, 16, 30–36. doi: 10.1093/
molehr/gap080. PMID: 19748904.
Ward W.S.: Regulating DNA supercoiling: sperm points the way. Biol Reprod.
2011, 84, 841–843. doi I: 10.1095/biolreprod.111.090951. PMID: 21248288.
Wenda-Różewicka L., Piasecka M.: Cykl nabłonka plemnikotwórczego w jądrze
człowieka. W: Układ płciowy męski. Badania kliniczne i doświadczalne.
Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego, Szczecin
2013, 189–193.
Wenda-Różewicka L., Wiszniewska B.: Organizacja przestrzeni śródmiąższowej
męskiej gonady. W: Układ płciowy męski. Badania kliniczne i doświadczalne.
Red. M. Piasecka. Wyd. Pomorskiego Uniwersytetu Medycznego, Szczecin
2013, 194–207.
Whitcomb B.W., Turzanski-Fortner R., Richter K.S., Kipersztok S., Stillman R.J.,
Levy M.J. i wsp.: Contribution of male age to outcomes in assisted reproductive
technologies. Fertil Steril. 2011, 95, 147–151. doi: 10.1016/j.fertnstert.
2010.06.039. PMID: 20663496.
Winkle T., Rosenbusch B., Gagsteiger F., Paiss T., Zoller N.: Th e correlation
between male age, sperm quality and sperm DNA fragmentation in 320
men attending a fertility center. J Assist Reprod Genet. 2009, 26, 41–46.
doi: 10.1007/s10815-008-9277-3. PMID: 19030983.
World Health Organization. WHO Laboratory Manual for the Examination
and Processing of Human Semen. 5th ed. World Health Organization Press,
Geneva 2010.
Wu F.C., Tajar A., Beynon J.M., Pye S.R., Silman A.J., Finn J.D. i wsp.:
Identifi cation of late-onset hypogonadism in middle-aged and elderly
men. N Engl J Med. 2010, 363, 123–135. doi: 10.1056/NEJMoa0911101.
PMID: 20554979.
Zitzmann M.: Eff ects of age on male infertilty. Best Pract Res Clin Endocrinol
Metab. 2013, 27, 617–628. doi: 10.1016/j.beem.2013.07.004. PMID:
24054934.
CZY ZAAWANSOWANY WIEK OJCOWSKI MA WPŁYW NA SUKCES ROZRODCZY? CZĘŚĆ II: ROZWÓJ ZARODKA, UZYSKANIE CIĄŻY ORAZ ZDROWIE POTOMSTWA
Aleksandra Rosiak
– mgr analityki medycznej, diagnosta laboratoryjny, absolwentka i doktorantka
Pomorskiego Uniwersytetu Medycznego w Szczecinie (PUM). Od 2015 r. pracownik
VitroLive Centrum Ginekologii i Leczenia Niepłodności w Szczecinie, a od 2017 r. również
Katedry i Zakładu Histologii i Biologii Rozwoju PUM. Współautorka prac naukowych i doniesień
zjazdowych w kraju i zagranicą. Aktywnie uczestniczy w projektach naukowych. Praca zawodowa
i naukowa związana jest z rozszerzeniem konwencjonalnej diagnostyki seminologicznej.
Aleksandra Rosiak
– master of Medical Analytics, laboratory diagnostician, graduate of the Pomeranian Medical
University in Szczecin (PUM). Currently she is PhD student at PUM. Since 2015 employed at VitroLive Fertility Clinic
in Szczecin and since 2017 at Department of Histology and Developmental Biology PUM. Author and co-author
of scientifi c publications and abstracts for national and international congresses. Actively participates in research
projects. Her professional and scientifi c work is associated with the extension of conventional semen diagnostics.
Streszczenie
W trakcie ontogenezy organizm mężczyzny narażony jest na liczne czynniki toksyczne oraz mutagenne, co doprowadza do wzrostu liczby
mutacji (duplikacje, delecje, disomie, diploidie chromosomów autosomalnych i płciowych) oraz zmian epigenetycznych. Następstwem
tych uszkodzeń i dysregulacji mogą być zaburzenia procesu zapłodnienia, implantacji, rozwoju zarodka oraz płodu, nawracające idiopatyczne
poronienia, dłuższy czas oczekiwania na ciążę, jak również wzrost ryzyka śmierci płodu, przedwczesnych porodów, również
płodów z niską masą urodzeniową oraz chorób genetycznych dziedziczonych autosomalnie dominująco i zaburzeń neurobehawioralnych
u potomstwa. Należy jednak podkreślić, że opinie co do wpływu wieku mężczyzny na jego płodność i zdrowie potomstwa
są niejednoznaczne, często rozbieżne i wzbudzają wiele wątpliwości. Dotyczą bowiem różnych etapów procesu rozrodczego i nie zawsze
na każdym etapie rozrodu obserwuje się znaczący wpływ zaawansowanego wieku ojca. Wynika to z faktu, iż przedmiotem publikowanych
badań są zróżnicowane grupy mężczyzn nie tylko pod względem wiekowym i liczebności, ale i kategorii seminologicznych.
Ponadto nie można zapomnieć, że wpływ wieku na płodność męską ma charakter indywidualny i zależy od zdolności reprodukcyjnej,
przebytych chorób, urazów układu moczowo-płciowego, stylu życia i wielu czynników środowiskowych.
Słowa kluczowe: wiek mężczyzny, płodność męska, plemniki, zaburzenia genetyczne, wady wrodzone
Abstract
Th e male organism is exposed to numerous toxic and mutagenous factors during ontogenesis which lead to an increase in the number
of mutations (duplications, deletions, disomies, diploidies of autosomal and sexual chromosomes) and epigenetic changes. Described
abnormalities could result in impaired fertilization, implantation, embryo and fetus development and recurrent pregnancy loss as well
as delayed conception. Furthermore, increased risk of fetal death, preterm birth, birth low weight and inherited autosomal dominant
genetic diseases, and neurobehavioral disorders in off spring could be associated with advanced paternal age. However, it should be
emphasized that opinions about the eff ect of age on male fertility potential and off spring health are ambiguous, often divergent and
arouse many doubts. Since obtained fi ndings concern the diff erent stages of the reproductive process and not always at every stage of
reproduction observed a signifi cant impact of advanced paternal age. Th is is due to the fact that the subject of published research are
diverse groups of men not only in terms of age and number, but also seminological categories. Moreover, the infl uence of age on male
fertility is individual and depends on reproductive ability, medical history, urogenital tract injuries, lifestyle and environmental factors.
Key words: male age, male fertility, spermatozoa, genetic aberrations, congenital disorders
Skróty / Abbreviations
ART – techniki wspomaganego rozrodu (ang. assisted reproductive technology), ASD –choroby ze spektrum autyzmu (ang. autism spectrum
disorders), EDN3 – gen kodujący endotelinę (ang. endothelin 3 gene), EDNRB – gen kodujący receptor typu B dla endoteliny (ang. endothelin
receptor B gene), FBN1 – gen kodujący fi brylinę (ang. fi brilin-1 gene), FGFR2 – gen kodujący receptor 2 dla czynnika wzrostu fi broblastów
(ang. fi broblast growth factor receptor 2 gene), FGFR3 – gen kodujący receptor 3 dla czynnika wzrostu fi broblastów (ang. fibroblast growth
factor receptor 3 gene), MITF – czynnik transkrypcyjny związany z mikroftalmią (ang. microphthalmia associated transcription factor), NF1 –
gen kodujący neurofi brominę (ang. neurofi bromin-1 gene), PAX3 – czynnki transkrypcyjny zawierający domenę paired (ang. paired box 3),
RET – onkogen predysponujący do powstawania guzów w gruczołach endokrynnych (ang. related to multiple endocrine neoplasia), SOX10 –
czynnik transkrypcyjny z domeną HMG związany z białkami Sry (ang. Sry-related HMG box)
Rozwój zarodka i uzyskanie ciąży
Uznano, że wraz z wiekiem mężczyzny (35.–45. r.ż. vs.
17.–24. r.ż.) wydłuża się czas oczekiwania na ciążę (20,3
vs. 5,3 miesięcy) (Katib i wsp., 2014; Louis i wsp., 2013)
oraz 4,6-krotnie zmniejsza szansa na uzyskanie ciąży
(>45. r.ż. vs. <25. r.ż.) po roku regularnego współżycia
bez stosowania środków antykoncepcyjnych (Kovac i wsp.,
2013), co w konsekwencji może doprowadzić do większej
biologicznej bezdzietności (35.–45. r.ż. vs. 17.–24. r.ż.)
(Louis i wsp., 2013).
W przypadku mężczyzn w zaawansowanym wieku
(szczególnie ≥ 50. r.ż. lub w 60. r.ż.) uczestniczących
w procedurach wspomaganego rozrodu (ART, ang. assisted
reproductive technology), zauważa się niższy odsetek
zapłodnionych oocytów i blastocyst, spowolniony rozwój
późnej blastocysty czy obniżoną jakość zarodka, a także
zaburzenia jego implantacji (Dain i wsp., 2011; Frattarelli
i wsp., 2008; García-Ferreyra i wsp., 2015; Klonoff -Cohen
i Natarajan, 2004; Luna i wsp., 2009; Wiener-Megnazi
i wsp., 2012). Może to prowadzić do wzrostu ryzyka poronień
spontanicznych (<20 tyg. rozwoju), zarówno ciąż
naturalnych, jak i wspomaganych medycznie, w wielu
przypadkach niezależnie od wieku matki i innych czynników
(Aitken, 2013; Nybo-Andersen i Urhoj, 2017; Belloc
i wsp., 2014; Kleinhaus i wsp., 2006; Puscheck i Jeyendran,
2007; Ramasamy i wsp., 2015; Sartorius i Nieschlag,
2010; Sharma i wsp., 2015). Według de la Rochebrochard
i Th onneau (2002, 2003), szczególnie gdy kobieta jest ≥35.
r.ż. a mężczyzna >40. r.ż., ryzyko poronień wzrasta, nawet
o 24%, gdy mężczyzna ma 40.–45. r.ż. w porównaniu
z mężczyznami mającymi 25.–29. r.ż. (Zitzmann, 2013).
Według Belloc i wsp. (2008) odsetek poronień zwiększa
się ponad 2-krotnie w parach, w których mężczyzna jest
>45. r.ż. w porównaniu z mężczyznami <30. r.ż. (odpowiednio:
32,4% vs. 13,7%). Podobne wyniki uzyskali
Slama i wsp. (2005), którzy dowodzą że ryzyko poronień
jest 1,26-krotnie większe, gdy ojcem jest mężczyzna
≥35. r.ż. Z kolei inni autorzy wykazują, że wraz z wiekiem
mężczyzn może obniżać się odsetek ciąż uzyskanych
naturalnie nawet o 50% (>35. r.ż. vs. <30. i ≤35. r.ż.)
(Kidd i wsp., 2001) oraz uzyskanych za pomocą technik
wspomaganej prokreacji (36.–38. r.ż. lub 39.–41. r.ż. vs.
<30. r.ż., 30.–32. r.ż.) (Wu i wsp., 2015). W innych badaniach
stwierdza się, że każdy dodatkowy rok życia ojca
>35. r.ż. zmniejsza szansę uzyskania ciąży o 11%, a o 12%
na urodzenie żywego dziecka w przypadku wykorzystania
ART. Co więcej, ryzyko to wzrasta 7-krotnie w przypadku
mężczyzn >40. r.ż. w porównaniu z mężczyznami ≤35. r.ż.
Oczywiście niebagatelne znaczenia ma wiek kobiety,
co zdecydowanie podkreślają autorzy, gdyż szansa uzyskania
ciąży zmniejsza się 4-krotnie, a urodzenia żywego
dziecka 20-krotnie u kobiet >40. r.ż. w porównaniu
z kobietami <35. r.ż. (Klonoff -Cohen i Natarajan, 2004).
Niemniej jednak wyniki autorów nie zawsze są zgodne
i jednoznaczne, dotyczą bowiem heterogennych grup
badawczych w aspekcie wieku i kategorii seminologicznych,
które niewątpliwie mogą być istotne dla sukcesu
rozrodczego (Nybo-Andersen i Olsen, 2011; Dain i wsp.,
2011; Ferreira i wsp., 2010; Ramasamy i wsp., 2015; Wu i wsp.,
2015). Ponadto badania dowodzą, że uzyskane dane zależą
od etapu procesu rozrodczego. Nie zawsze na każdym
etapie rozrodu obserwuje się znaczący wpływ zaawansowanego
wieku ojca. Wu i wsp. (2015) pomimo iż wykazali
związek między wiekiem mężczyzn a uzyskaniem ciąży,
nie stwierdzili jednak wpływu wieku na wzrost ryzyka
wystąpienia poronień. Podobnie Ferreira i wsp. (2010)
wykazali brak związku wieku ojcowskiego z poronieniami
zarówno w grupie mężczyzn z prawidłową koncentracją
plemników w nasieniu, jak i z oligo zoospermią. Natomiast
ujawnili wpływ wieku mężczyzn na proces implantacji
i odsetek uzyskanych ciąż tylko w przypadku tych ostatnich
badanych, u których każdy rok życia zmniejszał
szansę na uzyskanie ciąży o 5%. W obszernym opracowaniu
Dain i wsp. (2011) wskazują, że w 10 publikowanych
badaniach brak jest wyraźnego powiązania wieku
mężczyzny z procesem zapłodnienia, implantacją, uzyskaniem
ciąży i poronieniami. Niemniej jednak autorzy
wnioskują, że znaczące upośledzenie rozwoju zarodka
może być powiązane z wiekiem ojcowskim.
Uważa się, że zaburzenia zapłodnienia, rozwoju
zarodka i uzyskania ciąży w zależności od wieku mężczyzny
mogą być związane z aktywacją genomu ojcowskiego
podczas rozwoju zarodka (2.–5. doby po zapłodnieniu)
ze względu na zaawansowane zaburzenia
genetyczne (Aitken i De Iuliis, 2007; Dain i wsp., 2011;
Luna i wsp., 2009; Slama i wsp., 2005). Należy podkreślić,
że nieprawidłowości plemnikowego DNA ujawniają
się na etapie 8 blastomerowego zarodka, gdy dochodzi
do pełnej ekspresji genów ojcowskich, które w trakcie
ontogenezy narażone są na działanie licznych czynników
mutagennych i środowiskowych przyczyniających się
do stresu oksydacyjnego (Simon i wsp., 2014; Tesarik i wsp.,
2004). Nie ulega wątpliwości fakt, że nieprawidłowości
genomu mogą być naprawiane przez komórkę jajową już
na etapie wczesnej zygoty (na poziomie przedjądrzy), ale
jest to zależne od skali i rodzaju uszkodzeń DNA, bowiem
niektóre zaburzenia genetyczne przekraczają możliwości
naprawcze oocytu. Brak naprawy DNA może skutkować
spontanicznymi przedimplantacyjnymi poronieniami lub
też może mieć miejsce tolerancja uszkodzeń materiału
genetycznego. W takich przypadkach donoszenie ciąży
może wiązać się ze wzrostem ryzyka pojawienia się m.in.
zaburzeń genetycznych i epigenetycznych u potomstwa
(Aitken i De Iuliis, 2007; Gavriliouk i Aitken, 2015; Gill
i wsp., 2018; Martin, 2016; Ménézo i wsp., 2010; Perry,
2015; Slama i wsp., 2005) (rycina 1).
Choroby u potomstwa
Dzieci ojców >45. r.ż., >50. r.ż. częściej rodzą się przedwcześnie
(37. lub 32. tydzień rozwoju) oraz częściej mają
niską masę urodzeniową (Alio i wsp., 2012; Ramasamy
i wsp., 2015; Sartorius i Nieschlag, 2010; Zitzmann, 2013).
Wykazano również, że częściej dochodzi do śmierci płodu,
gdy ojciec ma ≥40. r.ż., >45. r.ż., >50. r.ż. (Alio i wsp., 2012;
Nybo-Andersen i Urhoj, 2017; Puscheck i Jeyendran, 2007;
Urhoj i wsp., 2017a; Zhu i wsp., 2008). Ponadto wiek mężczyzny
może wpływać niekorzystnie na zdrowie potomstwa
(rycina 1). Wraz z wiekiem pojawiają się zmiany epigenetycze
¹, które mimo iż nie zmieniają sekwencji DNA,
mogą m.in. zmniejszać ekspresję genów mających wpływ
na proces zapłodnienia, implantacji i rozwój zarodka.
Do czynników epigenetycznych zaliczamy również
szeroko pojęty styl życia (dieta, aktywność fi zyczna,
palenie papierosów) oraz narażenie na toksyczne substancje.
Efekty zmian epigenetycznych są trwałe i mogą
być dziedziczone nie tylko w pierwszym, ale także drugim
i kolejnych pokoleniach (Aitken, 2017; Curley i wsp., 2011;
Herati i wsp., 2017; Sharma i wsp., 2015).
Wraz z zaawansowanym wiekiem mężczyzny wzrasta
ryzyko chorób u potomstwa, które mogą być wynikiem
akumulacji mutacji pojawiających się de novo w męskich
komórkach germinalnych. W trakcie spermatogenezy
u mężczyzny dochodzi do licznych podziałów mitotycznych,
które sprzyjają powstawaniu mutacji. Uważa
się, że wraz z wiekiem mężczyzny co roku może pojawiać
się od 1 do 2 nowych mutacji, szczególnie niebezpieczne
są te zmieniające funkcję genu (przesuwające
ramkę odczytu, missensowne, nonsensowne czy mutacje
splicingowe) (Gratten i wsp., 2016; Janecka i wsp., 2017;
Neale i wsp., 2012; Sanders i wsp., 2012; Urhoj i wsp., 2017a).
Zwiększają one ryzyko pojawienia się chorób takich jak
autyzm² czy schizofrenia³ (Aitken, 2017; Kong i wsp., 2012;
Sharma i wsp., 2015).
1 Zmiany epigenetyczne – modyfi kacje genomu inne niż zmiany sekwencji
nukleotydów w DNA (np. metylacje DNA, modyfi kacje histonów,
zmiany konformacji struktury chromatyny), powodowane czynnikami
zewnętrznymi, mogące dziedziczyć się z pokolenia na pokolenie (Sharma
i wsp., 2015).
2 Autyzm, zaburzenia ze spektrum autyzmu – etiologia nie jest znana,
obserwuje się częstsze rodzinne występowanie schorzenia, częstość zachorowania
szacuje się na 1:100, objawia się zaburzeniami poznawczymi,
izolacją od świata zewnętrznego, niezdolnością do wytworzenia relacji
z ludźmi i komunikowania uczuć (Lisik, 2014).
3 Schizofrenia – zaburzenie funkcji mózgu, wpływające na myśli, uczucia
i działania chorego, częstość zachorowań szacuje się na 1:100. Objawy
rozwijają się stopniowo lub pojawiają się nagle i mogą się różnić w zależności
od pacjenta. Choroba ewoluuje w cyklach remisji i nawrotów. Objawy
to momenty oderwania od rzeczywistości z wytworzeniem urojeń, omamów,
emocjonalne zaburzenia i zdezorganizowane zachowanie. Prowadzi
do wyraźnej zmiany osobowości, izolacji społecznej, zawodowej niepełnosprawności,
upośledzenia funkcji poznawczych (Millier i wsp., 2014).
1 Zmiany epigenetyczne – modyfi kacje genomu inne niż zmiany sekwencji
nukleotydów w DNA (np. metylacje DNA, modyfi kacje histonów,
zmiany konformacji struktury chromatyny), powodowane czynnikami
zewnętrznymi, mogące dziedziczyć się z pokolenia na pokolenie (Sharma
i wsp., 2015).
2 Autyzm, zaburzenia ze spektrum autyzmu – etiologia nie jest znana,
obserwuje się częstsze rodzinne występowanie schorzenia, częstość zachorowania
szacuje się na 1:100, objawia się zaburzeniami poznawczymi,
izolacją od świata zewnętrznego, niezdolnością do wytworzenia relacji
z ludźmi i komunikowania uczuć (Lisik, 2014).
3 Schizofrenia – zaburzenie funkcji mózgu, wpływające na myśli, uczucia
i działania chorego, częstość zachorowań szacuje się na 1:100. Objawy
rozwijają się stopniowo lub pojawiają się nagle i mogą się różnić w zależności
od pacjenta. Choroba ewoluuje w cyklach remisji i nawrotów. Objawy
to momenty oderwania od rzeczywistości z wytworzeniem urojeń, omamów,
emocjonalne zaburzenia i zdezorganizowane zachowanie. Prowadzi
do wyraźnej zmiany osobowości, izolacji społecznej, zawodowej niepełnosprawności,
upośledzenia funkcji poznawczych (Millier i wsp., 2014).

Wraz z wiekiem wzrasta liczba delecji oraz duplikacji
w materiale genetycznym plemników (Sharma
i wsp., 2015). Sartorelli i wsp. (2001) wykazali, że u mężczyzn
między 59.–74. r.ż. częściej występują abberacje
chromosomalne w porównaniu z mężczyznami między
23.–29. r.ż. (Templado i wsp., 2011). Obserwuje się także
wraz z wiekiem mężczyzn (36.–60. r.ż. vs. 18.–35. r.ż.
lub >50. r.ż.) wzrost disomii XY (Sloter i wsp., 2004;
Wiener-Megnazi i wsp., 2012), co potwierdzają korelacje
między wiekiem mężczyzn a częstością występowania
plemników XY. Wzrost disomii XY zwiększa ryzyko
wystąpienia zespołu Klinefertera⁴ (Lowe i wsp., 2001),
szczególnie u dzieci mężczyzn >39. r.ż. ze stwierdzoną
niepłodnością idiopatyczną (Asada i wsp., 2000). Ryzyko
wystąpienia u dziecka zespołu Klinefertera po ukończeniu
przez ojca 50. r.ż. wg McIntosh i wsp. (1995)
wzrasta nawet dwukrotnie, w porównaniu z mężczyznami
między 25.–29. r.ż. Wykazano także, iż po 55. r.ż.
może zmniejszać się stosunek plemników X/Y (Stone
i wsp., 2013). U mężczyzn niepłodnych wiek koreluje
dodatnio z częstością diploidii (r = 0,544) (Brahem i wsp.,
2011). Rozważa się również związek między wiekiem
mężczyzn a występowaniem innych aneuploidii dotyczących
chromosomów autosomalnych oraz płciowych.
Wykazanie jednak tego związku nie jest łatwe ze względu
na silny wpływ wieku matki na występowanie aberracji
liczbowych chromosów (Conti i Eisenberg, 2016; Zhu i wsp.,
2005). Niemniej jednak potwierdzono, że zaawansowany
wiek mężczyzny (40.–44. r.ż) zwiększa ryzyko
wystąpienia zespołu Downa, gdy partnerka ma >35. r.ż.
(Ramasamy i wsp., 2015).
Sugeruje się, że wraz z wiekiem partnera aktywność
telomerazy w męskich komórkach rozrodczych nie
zmniejsza się, co powoduje wydłużanie telomerów chroniących
chromosomy przed ich skracaniem. Zjawisko to
może powodować przeżywanie komórek z uszkodzonym
materiałem genetycznym (nie będą poddane naturalnemu
procesowi apoptozy) i nieść ryzyko przekazania
powstałych mutacji kolejnym pokoleniom (Johnson i wsp.,
2015; Zitzmann, 2013) (rycina 1).
Choroby genetyczne u potomstwa związane z wiekiem
ojca są w większości dziedziczone autosomalnie dominująco.
Pierwszą, którą powiązano z zaawansowanym
wiekiem mężczyzny >35.–40. r.ż., jest achondroplazja⁵.
Odpowiada za nią mutacja genu kodującego receptor 3
dla czynnika wzrostu fi broblastów (FGFR3, ang. fibroblast
growth factor receptor 3), a zasadniczym objawem
4 Zespół Klinefertera – choroba powodowana aberracją liczbową chromosomów
X (47,XXY), częstość zachorowań szacowana jest na 1:1000–2000.
Objawy pojawiają się od środkowego okresu dojrzewania (stadium GIII wg
klasyfi kacji Tannera), obserwujemy hipogonadyzm hipergonadotropowy
związany z degeneracją struktury i upośledzeniem czynności jąder. Często
jedyną cechą kliniczną są małe jądra, a pacjenci są bezpłodni (Purwin i
Słowikowska-Hilczer, 2015; Tahmasbpour i wsp., 2014).
5 Achondroplazja – choroba genetycznie uwarunkowana, częstość występowania
szacowana jest na 1:10 000–30 000. Obraz kliniczny charakteryzuje
się karłowatością, nieproporcjonalną długością kości proksymalnych,
zaburzoną budową twarzoczaszki (Wright i Irving, 2012).
jest karłowatość (Conti i Eisenberg, 2016; Wright i Irving,
2012). Kolejną chorobą jest zespół Aperta⁶ (ryzyko
wzrasta >37. r.ż.), powodowany mutacją genu kodującego
receptor 2 dla czynnika wzrostu fi broblastów (FGFR2,
ang. fi broblast growth factor receptor 2), objawiający się
m.in. przedwczesnym zarośnięciem szwów czaszkowych
(kraniosynostoza), syndaktylią, malformacjami
twarzoczaszki oraz upośledzeniem umysłowym (Conti
i Eisenberg, 2016; Liu i wsp., 2013). Wystąpienie zespołu
Crouzona⁷ i Pfeiff era⁸ (wzrost ryzyka >50. r.ż.) powodują
mutacje w obrębie genów – FGFR1, FGFR2, FGFR3. Obie
choroby objawiają się kraniosynostozą, wytrzeszczem
oczu i opóźnieniem rozwoju (Conti i Eisenberg, 2016; Glaser
i wsp., 2000; Toriello i Meck, 2008). Zespół Marfana⁹ jest
również chorobą genetyczną wiązaną z zaawansowanym
wiekiem mężczyzny (>40. r.ż.), odpowiada za nią mutacja
w genie kodującym białko – fi brylinę (FBN1, ang. fi brilin-1
gene). Objawia się ona zmianami wielonarządowymi,
najbardziej charakterystyczne związane są z narządem
wzroku, układem ruchu, sercem i naczyniami krwionośnymi
(Keane i Pyeritz, 2008; Zitzmann, 2013). Podobnie
zespół Waardenburga¹⁰, za który odpowiadają mutacje
w obrębie genów kodujących: 1) czynnik transkrypcyjny
zawierający domenę paired (PAX3, ang. paired box
3 gene), 2) czynnik transkrypcyjny związany z mikroftalmią
(MITF, ang. microphthalmia associated transcription
factor), 3) czynnik transkrypcyjny z domeną HMG
związany z białkami Sry (SOX10, ang. Sry-related HMG
box), 4) gen receptora typu B dla endoteliny (EDNRB,
ang. endothelin receptor B gene) i 5) endotelinę (EDN3,
ang. endothelin 3 gene). Objawami zespołu Waanderburga
są niedosłuch czuciowo-nerwowy różnego stopnia, zaburzenia
barwnikowe skóry oraz włosów, jasne, czasem
różnobarwne tęczówki (Puscheck i Jeyendrean, 2007;
6 Zespół Aperta – choroba genetycznie uwarunkowana, częstość występowania
szacowana jest na 1:65 000. Obraz kliniczny charakteryzuje się
krótkogłowiem, płytkimi oczodołami, szeroko rozstawionymi gałkami
ocznymi, hipoplazją środkowej części twarzy, hipoplazją szczęki, rozszczepem
podniebienia (Liu i wsp., 2013).
7 Zespół Crouzona – choroba genetycznie uwarunkowana, częstość występowania
szacowana jest na 16:1 000 000. Obraz kliniczny obejmuje
przedwczesne zarośnięcie szwów czaszkowych, często hipoplazję śródmózgową,
hipoplazję szczęki, sporadycznie niedrożność górnych dróg
oddechowych, prognatyzm żuchwy, przepełnienie górnych zębów i łukowate
zęby w kształcie litery V, wąskie, wysokie lub rozszczepione podniebienie
i podwójny języczek (Balyen i wsp., 2017; Ko, 2016).
8 Zespół Pfeiff era – choroba genetycznie uwarunkowana, częstość występowania
szacowana jest na 1:100 000. Obraz kliniczny obejmuje kraniosynostozy
(zrośnięcie szwów czaszkowych) różnego stopnia, krótkie,
szerokie kciuki, duże palce, syndaktylię, nieprawidłowości w budowie
jamy ustnej oraz zębów oraz trudności w nauce (Hassona i wsp., 2017).
9 Zespół Marfana – choroba genetycznie uwarunkowana, częstość występowania
szacowana jest na 1:3000–5000. Obraz kliniczny obejmuje
skoliozę, osłabienie mięśni, nieprawidłowości w układzie krwionośnym –
w tym zaburzenia pracy serca, wypadnięcie zastawki mitralnej, zmiany
w narządzie wzroku – krótkowzroczność, zwichnięcie soczewki, a także
wysoki wzrost chorych (Keane i Pyeritz, 2008).
10 Zespół Waardenburga – zespół chorobowy genetycznie uwarunkowany,
częstość występowania szacowana jest na 1:40 000, objawiający
się wrodzoną głuchotą lub niedosłuchem, zaburzeniami barwnikowymi
skóry, włosów i oczu, zwiększoną odległością między wewnętrznymi kącikami
oczu, nieprawidłowościami kończyn górnych (Otręba i wsp., 2013).
Otręba i wsp., 2013). Do innych chorób pojawiających
się u dzieci mężczyzn ≥40. r.ż. lub >50. r.ż. zaliczamy
neurofi bromatozę typu 1¹¹, za którą odpowiada mutacja
w genie kodującym neurofi brominę – białko regulatorowe
(NF1, ang. neurofi bromin-1 gene). Objawami są zaburzenia
barwnikowe skóry oraz predyspozycje do występowania
łagodnych i złośliwych nowotworów układu nerwowego
(Dubov i wsp., 2016; Herati i wsp., 2017). Ściśle powiązane
z wiekiem mężczyzny jest także występowanie mutacji
genów (RET, ang. related to multiple endocrine neoplasia),
które predysponują do powstawania guzów w gruczołach
endokrynnych (Ramasamy i wsp., 2015).
Zaawansowany wiek ojca wpływa również na zachowanie
oraz zdrowie psychiczne potomstwa. Chociaż
dowody na ten związek są silne, nie odkryto dotychczas
ich patomechanizmu. Wśród neuropsychiatrycznych
zaburzeń wymienia się choroby ze spektrum autyzmu
(ASD, ang. autism spectrum disorders), które powodują nieprawidłowości
w interakcjach społecznych oraz komunikacji,
powtarzalne i stereotypowe zachowania oraz ograniczone
zainteresowania. Objawy te częściej obserwuje
się je u dzieci ojców, którzy ukończyli 40. r.ż. Do chorób
psychicznych należy również schizofrenia, ryzyko jej
wystąpienia u potomstwa rośnie nawet o 50% wraz
ze wzrostem wieku ojca o każde 10 lat (Conti i Eisenberg,
2016). U dzieci ojców po 50. r.ż. wzrasta także ryzyko
(1,37–1,6-krotnie) zaburzeń afektywnych dwubiegunowych
¹², w przebiegu których pojawiają się zespoły
maniakalne, depresja często powiązana z próbami samobójczymi
oraz nadużywaniem leków (Conti i Eisenberg,
2016; Frans i wsp., 2008; Sharma i wsp., 2015; Sipos i wsp.,
2004). Według Lehrer i wsp. (2016) po 45. r.ż. ryzyko
zachorowania potomstwa na zaburzenia afektywne dwubiegunowe
wzrasta niemal dwukrotnie w porównaniu
do mężczyzn między 20.–24. r.ż.
Obserwuje się także wpływ wieku mężczyzn
na ryzyko pojawienia się u potomstwa nowotworów centralnego
układu nerwowego, sutka oraz białaczek (Conti
i Eisenberg, 2016; Harris i wsp., 2017; Murray i wsp., 2002;
Ramasamy i wsp., 2015; Sergentanis i wsp., 2015). Wraz
ze wzrostem wieku ojca o każde 5 lat ryzyko wystąpienia
ostrej białaczki limfoblastycznej rośnie nawet o 13%
(Urhoj i wsp., 2017b). Częściej rodzą się dzieci z wadami
serca (ubytkami przegrody międzykomorowej, międzyprzedsionkowej;
>35. r.ż.), transpozycją dużych naczyń
(>40. r.ż., >45. r.ż), wadami cewy nerwowej (>45. r.ż.,
>50. r.ż.), anencefalią (>40. r.ż.) oraz przetoką tchawiczo-
-przełykową (30.–34. r.ż.) (Sharma i wsp., 2015).
Piśmiennictwo
Aitken R.J.: DNA damage in human spermatozoa; important contributor
to mutagenesis in the off spring. Transl Androl Urol. 2017, S761–S764. doi:
10.21037/tau.2017.09.13. PMID: 29082208.
Aitken R.J.: Human spermatozoa: revelations on the road to conception.
F1000Prime Rep. 2013, 1, 5–39. doi: 10.12703/P5-39. PMID: 24167720.
Aitken R.J., De Iuliis G.N.: Origins and consequences of DNA damage in male
germ cells. Reprod Biomed Online. 2007, 14, 727–33. PMID: 17579989.
Alio A.P., Salihu H.M., McIntosh C., August E.M., Weldeselasse H., Sanchez E.
i wsp.: Th e eff ect of paternal age on fetal birth outcomes. Am J Mens Health.
2012, 6 (5), 427–435. doi: 10.1177/1557988312440718. PMID: 22564913.
Asada H., Sueoka K., Hashiba T., Kuroshima M., Kobayashi N., Yoshimura Y.:
Th e eff ects of age and abnormal sperm count on the nondisjunction of
spermatozoa. J Assist Reprod Genet. 2000, 17, 51–59. PMID: 10754784.
Balyen L., Deniz Balyen L.S., Pasa S.: Clinical characteristics of Crouzon
syndrome. Oman J Ophthalmol. 2017, 10, 120–122. doi: 10.4103/0974-
620X.209111. PMID: 28757702.
Belloc S., Cohen-Bacrie P., Benkhalifa M., Cohen-Bacrie M., De Mouzon J.,
Hazout A. i wsp.: Eff ect of maternal and paternal age on pregnancy and
miscarriage rates after intrauterine insemination. Reprod Biomed Online.
2008, 17(3), 392–397. PMID: 18765010.
Belloc S., Hazout A., Zini A., Merviel P.,Cabry R., Chahine H. i wsp.: How to overcome
male infertility after 40: Infl uence of paternal age on fertility. Maturitas.
2014, 78, 22–29. doi: 10.1016/j.maturitas.2014.02.011. PMID: 24680129.
Bikowska-Opalach B., Jackowska T.: Nerwiakowłókniakowatość typu 1 – opis
obrazu klinicznego oraz molekularnych podstaw rozwoju choroby. Dev
Period Med. 2013, 17 (4), 334–340.
Bobo W.V.: Th e diagnosis and management of bipolar I and II disorders:
Clinical practice update. Mayo Clin Proc. 2017, 92 (10), 1532–1551. doi:
10.1016/j.mayocp.2017.06.022. PMID: 28888714.
Brahem S., Mehdi M., Elghezal H., Saad A.: Th e eff ects of male aging on semen
quality, sperm DNA fragmentation and chromosomal abnormalities in
an infertile population. J Assist Reprod Genet. 2011, 28, 425–432. doi:
10.1007/s10815-011-9537-5. PMID: 21287403.
Conti S.L., Eisenberg M.L.: Paternal aging and increased risk of congenital
disease, psychiatric disorders, and cancer. Asian J Androl. 2016, 18 (3),
420–424. doi: 10.4103/1008-682X.175097 PMID: 26975491.
Curley J.P., Mashoodh R., Champagne F.A.: Epigenetics and the origins
of paternal eff ects. Horm Behav. 2011, 59, 306–314. doi: 10.1016/j.
yhbeh.2010.06.018. PMID: 20620140.
Dain L., Auslander R., Dirnfeld M.: Th e eff ect of paternal age on assisted
reproduction outcome. Fertil Steril. 2011, 95 (1), 1–8. doi: 10.1016/j.fertnstert.
2010.08.029. PMID: 20932518.
de La Rochebrochard E., Th onneau P.: Paternal age >or=40 years: an important
risk factor for infertility. Am J Obstet Gynecol. 2003, 189, 901–905.
PMID: 14586322.
de la Rochebrochard E., Th onneau P.: Paternal age and maternal age are risk factors
for miscarriage; results of a multicentre European study. Hum Reprod.
2002, 17, 1649–1656. PMID: 12042293.
Dubov T., Toledano-Alhadef H., Bokstein F., Constantini S., Ben-Shachar S.: Th e
eff ect of parental age on the presence of de novo mutations – Lessons from
neurofi bromatosis type I. Mol Genet Genomic Med. 2016, 4, 480–486. doi:
10.1002/mgg3.222. PMID: 27468422.
Ferreira R.C., Braga D.P., Bonetti T.C., Pasqualotto F.F., Iaconelli A. Jr., Borges E.
Jr.: Negative infl uence of paternal age on clinical intracytoplasmic sperm
injection cycle outcomes in oligozoospermic patients. Fertil Steril. 2010,
93 (6), 1870–1874. doi: 10.1016/j.fertnstert.2008.12.043. PMID: 19409557.
Frans E.M., Sandin S., Reichenberg A., Lichtenstein P., Långström N., Hultman
C.E.: Advancing paternal age and bipolar disorder. Arch Gen Psychiatry.
2008, 65, 1034–40. doi: 10.1001/archpsyc.65.9.1034. PMID: 18762589.
Frattarelli J.L., Miller K.A., Miller B.T., Elkind-Hirsch K., Scott R.T. Jr.: Male
age negatively impacts embryo development and reproductive outcome in
donor oocyte assisted reproductive technology cycles. Fertil Steril. 2008,
90, 97–103. doi: 10.1016/j.fertnstert.2007.06.009. PMID: 17765235.
García-Ferreyra J., Luna D., Villegas L., Romero R., Zavala P., Hilario R. i wsp.:
High Aneuploidy Rates Observed in Embryos Derived from Donated
Oocytes are Related to Male Aging and High Percentages of Sperm DNA
Fragmentation. Clin Med Insights Reprod Health. 2015, 11, 9, 21–27. doi:
10.4137/CMRH.S32769. PMID: 26604851.
Gavriliouk D. Aitken R.J.: damage to sperm DNA mediated by reactive oxygen
species: its impact on human reproduction and the health trajectory of
off spring. Adv Exp Med Biol. 2015, 868, 23–47. doi: 10.1007/978-3-319-
18881-2_2. PMID: 26178844.
Gill K., Rosiak A., Gaczarzewicz D., Jakubik J., Kurzawa R., Kazienko A. i wsp.:
Th e eff ect of human sperm chromatin maturity on ICSI outcomes. Hum Cell,
2018, praca przyjęta do druku. doi: 10.1007/s13577-018-0203-4
Glaser R.L., Jiang W., Boyadjiev S.A., Tran A.K., Zachary A.A., Van
Maldergem L. i wsp.: Paternal origin of FGFR2 mutations in sporadic cases
of Crouzon syndrome and Pfeiff er syndrome. Am J Hum Genet. 2000, 66(3),
768-777. doi: 10.1086/302831. PMID: 10712195.
Gratten J., Wray N.R., Peyrot W.J., McGrath J.J., Visscher P.M., Goddard M.E.:
Risk of psychiatric illness from advanced paternal age is not predominantly
from de novo mutations. Nat Genet. 2016, 48 (7), 718–724. doi: 10.1038/
ng.3577. PMID: 27213288.
Harris B.S., Bishop K.C., Kemeny H.R., Walker J.S., Rhee E., Kuller J.A.: Risk
Factors for Birth Defects. Obstet Gynecol Surv., 2017, 72(2), 123–135. doi:
10.1097/OGX.0000000000000405. PMID: 28218773.
Hassona Y., Al-Hadidi A., Ghlassi T.A., Dali H.E., Scully C.: Pfeiff er syndrome:
oral healthcare management and description of new dental fi ndings in a craniosynostosis.
Spec Care Dentist. 2017, 258–262. doi: 10.1111/scd.12236.
PMID: 28845899.
Herati A.S., Zhelyazkova B.H., Butler P.R., Lamb D.J.: Age-related alterations
in the genetics and genomics of the male germ line. Fertil Steril. 2017, 107,
319–323. doi: 10.1016/j.fertnstert.2016.12.021. PMID: 28160920.
Janecka M., Mill J., Basson M.A., Goriely A., Spiers H., Reichenberg A. i wsp.:
Advanced paternal age eff ects in neurodevelopmental disorders–review
of potential underlying mechanisms Transl Psychiatry. 2017, 31, 7. doi:
10.1038/tp.2016.294. PMID: 28140401.
Johnson S.L., Dunleavy J., Gemmell N.J., Nakagawa S.: Consistent age-dependent
declines in human semen quality: a systematic review and meta-analysis. Ageing
Res Rev. 2015, 19, 22–33. doi: 10.1016/j.arr.2014.10.007. PMID: 25462195.
Katib A.A., Al-Hawsawi K., Motair W., Bawa A.M.: Secondary infertility and
the aging male, overview. Cent European J Urol. 2014, 67, 184–188. doi:
10.5173/ceju.2014.02.art13. PMID: 25140235.
Keane M.G., Pyeritz R.E.: Medical management of Marfan syndrome.
Circulation. 2008, 27, 117, 2802–2813. doi: 10.1161/CIRCULA TIONA
HA.107.693523. PMID: 18506019.
Kidd S.A., Eskenazi B., Wyrobek A.J.: Eff ects of male age on semen quality and fertility:
a review of the literature. Fertil Steril. 2001, 75, 237–248. PMID: 11172821.
Kleinhaus K., Perrin M., Friedlander Y., Paltiel O., Malaspina D., Harlap S.:
Paternal age and spontaneous abortion. Obstet Gynecol. 2006, 108, 369–
377. doi: 10.1097/01.AOG.0000224606.26514.3a. PMID: 16880308.
Klonoff -Cohen H.S., Natarajan L.: Th e eff ect of advancing paternal age on pregnancy
and live birth rates in couples undergoing in vitro fertilization or
gamete intrafallopian transfer. Am J Obstet Gynecol. 2004, 191 (2), 507–
514. doi: 10.1016/j.ajog.2004.01.035. PMID: 15343228.
Ko J.M.: Genetic syndromes associated with craniosynostosis. J Korean
Neurosurg Soc. 2016, 59, 187–191. doi: 10.3340/jkns.2016.59.3.187. PMID:
27226847 PMCID: PMC4877538.
Kong A., Frigge M.L., Masson G., Besenbacher S., Sulem P., Magnusson G. i wsp.:
Rate of de novo mutations and the importance of father’s age to disease
risk. Nature. 2012, 23, 488, 471–475. DOI: 10.1038/nature11396. PMID:
22914163.
Kovac J.R., Addai J., Smith R.P., Coward R.M., Lamb D.J., Lipshultz L.I.: Th e
eff ects of advanced paternal age on fertility. Asian J Androl. 2013, 15, 723–
728. doi: 10.1038/aja.2013.92. PMID: 23912310.
Lehrer D.S., Pato M.T., Nahhas R.W., Miller B.R., Malaspina D., Buckley P.F. i wsp.:
Paternal age eff ect: Replication in schizophrenia with intriguing dissociation
between bipolar with and without psychosis. Am J Med Genet B
Neuropsychiatr Genet. 2016, 171, 495–505. doi: 10.1002/ajmg.b.32334.
PMID: 26183902.
Lisik M.Z.: Molekularne podłoże zaburzeń ze spektrum autyzmu. Psychiatr
Pol. 2014, 48, 689–700.
Liu C., Cui Y., Luan J., Zhou X., Han J.: Th e molecular and cellular basis of
Apert syndrome. Intractable Rare Dis Res. 2013, 2, 115–122. doi: 10.5582/
irdr.2013.v2.4.115. PMID: 25343114.
Louis J.F., Th oma M.E., Sørensen D.N., McLain A.C., King R.B., Sundaram R.
i wsp.: Th e prevalence of couple infertility in the United States from a male
perspective: evidence from a nationally representative sample. Andrology.
2013, 1, 741–748. doi: 10.1111/j.2047-2927.2013.00110.x. PMID: 23843214.
Lowe X., Eskenazi B., Nelson D.O., Kidd S., Alme A., Wyrobek A.J.: Frequency of
XY sperm increases with age in fathers of boys with Klinefelter syndrome. Am
J Hum Genet. 2001, 69, 1046–1054. doi: 10.1086/323763. PMID: 11582569.
Luna M., Finkler E., Barritt J., Bar-Chama N., Sandler B., Copperman A.B.
i wsp.: Paternal age and assisted reproductive technology outcome in
ovum recipients. Fertil Steril. 2009, 92, 1772–1775. doi: 10.1016/j.fertnstert.
2009.05.036. PMID: 19539905.
Martin L.J.: Cell interactions and genetic regulation that contribute to testicular
Leydig cell development and diff erentiation. Mol. Reprod. Dev. 2016,
83, 470–487. DOI: 10.1002/mrd.22648 PMID: 27079813.
McIntosh G.C., Olshan A.F., Baird P.A.: Paternal age and the risk of birth
defects in off spring. Epidemiology. 1995, 6, 282–288.
Ménézo Y., Dale B., Cohen M.: DNA damage and repair in human oocytes
and embryos: a review. Zygote. 2010, 18, 357–365. doi: 10.1017/
S0967199410000286. PMID: 20663262.
Millier A., Schmidt U., Angermeyer M.C., Chauhan D., Murthy V., Toumi M. i wsp.:
Humanistic burden in schizophrenia: a literature review. J Psychiatr Res.
2014, 54, 85–93. doi: 10.1016/j.jpsychires.2014.03.021. PMID: 24795289.
Murray L., McCarron P., Bailie K., Middleton R., Davey Smith G., Dempsey S.
i wsp.: Association of early life factors and acute lymphoblastic leukaemia
in childhood: historical cohort study. Br J Cancer. 2002, 1, 86, 356–361.
doi: 10.1038/sj.bjc.6600012. PMID: 11875699.
Neale B.M., Kou Y., Liu L., Ma’ayan A., Samocha K.E., Sabo A. i wsp.: Patterns
and rates of exonic de novo mutations in autism spectrum disorders. Nature.
2012, 485, 242–245. doi: 10.1038/nature11011. PMID: 22495311.
Nybo-Andersen A.M., Olsen J.: Th e Danish National Birth Cohort: selected scientifi
c contributions within perinatal epidemiology and future perspectives.
Scand J Public Health. 2011, 39, 115-120. doi: 10.1177/1403494811407674.
PMID: 21775368.
Nybo-Andersen A.M., Urhoj S.K.: Is advanced paternal age a health risk for
the off spring? Fertil. Steril. 2017, 107, 312–318. doi: 10.1016/j.fertnstert.
2016.12.019. PMID: 28088314.
Otręba M., Miliński M., Buszman E., Wrześniok D., Beberok A.: Hipomelanocytozy
dziedziczne: rola genów PAX3, SOX10, MITF, SNAI2, KIT, EDN3
i EDNRB. Postepy Hig Med Dosw (online) 2013, 67, 1109–1118. doi:
10.5604/17322693.1077722.
Perry M.: Chemically induced DNA damage and sperm and oocyte repair
machinery: the story gets more interesting. Asian J Androl. 2015. doi:
10.4103/1008 -682X.156118. PMID: 25994653.
Purwin T., Słowikowska-Hilczer J.: Zespół Klinefeltera – aktualne zalecenia
odnośnie postępowania medycznego. Androl Online. 2015, 2(2), 12–24.
[przeglądany: 12.11.2017 r.]. Dostępny w: http://www.postepyandrologii.pl
Puscheck E.E., Jeyendran R.S.: Th e impact of male factor on recurrent pregnancy
loss. Curr Opin Obstet Gynecol. 2007, 19, 222–228. doi: 10.1097/
GCO.0b013e32813e3ff 0. PMID: 17495637.
Ramasamy R., Chiba K., Butler P., Lamb D.J.: Male biological clock: a critical
analysis of advanced paternal age. Fertil Steril. 2015, 103 (6), 1402–1406.
doi: 10.1016/j.fertnstert.2015.03.011. PMID: 25881878.
Sanders S.J., Murtha M.T., Gupta A.R., Murdoch J.D., Raubeson M.J., Willsey
A.J. i wsp.: De novo mutations revealed by whole-exome sequencing are
strongly associated with autism. Nature. 2012, 485, 237–241. doi: 10.1038/
nature10945. PMID: 22495306.
Sartorius G.A., Nieschlag E.: Paternal age and reproduction. Hum Reprod
Update. 2010, 16, 65–79. doi: 10.1093/humupd/dmp027. PMID: 19696093.
Sartorelli E.M., Mazzucatto L.F., de Pina-Neto J.M.: Eff ect of paternal age on
human sperm chromosomes. Fertil Steril. 2001, 76, 1119–1123. PMID:
11730737.
Sergentanis T.N., Th omopoulos T.P., Gialamas S.P., Karalexi M.A., Biniaris-
Georgallis S.I., Kontogeorgi E. i wsp.: Risk for childhood leukemia associated
with maternal and paternal age. Eur J Epidemiol. 2015, 30, 1229–1261.
doi: 10.1007/s10654-015-0089-3. PMID: 26537708.
Sharma R.K., Agarwal A., Rohra V.K., Assidi M., Abu-Elmagd M., Turki R.F.:
Eff ects of increased paternal age on sperm quality, reproductive outcome
and associated epigenetic risks to off spring. Reprod Biol Endocrinol. 2015,
19, 13–35. doi: 10.1186/s12958-015-0028-x. PMID: 25928123.
Simon L., Murphy K., Shamsi M.B., Liu L., Emery B., Aston K.I. i wsp.: Paternal
infl uence of sperm DNA integrity on early embryonic development. Hum
Reprod. 2014, 29, 2402–2412. doi: 10.1093/humrep/deu228. PMID:
25205757.
Sipos A., Rasmussen F., Harrison G., Tynelius P., Lewis G., Leon D.A. i wsp.:
Paternal age and schizophrenia: a population based cohort study. BMJ.
2004, 329–1070. doi: 10.1136/bmj.38243.672396.55. PMID: 15501901.
Slama R., Bouyer J., Windham G., Fenster L., Werwatz A., Swan S.H.: Infl uence
of paternal age on the risk of spontaneous abortion. Am J Epidemiol. 2005,
161 (9), 816–823. doi: 10.1093/aje/kwi097. PMID: 15840613.
Sloter E., Nath J., Eskenazi B., Wyrobek A.J.: Eff ects of male age on the frequencies
of germinal and heritable chromosomal abnormalities in humans
and rodents. Fertil Steril. 2004, 81 (4), 925–943. doi: 10.1016/j.fertnstert.
2003.07.043. PMID: 15066442.
Stone B.A., Alex A., Werlin L.B., Marrs R.P.: Age thresholds for changes in
semen parameters in men. Fertil Steril. 2013, 100, 952–958. doi: 10.1016/j.
fertnstert.2013.05.046. PMID: 23809502.
Tahmasbpour E., Balasubramanian D., Agarwal A.: A multi-faceted approach
to understanding male infertility: gene mutations, molecular defects and
assisted reproductive techniques (ART). J Assist Reprod Genet. 2014, 31,
1115-1137. doi: 10.1007/s10815-014-0280-6. PMID: 25117645.
Templado C., Donate A., Giraldo J., Bosch M., Estop A.: Advanced age
increases chromosome structural abnormalities in human spermatozoa.
Eur J Hum Gen. 2011, 19, 145–151. doi: 10.1038/ejhg.2010.166. PMID:
21045871.
Tesarik J., Greco E., Mendoza C.: Late, but not early, paternal eff ect on human
embryo development is related to sperm DNA fragmentation. Hum Reprod.
2004, 19, 611–615. doi: https://doi.org/10.1093/humrep/deh127.
Toriello H.V., Meck J.M.: Statement on guidance for genetic counseling
in advanced paternal age. Genet Med. 2008, 10, 457–460. doi: 10.1097/
GIM.0b013e318176fabb. PMID: 18496227.
Urhoj S.K., Andersen P.K., Mortensen L.H., Davey Smith G., Nybo Andersen A.M.:
Advanced paternal age and stillbirth rate: a nationwide register-based cohort
study of 944,031 pregnancies in Denmark. Eur J Epidemiol. 2017a, 32(3),
227–234. doi: 10.1007/s10654-017-0237-z. PMID: 28271174.
Urhoj S.K., Raaschou-Nielsen O., Hansen A.V., Mortensen L.H., Andersen P.K.,
Nybo Andersen A.M.: Advanced paternal age and childhood cancer in off -
spring: A nationwide register-based cohort study. Int J Cancer. 2017b, 140,
2461–2472. doi: 10.1002/ijc.30677. PMID: 28257590.
Wiener-Megnazi Z., Auslender R., Dirnfeld M.: Advanced paternal age and
reproductive outcome. Asian J Androl. 2012, 14, 69–76. doi: 10.1038/
aja.2011.69. PMID: 22157982.
Wright M.J., Irving M.D.: Clinical management of achondroplasia. Arch Dis
Child. 2012, 97, 129–134. doi: 10.1136/adc.2010.189092. PMID: 21460402.
Wu Y., Kang X., Zheng H., Liu H., Liu J.: Eff ect of paternal age on reproductive
outcomes of in vitro fertilization. PLoS One. 2015, 9, 10, 0135734. doi:
10.1371/journal.pone.0135734. PMID: 26352861.
Zhu J.L., Madsen K.M., Vestergaard M., Olesen A.V., Basso O., Olsen J.: Paternal
age and congenital malformations. Hum Reprod. 2005, 20, 3173–3177. doi:
10.1093/humrep/dei186. PMID: 1600646.
Zhu J.L., Vestergaard M., Madsen K.M., Olsen J.: Paternal age and mortality
in children. Eur J Epidemiol. 2008, 23 (7), 443–447. doi: 10.1007/s10654-
008-9253-3. PMID: 18437509.
Zitzmann M.: Eff ects of age on male infertilty. Best Pract Res Clin Endocrinol
Metab. 2013, 27, 617–628. doi: 10.1016/j.beem.2013.07.004. PMID:
24054934.
