Czasopismo Polskiego Towarzystwa Andrologicznego Journal of Polish Society of Andrology

KOMITET REDAKCYJNY
Redaktor naczelny:
dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego:
prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr n. med. Renata Walczak-Jędrzejowska, Łódź
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst,
Republika Południowej
Afryki
(Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga,
Dania (Copenhagen, Denmark)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Katedra i Zakład Histologii i Biologii Rozwoju
Wydział Nauk o Zdrowiu
Pomorski Uniwersytet Medyczny w Szczecinie
71-210 Szczecin ul. Żołnierska 48
tel. 91 48 00 917, 91 48 00 908
e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Agnieszka Hilczer
Waldemar Jachimczak
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Korekta języka polskiego:
Wojciech Markowski
Korekta języka angielskiego:
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI / CONTENTS / Strony 1–83 / Pages 1–83
O czasopiśmie / About Journal 4
Artykuły oryginalne / Original article
Katarzyna Marchlewska, Emilia Bogołębska, Renata Walczak-Jędrzejowska,
Elżbieta Oszukowska, Krzysztof Kula, Jolanta Słowikowska-Hilczer
Ocena dojrzałości chromatyny plemnikowej u mężczyzn z niepłodnych par
Evaluation of sperm chromatin maturity in men from infertile couples 6
Artur Wdowiak, Anita Wdowiak, Szymon Bakalczuk, Grzegorz Bakalczuk
Relationship between alcohol consumption and sperm nuclear DNA
fragmentation and pregnancy 14
Artykuły poglądowe / Review
Jolanta Chanduszko-Salska
Znaczenie pomocy psychologicznej i psychoterapii we wspomaganiu
leczenia niepłodności
Th e role of psychological help and psychotherapy as a supportive factor
in infertility treatment 22
Jan Karol Wolski
Palma sabalowa – czy warto zastosować w andrologii?
Serenoa repens – is it worth to apply in andrology? 33
Rekomendacje medyczne
Medical recommendation – Jolanta Słowikowska-Hilczer 39
K. Hatzimouratidis (Przewodniczący), I. Eardley, F. Giuliano, I. Moncada, A.
Salonia
Rekomendacje dotyczące zaburzeń seksualnych u mężczyzn: zaburzenia erekcji
i przedwczesny wytrysk
Guidelines on Male Sexual Dysfunction: erectile dysfunction and premature
ejaculation
Tłumaczenie i przygotowanie wersji polskiej
Translation and elaboration of Polish version:
Marta Sochaj, Zuzanna Słowikowska, Jolanta Słowikowska-Hilczer 40
Konferencja Polskiego Towarzystwa Andrologicznego – 18. Dzień Andrologiczny
Symposium of scientifi c training of the Polish Society of Andrology –
18t day of Andrology 76
Instrukcje dla autorów / Instructions for authors 77
O CZASOPIŚMIE / ABOUT THE JOURNAL
Wersja elektroniczna czasopisma jest wersją pierwotną.
Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open
Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.
Th e electronic version of the journal is a original
version. Access to scientifi c information published
in the journal is free and
unlimited (Open Access).
Zaburzenia męskiego układu płciowego dotyczą osób
w różnym wieku i w większości przypadków prowadzą
do niepłodności, która nabrała już rangi choroby cywilizacyjnej.
Najczęściej identyfi kowanymi nieprawidłowościami
są hipogonadyzm, zaburzenia seksualne, wady
rozwojowe narządów płciowych, nowotwory jąder i prostaty.
Ze względu na specyfi czne i coraz bardziej zanieczyszczone
środowisko antropogeniczne dotyczą one
głównie społeczeństw rozwiniętych, w tym również
Polski, i stanowią istotny oraz narastający problem
medyczny, społeczny, demografi czny, a także zdrowia
publicznego. Nauka, która zajmuje się fi zjologią i zaburzeniami
męskiego układu płciowego w aspekcie nauk
podstawowych i klinicznych, to andrologia. Ponieważ
jest to młoda dziedzina nauki, jeszcze do niedawna niezadowalający
stan wiedzy ograniczał możliwości diagnostyki
oraz leczenia zaburzeń męskiego układu płciowego.
Jednak w ostatnich latach obserwuje się niezwykle dynamiczny
rozwój andrologii, szczególnie molekularnej, spowodowany
wprowadzeniem nowych metod badawczych
z zakresu biochemii, biologii i genetyki molekularnej.
Andrologia staje się dziedziną interdyscyplinarną integrującą
wiedzę z różnych dyscyplin medycznych i naukowych.
Informacje związane z tymi zagadnieniami z trudem
docierają do lekarzy i osób zainteresowanych w naszym
kraju, ponieważ jest niewiele literatury w języku polskim,
a wykłady wygłaszane podczas konferencji nie zawsze
wyczerpująco wyjaśniają wątpliwości dotyczące m.in.
postępowania diagnostycznego, terapeutycznego, rekomendacji
czy też proponowanych algorytmów. Stąd też
potrzeba stworzenia czasopisma prezentującego wiedzę
andrologiczną lekarzom różnych specjalności, diagnostom
laboratoryjnym i przedstawicielom nauk podstawowych.
Czasopismo „Postępy Andrologii Online” powstało
z inicjatywy Polskiego Towarzystwa Andrologicznego,
które zainteresowane jest integracją środowiska osób
zajmujących się różnymi aspektami męskiego układu
płciowego, uzupełnieniem i poszerzeniem ich wiedzy,
a także poprawą opieki zdrowotnej nad mężczyznami
w naszym kraju.
Celem czasopisma jest: 1) dostarczenie istotnych
informacji na temat fi zjologii i patologii męskiego układu
płciowego, 2) propagowanie praktycznej wiedzy andrologicznej
kierowanej do szerokich kręgów odbiorców,
3) wymiana poglądów i opinii na temat zagadnień klinicznych
oraz wyników badań doświadczalnych oraz
4) przekazywanie informacji dotyczących konferencji
i kursów o tematyce andrologicznej.
Proponowana tematyka czasopisma to: 1) andrologia
kliniczna z uwzględnieniem etiopatogenezy, diagnostyki
i leczenia m.in. zaburzeń rozwojowych, niepłodności
i procesów starzenia mężczyzn, 2) nowatorskie
metody diagnostyczne, 3) andrologia doświadczalna
rozwijająca się w oparciu o nauki podstawowe oraz
4) inne interdyscyplinarne tematy związane z dziedziną
andrologii.
Czasopismo kierowane jest do lekarzy specjalności
bezpośrednio lub pośrednio związanych z andrologią,
m.in. urologów, endokrynologów, ginekologów, pediatrów,
ale także do lekarzy rodzinnych spotykających się
z coraz częstszym problemem niepłodności partnerskiej
i problemami starzejących się mężczyzn. Ponadto naszą
intencją jest zdobycie zainteresowania diagnostów laboratoryjnych
odgrywających istotną rolę w prawidłowym
postępowaniu terapeutycznym opartym na szerokim
panelu testów i badań, których wdrożenie wciąż wymaga
odpowiednich i wyczerpujących szkoleń z diagnostyki
andrologicznej, w tym seminologicznej. Mamy nadzieję,
że nasze czasopismo wzbudzi również zainteresowanie
biologów zajmujących się czynnością męskiego układu
płciowego w ramach nauk podstawowych, a także lekarzy
weterynarii oraz innych osób, które znajdą informacje
poszerzające ich wiedzę i kształtujące opinię z zakresu
szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac oryginalnych,
kazuistycznych i krótkich komunikatów, jak
również prac poglądowych, opracowanych w kondensacyjnej,
dydaktycznej i przystępnej formie. W pracach
tych autorzy powinni przedstawiać aktualny stan wiedzy
światowej oraz swoje opinie. Chcemy, aby czasopismo
spełniało rolę informatora i przewodnika w dziedzinie
andrologii oraz stanowiło forum dyskusyjne. Ponadto,
zapraszamy do publikowania artykułów będących
tłumaczeniem publikacji ukazujących się w języku angielskim,
które przedstawiają istotne postępy w andrologii.
http://www.postepyandrologii.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska -Hilczer
przewodnicząca
Polskiego Towarzystwa Andrologicznego
Disorders of the male reproductive system relate to
people of diff erent ages and in most cases lead to infertility,
which has already acquired a rank of a disease
associated with the progress of civilization. Th e most
frequently identifi ed irregularities are hypogonadism,
sexual dysfunction, genital malformations, testicular or
prostate cancer. Due to the specifi c and increasingly polluted
anthropogenic environment they concern mainly
developed societies, including Poland, and are an important
and growing medical, social, demographic and public
health problem. A science that deals with the physiology
and with disorders of the male reproductive system in
terms of the basic and clinical science is andrology. As
this is a young fi eld of science, until recently an unsatisfactory
state of knowledge limited the possibilities of the
diagnostics and treatment of the disorders of the male
reproductive system. However, in recent years there has
been a very dynamic development of andrology, especially
in the molecular aspect, due to the introduction
of new methods of research in the fi eld of biochemistry,
biology and molecular genetics. Andrology is becoming an
interdisciplinary fi eld which integrates knowledge from
various medical and scientifi c disciplines. Information
related to these issues reach doctors and interested people
in our country with diffi culty, because there is few publications
in Polish. Lectures given during conferences also
do not always fully explain the doubts concerning diagnostic
and therapeutic proceedings, recommendations
or proposed algorithms. Hence, the need for a journal
presenting the knowledge of andrology to the doctors of
various specialties, laboratory diagnosticians and representatives
of the basic science. Th e journal „Progress in
Andrology Online” is an initiative of the Polish Society
of Andrology, which is interested in the integration of
people involved in diff erent aspects of the male reproductive
system, supplement and broadening their knowledge,
as well as the improvement of health care for men
in our country.
Th e aim of the journal is: 1) to provide relevant
information about the physiology and pathology of the
male reproductive system, 2) the promotion of practical
andrological knowledge directed to broad audiences, 3) to
exchange views and opinions on issues of clinical andexperimental results, and 4) to provide information on
conferences and courses on the subject of andrology.
Th e proposed themes of the journal are: 1) clinical
andrology including etiopathogenesis, diagnostics and
treatment of developmental disorders, infertility and
men’s aging, 2) innovative diagnostic methods, 3) experimental
andrology developing on the basis of the basic
sciences and 4) other interdisciplinary topics related to
the fi eld of andrology.
Th e journal is directed to physicians with specialty
directly or indirectly related to andrology, including
urologists, endocrinologists, gynecologists, pediatricians,
but also to family doctors facing the increasingly
common problem of couple infertility and problems of
aging men. Moreover, our intention is to get the interest
of laboratory diagnosticians playing an important role
in keeping the correct therapeutic proceedings, based
on a broad panel of tests and studies. Th eir implementation
still requires proper and comprehensive training in
andrological diagnostics, including seminological one.
We hope that our magazine will also raise the interest
of biologists dealing with the functions of the male reproductive
system in the framework of basic sciences, as
well as veterinarians and others who will fi nd information
expanding their knowledge and shaping opinion in
the range of broad sciences of andrology. We encourage
you to publish original papers, case reports and short
announcements, as well as review papers, worked out in
the concentrated, didactic and accessible form. In these
articles authors should present the current state of the
global knowledge as well as their own opinions. We want
the journal to act as an informer and a guide in the fi eld
of andrology and become a forum for discussion. In addition,
we invite you to publish articles that are translations
of publications appearing in the English language,
which present signifi cant progress in andrology.
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska -Hilczer
przewodnicząca
Polskiego Towarzystwa Andrologicznego
OCENA DOJRZAŁOŚCI CHROMATYN PLEMNIKÓW MĘŻCZYZN Z NIEPŁODNYCH PAR / EVALUATION OF SPERM CHROMATIN MATURITY OF MEN OF INFERTILE COUPLES
EVALUATION OF SPERM CHROMATIN MATURITY
OF MEN OF INFERTILE COUPLES
Katarzyna Marchlewska¹, Emilia Bogołębska¹, Renata Walczak -Jędrzejowska¹,
Elżbieta Oszukowska², Krzysztof Kula¹, Jolanta Słowikowska -Hilczer¹
¹ Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ² II Klinika
Urologii, Uniwersytet Medyczny w Łodzi
Autor do korespondencji/corresponding author: Jolanta Słowikowska -Hilczer, Zakład Endokrynologii Płodności,
Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. Sterlinga 5, 91 -425 Łódź,
tel.: 42 633 07 05 (jolanta.slowikowska -hilczer@umed.lodz.pl)
Otrzymano/received: 27.01.2016 r. • Zaakceptowano/accepted: 30.06.2016 r.
Katarzyna Marchlewska – dr n. med., absolwentka Uniwersytetu Łódzkiego oraz Uniwersytetu
Medycznego w Lublinie, biolog, specjalność biochemia, diagnosta laboratoryjny. Nauczyciel akademicki
w Zakładzie Endokrynologii Płodności Katedry Andrologii i Endokrynologii Płodności Uniwersytetu
Medycznego w Łodzi. Współwykonawca polskich i europejskich projektów badawczych. Pierwszy autor
i współautor 41 publikacji naukowych. Członek Polskiego Towarzystwa Andrologicznego, członek
Międzynarodowego Towarzystwa Andrologicznego, Polskiego Towarzystwa Medycyny Rozrodu oraz
Komisji Andrologii Komitetu Biologii Rozrodu PAN. Praca zawodowa i naukowa autorki związana
jest z badaniami nad czynnością męskiego układu płciowego i jego zaburzeniami oraz diagnostyką andrologiczną.
Katarzyna Marchlewska – PhD, graduate of the University of Lodz and Medical University of Lublin as biologist,
specializing in biochemistry, laboratory diagnostician. Academic teacher at the Division of Reproductive
Endocrinology, Department of Andrology and Reproductive Endocrinology at the Medical University of Lodz.
Researcher in Polish and European scientifi c projects. Th e fi rst author and co -author of 41 scientifi c publications.
Member of the Polish Society of Andrology, a member of the International Society of Andrology, Polish Society
for Reproductive Medicine and Andrology Commission Committee of Reproductive Biology Sciences. Professional
and scientifi c work is associated with the research on the male reproductive system function and its disorders, and
andrology diagnostics.
Streszczenie
Uzasadnienie i cel pracy. Podstawowe badanie nasienia nie zawsze jednoznacznie wskazuje na przyczynę zaburzeń płodności u mężczyzn.
Jedną z dodatkowych metod diagnostycznych jest ocena dojrzałości chromatyny plemników, odzwierciedlająca prawidłową
przebudowę i kondensację materiału genetycznego podczas spermiogenezy. Celem pracy było znalezienie związku między podstawowymi
parametrami nasienia a dojrzałością chromatyny plemników.
Materiał i metody. W grupie 63 mężczyzn zgłaszających się z powodu niepłodności partnerskiej wykonano podstawowe badanie
nasienia (WHO, 2010). Do badania dojrzałości chromatyny zastosowano barwienie plemników kwaśnym roztworem błękitu aniliny
(AB) (czerwone – chromatyna dojrzała, niebieskie –
chromatyna niedojrzała).
Wyniki. Odsetek plemników z dojrzałą chromatyną (komórki AB -negatywne) mieścił się w zakresie 8–83 (mediana: 45%). Pacjenci
z nieprawidłowym odsetkiem plemników AB -negatywnych (<70%) mieli statystycznie istotnie niższą koncentrację plemników w porównaniu
do badanych, u których wykazano ≥70% komórek AB -negatywnych (mediana: 18,7 vs. 60,6 mln/mL). Z kolei, pacjenci z odsetkiem
≥4% plemników o prawidłowej morfologii mieli istotnie wyższy odsetek plemników AB -negatywnych (mediana: 49,7 vs. 36,9%).
Dojrzałość chromatyny plemników korelowała z waukolizacją główki plemnika w obrębie regionu postakrosomalnego (rs = 0,46) oraz
z koncentracją leukocytów w nasieniu (rs = −0,26).
Interpretacja i wnioski. Wyniki sugerują, że zaburzeniom koncentracji i morfologii plemników, jak również liczby leukocytów w ejakulacie
mogą towarzyszyć nieprawidłowości przebudowy chromatyny plemników manifestujące się zwiększoną ilością histonów jądrowych.
Słowa kluczowe: plemniki, chromatyna, kondensacja DNA, niepłodność męska
Abstract
Background and objectives. Th e basic semen analysis not always clearly indicate the cause of fertility problems in men. One of the additional
diagnostic method is assessment of sperm chromatin maturity refl ecting proper remodeling and condensation of the genetic material during
spermiogenesis. Th e aim of the study was to fi nd the relationship between the basic parameters of semen and sperm chromatin maturity.
Material and methods. Th e standard semen analysis (WHO, 2010) was carried out on spermatozoa of men (n = 63) of infertile couples.
Th e staining with acidic solution of aniline blue (AB) (red – mature chromatin, blue – immature chromatin) was used to evaluate the
sperm chromatin maturity.
Results. Th e proportion of mature sperm chromatin (AB -negative cells) was in the range 8–83 (median 45%). Patients with abnormal
percentage of AB -negative sperms (<70%) had a signifi cantly lower concentration of spermatozoa in comparison to subjects with
AB -negative cells ≥70% (median 18.7 vs. 60.6 million / mL). On the other hand, patients with percentage of sperm cells with normal
morphology ≥4% had signifi cantly higher percentage of AB -negative spermatozoa (median 49.7 vs. 36.9%). Th e maturity of the sperm
chromatin correlated with the sperm head vacuolisation within the postacrosomal region (rs = 0.46), and the concentration of leukocytes
in the semen (rs = −0.26).
Interpretation and conclusions. Th e results suggest that disorders of sperm concentration and morphology as well as the number of
leukocytes in the ejaculate may be accompanied by abnormalities of sperm chromatin remodeling manifested by an increased amount
of nuclear histones.
Key words: spermatozoa, chromatin, DNA condensation, male infertility
Skróty / Abbreviations
AB – błękit aniliny (ang. aniline blue), WHO – Światowa Organizacja Zdrowia (ang. World Health Organization)
Wstęp
Chromatyna, struktura występująca w jądrze komórkowym,
zbudowana jest z DNA, białek histonowych i niehistonowych.
Chromatyna zawarta w plemnikach dzięki
obecności protamin charakteryzuje się znacznie większą
kondensacją niż chromatyna komórek somatycznych.
Taka budowa materiału genetycznego pozwala na znaczne
zmniejszenie wielkości jądra komórkowego i umożliwia
szybkie dostarczenie ojcowskiego materiału genetycznego,
ale przede wszystkim warunkuje jego odporność
na działanie czynników fi zycznych oraz chemicznych
w trakcie wędrówki plemników przez męski, a następnie
żeński układ płciowy do bańki jajowodu, gdzie następuje
zapłodnienie (Björndahl i Kvist, 2010, 2014; Francis i wsp.,
2014; Gawecka i wsp., 2015; Miller, 2015).
Kondensacja materiału genetycznego w plemnikach
odbywa się w czasie przekształcania spermatyd w plemniki
(końcowy etap procesu spermatogenezy) (Kazienko
i wsp., 2012). W tym procesie białka histonowe zostają
zastąpione przez inne, bardziej zasadowe białka, tzw.
protaminy, bogate w argininę i cysteinę. Duża zawartość
argininy warunkuje tworzenie silnych wiązań między
cząsteczkami DNA, podczas gdy cysteina (utlenianie
grup tiolowych SH) umożliwia tworzenie wiązań disiarczkowych
zarówno wewnątrz, jak i między cząsteczkami
protaminy, co powoduje zdecydowanie większą kondensację
materiału genetycznego w główce plemnika
(Björndahl i Kvist, 2010; Rathke i wsp., 2014; Wiland i wsp.,
2006). Protaminy w połączeniu z DNA tworzą struktury
zwane toroidami, zbudowane z silnie upakowanych
pętli DNA powiązanych i stabilizowanych jonami cynku
oraz cysteiną (Björndahl i Kvist, 2010, 2011; Ward, 2010).
Plemniki, w których wymiana histonów na protaminy
nie dokonała się, nie mają odpowiedniej kondensacji
chromatyny (niedojrzała chromatyna), a tym samym
nie mają dostatecznej ochrony materiału genetycznego,
co może prowadzić do fragmentacji i uszkodzeń DNA
(Björndahl i Kvist, 2010, 2011; Francis i wsp., 2014).
Ocena jakościowa i ilościowa nasienia jest podstawowym
badaniem służącym do oceny stanu płodności
u mężczyzn. Wieloletnie obserwacje pozwoliły
stwierdzić, iż podstawowe badanie nasienia nie jest
wystarczające do jednoznacznej oceny płodności mężczyzny
oraz dokładnego określenia przyczyny niepłodności
(Björndahl, 2011; Cooper i wsp., 2010; Kazienko i wsp.,
2012; Pizzol i wsp., 2014; WHO, 2010). Wykluczenie czynnika
męskiego w niepłodności partnerskiej tylko na podstawie
badania nasienia skłania lekarzy do wykonywania
u kobiety badań, które są często inwazyjne i kosztowne.
Powoduje to jednocześnie rosnący stres u obojga partnerów,
co ma niekorzystny wpływ na czynność gonad
i utrudnia prokreację (Boivin i Gameiro, 2015). Z drugiej
strony odstępstwa od wartości referencyjnych w podstawowym
badaniu nasienia nie zawsze łączą się z niemożnością
uzyskania ciąży (Buck Louis i wsp., 2014; Jørgensen
i wsp., 2012 ).
Ocena dojrzałości chromatyny plemników może być
jednym z dodatkowych badań nasienia, które umożliwi
diagnostykę przyczyn męskiej niepłodności. Budowa
materiału genetycznego gamety męskiej wpływa bowiem
na zdolność plemników do zapłodnienia oraz na rozwój
zarodka. Prawidłowa dojrzałość chromatyny plemników
wskazuje na większą szansę osiągnięcia samoistnej ciąży
oraz może ułatwić kwalifi kację pacjenta do zastosowania
technik wspomaganego rozrodu pomimo obniżonych
wartości podstawowych parametrów nasienia. Wpływa
także na zwiększenie prawdopodobieństwa urodzenia
zdrowego dziecka (Boe -Hansen i wsp., 2006; Boitrelle i wsp.,
2015; Gawecka i wsp., 2015; Zhao i wsp., 2014; Zini i wsp.,
2014). Zatem celem niniejszych badań było znalezienie
związku między podstawowymi parametrami nasienia
a dojrzałością chromatyny plemników.
Materiał i metody
Badania wykonano¹
1 Procedura badań była pozytywnie zaopiniowana przez Komisję
Bioetyczną Uniwersytetu Medycznego w Łodzi – numer zezwolenia
RNN/125/12/KE.
na ejakulowanych plemnikach uzyskanych
od mężczyzn (n = 63) w wieku 20–58 lat (33 ±6), którzy byli
pacjentami Poradni Andrologii i Endokrynologii Płodności przy
Uniwersyteckim Szpitalu Klinicznym im. Wojskowej Akademii
Medycznej w Łodzi, z powodu niepłodności pary. Mężczyźni
otrzymali informację na temat badania i wyrazili pisemną zgodę
na uczestnictwo w badaniu. Wykluczono pacjentów z azoospermią.
Podstawowe badanie seminologiczne (objętość i pH nasienia,
koncentracja, całkowita liczba plemników w ejakulacie, ruchliwość,
żywotność i morfologia plemników) wykonano zgodnie z rekomendacjami
ŚWIATOWEJ Organizacji Zdrowia (WHO, ang. World Healt
Organization) z 2010 r. (WHO, 2010). Morfologię męskich gamet
oceniano na podstawie barwienia rozmazów plemników metodą
Papanicolaou. Weryfi kowano obecność wakuoli w regionie akrosomalnym
i postakrosomalnym i wyrażano jako wartość odsetka
plemników, u których te zjawiska stwierdzono. Na podstawie standardowej
oceny nasienia wyróżniono następujące kategorie seminologiczne:
normozoospermia– 23 przypadki; oligozoospermia
(koncentracja plemników <15 mln/mL) 21 przypadków; astenozoospermia
(ruch postępowy <32%) 16 przypadków; teratozoospermia
(odsetek prawidłowych plemników <4%) 23 przypadki. W tej grupie
znaleźli się również pacjenci z więcej niż jednym parametrem badania
ogólnego odbiegającym od wartości referencyjnej, tj. z astenoteratozoospermią
– 5 przypadków; oligoteratozoospermią – 3 przypadki;
oligoastenozoospermią – 2 przypadki i z oligoastenoteratozoospermią
– 5 przypadków. Natywne próbki nasienia zamrażano
w temp. −20oC do czasu wykonania oceny chromatyny plemników
(ok. 2 mies.). Po rozmrożeniu nasienie było płukane roztworem
soli fi zjologicznej i odwirowywane przy prędkości 3000 g przez 5
minut. Czynność tę powtarzano dwukrotnie.
Do oceny dojrzałości chromatyny plemników wykorzystana
została metoda barwienia kwaśnym błękitem aniliny (AB, ang. aniline
blue) za pomocą dostępnego komercyjnie testu (SpermFunc® Histone,
BRED Life Science Technology Inc., Chiny). W skład testu wchodziły:
bufor fosforanowy, bufor TRIS (2 -Amino -2 -hydroxymethyl -propa
ne -1,3 -diol), roztwór błękitu aniliny, roztwór ksantenu oraz formaldehyd
4% (w/v). Barwienie wykonano według instrukcji producenta.
Barwienie błękitem aniliny umożliwia weryfi kację plemników
z obecnością resztkowych histonów, bowiem barwnik ten selektywnie
łączy się z bogatymi w lizynę histonami i ujawnia anomalię
w kondensacji chromatyny plemników (Sellami i wsp., 2013). W teście
tym plemniki charakteryzujące się pełną dojrzałością chromatyny
(bez resztkowych histonów, komórki AB -negatywne) mają główki
zabarwione na kolor czerwony (rycina 1). Z kolei plemniki z nieprawidłowo
skondensowaną chromatyną (komórki AB-pozytywne),
w której obecne są w dużej ilości resztkowe histony, mają główki
zabarwione na niebiesko. Według sugestii producenta testu plemniki
zabarwione na kolor pośredni zaliczono do nieprawidłowych.
Dolna wartość referencyjna dla plemników z prawidłowo dojrzałą
chromatyną – wg producenta – to 70%. Ocenę dojrzałości chromatyny
plemników przeprowadzono w mikroskopie świetlnym, stosując
powiększenie ×1000 (Nikon Eclipse E600, Japonia).
Uzyskane wyniki zaprezentowano, podając przedział zmienności,
medianę, średnią arytmetyczną i odchylenie standardowe.
Zgodność rozkładu zmiennych ciągłych z rozkładem normalnym
sprawdzono za pomocą testu Shapiro–Wilka, przyjmując zgodność
na poziomie istotności p > 0,05 (>5%). Porównanie dwóch grup niezależnych
w zakresie badanych zmiennych dokonano, stosując nieparametryczny
test istotności U Manna–Whitneya. Współzależność
zmiennych zweryfi kowano, obliczając współczynniki korelacji rang
Spearmana. Poziom istotności statystycznej przyjęto dla p < 0,05.
Wyniki
Wyniki standardowej oceny seminologicznej wraz z oceną
dojrzałości chromatyny plemników (mediana: 45%,
zakres: 8–83%) przedstawiono w tabeli 1. Tylko w przypadku
8 mężczyzn (12,7%) spośród 63 badanych stwierdzono
≥70% plemników z prawidłowo dojrzałą chromatyną.
Porównując standardowe parametry seminologiczne
między grupą mężczyzn, u których wykazano ≥70% plemników
AB–negatywnych (komórki z dojrzałą chromatyną)
a grupą badanych, u których stwierdzono <70% plemników
AB-negatywnych, różnicę statystycznie istotną
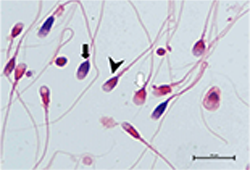
Ryc. 1. Mikroskopowa ocena dojrzałości chromatyny plemników barwionych kwaśnym błękitem aniliny (AB) i roztworem ksantenowym. Strzałka biała –
plemniki z dojrzałą chromatyną (główki plemników czerwone, komórki AB-negatywne), strzałka czarna – plemniki z niedojrzałą chromatyną (główki
plemników ciemnoniebieskie, komórki AB-pozytywne), grot strzałki – pośrednie formy plemników zakwalifi kowane jako niedojrzałe (główki plemników
ciemnoniebieskie i częściowo czerwone, komórki AB-pozytywne). Skala = 10 μm
Fig. 1. Microscopic evaluation of chromatin maturity of sperm stained with acidic aniline blue (AB) xanten solution. White arrow – sperm cells with
mature chromatin (red sperm head, AB-negative cells), black arrow – sperm cells with immature chromatin (dark blue sperm head, AB-positive cells),
arrowhead – sperm cells with intermediate stain included into immature (dark blue and partly red sperm head, AB-positive cells). Scale bar = 10 μm
Tabela 1. Wyniki standardowej oceny seminologicznej oraz testu z błękitem aniliny (AB) (n = 63)
Table 1. Descriptive statistics of standard semen and aniline blue (AB) analyses (n = 63)

(p = 0,01) wykazano tylko w przypadku koncentracji
męskich gamet. Mężczyźni, u których odsetek plemników
z dojrzałą chromatyną wynosił ≥70, wykazywali istotnie
wyższą koncentrację plemników w ejakulacie (mediana:
60,6 vs. 18,7 mln/mL) (rycina 2). Z kolei, porównując
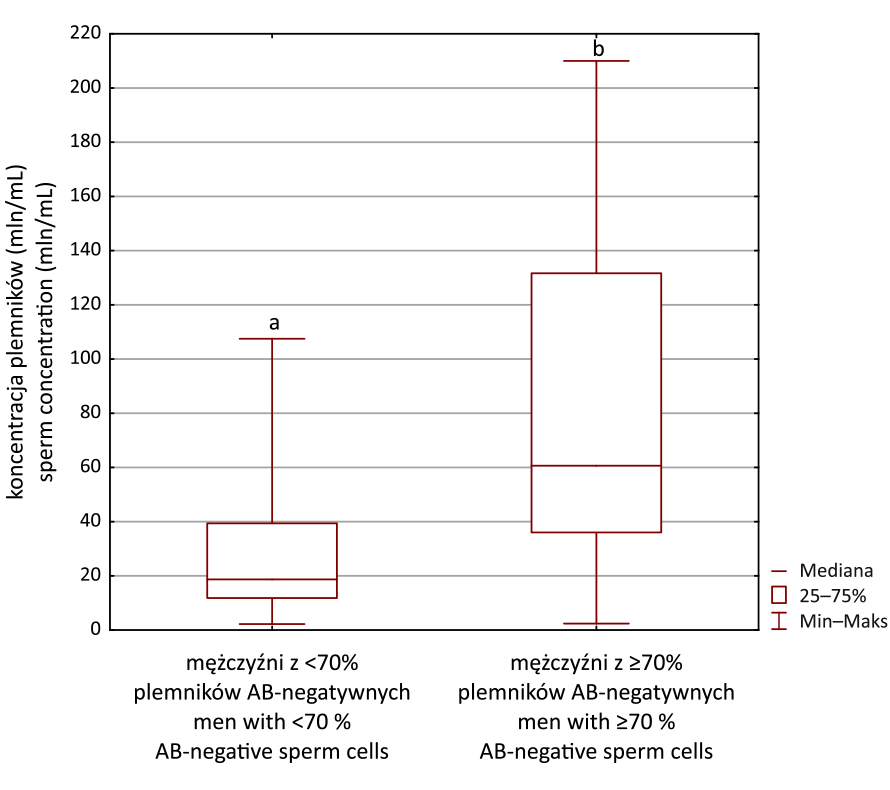
mężczyzn z ≥4% (n = 40) i <4% (n = 23) plemników o prawidłowej
morfologii stwierdzono statystycznie istotnie
(p = 0,015) wyższy odsetek plemników AB -negatywnych
w grupie mężczyzn z prawidłową morfologią plemników
(mediana: 49,7 vs. 36,9%) (rycina 3). Ponadto, analiza
korelacji rang Spearmana² ujawniła statystycznie istotne
(p < 0,05) zależności między odsetkiem plemników
AB -negatywnych a odsetkiem plemników zawierających
wakuole w obrębie regionu postakrosomalnego główki
2 Przyp. red.: uzyskane wartości współczynnika korelacji interpretowano
w następujący sposób: <0,2 – brak związku liniowego; 0,2–0,4 – słaba
zależność; 0,4–0,7 – umiarkowana zależność; 0,7–0,9 – silna zależność;
>0,9 – bardzo silna zależność
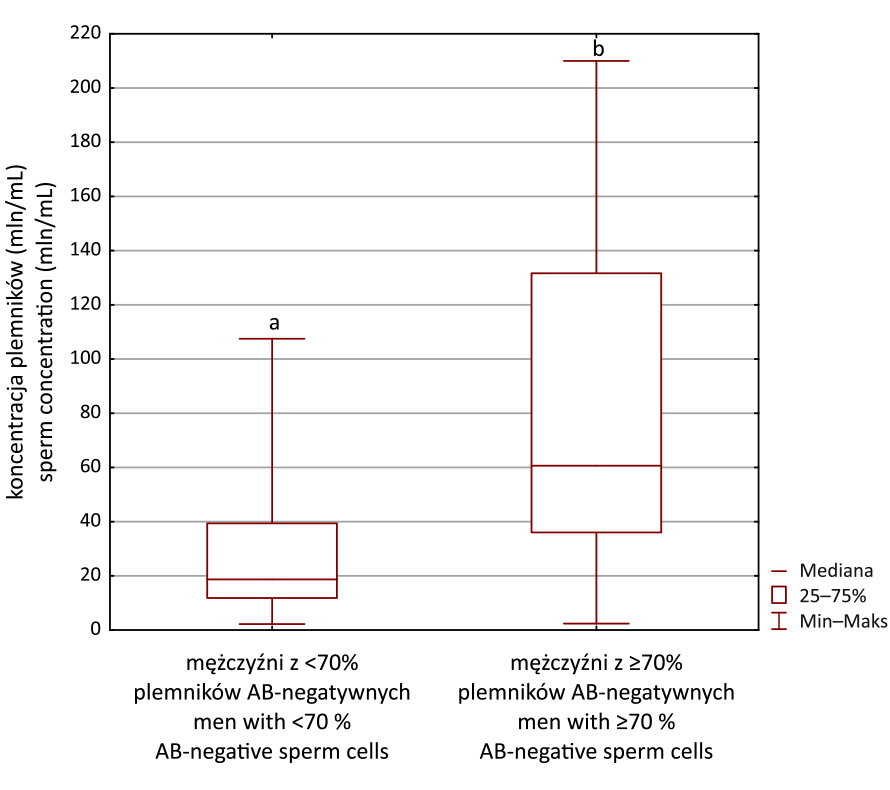
Ryc. 2. Porównanie koncentracji plemników w nasieniu mężczyzn z <70%
(n = 55) i ≥70% (n = 8) plemników AB-negatywnych (test z błękitem aniliny).
Test U Manna–Whitneya, ab: p = 0,01
Fig. 2. Comparison of sperm concentration between subjects with <70%
(n = 55) and with ≥70% (n = 8) AB-negative sperm cells (aniline blue assay).
Manna–Whitney U-test, diff erent letters (ab) denote signifi cant diff erence
between compared groups, p = 0.01
 alt="porównanie_Ryc.2_Fig.png" />
alt="porównanie_Ryc.2_Fig.png" />
Ryc. 3. Porównanie odsetka plemników AB-negatywnych (test z błękitem
aniliny) między grupami mężczyzn z <4% (n = 23) i ≥4% (n = 40) plemników
z prawidłową morfologią. Test U Manna–Whitneya, ab: p = 0,015
Fig. 3. Comparison of the percentage of AB-negative sperm cells (aniline blue
assay) between groups with <4% (n = 23) and with ≥4% (n = 40) spermatozoa
with normal morphology. Mann–Whitney U test, diff erent letters (ab) denote
signifi cant diff erence between compared groups, p = 0.015
Tabela 2. Korelacja rang Spearmana (rs) między wynikami test z błękitem aniliny (plemniki AB-negatywne) a wiekiem mężczyzn
oraz standardowymi parametrami seminologicznymi (n = 63)
Table 2. Correlation (rank Spearman correlation coeffi cient – rs) of aniline blue assay (AB-negative sperm cells) with age
and parameters of standard semen analysis (n = 63)
 Parametr / Parameter / rs / p
Parametr / Parameter / rs / p
Wiek (lata) / Age (years) −0,050 0,697
Objętość (mL) / Volume (mL) 0,007 0,955
Koncentracja plemników (mln/mL) / Sperm concentration
(mln/mL) −0,048 0,704
Całkowita liczba plemników (mln/ejakulat)
/ Total sperm number (mln/ejaculate) −0,050 0,692
Plemniki ruchliwe (%) / Motile sperm cells (%) 0,042 0,740
Plemniki z ruchem postępowym (%) / Sperm cells with progressive motility
(%) 0,114 0,370
Plemniki z brakiem ruchu (%) / Immotile sperm cells 0,001 0,988
Żywotność plemników (% plemników eozyno-negatywnych) / Sperm vitality (% eosine-negative sperm cells) 0,050 0,694
Plemniki z prawidłową morfologią (%) / Sperms with normal morphology (%) 0,063 0,620
Plemniki z wakuolami w regionie akrosomalnym (%) / Sperm cells with vacuoles in the acrosomal region (%) 0,124 0,332
Plemniki z wakuolami w regionie postakrosomalnym (%)
/ Sperm cells with vacuoles in the postacrosomal region (%)
0,456 <0,0001
Plemniki z resztkową cytoplazmą (%) / Sperm cells with residual cytoplasm (%) −0,145 0,254
Koncentracja komórek okrągłych (mln/mL) / Round cells concentration (mln/mL) −0,214 0,091
Koncentracja leukocytów (mln/mL) / Leukocyte concentration (mln/mL) −0,257 0,041
p < 0,05 – korelacja statystycznie istotna; p < 0.05 – correlation statistically signifi cant
plemnika (rs = 0,46) oraz między koncentracją leukocytów
(rs = −0,26). W przypadku pozostałych parametrów nie
stwierdzono statystycznie istotnych korelacji (tabela 2).
Na podstawie wielkości współczynnika korelacji można
przyjąć istnienie umiarkowanej zależności między dojrzałością
chromatyny a odsetkiem plemników z wakuolami
w regionie postakrosomalnym oraz istnienie słabej zależności
między koncentracją leukocytów. Dokonano analizy
korelacji między odsetkiem plemników AB -negatywnych
a morfologią plemników w grupie mężczyzn o prawidłowej
morfologii (z ≥4%, n = 40) oraz osobno u mężczyzn
z teratozoospermią i uzyskano wartości nieznamienne
statystycznie (odpowiednio rs = −0,16 i rs = −0,07).
Dyskusja
Wraz z postępem medycyny oraz rozwojem nowych
możliwości diagnostycznych nasuwają się wątpliwości
co do wystarczającej roli podstawowego badania nasienia
w diagnostyce niepłodności u mężczyzn, zwłaszcza w tzw.
niepłodności idiopatycznej. Opracowanie nowych technik
pozwalających na bardziej szczegółową analizę poszczególnych
elementów ejakulatu umożliwia uzyskanie
nowych informacji na temat jakości nasienia. Między
innymi standardowa ocena seminologiczna nie daje pewności
co do zdolności plemników do zapłodnienia komórki
jajowej i dalszego rozwoju zarodka. Tymczasem nowe
metody diagnostyczne mogą wykazać zmiany w komórkach
na poziomie molekularnym, np. związane z materiałem
genetycznym (Iranpour, 2014; Krausz i wsp., 2015).
Tego typu analizy wydają się szczególnie ważne w przypadku
kwalifi kacji pacjenta do technik wspomaganego
rozrodu (Kazerooni i wsp., 2009; Kazienko i wsp., 2012).
W niniejszej pracy jako badanie dodatkowe zastosowano
ocenę dojrzałości chromatyny plemników (test
z AB). Według zaleceń producenta testu za wartość referencyjną
uznano ≥70% plemników z prawidłową dojrzałością
chromatyny (komórki AB -negatywne). Wśród mężczyzn
z niepłodnych par tylko u 12,7% (8 z 63 badanych)
wykazano nasienie z odsetkiem plemników ≥70% z prawidłowo
dojrzałą chromatyną. Niektórzy autorzy (Auger
i wsp., 1990; Sellami i wsp., 2013; Zhang i wsp., 2015) uznają
jednak wartość 80% plemników z prawidłową dojrzałością
chromatyny za dolną granicę wartości referencyjnej.
Przy takim założeniu jeszcze mniejszy odsetek mężczyzn
(1,6%) biorących udział w opisywanym badaniu miałby
prawidłowe pod tym względem plemniki.
Poszukuje się związku między dojrzałością chromatyny
plemników a standardowymi parametrami seminologicznymi
(Kim i wsp., 2013; Sellami i wsp., 2013),
co pozwoliłoby na dalsze prawidłowe postępowanie
diagnostyczne i terapeutyczne. W pracy Bianchi i wsp.
(1996) wykazano zależność między niedojrzałością
chromatyny plemników a obniżeniem koncentracji oraz
żywotności plemników. Pacjenci z dużym odsetkiem
plemników z nieprawidłową dojrzałością chromatyny
mieli znamiennie niższą koncentrację plemników niż
pacjenci z dużym odsetkiem plemników z prawidłową
dojrzałością chromatyny, co może wskazywać na upośledzenie
procesu przekształcania spermatyd w plemniki
w nabłonku plemnikotwórczym. Ponadto, Bianchi
i wsp. (1996) nie uzyskali korelacji między dojrzałością
chromatyny plemników a ich morfologią, co było zgodne
z wynikami badań autorskich, jednak mężczyźni z teratozoospermią
(<4% plemników o prawidłowej budowie)
mieli istotnie niższy odsetek plemników z dojrzałą chromatyną
(rycina 3). Podobne wyniki uzyskali Boitrelle
i wsp. (2012). Wykazali oni, że niedojrzała chromatyna
występowała częściej w plemnikach o nieprawidłowej
morfologii (z wakuolami). Z kolei, Monte i wsp. (2013)
nie stwierdzili statystycznie istotnych różnic w odsetku
plemników z prawidłową dojrzałością chromatyny
pomiędzy grupami mężczyzn z odsetkiem plemników
z prawidłową morfologią (≥4%) i nieprawidłową (<4%).
Nie można jednak wykluczyć, że plemniki morfologicznie
prawidłowe oceniane w mikroskopie świetlnym
nie mają zmian molekularnych chromatyny. Boitrelle
i wsp. (2015) sugerują, że nawet w przypadku plemnika
o prawidłowej strukturze mogą mieć miejsce zaburzenia
np. kondensacji jego chromatyny. Konsekwencją tego
zjawiska jest zwiększone ryzyko użycia plemnika
o takim typie zaburzenia w technikach rozrodu wspomaganego.
Potwierdzają to prace wykazujące, że problem
uzyskania i utrzymania ciąży związany jest z nieprawidłową
dojrzałością chromatyny (Dogan i wsp., 2015;
Hammadeh i wsp., 1998; Kazerooni i wsp., 2009; Talebi
i wsp., 2012, 2016).
W przedstawianej pracy stwierdzono istotną statystycznie
zależność, według której rosnącemu odsetkowi
plemników z dojrzałą chromatyną towarzyszył wzrost
odsetka plemników z wakuolizacją w regionie postakrosomalnym.
Jest to zjawisko trudne do wytłumaczenia,
ponieważ pochodzenie wakuoli w plemnikach jest zjawiskiem
słabo poznanym. Według zaleceń WHO (2010)
najwyżej dwie jasne, małe wakuole zajmujące ≤20% prawidłowej
powierzchni główki w części akrosomalnej uważa
się za zjawisko prawidłowe. Część postakrosomalna nie
powinna zawierać wakuoli, a jeśli są obecne, takie plemniki
zalicza się do nieprawidłowych morfologicznie (Park
i wsp., 2014; WHO, 2010). W badanej grupie pacjentów
zjawisko występowania wakuoli w regionie postakrosomalnym
jest dość słabo wyrażone (mediana 4%), wartość
maksymalna 17% (tabela 1). Należałoby zbadać to zjawisko
u pacjentów, u których wakuolizacja jest nasilona.
Wakuole mogą powstawać w procesie dojrzewania
plemników. Pierwsze wakuole w główce plemnika pojawiają
się pod koniec procesu spermatogenezy. W obrębie
najądrzy plemniki podlegają dalszym zmianom morfologicznym,
jak i czynnościowym (Cooper, 2007). Pojawia się
coraz więcej wakuoli, ale o małych rozmiarach (Tanaka
i wsp., 2012). Tak więc plemniki zbyt wcześnie uwolnione
z nabłonka plemnikotwórczego do światła dróg
wyprowadzających nasienie i zbyt krótko przebywające
w najądrzach charakteryzują się brakiem pełnej dojrzałości
morfologicznej, a jednocześnie mogą zawierać małą
ilość wakuoli.
Powstawanie wakuoli w główkach plemników może
być zjawiskiem patologicznym. Perdrix i Rives (2013)
wysunęli hipotezę, według której występowanie dużych
wakuoli w plemnikach może być bezpośrednio związane
z anomaliami na poziomie materiału genetycznego,
w szczególności z niedojrzałością chromatyny. Hipoteza
ta została potwierdzona poprzez wykazanie, że dojrzałość
chromatyny jest wyższa w plemnikach całkowicie
pozbawionych wakuoli. Stwierdzono bowiem, że obecność
>3, nawet małych, wakuoli w obrębie główki plemnika
świadczy o zaburzeniach protaminacji materiału
genetycznego (Boitrelle i wsp., 2012, 2015; Garolla i wsp.,
2008; Khalifa i wsp., 2008; Setti i wsp., 2013; Tamburrino
i wsp., 2012). Cassuto i wsp. (2012) wykazali, że plemniki
z nieprawidłowościami w obrębie główek mają dwukrotnie
wyższy odsetek zaburzeń chromatyny. Ponadto
autorzy ci pokazali silne, dodatnie korelacje między obecnością
dużych wakuoli a niskim stopniem protaminacji
plemników.Osobnym zagadnieniem, które zasługuje na uwagę,
jest obecność wakuoli powstałych na skutek procedur
stosowanych w podstawowym badaniu nasienia, m.in.
z powodu inkubacji w temp. 37ºC, a także na skutek
działania wolnych rodników tlenowych znajdujących
się w powietrzu atmosferycznym (Peer i wsp., 2007;
Perdrix i Rives, 2013; Setti i wsp., 2013). Udowodniono
także, iż zamrażanie i rozmrażanie próbki nasienia (tak
jak w omawianych badaniach) powoduje wystąpienie
przedwczesnej reakcji akrosomalnej, a co za tym idzie
nadmierny wyrzut enzymów uszkadzających nukleoproteiny
(Boitrelle i wsp., 2012). Dodatkowo płukanie
plemników może prowadzić do zmniejszenia ilości białek
w nasieniu oraz do inaktywacji antyoksydantów, co prowadzi
do zmniejszenia stabilności DNA.
Źródłem dużej ilości wolnych rodników tlenowych,
które są przyczyną stresu oksydacyjnego uszkadzającego
m.in. DNA plemników, są leukocyty (Walczak-
-Jędrzejowska i wsp., 2014). Podczas toczącego się stanu
zapalnego w układzie moczowo -płciowym u mężczyzn
w nasieniu można wykazać obecność białych krwinek
(leukocytów). Najczęściej dotyczy to stanów zapalnych
gruczołów dodatkowych (prostaty, pęcherzyków nasiennych),
nie można jednak wykluczyć jądrowego pochodzenia
stanu zapalnego (Weidner i wsp., 2013). Jednym
z powikłań może być zaburzenie spermatogenezy zachodzącej
w jądrach (Krause, 2008). Jak wcześniej zaobserwowano,
materiał genetyczny plemnika dojrzewa
na poziomie spermatydy, w związku z czym toczący
się w obrębie jąder stan zapalny, wpływając na proces
spermatogenezy, powiązany jest z obniżoną dojrzałością
plemników opuszczających przedwcześnie nabłonek
plemnikotwórczy. La Vignera i wsp. (2015) podkreślają,
że obecność leukocytów w nasieniu nie jest jedynie odpowiedzią
na pojawiające się mikroorganizmy, ale także ich
zadaniem jest usuwanie niedojrzałych komórek spermatogenezy
uwalnianych z nabłonka plemnikotwórczego.
Dzięki temu w nasieniu współistnieje podwyższona
liczba niedojrzałych męskich gamet wraz z podwyższoną
koncentracją leukocytów. W niniejszej pracy obserwacja
ta została potwierdzona poprzez ujemną korelację
pomiędzy odsetkiem plemników z dojrzałą chromatyną
a koncentracją leukocytów w nasieniu.
Podsumowanie
Na podstawie uzyskanych wyników wydaje się, że zaburzeniom
koncentracji i morfologii plemników, jak również
liczby leukocytów w ejakulacie mogą towarzyszyć nieprawidłowości
przebudowy chromatyny plemników manifestujące
się zwiększoną ilością histonów jądrowych.
Na uwagę zasługuje fakt, że zaburzenia kondensacji chromatyny
plemników dotyczą znacznej grupy pacjentów
leczonych z powodu niepłodności. Należy jednak podkreślić,
że ze względu na małą liczebność grupy badawczej
reprezentowanej przez mężczyzn leczonych z powodu
niepłodności oraz brak grupy odniesienia (zdrowi mężczyźni
z normozoospermią i/lub płodni) uzyskane zależności
wymagają potwierdzenia w dalszych badaniach
Podziękowania
Praca sponsorowana z działalności statutowej
Uniwersytetu Medycznego w Łodzi nr 503/1 -089 -03/
503 -01 oraz grantu Narodowego Centrum Nauki UMO-
-2012/05/B/NZ5/01308.
Piśmiennictwo
Auger J., Mesbah M., Huber C., Dadoune J.P.: Aniline blue staining as a marker
of spermchromatin defects associated with diff erent semen characteristics
di scriminates between proven fertile and suspected infertile men. Int
J Androl. 1990, 13 (6), 452–462. PMID: 1710607.
Bianchi P.G., Manicardi G.C., Urner F., Campana A., Sakkas D.: Chromatin
packing and morphology in ejaculated human spermatozoa: evidence of
hidden anomalies in normal spermatozoa. Mol Hum Reprod. 1996, 2 (3),
139–144. PMID: 9238672.
Björndahl L.: What is normal semen quality? On the use and abuse of reference
limits for the interpretation of semen analysis results. Hum Fertil
(Camb). 2011, 14 (3), 179–186. doi: 10.3109/14647273.2011.580823. PMID:
21770820.
Björndahl L., Kvist U.: A model for the importance of zinc in the dynamics
of human sperm chromatin stabilization after ejaculation in relation
to sperm DNA vulnerability. Syst Biol Reprod Med. 2011, 57, 86–92. doi:
10.3109/19396368.2010.516306. PMID: 21204594.
Björndahl L., Kvist U.: Human sperm chromatin stabilization: a proposed
model including zinc bridges. Mol Hum Reprod. 2010, 16 (1), 23–29. doi:
10.1093/molehr/gap099. PMID: 19933313.
Björndahl L., Kvist U.: Structure of chromatin in spermatozoa. Adv Exp Med
Biol. 2014, 791, 1–11. doi: 10.1007/ 978 -1 -4614 -7783 -9_1. PMID: 23955669.
Boe -Hansen G.B., Fedder J., Ersbøll A.K., Christensen P.: Th e sperm chromatin
structure assay as a diagnostic tool in the human fertility clinic. Hum
Reprod. 2006, 21 (6), 1576–1582. PMID: 16543258.
Boitrelle F., Albert M., Th eillac C., Ferfouri F., Bergere M., Vialard F. i wsp.:
Cryopreservation of human spermatozoa decreases the number of motile
normal spermatozoa, induces nuclear vacuolization and chromatin decondensation.
J Androl. 2012, 33 (6), 1371–1378. doi: 10.2164/jandrol.112.016980.
PMID: 22700764.
Boitrelle F., Pagnier M., Athiel Y., Swierkowski -Blanchard N., Torre A., Alter L.
i wsp.: A human morphologically normal spermatozoon may have noncondensed
chromatin. Andrologia. 2015, 47(8), 879–886. doi: 10.1111/
and.12341. PMID: 25220830.
Boivin J., Gameiro S.: Evolution of psychology and counseling in infertility.
Fertil Steril. 2015, 104 (2), 251–259. doi: 10.1016/j.fertnstert.2015.05.035.
PMID: 26092131.
Buck Louis G.M., Sundaram R., Schisterman E.F., Sweeney A., Lynch C.D., Kim S.
i wsp.: Semen quality and time to pregnancy: the Longitudinal Investigation
of Fertility and the Environment Study. Fertil Steril. 2014, 101 (2), 453–462.
doi: 10.1016/j.fertnstert.2013.10.022. PMID: 24239161.
Cooper T.G.: Sperm maturation in the epididymis: a new look at an old problem.
Asian J Androl. 2007, 9, 533–539.
Cooper T.G., Noonan E., von Eckardstein S., Auger J., Baker H.W., Behre H.M.
i wsp.: World Health Organization reference values for human semen characteristics.
Hum Reprod Update. 2010, 16 (3), 231–245. doi: 10.1093/humupd/
dmp048. PMID: 19934213.
Dogan S., Vargovic P., Oliveira R., Belser LE., Kaya A., Moura A. i wsp.: Sperm
protamine -status correlates to the fertility of breeding bulls. Biol Reprod.
2015, 92 (4), 1–9. doi: 10.1095/biolreprod.114.124255. PMID: 25673563.
Francis S., Yelumalai S., Jones C., Coward C.: Aberrant protamine in sperm and
consequential implications for infertility treatment. Hum Fertile (Camb).
2014, 17 (2), 80–89. doi: 10.3109/14647273.2014.915347. PMID: 24869677.
Garolla A., Fortini D., Menegazzo M., De Toni L., Nicoletti V., Moretti A. i wsp.:
High -power microscopy for selecting spermatozoa for ICSI by physiological
status. Reprod Biomed Online. 2008, 17 (5), 610–616. PMID: 18983744.
Gawecka J.E., Ribas -Maynou J., Benet J., Ward W.S.: A model for the control
of DNA integrity by the sperm nuclear matrix. Asian J Androl. 2015, 17 (4),
610–615. doi: 10.4103/1008 -682X.153853. PMID: 25926613.
Hammadeh M.E., Stieber M., Haidl G., Schmidt W.: Association between sperm
cell chromatin condensation, morphology based on strict criteria, and fertilization,
cleavage and pregnancy rates in an IVF program. Andrologia.
1998, 30 (1), 29–35. PMID: 9567167.
Iranpour F.G.: Th e eff ects of protamine defi ciency on ultrastructure of human
sperm nucleus Adv Biomed Res. 2014, 3, 24. doi: 10.4103/2277 -9175.124666
PMID: 24592371.
Jørgensen N., Joensen U.N., Jensen T.K., Jensen M.B., Almstrup K., Olesen I.A.
i wsp.: Human semen quality in the new millennium: a prospective cross-
-sectional population -based study of 4867 men. BMJ Open. 2012, 2 (4).
doi: 10.1136/bmjopen -2012 -000990. PMID: 22761286.
Kazerooni T., Asadi N., Jadid L., Kazerooni M., Ghanami A., Ghaff arpasand F.
i wsp.: Evaluation of sperm’s chromatin quality with acridine orange test,
chromomycin A3 and aniline blue staining in couples with unexplained
abortion. J Assist Reprod Genet. 2009, 26 (11–12), 591–596. doi: 10.1007/
s10815 -009 -9361 -3. PMID: 19894107.
Kazienko A., Piasecka M., Rymaszewska A., Gączarzewicz D., Kurzawa R.,
Frączek M. i wsp.: Molekularne markery niepłodności męskiej: zmiany polimorfi
czne genów białek chromatyny plemnika – część I. Postępy Biologii
Komórki. 2012, 39 (3), 345–370.
Khalifa T.A.A., Rekkas C.A., Lymberopoulos A.G., Sioga A., Dimitriadis I.,
Papanikolaou Th .: Factors aff ecting chromatin stability of bovine spermatozoa.
Anim Reprod Sci. 2008, 104 (2–4), 143–163. PMID: 17398042.
Kim H.S., Kang M.J., Kim S.A., Oh S.K., Kim H., Ku S.Y. i wsp.: Th e utility of
sperm DNA damage assay using toluidine blue and aniline blue staining
in routine semen analysis. Clin Exp Reprod Med. 2013, 40 (1), 23–28. doi:
10.5653. PMID:23614112.
Krause W.: Male accessory gland infection. Andrologia. 2008, 40 (2), 113–
116. doi: 10.1111/j.1439 -0272.2007.00822.x. PMID: 18336461.
Krausz C., Escamilla A.R., Chianese C.: Genetics of male infertility: from
research to clinic. Reproduction. 2015, 150(5), 159–174. doi: 10.1530/REP-
-15 -0261, PMID: 26447148.
Miller D.: Confrontation, Consolidation, and Recognition: Th e Oocyte’s
Perspective on the Incoming Sperm. Cold Spring Harb Perspect Med. 2015,
5 (8). doi: 10.1101/cshperspect.a023408. PMID: 25957313.
Monte G.L., Murisier F., Piva I., Germond M., Marci R.: Focus on intracytoplasmic
morphologically selected sperm injection (IMSI): a mini – review. Asian J
Androl. 2013, 15 (5), 608–615. doi: 10.1038/aja.2013.54. PMID: 23832017.
Peer S., Eltes F., Berkovitz A., Yehuda R., Itsykson P., Bartoov B.: Is fi ne morphology
of the human sperm nuclei aff ected by in vitro incubation at 37°C?
Fertil Steril. 2007, 88(6), 1589–1594. PMID: 17481619.
Perdrix A., Rives N.: Motile sperm organelle morphology examination (MSOME)
and sperm head vacuoles: state of the art in 2013. Hum Reprod Update.
2013, 19(5), 527–541. doi: 10.1093/humupd/dmt021. PMID: 23825157.
Pizzol D., Bertoldo A., Foresta C.: Male infertility: biomolecular aspects. Biomol
Concepts. 2014, 5(6), 449–456. doi: 10.1515/bmc -2014 -0031. PMID: 25390025.
Rathke C., Baarends W.M, Awe S., Renkawitz -Pohl R.: Chromatin dynamics
during spermiogenesis. Biochim Biophys Acta. 2014, 1839(3), 155–168.
doi: 10.1016/j.bbagrm.2013.08.004. PMID: 24091090.
Sellami A., Chakroun N., Ben Zarrouk S., Sellami H., Kebaili S., Rebai T. i wsp.:
Assessment of chromatin maturity in human spermatozoa: useful aniline
blue assay for routine diagnosis of male infertility. Adv Urol. 2013: 578–
631. PMID: 24198830.
Setti A.S., Paes de Almeida Ferreira Braga D., Iaconelli Jr. A., Aoki T.,
Borges Jr. E.: Twelve years of MSOME and IMSI: a review. Reprod Biomed
Online. 2013, 27 (4), 338–352. doi: 10.1016/j.rbmo.2013.06.011. PMID:
23948449.
Talebi A.R., Fesahat F., Mangoli E., Ghasemzadeh J., Nayeri M., Sadeghian-
-Nodoshan F.: Relationship between sperm protamine defi ciency and apoptosis
in couples with unexplained repeated spontaneous abortions. Int J Reprod
Biomed (Yazd). 2016, 14, 199–204.
Talebi A.R., Vahidi S., Afl atoonian A., Ghasemi N., Ghasemzadeh J., Firoozabadi R.D.:
Cytochemical evaluation of sperm chromatin and DNA integrity in couples
with unexplained recurrent spontaneous abortions. Andrologia. 2012,
44, 462–470.
Tamburrino L., Marchiani S., Montoya M., Elia Marino F., Natali I., Cambi M.
i wsp.: Mechanisms and clinical correlates of sperm DNA damage. Asian J
Androl. 2012, 14 (1), 24–31. doi: 10.1038/aja.2011.59. PMID: 22138903.
la Vignera S., Condorelli R.A., Morgia G., Favilla V., Russo G.I., Cimino S. i wsp.:
Diff erent levels of Cd45pos leukocytes in the semen of patients with low
testicular volume. Int J Immunopathol Pharmacol. 2015, 28 (1), 85–92.
doi: 10.1177/0394632015572748. PMID: 25816410.
Ward W.S.: Function of sperm chromatin structural elements in fertilization
and development. Mol Hum Reprod. 2010, 16 (1), 30–36. doi: 10.1093/
molehr/gap080. PMID: 19748904
Weidner W., Pilatz A., Diemer T., Schuppe H.C., Rusz A., Wagenlehner F.: Male
urogenital infections: impact of infection and infl ammation on ejaculate
parameters. World J Urol. 2013, 31(4), 717–723. doi: 10.1007/s00345 -013-
-1082 -7. PMID: 23857546.
World Health Organization. WHO Laboratory Manual for the Examination
and Processing of Human Semen. 5th ed. World Health Organization Press,
Geneva 2010.
Wiland E., Żegało M., Kurpisz M.: Topologia chromosomów w jądrze komórkowym.
Plemnik. Część 2. Postępy Higieny i Medycyny Doświadczalnej.
2006, 60, 343–351.
Park Y.S., Park S., Ko D.S., Park D.W., Seo J.T., Yang K.M.: Observation of
sperm -head vacuoles and sperm morphology under light microscope. Clin
Exp Reprod Med. 2014, 41 (3), 132–136. doi: 10.5653/cerm.2014.41.3.132.
PMID: 25309858.
Zhang M -H., Zhang A -D., Shi Z -D., Wang L.G., Qiu Y.: Changes in levels of
seminal nitric oxide synthase, macrophage migration inhibitory factor,
sperm dna integrity and caspase -3 in fertile men after scrotal heat stress.
PLoS ONE. 2015, 10 (10), e0141320. doi:10.1371/journal.pone.0141320.
PMID: 26512992.
Zhao J., Zhang Q., Wang Y., Li Y.: Whether sperm deoxyribonucleic acid
fragmentation has an eff ect on pregnancy and miscarriage after in vitro
fertilization/intracytoplasmic sperm injection: a systematic review and
meta -analysis. Fertil Steril. 2014, 102 (4), 998–1005. doi: 10.1016/j.fertnstert.
2014.06.033. PMID: 25190048.
Zini A., Albert O., Robaire B.: Assessing sperm chromatin and DNA damage:
clinical importance and development of standards. Andrology. 2014,
2 (3), 322–325. doi: 10.1111/j.2047 -2927.2014.00193.x. PMID: 24520005.