PALMA SABALOWA CZY WARTO ZASTOSOWAĆ W ANDROLOGII? / SERENOA REPENS IS IT WORTH TO APPLY IN ANDROLOGY?
Jan Karol Wolski
Przychodnia Lekarska nOvum, Warszawa, Klinika Nowotworów Układu Moczowego, Centrum Onkologii – Instytut
im. Marii Skłodowskiej -Curie, Warszawa
Autor do korespondencji/corresponding author: Jan Karol Wolski, Przychodnia Lekarska nOvum, ul. Bociania 13,
02–807 Warszawa, tel.: +48 22 566 80 00, Klinika Nowotworów Układu Moczowego, Centrum Onkologii – Instytut
im. Marii Skłodowskiej -Curie, ul. W.K. Roentgena 5, 02–781 Warszawa, tel.: +48 22 546 20 00 (jkwolski@op.pl)
Otrzymano/received: 09.05.2016 r. • Zaakceptowano/accepted: 30.06.2016 r.
Jan Karol Wolski – lek. med., absolwent II Wydziału Lekarskiego Akademii Medycznej w Warszawie
specjalista urolog FEBU (ang. Fellow of European Board of Urology), specjalista chirurg dziecięcy, specjalista
urolog dziecięcy. Konsultant ds. andrologii, od 1995 r. w Przychodni Leczenia Niepłodności
nOvum w Warszawie. W latach 1981–2003 pracował w Klinice Urologii Dziecięcej Centrum
Zdrowia Dziecka. Od 2008 r. pracuje w Klinice Nowotworów Układu Moczowego, Centrum
Onkologii w Warszawie, jako urolog operujący pacjentów ze schorzeniami uroonkologicznymi.
Laureat nagród: Polskiego Towarzystwa Chirurgów Dziecięcych, American Society of Andrology,
Wyróżnienia Komitetu Naukowego Instytutu „Pomnik -Centrum Zdrowia Dziecka oraz Polskiego Towarzystwa
Urologicznego. Członek wielu towarzystw naukowych, m.in. założyciel Polskiego Towarzystwa Andrologicznego
i Polskiego Towarzystwa Urologii Dziecięcej.
Streszczenie
Palma sabalowa (łac. Serenoa repens), znana od wieków w medycynie ludowej, od ponad 100 lat stosowana jest także w medycynie konwencjonalnej.
Poznano biologicznie aktywne związki chemiczne zawarte w owocach tej rośliny. Frakcja lipidowo -sterolowa hamuje
działanie 5α -reduktazy steroidowej i aromatazy, co w konsekwencji blokuje przekształcenie testosteronu odpowiednio w dihydrotestosteron
i estrogen. Ekstrakty stosowane są w urologii we wczesnej i umiarkowanej postaci łagodnego rozrostu gruczołu krokowego.
W ostatnich latach zwrócono uwagę na aspekt przeciwzapalny. Fitosterole zaburzają kaskadę kwasu arachidonowego, związaną z procesem
zapalnym, w mechanizmie hamowania szlaku lipooksygenazy i cyklooksygenazy. Zapalenie gruczołu krokowego, wymagająceczęsto wielomiesięcznego leczenia, obniża znacząco jakość nasienia i jest jedną z przyczyn niepłodności męskiej. Alternatywą dla
przedłużonej antybiotykoterapii mogą być preparaty zawierające wyciągi z palmy sabalowej.
słowa kluczowe: fi toterapia chorób układu moczowego, łagodny rozrost gruczołu krokowego, zapalenie gruczołu krokowego, niepłodność
męska
Abstract
Saw Palmetto (lat. Serenoa repens), known for centuries in folk medicine, is also used in conventional medicine for over 100 years.
Biologically active chemical compounds contained in fruits of this plant are good known. Liposterolic extract inhibits the action of
5α -steroid reductase and aromatase which in turn inhibits the conversion of testosterone into dihydrotestosterone and estrogen respectivelly.
Extracts are used in urology in the early and moderate form of benign prostatic hyperplasia. In recent years, the attention on the
aspect of an anti -infl ammatory was focused. Phytosterols interfere with arachidonic acid cascade associated with infl ammation, in the
braking mechanism trail of lipoxygenase and cyclooxygenase. Infl ammation of the prostate gland, often needing multi -months treatment
signifi cantly reduced sperm quality and is one of the causes of male infertility. An alternative to prolonged antibiotic treatment
may be medicine containing extracts from the Saw Palmetto.
key words: phytotherapy of the urinary tract disease, benign prostate hyperplasia, prostatitis, male infertility
Skróty / Abbreviations
5α -red – 5α -reduktaza steroidowa (ang. 5α -steroid reductase); BPH – łagodny rozrost gruczołu krokowego (ang. benign prostatic hyperplasia),
DHT – dihydrotestosteron (ang. dihydrotestosterone), EAU – Europejskie Towarzystwo Urologiczne (ang. European Association of Urological),
IPSS – międzynarodowa skala objawów dotyczących prostaty (ang. International Prostate Symptom Score), LUTS – objawy z dolnych dróg
moczowych (ang. lower urinary tract symptomes), LE – poziom wiarygodności (ang. level of evidence), NIH – Narodowy Instytut Zdrowia
(ang. National Institute of Health)
Palma sabalowa (łac. Serenoa repens, ang. saw palmetto,
bocznia piłkowana) to pospolita roślina, która występuje
naturalnie w Ameryce Północnej (Okla homa, Alabama,
Arkansas, Floryda, Georgia, Luizjana, Missisipi, Karolina
Północna i Południowa), na Antylach, wyspach Bahama
oraz w południowej Europie i północnej Afryce (Kowalczyk
i Gałuszka, 2012; Tanner i wsp., 1999). Symbolika stanu
Floryda zawiera wizerunek palmy sabalowej – można ją
zobaczyć na pieczęci i fl adze stanowej.
Historia badań naukowych nad palmą sabalową liczy
sobie ponad 2 wieki. Pierwszy opisał tę roślinę amerykański
przyrodnik William Bartram, który w 1770 r.
badał fl orę i faunę kontynentu amerykańskiego oraz
kulturę Indian. W 1805 r. botanik Christiaan Hendrik
Persoon zaszeregował ją w królestwie roślin do rodziny
arekowatych (łac. Arecaceae – palmy) i rodzaju sabal (łac.
Sabal minor (Jacq.)Pers. Syn.pl.1:399.1805). Dzisiaj funkcjonuje
kilkanaście nazw systematycznych oraz wiele
zwyczajowych, co świadczy o znaczącej obecności tej
rośliny w codziennym życiu. Bogate nazewnictwa znajduje
swoje odzwierciedlenie w opisie składu ponad 100
preparatów leczniczych, zawierających ekstrakt z palmy
sabalowej (U.S. National Plant Germplasm System, 2011 ).
Sama roślina ma pokrój krzewu o wysokości 0,6–2,1 m
lub małego drzewa wysokości przeciętnie do 3 m. Jest
gatunkiem długowiecznym, niektóre okazy mogą osiągać
500–700 lat. Ma bardzo krótki pęd, na szczycie którego
wyrasta pióropusz liści. Są one sztywne, zielone lub niebieskozielone
i podzielone na taśmowate listki. Ogonki liściowe są pokryte ostrymi kolcami, stąd nazwa „bocznia
piłkowana”. Drobne, białe kwiaty zebrane są w smukłe
i wzniesione wiechy wystające powyżej liści. Powstają
z nich drobne ciemnoczerwone, niebieskawe lub czarne
błyszczące owoce. W tych jagodach wielkości oliwek
zawarte są składniki farmakologicznie czynne (EMA,
2015; Geavlete i wsp., 2011; Kowalczyk i Gałuszka, 2012;
www.sawpalmetto.com).
Wykorzystanie rośliny
Palma sabalowa zawsze była wykorzystywana jako
cenne źródło pokarmu przez pierwotnych mieszkańców
Florydy, plemiona Indian Miccosukee i Seminoli.
Znana była także jako surowiec w medycynie ludowej.
Leczniczo stosowano przede wszystkim owoce, spożywane
w postaci świeżej i suszonej lub w postaci naparu.
Plemię Seminoli stosowało je w leczeniu rozrostu gruczołu
krokowego, zapalenia pęcherza moczowego, rzeżączki
i podrażnienia błon śluzowych. Zaobserwowano
korzystne działanie moczopędne, tonizujące i relaksujące,
a słodzony olej działał uspokajająco i był stosowany
w przypadkach bezsenności, uporczywego kaszlu
czy zapalenia górnych dróg oddechowych. Świeże pąki
liściowe, zjadane na surowo, znalazły się w diecie osadników
hiszpańskich od początku kolonizacji półwyspu
(XVI w.). Do dzisiaj sprzedawane są pod zwyczajową
nazwą „kapusta bagienna” (ang. Swamp Cabbbage), a sama roślina funkcjonuje w potocznym języku jako palma
kapuściana (ang. Cabbage Palmeto). Z owoców tłoczy się
olej, wysuszone nasiona miele na mąkę, a sok z owoców
zmieszany z wodą gazowaną to popularny bezalkoholowy
napój metto. Ekstrakt z palmy spożywany jest jako napar
(herbaty fi x) i wchodzi w skład wielu nalewek alkoholowych.
Roślina znalazła także zastosowania jako budulec,
jako nasadzenia na zboczach, wzdłuż dróg i na plażach.
Uzyskiwane z liści, korzeni oraz łodygi włókna służą
do produkcji sznurów, szczotek, dywaników, wzmocnień
do plastrów medycznych (Kowalczyk i Gałuszka, 2012;
Tanner i wsp., 1999).
Związki biologicznie czynne
Badania nad właściwościami leczniczymi Serenoa
repens są często opisywane. Jako surowca medycznego
używa się dojrzałych wysuszonych owoców zawierajcych
substancje biologicznie czynne. Wyciągi uzyskuje
za pomocą etanolu, co pozwala na izolację frakcji lipofi
lnej i hydrofi lnej. Frakcja rozpuszczalna w tłuszczach
zawiera tłuste oleje (estry kwasu olejowego, laurowego,
mirystynowego), różne kwasy tłuszczowe i fi tosterole.
Frakcja rozpuszczalna w wodzie składa się z heteropolisacharydów
naturalnych (galaktoza, arabinoza, kwas
uronowy). Wykorzystuje się głównie etanolowy wyciąg
z owoców boczni piłkowanej, ponieważ można wyizolować
frakcję lipofi lną i hydrofi lną. Lipofi lna zawiera
frakcję lipidowo -sterolową (głównie estry kwasu olejowego,
kwasu laurowego i kwasu mirystynowego), różne
kwasy tłuszczowe (kaprynowy, kapronowy i kaprylowy,
laurynowy, mirystynowy, olejowy i palmitynowy), ich
estry etylowe, trójglicerydy i fi tosterole (β -sitosterol,
stigmosterol, kampesterol, cykloartenol). Z kolei frakcja
rozpuszczalna w wodzie składa się z mieszaniny heteropolisacharydów
naturalnych (kempferol, kwercetyna, izokwercytryna,
roifolina, farnezol, lupeol, lupenon, kwasy
uronowe, arabinoza, galaktoza, polisacharydy, żywice,
taniny) (De Monte i wsp., 2014). Z surowca wyizolowano
biologicznie czynne monoacyloglicerydy (1 -monolaurynę
i 1 -monomirystynę) o działaniu cytotoksycznym
wobec ludzkich komórek prostaty (Habib i wsp., 2005).
Przeprowadzona analiza porównawcza z palmą olejową
wykazała znamiennie większą koncentrację wspomnianych
substancji biologicznie czynnych w palmie sabalowej
(Penugonda i Lindshield, 2013; US Pharmacopeial Bulletin,
2013; www.sawpalmetto.com).
Mechanizm działania
Badane mechanizmy działania (rycina 1) wyciągu lipofi
lnego z jagód Serenoa repens wykazują, że hamowana
jest 5α -reduktaza steroidowa (5α -red, ang. 5α -steroid
reductase) przekształcająca testosteron w bardziej czynny
biologicznie androgen – dihydro testosteron (DHT, ang. dihydrotestosterone), który uważany jest za główny czynnik
łagodnego rozrostu stercza (BPH, ang. benign prostatic
hyperplasia) (EAU, 2016; Oszukowska i Różański, 2013).
Wśród aktywnych substancji czynnych, kwas laurowy,
mirystynowy i olejowy odgrywają szczególną rolę.
Mechanizm inhibicji aktywności obu izoform 5α -red
(typu I i II) jest nawet bardziej wydajny w porównaniu
z syntetycznym fi nasterydem, który hamuje jedynie izoformę
typu II. Powoduje to spowolnienie rozrostu gruczołu
krokowego, co wpływa klinicznie na zmniejszenie
uciążliwych objawów z dolnych dróg moczowych (LUTS,
ang. lower urinary tract symptomes) (EAU, 2016; Levin i Das,
2000; Kaplan i wsp., 2004; Oszukowska i Różański, 2013;
Penugonda i Lindshield, 2013; Schaeff er, 2006).
Fitosterole działają przeciwobrzękowo i przeciwzapalnie
(ryc. 1), hamując powstawanie mediatorów stanu
zapalnego poprzez spowalnianie kaskady kwasu arachidonowego
(obniżenie aktywności lipooksygenazy
i cyklooksygenazy¹) (Sirab i wsp., 2013). Polisacharydy
są immunostymulantami, fl awonoidy działają przeciwzapalnie,
przeciwwysiękowo, przeciwobrzękowo, poprawiają
ukrwienie. Ekstrakt palmy sabalowej działa antyagregacyjnie,
rozluźniająco na mięśniówkę dolnych dróg
moczowych, stabilizuje błony komórkowe i śródbłonki
oraz ma efekt przeciwalergiczny. W badaniach na modelu
zwierzęcym opisano blokowanie aktywności androgenów.
Stwierdzono, że podawanie wyciągu łącznie z hormonami
(testosteron i estradiol) powoduje u wykastrowanych
szczurów zahamowanie przyrostu masy prostaty.
Dobrze opisane efekty in vitro (model zwierzęcy) niestety
nie zawsze maja odniesienie do badań klinicznych, stąd
mechanizm działania wyciągów roślinnych jest nadal
niejasny (EAU, 2016; Geavlete i wsp., 2011).
Właściwości lecznicze
Amerykańscy koloniści szybko przejęli od Indian wiedzę
o jagodach palmy sabalowej i stosowali je jako składnik
leczniczy preparatów roślinnych przepisywanych przez
lekarzy już w XIX wieku. Owoce palmy sabalowej spożywano
od wieków, ponieważ skojarzono fakt zjedzenia
z korzystnym oddziaływaniem na dolegliwości dolnych
dróg moczowych (Tanner i wsp., 1999). W XX wieku
gatunek ten wprowadzono do XXIII wydania spisu
leków Stanów Zjednoczonych, farmakopei USA i krajowego
receptariusza (Blumenthal, 2003). Także w Europie
palma sabalowa znalazła szerokie uznanie, na rynku
dostępne są liczne preparaty z ekstraktami dedykowanymi
przede wszystkim terapii łagodnego rozrostu
stercza. Ponadto, z uwagi na antyandrogenowe działanie,
stosowane są w dermatologii i kosmetologii (trądzik, hirsutyzm
u kobiet).
1 Lipooksygenaza i cyklooksygenaza odgrywają kluczową rolę w kaskadzie
kwasu arachidonowego, uwalnianego z fosfolipidów błonowych, prowadzącej
do powstania leukotrienów, prostaglandyn, prostacyklin i tromboksanów
biorących udział w procesach zapalnych (przyp. red.)
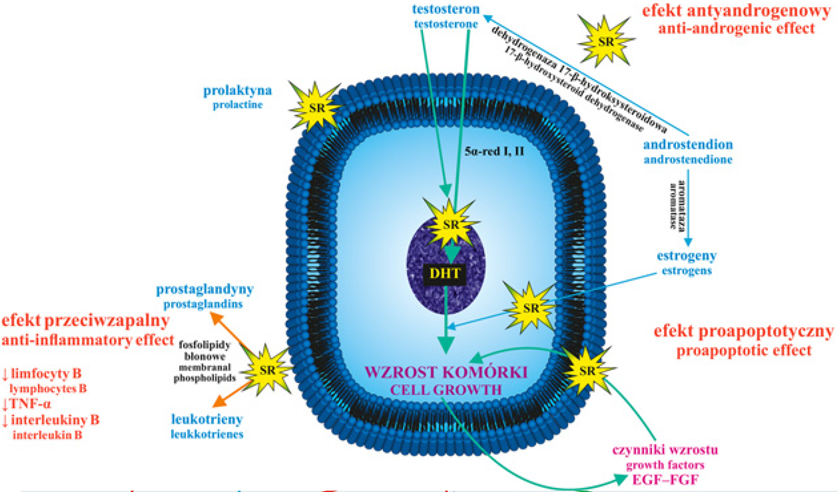
Ryc. 1. Przypuszczalny mechanizm działania wyciągu z Sernoa repens (SR) na poziomie komórki w leczeniu łagodnego rozrostu gruczołu krokowego (BPH).
Sugeruje się, że SR wykazuje efekt antyandrogenowy (zmniejszenie poziomu DHT), proapoptotyczny (hamowanie cyklu komórkowego) i przeciwzapalny
(zmniejszenie liczby komórek zapalnych i cytokin) (wg Habib, 2009, zmodyfi kowane, szczegóły w tekście); 5α -red – 5α -reduktaza steroidowa; BPH – łagodny
rozrost gruczołu krokowego; DHT – dihydrotestosteron; EGF – naskórkowy czynnik wzrostu; FGF – fi broblastyczny czynnik wzrostu
Fig. 1. Suggested mechanism of action Sernoa repens (SR) extract at the cellular level for the treatment of benign prostatic hyperplasia (BPH). It seems that
SR may reveal anti -androgenic eff ect (decrease in DHT level), proapoptotic eff ect (inhibition of cellular cycle) and anti -infl ammatory eff ect (decrease in
number of infl ammatory cells and cytokine) (according to Habib, 2009, modyfi ed, details i the text); 5α -red –5α -steroid reductase; BPH –benign prostatic
hyperplasia; DHT – dihydrotestosterone; EGF – epidermal growth factor; FGF – fi broblast growth factor
Działania niepożądane zgłaszane są rzadko,
o nasi leniu łagodnym i obejmują głównie zaburzenia
żołądkowo -jelitowe. Przy długotrwałym przyjmowaniu
mogą pojawić się problemy z krzepnięciem krwi, rzadko
zapalenie trzustki (Bruminhent, 2011; EAU, 2016; Jibrin
i wsp., 2006; Zeiger, 1997).
Terapia BPH
W ostatnich latach ukazało się wiele doniesień i analiz
wykazujących skuteczność Serenoa repens w leczeniu BPH.
Były to w większości prace o wiarygodności (LE, ang. level
of evidence) na poziomie 2 (prace bez randomizacji), niemniej
dające dowód na biologiczne działanie ekstraktów
z palmy sabalowej. Istnieją też raporty oceniające efekt
na poziomie placebo. Ta odmienna ocena skuteczności
terapii BPH w monoterapii preparatami Serenoa repens
wynika przede wszystkim z mnogości preparatów oraz
braku standaryzacji (zawartości czynnych biologicznie
substancji w jednej dawce), co oznaczało, że analizy dotyczyły
innych stężeń czy koncentracji i nie mogły być
ze sobą porównywane (Jambor, 2012; Pagano i wsp., 2014).
Zanotowano także obserwacje na poziomie 1 LE.
Analiza 18 randomizowanych prób klinicznych obejmujących
2939 pacjentów wykazała podobną skuteczność ekstraktów z palmy sabalowej w zmniejszaniu objawów
LUTS w porównaniu z fi nasterydem – międzynarodowa
skala objawów (IPSS, ang. International Prostate Symptom
Score) oraz maksymalny przepływ moczu (mL/s) (ang.
maximum urinary peak fl ow). Ponadto, ujawniła mniej,
co ważne, działań niepożądanych (dysfunkcja erekcyjna)
(Wilt i wsp., 1998), co potwierdzano w kolejnych obserwacjach
(Marzano i wsp., 2015).
Do innych wniosków doszli Tacklind i wsp. (2012),
którzy przeprowadzili analizę danych opublikowanych
w Bibliotece Cochrane² dotyczących 32 randomizowanych
prób klinicznych obejmujących 5666 mężczyzn,
trwających 4–60 tygodni. Wykazano, że pośród analizowanych
punktów końcowych poprawę po stosowaniu
ekstraktów palmy sabalowej jako monoterapii
w porównaniu z placebo, stwierdzono w częstomoczu
nocnym, natomiast IPSS, maksymalny przepływ moczu
oraz objętość prostaty pozostawały na tym samym
poziomie, co placebo (Tacklind i wsp., 2012). Należy
uwzględnić uwagę autorów, że co najmniej 30 preparatów
ekstraktu z palmy (monoterapia) było stosowanych
u pacjentów. W ostatnich latach ukazały się dobrze udokumentowane randomizowane próby, które wykazały,
że preparaty złożone (ekstraktu Serenoa repens i α -bloker)
są znamiennie lepsze niż α -bloker w monoterapii BPH
(Morgia i wsp., 2014; Ryu i wsp., 2015).
Aktualne wytyczne Europejskiego Towarzystwa
Urologicznego (EAU, ang. European Association of Urology)
wskazują na korzystne działanie preparatów złożonych
(Oelke i wsp., 2014). Mimo to ostateczna konkluzja panelu
ekspertów EAU nie daje jednoznacznej rekomendacji
w codziennym leczeniu pacjentów z LUTS, ponieważ preparaty
Serenoa repens są bardzo liczną heterogenną grupą,
o zmiennej zawartości samego ekstraktu z Serenoa repens
i różnymi dodatkami, mają więc trudno porównywalną
aktywność biologiczną (Geavlete i wsp., 2011; Habib i wsp.,
2005; Little i Jeanson, 2013). Ponadto, ograniczenia i niedoskonałości
dotyczą samej metodologii i metaanaliz
publikowanych prac (małe grupy pacjentów, krótki czas
obserwacji). Wszyscy autorzy podkreślają konieczność
przeprowadzenia randomizowanych prób klinicznych
z użyciem preparatów złożonych o standaryzowanej
koncentracji Serenoa repens (EAU, 2016).
2 Opracowania dowodów, w oparciu o zasady medycyny opartej na faktach,
publikowane są w formie przeglądów systematycznych w bazach
Biblioteki Cochrane (Cochrane Library) (przyp. red.)
Działanie przeciwzapalne
Zapalenie gruczołu krokowego występuje przede
wszystkim u mężczyzn młodych <35. r.ż., w okresie największej
aktywności zawodowej i seksualnej. Według
danych Narodowego Instytutu Zdrowia (NIH, ang.
National Institute of Health) 8,2% wszystkich mężczyzn
przynajmniej raz w życiu miało zapalenie prostaty (ang.
prostatitis). Liczba wizyt lekarskich z tego powodu w USA
sięgała 2 milionów rocznie (Schaeff er, 2006). Szacuje
się, że zapalenie gruczołu krokowego, ostre i przewlekłe,
to 5–10% wszystkich chorób prostaty (Murphy
i wsp., 2009). W przeciwieństwie do BPH i raka prostaty,
które dotyczą mężczyzn >50. r.ż., zapalenie jest domeną
młodych mężczyzn. Przewlekłe zapalenie prostaty znacząco
obniża jakość życia pacjentów, a jego uciążliwość
jest porównywalna jak u pacjentów z zawałem mięśnia
sercowego, niestabilną chorobą wieńcową lub chorobą
Crohna (Wenninger i wsp., 1996). Proponowane przez
EAU schematy leczenia opierają się przede wszystkim
na fl ourochinolonach w monoterapii, jako antybiotykach
o dobrej farmakokinetyce, biodostępności, penetracji
i odpowiedniej aktywności przeciw typowym i nietypowym
patogenom (EAU, 2016). Jednak konieczność
stosowania w wielu przypadkach przedłużonych kuracji,
powodujących istotne zaburzenia żołądkowo -jelitowe
i wytworzenie antybiotykoodporności, jest powodem
odstępowania od powyższych wytycznych zarówno przez
pacjentów, jak i lekarzy (Magistro i wsp., 2016; Shoskes,
2002).
Zapalenie prostaty obok istotnego zmniejszenia
jakości życia (objawy LUTS, pogorszenie seksualności),
strat ekonomicznych (absencje w pracy) powoduje także,
co szczególnie ważne w tej grupie wiekowej, kłopoty w rozrodzie (pogorszenie jakości nasienia) i jest jedną
z przyczyn niepłodności męskiej (EAU, 2016; Oszukowska
i Różański, 2013). Poznano mechanizmy przeciwzapalne
wyciągów z owoców palmy sabalowej, zawierających
węglowodany (mannitol, polisacharydy o wysokiej
masie cząsteczkowej), fi tosterole (beta -sitosterol), fl awonoidy
i oleje stałe. Substancje te zaburzają kaskadę
kwasu arachidonowego, związaną z procesem zapalnym,
w mechanizmie hamowania szlaku lipooksygenazy
i cyklooksygenazy (Habib, 2009; Sirab i wsp., 2013;
Shoskes, 2002). Zachęciło to do włączenia preparatów
zawierających wyciąg z owoców Serenoa repens w monoterapii
oraz w połączeniu z chinolonami z dodatkiem
probiotyków. Przedstawione ostatnio wyniki badania
klinicznego z Włoch, obejmującego 290 pacjentów, wykazały
szybsze ustąpienie objawów przewlekłego zapalenia
stercza oraz mniejszą liczbę notowanych działań niepożądanych
u pacjentów tak leczonych, w porównaniu z klasyczną
monoterapią antybiotykową (Busetto i wsp., 2014).
Podsumowanie
Wyciągi z owoców palmy sabalowej używane są od dawna
w leczeniu BPH. Badania nad składnikami biologicznie
aktywnymi tej rośliny rozszerzyły zakres stosowania preparatów
w terapii przewlekłych stanów zapalnych stercza.
Czy można wykorzystać ten mechanizmu w leczeniu
pacjentów z obniżoną płodnością spowodowaną czynnikami
infekcyjnymi w nasieniu? Aby z przekonaniem
odpowiedzieć na to pytanie, potrzeba więcej dobrze udokumentowanych
prac klinicznych.
Piśmiennictwo
Blumenthal M. (red). ABC’s Clinical Guide to Herbs. American Botanical
Council, Austin, Texas 2003.
Bruminhent J., Carrera P., Li Z., Amankona R., Roberts I.M.: Acute pancreatitis
with saw palmetto use: a case report. J Med Case Rep. 2011, 5, 414. doi:
10.1186/1752 -1947 -5 -414. PMID: 21867545.
Busetto G.M., Giovannone R., Ferro M., Tricarico S., Del Giudice F., Matei
D.V. i wsp.: Chronic bacterial prostatitis:effi cacy of short–lasting antibiotic
therapy with prulifl oxacin (Unidrox®) in association with saw palmetto
extract, lactobacillus sporogens and arbutin (Lactorepens®). BMC Urol. 2014.
19, 14:53. doi: 10.1186/1471 -2490 -14 -53. PMID: 25038794
De Monte C., Carradori S., Granese A., Di Pierro G.B., Leonardo C., De Nunzio C.:
Modern extraction techniques and their impact on the pharmacological profi le
of Serenoa repens extracts for the treatment of lower urinary tract symptoms.
BMC Urol. 2014, 14, 63. doi: 10.1186/1471 -2490 -14 -63. PMID: 25112532.
European Association of Urology 2016 https://uroweb.org/guidelines/
compilations -of -all -guidelines/, data wejścia 02.05.2016 r.
European Medicines Agency2015 http://www.ema.europa.eu/docs/en_GB/
document_library/Herbal_ -_Herbal_monograph/2016/01/WC500199750.
pdf/, data wejścia 02.05.2016 r.
Geavlete P., Multescu R., Geavlete B.: Serenoa repens extract in the treatment
of benign prostatic hyperplasia. Th er Adv Urol. 2011. 3(4):193–198. doi:
10.1177/1756287211418725. PMID: 21969849.
Habib F.K., Ross M., Ho C.K., Chapman K.: Serenoa repens (Permixon) inhibits
the 5alpha -reductase activity of human prostate cancer cell lines with out interfering with PSA expression. Int J Cancer. 2005, 114 (2), 190–194.
doi: 10.1002/ijc.20701. PMID: 15543614.
Habib F.K.: Serenoa repens: Th e Scientifi c Basis for the Treatment of Benign
Prostatic Hyperplasia. EuroUrol Suppl. 2009, 8 (13), 887–893. doi: 10.1016/j.
eursup.2009.11.005.
Jambor J.: Fitoterapia chorób układu moczowego. Przeg Urol. 2012, 1 (71), 23–29.
Jibrin I., Erinle A., Saidi A., Aliyu Z.Y.: Saw palmetto -induced pancreatitis. South
Med J. 2006, 99 (6), 611–612. doi: 10.1097/01.smj.0000215642.76198.44.
PMID: 16800417.
Kaplan S., Volpe M.A., Te A.E.: A prospective, 1 -year trial using saw palmetto
versus fi nasterid in the treatment of category III prostatitis/chronic
pelvic pain syndrome. J Urol. 2004, 171, 284–288. doi: 10.1097/01.
ju.0000101487.83730.80. PMID: 14665895.
Kowalczyk B., Gałuszka A.: Palma Sabalowa. Panacea. 2012, 38(1), 20–22.
Levin, R.M., Das A.K.: A scientifi c basis for the therapeutic eff ects of Pygeum
africanum and Serenoa repens. Urol Res, 2000, 28 (3), 201–209. PMID:
10929430.
Little D.P., Jeanson M.L.: DNA barcode authentication of saw palmetto herbal
dietary supplements. Sci Rep 2013, 17, 3, 3518. doi: 10.1038/srep03518.
PMID: 24343362.
Magistro G., Wagenlehner F.M.E., Grabe M., Weidner W., Stief C.G., Nickel J.C.:
Contemporary Management of Chronic Prostatitis/Chronic Pelvic Pain
Syndrome. Eur Urol 2016, 69 (2), 286–297. doi: 10.1016/j.eururo.2015.08.061.
PMID: 26411805.
Marzano R., Dinelli N., Ales V., Bertozzi M.A.: Eff ectiveness on urinary symptoms
and erectile function of Prostamev Plus® vs only extract Serenoa repens.
Arch Ital Urol Androl. 2015, 87 (1), 25–27. doi: 10.4081/aiua.2015.1.25.
PMID: 25847892.
Morgia G., Russo G.I., Voce S., Palmieri F., Gentile M., Giannantoni A. i wsp.:
Serenoa repens, lycopene and selenium versus tamsulosin for the treatment
of LUTS/BPH. An Italian multicenter double -blinded randomized study
between single or combination therapy (PROCOMB trial). Prostate. 2014,
74 (15), 1471–1480. doi: 10.1002/pros.22866. PMID: 25154739.
Murphy A.B., Macejko A., Taylor A., Nadler R.B.: Chronic prostatitis: management
strategies. Drugs. 2009, 69 (1), 71–84. doi: 10.2165/00003495 -
200969010 -00005. PMID: 19192937.
Oelke M., Berges R., Schlafke S., Burkart M.: Fixed -dose combination PRO
160/120 of sabal and urtica extracts improves nocturia in men with LUTS suggestive
of BPH: re -evaluation of four controlled clinical studies. World J Urol.
2014, 32, 1149–1154. doi: 10.1007/s00345 -014 -1338 -x. PMID: 24938176.
Oszukowska E., Różański W.: Czynność i choroby gruczołu krokowego – znaczenie
w płodności męskiej. W: Układ płciowy męski. Badania kliniczne
i doświadczalne. Red. M. Piasecka. Wyd. PUM, Szczecin, 2013, 473–494.
Pagano E., Laudato M., Griff o M., Capasso R.: Phytotherapy of benign prostatic
hyperplasia. A minireview. Phytother Res. 2014, 28 (7), 949–955.
PMID: 25165780.
Penugonda K., Lindshield B.L.: Article Fatty Acid and Phytosterol Content of
Commercial Saw Palmetto Supplements. Nutrients. 2013, 5, 3617–3633.
doi: 10.3390/nu5093617. PMID: 24067389.
Ryu Y.W., Lim S.W., Kim J.H., Ahn S.H., Choi J.D.: Comparison of tamsulosin
plus serenoa repens with tamsulosin in the treatment of benign prostatic
hyperplasia in Korean men: 1 -year randomized open label study. Urol Int.
2015, 94(2), 187–193. doi: 10.1159/000366521. PMID: 25614155.
Schaeff er A.J.: Clinical practice. Chronic prostatitis and the chronic pelvic
pain syndrome. N Engl J Med. 2006, 355 (16), 1690–1698. doi: 10.1056/
NEJMcp060423. PMID: 17050893.
Shoskes D.A: Phytotherapy in chronic prostatitis. Urology 2002, 60 (6), 35–37.
doi: 10.1016/S0090 -4295(02)02383 -X. PMID: 12521591.
Sirab N., Robert G., Fasolo V., Descazeaud A., Vacherot F., de la Taille A. i wsp.:
Lipidosterolic Extract of Serenoa Repens Modulates the Expression of
Infl ammation Related -Genes in Benign Prostatic Hyperplasia Epithelial
and Stromal Cells. Int J Mol Sci. 2013, 14, 14301–14320. doi: 10.3390/
ijms140714301. PMID: 23846725.
Tacklind J., MacDonald R., Rutks I., Wilt T.J.: Serenoa repens for benign prostatic
hyperplasia. Cochrane Database Syst Rev. 2012, 12, CD001423. doi:
10.1002/14651858. PMID: 23235581.
Tanner G.W., Mullahey J.J., Maehr D.: Saw -palmetto: an Ecologically and
Economically Important Native Palm. University of Florida, Institute of
Food and Agriculture, 1999, WEC -109 [przeglądany 02.05.2016 r.]. Dostępny
w: http://irieonline.com/websites/plantapalm/vpe/misc/saw -palmetto.pdf
US Pharmacopeial Bulletin 2013 http://www.usp.org/sites/default/fi les/
usp_pdf/EN/USPNF/revisions/saw_palmetto.pdf/, data wejścia 02.05.2016 r.
U.S. National Plant Germplasm System 2011 https://npgsweb.ars -grin.
gov/gringlobal/taxon/taxonomysearch.aspx?language=en/, data wejścia
02.05.2016 r.
Wenninger K., Heiman J.R., Rothman I., Berghuis J.P., Berger R.E.: Sickness
impact of chronic nonbacterial prostatitis and its correlates. J Urol. 1996,
155, 965–968. PMID: 8583619.
Wilt T.J., Ishani A., Stark G., MacDonald R., Lau J., Mulrow C.: Saw palmetto
extracts for treatment of benign prostatic hyperplasia: a systematic review.
JAMA. 1998, 280 (18), 1604–1609. PMID: 9820264
www.sawpalmetto.com, data wejścia 02.05.2016 r.
Zeiger E.: Saw Palmetto (Serenoa repens) and One of Its Constituent Sterols
-Sitosterol [83 -46 -5]. Review of Toxicological Literature. NIEHS, USA 1997
[przeglądany 02.05.2016 r.]. Dostępny w: http://ntp.niehs.nih.gov/ntp/
htdocs/chem_background/exsumpdf/sawpalmetto_508.pdf
REKOMENDACJE MEDYCZNE / MEDICAL RECOMMENDATION
Rekomendacje medyczne (zwane inaczej wytycznymi
lub zaleceniami) są dokumentem, który tworzony jest
w celu zapewnienia jednolitego postępowania diagnostycznego
i terapeutycznego w danej dziedzinie medycyny.
Takie dokumenty stosowane były w medycynie podczas
całej jej historii. Jednak w przeciwieństwie do wcześniejszych
zaleceń, które oparte były często na tradycyjnych
praktykach, niesprawdzonych teoriach i irracjonalnych
wierzeniach, nowoczesne wytyczne medyczne oparte
są na aktualnych danych uzyskanych w badaniach naukowych,
co nazywane jest medycyną opartą na dowodach
(EBM, ang. evidence based medicine). Rekomendacje są formułowane
przez uznanych specjalistów z danej dziedziny
i powstają jako konsensus ich opinii na dany temat.
Andrologia jest dziedziną medycyny, która powstała
na pograniczu endokrynologii, urologii, medycyny
rozrodu, seksuologii i pediatrii, dlatego rekomendacje
odnośnie postępowania w zaburzeniach andrologicznych
są często tworzone w ramach różnych specjalizacji.
Europejska Akademia Andrologii (EAA, ang. European
Academy of Andrology), której zadaniem jest m.in. kształcenie
w dziedzinie andrologii, poleca lekarzom andrologom
oraz kandydatom do zdobycia tytułu androloga
klinicznego zapoznanie się z Rekomendacjami
Europejskiego Towarzystwa Urologicznego (EAU, ang.
European Association of Urology). Przedstawiciele EAA
i EAU wypracowali bowiem wspólny program nauczania
tematyki andrologicznej.
W 2015 r. ukazało się nowe, zaktualizowane wydanie
Rekomendacji EAU. Aby ułatwić polskim lekarzom zapoznanie
się z tymi Rekomendacjami, Polskie Towarzystwo
Andrologiczne (PTA) podjęło się ich tłumaczenia na język
polski. Dotychczas zostały przetłumaczone rekomendacje
odnośnie postępowania w męskim hipogonadyzmie,
zaburzeniach seksualnych u mężczyzn i w męskiej
niepłodności. Polskie wersje Rekomendacji EAU będą
się ukazywały w częściach w czasopiśmie „Postępy
Andrologii Online”, a także będą umieszczone na stronie
internetowej PTA. Mamy nadzieję, że Rekomendacje
podniosą wiedzę i umiejętności lekarzy zajmujących
się problemami andrologicznymi w Polsce, a także będą
pomocne w wyjaśnieniu często kontrowersyjnych zagadnień.
Prof. dr hab. n. med. Jolanta Słowikowska -Hilczer
Przewodnicząca
Polskiego Towarzystwa Andrologicznego
REKOMENDACJE DOTYCZĄCE ZABURZEŃ... / GUIDELINES ON MALE SEXUAL ... / Część_1
REKOMENDACJE DOTYCZĄCE ZABURZEŃ
SEKSUALNYCH U MĘŻCZYZN: ZABURZENIA
EREKCJI I PRZEDWCZESNY WYTRYSK
GUIDELINES ON MALE SEXUAL DYSFUNCTION: ERECTILE
DYSFUNCTION AND PREMATURE EJACULATION
K. Hatzimouratidis (przewodniczący), I. Eardley, F. Giuliano, I. Moncada, A. Salonia
Tłumaczenie i przygotowanie wersji polskiej / Translation and elaboration of Polish version:
Marta Sochaj¹,², Zuzanna Słowikowska³, Jolanta Słowikowska -Hilczer³
¹ I Klinika Urologii, Uniwersytet Medyczny w Łodzi; ² Uniwersytecki Szpital Kliniczny im. Wojskowej Akademii Medycznej – Centralny
Szpital Weteranów w Łodzi; ³ Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny
w Łodzi
Autor do korespondencji/corresponding author: Jolanta Słowikowska -Hilczer, Zakład Endokrynologii Płodności,
Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. Sterlinga 5, 91 -425 Łódź,
tel.: 42 633 07 05, jolanta.slowikowska -hilczer@umed.lodz.pl
Otrzymano/received: 23.10.2015 r. • Zaakceptowano/accepted: 01.03.2016 r.
© European Association of Urology 2015
Skróty / Abbreviations
5-HT – 5-hydroksytryptamina (ang. 5-hydroxytriptamine); AIPE – Arabski Wskaźnik Przedwczesnego Wytrysku (ang. Arabic Index of Premature
Ejaculation); AUC – pole powierzchni pod krzywą zależności stężenia leku we krwi od czasu (ang. area under the curve); BPH – łagodny rozrost
gruczołu krokowego (ang. benign prostatic hyperplasia); Cmax – maksymalne stężenie leku, jakie jest osiągane we krwi po podaniu (ang.
maximal concentration); CGRP – białko związane z genem kalcytoniny (ang. calcitonin gene -related peptide); CHF – zastoinowa niewydolność
serca (ang. congestive heart failure); cGMP – cykliczny 3’,5’guanozynomonofosforan (ang. 3’,5’ -cyclic guanosine monophosphate); DSM-IV-TR –
Diagnostyczny i Statystyczny Wykaz Chorób Umysłowych (ang. Diagnostic and Stastical Manual of Mental Disorders); EAU – Europejskie
Towarzystwo Urologiczne (ang. European Association of Urology); ED – zaburzenia erekcji (ang. erectile dysfunction); EF – funkcja erekcyjna
(ang. erectile function); EMA – Europejska Agencja Leków (ang. European Medicines Agency); FDA – Amerykańska Agencja ds. Leków i Żywności
(ang. Food and Drug Administration); GAQ – Kwestionariusz Oceny Globalnej (ang. General Assessment Questionnaire); GnRH – gonadoliberyna
(ang. gonadotropin-releasing hormone); GSSAB – Globalne Badanie Postaw i Zachowań Seksualnych (ang. Global Study of Sexual Attitudes and
Behaviors); GR – stopień rekomendacji (ang. grade of recommendation); HIFU – skupiona wiązka fal ultradźwiękowych o wysokim natężeniu
(ang. high intensity focus ultrasound); ICD -10 – Międzynarodowa Statystyczna Klasyfi kacja Chorób i Problemów Zdrowotnych. Rewizja 10
(ang. International Statistical Classifi cation of Diseases and Related Health Problems. 10th Revision); IELT – wewnątrzpochwowy czas opóźnienia
ejakulacji (ang. intravaginal ejaculation latency time); IIEF – międzynarodowy wskaźnik funkcji erekcyjnej (ang. international index of erectile
function); IPE – wskaźnik przedwczesnego wytrysku (ang. index of premature ejaculation); IPSS – Międzynarodowy kwestionariusz objawów
ze strony gruczołu krokowego (ang. International Prostate Symptom Score); ISSM – Międzynarodowe Towarzystwo Medycyny Seksualnej (ang.
International Society of Sexual Medicine); LE – poziom wiarygodności dowodu naukowego (ang. level of evidence); LH – hormon luteinizujący
(ang. luteinizing hormone); LI -SWT – terapia falą uderzeniową o małej intensywności (ang. low -intensity extracorporeal shock wave therapy);
LUTS – objawy z dolnych dróg moczowych (ang. lower urinary tract symptoms); LVD – niewydolność lewej komory serca (ang. left ventricular
dysfunction); MeSH – główne tytuły medyczne (ang. Medical Subject Headings); MMAS – Badania z Massachusetts nad Starzeniem się
Mężczyzn (ang. Massachusetts Male Aging Study); MSAM -7 – Międzynarodowe Badanie nad Starzeniem się Mężczyzn (ang. Multinational Survey on the Aging Male); MSHQ -EjD – Kwestionariusz do Oceny Zdrowia Seksualnego Mężczyzn – Dysfunkcja Ejakulacji (ang. Male Sexual
Health Questionnaire – Ejaculatory Dysfunction); NHSLS – sondaż dotyczący zdrowia i życia społecznego (ang. National Health and Social Life
Survey); NYHA – Nowojorskie Towarzystwo Chorób Serca (ang. New York Heart Association); NTPR – nocna ocena sztywności i twardości
prącia (ang. nocturnal penile tumescence and rigidity); NSRP – radykalna prostatektomia z oszczędzeniem pęczków nerwowych (ang. nerve
sparing radical prostatectomy); NO – tlenku azotu (ang. nitric oxide); ODT – tabletki rozpuszczalne w jamie ustnej (ang. orally disintegrating
tablet); OUN – ośrodkowy układ nerwowy (ang. central nervous system)PDE – fosfodiesteraza (ang. phosphodiesterase); PDE5 – fosfodiesteraza
typu 5 (ang. phosphodiesterase 5); PDE5i – inhibitory fosfodiesterazy typu 5 (ang. phosphodiesterase 5 inhibitors); PE – przedwczesny
wytrysk (ang. premature ejaculation); PEDT – narzędzie diagnostyczne do oceny wytrysku przedwczesnego (ang. premature ejaculation
diagostic tool); PEP – profi l przedwczesnego wytrysku (ang. premature ejaculation profi le); PEPA – częstość występowania przedwczesnego
wytrysku i postaw wobec zaburzenia (ang. premature ejaculation prevalence and attitudes); PRO – jednoczynnikowy raport pacjenta (ang.
single -item patient reported outcome); PSA – antygen specyfi czny dla prostaty (ang. prostate specifi c antygen); QoL – jakość życia (ang. quality of
life);RP – radykalna prostatektomia, całkowite usunięcie gruczołu krokowego (ang. radical prostatectomy); RARP – radykalna prostatektomia
z zastosowaniem robota (ang. robot -assisted radical prostatectomy); SEP – profi l spotkań seksualnych (ang. sexual encounter profi le); SHIM –
Inwentarz Zdrowia Seksualnego dla Mężczyzn (ang. Sexual Health Inventory for Men); SSRI – selektywne inhibitory wychwytu zwrotnego
serotoniny (ang. selective serotonin re -uptake inhibitors); TEMPE – odmierzona dawka lidokainy i prilokainy w postaci areozolu stosowanego
w terapii przedwczesnego wytrysku (ang. topical mixture for premature ejaculation); Tmax – czas, który mija od podania leku do osiągnięcia
we krwi maksymalnego stężenia substancji aktywnej (ang. time -to -maximum plasma concentration); T½ – biologiczny okres półtrwania leku,
czas, w którym stężenie leku we krwi zmniejszy się do połowy wartości początkowej (ang. plasma elimination halftime); VED – urządzenia
próżniowe poprawiające erekcję (ang. vacuum erection device); VIP – naczynioaktywny peptyd jelitowy (ang. vasoactive intestinal peptide)
1. WSTĘP . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
1.1. Cel. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
1.2. Historia publikacji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
1.3. Skład panelu ekspertów . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
2. METODOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
3. REKOMENDACJE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3A. ZABURZENIA EREKCJI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
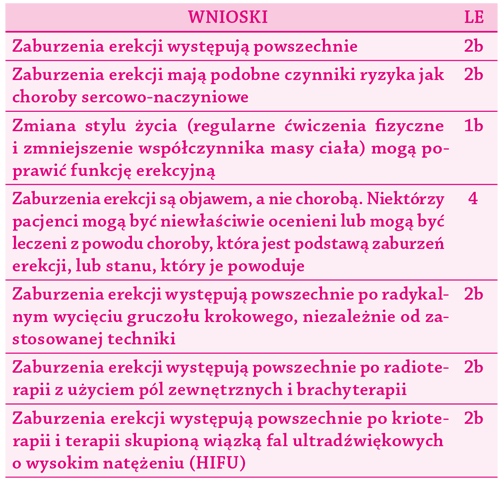
3A.1. Epidemiologia/etiologia/patofi zjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3A.1.1. Epidemiologia. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3A.1.2. Czynniki ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3A.1.3. Patofi zjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A.1.4. Zaburzenia erekcji po radykalnej prostatektomii, radioterapii i brachyterapii . . . . . . . . . . . . . . . . . . . . 45
3A.1.5. Wnioski odnośnie epidemiologii/etiologii/patofi zjologii zaburzeń erekcji. . . . . . . . . . . . . . . . . . . . . . . 45
3A.2. Klasyfi kacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46
3A.3. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3A.3.1. Podstawowe badania lekarskie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3A.3.2. Wywiad dotyczący życia seksualnego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3A.3.3. Badanie fi zykalne. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3A.3.4. Testy laboratoryjne. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3A.3.5. Układ krążenia i aktywność seksualna: ryzyko dla pacjenta. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3A.3.5.1. Kategoria niskiego ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3A.3.5.2. Kategoria średniego lub nieokreślonego ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3A.3.5.3. Kategoria wysokiego ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3A.3.6. Specjalistyczne testy diagnostyczne. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3A.3.6.1. Ocena nocnej zmiany objętości i sztywności prącia. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3A.3.6.2. Test wstrzyknięcia substancji wazoaktywnych do ciał jamistych. . . . . . . . . . . . . . . . . . . . . . 50
3A.3.6.3. Ultrasonografi a Doppler duplex prącia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3A.3.6.4. Arteriografi a i dynamiczna przepływowa kawernozometria lub kawernozografi a . . . . . . . . . . . . 50
3A.3.6.5. Ocena psychiatryczna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3A.3.6.6. Anomalie budowy prącia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3A.3.7. Edukacja pacjenta – konsultacja i skierowania do dalszych badań . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3A.3.8. Rekomendacje dotyczące postępowania diagnostycznego w zaburzeniach erekcji . . . . . . . . . . . . . . . . . . 52
3A.4. Leczenie zaburzeń erekcji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3A.4.1. Możliwości leczenia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3A.4.2. Styl życia w przypadkach zaburzeń erekcji z towarzyszącymi czynnikami ryzyka chorób układu krążenia . . . 52
3A.4.3. Zaburzenia erekcji po radykalnej prostatektomii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3A.4.4. Przyczyny zaburzeń erekcji, które potencjalnie mogą zostać wyleczone . . . . . . . . . . . . . . . . . . . . . . . . 53
3A.4.4.1. Przyczyny hormonalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53
3A.4.4.2. Pourazowe naczyniopochodne zaburzenia erekcji u młodych pacjentów . . . . . . . . . . . . . . . . . 54
3A.4.4.3. Poradnictwo psychologiczne i psychoterapia. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3A.4.5. Terapia pierwszej linii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3A.4.5.1. Doustna farmakoterapia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3A.4.5.1.1. Sildenafi l . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3A.4.5.1.2. Tadalafi l . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3A.4.5.1.3. Wardenafi l . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
3A.4.5.1.4. Awanafi l . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
3A.4.5.1.5. Wybór pomiędzy różnymi inhibitorami PDE5. . . . . . . . . . . . . . . . . . . . . . . . . . 55
3A.4.5.1.6. Stałe stosowanie inhibitorów PDE5 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
3A.4.5.1.7. Bezpieczeństwo stosowania inhibitorów PDE5 . . . . . . . . . . . . . . . . . . . . . . . . . 56
3A.4.5.1.7.1. Bezpieczeństwo układu krążenia . . . . . . . . . . . . . . . . . . . . . . . . . 56
3A.4.5.1.7.2. Stosowanie azotanów z inhibitorami PDE5 jest przeciwwskazane. . . . . . 56
3A.4.5.1.7.3. Leki hipotensyjne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3A.4.5.1.7.4. Interakcje z α -blokerami . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3A.4.5.1.7.5. Modyfi kacja dawki . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3A.4.5.1.8. Postępowanie w przypadku braku reakcji na inhibitory PDE5 . . . . . . . . . . . . . . . . 57
3A.4.5.1.8.1. Sprawdzenie, czy pacjent używa leku z legalnego źródła . . . . . . . . . . . 57
3A.4.5.1.8.2. Sprawdzenie, czy lek został poprawnie przepisany i czy jest prawidłowo
zażywany . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3A.4.5.1.8.3. Możliwe modyfi kacje leczenia u pacjentów prawidłowo przyjmujących
inhibitory PDE5 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3A.4.5.2. Urządzenia próżniowe. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3A.4.5.3. Terapia falą uderzeniową . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3A.4.6. Terapia drugiej linii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3A.4.6.1. Wstrzyknięcia do ciał jamistych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3A.4.6.1.1. Alprostadil . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3A.4.6.1.2. Leczenie skojarzone . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
3A.4.6.1.3. Alprostadil podawany do cewki moczowej . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3A.4.7. Terapia trzeciej linii (protezy prącia). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3A.4.7.1. Powikłania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3A.4.7.2. Wnioski dotyczące terapii trzecioliniowej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3A.4.8. Rekomendacje dotyczące leczenia zaburzeń erekcji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3A.5. Badania kontrolne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3B. PRZEDWCZESNY WYTRYSK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3B.1. Wprowadzenie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3B.1.1. Epidemiologia. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3B.1.2. Patofi zjologia i czynniki ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3B.1.3. Wpływ przedwczesnego wytrysku na jakość życia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
3B.2. Klasyfi kacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
3B.3. Testy diagnostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3B.3.1. Wewnątrzpochwowy czas opóźnienia ejakulacji. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3B.3.2. Kwestionariusze do oceny przedwczesnego wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3B.3.3. Badanie fi zykalne i badania dodatkowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3B.3.4. Rekomendacje odnośnie diagnostyki w przedwczesnym wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3B.4. Leczenie przedwczesnego wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3B.4.1. Strategie psychologiczne/behawioralne. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3B.4.2. Dapoksetyna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3B.4.3. Stosowanie leków przeciwdepresyjnych poza wskazaniami: inhibitory zwrotnego wychwytu serotoniny
i klomipramina . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3B.4.4. Środki znieczulające miejscowo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
3B.4.4.1. Lidokaina–prylokaina w kremie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
3B.4.5. Tramadol. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
3B.4.6. Inne leki . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
3B.4.6.1. Inhibitory fosfodiesterazy 5 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
3B.4.7. Rekomendacje dotyczące leczenia przedwczesnego wytrysku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
4. DALSZE LECZENIE AMBULATORYJNE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
5. KONFLIKT INTERESÓW. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
6. PIŚMIENNICTWO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
Wstęp
1.1. Cel
Celem poniższych rekomendacji jest przedstawienie aktualnych
poglądów na diagnostykę i leczenie pacjentów
cierpiących na zaburzenia erekcji (ED, ang. erectile dysfunction)
i przedwczesny wytrysk (PE, ang. premature
ejaculation). ED i PE są u mężczyzn głównymi dolegliwościami
z zakresu medycyny seksualnej (Lindau i wsp., 2007;
Rosenberg i Sadovsky, 2007). Terapia farmakologiczna
całkowicie zmieniła podejście diagnostyczne i lecznicze
do ED, z tego powodu Biuro Wytycznych Europejskiego
Towarzystwa Urologicznego (ang. the Guidelines Offi ce of
the European Association of Urology) powołało panel ekspertów
celem zaktualizowania wcześniej opublikowanych
rekomendacji Europejskiego Towarzystwa Urologicznego
(EAU, ang. European Association of Urology) dotyczących
ED (inaczej impotencji).
1.2. Historia publikacji
Pierwsze rekomendacje EAU dotyczące ED zostały opublikowane
w 2000 r., a następnie aktualizowane w latach
2001, 2002, 2004, 2005, 2009, 2013 i 2014. Szczególne
znaczenie miała aktualizacja w 2009 r., kiedy do rekomendacji
włączono temat „Przedwczesny wytrysk” i zmieniono
tytuł całości na „Rekomendacje EAU odnośnie zaburzeń
seksualnych u mężczyzn” (Wespes i wsp., 2009). W 2011 r.
panel ekspertów zdecydował o wydaniu osobnych rekomendacji
poświęconych „skrzywieniu prącia”, które ukazały
się w 2012 r. (Hatzimouratidis i wsp., 2012a). W 2014 r. ukończono
rekomendacje dotyczące priapizmu (Salonia i wsp.,
2014a). Do obecnych rekomendacji z 2015 r. przejrzano
piśmiennictwo na temat skuteczności i bezpieczeństwa
stosowania awanafi lu (nowego inhibitora fosfodiesterazy
5) u mężczyzn z ED i dodano podrozdział na ten temat.
Ponadto, tekst został zaktualizowany i znacząco
zredukowany, aby przedstawiać tylko kluczowe informacje,
i przeformatowany, aby był zgodny z wzorcem
rekomendacji nieonkologicznych EAU i żeby całość rekomendacji
prezentowała podobny format. Równocześnie
opublikowano kilka naukowych podsumowań w czasopiśmie
EAU – „European Urology” (Hatzimouratidis
i wsp., 2012b; Salonia i wsp., 2014b; Wespes i wsp., 2002,
2006), a także kieszonkowy format rekomendacji, które
są dostępne w formie drukowanej i w różnych wersjach
na urządzenia przenośne. Zawierają one główne informacje
z „Rekomendacji dotyczących zaburzeń seksualnych
u mężczyzn”. Są to wersje skrócone, które mogą
wymagać porównania z wersją pełną. Wszystkie te materiały
dostępne są na stronie internetowej EAU dla własnego
użytkowania http://www.uroweb.org/guidelines/
online -guidelines/. Na stronie internetowej EAU znajduje
się także szereg innych rekomendacji EAU w wersji
anglojęzycznej oraz przetłumaczonych na różne języki
przez poszczególne towarzystwa urologiczne.
Dokument ten był recenzowany przed opublikowaniem.
1.3. Skład panelu ekspertów
Panel ekspertów do spraw dysfunkcji seksualnej u mężczyzn
składa się z lekarzy urologów. Członkowie tego
panelu zostali wybrani na podstawie ich doświadczenia,
jako osoby, które mogą reprezentować profesjonalistów
zajmujących się pacjentami cierpiącymi na ED.
Metodologia
Członkowie panelu ekspertów przeprowadzili systematyczne
poszukiwania piśmiennictwa dla ED i PE. Baza
danych MedLine została przeszukana przy użyciu głównych
tytułów medycznych (MeSH, ang. Medical Subject
Headings) i haseł takich jak: „zaburzenia erekcji”, „zaburzenia
seksualne”, „wytrysk”. Pod uwagę były brane
wszystkie artykuły publikowane pomiędzy styczniem
2009 r. (poprzednia aktualizacja) i październikiem 2014 r.
Dla PE bazę MedLine przeszukano pod hasłem „przedwczesny
wytrysk” we wszystkich polach wyszukiwania
i pokrywając ramy czasowe do października 2014 r. Panel
ekspertów zidentyfi kował również ważne problemy i luki
w wiedzy, dzięki czemu ustanowił priorytety dla przyszłych
badań klinicznych.
Wykorzystane źródła piśmiennictwa zostały ocenione
w zależności od poziomu wiarygodności dowodu
naukowego (LE, ang. level of evidence), dzięki czemu zalecenia
zawierają także stopień rekomendacji (GR, ang.
grade of recommendation). W obecnych „Rekomendacjach
dotyczących zaburzeń seksualnych u mężczyzn” EAU
z 2015 r. wszystkie informacje na temat LE i GR zostały
usunięte dla zachowania zwięzłości tekstu. Znajdują
się one na początku pełnej wersji Rekomendacji EAU
i zostały utworzone zgodnie z klasyfi kacją Oksfordzkiego
Centrum do spraw Oceny Poziomu Dowodów Naukowych
w Medycynie (ang. Oxford Centre for Evidence -based
Medicine Levels of Evidence)¹. Celem podawania GR jest
zapewnienie przejrzystości pomiędzy odpowiednimi
dowodami naukowymi a daną rekomendacją.

1a dowody uzyskane z metaanalizy badań z randomizacją
1b dowody uzyskane w co najmniej jednym badaniu
z randomizacją
2a dowody uzyskane z jednego dobrze zaprojektowanego
badania z grupą kontrolną, bez randomizacji
2b dowody uzyskane z co najmniej jednego dobrze
zaprojektowanego badania innego typu, quasi-
-eksperymentalnego
Tabela A. Poziomy wiarygodności dowodu naukowego
1 Przypis tłumaczy: Ze względu na osobne tłumaczenie poszczególnych
rekomendacji EAU do wersji polskiej dołączone zostały tabele A i B oraz
tekst je wyjaśniający z poprzedniej edycji „Rekomendacji dotyczących zaburzeń
seksualnych u mężczyzn”.
 Poziom Typ dowodu
3 dowody uzyskane z dobrze zaprojektowanego
badania nieeksperymentalnego, takiego jak badania
porównawcze, badania korelacji i opisy
przypadków
4 dowody uzyskane z raportów komisji ekspertów,
opinii lub doświadczeń klinicznych szanowanych
autorytetów naukowych
Poziom Typ dowodu
3 dowody uzyskane z dobrze zaprojektowanego
badania nieeksperymentalnego, takiego jak badania
porównawcze, badania korelacji i opisy
przypadków
4 dowody uzyskane z raportów komisji ekspertów,
opinii lub doświadczeń klinicznych szanowanych
autorytetów naukowych
Tabela B. Stopnie rekomendacji
 Stopień Charakter zaleceń
A na podstawie badań klinicznych dobrej jakości
i spójności, w tym co najmniej jednego randomizowanego
badania, skierowanego na konkretne
zalecenia
B na podstawie prawidłowo przeprowadzonych
badań klinicznych, jednak bez randomizowanych
badań klinicznych
C utworzone pomimo braku dobrej jakości badań
klinicznych
Stopień Charakter zaleceń
A na podstawie badań klinicznych dobrej jakości
i spójności, w tym co najmniej jednego randomizowanego
badania, skierowanego na konkretne
zalecenia
B na podstawie prawidłowo przeprowadzonych
badań klinicznych, jednak bez randomizowanych
badań klinicznych
C utworzone pomimo braku dobrej jakości badań
klinicznych
Trzeba zaznaczyć, że kiedy rekomendacje są przygotowywane,
nie istnieje ustalony związek pomiędzy LE
a GR. W szczególności dostępność badań randomizowanych
będących podstawą rekomendacji nie musi automatycznie
oznaczać, że ta rekomendacja otrzyma stopień A,
jeśli w tych badaniach znajdują się ograniczenia metodologiczne
lub badania nie mają zgodnych wyników.
Odwrotnie, brak popierających badań o wysokim LE
nie musi od razu wykluczać rekomendacji z poziomu A,
w sytuacji gdy rekomendacja wynika z niepodważalnych
wyników badań klinicznych. Ponadto, mogą mieć miejsce
sytuacje wyjątkowe, w których rekomendacja nie może
zostać poparta badaniami, ponieważ badania takie nie
mogą zostać przeprowadzone, na przykład z powodów
etycznych lub innych. W takich przypadkach uważa się,
że jednoznaczne rekomendacje są pomocne czytelnikowi.
Jeśli kiedykolwiek taka sytuacja ma miejsce, w tekście
zostaje to zaznaczone z uwagą ,,uaktualnione na podstawie
zgody zespołu”. Jakość LE jest bardzo istotnym
czynnikiem, ale musi uwzględniać równowagę między
korzyściami i stratami, wartościami i preferencjami oraz
kosztami, kiedy ustalany jest GR.
Biuro wytycznych EAU nie przeprowadza analiz
kosztów, ani nie zawsze może uwzględniać warunki lokalne
lub ogólnokrajowe. Jednakże, jeśli informacje na dany
temat są dostępne, zespół ekspertów bierze je pod uwagę.
REKOMENDACJE
3A. Zaburzenia erekcji
3A.1. Epidemiologia/etiologia/patofi zjologia
Wzwód prącia (erekcja) jest złożonym zjawiskiem, obejmującym
subtelne i skoordynowane współdziałanie
pomiędzy układem nerwowym, naczyniowym i tkankowym.
Na zjawisko to składa się rozszerzenie naczyń
tętniczych, rozkurcz mięśni gładkich i aktywacja mechanizmu
żylno -okluzyjnego ciał jamistych (Gratzke i wsp.,
2010). Zaburzenia erekcji są defi niowane jako stała niezdolność
do osiągnięcia i utrzymania erekcji w stopniu
pozwalającym na odbycie satysfakcjonującego stosunku
płciowego (NIH, 1993). Zaburzenia erekcji mogą mieć
wpływ na zdrowie fi zyczne i psychospołeczne, jak również
znacząco wpływać na jakość życia (QoL, ang. quality of
life) zarówno u osob nań cierpiących, jak i ich partnerek
(Feldman i wsp., 1994; Fisher i wsp., 2009; Salonia i wsp.,
2012c). Jest coraz więcej dowodów na to, że ED może
być wczesną oznaką choroby wieńcowej i chorób naczyń
obwodowych. Zaburzenia erekcji nie powinny być traktowane
tylko jako kwestia jakości życia, ale też jako ostrzeżenie
przed potencjalną chorobą układu krążenia (Dong
i wsp., 2011; Gandaglia i wsp., 2014; Gupta i wsp., 2011).
3A.1.1. Epidemiologia
Dane epidemiologiczne pokazują duże rozpowszechnienie
i częstość występowania ED na całym świecie. Między
innymi Badania z Massachusetts nad Starzeniem się
Mężczyzn (MMAS, ang. Massachusetts Male Aging Study)
(Feldman i wsp., 1994) wykazały, że ogólne rozpowszechnienie
ED na obszarze Bostonu wynosiło 52% u mężczyzn
w wieku 40–70 lat; szczegółowe rozpowszechnienie
ED minimalnego, umiarkowanego i ciężkiego wynosiło
odpowiednio 17,2%, 25,2% i 9,6%. W Kolonii badania
u mężczyzn w wieku 30–80 lat wykazały rozpowszechnienie
ED – 19,2%, z gwałtownym wzrostem związanym
z wiekiem 2,3–53,4% (Braun i wsp., 2000). Częstość
występowania ED (nowe przypadki na 1000 mężczyzn
rocznie) wynosiła 26/1000/rok, według danych z badania
MMAS (Johannes i wsp., 2000) z długim okresem obserwacji
i 19,2 (średni okres obserwacji 4,2 lata) w badaniu
duńskim (Schouten i wsp., 2005). W badaniu przekrojowym
przeprowadzonym wśród mężczyzn poszukujących
pomocy medycznej z powodu ED jeden na czterech
mężczyzn był poniżej 40. roku życia, przy prawie 50%
młodych mężczyzn z ciężką postacią ED (Capogrosso
i wsp., 2013). Różnice między tymi badaniami można
wytłumaczyć różnicami w metodologii badań, w wieku
chorych i statusie kulturowym badanej populacji.
3A.1.2. Czynniki ryzyka
Zaburzenia erekcji mają wspólne niemodyfi kowalne
i modyfi kowalne czynniki ryzyka z chorobami układu
krążenia (np. otyłość, cukrzyca, dyslipidemia, zespół
metaboliczny, brak ćwiczeń i palenie tytoniu) (Buvat
i wsp., 2010; Jackson i wsp., 2010; Salonia i wsp., 2012c).
W tym kontekście mężczyźni z łagodnym ED mają
podobne czynniki ryzyka do osób z ED w ogólnej populacji,
które zostały przebadane w ramach badań klinicznych
(Lee i wsp., 2011b). Dlatego łagodne postacie ED
są istotnym wskaźnikiem ryzyka wystąpienia schorzeń
utajonych (choroby układu sercowo -naczyniowego) (Lee i wsp., 2011b). Wiele badań dowodzi, że zmiana stylu
życia (Gandaglia i wsp., 2014; Glina i wsp., 2013) i farmakoterapia
(Gandaglia i wsp., 2014; Vlachopoulos i wsp.,
2013) czynników ryzyka chorób sercowo -naczyniowych
mogą poprawiać funkcje seksualne u mężczyzn z ED.
Jednakże należy podkreślić, że konieczne jest przeprowadzenie
prospektywnych badań z grupą kontrolną, aby
dokładnie określić znaczenie ćwiczeń fi zycznych i innych
elementów stylu życia w prewencji i leczeniu ED (Gupta
i wsp., 2011).
Badania epidemiologiczne jednoznacznie wykazały
związek pomiędzy objawami z dolnych dróg moczowych
(LUTS, ang. lower urinary tract symptoms) oraz łagodnym
rozrostem gruczołu krokowego (BPH, ang. benign prostatic
hyperplasia) a zaburzeniami seksualnymi niezależnie
od wieku, innych chorób, różnych elementów stylu życia
(Seftel i wsp., 2013). W Międzynarodowym Badaniu nad
Starzeniem się Mężczyzn (MSAM -7, ang. Multinational
Survey on the Aging Male), przeprowadzonym w USA,
Francji, Niemczech, Włoszech, Holandii, Hiszpanii
i Wielkiej Brytanii, porównywano związek pomiędzy
LUTS i zaburzeniami seksualnymi u >12 000 mężczyzn
w wieku 50–80 lat. Wśród 83% mężczyzn, którzy określili
się jako aktywni seksualnie, rozpowszechnienie LUTS
wynosiło 90%, ED 49%, a całkowity brak erekcji występował
u 10% pacjentów. Ponadto, rozpowszechnienie
zaburzeń wytrysku wynosiło 46% (Rosen i wsp., 2003).
3A.1.3. Patofi zjologia
Patofi zjologia ED może być naczyniopochodna, neuropochodna,
anatomiczna, hormonalna, lekopochodna
i psychogenna (tabela 1) (Gratzke i wsp., 2010).
3A.1.4. Zaburzenia erekcji po radykalnej
prostatektomii, radioterapii i brachyterapii
Radykalne usunięcie gruczołu krokowego – radykalna
prostatektomia (RP, ang. radical prostatectomy) w jakiejkolwiek
formie (otwartej, laparoskopowej, przy użyciu
robota) jest procedurą powszechnie przeprowadzaną
u pacjentów z klinicznie zlokalizowanym rakiem gruczołu
krokowego i przewidywaną długością życia przynajmniej
10 lat. Procedura ta może prowadzić do specyfi cznych
następstw leczenia, które mają wpływ na jakość życia
związaną ze stanem zdrowia. Staje się to coraz ważniejsze
z powodu coraz częstszego rozpoznawania raka prostaty
u młodszych pacjentów (Salonia i wsp., 2012a, 2012b).
Badania pokazują, że 25–75% mężczyzn doświadcza
pooperacyjnego ED (Sanda i wsp., 2008). Z powodu coraz
większego znaczenia RP z zastosowaniem robota (RARP,
ang. robot -assisted RP) ten typ zabiegu chirurgicznego
staje się paradygmatem ze względu na dobre wyniki
funkcjonalne po operacji. Zestawienia systematyczne
prac naukowych wykazały istotną przewagę RARP nad
prostatektomią z dostępu łonowego, jeśli weźmie się pod
uwagę odsetek mężczyzn zdolnych do uzyskania erekcji
12 miesięcy po operacji (Ficarra i wsp., 2012), bez istotnych
różnic między laparoskopową RP a RARP. Jednakże konieczne jest przeprowadzenie większej ilości kontrolowanych
badań, aby wykazać rzeczywistą przewagę RARP,
jeśli chodzi o liczbę ED po operacji (Isgoren i wsp., 2014).
Ogólnie rzecz biorąc, wiek pacjenta oraz umiejętności
chirurgów, a w konsekwencji możliwość zachowania
pęczków naczyniowo -nerwowych, wydają się być tutaj
głównymi czynnikami odpowiadającymi za zachowanie
potencji po operacji (Salonia i wsp., 2012a, 2012b).
Potencja przedoperacyjna jest głównym czynnikiem
wpływającym na powrót funkcji erekcyjnej po operacji.
Pacjenci, u których rozważana jest RP z zachowaniem
pęczków naczyniowo -nerwowych, powinni
mieć zachowaną potencję przed operacją (Salonia i wsp.,
2012a, 2012b). Aspekty czasowe mają duże znaczenie
kliniczne w odzyskaniu funkcji erekcyjnej. Dostępne dane
potwierdzają obserwację, że powrót funkcji erekcyjnej
może również nastąpić kilka lat po RP (do 48 miesięcy).
Leczenie ED (każdego typu) powinno być przeprowadzone
jak najszybciej po operacji (Salonia i wsp., 2012b;
Sanda i wsp., 2008).
Zaburzenia erekcji są częstym następstwem radioterapii
z użyciem pól zewnętrznych i brachyterapii stosowanych
przy raku prostaty (Incrocci i Jensen, 2013;
Stember i wsp., 2012). Mechanizmy przyczyniające się
do powstania ED po napromieniowaniu prostaty obejmują
uszkodzenie pęczków naczyniowo -nerwowych,
układu naczyniowego prącia oraz tkanki strukturalnej
ciał jamistych (Incrocci i Jensen, 2013; Stember i Mulhall,
2012). Metody alternatywnego leczenia raka prostaty,
takie jak krioterapia i skupiona wiązka fal ultradźwiękowych
o wysokim natężeniu (HIFU, ang. high intensity
focus ultrasound), są związane z takim samym lub
wyższym odsetkiem ED w porównaniu do zabiegu chirurgicznego
lub radioterapii (Cordeiro i wsp., 2012; Williams
i wsp., 2012).
3A.1.5. Wnioski odnośnie epidemiologii/etiologii/
patofi zjologii zaburzeń erekcji

3A.2. Klasyfi kacja
Zaburzenia erekcji są zwykle klasyfi kowane w zależności
od etiologii w trzech kategoriach, takich jak przyczyny
organiczne, psychogenne i mieszane. Jednakże podział
ten powinien być stosowany z rozwagą, gdyż większość
przypadków ma etiologię mieszaną. Z tego powodu sugeruje
się stosowanie terminologii: przyczyna pierwotnie
organiczna lub pierwotnie psychogenna.
3A.3. Diagnostyka
3A.3.1. Podstawowe badania lekarskie
Pierwszym krokiem w diagnostyce ED (rycina 1) jest
zawsze zebranie szczegółowego wywiadu medycznego
oraz dotyczącego życia seksualnego pacjentów i ich partnerek,
jeśli jest to możliwe (Hatzichristou i wsp., 2002;
Th e Process of Care Consensus Panel, 1999). W tym kontekście
zebranie szerokiego wywiadu może ujawnić jedną
z chorób, które są związane z ED (Hatzichristou i wsp.,
2002; Th e Process of Care Consensus Panel, 1999). Ważne
jest, aby w trakcie zbierania wywiadu panowała swobodna
atmosfera. Łatwiej będzie wówczas: 1) zadawać
pytania na temat ED i innych aspektów życia seksualnego
oraz 2) wyjaśnić pacjentowi i jego partnerce procedury
diagnostyczne i terapeutyczne.
3A.3.2. Wywiad dotyczący życia seksualnego
Historia życia seksualnego (jeśli jest dostępna) musi
zawierać informacje dotyczące obecnych i poprzednich
związków seksualnych, obecnego stanu emocjonalnego,
początku i czasu trwania problemów z erekcją, poprzednich
konsultacji i metod leczenia. Dane dotyczące stanu
zdrowia seksualnego partnerki lub partnerek seksualnych
(jeśli to możliwe) mogą również okazać się przydatne.
Szczegółowy opis sztywności prącia oraz czasu trwania
erekcji, zarówno w trakcie stosunku, jak i porannych
erekcji, problemy z pożądaniem seksualnym, podnieceniem,
wytryskiem i orgazmem powinny także zostać
odnotowane (Th e Process of Care Consensus Panel, 1999;
Althof i wsp., 2013). Walidowane kwestionariusze psychometryczne,
takie jak międzynarodowy wskaźnik funkcji
erekcyjnej (IIEF, ang. International Index of Erectile Function)
(Rosen i wsp., 1997) lub jego skrócona wersja – Inwentarz
Zdrowia Seksualnego dla Mężczyzn (SHIM, ang. Sexual
Health Inventory for Men) pomagają oszacować różne
domeny funkcji seksualnych (np. pożądanie seksualne,
funkcję erekcyjną, orgazm, stosunek płciowy i ogólną
satysfakcję ze współżycia seksualnego), jak również wpływ
specyfi cznego sposobu leczenia. Analiza psychometryczna
zawiera ocenę stopnia twardości prącia (ang. erectile hardness
score), co wykorzystuje się w praktyce klinicznej oraz
w badaniach klinicznych (Mulhall i wsp., 2007).
W codziennej praktyce lekarskiej dla stwierdzenia klinicznej
depresji polecane jest zastosowanie 2 -pytaniowej
skali depresji: „Czy w ostatnim miesiącu często czuł się pan
smutny, przygnębiony i miał uczucie braku sensu życia?
Czy w ostatnim miesiącu zaniepokoiło pana małe zainteresowanie
wykonywanymi czynnościami, bądź nie miał pan
z ich wykonywania przyjemności?” (Whooley i wsp., 1997).
W każdym przypadku pacjenci powinni zostać poddani
badaniom w kierunku wykluczenia hipogonadyzmu
(niedoboru testosteronu), któremu towarzyszą objawy
zmniejszonej energii życiowej i libido, uczucia znużenia,
zaburzenia poznawcze oraz LUTS. Tam, gdzie są do tego
wskazania, można użyć kwestionariusze do badań przesiewowych,
np. Międzynarodowego kwestionariusza objawów ze strony gruczołu krokowego (IPSS, ang.International Prostate Symptom Score) (Oelke i wsp., 2013).
3A.3.3. Badanie fizykalne
Każdy pacjent musi zostać poddany badaniu fi zykalnemu
skoncentrowanemu na układach moczowo -płciowym,
wewnątrzwydzielniczym, naczyniowym i nerwowym
(David -Joseph i wsp., 1995; Ghanem i wsp., 2013). Badanie
lekarskie może ujawnić niespodziewane rozpoznania,
takie jak choroba Peyroniego, przednowotworowe lub
nowotworowe zmiany w układzie płciowym, powiększenie
gruczołu krokowego lub nieregularność jego struktury,
albo też objawy sugerujące hipogonadyzm (małe
jądra, nieprawidłowe wtórne cechy płciowe). Powinno
się zmierzyć ciśnienie krwi i tętno, jeśli nie było to zrobione
w trakcie ostatnich 3–6 miesięcy.
3A.3.4. Testy laboratoryjne
Testy laboratoryjne muszą być dostosowane do rodzaju
skarg pacjenta i do czynników ryzyka. Chory może
wymagać oznaczenia stężenia glukozy na czczo, hemoglobiny
glikowanej HbA1c i profi lu lipidowego, jeśli
ostatnio te badania nie zostały wykonane. Testy hormonalne
obejmują oznaczenie stężenia we krwi testosteronu
całkowitego w godzinach porannych. Jeśli są wskazania,
można wyliczyć testosteron biodostępny lub wolny,
aby ocenić całkowity profi l testosteronu. Jednak próg
stężenia testosteronu, przy którym występuje ED, jest
bardzo niski, a ED jest zazwyczaj przejawem poważniejszych
przypadków hipogonadyzmu (Buvat i wsp., 2010;
Bhasin i wsp., 2010; Isidori i wsp., 2014; O’Connor i wsp.,
2011). Dla poziomów testosteronu >8 nmol/L związek
pomiędzy stężeniem testosteronu a funkcjami seksualnymi
jest bardzo mały (Bhasin i wsp., 2010; Buvat
i wsp., 2010; Isidori i wsp., 2014; O’Connor i wsp., 2011).
U wybranych pacjentów mogą być brane pod uwagę
dodatkowe testy laboratoryjne określające poziom, np.
antygenu specyfi cznego dla prostaty (PSA, ang. prostate
specifi c antygen) (Heidenreich i wsp., 2014), prolaktyna lub
hormonu luteinizującego (LH, ang. luteinizing hormone)
(Maggi i wsp., 2013). Pomimo że badanie fi zykalne i testy
laboratoryjne u większości mężczyzn z ED nie prowadzą
do wykrycia konkretnej przyczyny, nie powinno się ich
pomijać, gdyż mogą ujawnić współwystępowanie innych
chorób (Ghanem i wsp., 2013).
3A.3.5. Układ krążenia i aktywność seksualna:
ryzyko dla pacjenta
U pacjentów poszukujących terapii ED wysokie jest prawdopodobieństwo
wystąpienia chorób układu krążenia.
Badania epidemiologiczne podkreślają związek pomiędzy
sercowo -naczyniowymi i metabolicznymi czynnikami
ryzyka a dysfunkcją seksualną u mężczyzn (Laumann
i wsp., 1999b) i kobiet (Miner i wsp., 2012). Zgłaszane zaburzenia
erekcji mogą zwiększać czułość badań przesiewowych
bezobjawowych chorób układu krążenia u mężczyzn
z cukrzycą (Gazzaruso i wsp., 2011; Turek i wsp., 2013).
Zaburzenia erekcji znacząco zwiększają ryzyko chorób
układu krążenia, choroby wieńcowej serca, udaru mózgu,
większej umieralności z wszystkich powodów, a wzrost
ten jest prawdopodobnie niezależny od konwencjonalnych
czynników ryzyka sercowo -naczyniowego (Dong i wsp.,
2011; Gandaglia i wsp., 2014; Vlachopoulos i wsp., 2014).
Wytyczne EAU dotyczące diagnostyki i leczenia mężczyzn
z ED zostały zmienione na podstawie poprzednio
publikowanych wytycznych z konferencji Princeton
Consensus dotyczących zaburzeń seksualnych i ryzyka
sercowego (Dong i wsp., 2011). Konferencja Princeton
Consensus (panel ekspertów) była poświęcona optymalizacji
funkcji seksualnych i zachowaniu zdrowia
sercowo -naczyniowego (DeBusk i wsp., 2000; Kostis i wsp.,
2005; Nehra i wsp., 2012). Zgodnie z tymi wytycznymi,
pacjenci z ED mogą być podzieleni na trzy kategorie
ryzyka sercowo -naczyniowego (tabela 2), które mogą
znaleźć zastosowanie jako podstawa algorytmu postępowania
u pacjentów, którzy pragną rozpocząć albo
wznowić aktywność seksualną (rycina 2). Lekarz może
również ocenić ryzyko aktywności seksualnej na podstawie
poziomu tolerancji na wysiłek fi zyczny, który
można określić, biorąc pod uwagę wywiad medyczny
pacjenta (Vlachopoulos i wsp., 2013).
3A.3.5.1. Kategoria niskiego ryzyka
Kategoria niskiego ryzyka dotyczy pacjentów, u których
nie występuje większe ryzyko sercowo -naczyniowe związane
z aktywnością seksualną. Niskie ryzyko wiąże się
ze zdolnością do wykonywania ćwiczeń fi zycznych
o średniej intensywności, defi niowanych jako >6 „metabolicznych
odpowiedników wydatku energetycznego
w stanie spoczynku”, bez objawów. Zgodnie z obecną
wiedzą na temat aktywności fi zycznej lub stresu emocjonalnego
związanego z aktywnością seksualną, pacjenci
niskiego ryzyka nie potrzebują testów kardiologicznych,
ani oceny medycznej przed podjęciem lub wznowieniem
współżycia lub terapii zaburzeń seksualnych.
3A.3.5.2. Kategoria średniego
lub nieokreślonego ryzyka
Kategoria średniego lub nieokreślonego ryzyka dotyczy
pacjentów z możliwą chorobą serca lub tych, których
profi l ryzyka wymaga przeprowadzenia badań lub oceny
medycznej przed wznowieniem aktywności seksualnej.
W zależności od wyników badań pacjent może być zakwalifi
kowany do grupy wysokiego bądź niskiego ryzyka.
U niektórych pacjentów może być potrzebna konsultacja
kardiologiczna, aby pomóc lekarzowi prowadzącemu
w określeniu bezpieczeństwa aktywności seksualnej.
3A.3.5.3. Kategoria wysokiego ryzyka
Pacjenci wysokiego ryzyka mają chorobę serca, która
jest wystarczająco poważna i/lub niestabilna i niesie
znaczące ryzyko przy podjęciu aktywności fi zycznej.
Większość pacjentów należących do tej kategorii cierpi
na objawową chorobę serca, od umiarkowanej do ciężkiej.
3A.3.5. Układ krążenia i aktywność seksualna:
ryzyko dla pacjenta
U pacjentów poszukujących terapii ED wysokie jest prawdopodobieństwo
wystąpienia chorób układu krążenia.
Badania epidemiologiczne podkreślają związek pomiędzy
sercowo -naczyniowymi i metabolicznymi czynnikami
ryzyka a dysfunkcją seksualną u mężczyzn (Laumann
i wsp., 1999b) i kobiet (Miner i wsp., 2012). Zgłaszane zaburzenia
erekcji mogą zwiększać czułość badań przesiewowych
bezobjawowych chorób układu krążenia u mężczyzn
z cukrzycą (Gazzaruso i wsp., 2011; Turek i wsp., 2013).
Zaburzenia erekcji znacząco zwiększają ryzyko chorób
układu krążenia, choroby wieńcowej serca, udaru mózgu,
większej umieralności z wszystkich powodów, a wzrost
ten jest prawdopodobnie niezależny od konwencjonalnych
czynników ryzyka sercowo -naczyniowego (Dong i wsp.,
2011; Gandaglia i wsp., 2014; Vlachopoulos i wsp., 2014).
Wytyczne EAU dotyczące diagnostyki i leczenia mężczyzn
z ED zostały zmienione na podstawie poprzednio
publikowanych wytycznych z konferencji Princeton
Consensus dotyczących zaburzeń seksualnych i ryzyka
sercowego (Dong i wsp., 2011). Konferencja Princeton
Consensus (panel ekspertów) była poświęcona optymalizacji
funkcji seksualnych i zachowaniu zdrowia
sercowo -naczyniowego (DeBusk i wsp., 2000; Kostis i wsp.,
2005; Nehra i wsp., 2012). Zgodnie z tymi wytycznymi,
pacjenci z ED mogą być podzieleni na trzy kategorie
ryzyka sercowo -naczyniowego (tabela 2), które mogą
znaleźć zastosowanie jako podstawa algorytmu postępowania
u pacjentów, którzy pragną rozpocząć albo
wznowić aktywność seksualną (rycina 2). Lekarz może
również ocenić ryzyko aktywności seksualnej na podstawie
poziomu tolerancji na wysiłek fi zyczny, który
można określić, biorąc pod uwagę wywiad medyczny
pacjenta (Vlachopoulos i wsp., 2013).
3A.3.5.1. Kategoria niskiego ryzyka
Kategoria niskiego ryzyka dotyczy pacjentów, u których
nie występuje większe ryzyko sercowo -naczyniowe związane
z aktywnością seksualną. Niskie ryzyko wiąże się
ze zdolnością do wykonywania ćwiczeń fi zycznych
o średniej intensywności, defi niowanych jako >6 „metabolicznych
odpowiedników wydatku energetycznego
w stanie spoczynku”, bez objawów. Zgodnie z obecną
wiedzą na temat aktywności fi zycznej lub stresu emocjonalnego
związanego z aktywnością seksualną, pacjenci
niskiego ryzyka nie potrzebują testów kardiologicznych,
ani oceny medycznej przed podjęciem lub wznowieniem
współżycia lub terapii zaburzeń seksualnych.
3A.3.5.2. Kategoria średniego
lub nieokreślonego ryzyka
Kategoria średniego lub nieokreślonego ryzyka dotyczy
pacjentów z możliwą chorobą serca lub tych, których
profi l ryzyka wymaga przeprowadzenia badań lub oceny
medycznej przed wznowieniem aktywności seksualnej.
W zależności od wyników badań pacjent może być zakwalifi
kowany do grupy wysokiego bądź niskiego ryzyka.
U niektórych pacjentów może być potrzebna konsultacja
kardiologiczna, aby pomóc lekarzowi prowadzącemu
w określeniu bezpieczeństwa aktywności seksualnej.
3A.3.5.3. Kategoria wysokiego ryzyka
Pacjenci wysokiego ryzyka mają chorobę serca, która
jest wystarczająco poważna i/lub niestabilna i niesie
znaczące ryzyko przy podjęciu aktywności fi zycznej.
Większość pacjentów należących do tej kategorii cierpi
na objawową chorobę serca, od umiarkowanej do ciężkiej.
Tabela 2. Klasyfi kacja czynników ryzyka sercowo -naczyniowego (na podstawie
2. Konsensusu z Princeton, Kostis i wsp., 2005)
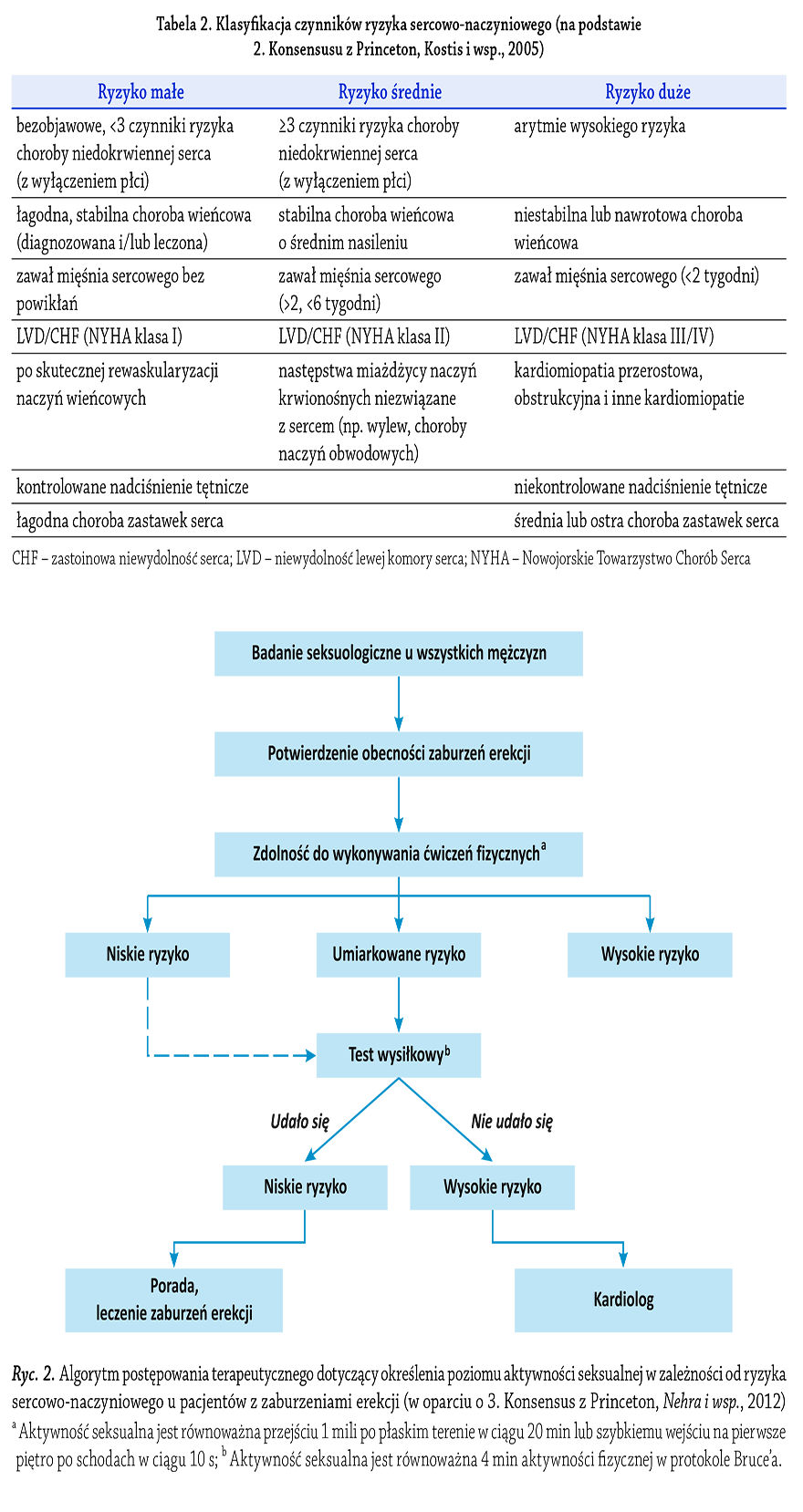
Ryc. 2. Algorytm postępowania terapeutycznego dotyczący określenia poziomu aktywności seksualnej w zależności od ryzyka
sercowo -naczyniowego u pacjentów z zaburzeniami erekcji (w oparciu o 3. Konsensus z Princeton, Nehra i wsp., 2012)
a Aktywność seksualna jest równoważna przejściu 1 mili po płaskim terenie w ciągu 20 min lub szybkiemu wejściu na pierwsze
piętro po schodach w ciągu 10 s; b Aktywność seksualna jest równoważna 4 min aktywności fi zycznej w protokole Bruce’a.
Osoby z wysokim ryzykiem powinny zostać skierowane
na badania kardiologiczne i leczenie. Aktywność seksualna
powinna być wstrzymana do czasu, gdy stan
pacjenta zostanie ustabilizowany poprzez leczenie lub
gdy kardiolog i/lub internista stwierdzą, że wznowienie
aktywności płciowej jest bezpieczne.
3A.3.6. Specjalistyczne testy diagnostyczne
Większość pacjentów z ED może być prowadzona
w ramach opieki seksuologicznej, ale niektórzy mogą
potrzebować bardziej szczegółowych testów diagnostycznych
(tabele 3 i 4).
3A.3.6.1. Ocena nocnej zmiany objętości
i sztywności prącia
Nocna ocena sztywności i twardości prącia (NTPR, ang.
nocturnal penile tumescence and rigidity) powinna być wykonywana
w ciągu co najmniej dwóch nocy. Na sprawny
czynnościowo mechanizm erekcji wskazuje co najmniej
60% sztywność odnotowana na szczycie prącia, która
trwa przez ≥10 min (Hatzichristou i wsp., 1998).
3A.3.6.2. Test wstrzyknięcia substancji
wazoaktywnych do ciał jamistych
Test wstrzyknięcia do ciał jamistych substancji wazoaktywnych
daje niewiele informacji o stanie naczyń
krwionośnych. Za test pozytywny uważa się sztywną
erekcję (niezdolność do zgięcia prącia), która pojawia
się w ciągu 10 min od wstrzyknięcia i utrzymuje przez
30 min (Hatzichristou i wsp., 1999). Ogólnie mówiąc, test
ten jest nieprzekonujący jako procedura diagnostyczna
i jeśli istnieją wskazania kliniczne, należy wykonać
badanie prącia metodą Dopplera (ang. duplex Doppler).
3A.3.6.3. Ultrasonografi a Doppler duplex prącia
Za prawidłowe wyniki uznaje się szczytowo -skurczową
szybkość przepływu krwi >30 cm/s i końcowo -rozkurczową
<3 cm/s, a współczynnik oporu >0,8 (Sikka i wsp.,
2013). Dalsze badanie stanu naczyń krwionośnych nie
jest potrzebne, jeśli wyniki badania ultrasonografi cznego
są w normie.
3A.3.6.4. Arteriografi a i dynamiczna przepływowa
kawernozometria lub kawernozografia
Arteriografi a i dynamiczna przepływowa kawernozometria
lub kawernozografi a powinny być wykonywane
tylko u pacjentów, którzy są kwalifi kowani do operacji
rekonstrukcji naczyniowej (Glina i Ghanem, 2013).
3A.3.6.5. Ocena psychiatryczna
Pacjenci z zaburzeniami psychiatrycznymi powinni być
skierowani do psychiatry, który specjalizuje się w zaburzeniach
seksualnych. U młodszych pacjentów (<40 lat),
z długotrwałym pierwotnym ED (Capogrosso i wsp., 2013),
badanie psychiatryczne może być pomocne, jeszcze
zanim zostanie przeprowadzone badanie fi zykalne.
3A.3.6.6. Anomalie budowy prącia
Korekcja chirurgiczna może być potrzebna u pacjentów
z ED w związku z anomaliami budowy prącia (np. spodziectwem,
wrodzonym skrzywieniem prącia, chorobą
Peyroniego z zachowaną sztywnością prącia).
3A.3.7. Edukacja pacjenta – konsultacja
i skierowania do dalszych badań
Konsultacja pacjenta z ED powinna uwzględniać rozmowę
dotyczącą oczekiwań i potrzeb zarówno pacjenta, jak
i jego stałej partnerki seksualnej, jeśli jest to możliwe.
Podczas rozmowy powinno się również sprawdzić, czy
pacjent i jego partnerka rozumieją termin „zaburzenia

Tabela 3. Wskazania do specyfi cznych testów diagnostycznych
Początkowe zaburzenia erekcji (niespowodowane chorobą organiczną ani przyczyną psychogenną)
Młodzi pacjenci po urazie miednicy bądź krocza, którzy potencjalnie mogliby osiągnąć korzyści dzięki operacji
naczyniowej
Pacjenci z deformacją prącia, która może wymagać korekcji chirurgicznej, np. choroba Peyroniego, wrodzone
skrzywienie prącia
Pacjenci ze złożonymi zaburzeniami psychiatrycznymi lub psychoseksualnymi
Pacjenci ze złożonymi zaburzeniami endokrynologicznymi
Szczegółowe badania mogą być zalecone na prośbę pacjenta bądź jego partnerki
Powody medyczno -prawne (np. implantacja protezy prącia, molestowanie seksualne)
Tabela 4. Specyfi czne testy diagnostyczne
NTPR przy użyciu Rigiscan
Badania naczyniowe:
– test wstrzyknięcia do ciał jamistych substancji wazoaktywnej
– badanie ultrasonografi czne prącia metodą dynamic duplex doppler
– dynamiczna kawernozometria i kawernozografi a prącia
– arteriografi a tętnicy sromowej wewnętrznej
Badania neurologiczne np. badanie odruchu opuszkowo -jamistego, badanie przewodnictwa nerwowego
Badania endokrynologiczne
Specjalistyczna ocena psychodiagnostyczna
NTPR – nocna ocena sztywności i twardości prącia

Ryc. 3. Algorytm postępowania w leczeniu zaburzeń erekcji
PDE5 – fosfodiesteraza typu 5
erekcji” i wyniki testów diagnostycznych i przedstawić
rozsądny wybór opcji leczenia (Montorsi i wsp.,
2010). Edukacja pacjenta i jego partnerki jest kluczową
częścią postępowania terapeutycznego u pacjentów z ED
(Hatzichristou i wsp., 2010; Montorsi i wsp., 2010).3A.3.8. Rekomendacje dotyczące postępowania
diagnostycznego w zaburzeniach erekcji
3A.3.8. Rekomendacje dotyczące postępowania
diagnostycznego w zaburzeniach erekcji3A.3.8. Rekomendacje dotyczące postępowania
diagnostycznego w zaburzeniach erekcji
Część dalsza w zakładce Część _2
REKOMENDACJE DOTYCZĄCE ZABURZEŃ... / GUIDELINES ON MALE SEXUAL ... / Część_2
erekcji” i wyniki testów diagnostycznych i przedstawić
rozsądny wybór opcji leczenia (Montorsi i wsp.,
2010). Edukacja pacjenta i jego partnerki jest kluczową
częścią postępowania terapeutycznego u pacjentów z ED
(Hatzichristou i wsp., 2010; Montorsi i wsp., 2010).
3A.3.8. Rekomendacje dotyczące postępowania
diagnostycznego w zaburzeniach erekcji
ED – zaburzenia erekcji; GR – stopień rekomendacji; LE – poziom
wiarygodności dowodu naukowego

ED – zaburzenia erekcji; GR – stopień rekomendacji; LE – poziom
wiarygodności dowodu naukowego
3A.4. Leczenie zaburzeń erekcji
3A.4.1. Możliwości leczenia
Zaburzenia erekcji mogą być związane z modyfi kowalnymi
lub odwracalnymi czynnikami ryzyka, włączając
w to styl życia bądź wpływ leków. Czynniki te mogą być
modyfi kowane przed lub w tym samym czasie, kiedy
stosowane są specyfi czne terapie. Zaburzenia erekcji
mogą być związane z towarzyszącymi lub przyczynowymi
chorobami (takimi jak choroby endokrynologiczne
i metaboliczne, np. cukrzyca, niektóre choroby układu
krążenia, np. nadciśnienie), które powinny być poddane
dobrej kontroli, co jest pierwszym etapem leczenia ED.
Z reguły ED można skutecznie osłabić obecnie stosowanymi
metodami leczenia, ale nie można wyleczyć.
Jedynymi wyjątkami są psychogenne ED, pourazowe
naczyniopochodne ED u młodych pacjentów i ED spowodowane
przyczynami hormonalnymi, np. hipogonadyzmem
i hiperprolaktynemią (Isidori i wsp., 2014; Maggi
i wsp., 2013), które potencjalnie mogą zostać wyleczone
konkretną terapią. Większość mężczyzn z ED jest leczona
metodami, które nie są związane z przyczyną. Efektem
takiego postępowania jest przyjęcie strategii leczenia uzależnionej
od jej skuteczności, bezpieczeństwa, inwazyjności
i kosztów, jak również preferencji pacjenta (Montorsi
i wsp., 2010). W tym kontekście dialog lekarz–pacjent
(partnerka) jest niezbędny przez cały okres leczenia ED.
Ocena opcji terapeutycznych musi brać pod uwagę satysfakcję
pacjenta i partnerki, jak również inne czynniki
wpływające na jakość życia oraz efektywność i bezpieczeństwo
leczenia. Algorytm leczenia ED przedstawiony
został na rycinie 3.
3A.4.2. Styl życia w przypadkach zaburzeń erekcji
z towarzyszącymi czynnikami ryzyka chorób
układu krążenia
Podstawą postępowania lekarskiego w przypadkach
ED jest identyfi kacja odwracalnych czynników ryzyka.
Zmiany w stylu życia i modyfi kacja czynników ryzyka
muszą poprzedzać bądź towarzyszyć każdemu leczeniu
farmakologicznemu. Większość korzyści wynikających
ze zmiany stylu życia można uzyskać u mężczyzn z ED
i współistniejącymi chorobami sercowo -naczyniowymi
i metabolicznymi, takimi jak cukrzyca czy nadciśnienie
tętnicze (Gupta i wsp., 2011; Moyad i wsp., 2004).
3A.4.3. Zaburzenia erekcji po radykalnej
prostatektomii
Stosowanie leków poprawiających erekcję po radykalnej
prostatektomii jest ważne ze względu na możliwość uzyskania
erekcji po operacji. Kilka badań wykazało wyższy
wskaźnik odzyskania funkcji erekcyjnej po radykalnej
prostatektomii u pacjentów otrzymujących dowolny
lek (terapeutycznie lub profi laktycznie) poprawiający
ED. Porównanie wczesnego leczenia z opóźnioną rehabilitacją
erekcji wydaje się wskazywać na lepszy efekt
szybkiego powrotu potencji tej pierwszej metody (Salonia
i wsp., 2012b). Obecnie dostępny arsenał metod leczenia
przedstawiony jest w postaci algorytmu postępowania
w ED na rycinie 3.
Postępowanie w ED po radykalnej prostatektomii
zostało zrewolucjonizowane przez pojawienie się inhibitorów
fosfodiesterazy typu 5 (PDE5i, ang. phosphodiesterase
5 inhibitors), z ich potwierdzoną skutecznością,
łatwością stosowania, dobrą tolerancją, doskonałym
bezpieczeństwem i pozytywnym wpływem na jakość
życia. Należy podkreślić, że pacjenci z ED po radyklanej
prostatektomii słabo reagują na PDE5i. Jednak PDE5i
to terapia pierwszej linii u pacjentów, którzy zostali
poddani radykalnej prostatektomii z oszczędzeniem
pęczków nerwowych (NSRP, ang. nerve sparing radical
prostatectomy), niezależnie od zastosowanej techniki
operacyjnej (Salonia i wsp., 2012a, 2012b).
Kilka parametrów klinicznych zostało zidentyfi kowanych
jako czynniki potencjalnie przewidujące skuteczność
działania PDE5i. Wiek pacjenta oraz jakość techniki
NS są kluczowymi czynnikami wpływającymi na zachowanie
pooperacyjnej czynności erekcyjnej (Ficarra i wsp.,
2012; Salonia i wsp., 2012a, 2012b). Odsetek reakcji
na leczenie ED sildenafi lem u osób po NSRP w różnych
badaniach waha się od 35% do 75%, a wśród tych, którzy
nie byli poddani NS, od 0% do 15% (Montorsi i wsp., 2005;
Salonia i wsp., 2012b). Sugeruje się, że wczesne stosowanie
wysokich dawek sildenafi lu po radykalnej prostatektomii ma wpływ na zachowanie mięśniówki gładkiej w ciałach
jamistych (Schwartz i wsp., 2004). Codzienne stosowanie
sildenafi lu powoduje także szybszy powrót spontanicznej,
prawidłowej czynności erekcyjnej po radykalnej prostatektomii
w porównaniu do działania placebo u pacjentów
po NSRP, którzy byli w pełni sprawni przed operacją
(Padma -Nathan i wsp., 2008).
U pacjentów z ED po radykalnej prostatektomii oceniano
skuteczność tadalafi lu i wardenafi lu w leczeniu
na żądanie. Duże wieloośrodkowe badanie przeprowadzone
w Europie i USA sprawdzało działanie tadalafi lu
u pacjentów z ED po obustronnej operacji z NS. Funkcja
erekcyjna poprawiła się u 71% pacjentów otrzymujących
20 mg tadalafi lu w porównaniu z 24% pacjentów otrzymujących
placebo, natomiast odsetek udanych prób
odbycia stosunku płciowego wynosił 52% przy zastosowaniu
20 mg tadalafi lu w porównaniu z 26% w grupie
z placebo (Montorsi i wsp., 2004a; Salonia i wsp., 2012b).
Podobnie został przetestowany wardenafi l u pacjentów
z ED po operacji NSRP w randomizowanym, wieloośrodkowym,
prospektywnym i kontrolowanym placebo
badaniu w Ameryce Północnej (Brock i wsp., 2003; Salonia
i wsp., 2012b).
Po obustronnej NSRP funkcja erekcyjna (EF, ang.
erectile function) poprawiła się odpowiednio o 71% i 60%,
przy podawaniu 10 i 20 mg wardenafi lu. Rozszerzona
analiza tych samych pacjentów wykazała korzyści
płynące ze stosowania wardenafi lu w porównaniu
z placebo w zakresie takim, jak satysfakcja ze współżycia
płciowego, sztywność erekcji, funkcja orgazmiczna
i ogólne zadowolenie z doświadczeń seksualnych (Nehra
i wsp., 2005; Salonia i wsp., 2012b). Ponadto, w randomizowanym,
podwójnie zaślepionym, podwójnie zamaskowanym,
wieloośrodkowym badaniu mężczyzn
w wieku ok. 68 lat z prawidłową czynnością erekcyjną
przed NSRP w 50 ośrodkach w 9 krajach w Europie
i w Kanadzie porównywano podawanie tadalafi lu raz
dziennie z placebo (Montorsi i wsp., 2014). Tadalafi l
był bardziej skuteczny w poprawie funkcji erekcyjnej
u mężczyzn po NSRP. Dane te sugerują pozytywną rolę
tadalafi lu podawanego raz dziennie wcześnie po operacji
w przywracaniu funkcji erekcyjnej u mężczyzn
z ED po NSRP, prawdopodobnie dzięki zapobieganiu
zmianom strukturalnym w prąciu (Montorsi i wsp., 2014).
Niewspomagana funkcja erekcyjna nie poprawiała się
po przerwaniu aktywnej terapii stosowanej przez 9 miesięcy
(Montorsi i wsp., 2014). Ponadto, dane te wskazują,
że stosowanie tadalafi lu raz dziennie może znacząco
skrócić czas powrotu czynności erekcyjnej po NSRP
w porównaniu z placebo (Moncada i wsp., 2015).
W randomizowanym, podwójnie zaślepionym,
podwójnie zamaskowanym, wieloośrodkowym badaniu
równoległych grup w 87 ośrodkach w Europie, Kanadzie,
Afryce Południowej i USA porównywano podawanie wardenafi
lu na żądanie i co noc u mężczyzn z ED po obustronnej
NSRP. U pacjentów, u których wynik funkcji
erekcyjnej mierzonej IIEF – EF wynosił ≥26 punktów
przed operacją, wardenafi l był skuteczny przy zastosowaniu
na żądanie, co wspiera zmianę paradygmatu w kierunku
podawania PDE5i na żądanie w ED po radykalnej
prostatektomii (Montorsi i wsp., 2008). Randomizowane
badanie z podwójnie ślepą próbą, kontrolowane, z grupą
placebo, na grupach równoległych, u 298 pacjentów z ED
po obustronnej NSRP, u których zastosowano 100 lub
200 mg awanafi lu lub placebo (brane 30 min przed aktywnością
seksualną) przez 12 tygodni, wykazało znamiennie
większy wzrost SEP2 (ang. sexual encounter profi le) i SEP3
oraz zmiany w średniej punktacji domeny funkcji erekcyjnej
w IIEF -EF po podaniu 100 i 200 mg awanafi lu
w porównaniu z placebo (p < 0,01) (Mulhall i wsp., 2013).
Kontynuacja podawania awanafi lu spowodowała, że 36,4%
(28 z 77) prób współżycia seksualnego (SEP3) przez 15
min lub mniej było udanych w porównaniu z 4,5% (2
z 44) w grupie z placebo (p < 0,01) (Mulhall i wsp., 2013).
W poprzednich latach u pacjentów z pooperacyjnymi
ED stosowano takie metody terapeutyczne, jak
wstrzyknięcie do ciał jamistych substancji wazoaktywnych
(Montorsi i wsp., 1997; Salonia i wsp., 2012b), preparaty
docewkowe (Salonia i wsp., 2012b; Raina i wsp., 2007),
aparaty próżniowe (Raina i wsp., 2006; Salonia i wsp.,
2012b) i implanty wszczepiane do prącia (Hellstrom i wsp.,
2010; Salonia i wsp., 2012b; Tal i wsp., 2011). Wstrzyknięcia
do ciał jamistych i implanty prącia są nadal zalecane jako
postępowanie drugiej i trzeciej linii leczenia, jeśli PDE5i
nie dają odpowiedniego efektu lub są przeciwwskazane
u pacjentów po operacjach (sekcje 3A.4.6 i 3A.4.7).
3A.4.4. Przyczyny zaburzeń erekcji,
które potencjalnie mogą zostać wyleczone
3A.4.4.1. Przyczyny hormonalne
Porada endokrynologa może być korzystna dla pacjentów
z zaburzeniami hormonalnymi (Maggi i wsp., 2013).
Niedobór testosteronu jest wynikiem pierwotnej niewydolności
jąder lub jest wtórny do zaburzeń przysadki/podwzgórza,
np. guz przysadki, w wyniku którego dochodzi
do hiperprolaktynemii (Maggi i wsp. 2013; Tajar i wsp.,
2012). Jeśli jest to klinicznie uzasadnione, stosuje się
suplementację testosteronem (domięśniowo, doustnie
lub przezskórnie), która może być skuteczna, ale powinno
się wcześniej wyeliminować inne endokrynologiczne
przyczyny niewydolności jąder (Buvat i wsp., 2010; Isidori
i wsp., 2014; Wang i wsp., 2009). Przed rozpoczęciem
terapii testosteronem powinno się wykonać badania,
takie jak badanie per rectum, stężenie PSA w surowicy
krwi, hematokryt, testy czynności wątroby oraz profi l
lipidów (Buvat i wsp., 2010; Isidori i wsp., 2014). Pacjentów,
którzy otrzymują terapię androgenową, należy monitorować
pod kątem objawów klinicznych, podwyższonego
hematokrytu i rozwoju zaburzeń wątroby lub prostaty
(Buvat i wsp., 2010; Isidori i wsp., 2014). Stosowanie suplementacji
testosteronu jest kontrowersyjne u mężczyzn
z rakiem prostaty w wywiadzie (LE: 4) (Khera i wsp., 2014),
ponieważ istnieją ograniczone dowody wskazujące na to, że takie leczenie nie zwiększa ryzyka nawrotu lub progresji
raka gruczołu krokowego, terapia testosteronem
jest przeciwwskazana u pacjentów z nieleczonym rakiem
prostaty (LE: 4).
Suplementacja testosteronem jest przeciwwskazana
u pacjentów z niestabilną chorobą serca. Z drugiej strony,
kontrowersyjna jest rola testosteronu w prawidłowej czynności
układu krążenia. Wyniki badań klinicznych nie
są wystarczająco jednoznaczne dla ostatecznego potwierdzenia
niekorzystnego wpływu terapii testosteronem
na układ krążenia (Baillargeon i wsp., 2014; Basaria i wsp.,
2010; Calof i wsp., 2005; Fernandez -Balsells i wsp., 2010;
Haddad i wsp., 2007; Vigen i wsp., 2013). Obecne rekomendacje
Towarzystwa Endokrynologicznego nie uwzględniają
zalecenia badania pacjentów z chorobą układu krążenia
w kierunku hipogonadyzmu, ani nie zalecają suplementacji
pacjentów z chorobą serca w celu podwyższenia ich przeżywalności
(Bhasin i wsp., 2010). Jednakże ostatni kompleksowy,
systematyczny przegląd i metaanaliza randomizowanych
badań klinicznych, kontrolowanych, z grupą placebo
nad wpływem suplementacji testosteronu na choroby układu
sercowo -naczyniowego nie potwierdziły związku przyczynowego
pomiędzy terapią testosteronem a niekorzystnymi
zdarzeniami w układzie krążenia (Corona i wsp., 2014).
3A.4.4.2. Pourazowe naczyniopochodne zaburzenia
erekcji u młodych pacjentów
U młodych pacjentów z urazem miednicy lub krocza chirurgiczna
rewaskularyzacja prącia ma długoterminowy
pozytywny efekt w 60–70% przypadków (Sohn i wsp.,
2013). Zaburzenie musi być potwierdzone przez farmako-
-arteriografi ę prącia. Dysfunkcja żylno -okluzyjna ciał
jamistych jest przeciwwskazaniem do rewaskularyzacji
i musi być wykluczona przez dynamiczną kawernozometrię
lub kawernozografi ę. Chirurgia naczyniowa przy dysfunkcji
żylno -okluzyjnej nie jest już zalecana ze względu
na słabe wyniki długoterminowe (Sohn i wsp., 2013).
3A.4.4.3. Poradnictwo psychologiczne i psychoterapia
U pacjentów z istotnym problemem psychologicznym
może być stosowana sama terapia psychoseksualna lub
razem z inną metodą terapeutyczną. Terapia psychoseksualna
wymaga regularnej kontroli ambulatoryjnej
i wykazuje zmienne rezultaty (Rosen, 2001).
3A.4.5. Terapia pierwszej linii
3A.4.5.1. Doustna farmakoterapia
Fosfodiesteraza typu 5 (PDE5, ang. phosphodiesterase 5)
hydrolizuje cykliczny 3’,5’ -guanozynomonofosforan
(cGMP, ang. 3’,5’ -cyclic guanosine monophosphate) w ciałach
jamistych. Hamowanie PDE5 powoduje rozkurcz mięśni
gładkich i zwiększony napływ krwi tętniczej, co prowadzi
do uciśnięcia splotu żylnego pod osłonką białawą
i do erekcji prącia (Lue, 2000). Cztery silnie działające
selektywne PDE5i zostały zatwierdzone przez Europejską
Agencję Leków (EMA, ang. European Medicines Agency)
do leczenia ED (Yuan i wsp., 2013). Nie są one inicjatorami
erekcji i wymagają stymulacji seksualnej, aby umożliwić
erekcję. Ich skuteczność jest oceniana poprzez zdolność
do uzyskania erekcji ze sztywnością prącia wystarczającą
do penetracji pochwy.
3A.4.5.1.1. Sildenafi l
Sildenafi l został wprowadzony w 1998 r. i był pierwszym
PDE5i dostępnym na rynku (Goldstein i wsp., 1998). Jest
podawany w dawkach wynoszących 25, 50 i 100 mg.
Zalecana dawka początkowa wynosi 50 mg i powinna być
dostosowana do reakcji pacjenta i występujących u niego
skutków ubocznych. Sildenafi l rozpoczyna działanie
30–60 min po podaniu. Jego skuteczność jest mniejsza
po ciężkim, tłustym posiłku ze względu na przedłużającą
się absorpcję. Skuteczność może być utrzymana
przez okres do 12 godzin (Moncada i wsp., 2004). Dane
farmakokinetyczne sildenafi lu przedstawiono w tabeli 5.
Działania niepożądane (tabela 6) są z reguły łagodne
i zmniejszają się przy ciągłym stosowaniu (Giuliano i wsp.,
2010; Tsertsvadze i wsp., 2009). Po 24 tygodniach badań
reakcji na daną dawkę stwierdzono, że erekcja poprawiła
się u 56%, 77% i 84% wszystkich badanych mężczyzn
z ED, którzy stosowali odpowiednio 25, 50 i 100 mg
sildenafi lu, w porównaniu do 25% mężczyzn zażywających
placebo (Goldstein i wsp., 1998). Sildenafi l znamiennie
poprawił punktację w skali IIEF, SEP2 i SEP3
oraz w Kwestionariuszu Oceny Globalnej (GAQ, ang.
General Assessment Questionnaire), a także zadowolenie
z leczenia. Stwierdzono skuteczność sildenafi lu prawie
w każdej z podgrup pacjentów z ED. Dla sildenafi lu ustalono
LE – 1 i GR – A. Ostatnio stworzono tabletki rozpuszczalne
w jamie ustnej (ODT, ang. orally disintegrating
tablet) z cytrynianem sildenafi lu w dawce 50 mg dla
pacjentów, którzy mają problem z połykaniem twardych
form leku.
3A.4.5.1.2. Tadalafi l
Tadalafi l został dopuszczony do leczenia ED w lutym
2003 r. Jest skuteczny po 30 min po podaniu, ze szczytową
skutecznością po ok. 2 godz. Skuteczność utrzymuje
się do 36 godz. (Curran i Keating, 2003) i spożywane
posiłki nie wchodzą w interakcje. Jest podawany
na żądanie w dawce 10 i 20 mg albo alternatywnie
w dawce 5 mg codziennie. Zalecana dawka początkowa
wynosi 10 mg i powinna być dostosowana do odpowiedzi
pacjenta i występujących u niego działań ubocznych.
Dane farmakokinetyczne tadalafi lu zostały przedstawione
w tabeli 5. Działania niepożądane (tabela 6)
są z reguły łagodne i zmniejszają się przy ciągłym stosowaniu.
W badaniach premarketingowych po 12 tygodniach
leczenia oraz badaniach reakcji na różne dawki
poprawę erekcji odnotowano u 67% i 81% badanych mężczyzn
z ED, którzy przyjmowali odpowiednio 10 i 20 mg
tadalafi lu, w porównaniu do 35% mężczyzn w grupie
kontrolnej stosującej placebo (Curran i Keating, 2003).
Tadalafi l znacznie poprawiał wyniki pacjentów w skali
IIEF, SEP2, SEP3 i GAQ oraz zadowolenie z leczenia. Wyniki te zostały potwierdzone w badaniach po wprowadzeniu
leku do obrotu (badania postmarketingowe).
Skuteczność tadalafi lu wykazano w prawie każdej podgrupie
pacjentów z ED, również w przypadkach trudnych
do leczenia (np. w cukrzycy). Dla tadalafi lu ustalono
LE – 1 i GR – A (Keating i Scott, 2003).
3A.4.5.1.3. Wardenafi l
Wardenafi l jest dostępny na rynku od marca 2003 r.
Jest skuteczny po 30 min po podaniu (Keating i Scott,
2003). Jego działanie może być zmniejszone przez ciężki,
tłusty posiłek (>57% tłuszczu). Dawki 5, 10 i 20 mg stosowane
na żądanie zostały zatwierdzone do leczenia ED.
Zalecana dawka początkowa wynosi 10 mg i powinna
być dostosowana do reakcji pacjenta i występujących
u niego działań ubocznych (Chung i Broc, 2011). Dane
farmakokinetyczne wardenafi lu przedstawiono w tabeli 5.
Działania niepożądane (tabela 6) są z reguły łagodne
i zmniejszają się przy ciągłym stosowaniu (Chung i Broc,
2011). Po 12 tygodniach badania odpowiedzi na różne
dawki poprawę erekcji obserwowano u 66%, 76% i 80%
pacjentów z ED przyjmujących odpowiednio 5, 10 i 20 mg
wardenafi lu, w porównaniu z 30% mężczyzn otrzymujących
placebo (Chung i Broc, 2011; Sanford, 2012).
Wardenafi l znamiennie poprawiał wyniki pacjentów
w IIEF, SEP2, SEP3 i GAQ oraz zadowolenie z leczenia.
Skuteczność wardenafi lu została potwierdzona w badaniach
postmarketingowych przeprowadzonych po wprowadzeniu
go na rynek (Chung i Broc, 2011; Sanford, 2012).
Skuteczność wardenafi lu wykazano w prawie każdej
podgrupie pacjentów z ED, również w tych trudnych
do leczenia (np. w cukrzycy). Dla wardenafi lu ustalono
LE – 1 i GR – A (Keating i Scott, 2003). Ostatnio stworzono
wardenafi l w postaci ODT (Sanford, 2012). Preparaty
ulegające rozpadowi w jamie ustnej są wygodniejsze
od preparatów powlekanych i mogą być chętniej przyjmowane
przez pacjentów. Absorpcja leku nie jest związana
ze spożyciem pokarmu i wykazuje lepszą biodostępność
w porównaniu do tabletek powlekanych (Debruyne i wsp.,
2011). Skuteczność wardenafi lu w postaci ODT wykazano
w kilku randomizowanych i kontrolowanych badaniach
klinicznych i nie wydaje się ona różnić od zwykłego preparatu
(Debruyne i wsp., 2011; Wang i wsp., 2014).
3A.4.5.1.4. Awanafi l
Awanafi l jest wysoko wyselekcjonowanym PDE5i, który
ostatnio stał się komercyjnie dostępny – autoryzacja
EMA w czerwcu 2013 r. (Wang i wsp., 2012). Awanafi l
ma duży współczynnik hamowania PDE5 w porównaniu
do innych podtypów PDE, co pozwala na stosowanie tego
leku w ED z jednoczesnym zminimalizowaniem działań
ubocznych (Kyle i wsp., 2013). Dawki 50, 100 i 200 mg
stosowane na żądanie zostały zatwierdzone do leczenia
ED (Wang i wsp., 2012). Zalecana dawka początkowa
wynosi 100 mg doustnie, stosowana w razie potrzeby
ok. 30 min przed aktywnością seksualną, powinna być
dostosowana do skuteczności i tolerancji leku (Goldstein
i wsp., 2012; Wang i wsp., 2012). U mężczyzn z ED średni
odsetek udanych prób współżycia seksualnego wyniósł
ok. 47%, 58% i 59% po podaniu odpowiednio 50, 100
i 200 mg awanafi lu w porównaniu z 28% mężczyzn
stosujących placebo (Goldstein i wsp., 2012; Wang i wsp.,
2012). Udane próby seksualne po 15 min od podania 50,
100, 200 mg obserwowano odpowiednio w 64%, 67%
i 71% przypadków. Maksymalna częstość dawkowania
leku to raz dziennie. Dawkowanie nie zostało ustalone
w oparciu o badanie czynności nerek, wątroby, a także
w zależności od wieku i płci (Goldstein i wsp., 2012). Dane
farmakokinetyczne awanafi lu przedstawiono w tabeli
5 (Goldstein i wsp., 2012; Wang i wsp., 2012). Działania
niepożądane (tabela 6) są z reguły łagodne (Wang i wsp.,
2012; Goldstein i wsp., 2012). Dane uzyskane z metaanalizy
dostępnych badań wskazują, że awanafi l znamiennie
poprawiał wyniki pacjentów w IIEF, SEP2, SEP3 i GAQ,
z ewidentną zależnością od dawki (Wang i wsp., 2014,
2012). Podawanie leku łącznie z posiłkiem może opóźnić
rozpoczęcie jego działania w porównaniu ze stosowaniem
na czczo, jednak awanafi l może być podawany z jedzeniem
lub bez. Skuteczność awanafi lu wykazano w wielu
podgrupach pacjentów z ED, również w tych trudnych
do leczenia (np. w cukrzycy). Dla wardenafi lu ustalono
LE – 1 i GR – A (Keating i Scott, 2003).
3A.4.5.1.5. Wybór pomiędzy różnymi inhibitorami PDE5
Do dnia dzisiejszego brak jest dostępnych danych
z podwójnie lub potrójnie zaślepionych wieloośrodkowych
badań porównujących skuteczność i/lub preferencje
pacjentów odnośnie sildenafi lu, tadalafi lu, wardenafi lu
i awanafi lu. Wybór leku zależy od częstotliwości współżycia
(sporadyczne stosowanie lub regularna terapia, 3–4
razy w tygodniu) i osobistych doświadczeń pacjenta.
Pacjenci muszą być poinformowani, czy lek jest krótko
lub długo działający, powinni znać jego ewentualne wady
i powinni wiedzieć, jak go stosować.
3A.4.5.1.6. Stałe stosowanie inhibitorów PDE5
Badania na zwierzętach wykazały, że przewlekłe stosowanie
PDE5i znacząco poprawia lub zapobiega zmianom
struktur ciał jamistych związanym z wiekiem, cukrzycą,
lub uszkodzeniem chirurgicznym (Behr -Roussel i wsp.,
2005; Ferrini i wsp., 2006, 2007; Kovanecz i wsp., 2008;
Vignozzi i wsp., 2006). Nie ma danych dla populacji
ludzkiej. U ludzi w badaniach klinicznych wykazano,
że tadalafi l podawany raz dziennie w dawce 5 mg mężczyznom
z różnym natężeniem ED był dobrze tolerowany
i skuteczny (Porst i wsp., 2014). W 2007 r. tadalafi
l w dawce 2,5 i 5 mg został zatwierdzony przez EMA
do codziennego stosowania w leczeniu ED. Zgodnie
z EMA sposób podawania tadalafi lu 2,5 i 5 mg raz
dziennie może być korzystny i zależy od wyboru pacjenta
i oceny lekarza. Zalecaną dawką jest 5 mg zażywane raz
dziennie w podobnej porze dnia. Tadalafi l 5 mg podawany
codziennie stanowi alternatywę dla schematu
na żądanie u pacjentów, którzy wolą spontaniczną niż
Tabela 5. Podsumowanie najważniejszych danych
farmakokinetycznych dla czterech
inhibitorów PDE5 obecnie dopuszczonych przez EMA w
leczeniu zaburzeń erekcji*
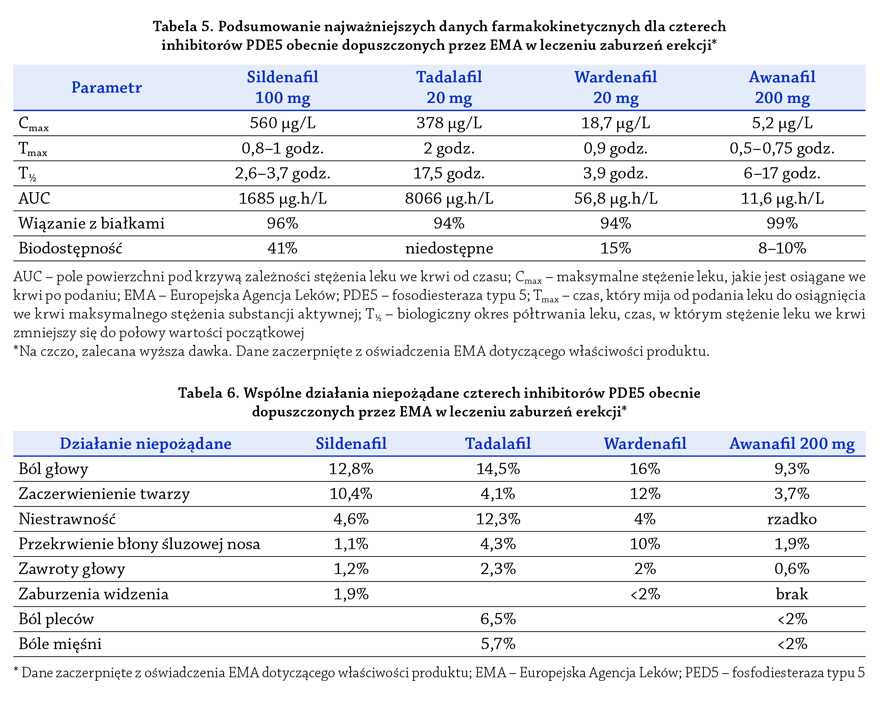
* Dane zaczerpnięte z oświadczenia EMA dotyczącego właściwości produktu; EMA – Europejska Agencja Leków; PED5 – fosfodiesteraza typu 5
planowaną aktywność seksualną lub kiedy przewidują
częstszą aktywność seksualną, co oznacza, że zażywanie
leku oraz aktywność seksualna nie muszą odbywać się
w tym samym czasie. Schemat codziennego przyjmowania
powinien być okresowo poddawany weryfi kacji
(Porst i wsp., 2014; Buvat i wsp., 2014). Ciągłe stosowanie
tadalafi lu może być zalecane u pacjentów z ED i dodatkowymi
chorobami np. LUTS.
3A.4.5.1.7. Bezpieczeństwo stosowania inhibitorów
PDE5
3A.4.5.1.7.1. Bezpieczeństwo układu krążenia
Wyniki badań klinicznych czterech PDE5i i dane uzyskane
po wprowadzeniu na rynek farmaceutyczny sildenafi lu,
tadalafi lu i wardenafi lu nie wykazały wzrostu częstości
zawałów serca u pacjentów otrzymujących PDE5i w ramach
podwójnie zaślepionych badań kontrolowanych placebo
lub badań otwartych lub w porównaniu do częstości tych
zaburzeń w populacji mężczyzn w tym samym wieku.
Żaden z PDE5i nie miał negatywnego wpływu na całkowity
czas wysiłku (ang. total exercise time) i czas do niedokrwienia
(ang. time -to -ischaemia) podczas próby wysiłkowej
u mężczyzn z chorobą wieńcową. Stosowanie
tych substancji przewlekle lub na żądanie jest dobrze
tolerowane przy podobnym poziomie bezpieczeństwa.
Wszystkie PDE5i są przeciwwskazane u: 1) pacjentów,
którzy mieli zawał serca, udar mózgu, arytmię serca
zagrażającą życiu w ciągu ostatnich 6 miesięcy, 2)
pacjentów z niedociśnieniem (<90/50 mm Hg) lub nadciśnieniem
(>170/100 mm Hg), 3) pacjentów z niestabilną
chorobą wieńcową, objawami choroby wieńcowej podczas
stosunku płciowego lub zastoinową niewydolnością
serca, klasyfi kowanymi przez Nowojorskie Towarzystwo
Kardiologiczne (ang. New York Heart Association) jako
klasa 2 lub wyższa.
3A.4.5.1.7.2. Stosowanie azotanów z inhibitorami
PDE5 jest przeciwwskazane
Azotany organiczne (np. nitrogliceryna, monoazotan izosorbidu
i diazotan izosorbidu) lub donory tlenku azotu
(NO, ang. nitric oxide) i inne azotany stosowane w leczeniu
choroby wieńcowej, jak również azotyn amylu lub azotan
amylu wykorzystywane jako używki (ang. poppers) są bezwzględnie
przeciwwskazane przy stosowaniu PDE5i.
Efektem ich działania jest akumulacja cGMP i nieprzewidywalne
spadki ciśnienia krwi oraz objawy niedociśnienia.
Czas interakcji między organicznymi azotanami
i PDE5i zależy od rodzaju PDE5i i azotanu. Jeśli
PDE5i zostanie przyjęty przez pacjenta i wystąpią bóle
w klatce piersiowej, podanie nitrogliceryny musi zostać
wstrzymane na co najmniej 24 godz., jeśli używany jest
sildenafi l (i prawdopodobnie również wardenafi l – okres półtrwania 4 godz.), i przez co najmniej 48 godz., jeśli
jest stosowany tadalafi l (okres półtrwania 17,5 godz.),
i nie mniej niż 12 godz., jeśli stosowany jest awanafi l
(okres półtrwania 6–17 godz.) (Swearingen i wsp., 2013).
3A.4.5.1.7.3. Leki hipotensyjne
Jednoczesne stosowanie PDE5i z lekami hipotensyjnymi
(inhibitory konwertazy angiotensyny, blokery
receptora angiotensyny, blokery kanałów wapniowych,
β -blokery i leki moczopędne) może prowadzić do niewielkich
spadków ciśnienia krwi, które są zazwyczaj niegroźne.
Ogólnie, profi l działań niepożądanych PDE5i nie
pogarsza się pod wpływem stosowania leków hipotensyjnych,
nawet wtedy gdy pacjent przyjmuje ich kilka.
3A.4.5.1.7.4. Interakcje z α -blokerami
Wszystkie PDE5i wykazują niewielkie interakcje
z α -blokerami, które w pewnych warunkach mogą doprowadzić
do hipotonii ortostatycznej.
Ulotka sildenafi lu obecnie informuje, że 50 lub 100 mg
należy stosować ostrożnie u pacjentów przyjmujących
α -bloker (zwłaszcza doksazosynę). Niedociśnienie
tętnicze może wystąpić w ciągu 4 godz. w przypadku
przyjmowania α -blokera. Zaleca się rozpoczęcie
leczenia od dawki 25 mg (Giuliano i wsp., 2010).
Jednoczesne stosowanie wardenafi lu należy rozpocząć
tylko wtedy, gdy pacjent został ustabilizowany
w trakcie terapii blokerami receptorów α.
Równoczesne stosowanie wardenafi lu i tamsulozyny
nie prowadzi do znaczącego klinicznie niedociśnienia
krwi (Chung i Broc, 2011; Keating i Scott, 2003; Sanford,
2012).
Tadalafi l nie jest zalecany u pacjentów przyjmujących
doksazosynę, ale nie dotyczy to przyjmujących tamsulozynę
(Curran i Keating, 2003; Kloner i wsp., 2004).
Ulotka do awanafi lu informuje obecnie, że pacjenci
powinni być ustabilizowani na terapii α -blokerami,
zanim podejmą próbę przyjmowania awanafi lu.
U takich pacjentów powinno się rozpocząć podawanie
awanafi lu od najmniejszej dawki 50 mg. Odwrotnie,
u pacjentów już przyjmujących optymalną dawkę
awanafi lu terapia α -blokerami powinna się rozpocząć
od najniższej dawki.
3A.4.5.1.7.5. Modyfi kacja dawki
Leki (m.in. ketokonazol, ritonavir, atazanavir, klarytromycyna,
idinavir, itrakonazol, nefazodon, nelfi -
navir, saquinavir i telitromycyna), które hamują szlak
CYP3A4², będą hamować rozkład metaboliczny PDE5i
i zwiększać ich poziom we krwi. Z tego powodu konieczne
jest stosowanie niższych dawek PDE5i. Jednakże inne
czynniki, takie jak ryfampicyna, fenobarbital, fenytoina
i karbamazepina, mogą indukować CYP3A4 i przyspieszać
rozkład PDE5i, a z tego powodu konieczne będą
większe dawki PDE5i. Ciężka niewydolność nerek lub
2 przyp. red. izoenzym 3A4 cytochromu P450
wątroby mogą wymagać dostosowania dawki PDE5i, więc
konieczna jest ostrożność w stosowaniu tych preparatów.
3A.4.5.1.8. Postępowanie w przypadku braku reakcji
na inhibitory PDE5
Dwa główne powody, dla których pacjenci nie reagują
na PDE5i, to niewłaściwe stosowanie albo brak jego
skuteczności. Dane wskazują, że powinno się podjąć
przynajmniej sześć prób stosowania konkretnego
leku (McCullough i wsp., 2002). Postępowanie u osób
niereagujących na leki zależy od określenia przyczyny
tego stanu.
3A.4.5.1.8.1. Sprawdzenie, czy pacjent używa
leku z legalnego źródła
Istnieje duży czarny rynek preparatów PDE5i. Ilość
aktywnej substancji w tych lekach może być bardzo
różna i ważne jest, aby sprawdzić, w jaki sposób i z jakiego
źródła pacjent uzyskał lek.
3A.4.5.1.8.2. Sprawdzenie, czy lek został poprawnie
przepisany i czy jest prawidłowo
zażywany
Głównym powodem niewłaściwego stosowania leków
przez pacjentów jest niewystarczająca informacja przekazana
przez lekarza. Główne sytuacje, w których lek
może być niewłaściwie stosowany, to:
1) brak odpowiedniej
stymulacji seksualnej,
2) nieodpowiednia dawka,
3) nieodczekanie odpowiedniej ilości czasu od momentu
zażycia leku do podjęcia próby współżycia seksualnego.
Brak odpowiedniej stymulacji seksualnej: działanie
PDE5i jest zależne od uwalniania NO przez przywspółczulne
zakończenia nerwowe w tkankach prącia ulegających
erekcji. Podstawowym bodźcem do uwalniania
NO jest stymulacja seksualna, a bez niej (i uwalniania
NO) leki nie działają. Przy doustnym przyjmowaniu
PDE5i potrzebna jest różna ilość czasu do osiągnięcia
jego maksymalnego stężenia w surowicy (Debruyne i wsp.,
2011; Forgue i wsp., 2006; Moncada i wsp., 2004; Nichols
i wsp., 2002; Rosen i wsp., 2004; Tsertsvadze i wsp., 2009;
Wang i wsp., 2014; ). Mimo że aktywność farmakologiczną
leku uzyskuje się, gdy jego poziom w osoczu jest znacznie
poniżej maksymalnego stężenia, to po doustnym zażyciu
leku istnieje okres czasu, podczas którego lek jest nieskuteczny.
Chociaż u niektórych pacjentów wszystkie cztery
leki zaczynają działać w ciągu 15–30 min po doustnym
spożyciu (Debruyne i wsp., 2011; Forgue u wsp., 2006;
Rosen i wsp., 2004, Nichols i wsp., 2002; Tsertsvadze
i wsp., 2009; Wang i wsp., 2014; ), to większość pacjentów
wymaga więcej czasu (Chung i Broc, 2011; Montorsi i wsp.,
2004b; Padma -Nathan i wsp., 2003; Wang i wsp., 2014).
Wchłanianie sildenafi lu może być opóźnione przez
posiłek, a wchłanianie wardenafi lu może być opóźnione
po tłustym posiłku (Rajagopalan i wsp., 2003). Absorpcja
tadalafi lu jest w mniejszym stopniu zależna od spożycia
pokarmów pod warunkiem, że upłynęła wystarczająca
ilość czasu pomiędzy doustnym przyjęciem leku a próbą odbycia stosunku płciowego (Forgue i wsp., 2006). Kiedy
awanafi l jest przyjmowany z bardzo tłustym posiłkiem,
wchłanianie jest obniżone przy średnim obniżeniu Tmax
o 1,25 godz. i średnie obniżenie Cmax (maksymalne stężenie
leku, jakie jest osiągane we krwi po podaniu, ang.
maximal concentration) o 39% (200 mg). Nie wpływa
to na powiększenie ekspozycji³ (AUC – pole powierzchni
pod krzywą zależności stężenia leku we krwi od czasu,
ang. area under the curve). Małe zmiany Cmax przy stosowaniu
awanafi lu uważane są za nieznaczące klinicznie
(Kyle i wsp., 2013; Wang i wsp., 2012, 2014).
Możliwe jest, że pacjent zbyt długo czeka po zażyciu
leku do momentu rozpoczęcia współżycia seksualnego.
Okres półtrwania sildenafi lu i wardenafi lu wynosi ok. 4
godz., co sugeruje, że prawidłowa skuteczność leku występuje
6–8 godzin po zażyciu, chociaż reakcje po tym czasie
mogą być dobre. Okres półtrwania awanafi lu wynosi 6–17
godz. Tadalafi l ma dłuższy okres półtrwania, który wynosi
ok. 17,5 godzin, więc prawidłowa skuteczność jest dłuższa,
do ok. 36 godz. Dane z badań niekontrolowanych wskazują,
że edukacja może uchronić pacjenta z pozornym
brakiem reakcji na PDE5i przed rezygnacją z przyjmowania
tego preparatu. Po przyjmowaniu właściwej dawki
leku w odpowiednim czasie i po stymulacji seksualnej
erekcja może być skutecznie przywrócona po ponownym
zastosowaniu PDE5i (Gruenwald i wsp., 2006; Hatzichristou
i wsp., 2005; Hatzimouratidis i wsp., 2006).
3A.4.5.1.8.3. Możliwe modyfi kacje leczenia
u pacjentów prawidłowo przyjmujących
inhibitory PDE5
Istnieją kontrowersyjne i niejednoznaczne dowody sugerujące,
że u pacjentów z niedoborem testosteronu jego
suplementacja może poprawić odpowiedź na PDE5i
(Greco i wsp., 2006; Isidori i wsp., 2014; Spitzer i wsp., 2012,
2013). Modyfi kacja czynników ryzyka może być także
pomocna, jak o tym wspomniano w rozdziale 3A.4.2.
Kilka badań wskazuje, że niektórzy pacjenci mogą odpowiadać
lepiej na jedne PDE5i niż na inne (Eardley i wsp.,
2007). Mimo że te różnice w działaniu mogą być wyjaśnione
przez różnice w farmakokinetyce leków, to wskazują
one na możliwość, że pomimo identycznego sposobu
działania przestawienie na inny PDE5i może przynieść
rezultat. Ponadto sugeruje się, żeby połączyć codziennie
stosowany tadalafi lu z krótko działającym PDE5i (takim
jak sildenafi l), bez żadnego znaczącego wzrostu działań
ubocznych (Cui i wsp., 2015). Jeśli leczenie farmakologiczne
nie powiedzie się, pacjenci powinni zostać skierowani
na alternatywną terapię, np. dojamiste iniekcje
substancji wazoaktywnych lub urządzenia próżniowe.
3A.4.5.2. Urządzenia próżniowe
Urządzenia próżniowe poprawiające erekcję (VED, ang.
vacuum erection device) wraz z pierścieniem umieszczonym
3 przyp red. należy rozumieć, że tłusty posiłek nie wpływa na stężenie
awanafi lu we krwi w zależności od czasu
u podstawy prącia zapewniają bierne ukrwienie ciał jamistych.
Według opublikowanych danych, zadowolenie
ze współżycia seksualnego przy tak wywołanej erekcji
wynosi aż 90%, niezależnie od przyczyn ED, a rozpiętość
waha się od 27% do 94% (Levine i Dimitriou, 2001;
Yuan i wsp., 2010). Mężczyźni, którzy rezygnują z stosowania
VED, podejmują taką decyzję w ciągu 3 miesięcy.
Długotrwałe stosowanie VED kształtuje się na poziomie
50–64% po 2 latach (Cookson i Nadig, 1993). Najczęstsze
działania niepożądane to ból, niezdolność do wytrysku,
wybroczyny, zasinienie i drętwienie prącia, które występują
u <30% pacjentów (Yuan i wsp., 2010). Poważnych
działań niepożądanych (martwica skóry) można
uniknąć, jeśli pacjenci usuną pierścień w ciągu 30 min.
Urządzenia próżniowe poprawiające erekcję są przeciwwskazane
u pacjentów z zaburzeniami krzepnięcia lub
w trakcie leczenia przeciwzakrzepowego. Mogą być leczeniem
z wyboru dla dobrze poinformowanych starszych
pacjentów z małą częstotliwością współżycia seksualnego
i przy chorobach współistniejących, które wymagają nieinwazyjnego
i niefarmakologicznego postępowania w ED
(Levine i Dimitriou, 2001; Yuan i wsp., 2010).
3A.4.5.3. Terapia falą uderzeniową
Ostatnio zaproponowano stosowanie pozaustrojowej
terapii falą uderzeniową o małej intensywności (LI -SWT,
ang. low -intensity extracorporeal shock wave therapy) jako
nowy sposób leczenia ED (Vardi i wsp., 2010). W pierwszym
randomizowanym, podwójnie zaślepionym, kontrolowanym
badaniu wykazano, że LI -SWT miała
pozytywny, krótkotrwały wpływ kliniczny i fi zjologiczny
na funkcję erekcyjną u mężczyzn, którzy reagują
na doustne podanie PDE5i (Vardi i wsp., 2012). Co więcej,
istnieją wstępne dane pokazujące poprawę hemodynamiki
prącia i funkcji śródbłonka, jak również wskazują
na poprawę wyników punktacji IIEF w domenie EF
u pacjentów z ciężkim ED, słabo reagujących na PDE5i
(Gruenwald i wsp., 2012, 2013). Obecne dane są ciągle
ograniczone i nie można jednoznaczne sformułować
rekomendacji.
3A.4.6. Terapia drugiej linii
Pacjentom niereagującym na leki doustne można zaoferować
wstrzyknięcia do ciał jamistych. Wskaźnik skuteczności
jest wysoki (85%) (Coombs i wsp., 2012; Shabsigh
i wsp., 2000). Podawanie leków rozszerzających naczynia
krwionośne do ciał jamistych było pierwszym leczeniem
ED zastosowanym ponad 20 lat temu (Eardley i wsp., 2010;
Porst i wsp., 2013).
3A.4.6.1. Wstrzyknięcia do ciał jamistych
3A.4.6.1.1. Alprostadil
Alprostadil (CaverjectTM, EDEX/ViridalTM) był pierwszym
i jedynym lekiem podawanym do ciał jamistych zatwierdzonym
do leczenia ED (Eardley i wsp., 2010; Porst i wsp.,
2013). Alprostadil wstrzykiwany do ciał jamistych jest
najbardziej skuteczny w monoterapii, w dawce 5–40 μg (dawka 40 μg nie jest zarejestrowana w każdym kraju
europejskim). Erekcja pojawia się po 5–15 min, a długość
jej trwania zależy od podanej dawki. Niezbędne jest
szkolenie pacjenta (podczas jednej lub dwóch wizyt)
w celu nauczenia go prawidłowej techniki wstrzyknięcia.
W przypadku ograniczonej sprawności manualnej
pacjenta, techniki tej może się nauczyć partnerka.
Zastosowanie specjalnego automatycznego pena pozwala
nie tylko na uproszczenie techniki, ale też na uniknięcie
widoku igły i tym samym może rozwiązać problem lęku
przed ukłuciem prącia. Skuteczność wstrzyknięć alprostadilu
do ciał jamistych określono na >70% w ogólnej
populacji mężczyzn z ED, a u pacjentów w podgrupach
z różnymi schorzeniami (np. z cukrzycą lub chorobami
układu krążenia) aktywnych seksualnie po 94% wstrzyknięć,
stopień satysfakcji wynosił 87–93,5% u pacjentów
i 86–90,3% u ich partnerek (Eardley i wsp., 2010; Porst
i wsp., 2013). Powikłania przy przyjmowaniu alprostadilu
do ciał jamistych to ból prącia (50% pacjentów zgłaszało
ból, ale ból zgłaszany był tylko po 11% ogólnej liczby
wstrzyknięć), przedłużone erekcje (5%), priapizm (1%)
i zwłóknienie (2%) (Eardley i wsp., 2010; Lakin i wsp., 1990;
Porst i wsp., 2013; ). Ból ustępuje samoistnie po dłuższym
okresie stosowania. Można go złagodzić przez
dodanie wodorowęglanu sodu lub znieczulenie miejscowe
(Eardley i wsp., 2010; Moriel i Rajfer, 1993; Porst
i wsp., 2013). Zwłóknienie ciał jamistych (z powodu
małego krwiaka) zazwyczaj zanika w ciągu kilku miesięcy
po okresowym zaprzestaniu wstrzykiwań. Jednak zwłóknienie
osłonki ciał jamistych sugeruje wczesny początek
choroby Peyroniego i może wskazywać na konieczność
zaprzestania wstrzyknięć dojamistych na czas nieokreślony.
Ogólnoustrojowe działania niepożądane
są rzadkie. Najczęściej jest to łagodne niedociśnienie
tętnicze, szczególnie podczas przyjmowania wyższych
dawek. Przeciwwskazania obejmują mężczyzn z nadwrażliwością
na alprostadil, zagrożonych priapizmem
i mężczyzn z zaburzeniami krzepnięcia krwi.
Pomimo tych korzystnych danych rezygnacja z farmakoterapii
dojamistej wynosi 41–68% (Eardley i wsp.,
2010; Gupta i wsp., 1997; Porst i wsp., 2013; Sundaram
i wsp., 1997), przy czym większość rezygnacji występowała
w ciągu pierwszych 2–3 miesięcy. W badaniu porównawczym
monoterapia alprostadilem miała najniższy
wskaźnik przerwania terapii (27,5%) w porównaniu
do różnych kombinacji leków (37,6%), przy wskaźniku
migracji pacjentów wynoszącym 10% rocznie po pierwszych
kilku miesiącach leczenia. Powodami przerwania
leczenia były m.in. pragnienie stałego rodzaju terapii
(29%), brak odpowiedniej partnerki (26%), zła reakcja
(23%) – szczególnie wśród pacjentów wcześnie porzucających
terapię, lęk przed igłami (23%), lęk przed powikłaniami
(22%) oraz brak spontaniczności (21%). Uważne
doradzanie pacjentom w fazie szkoleniowej, jak również
wnikliwa kontrola, są ważne z punktu widzenia rezygnacji
pacjentów z terapii wstrzyknięć do ciał jamistych
(Vardi i wsp., 2000).
3A.4.6.1.2. Leczenie skojarzone
Leczenie skojarzone umożliwia pacjentowi wykorzystanie
różnych sposobów działania przyjmowanych leków, jak
również złagodzenie skutków ubocznych przy zastosowaniu
niższych dawek każdego leku.
Papaweryna (20–80 mg) była pierwszym doustnym
lekiem stosowanym we wstrzyknięciach dojamistych.
Jest to obecnie najczęściej stosowany lek w terapii
skojarzonej ze względu na wysoką częstość występowania
działań ubocznych w monoterapii. Obecnie
nie jest licencjonowany.
Fentolamina jest stosowana w terapii skojarzonej
w celu zwiększenia skuteczności. W monoterapii
prowadzi do słabej odpowiedzi erekcyjnej.
Nieliczne dane literaturowe popierają stosowanie
innych substancji, takich jak naczynioaktywny
peptyd jelitowy (VIP, ang. vasoactive intestinal peptide),
donory NO (linsidomina), forskolina, leki otwierające
kanały potasowe, moksysilit lub białko związane
z genem kalcytoniny (CGRP, ang. calcitonin
gene -related peptide), zazwyczaj w połączeniu z podstawowymi
lekami (Buvat i wsp., 1998; Mulhall i wsp.,
1997). Większość kombinacji nie jest standaryzowana
i niektóre leki mają ograniczoną dostępność w niektórych
krajach.
Papaweryna (7,5–45 mg) z fentolaminą (0,25–1,5 mg)
oraz papaweryna (8–16 mg) z fentolaminą (0,2–0,4 mg)
i alprostadilem (10–20 μg) są stosowane powszechnie
i z dużą skutecznością, mimo że nigdy nie uzyskały
licencji do stosowania w ED (Bechara i wsp., 1997;
McMahon, 1999). Schemat zastosowania kombinacji
trzech substancji papaweryny, fentolaminy
i alprostadilu ma najwyższe wskaźniki skuteczności,
sięgające 92%. Takie leczenie ma podobne
skutki uboczne jak monoterapia alprostadilem, ale
mniejszą częstość występowania bólu prącia z powodu
niższych dawek alprostadilu. Jednakże zwłóknienie
występuje częściej (5–10%), gdy stosowana
jest papaweryna (w zależności od całkowitej dawki).
VIP (25 μg) + mezylan fentolaminy (1–2 mg)
(InvicorpTM, obecnie zarejestrowany w Skandynawii),
jest kombinacją dwóch aktywnych substancji z uzupełniającym
się sposobem działania. Badania kliniczne
wykazały, że taka kombinacja jest skuteczna
u ≥80% mężczyzn z ED, włączając tych, którzy nie
odpowiadają na inne terapie, i inaczej niż dotychczasowe
leczenie iniekcjami, bardzo rzadko wiążą się
z bólem prącia i nieistotnym ryzykiem priapizmu
(Dinsmore i Wyllie, 2008).
Pomimo wysokich wskaźników skuteczności, 5–10%
pacjentów nie reaguje na kombinację substancji we
wstrzyknięciach do ciał jamistych. Połączenie sildenafi
lu i potrójnej terapii skojarzonej może pomóc aż 31%
pacjentów, którzy nie reagują na samą potrójną terapię
skojarzoną (McMahon i wsp., 1999). Jednak terapia skojarzona
wiąże się z występowaniem u 33% pacjentów
działań niepożądanych, takich jak zawroty głowy występujące u 20% pacjentów. Strategia ta może być
rozpatrywana u starannie wybranych pacjentów przed
przejściem do następnego etapu leczenia, jakim jest
proteza prącia (LE-4).
3A.4.6.1.3. Alprostadil podawany do cewki moczowej
Specyfi czna postać alprostadilu (125–1000 μg) w peletkach
(MUSETM) została zatwierdzona do stosowania
w ED (Nichols i wsp., 2002). Oddziaływanie naczyniowe
pomiędzy cewką moczową i ciałami jamistymi
umożliwia przenoszenie leku pomiędzy tymi strukturami
(Padma -Nathan i wsp., 1997). Erekcję wystarczającą
do odbycia stosunku uzyskuje się u 30–65,9%
pacjentów. W praktyce klinicznej tylko wyższe dawki
(500 i 1000 μg) były stosowane przy niskim odsetku
odpowiedzi (Costa i Potempa, 2012; Mulhall i wsp., 2001;
Padma -Nathan i wsp., 1997). Zastosowanie pierścienia
u nasady prącia (ACTISTM) może poprawić skuteczność
metody (Costa i Potempa, 2012; Mulhall i wsp., 2001).
Najczęstszymi działaniami niepożądanymi jest miejscowy
ból (29–41%) i zawroty głowy z ewentualnym
niedociśnieniem (1,9–14%). Zwłóknienie prącia i priapizm
występują bardzo rzadko (<1%). Krwawienie z cewki
moczowej (5%) i infekcje dróg moczowych (0,2%) są działaniami
niepożądanymi związanymi ze sposobem podawania.
Skuteczność jest znacznie niższa niż przy farmakoterapii
dojamistej (Shabsigh i wsp., 2000). Terapia
w postaci leku podawanego do cewki moczowej jest leczeniem
drugiego rzutu i stanowi alternatywę dla iniekcji
dojamistych u pacjentów, którzy preferują mniej inwazyjne,
choć mniej skuteczne leczenie. Miejscowa aplikacja
jest kolejną drogą podawania alprostadilu. Obecnie
jest to postać kremu, który zawiera środek ułatwiający
przenikanie substancji, aby umożliwić absorpcję alprostadilu
(200 i 300 μg) z cewki moczowej (Yeager i Beihn,
2005). Dane kliniczne są ograniczone. Znaczącą poprawę
w porównaniu z placebo zanotowano w testach IIEF, SEP2
i SEP3 w dużej grupie pacjentów z łagodnym do ciężkiego
ED (Padma -Nathan i Yeager, 2006). Działania niepożądane
to zaczerwienienie, pieczenie i ból prącia. Układowe
działania uboczne występują bardzo rzadko. Alprostadil
do podawania miejscowego jest zarejestrowany i dostępny
w niektórych krajach europejskich.
3A.4.7. Terapia trzeciej linii (protezy prącia)
Chirurgiczne wszczepienie protezy prącia można rozważyć
u pacjentów, którzy nie reagują na leczenie farmakologiczne,
lub którzy wolą trwałe rozwiązanie ich
problemu. Dwa obecnie dostępne rodzaje implantów
prącia to protezy hydrauliczne (2 - i 3 -częściowe)
i protezy półsztywne (Hellstrom i wsp., 2010; Martinez-
-Salamanca i wsp., 2011; Montague, 2011; Salonia i wsp.,
2012b). Większość pacjentów woli urządzenia hydrauliczne
trzyczęściowe ze względu na uzyskanie bardziej
„naturalnej” erekcji. Trzyczęściowe protezy hydrauliczne
zapewniają najlepszą sztywność i najlepsze zwiotczenie
prącia, ponieważ wypełniają każdą część ciał jamistych.
Jednak dwuczęściowe protezy hydrauliczne mogą być
dobrym rozwiązaniem dla pacjentów, u których występuje
duże ryzyko powikłań związane z umieszczeniem
zbiornika z płynem. Protezy półsztywne sprawiają,
że prącie jest odpowiednio twarde i może być własnoręcznie
ustawione w stan erekcji lub stan zwiotczenia
(Hellstrom i wsp., 2010; Martinez -Salamanca i wsp., 2011;
Montague, 2011; Salonia i wsp., 2012b).
Istnieją dwa dostępy chirurgiczne do wszczepiania
protezy prącia: przez kąt prąciowo -mosznowy oraz
przez okolicę łonową (Martinez -Salamanca i wsp., 2011;
Montague, 2011; Montague i wsp., 2001; Mulcahy i wsp.,
2004). Podejście pierwsze zapewnia doskonały dostęp,
umożliwia wgląd w proksymalne odnogi ciał jamistych,
pozwala uniknąć uszkodzenia nerwu grzbietowego
i umożliwia bezpośredni wgląd w miejsce wszczepiania
pompy. Jednakże przy tym dostępie zbiornik jest
umieszczany na ślepo do przestrzeni załonowej, co może
stanowić problem u pacjentów po rozległych operacjach
narządów miednicy (głównie radykalnej cystektomii).
Drugi dostęp ma tę zaletę, że zbiornik umieszcza się pod
kontrolą wzroku, ale samo wszczepienie pompy może
być trudniejsze i pacjenci są narażeni na nieznacznie
zwiększone ryzyko uszkodzenia nerwu grzbietowego
prącia. Powtórna operacja jest związana z gorszym
efektem i może być trudniejsza. Niezależnie od wskazań,
implantacja protezy daje największy współczynnik satysfakcji
(92–100% u pacjentów i 95% u partnerek) spośród
różnych metod leczenia ED (Bettocchi i wsp., 2010; Chung
i wsp., 2013; Falcone i wsp., 2013; Hellstrom i wsp., 2010;
Henry i wsp., 2012a; Kim i wsp., 2010; Lux i wsp., 2007;
Martinez -Salamanca i wsp., 2011; Natali i wsp., 2008;
Salonia i wsp., 2012a). U pacjentów z korzystnym rokowaniem
onkologicznym po radykalnej prostatektomii
z powodu raka prostaty skojarzone leczenie chirurgiczne
w przypadku ED z wszczepieniem protezy prącia jest
skuteczne i trwałe oraz ma ustaloną pozycję w leczeniu
tego schorzenia (Hellstrom i wsp., 2010; Lee i wsp., 2011a,
2013; Salonia i wsp., 2012a; Segal i wsp., 2013).
3A.4.7.1. Powikłania
Dwa główne powikłania mogące występować po wszczepieniu
protezy prącia to niewydolność mechaniczna oraz
infekcje. Modyfi kacje techniczne najczęściej używanych
trzyczęściowych protez (AMS 700CX/CXRTM i Coloplast
Alpha ITM) zmniejszyły awaryjność mechaniczną <5%
po 5 latach obserwacji (Carson i wsp., 2000; Hellstrom
i wsp., 2010; Wilson i wsp., 1999). Dobra technika chirurgiczna
z właściwą profi laktyką antybiotykową przeciwko
bakteriom Gram -dodatnim i Gram -ujemnym zmniejsza
ilość infekcji o 2–3% u pacjentów niskiego ryzyka z pierwotną
implantacją. Częstość zakażeń można dodatkowo
zmniejszyć do 1–2% przez wszczepienie protezy zaimpregnowanej
antybiotykiem (AMS InhibizoneTM) lub
z pokryciem hydrofi lnym (Coloplast TitanTM) (Carson
i wsp., 2011; Darouiche i wsp., 2013; Hellstrom i wsp., 2010;
Serefoglu i wsp., 2012; Zargaroff i wsp., 2014).Do grupy zwiększonego ryzyka należą pacjenci
poddający się reoperacji, z obniżoną odpornością organizmu
(immunosupresja, cukrzyca, uszkodzenie rdzenia
kręgowego) lub ze zwłóknieniem ciał jamistych prącia
(Hatzimouratidis i wsp., 2012b; Hellstrom i wsp., 2010;
Henry i wsp., 2012b; Levine i Burnett, 2013; Martinez-
-Salamanca i wsp., 2011; Trost i wsp., 2013). Infekcja
wymaga usunięcia protezy i podawania antybiotyku.
Alternatywne postępowanie to usunięcie zainfekowanej
protezy z natychmiastową wymianą na nową, co zostało
opisane w badaniu z protokołem washout ze skutecznością
>80% przypadków (Henry i wsp., 2012b; Mulcahy,
2000; Trost i wsp., 2013). Większość reoperacji jest wtórna
do uszkodzeń mechanicznych powiązanych z nadżerką
lub infekcją. 93% przypadków jest z powodzeniem korygowanych
i zapewnia sprawną czynnościowo protezę.
3A.4.7.2. Wnioski dotyczące terapii trzecioliniowej
Implanty prącia są atrakcyjnym rozwiązaniem dla
pacjentów, którzy nie reagują na leczenie zachowawcze.
Istnieją wystarczające dowody na to, aby polecić to rozwiązanie
pacjentom niereagującym na terapie mniej inwazyjne,
ze względu na jego wysoką skuteczność, bezpieczeństwo
i poziom zadowolenia.
3A.4.8. Rekomendacje dotyczące leczenia
zaburzeń erekcji

3A.5. Badania kontrolne
Badania kontrolne są ważne ze względu na ocenę skuteczności
i bezpieczeństwa zastosowanego leczenia.
Zasadnicze znaczenie ma również zadowolenie pacjenta.
Lekarze muszą być świadomi tego, że nie ma jednakowego
sposobu leczenia dla wszystkich pacjentów i dla wszystkich
sytuacji, które opisano szczegółowo w poprzednich
rozdziałach.
3B. PRZEDWCZESNY WYTRYSK
3B.1. Wprowadzenie
Pomimo iż PE jest częstym zaburzeniem seksualnym,
pozostaje problemem słabo rozumianym. Pacjenci niechętnie
omawiają swoje dolegliwości, a wielu lekarzy
nie wie o skutecznych metodach leczenia. W rezultacie
pacjenci mogą zostać niewłaściwie zdiagnozowani lub
leczeni (Rosenberg i Sadovsky, 2007).
3B.1.1. Epidemiologia
Największym problemem związanym z określeniem częstości
występowania PE jest brak precyzyjnych (walidowanych)
defi nicji tego zaburzenia (Waldinger, 2002). Największą
częstość występowania 31% (u mężczyzn w wieku 18–59
lat) wykryto w sondażu dotyczącym zdrowia i życia społecznego
(NHSLS, ang. National Health and Social Life Survey)
w USA (Laumann i wsp., 1999a). Częstość występowania
różniła się w zależności od wieku pacjentów i wynosiła
odpowiednio: 30% w przedziale 18–29 lat, 32% w przedziale
30–39 lat, 28% w przedziale 40–49 lat oraz 55%
w przedziale 50–59 lat. Wydaje się jednak mało prawdopodobne
to, że częstość PE kształtuje się na poziomie
20–30%, biorąc pod uwagę fakt, jak niewielu mężczyzn
zgłasza się z tym problemem celem leczenia. Tak wysoki
wskaźnik może być rezultatem dychotomicznej skali (tak/
nie) w pojedynczym pytaniu „czy wytrysk wystąpił zbyt
wcześnie?” zamieszczonym w kwestionariuszu. W badaniach
europejskich częstości występowania były znacznie
niższe (Porst i wsp., 2007). Waldinger i wsp. (2008) proponują
cztery podtypy PE: wrodzony PE o częstości występowania
2,3%, nabyty PE – 3,9%, zmienny osobniczo
PE – 8,5%, zaburzenie seksualne imitujące PE – 5,1%
(Serefoglu i wsp., 2011). Częstość występowania wrodzonego
i nabytego PE na poziomie 5% w populacji ogólnej
dobrze koreluje z danymi epidemiologicznymi wskazującymi,
że ok. 5% populacji wykazuje wewnątrzpochwowy
czas opóźnienia ejakulacji (IELT, ang. intravaginal ejaculation
latency time) na poziomie poniżej 2 min (Althof i wsp., 2014).
3B.1.2. Patofi zjologia i czynniki ryzyka
Etiologia PE nie jest znana. Istnieje niewiele badań
sugerujących hipotezy biologiczne i psychologiczne
opisujące lęki, nadwrażliwość prącia oraz dysfunkcję
receptora 5 -hydroksytryptaminy (5 -HT, ang. 5-hydroxytriptamine)
(McMahon i wsp., 2004). Patofi zjologia PE jest
również słabo poznana. Procesy fi zjologiczne prowadzące
do wydalenia nasienia poprzez ujście zewnętrzne cewki
moczowej nie są zaburzone u pacjentów z PE. Znaczna
liczba pacjentów cierpiących na ED doświadcza również
PE (Laumann i wsp., 2005). Silne lęki podczas współżycia
związane z ED mogą nasilać PE i istnieje ryzyko rozpoznania
PE zamiast ED. Według NHLS wiek nie wpływa
na częstość występowania PE (Laumann i wsp., 1999a;
Porst i wsp., 2007), w odróżnieniu od ED, które występują
tym częściej, im starszy jest mężczyzna. Stan cywilny
oraz wysokość przychodów nie wpływają na PE (Laumanni wsp., 1999a). Częstość występowania PE jest większa
u Afroamerykanów, Hiszpanów oraz muzułmanów
(Carson i Gunn, 2006; Richardson i Goldmeier, 2005) oraz
u mężczyzn z niższym stopniem wykształcenia (Laumann
i wsp., 1999a, 2005). Inne czynniki ryzyka to predyspozycje
genetyczne (Waldinger i wsp., 1998b), zły stan ogólny
i otyłość (Laumann i wsp., 1999a), zapalenie gruczołu krokowego
(Screponi i wsp., 2001; Shamloul i el -Nashaar, 2006),
nieprawidłowa funkcja tarczycy (Cordeiro i wsp., 2012),
problemy emocjonalne i stres (Dunn i wsp., 1999; Laumann
i wsp., 1999a) oraz traumatyczne doświadczenia seksualne
(Laumann i wsp., 1999a, 2005). W jedynym opublikowanym
badaniu na temat zapobiegania i modyfi kacji czynników
ryzyka PE (el -Nashaar i Shamloul, 2007) skuteczna
eliminacja przyczyny u chorych z przewlekłym zapaleniem
gruczołu krokowego i PE spowodowała znaczną
poprawę IELT oraz kontroli nad ejakulacją w porównaniu
do nieleczonych chorych (Palmieri i wsp., 2012).
3B.1.3. Wpływ przedwczesnego wytrysku
na jakość życia
Mężczyźni z PE częściej zgłaszają niezadowolenie
ze związków seksualnych, ze współżycia, trudności
w rozluźnieniu się podczas stosunków płciowych oraz
rzadsze współżycie (Rowland i wsp., 2004, 2007). Jednak
negatywny wpływ PE rozciąga się poza ramy dysfunkcji
seksualnych. Przedwczesny wytrysk ma negatywny
wpływ na pewność siebie i związek z partnerką,
może powodować lęki, zawstydzenie oraz depresję
(Rowland i wsp., 2004; Symonds i wsp., 2003). Libido
oraz zainteresowanie seksem nie są zaburzone przy
PE (Riley i Segraves, 2006), jednak satysfakcja partnerki
ze stosunków płciowych maleje wraz z nasilającymi
się objawami u pacjenta (Byers i Grenier, 2003).
Pomimo potencjalnie poważnych konsekwencji psychologicznych
oraz obniżonej jakości życia niewielu
mężczyzn szuka porady. W Globalnym Badaniu Postaw
i Zachowań Seksualnych (GSSAB, ang. Global Study of
Sexual Attitudes and Behaviors) 78% mężczyzn zgłaszających
zaburzenia seksualne nie szukało porady w tej
sprawie (Laumann i wsp., 2005), więcej mężczyzn zgłaszało
się z powodu ED niż z powodu PE (Laumann i wsp.,
2005). W ankiecie dotyczącej częstości występowania
PE i postaw wobec zaburzenia (PEPA, ang. premature
ejaculation prevalence and attitudes) jedynie 9% mężczyzn
deklarujących PE zgłosiło się po poradę (Porst
i wsp., 2007). Główne powody nieomawiania tych dolegliwości
to zawstydzenie oraz przekonanie, że nie istnieje
skuteczne leczenie. Lekarze czują się niepewnie,
omawiając te dolegliwości, z powodu zawstydzenia oraz
niedoboru wiedzy i doświadczenia w leczeniu tej przypadłości
(Solursh i wsp., 2003; Sotomayor, 2005). Lekarze
powinni zachęcać pacjentów do poruszania tematu PE.
3B.2. Klasyfi kacja
Istnieją dwie ofi cjalne defi nicje PE, ale żadna z nich nie
została powszechnie uznana.
W „Diagnostycznym i Statystycznym Wykazie
Chorób Umysłowych IV – wydanie uaktualnione”
(DSM -IV -TR, ang. Diagnostic and Stastical Manual of
Mental Disorders IV – Text Revision) PE jest defi niowany
jako: „Utrzymująca się lub nawracająca sytuacja, gdy
ejakulacja poprzedzona jest minimalną stymulacją
seksualną przed, w trakcie lub krótko po wprowadzenia
członka do pochwy, wcześniej niż życzy tego
sobie mężczyzna. Lekarz powinien wziąć po uwagę
czynniki, które wpływają na długość fazy podniecenia,
takie jak: wiek, nowa partnerka lub okoliczności
oraz ostatnia częstotliwość stosunków seksualnych”
(DSM IV, 2000). Defi nicja PE została uaktualniona
w wydaniu V (DSM V, 2013).
Międzynarodowa Statystyczna Klasyfi kacja Chorób
i Problemów Zdrowotnych. Rewizja 10 (ICD -10, ang.
International Statistical Classifi cation of Diseases and
Related Healt Problems 10th Revision) defi niuje PE
następująco: „Brak możliwości opóźnienia ejakulacji
w celu osiągnięcia satysfakcji seksualnej, co manifestuje
się poprzez pojawienie się wytrysku przed lub
tuż po rozpoczęciu współżycia (przed lub w ciągu
15 s) lub wytrysk pojawia się przy braku pełnej erekcji
i uniemożliwia współżycie. Problem nie jest wynikiem
wydłużonego okresu braku aktywności seksualnej”
(WHO, 1994).
Drugi międzynarodowy konsensus dotyczący zaburzeń
seksualnych i erekcji (ang. Second International
Consultation on Sexual and Erectile Dysfunction) defi niuje
PE jako: „Wytrysk przy minimalnej stymulacji, wcześniej
niż pożądany, przed lub wkrótce po penetracji pochwy,
który wywołuje stres i nad którym jest niewielka kontrola
lub brak kontroli mężczyzny” (McMahon i wsp., 2004).
Międzynarodowe Towarzystwo Medycyny Seksualnej
(ISSM, ang. International Society of Sexual Medicine) stworzyło
nową defi nicję opartą na faktach (Serefoglu i wsp.,
2014):
1. Wytrysk, który zawsze lub prawie zawsze występuje
przed lub w ciągu jednej minuty od penetracji pochwy
(PE wrodzony) lub istotne klinicznie i uciążliwe skrócenie
czasu opóźnienia wytrysku do 3 min lub mniej
(nabyty PE).
2. Brak możliwości opóźnienia ejakulacji podczas wszystkich
lub prawie wszystkich stosunków pochwowych.
3. Negatywne konsekwencje osobiste, takie jak stres,
frustracja i unikanie kontaktów seksualnych.
Cztery powyższe defi nicje biorą pod uwagę czas
pojawienia się wytrysku, brak kontroli i negatywne
konsekwencje osobiste z powodu PE. Jednak głównym
punktem spornym jest ilościowy pomiar czasu do wystąpienia
ejakulacji, który najczęściej jest opisywany poprzez
IELT (DSM V, 2013).
Ostatnio zaproponowano dwa nowe rodzaje PE
(Waldinger i Schweitzer, 2006):
„Zmienny PE” – charakteryzujący się nieregularnym
i zmiennym występowaniem wczesnej ejakulacji, który
jest odmianą prawidłowych reakcji seksualnych. „Subiektywny PE” jako subiektywna ocena notorycznego
lub nieregularnego występowania wczesnej ejakulacji
podczas stosunku płciowego, podczas gdy IELT
pozostaje w granicach normy lub może nawet być
dłuższy. Nie należy tego stanu rozpoznawać jako
patologicznego z medycznego punktu widzenia.
Dodanie nowych rodzajów PE może pomóc w diagnostyce
i leczeniu pacjentów, ale dokładna rola, jaką
odgrywają, wymaga dalszych badań (Waldinger, 2007b).
3B.3. Testy diagnostyczne
Aby rozpoznać PE, należy przeprowadzić badanie podmiotowe
oraz przedmiotowe pacjenta (Shabsigh, 2006;
Sharlip, 2005). Wywiad lekarski powinien umożliwić
różnicowanie PE wrodzonego, nabytego oraz zależnego
od sytuacji (okoliczności, partnerka) oraz występującego
stale. Należy zwracać szczególną uwagę na czas
wystąpienia ejakulacji, stopień podniecenia seksualnego,
wpływ problemu na aktywność seksualną i jakość życia,
stosowane oraz nadużywane leki. Należy zróżnicować PE
z ED. Wielu pacjentów z ED rozwija wtórnie PE na skutek
lęków związanych z trudnością w uzyskaniu i utrzymaniu
erekcji (Rowland i Slob, 1997). Część pacjentów nie zdaje
sobie sprawy, że po ejakulacji następuje fi zjologiczne
ustępowanie erekcji. Chorzy ci mogą uskarżać sią na ED,
kiedy ich pierwotnym problemem jest PE (Althof, 2006).
Istnieje kilka nakładających się częściowo defi nicji PE
o czterech wspólnych składowych (tabela 7), tworzących
w rezultacie defi nicję wielopłaszczyznową (Althof
i Symonds, 2007).
Tabela 7. Wspólne składowe defi nicji PE
– czas do osiągnięcia ejakulacji oceniany przez wewnątrz
pochwowy czas opóźnienia ejakulacji (IELT)
– odczucie kontroli nad ejakulacją
– niezadowolenie
– trudności interpersonalne wynikające z dysfunkcji
ejakulacji
3B.3.1. Wewnątrzpochwowy czas opóźnienia
ejakulacji
Oznaczenie samego IELT nie jest wystarczające, aby zdefi -
niować PE, gdyż podobne wartości obserwuje się zarówno
u mężczyzn z PE, jak i u zdrowych (Giuliano i wsp., 2008;
Patrick i wsp., 2005). Wewnątrzpochwowy czas opóźnienia
ejakulacji wpływa znacząco na poziom odczuwanej kontroli
nad ejakulacją, lecz nie wpływa bezpośrednio na niezadowolenie
z relacji partnerskich wywołane wczesną
ejakulacją lub na satysfakcję ze współżycia seksualnego
(Patrick i wsp., 2007). Ponadto odczuwana kontrola nad
ejakulacją ma bezpośredni znamienny wpływ zarówno
na niezadowolenie z relacji partnerskich wywołane tym
zaburzeniem, jak i na satysfakcję ze współżycia seksualnego
(oba czynniki bezpośrednio wpływają na problemy
w relacjach interpersonalnych związane z ejakulacją).
W praktyce ambulatoryjnej samodzielne określenie przez pacjenta IELT jest wystarczające (Althof i wsp., 2010).
Oceniany samodzielnie oraz przy użyciu stopera IELT
pozwala uzyskać porównywalne wyniki oraz rozpoznać
PE z 80% czułością i 80% swoistością (Rosen i wsp., 2007b).
Poprzez połączenie IELT z jednoczynnikowym raportem
pacjenta (PRO, ang. single -item patient reported outcome)
można uzyskać swoistość na poziomie 96% w odniesieniu
do kontroli nad ejakulacją i satysfakcji ze współżycia
seksualnego (skala od 0 – bardzo zła do 4 – bardzo
dobra) oraz niezadowolenia i trudności interpersonalnych
(skala od 0 – brak do 4 – ekstremalne). Pomiary
IELT przy użyciu stopera są wymagane przy badaniach
naukowych. Choć IELT jest obiektywnym narzędziem
do oceny PE, nowe badania donoszą, że satysfakcja oraz
niezadowolenie ze współżycia korelują silniej z odczuciem
kontroli nad ejakulacją niż z samodzielne określonym
IELT (Kempeneers i wsp., 2013).
3B.3.2. Kwestionariusze do oceny przedwczesnego
wytrysku
Potrzeba obiektywnej oceny PE doprowadziła do powstania
kilku kwestionariuszy opartych na raportach
PRO (Althof i Symonds, 2007). Jedynie dwa kwestionariusze
potrafi ą rozróżnić pacjentów cierpiących na PE
od zdrowych:
Narzędzie diagnostyczne do oceny przedwczesnego
wytrysku (PEDT, ang. premature ejaculation diagostic
tool): 5 -punktowy kwestionariusz oparty na grupach
docelowych oraz wywiadach u mężczyzn z USA,
Niemiec i Hiszpanii. Ocenia kontrolę nad ejakulacją,
częstotliwość i poziom minimalnej stymulacji, poziom
niezadowolenia oraz trudności interpersonalnych
(Symonds i wsp., 2007a, 2007b). Całkowita liczba
punktów ≥11 wskazuje na PE, wynik w zakresie 9–10
sugeruje, że diagnoza jest prawdopodobna, wynik ≤8
oznacza niskie prawdopodobieństwo PE.
Arabski Wskaźnik Przedwczesnego Wytrysku (AIPE,
ang. Arabic Index of Premature Ejaculation): 7 -punktowy
kwestionariusz powstały w Arabii Saudyjskiej, który
ocenia pożądanie, twardość erekcji potrzebnej
do współżycia, czas do ejakulacji, kontrolę nad ejakulacją,
satysfakcję pacjenta i partnerki, lęki lub depresję
(Arafa i Shamloul, 2007). Punktacja powyżej 30
wyklucza występowanie PE (zakres 7–35). Nasilenie
PE klasyfi kuje się jako: postać ciężką (7–13 punktów),
umiarkowaną (14–19 punktów), łagodną do umiarkowanej
(20–25 punktów) i łagodną (26–30 punktów).
Najczęściej stosowany jest kwestionariusz PEDT.
Jednak korelacja pomiędzy diagnozą z PEDT a raportem
PRO jest niska. Nowe badanie opisuje, że jedynie 40%
mężczyzn z PE zdiagnozowanym w PEDT oraz 19%
z podejrzeniem PE raportowało występowanie zaburzenia
(McMahon i wsp., 2012). Kwestionariusze będą ułatwiały
metodologię badań nad lekami stosowanymi w PE,
jednak wskazana jest szersza walidacja międzykulturowa
(McMahon, 2007). Pozostałe kwestionariusze stworzone
do określenia PE oraz oceny efektu leczniczego to profil przedwczesnego wytrysku (PEP, ang. premature ejaculation
profi le) (Patrick i wsp., 2005), wskaźnik przedwczesnego
wytrysku (IPE, ang. index of premature ejaculation)
(Hatzichristou i wsp., 1999) oraz Kwestionariusz do Oceny
Zdrowia Seksualnego Mężczyzn – Dysfunkcja Ejakulacji
(MSHQ -EjD, ang. Male Sexual Health Questionnaire-
-Ejaculatory Dysfunction) (Rosen i wsp., 2007a). Ich zastosowanie
w praktyce ambulatoryjnej jest opcjonalne.
3B.3.3. Badanie fi zykalne i badania dodatkowe
Badanie fi zykalne stanowi uzupełnienie wstępnej diagnostyki.
Warto dokonać oceny endokrynologicznej i neurologicznej
pacjenta pod kątem chorób mających wpływ
na PE: endokrynopatii, choroby Peyroniego, zapalenia
cewki moczowej oraz gruczołu krokowego. Nie zaleca się
wykonywania rutynowo badań laboratoryjnych, jedynie
jeśli są wskazane na podstawie wywiadu i badania fi zykalnego
(Shabsigh, 2006).
ED – zaburzenia erekcji; GR – stopień rekomendacji; IELT –
wewnątrzpochwowy czas opóźnienia ejakulacji; LE – poziom wiarygodności
dowodu naukowego; PE – przedwczesny wytrysk; PRO –
jednoczynnikowy raport pacjenta
3B.4. Leczenie przedwczesnego wytrysku
Kiedy PE powoduje niewiele dolegliwości, leczenie można
ograniczyć do edukacji pacjenta i porad psychologicznych
u seksuologa. Przed rozpoczęciem leczenia należy omówić
z pacjentem jego oczekiwania wobec terapii. Jeżeli współistnieją
zaburzenia erekcji lub zapalenie gruczołu krokowego,
należy te schorzenia leczyć w pierwszej kolejności.
U pacjentów, dla których leczenie farmakologiczne
jest nieodpowiednie, można zastosować różne techniki
behawioralne. W przypadku wrodzonego PE nie zaleca
się stosowania technik behawioralnych jako leczenia
pierwszego rzutu. Wspomniane techniki są czasochłonne
i wymagają wsparcia od partnerki. Długofalowe korzyści
leczenia technikami behawioralnymi nie są znane.
Farmakoterapia to podstawowe leczenie wrodzonego
PE. Dapoxetyna to jedyny lek na żądanie zarejestrowany
w wielu krajach, z wyjątkiem USA. Pozostałe leki stosowane
w terapii PE nie mają rejestracji do stosowania
w tym zaburzeniu (ang. off -label). Leki przeciwdepresyjne
do stosowania przewlekłego m.in. selektywne inhibitory
wychwytu zwrotnego serotoniny (SSRI, ang. selective
serotonin re -uptake inhibitors), klomipramina, trójcykliczne
leki przeciwdepresyjne oraz stosowane na żądanie
leki znieczulające miejscowo do stosowania zewnętrznego
wykazują efekt leczniczy w terapii PE. Długofalowe
korzyści z ich stosowania nie są znane.
Dokonano analizy opartej na faktach wszystkich stosowanych
metod leczniczych. Poziom dowodu, stopień
rekomendacji oraz algorytm postępowania zostały przedstawione
na rycinie 4.
3B.4.1. Strategie psychologiczne/behawioralne
Strategie behawioralne to głównie technika „stop -start”
opracowana przez Semansa (1956) i jej modyfi kacja, technika
„ściskania” zaproponowana przez Masters i Johnson:
Technika „start- stop” polega na stymulowaniu prącia
przez partnerkę do momentu odczuwania nadchodzącej
ejakulacji. Wtedy mężczyzna instruuje partnerkę,
aby zaprzestała stymulacji, czeka aż odczucie
przeminie, wtedy partnerka ponawia stymulację
prącia.
W technice „ściskania” stymulacja przebiega analogicznie,
lecz partnerka ściska żołądź chwilę przed
pojawieniem się fali ejakulacji do momentu utraty
odczuwania nadchodzącej ejakulacji.
Obie powyższe procedury są stosowane w cyklu
trzech powtórzeń, zanim partnerzy przejdą do odczuwania
orgazmu. Techniki behawioralne są oparte na hipotezie,
która mówi, że PE pojawia się w sytuacji, kiedy
mężczyzna nie potrafi rozpoznać sytuacji znacznego
podniecenia oraz nieuniknionej ejakulacji. Trenowanie
może modyfi kować odpowiedź na bodziec poprzez ekspozycję
pacjenta na stopniowo coraz silniejsze i dłuższe
stymulacje, zachowując przy tym intensywność i długość
bodźców tuż poniżej progu wyzwolenia ejakulacji. Istnieje
wiele modyfi kacji tej techniki, przez co trudno je ze sobą
porównywać.
Masturbacja przed spodziewanym współżyciem
seksualnym jest techniką stosowaną przez młodszych
mężczyzn. Po masturbacji prącie jest mniej wrażliwe,
co wydłuża czas do ejakulacji po okresie refrakcji. W innej
technice mężczyzna uczy się rozpoznawać moment
wzmożonego podniecenia i w jaki sposób ma utrzymać
niższy stopień podniecenia, aby nie doszło do ejakulacji.
Skuteczność tej techniki jest porównywalna do techniki
„start -stop”. Z PE mogą być związane czynniki psychologiczne,
które powinny być uwzględnione w leczeniu. Należą
do nich lęki, ale także problemy interpersonalne.
Ograniczona ilość badań sugeruje, że terapie behawioralne
oraz terapie seksuologiczne prowadzą do wydłużenia
czasu stosunków płciowych i do poprawy satysfakcji
ze współżycia.
Powyższe techniki ogółem prowadzą do krótkoterminowej
poprawy na poziomie 50–60% (Grenier i Byers,
1995; Metz i Pryor, 1997). Jednakże nie ma badań kontrolowanych,
które wykazywałyby skuteczność terapii
behawioralnych. Natomiast badania podwójnie zaślepione,
randomizowane dowodzą skuteczności farmakoterapii
(klomipramina, sertralina, paroksetyna i sildenafi
l) w postaci wydłużonego IELT w stosunku do technik
behawioralnych (Abdel -Hamid i wsp., 2001). Co więcej,
praktyka kliniczna sugeruje, że poprawa po leczeniu behawioralnym
nie utrzymuje się długoterminowo (de Amicis
i wsp., 1985; Hawton i wsp., 1986). Terapia behawioralna
ma największą wartość jako leczenie dodatkowe, choć
wymaga to potwierdzenia w dalszych badaniach randomizowanych.
Punkty końcowe tych badań powinny
być uzyskane przez narzędzie walidowane. Aby wysunąć
ostateczne wnioski, wskazana jest dłuższa obserwacja.
3B.4.2. Dapoksetyna
Wodorochlorek dapoksetyny to krótko działający SSRI,
z profi lem farmakokinetycznym odpowiednim do stosowania
na żądanie w przypadku PE. Posiada szybki czas
do osiągnięcie stężenia maksymalnego Tmax (1,3 godz.)
oraz krótki okres półtrwania (95% wydalone po 24 godz.)
(Modi i wsp., 2006). Do chwili obecnej dapoksetyna
została przebadana u 6081 chorych (McMahon, 2012).
Jest zarejestrowana do stosowania na żądanie w krajach
europejskich i poza nimi, ale nie w USA.
Obie dostępne dawki dapoksetyny (30 i 60 mg)
powodowały wydłużenie IELT, odpowiednio 2,5 - oraz
3 -krotnie. Pacjenci z wyjściowym IELT <0,5 min osiągają
poprawę 3,4–4,3 -krotną (McMahon i Porst, 2011; Porst
i wsp., 2010). W badaniach randomizowanych, kontrolowanych
placebo dapoksetyna w dawkach 30 i 60 mg,
zażyta 1–2 godz. przed stosunkiem, była skuteczna
od pierwszego przyjęcia, wydłużała IELT, zwiększała
odczuwaną kontrolę ejakulacji, zmniejszała niezadowolenie
oraz poprawiała satysfakcję ze współżycia seksualnego.
Dapoksetyna wykazywała porównywalną
skuteczność u mężczyzn z wrodzonym i nabytym PE
(Porst i wsp., 2010). Działania niepożądane były zależne
od dawki i objawiały się pod postacią nudności, biegunki,
bólów oraz zawrotów głowy. Cztery procent badanych
przerwało leczenie ze względu na działania niepożądane
przy dawce 30 mg, 10% badanych zrezygnowało
z badania, przyjmując dawkę 60 mg (Althof i wsp., 2010).
Nie stwierdzono zwiększonego ryzyka wystąpienia
myśli lub zachowań samobójczych, ani zespołu odstawiennego
przy nagłym przerwaniu leczenia (McMahon
i wsp., 2011).
Dołączenie dapoksetyny do przyjmowanego już
inhibitora fosfodiesterazy 5 (PDE5i) może zwiększyć
ryzyko objawów prodromalnych, które mogą spowodować
omdlenie. Takiego ryzyka nie obserwuje się w monoterapii
tymi lekami. Ogólnie występuje dobra tolerancja
przy stosowaniu obu leków jednocześnie, z profi lem bezpieczeństwa
na poziomie przyjmowania samej dopoksetyny
(na podstawie wcześniejszych badań trzeciej fazy
tego leku). Jak podaje charakterystyka produktu, parametry
takie jak tętno i ciśnienie tętnicze krwi (istotne
przy omdleniach ortostatycznych) powinny być zmierzone
przed rozpoczęciem leczenia dapoksetyną. Nie
odnotowano omdleń ortostatycznych w badaniu obserwacyjnym,
postmarketingowym, w którym zidentyfi kowano
chorych z ryzykiem na podstawie wywiadu lekarskiego
oraz badań ortostatycznych (Mirone i wsp., 2014).
Nadal rozpatruje się mechanizm działania krótko
działających SSRI w PE. Dapoksetyna przypomina
leki SSRI o działaniu antydepresyjnym w następujący
sposób: lek wiąże się z transporterem wychwytu
zwrotnego 5 -HT na poziomie subnanomolarnym, ma
jedynie ograniczone powinowactwo do receptora 5 -HT
i jest słabym antagonistą receptorów adrenergicznych
1A, dopaminergicznych D1 oraz 5 -HT2B. Szybkie wchłanianie
dapoksetyny może prowadzić do nagłego wzrostu
zewnątrzkomórkowego stężenia serotoniny, co może
przełamać procesy autoregulacyjne. Czy mechanizm
działania krótko działających SSRI różni się od tradycyjnego
mechanizmu leków długo działających? Żaden
z nich nie powoduje aktywacji autoreceptora i kompensacji
opisywanej przy lekach przewlekle stosowanych
lub procesy te zachodzą, ale nie niwelują one działania
krótko działającego SSRI (Giuliano, 2007).
3B.4.3. Stosowanie leków przeciwdepresyjnych
poza wskazaniami: inhibitory zwrotnego
wychwytu serotoniny i klomipramina
Zjawisko ejakulacji zostaje zapoczątkowane w ośrodku
ejakulacji w rdzeniu przedłużonym (Borgdorff i wsp., 2008;
Truitt i Coolen, 2002), pozostaje pod wpływem pobudzającym
lub hamującym ośrodkowego i obwodowego układu
nerwowego (Giuliano i Clement, 2012). 5 -HT (serotonina)
bierze udział w zjawisku ejakulacji. Hamowanie ejakulacji
jest najprawdopodobniej spowodowane przez aktywację
receptora 5 -HT1B i 5 -HT2C w ośrodkach rdzeniowych
i nadrdzeniowych. Natomiast stymulacja receptorów
5 -HT1A wywołuje ejakulację (Giuliano, 2007).
Stosowane w leczeniu zaburzeń nastroju są SSRI.
Jednocześnie opóźniają ejakulację i z tego powodu
są szeroko stosowane poza zarejestrowanymi wskazaniami
do leczenia PE. Efekt terapeutyczny po SSRI,
zarówno w depresji, jak i w PE, uwidacznia się po 1–2
tygodniach zażywania leku (Giuliano, 2007). Przewlekłe
stosowanie SSRI powoduje przedłużony wzrost stężenia
serotoniny w szczelinie synaptycznej, co skutkuje
desensytyzacją receptorów 5 -HT1A i 5 -HT1B (Olivier
i wsp., 1998). Pierwszy najsilniejszy serotoninergiczny trójcykliczny antydepresant o skuteczności w leczeniu PE
to klomipramina, opisana w 1973 r. (Waldinger, 2007a).
Leczenie PE zrewolucjonizowały SSRI. Zmieniły również
rozumienie tego zaburzenia od czasu pierwszej publikacji
na temat paroksetyny w 1970 r. (Waldinger i wsp.,
1994). Przed erą dapoksetyny codzienne stosowanie SSRI
było leczeniem pierwszego rzutu w PE. Najczęściej stosowane
leki to citalopram, fl uoksetyna, fl uwoksamina,
paroksetyna i sertralina – wszystkie charakteryzują się
podobnym mechanizmem działania farmakologicznego.
Z przeglądu i metaanalizy badań nad wszystkimi
stosowanymi w PE lekami wynika, że pomimo częstych
różnic w metodologii tych badań można wskazać
kilka dobrze zaprojektowanych, podwójnie zaślepionych
badań z użyciem placebo, które wykazują korzyści
płynące z codziennego stosowania SSRI w leczeniu PE
(Waldinger i wsp., 2004b). Jednakże pomimo znaczącego
wydłużenia IELT brak jest danych na temat raportów
PRO z PE stosujących SSRI.
W oparciu o tę metaanalizę stwierdzono, że SSRI
wydłużają średnią geometryczną IELT 2,6–13,3 -krotnie.
Paroksetyna wykazała większą skuteczność niż fl uoksetyna,
klomipramina i sertralina. Sertralina z kolei
wykazywała silniejszy efekt od fl uoksetyny, a skuteczność
klomipraminy nie była większa niż fl uoksetyny
i sertraliny. Leki oceniano przy następującym dawkowaniu:
paroksetyna 20–40 mg, sertralina 25–200 mg,
fl uoksetyna 10–60 mg i klomipramina 25–50 mg; nie
obserwowano korelacji pomiędzy dawką leku i skutecznością
terapeutyczną przy stosowaniu różnych leków.
Istnieją ograniczone dowody na to, że citalopram jest
mniej skuteczny w porównaniu z innymi lekami z grupy
SSRI, a fl uwoksamina może nie być skuteczna (Waldinger
i wsp., 1998a, 2001).
Opóźnienie ejakulacji może się rozpocząć po kilku
dniach od przyjmowania leku, uzyskując wyraźny efekt
po 1–2 tygodniach, ponieważ desensytyzacja receptora
wymaga czasu. Skuteczność leku może być utrzymana
przez okres kilku lat, jednak może wystąpić zjawisko
tachyfi laksji po 6–12 miesiącach stosowania (słabnąca
odpowiedź na leczenie na skutek przewlekłego przyjmowania
leku) (Waldinger, 2007a). Często obserwowane
działania niepożądane po SSRI to: zmęczenie, senność,
ziewanie, nudności, wymioty, suchość w ustach, biegunka
i pocenie się. Objawy te są zwykle łagodne i stopniowo
zmniejszają się po 2–3 tygodniach od rozpoczęcia terapii
(McMahon i Porst, 2011; Waldinger, 2007b). Opisywano
również zmniejszenie libido, anorgazmię, brak wytrysku
oraz ED.
Ze względu na teoretyczne ryzyko wystąpienia myśli
lub prób samobójczych zaleca się szczególną uwagę przy
stosowaniu SSRI u młodocianych pacjentów z PE, w wieku
18 lat lub poniżej oraz u pacjentów z PE, u których jednocześnie
stwierdzono zaburzenia depresyjne, szczególnie
jeśli były one związane z myślami samobójczymi. Należy
odradzić pacjentom unikania nagłego odstawienia lub
zmniejszania dawek leków z grupy SSRI, co mogłoby się
wiązać z wystąpieniem zespołu odstawiennego (Althof
i wsp., 2010).
W jednym kontrolowanym badaniu odnotowano skuteczność
stosowania klomipraminy na żądanie (ale nie
paroksetyny) 3–5 godz. przed współżyciem. Opóźnienie
ejakulacji mierzone IELT było jednak mniejsze niż przy
codziennym stosowaniu tego samego leku (Waldinger
i wsp., 2004a). Jednakże leczenie na żądanie może być
łączone z próbą codziennego przyjmowania leku lub
z terapią niskimi dawkami leku, w ten sposób zmniejszając
występowanie objawów niepożądanych (Kim i Paick,
1999; McMahon i Touma, 1999).
Prawo farmaceutyczne w poszczególnych państwach
zdecydowanie odradza przepisywanie leków poza ich
zarejestrowanymi wskazaniami, co może przysparzać
lekarzom problemów.
3B.4.4. Środki znieczulające miejscowo
Środki znieczulające miejscowo to najstarsza forma
terapii PE (Morales i wsp., 2007). Kilka badań (Sachs
i Liu, 1991; Wieder i wsp., 2000) podtrzymuje hipotezę,
że leki te zmniejszają wrażliwość żołędzi prącia i wydłużają
czas do ejakulacji, nie wpływając ujemnie na odczuwanie
samej ejakulacji.
3B.4.4.1. Lidokaina–prylokaina w kremie
W badaniu randomizowanym, podwójnie zaślepionym,
z grupą placebo zastosowanie lidokainy–prylokainy
w kremie wydłużało IELT od 1 min w grupie placebo
do 6,7 min w grupie badanej (Atikeler i wsp., 2002).
W innym badaniu randomizowanym, podwójnie zaślepionym,
z grupą placebo zastosowanie lidokainy–prylokainy
w kremie istotnie wydłużało IELT mierzony stoperem
z 1,49 do 8,45 min. Nie wykazano różnicy w grupie
placebo (1,67 do 1,95 min) (Busato i Galindo, 2004).
5-procentowy krem z lidokainą–prylokainą jest nakładany
miejscowo 20–30 min przed stosunkiem płciowym.
Wydłużone utrzymywanie kremu (30–45 min) u znacznego
odsetka mężczyzn może skutkować utratą erekcji
z powodu znieczulenia prącia (Atikeler i wsp., 2002).
Założenie prezerwatywy zapobiega wchłanianiu się
kremu przez śluzówkę pochwy i tym samym wywieraniu
efektu znieczulenia miejscowego u partnerki.
Alternatywnie, zaleca się zdjęcie prezerwatywy
i umycie skóry prącia przed stosunkiem, by usunąć resztki
kremu. Choć nie odnotowano działań ubocznych, środki
miejscowe nie są wskazane, gdy u pacjenta lub jego partnerki
występuje alergia na którykolwiek składnik leku.
Eksperymentalnie zastosowano złożony lek w aerozolu
składający się z 7,5 mg lidokainy i 2,5 mg prylokainy
(TEMPE, ang. topical mixture for premature ejaculation)
5 min przed stosunkiem u 539 mężczyzn.
Zaobserwowano wzrost średniej geometrycznej IELT
z wartości wyjściowej 0,58 min do 3,17 min po 3 miesiącach
stosowania leku w badaniu podwójnie zaślepionym.
Stwierdzono 3,3 -krotne opóźnienie ejakulacji w stosunku
do grupy placebo (p < 0,001) (Wyllie i Powell, 2012). 3B.4.5. Tramadol
Tramadol to lek działający ośrodkowo poprzez aktywację
receptora oraz hamowanie wychwytu zwrotnego serotoniny
i noradrenaliny. Tramadol jest szybko wchłaniany
z przewodu pokarmowego i jego czas półtrwania wynosi
5–7 godz. Jako lek przeciwbólowy jest stosowany 3–4
razy dziennie w dawkach 50–100 mg. Działania niepożądane
były opisywane przy dawkach analgetycznych
(do 400 mg dziennie) w postaci zaparć, sedacji i suchości
w ustach. Tramadol jest słabym agonistą receptora opioidowego,
jak również wykazuje właściwości antagonistyczne
w przekaźnictwie noradrenaliny i 5 -HT (Frink
i wsp., 1996). Mechanizm działania tramadolu różni się
od działania innych opioidów, np. morfi ny. Jednak w maju
2009 r. Amerykańska Agencja ds. Leków i Żywności (FDA,
ang. Food and Drug Administration) ogłosiła ostrzeżenie
dotyczące potencjalnego uzależnienia od leku oraz
występowania trudności w oddychaniu (FDA, 2009).
W ciągu 12 tygodni przeprowadzono duże, wieloośrodkowe,
randomizowane, podwójnie zaślepione badanie,
z grupą placebo, aby określić, która z dwóch dawek (62
i 89 mg) tramadolu podawana w postaci tabletki rozpuszczalnej
w jamie ustnej jest bardziej skuteczna i bezpieczna
w leczeniu PE (Bar -Or i wsp., 2012). Uprzednio
przeprowadzone badanie oceniające biodostępność leków
wykazało, że tramadol ODT i tramadol HCl są równoważne.
U chorych z wrodzoną postacią PE i IELT <2 min
stwierdzono wydłużenie IELT o 0,6 min (1,6×) w grupie
z placebo, o 1,2 min (2,4×) w grupie przyjmującej 62 mg
tramadolu ODT i o 1,5 min (2,5×) w grupie przyjmującej
89 mg tramadolu ODT. Należy zwrócić uwagę, że nie
wykazano zależności odpowiedzi od dawki tramadolu.
Tolerancja leczenia przez okres 12 tygodni badania była
zadowalająca. Podsumowując, tramadol wykazał umiarkowany
efekt działania ze skutecznością porównywalną
do dapoksetyny. Biorąc pod uwagę wiedzę na temat neurofarmakologii
ejakulacji i mechanizmu działania tramadolu,
efekt opóźnienia ejakulacji można wytłumaczyć
poprzez podwójne działanie na ośrodkowy układ nerwowy
(OUN, ang. central nervous system) poprzez stymulację
receptora opioidowego μ i zwiększoną dostępność 5 -HT
w OUN. Jednak skuteczność i tolerancję tramadolu należy
potwierdzić w większych, długoterminowych badaniach.
3B.4.6. Inne leki
3B.4.6.1. Inhibitory fosfodiesterazy 5
Przeprowadzono tylko jedno dobrze zaprojektowane,
randomizowane, podwójnie zaślepione badanie z grupą
kontrolną porównujące sildenafi l do placebo (McMahon
i wsp., 2005). Pomimo iż uzyskano jedynie nieznacznie
wydłużenie IELT, sildenafi l zwiększał pewność siebie
oraz uczucie kontroli nad ejakulacją i ogólną satysfakcję
seksualną, redukował lęki i skracał czas refrakcji do odzyskania
ponownej erekcji po ejakulacji.
Kilka niezaślepionych badań potwierdza, że połączenie
sildenafi lu z SSRI jest skuteczniejsze niż SSRI
w monoterapii:
sildenafi l w połączeniu z paroksetyną znacznie
wydłuża IELT i poprawia satysfakcję w porównaniu
z paroksetyna w monoterapii (Salonia i wsp., 2002),
sildenafi l w połączeniu z sertraliną znacznie wydłuża
IELT i poprawia satysfakcję w porównaniu z sertraliną
w monoterapii (Zhang i wsp., 2005),
sildenafi l w połączeniu z paroksetyną oraz terapią
psychologiczną i behawioralną znacznie wydłuża IELT
i poprawia satysfakcję u chorych, u których zawiodło
inne leczenie (Chen i wsp., 2003),
sildenafi l w połączeniu z terapią behawioralną znacznie
wydłuża IELT i poprawia satysfakcję w porównaniu
z monoterapią behawioralną (Tang i wsp., 2004).
Istnieją jedynie ograniczone dane na temat skuteczności
innych PDE5i – tadalafi lu i wardenafi lu (McMahon
i wsp., 2006; Wang i wsp., 2006). Nie ustalono roli, jaką
odgrywają PDE5i u pacjentów z PE bez ED, gdyż dostępne
są tylko nieliczne dane z podwójnie zaślepionych badań,
kontrolowanych, z grupą placebo.
3B.4.7. Rekomendacje dotyczące leczenia
przedwczesnego wytrysku
 ED – zaburzenia erekcji; GR – stopień rekomendacji; LE – poziom
wiarygodności dowodu naukowego; PDE5 – fosfodiesteraza typu 5;
PE – przedwczesny wytrysk; SSRI – inhibitory zwrotnego wychwytu
serotoniny
ED – zaburzenia erekcji; GR – stopień rekomendacji; LE – poziom
wiarygodności dowodu naukowego; PDE5 – fosfodiesteraza typu 5;
PE – przedwczesny wytrysk; SSRI – inhibitory zwrotnego wychwytu
serotoniny
 Ryc. 4. Algorytm postępowania w PE. Adaptacja Lue i wsp. (2004)
ED – zaburzenia erekcji; IELT – wewnątrzpochwowy czas opóźnienia
ejakulacji; PE – przedwczesny wytrysk; SSRI – inhibitory
zwrotnego wychwytu serotoniny
Ryc. 4. Algorytm postępowania w PE. Adaptacja Lue i wsp. (2004)
ED – zaburzenia erekcji; IELT – wewnątrzpochwowy czas opóźnienia
ejakulacji; PE – przedwczesny wytrysk; SSRI – inhibitory
zwrotnego wychwytu serotoniny
4. DALSZE LECZENIE AMBULATORYJNE
Kontrola ambulatoryjna jest wskazana celem oceny skuteczności
leczenia oraz wystąpienia działań niepożądanych,
jak również satysfakcji pacjenta i jego partnerki,
o czym wspomniano w poprzednim rozdziale.
5. KONFLIKT INTERESÓW
Wszyscy członkowie panelu naukowego Europejskiego
Towarzystwa Urologicznego (EAU) dotyczącego zaburzeń
seksualnych u mężczyzn przedstawili oświadczenia
dotyczące powiązań, które mogłyby być
postrzegane jako potencjalne źródło konfl iktu interesów.
Informacje te są przechowywane w bazie
danych Centralnego Biura EAU. Niniejszy dokument
został opracowany przy wsparciu fi nansowym EAU.
Zewnętrzne źródła fi nansowania i wsparcia nie były
zaangażowane. Europejskie Towarzystwo Urologiczne
jest organizacją non -profi t, a fundusze są ograniczone
do pomocy administracyjnej oraz kosztów podróży
i spotkań. Nie wypłacono honorariów ani innych
rodzajów zwrotu kosztów.
6. PIŚMIENNICTWO
Abdel -Hamid I.A., El Naggar E.A., El Gilany A.H.: Assessment of as needed
use of pharmacotherapy and the pause -squeeze technique in premature
ejaculation. Int J Impot Res. 2001, 13 (1), 41–45.
Althof S.E.: Prevalence, characteristics and implications of premature ejaculation/
rapid ejaculation. J Urol. 2006, 175 (3 Pt 1), 842–848.
Althof S.E., Abdo C.H., Dean J., Hackett G., McCabe M., McMahon C.G. i wsp.:
International Society for Sexual Medicine’s guidelines for the diagnosis
and treatment of premature ejaculation. J Sex Med. 2010, 7 (9), 2947–2969.
Althof S.E., McMahon C.G., Waldinger M.D., Serefoglu E.C., Shindel A.W., Adaikan
P.G. i wsp.: An update of the International Society of Sexual Medicine’s
guidelines for the diagnosis and treatment of premature ejaculation (PE).
J Sex Med. 2014, 11 (6), 1392–1422.
Althof S.E., Rosen R.C., Perelman M.A., Rubio -Aurioles E.: Standard operating
procedures for taking a sexual history. J Sex Med. 2013, 10 (1), 26–35.
Althof S.E., Symonds T.: Patient reported outcomes used in the assessment of
premature ejaculation. Urol Clin North Am. 2007, 34 (4), 581–589.
Arafa M., Shamloul R.: Development and evaluation of the Arabic Index of
Premature Ejaculation (AIPE). J Sex Med. 2007, 4 (6), 1750–1756.
Atikeler M.K., Gecit I., Senol FA.: Optimum usage of prilocaine -lidocaine
cream in premature ejaculation. Andrologia. 2002, 34 (6), 356–359.
Baillargeon J., Urban R.J., Kuo Y.F., Ottenbacher K.J., Raji M.A., Du F. i wsp.:
Risk of myocardial infarction in older men receiving testosterone therapy.
Ann Pharmacother. 2014, 48 (9), 1138–1144.
Bar -Or D., Salottolo K.M., Orlando A., Winkler J.V.: A randomized double -blind,
placebo -controlled multicenter study to evaluate the effi cacy and safety of two
doses of the tramadol orally disintegrating tablet for the treatment of premature
ejaculation within less than 2 minutes. Eur Urol. 2012, 61 (4), 736–743.
Basaria S., Coviello A.D., Travison T.G., Storer T.W., Farwell W.R., Jette A.M. i wsp.:
Adverse events associated with testosterone administration. N Engl
J Med. 2010, 363 (2), 109–122.
Bechara A., Casabé A., Chéliz G., Romano S., Rey H., Fredotovich N.: Comparative
study of papaverine plus phentolamine versus prostaglandin E1 in erectile
dysfunction. J Urol. 1997, 157 (6), 2132–2134.
Behr -Roussel D., Gorny D., Mevel K., Caisey S., Bernabé J., Burgess G. i wsp.:
Chronic sildenafi l improves erectile function and endothelium -dependent cavernosal
relaxations in rats: lack of tachyphylaxis. Eur Urol. 2005, 47 (1), 87–91.
Bettocchi C., Palumbo F., Spilotros M., Lucarelli G., Palazzo S., Battaglia M. i wsp.:
Patient and partner satisfaction after AMS infl atable penile prosthesis
implant. J Sex Med. 2010, 7 (1 Pt 1), 304–309.
Bhasin S., Cunningham G.R., Hayes F.J., Matsumoto A.M., Snyder P.J.,
Swerdloff R.S. i wsp.: Testosterone therapy in men with androgen defi -
ciency syndromes: an Endocrine Society clinical practice guideline. J Clin
Endocrinol Metab. 2010, 95 (6), 2536–2559.
Borgdorff A.J., Bernabé J., Denys P., Alexandre L., Giuliano F.: Ejaculation elicited
by microstimulation of lumbar spinothalamic neurons. Eur Urol. 2008,
54 (2), 449–456.
Braun M., Wassmer G., Klotz T., Reifenrath B., Mathers M., Engelmann U.:
Epidemiology of erectile dysfunction: results of the ‘Cologne Male Survey’.
Int J Impot Res. 2000, 12 (6), 305–311.
Brock G., Nehra A., Lipshultz L.I., Karlin G.S., Gleave M., Seger M. i wsp.: Safety
and effi cacy of vardenafi l for the treatment of men with erectile dysfunction
after radical retropubic prostatectomy. J Urol. 2003, 170 (4 Pt 1), 1278–1283.
Busato W., Galindo C.C.: Topical anaesthetic use for treating premature ejaculation:
a double -blind, randomized, placebocontrolled study. BJU Int. 2004,
93 (7), 1018–1021.
Buvat J., Costa P., Morlier D., Lecocq B., Stegmann B., Albrecht D.: Double-
-blind multicenter study comparing alprostadil alpha -cyclodextrin with
moxisylyte chlorhydrate in patients with chronic erectile dysfunction. J
Urol. 1998, 159 (1), 116–119.
Buvat J., Hatzichristou D., Boess F.G., Büttner H., Gehchan N., Henneges C. i wsp.:
Continuation and eff ectiveness of tadalafi l once daily during a 6 -month
observational study in erectile dysfunction: the EDATE study. Int J Clin
Pract. 2014, 68 (9), 1087–1099.
Buvat J., Maggi M., Gooren L., Guay A.T., Kaufman J., Morgentaler A. i wsp.:
Endocrine aspects of male sexual dysfunctions. J Sex Med. 2010, 7 (4 Pt
2), 1627–1656.
Byers E.S., Grenier G.: Premature or rapid ejaculation: heterosexual couples’
perceptions of men’s ejaculatory behavior. Arch Sex Behav. 2003, 32
(3), 261–270.
Calof O.M., Singh A.B., Lee M.L., Kenny A.M., Urban R.J., Tenover J.L. i wsp.:
Adverse events associated with testosterone replacement in middle -aged
and older men: a meta -analysis of randomized, placebo -controlled trials.
J Gerontol A Biol Sci Med Sci. 2005, 60 (11), 1451–1457.
Capogrosso P., Colicchia M., Ventimiglia E., Castagna G., Clementi M.C., Suardi N.
i wsp.: One patient out of four with newly diagnosed erectile dysfunction is
a young man worrisome picture from the everyday clinical practice. J Sex
Med. 2013, 10 (7), 1833–1841.
Carson C.C., Cleves M.A., Delk J.R.: Long -term infection outcomes after original
antibiotic impregnated infl atable penile prosthesis implants: up to 7.7
years of followup. J Urol. 2011, 185 (2), 614–618.
Carson C.C., Gunn K.: Premature ejaculation: defi nition and prevalence. Int
J Impot Res. 2006, 18 (Suppl 1), 5–13.
Carson C.C., Mulcahy J.J., Govier F.E.: Effi cacy, safety and patient satisfaction
outcomes of the AMS 700CX infl atable penile prosthesis: results of
a long -term multicenter study. AMS 700CX Study Group. J Urol. 2000,
164 (2), 376–380.
Chen J., Mabjeesh N.J., Matzkin H., Greenstein A.: Effi cacy of sildenafi l as
adjuvant therapy to selective serotonin reuptake inhibitor in alleviating
premature ejaculation. Urology. 2003, 61 (1), 197–200.
Chung E., Broc G.B.: A state of art review on vardenafi l in men with erectile
dysfunction and associated underlying diseases. Expert Opin Pharmacother.
2011, 12 (8), 1341–1348.
Chung E., Van C.T., Wilson I., Cartmill R.A.: Penile prosthesis implantation for
the treatment for male erectile dysfunction: clinical outcomes and lessons
learnt after 955 procedures. World J Urol. 2013, 31 (3), 591–595.
Cookson M.S., Nadig P.W.: Long -term results with vacuum constriction device.
J Urol. 1993, 149 (2), 290–294.
Coombs P.G., Heck M., Guhring P., Narus J., Mulhall J.P.: A review of outcomes
of an intracavernosal injection therapy programme. BJU Int. 2012,
110 (11), 1787–1791.
Cordeiro E.R., Cathelineau X., Th üroff S., Marberger M., Crouzet S., de la Rosette
J.J.: High -intensity focused ultrasound (HIFU) for defi nitive treatment of
prostate cancer. BJU Int. 2012, 110 (9), 1228–1242.
Corona G., Maseroli E., Rastrelli G., Isidori A.M., Sforza A., Mannucci E. i wsp.:
Cardiovascular risk associated with testosterone -boosting medications:
a systematic review and meta -analysis. Expert Opin Drug Saf. 2014, 13
(10), 1327–1351.
Costa P., Potempa A.J.: Intraurethral alprostadil for erectile dysfunction:
a review of the literature. Drugs. 2012, 72 (17), 2243–2254.
Cui H., Liu B., Song Z., Fang J., Deng Y., Zhang S. i wsp.: Effi cacy and safety
of long -term tadalafi l 5 mg once daily combined with sildenafi l 50 mg as
needed at the early stage of treatment for patients with erectile dysfunction.
Andrologia. 2015, 47 (1), 20–24.
Curran M., Keating G.: Tadalafi l. Drugs. 2003, 63 (20), 2203–2212.
Darouiche R.O., Bella A.J., Boone T.B., Brock G., Broderick G.A., Burnett A.L.
i wsp.: North American consensus document on infection of penile prostheses.
Urology. 2013, 82 (4), 937–942.
Davis -Joseph B., Tiefer L., Melman A.: Accuracy of the initial history and physical
examination to establish the etiology of erectile dysfunction. Urology.
1995, 45 (3), 498–502.
de Amicis L.A., Goldberg D.C., LoPiccolo J., Friedman J., Davies L.: Clinical
follow -up of couples treated for sexual dysfunction. Arch Sex Behav. 1985,
14 (6), 467–489.
de Carufel F., Trudel G.: Eff ects of a new functional -sexological treatment for
premature ejaculation. J Sex Marital Th er. 2006, 32 (2), 97–114.
Debruyne F.M., Gittelman M., Sperling H., Börner M., Beneke M.: Time to onset
of action of vardenafi l: a retrospective analysis of the pivotal trials for the
orodispersible and fi lm -coated tablet formulations. J Sex Med. 2011, 8
(10), 2912–2923.
DeBusk R., Drory Y., Goldstein I., Jackson G., Kaul S., Kimmel S.E. i wsp.:
Management of sexual dysfunction in patients with cardiovascular disease:
recommendations of Th e Princeton Consensus Panel. Am J Cardiol.
2000, 86 (2), 175–181.
Dinsmore W.W., Wyllie M.G.: Vasoactive intestinal polypeptide/phentolamine
for intracavernosal injection in erectile dysfunction. BJU Int. 2008,
102 (8), 933–937.
Dong J.Y., Zhang Y.H., Qin L.Q.: Erectile dysfunction and risk of cardiovascular
disease: meta -analysis of prospective cohort studies. J Am Coll Cardiol.
2011, 58 (13), 1378–1385.
DSM IV, American Psychiatric Association. Diagnostic and Statistical Manual
of Mental Disorders. 4th edition. Text Revision. (Access date February 2014)
Revision. 2000, American Psychiatric Publishing Inc: Washington, DC.
DSM V, American Psychiatric Association. Diagnostic and Statistical Manual
of Mental Disorders, 5th edition. 2013, Arlington, VA (access date: February
2015 2013).
Dunn K.M., Croft P.R., Hackett G.I.: Association of sexual problems with social,
psychological, and physical problems in men and women: a cross sectional
population survey. J Epidemiol Community Health. 1999, 53 (3), 144–148.
Eardley I., Donatucci C., Corbin J., El -Meliegy A., Hatzimouratidis K., McVary K.
i wsp.: Pharmacotherapy for erectile dysfunction. J Sex Med. 2010, 7 (1 Pt 2),
524–540.
Eardley I., Montorsi F., Jackson G., Mirone V., Chan M.L., Loughney K. i wsp.:
Factors associated with preference for sildenafi l citrate and tadalafi l for
treating erectile dysfunction in men naive to phosphodiesterase 5 inhibitor
therapy: post hoc analysis of data from a multicentre, randomized, open-
-label, crossover study. BJU Int. 2007, 100 (1), 122–129.
El -Nashaar A., Shamloul R.: Antibiotic treatment can delay ejaculation in
patients with premature ejaculation and chronic bacterial prostatitis. J Sex
Med. 2007, 4 (2), 491–496.
Falcone M., Rolle L., Ceruti C., Timpano M., Sedigh O., Preto M. i wsp.: Prospective
analysis of the surgical outcomes and patients’ satisfaction rate after the
AMS Spectra penile prosthesis implantation. Urology. 2013, 82 (2), 373–376.
FDA. U.S. Food and Drug Administration (2009) Warning letter to William
Weldon, CEO & Chairman of Johnson & Johnson, regarding Ultram-
-ER web advertisement. Division of Drug Marketing, Advertising, and
Communications, U.S. Food and Drug Administration, Public Health Service,
Department of Health and Human Services, Silver Spring, MD.
Feldman H.A., Goldstein I., Hatzichristou D.G., Krane R.J., McKinlay J.B.:
Impotence and its medical and psychosocial correlates: results of the
Massachusetts Male Aging Study. J Urol. 1994, 151 (1), 54–61.
Fernandez -Balsells M.M., Murad M.H., Lane M., Lampropulos J.F., Albuquerque F.,
Mullan R.J. i wsp.: Clinical review 1: Adverse eff ects of testosterone therapy
in adult men: a systematic review and meta -analysis. J Clin Endocrinol
Metab. 2010, 95 (6), 2560–2675.
Ferrini M.G., Davila H.H., Kovanecz I., Sanchez S.P., Gonzalez -Cadavid N.F.,
Rajfer J.: Vardenafi l prevents fi brosis and loss of corporal smooth muscle
that occurs after bilateral cavernosal nerve resection in the rat. Urology.
2006, 68 (2), 429–435.
Ferrini M.G., Kovanecz I., Sanchez S., Vernet D., Davila H.H., Rajfer J. i wsp.:
Long -term continuous treatment with sildenafi l ameliorates aging -related
erectile dysfunction and the underlying corporal fi brosis in the rat. Biol
Reprod. 2007, 76 (5), 915–923.
Ficarra V., Novara G., Ahlering T.E., Costello A., Eastham J.A., Graefen M. i wsp.:
Systematic review and meta -analysis of studies reporting potency rates
after robot -assisted radical prostatectomy. Eur Urol. 2012, 62 (3), 418–430.
Fisher W.A., Eardley I., McCabe M., Sand M.: Erectile dysfunction (ED) is
a shared sexual concern of couples I: couple conceptions of ED. J Sex
Med. 2009, 6 (10), 2746–2760.
Forgue S.T., Patterson B.E., Bedding A.W., Payne C.D., Phillips D.L., Wrishko R.E.
i wsp.: Tadalafi l pharmacokinetics in healthy subjects. Br J Clin Pharmacol.
2006, 61 (3), 280–288.
Frink M.C., Hennies H.H., Englberger W., Haurand M., Wilff ert B.:
Infl uence of tramadol on neurotransmitter systems of the rat brain.
Arzneimittelforschung. 1996, 46 (11), 1029–1036.
Gandaglia G., Briganti A., Jackson G., Kloner R.A., Montorsi F., Montorsi P. i wsp.:
A systematic review of the association between erectile dysfunction and
cardiovascular disease. Eur Urol. 2014, 65 (5), 968–978.
Gazzaruso C., Coppola A., Montalcini T., Valenti C., Garzaniti A., Pelissero G. i wsp.:
Erectile dysfunction can improve the eff ectiveness of the current guidelines
for the screening for asymptomatic coronary artery disease in diabetes.
Endocrine. 2011, 40 (2), 273–279.
Ghanem H.M., Salonia A., Martin -Morales A.: SOP: physical examination
and laboratory testing for men with erectile dysfunction. J Sex Med. 2013,
10 (1), 108–110.
Giuliano F.: 5 -Hydroxytryptamine in premature ejaculation: opportunities
for therapeutic intervention. Trends Neurosci. 2007, 30 (2), 79–84.
Giuliano F., Clement P.: Pharmacology for the treatment of premature ejaculation.
Pharmacol Rev. 2012, 64 (3), 621–644.
Giuliano F., Jackson G., Montorsi F., Martin -Morales A., Raillard P. i wsp.: Safety
of sildenafi l citrate: review of 67 double -blind placebo -controlled trials and
the postmarketing safety database. Int J Clin Pract. 2010, 64 (2), 240–255.
Giuliano F., Patrick D.L., Porst H., La Pera G., Kokoszka A., Merchant S. i wsp.:
Premature ejaculation: results from a fi ve -country European observational
study. Eur Urol. 2008, 53 (5), 1048–1057.
Glina S., Ghanem H.: SOP: corpus cavernosum assessment (cavernosography/
cavernosometry). J Sex Med. 2013, 10 (1), 111–114.
Glina S., Sharlip I.D., Hellstrom W.J.: Modifying risk factors to prevent and
treat erectile dysfunction. J Sex Med. 2013, 10 (1), 115–119.
Goldstein I., Lue T.F., Padma -Nathan H., Rosen R.C., Steers W.D., Wicker P.A.:
Oral sildenafi l in the treatment of erectile dysfunction. 1998. J Urol. 2002,
167 (2 Pt 2), 1197–1203.
Goldstein I., McCullough A.R., Jones L.A., Hellstrom W.J., Bowden C.H.,
Didonato K. i wsp.: A randomized, double -blind, placebo -controlled evaluation
of the safety and effi cacy of avanafi lin subjects with erectile dysfunction.
J Sex Med. 2012, 9 (4), 1122–1133.
Gratzke C., Angulo J., Chitaley K., Dai Y.T., Kim N.N., Paick J.S. i wsp.: Anatomy,
physiology, and pathophysiology of erectile dysfunction. J Sex Med. 2010,
7 (1 Pt 2), 445–475.
Greco E.A., Spera G., Aversa A.: Combining testosterone and PDE5 inhibitors
in erectile dysfunction: basic rationale and clinical evidences. Eur Urol.
2006, 50 (5), 940–947.
Grenier G., Byers E.S.: Rapid ejaculation: a review of conceptual, etiological,
and treatment issues. Arch Sex Behav. 1995, 24 (4), 447–472.
Gruenwald I., Appel B., Kitrey N.D., Vardi Y.: Shockwave treatment of erectile
dysfunction. Th er Adv Urol. 2013, 5 (2), 95–99.
Gruenwald I., Appel B., Vardi Y.: Low -intensity extracorporeal shock wave
therapy – a novel eff ective treatment for erectile dysfunction in severe ED
patients who respond poorly to PDE5 inhibitor therapy. J Sex Med. 2012,
9 (1), 259–264.
Gruenwald I., Shenfeld O., Chen J., Raviv G., Richter S., Cohen A. i wsp.: Positive
eff ect of counseling and dose adjustment in patients with erectile dysfunction
who failed treatment with sildenafi l. Eur Urol. 2006, 50 (1), 134–140.
Gupta B.P., Murad M.H., Clifton M.M., Prokop L., Nehra A., Kopecky S.L.: Th e
eff ect of lifestyle modifi cation and cardiovascular risk factor reduction
on erectile dysfunction: a systematic review and meta -analysis. Arch Intern
Med. 2011, 171 (20), 1797–1803.
Gupta R., Kirschen J., Barrow R.C., Eid J.F.: Predictors of success and risk
factors for attrition in the use of intracavernous injection. J Urol. 1997,
157 (5), 1681–1686.
Haddad R.M., Kennedy C.C., Caples S.M., Tracz M.J., Boloña E.R., Sideras K.
i wsp.: Testosterone and cardiovascular risk in men: a systematic review
and meta -analysis of randomized placebo -controlled trials. Mayo Clin Proc.
2007, 82 (1), 29–39.
Hatzichristou D.G., Hatzimouratidis K., Apostolidis A., Ioannidis E.,
Yannakoyorgos K., Kalinderis A.: Hemodynamic characterization of a functional
erection. Arterial and corporeal venoocclusive function in patients
with a positive intracavernosal injection test. Eur Urol. 1999, 36 (1), 60–67.
Hatzichristou D.G., Hatzimouratidis K., Bekas M., Apostolidis A., Tzortzis V.,
Yannakoyorgos K.: Diagnostic steps in the evaluation of patients with erectile
dysfunction. J Urol. 2002, 168 (2), 615–620.
Hatzichristou D.G., Hatzimouratidis K., Ioannides E., Yannakoyorgos K.,
Dimitriadis G., Kalinderis A.: Nocturnal penile tumescence and rigidity
monitoring in young potent volunteers: reproducibility, evaluation criteria
and the eff ect of sexual intercourse. J Urol. 1998, 159 (6), 1921–1926.
Hatzichristou D.G., Moysidis K., Apostolidis A., Bekos A., Tzortzis V.,
Hatzimouratidis K. i wsp.: Sildenafi l failures may be due to inadequate patient
instructions and follow -up: a study on 100 non -responders. Eur Urol. 2005,
47 (4), 518–522.
Hatzichristou D.G., Rosen R.C., Derogatis L.R., Low W.Y., Meuleman E.J.,
Sadovsky R.: Recommendations for the clinical evaluation of men and women
with sexual dysfunction. J Sex Med. 2010, 7 (1 Pt 2), 337–348.
Hatzimouratidis K., Eardley I., Giuliano F., Moncada I., Salonia A.: EAU Guidelines
Panel on Male Sexual Dysfunction. EAU guidelines on Penile Curvature.
Edn. presented at the EAU Annual Congress Paris, 2012. Arnhem 2012a.
Hatzimouratidis K., Eardley I., Giuliano F., Hatzichristou D., Moncada I., Salonia A.
i wsp.: European Association of Urology. EAU guidelines on Penile curvature.
Eur Urol. 2012b, 62 (3), 543–552.
Hatzimouratidis K., Moysidis K., Apostolidis A., Bekos A., Tzortzis V.,
Hatzimouratidis K. i wsp.: Treatment strategy for “non -responders” to tadalafi
l and vardenafi l: a real -life study. Eur Urol. 2006, 50 (1), 126–132.
Hawton K., Catalan J., Martin P., Fagg J.: Long -term outcome of sex therapy.
Behav Res Th er. 1986, 24 (6), 665–675.
Heidenreich A., Bastian P.J., Bellmunt J., Bolla M., Joniau S., van der Kwast T.
i wsp.: EAU guidelines on prostate cancer. part 1: screening, diagnosis, and
local treatment with curative intent -update 2013. Eur Urol. 2014, 65 (1),
124–137.
Hellstrom W.J., Montague D.K., Moncada I., Carson C., Minhas S., Faria G. i wsp.:
Implants, mechanical devices, and vascular surgery for erectile dysfunction.
J Sex Med. 2010, 7 (1 Pt 2), 501–523.
Henry G.D., Brinkman M.J., Mead S.F., Delk J.R., Cleves M.A., Jennermann C.
i wsp.: A survey of patients with infl atable penile prostheses: assessment
of timing and frequency of intercourse and analysis of implant durability.
J Sex Med. 2012a, 9 (6), 1715–1721.
Henry G.D., Donatucci C.F., Conners W., Greenfi eld J.M., Carson C.C., Wilson S.K.
i wsp.: An outcomes analysis of over 200 revision surgeries for penile prosthesis
implantation: a multicenter study. J Sex Med. 2012b, 9 (1), 309–315.
Incrocci L., Jensen P.T.: Pelvic radiotherapy and sexual function in men and
women. J Sex Med. 2013, 10 (Suppl 1), 53–64.
Isgoren A.E., Satz T.R., Serefoglu E.C.: Erectile Function Outcomes after
Robot -Assisted Radical Prostatectomy: Is It Superior to Open Retropubic
or Laparoscopic Approach? Sex Med Rev. 2014, 2 (1), 10–23.
Isidori A.M., Buvat J., Corona G., Goldstein I., Jannini E.A., Lenzi A. i wsp.: A critical
analysis of the role of testosterone in erectile function: from pathophysiology
to treatment – a systematic review. Eur Urol. 2014, 65 (1), 99–112.
Jackson G., Montorsi P., Adams M.A., Anis T., El -Sakka A., Miner M. i wsp.:
Cardiovascular aspects of sexual medicine. J Sex Med. 2010, 7 (4 Pt 2), 1608–1626.
Johannes C.B., Araujo A.B., Feldman H.A., Derby C.A., Kleinman K.P., McKinlay J.B.:
Incidence of erectile dysfunction in men 40 to 69 years old: longitudinal results
from the Massachusetts male aging study. J Urol. 2000, 163 (2), 460–463.
Keating G.M., Scott L.J.: Vardenafi l: a review of its use in erectile dysfunction.
Drugs. 2003, 63 (23), 2673–2703
.
Kempeneers P., Andrianne R., Bauwens S., Georis I., Pairoux J.F., Blairy S.:
Functional and psychological characteristics of belgian men with premature
ejaculation and their partners. Arch Sex Behav. 2013, 42 (1), 51–66.
Khera M., Crawford D., Morales A., Salonia A., Morgentaler A.: A new era of
testosterone and prostate cancer: from physiology to clinical implications.
Eur Urol. 2014, 65 (1), 115–123.
Kim D.S., Yang K.M., Chung H.J., Choi H.M., Choi Y.D., Choi H.K.: AMS 700CX/
CXM infl atable penile prosthesis has high mechanical reliability at long-
-term follow up. J Sex Med. 2010, 7 (7), 2602–2607.
Kim S.W., Paick J.S.: Short -term analysis of the eff ects of as needed use of
sertraline at 5 PM for the treatment of premature ejaculation. Urology.
1999, 54 (3), 544–547.
Kloner R.A., Jackson G., Emmick J.T., Mitchell M.I., Bedding A., Warner M.R. i wsp.:
Interaction between the phosphodiesterase 5 inhibitor, tadalafi l and 2 alpha-
-blockers, doxazosin and tamsulosin in healthy normotensive men. J Urol.
2004, 172 (5 Pt 1), 1935–1940.
Kostis J.B., Jackson G., Rosen R., Barrett -Connor E., Billups K., Burnett A.L. i wsp.:
Sexual dysfunction and cardiac risk (the Second Princeton Consensus
Conference). Am J Cardiol. 2005, 96 (2), 313–321.
Kovanecz I., Rambhatla A., Ferrini M.G., Vernet D., Sanchez S., Rajfer J. i wsp.:
Chronic daily tadalafi l prevents the corporal fi brosis and veno -occlusive
dysfunction that occurs after cavernosal nerve resection. BJU Int. 2008,
101 (2), 203–210.
Kyle J.A., Brown D.A., Hill J.K.: Avanafi l for erectile dysfunction. Ann
Pharmacother. 2013, 47 (10), 1312–1320.
Lakin M.M., Montague D.K., VanderBrug Medendorp S., Tesar L., Schover L.R.:
Intracavernous injection therapy: analysis of results and complications.
J Urol. 1990, 143 (6), 1138–1141.
Laumann E.O., Nicolosi A., Glasser D.B., Paik A., Gingell C., Moreira E. i wsp.:
Sexual problems among women and men aged 40–80 y: prevalence and
correlates identifi ed in the Global Study of Sexual Attitudes and Behaviors.
Int J Impot Res. 2005, 17 (1), 39–57.
Laumann E.O., Paik A., Rosen R.C.: Sexual dysfunction in the United States:
prevalence and predictors. JAMA. 1999a, 281 (6), 537–544.
Laumann E.O., Paik A., Rosen R.C.: Th e epidemiology of erectile dysfunction:
results from the National Health and Social Life Survey. Int J Impot Res.
1999b, 11 (Suppl 1), S60–64.
Lee D., Romero C., Alba F., Westney O.L., Wang R.: Simultaneous penile prosthesis
and male sling/artifi cial urinary sphincter. Asian J Androl. 2013,
15 (1), 10–15.
Lee D., Westney OL, Wang R.: Combination surgery for erectile dysfunction
and male incontinence. Curr Urol Rep. 2011a, 12 (6), 461–469.
Lee J.C., Bénard F., Carrier S., Talwar V., Defoy I.: Do men with mild erectile
dysfunction have the same risk factors as the general erectile dysfunction
clinical trial population? BJU Int. 2011b, 107 (6), 956–960.
Levine L.A., Burnett A.L.: Standard operating procedures for Peyronie’s disease.
J Sex Med. 2013, 10 (1), 230–244.
Levine L.A., Dimitriou R.J.: Vacuum constriction and external erection devices
in erectile dysfunction. Urol Clin North Am. 2001, 28 (2), 335–341.
Lindau S.T., Schumm L.P., Laumann E.O., Levinson W., O’Muircheartaigh C.A.,
Waite L.J.: A study of sexuality and health among older adults in the United
States. N Engl J Med. 2007, 357 (8), 762–774.
Lue T.F., Giuliano F., Montorsi F., Rosen R.C., Andersson K.E., Althof S. i wsp.:
Summary of the recommendations on sexual dysfunctions in men. J Sex
Med. 2004, 1 (1), 6–23.
Lue T.F.: Erectile dysfunction. N Engl J Med. 2000, 342 (24), 1802–1813.
Lux M., Reyes -Vallejo L., Morgentaler A., Levine L.A.: Outcomes and satisfaction
rates for the redesigned 2 -piece penile prosthesis. J Urol. 2007, 177
(1), 262–266.
Maggi M., Buvat J., Corona G., Guay A., Torres L.O.: Hormonal causes of male
sexual dysfunctions and their management (hyperprolactinemia, thyroid
disorders, GH disorders, and DHEA). J Sex Med. 2013, 10 (3), 661–677.
Martinez -Salamanca J.I., Mueller A., Moncada I., Carballido J., Mulhall J.P.:
Penile prosthesis surgery in patients with corporal fi brosis: a state of the
art review. J Sex Med. 2011, 8 (7), 1880–1889.
McCullough A.R., Barada J.H., Fawzy A., Guay A.T., Hatzichristou D.: Achieving
treatment optimization with sildenafi l citrate (Viagra) in patients with
erectile dysfunction. Urology. 2002, 60 (2 Suppl 2), 28–38.
McMahon C.G.: Dapoxetine: a new option in the medical management of
premature ejaculation. Th er Adv Urol. 2012, 4 (5), 233–251.
McMahon C.G.: Ejaculatory latency vs. patient -reported outcomes (PROs)
as study end points in premature ejaculation clinical trials. Eur Urol. 2007,
52 (2), 321–323.
McMahon C.G., Abdo C., Incrocci L., Perelman M., Rowland D., Waldinger M. i wsp.:
Disorders of orgasm and ejaculation in men. J Sex Med. 2004, 1 (1), 58–65.
McMahon C.G., Althof S.E., Kaufman J.M., Buvat J., Levine S.B., Aquilina J.W.
i wsp.: Effi cacy and safety of dapoxetine for the treatment of premature
ejaculation: integrated analysis of results from fi ve phase 3 trials. J Sex
Med. 2011, 8 (2), 524–539.
McMahon C.G., Giuliano F., Dean J., Hellstrom W.J., Bull S., Tesfaye F. i wsp.:
Effi cacy and safety of dapoxetine in men with premature ejaculation and
concomitant erectile dysfunction treated with a phosphodiesterase type 5
inhibitor: randomized, placebo -controlled, phase III study. J Sex Med. 2013,
10 (9), 2312–2325.
McMahon C.G., Lee G., Park J.K., Adaikan P.G.: Premature ejaculation and
erectile dysfunction prevalence and attitudes in the Asia -Pacifi c region.
J Sex Med. 2012, 9 (2), 454–465.
McMahon C.G., McMahon C.N., Leow L.J., Winestock C.G.: Effi cacy of type -5
phosphodiesterase inhibitors in the drug treatment of premature ejaculation:
a systematic review. BJU Int. 2006, 98 (2), 259–272.
McMahon C.G., Porst H.: Oral agents for the treatment of premature ejaculation:
review of effi cacy and safety in the context of the recent International
Society for Sexual Medicine criteria for lifelong premature ejaculation. J Sex
Med. 2011, 8 (10), 2707–2725.
McMahon C.G., Samali R, Johnson H.: Treatment of intracorporeal injection
nonresponse with sildenafi l alone or in combination with triple agent intracorporeal
injection therapy. J Urol. 1999, 162 (6), 1992–1997.
McMahon C.G., Stuckey B.G., Andersen M., Purvis K., Koppiker N., Haughie S.
i wsp.: Effi cacy of sildenafi l citrate (Viagra) in men with premature ejaculation.
J Sex Med. 2005, 2 (3), 368–375.
McMahon C.G., Touma K.: Treatment of premature ejaculation with paroxetine
hydrochloride as needed: 2 single -blind placebo controlled crossover
studies. J Urol. 1999, 161 (6), 1826–1830.
Metz M.E., Pryor J.L.: Premature ejaculation: a psychophysiological review.
J Sex Marital Th er. 1997, 23 (1), 3–23.
Miner M., Esposito K., Guay A., Montorsi P., Goldstein I.: Cardiometabolic risk
and female sexual health: the Princeton III summary. J Sex Med. 2012, 9
(3), 641–651.
Mirone V., Arcaniolo D., Rivas D., Bull S., Aquilina J.W., Verze P.: Results from a prospective
observational study of men with premature ejaculation treated with
dapoxetine or alternative care: the PAUSE study. Eur Urol. 2014, 65 (4), 733–739.
Modi N.B., Dresser M.J., Simon M., Lin D., Desai D., Gupta S.: Single - and
multiple -dose pharmacokinetics of dapoxetine hydrochloride, a novel agent
for the treatment of premature ejaculation. J Clin Pharmacol. 2006, 46
(3), 301–309.
Moncada I., de Bethencourt F.R., Lledó -García E., Romero -Otero J., Turbi C.,
Büttner H. i wsp.: Eff ects of tadalafi l once daily or on demand versus placebo
on time to recovery of erectile function in patients after bilateral nerve-
-sparing radical prostatectomy. World J Urol. 2015, 33 (7), 1031–1038.
Moncada I., Jara J., Subirá D., Castaño I., Hernández C.: Effi cacy of sildenafi l
citrate at 12 hours after dosing: re -exploring the therapeutic window. Eur
Urol. 2004, 46 (3), 357–360.
Montague D.K.: Penile prosthesis implantation in the era of medical treatment
for erectile dysfunction. Urol Clin North Am. 2011, 38 (2), 217–225.
Montague D.K., Angermeier K.W., Lakin M.M.: Penile prosthesis implantation.
Urol Clin North Am. 2001, 28 (2), 355–361.
Montorsi F., Adaikan G., Becher E., Giuliano F., Khoury S., Lue T.F. i wsp.:
Summary of the recommendations on sexual dysfunctions in men. J Sex
Med. 2010, 7 (11), 3572–3588.
Montorsi F., Brock G., Lee J., Shapiro J., Van Poppel H., Graefen M. i wsp.: Eff ect
of nightly versus on -demand vardenafi l on recovery of erectile function
in men following bilateral nerve -sparing radical prostatectomy. Eur Urol.
2008, 54 (4), 924–931.
Montorsi F., Brock G., Stolzenburg J.U., Mulhall J., Moncada I., Patel H.R. i wsp.:
Eff ects of tadalafi l treatment on erectile function recovery following bilateral
nerve -sparing radical prostatectomy: a randomised placebo -controlled
study (REACTT). Eur Urol. 2014, 65 (3), 587–596.
Montorsi F., Guazzoni G., Strambi L.F., Da Pozzo L.F., Nava L., Barbieri L. i wsp.:
Recovery of spontaneous erectile function after nerve -sparing radical retropubic
prostatectomy with and without early intracavernous injections of
alprostadil: results of a prospective, randomized trial. J Urol. 1997, 158
(4), 1408–1410.
Montorsi F., McCullough A.: Effi cacy of sildenafi l citrate in men with erectile
dysfunction following radical prostatectomy: a systematic review of clinical
data. J Sex Med. 2005, 2 (5), 658–667.
Montorsi F., Nathan H.P., McCullough A., Brock G.B., Broderick G., Ahuja S. i wsp.:
Tadalafi l in the treatment of erectile dysfunction following bilateral nerve
sparing radical retropubic prostatectomy: a randomized, double -blind, placebo
controlled trial. J Urol. 2004a, 172 (3), 1036–1041.
Montorsi F., Padma -Nathan H., Buvat J., Schwaibold H., Beneke M., Ulbrich E
i wsp.: Earliest time to onset of action leading to successful intercourse with
vardenafi l determined in an at -home setting: a randomized, double -blind,
placebo -controlled trial. J Sex Med. 2004b, 1 (2), 168–178.
Morales A., Barada J., Wyllie M.G.: A review of the current status of topical
treatments for premature ejaculation. BJU Int. 2007, 100 (3), 493–501.
Moriel E.Z., Rajfer J.: Sodium bicarbonate alleviates penile pain induced
by intracavernous injections for erectile dysfunction. J Urol. 1993, 149
(5 Pt 2), 1299–1300.
Moyad M.A., Barada J.H., Lue T.F., Mulhall J.P., Goldstein I., Fawzy A.:
Prevention and treatment of erectile dysfunction using lifestyle changes
and dietary supplements: what works and what is worthless, part I. Urol
Clin North Am. 2004, 31 (2), 249–257.
Mulcahy J.J., Austoni E., Barada J.H., Choi H.K., Hellstrom W.J., Krishnamurti S.
i wsp.: Th e penile implant for erectile dysfunction. J Sex Med. 2004, 1 (1),
98–109.
Mulcahy J.J.: Long -term experience with salvage of infected penile implants.
J Urol. 2000, 163 (2), 481–482.
Mulhall J.P., Burnett A.L., Wang R., McVary K.T., Moul J.W., Bowden C.H. i wsp.:
A phase 3, placebo controlled study of the safety and effi cacy of avanafi l
for the treatment of erectile dysfunction after nerve sparing radical prostatectomy.
J Urol. 2013, 189 (6), 2229–2236.
Mulhall J.P., Daller M., Traish A.M., Gupta S., Park K., Salimpour P. i wsp.:
Intracavernosal forskolin: role in management of vasculogenic impotence
resistant to standard 3 -agent pharmacotherapy. J Urol. 1997, 158
(5), 1752–1758.
Mulhall J.P., Goldstein I., Bushmakin A.G., Cappelleri J.C., Hvidsten K.: Validation
of the erection hardness score. J Sex Med. 2007, 4 (6), 1626–1634.
Mulhall J.P., Jahoda A.E., Ahmed A., Parker M.: Analysis of the consistency
of intraurethral prostaglandin E(1) (MUSE) during at -home use. Urology.
2001, 58 (2), 262–266.
Natali A., Olianas R, Fisch M.: Penile implantation in Europe: successes and
complications with 253 implants in Italy and Germany. J Sex Med. 2008,
5 (6), 1503–1512.
Nehra A., Grantmyre J., Nadel A., Th ibonnier M., Brock G.: Vardenafi l improved
patient satisfaction with erectile hardness, orgasmic function and sexual
experience in men with erectile dysfunction following nerve sparing radical
prostatectomy. J Urol. 2005, 173 (6), 2067–2071.
Nehra A., Jackson G., Miner M., Billups K.L., Burnett A.L., Buvat J. i wsp.: Th e
Princeton III Consensus recommendations for the management of erectile
dysfunction and cardiovascular disease. Mayo Clin Proc. 2012, 87 (8),
766–778.
Nichols D.J., Mirhead G.J., Harness J.A.: Pharmacokinetics of sildenafi l after
single oral doses in healthy male subjects: absolute bioavailability, food eff ects
and dose proportionality. Br J Clin Pharmacol. 2002, 53 (Suppl 1), 5–12.
NIH Consensus Conference. Impotence. NIH Consensus Development Panel
on Impotence. JAMA. 1993, 270 (1), 83–90.
O’Connor D.B., Lee D.M., Corona G., Forti G., Tajar A., O’Neill T.W. i wsp.: Th e
relationships between sex hormones and sexual function in middle -aged and
older European men. J Clin Endocrinol Metab. 2011, 96 (10), E1577–1587.
Oelke M., Bachmann A., Descazeaud A., Emberton M., Gravas S., Michel M.C.
i wsp.: EAU guidelines on the treatment and follow -up of non -neurogenic
male lower urinary tract symptoms including benign prostatic obstruction.
Eur Urol. 2013, 64 (1), 118–140.
Olivier B., van Oorschot R., Waldinger M.D.: Serotonin, serotonergic receptors,
selective serotonin reuptake inhibitors and sexual behaviour. Int Clin
Psychopharmacol. 1998, 13 (Suppl 6), S9–14.
Padma -Nathan H., Hellstrom WJ., Kaiser FE., Labasky RF., Lue TF., Nolten
WE.: Treatment of men with erectile dysfunction with transurethral alprostadil.
Medicated Urethral System for Erection (MUSE) Study Group. N Engl
J Med. 1997, 336 (1), 1–7.
Padma -Nathan H., McCullough A.R., Levine L.A., Lipshultz L.I., Siegel R.,
Montorsi F.: Randomized, double -blind, placebo -controlled study of post-
-operative nightly sildenafi l citrate for the prevention of erectile dysfunction
after bilateral nerve -sparing radical prostatectomy. Int J Impot Res.
2008, 20 (5), 479–486.
Padma -Nathan H., Stecher V.J., Sweeney M., Orazem J., Tseng L.J., Deriesthal H.:
Minimal time to successful intercourse after sildenafi l citrate: results of
a randomized, double -blind, placebo -controlled trial. Urology. 2003, 62
(3), 400–403.
Padma -Nathan H., Yeager J.L.: An integrated analysis of alprostadil topical
cream for the treatment of erectile dysfunction in 1732 patients. Urology.
2006, 68 (2), 386–391.
Palmieri A., Imbimbo C, Longo N, Fusco F, Verze P, Maletta A, i wsp.: Ejaculatory
abstinence infl uences intravaginal ejaculatory latency time: results from
a prospective randomized trial. Urol Int. 2012, 88 (4), 459–462.
Patrick D.L., Althof S.E., Pryor J.L., Rosen R., Rowland D.L., Ho K.F. i wsp.:
Premature ejaculation: an observational study of men and their partners.
J Sex Med. 2005, 2 (3), 358–367.
Patrick D.L., Rowland D.L., Rothman M.: Interrelationships among measures
of premature ejaculation: the central role of perceived control. J Sex
Med. 2007, 4 (3), 780–788.
Porst H., Burnett A., Brock G., Ghanem H., Giuliano F., Glina S. i wsp.: SOP
conservative (medical and mechanical) treatment of erectile dysfunction.
J Sex Med. 2013, 10 (1), 130–171.
Porst H., Gacci M., Büttner H., Henneges C., Boess F.: Tadalafi l once daily in
men with erectile dysfunction: an integrated analysis of data obtained from
1913 patients from six randomized, double -blind, placebo -controlled, clinical
studies. Eur Urol. 2014, 65 (2), 455–464.
Porst H., McMahon C.G., Althof S.E., Sharlip I., Bull S., Aquilina J.W. i wsp.:
Baseline characteristics and treatment outcomes for men with acquired or
lifelong prematureejaculation with mild or no erectile dysfunction: integrated
analyses of two phase 3 dapoxetine trials. J Sex Med. 2010, 7 (6),
2231–2242.
Porst H., Montorsi F., Rosen R.C., Gaynor L., Grupe S., Alexander J.: Th e
Premature Ejaculation Prevalence and Attitudes (PEPA) survey: prevalence,
comorbidities, and professional help -seeking. Eur Urol. 2007, 51 (3), 816–823.
Raina R., Agarwal A., Ausmundson S., Lakin M., Nandipati K.C., Montague D.K.
i wsp.: Early use of vacuum constriction device following radical prostatectomy
facilitates early sexual activity and potentially earlier return of erectile
function. Int J Impot Res. 2006, 18 (1), 77–81.
Raina R., Pahlajani G., Agarwal A., Zippe C.D.: Th e early use of transurethral
alprostadil after radical prostatectomy potentially facilitates an earlier
return of erectile function and successful sexual activity. BJU Int. 2007,
100 (6), 1317–1321.
Rajagopalan P., Mazzu A., Xia C., Dawkins R., Sundaresan P.: Eff ect of high -fat
breakfast and moderate -fat evening meal on the pharmacokinetics of vardenafi
l, an oral phosphodiesterase -5 inhibitor for the treatment of erectile
dysfunction. J Clin Pharmacol. 2003, 43 (3), 260–267.
Richardson D., Goldmeier D.: Premature ejaculation – does country of origin
tell us anything about etiology? J Sex Med. 2005, 2 (4), 508–512.
Riley A., Segraves R.T.: Treatment of premature ejaculation. Int J Clin Pract.
2006, 60 (6), 694–697.
Rosen R., Altwein J., Boyle P., Kirby R.S., Lukacs B., Meuleman E. i wsp.: Lower
urinary tract symptoms and male sexual dysfunction: the multinational
survey of the aging male (MSAM -7). Eur Urol. 2003, 44 (6), 637–649.
Rosen R.C., Catania J.A., Althof S.E., Pollack L.M., O’Leary
M., Seftel A.D. i wsp.: Development and validation of four-
-item version of Male Sexual Health Questionnaire to assess
ejaculatory dysfunction. Urology. 2007a, 69 (5), 805–809.
Rosen R.C., McMahon C.G., Niederberger C., Broderick G.A., Jamieson C.,
Gagnon D.D.: Correlates to the clinical diagnosis of premature ejaculation:
results from a large observational study of men and their partners. J Urol.
2007b, 177 (3), 1059–1064.
Rosen R.C., Padma -Nathan H., Shabsigh R., Saikali K., Watkins V., Pullman W.:
Determining the earliest time within 30 minutes to erectogenic eff ect after
tadalafi l 10 and 20 mg: a multicenter, randomized, double -blind, placebo-
-controlled, at -home study. J Sex Med. 2004, 1 (2), 193–200.
Rosen R.C., Riley A., Wagner G., Osterloh I.H., Kirkpatrick J., Mishra A.: Th e
international index of erectile function (IIEF): a multidimensional scale
for assessment of erectile dysfunction. Urology. 1997, 49 (6), 822–830.
Rosen R.C.: Psychogenic erectile dysfunction. Classifi cation and management.
Urol Clin North Am. 2001, 28 (2), 269–278.
Rosenberg M.T., Sadovsky R.: Identifi cation and diagnosis of premature ejaculation.
Int J Clin Pract. 2007, 61 (6), 903–908.
Rowland D., Perelman M., Althof S., Barada J., McCullough A., Bull S. i wsp.:
Self -reported premature ejaculation and aspects of sexual functioning and
satisfaction. J Sex Med. 2004, 1 (2), 225–232.
Rowland D.L., Patrick D.L., Rothman M., Gagnon D.D.: Th e psychological burden
of premature ejaculation. J Urol. 2007, 177 (3), 1065–1070.
Rowland D.L., Slob A.K.: Premature ejaculation: psychophysiological considerations
in theory, research, and treatment. Annu Rev Sex Res. 1997, 8, 224–253.
Sachs B.D., Liu Y.C.: Maintenance of erection of penile glans, but not
penile body, after transection of rat cavernous nerves. J Urol. 1991, 146
(3), 900–905.
Salonia A., Eardley I., Giuliano F., Hatzichristou D., Mondaca I., Vardi Y. i wsp.: EAU
Guidelines Panel on Male Sexual Dysfunction. EAU Guidelines on Priapism.
Edn. presented at the EAU Annual Congress Stockholm. Arnhem 2014a.
Salonia A., Burnett A.L., Graefen M., Hatzimouratidis K., Montorsi F., Mulhall J.P.
i wsp.: Prevention and management of postprostatectomy sexual dysfunctions.
Part 1: choosing the right patient at the right time for the right surgery.
Eur Urol. 2012a, 62 (2), 261–272.
Salonia A., Burnett A.L., Graefen M., Hatzimouratidis K., Montorsi F., Mulhall J.P.
i wsp.: Prevention and management of postprostatectomy sexual dysfunctions
part 2: recovery and preservation of erectile function, sexual desire,
and orgasmic function. Eur Urol. 2012b, 62 (2), 273–286.
Salonia A., Castagna G., Saccà A., Ferrari M., Capitanio U., Castiglione F. et al.: Is
erectile dysfunction a reliable proxy of general male health status? Th e case
for the International Index of Erectile Function -Erectile Function domain.
J Sex Med. 2012c, 9 (10), 2708–2715.
Salonia A., Eardley I., Giuliano F., Hatzichristou D., Moncada I., Vardi Y. i wsp.:
European association of urology guidelines on priapism. Eur Urol. 2014b,
65 (2), 480–489.
Salonia A., Maga T., Colombo R., Scattoni V., Briganti A., Cestari A. i wsp.: A prospective
study comparing paroxetine alone versus paroxetine plus sildenafi l
in patients with premature ejaculation. J Urol. 2002, 168 (6), 2486–2489.
Sanda M.G., Dunn R.L., Michalski J., Sandler H.M., Northouse L., Hembroff L.
i wsp.: Quality of life and satisfaction with outcome among prostate -cancer
survivors. N Engl J Med. 2008, 358 (12), 1250–1261.
Sanford M.: Vardenafi l orodispersible tablet. Drugs. 2012, 72 (1), 87–98.
Schouten B.W., Bosch J.L., Bernsen R.M., Blanker M.H., Th omas S., Bohnen A.M.:
Incidence rates of erectile dysfunction in the Dutch general population.
Eff ects of defi nition, clinical relevance and duration of follow -up in the
Krimpen Study. Int J Impot Res. 2005, 17 (1), 58–62.
Schwartz E.J., Wong P., Graydon R.J.: Sildenafi l preserves intracorporeal
smooth muscle after radical retropubic prostatectomy. J Urol. 2004, 171
(2 Pt 1), 771–774.
Screponi E., Carosa E., Di Stasi S.M., Pepe M., Carruba G., Jannini E.A.:
Prevalence of chronic prostatitis in men with premature ejaculation. Urology.
2001, 58 (2), 198–202.
Seftel A.D., de la Rosette J., Birt J., Porter V., Zarotsky V., Viktrup L.: Coexisting
lower urinary tract symptoms and erectile dysfunction: a systematic review
of epidemiological data. Int J Clin Pract. 2013, 67 (1), 32–45.
Segal R.L., Cabrini M.R., Harris E.D., Mostwin J.L., Bivalacqua T.J., Burnett A.L.:
Combined infl atable penile prosthesis -artifi cial urinary sphincter implantation:
no increased risk of adverse events compared to single or staged
device implantation. J Urol. 2013, 190 (6), 2183–2188.
Semans J.H.: Premature ejaculation: a new approach. South Med J. 1956,
49 (4), 353–358.
Serefoglu E.C., Mandava S.H., Gokce A., Chouhan J.D., Wilson S.K., Hellstrom W.J.:
Long -term revision rate due to infection in hydrophilic -coated infl atable
penile prostheses: 11 -year follow -up. J Sex Med. 2012, 9 (8), 2182–2186.
Serefoglu E.C., McMahon C.G., Waldinger M.D., Althof S.E., Shindel A., Adaikan G.
i wsp.: An evidence -based unifi ed defi nition of lifelong and acquired premature
ejaculation: report of the second International Society for Sexual
Medicine Ad Hoc Committee for the Defi nition of Premature Ejaculation.
J Sex Med. 2014, 11 (6), 1423–1441.
Serefoglu E.C., Yaman O., Cayan S., Asci R., Orhan I., Usta M.F. i wsp.: Prevalence
of the complaint of ejaculating prematurely and the four premature ejaculation
syndromes: results from the Turkish Society of Andrology Sexual
Health Survey. J Sex Med. 2011, 8 (2), 540–548.
Shabsigh R., Padma -Nathan H., Gittleman M., McMurray J., Kaufman J.,
Goldstein I.: Intracavernous alprostadil alfadex (EDEX/VIRIDAL) is eff ective
and safe in patients with erectile dysfunction after failing sildenafi l
(Viagra). Urology. 2000, 55 (4), 477–480.
Shabsigh R.: Diagnosing premature ejaculation: a review. J Sex Med. 2006,
3 (Suppl 4), 318–323.
Shamloul R., el -Nashaar A.: Chronic prostatitis in premature ejaculation:
a cohort study in 153 men. J Sex Med. 2006, 3 (1), 150–154.
Sharlip I.: Diagnosis and treatment of premature ejaculation: the physician’s
perspective. J Sex Med. 2005, 2 (Suppl 2), 103–109.
Sikka S.C., Hellstrom W.J., Brock G., Morales A.M.: Standardization of vascular
assessment of erectile dysfunction: standard operating procedures for
duplex ultrasound. J Sex Med. 2013, 10 (1), 120–129.
Sohn M., Hatzinger M., Goldstein I., Krishnamurti S.: Standard operating procedures
for vascular surgery in erectile dysfunction: revascularization and
venous procedures. J Sex Med. 2013, 10 (1), 172–179.
Solursh D.S., Ernst J.L., Lewis R.W., Prisant L.M., Mills T.M., Solursh L.P. i wsp.:
Th e human sexuality education of physicians in North American medical
schools. Int J Impot Res. 2003, 15 (Suppl 5), 41–45.
Sotomayor M.: Th e burden of premature ejaculation: the patient’s perspective.
J Sex Med. 2005, 2 (Suppl 2), 110–114.
Spitzer M., Basaria S., Travison T.G., Davda M.N., DeRogatis L., Bhasin S.:
Th e eff ect of testosterone on mood and well -being in men with erectile
dysfunction in a randomized, placebo -controlled trial. Andrology. 2013,
1 (3), 475–482.
Spitzer M., Basaria S., Travison T.G., Davda M.N., Paley A., Cohen B. i wsp.: Eff ect
of testosterone replacement on response to sildenafi l citrate in men with
erectile dysfunction: a parallel, randomized trial. Ann Intern Med. 2012,
157 (10), 681–691.
Stember D.S., Mulhall J.P.: Th e concept of erectile function preservation
(penile rehabilitation) in the patient after brachytherapy for prostate cancer.
Brachytherapy. 2012, 11 (2), 87–96.
Sundaram C.P., Th omas W., Pryor L.E., Sidi A.A., Billups K., Pryor J.L.: Long-
-term follow -up of patients receiving injection therapy for erectile dysfunction.
Urology. 1997, 49 (6), 932–935.
Swearingen D., Nehra A., Morelos S., Peterson C.A.: Hemodynamic eff ect of
avanafi l and glyceryl trinitrate coadministration. Drugs Context. 2013,
212248.
Symonds T., Perelman M., Althof S., Giuliano F., Martin M., Abraham L. i wsp.:
Further evidence of the reliability and validity of the premature ejaculation
diagnostic tool. Int J Impot Res. 2007a, 19 (5), 521–525.
Symonds T., Perelman M.A., Althof S., Giuliano F., Martin M., May K. i wsp.:
Development and validation of a premature ejaculation diagnostic tool.
Eur Urol. 2007b, 52 (2), 565–573.
Symonds T., Roblin D., Hart K., Althof S.: How does premature ejaculation
impact a man s life? J Sex Marital Th er. 2003, 29 (5), 361–370.
Tajar A., Huhtaniemi I.T., O’Neill T.W., Finn J.D., Pye S.R., Lee D.M. i wsp.:
Characteristics of androgen defi ciency in late -onset hypogonadism: results
from the European Male Aging Study (EMAS). J Clin Endocrinol Metab.
2012, 97 (5), 1508–1516.
Tal R., Jacks L.M., Elkin E., Mulhall J.P.: Penile implant utilization following
treatment for prostate cancer: analysis of the SEER -Medicare database.
J Sex Med. 2011, 8 (6), 1797–1804.
Tang W., Ma L, Zhao L, Liu Y, Chen Z.: (Clinical effi cacy of Viagra with behavior
therapy against premature ejaculation). Zhonghua Nan Ke Xue. 2004
10 (5), 366–370.
Th e Process of Care Consensus Panel. Th e process of care model for evaluation
and treatment of erectile dysfunction. Int J Impot Res. 1999, 11 (2), 59–70.
Trost L.W., McCaslin R., Linder B., Hellstrom W.J.: Long -term outcomes of
penile prostheses for the treatment of erectile dysfunction. Expert Rev
Med Devices. 2013, 10 (3), 353–366.
Truitt W.A., Coolen L.M.: Identifi cation of a potential ejaculation generator
in the spinal cord. Science. 2002, 297 (5586), 1566–1569.
Tsertsvadze A., Yazdi F., Fink H.A., MacDonald R., Wilt T.J., Bella A.J. i wsp.:
Oral sildenafi l citrate (viagra) for erectile dysfunction: a systematic review
and meta -analysis of harms. Urology. 2009, 74 (4), 831–836.
Turek S.J., Hastings S.M., Sun J.K., King G.L., Keenan H.A.: Sexual dysfunction
as a marker of cardiovascular disease in males with 50 or more years
of type 1 diabetes. Diabetes Care. 2013, 36 (10), 3222–3226.
Vardi Y., Appel B., Jacob G., Massarwi O., Gruenwald I.: Can low -intensity
extracorporeal shockwave therapy improve erectile function? A 6 -month
follow up pilot study in patients with organic erectile dysfunction. Eur
Urol. 2010, 58 (2), 243–248.
Vardi Y., Appel B., Kilchevsky A., Gruenwald I.: Does low intensity extracorporeal
shock wave therapy have a physiological eff ect on erectile function?
Short -term results of a randomized, double -blind, sham controlled study.J Urol. 2012, 187 (5), 1769–1775.
Vardi Y., Sprecher E., Gruewald I.: Logistic regression and survival analysis
of 450 impotent patients treated with injection therapy: long -term dropout
parameters. J Urol. 2000, 163 (2), 467–470.
Vigen R., O’Donnell C.I., Barón A.E., Grunwald G.K., Maddox T.M., Bradley S.M.
i wsp.: Association of testosterone therapy with mortality, myocardial infarction,
and stroke in men with low testosterone levels. JAMA. 2013, 310
(17), 1829–1836.
Vignozzi L., Filippi S., Morelli A., Ambrosini S., Luconi M., Vannelli G.B. i wsp.:
Eff ect of chronic tadalafi l administration on penile hypoxia induced by cavernous
neurotomy in the rat. J Sex Med. 2006, 3 (3), 419–431.
Vlachopoulos C., Ioakeimidis N., Aznaouridis K., Terentes -Printzios D., Rokkas
K., Aggelis A. i wsp.: Prediction of cardiovascular events with aortic stiff -
ness in patients with erectile dysfunction. Hypertension. 2014, 64 (3),
672–678.
Vlachopoulos C., Jackson G., Stefanadis C., Montorsi P.: Erectile dysfunction in
the cardiovascular patient. Eur Heart J. 2013, 34 (27), 2034–2046.
Waldinger M.D.: Premature ejaculation: defi nition and drug treatment. Drugs.
2007a, 67 (4), 547–568.
Waldinger M.D.: Premature ejaculation: state of the art. Urol Clin North
Am. 2007b, 34 (4), 591–599.
Waldinger M.D.: Th e neurobiological approach to premature ejaculation.
J Urol. 2002, 168 (6), 2359–2367.
Waldinger M.D., Hengeveld M.W., Zwinderman A.H.: Paroxetine treatment
of premature ejaculation: a double -blind, randomized, placebo controlled
study. Am J Psychiatry. 1994, 151 (9), 1377–1379.
Waldinger M.D., Hengeveld M.W., Zwinderman A.H., Olivier B.: Eff ect of SSRI
antidepressants on ejaculation: a double -blind, randomized, placebocontrolled
study with fl uoxetine, fl uvoxamine, paroxetine, and sertraline. J Clin
Psychopharmacol. 1998a, 18 (4), 274–281.
Waldinger M.D., Rietschel M., Nöthen M.M., Hengeveld M.W., Olivier B.: Familial
occurrence of primary premature ejaculation. Psychiatr Genet. 1998b, 8
(1), 37–40.
Waldinger M.D., Schweitzer D.H.: Changing paradigms from a historical
DSM -III and DSM -IV view toward an evidence -based defi nition of premature
ejaculation. Part II – proposals for DSM -V and ICD -11. J Sex Med. 2006,
3 (4), 693–705.
Waldinger M.D., Schweitzer D.H.: Th e use of old and recent DSM defi nitions
of premature ejaculation in observational studies: a contribution to the present
debate for a new classifi cation of PE in the DSM -V. J Sex Med. 2008,
5 (5), 1079–1087.
Waldinger M.D., Zwinderman A.H., Olivier B.: On -demand treatment of
premature ejaculation with clomipramine and paroxetine: a randomized,
double -blind fi xed -dose study with stopwatch assessment. Eur Urol. 2004a,
46 (4), 510–515.
Waldinger M.D., Zwinderman A.H., Olivier B.: SSRIs and ejaculation: a double-
-blind, randomized, fi xed -dose study with paroxetine and citalopram. J Clin
Psychopharmacol. 2001, 21 (6), 556–560.
Waldinger M.D., Zwinderman A.H., Schweitzer D.H., Olivier B.: Relevance of
methodological design for the interpretation of effi cacy of drug treatment of
premature ejaculation: a systematic review and meta -analysis. Int J Impot
Res. 2004b, 16 (4), 369–381.
Wang R., Burnett A.L., Heller W.H., Omori K., Kotera J., Kikkawa K.: Selectivity
of avanafi l, a PDE5 inhibitor for the treatment of erectile dysfunction:
implications for clinical safety and improved tolerability. J Sex Med. 2012,
9 (8), 2122–2129.
Wang W.F., Minhas S., Ralph D.J.: Phosphodiesterase 5 inhibitors in the treatment
of premature ejaculation. Int J Androl. 2006, 29 (5), 503–509.
Wang C., Nieschlag E., Swerdloff R., Behre H.M., Hellstrom W.J., Gooren L.J. i wsp.:
Investigation, treatment, and monitoring of late -onset hypogonadism in
males: ISA, ISSAM, EAU, EAA, and ASA recommendations. Int J Androl.
2009, 30 (1), 1–10.
Wang H., Yuan J., Hu X., Tao K., Liu J., Hu D.: Th e eff ectiveness and safety
of avanafi l for erectile dysfunction: a systematic review and metaanalysis.
Curr Med Res Opin. 2014, 30 (8), 1565–1571.
Wespes E., Amar E., Eardley I., Giuliano F., Hatzichristou D., Hatzimouratidis K.
i wsp.: EAU Guidelines Panel on Male Sexual Dysfunction. EAU Guidelines
on Male Sexual Dysfunction (Erectile Dysfunction and premature ejaculation).
Edn. presented at the EAU Annual Congress Stockholm 2009.
Wespes E., Amar E., Hatzichristou D., Montorsi F., Pryor J., Vardi Y.: EAU
Guidelines on erectile dysfunction: an update. Eur Urol. 2006, 49 (5), 806–815.
Wespes E., Amar E., Hatzichristou D., Montorsi F., Pryor J., Vardi Y.: Guidelines
on erectile dysfunction. Eur Urol. 2002, 41 (1), 1–5.
Whooley M.A., Avins A.L., Miranda J., Browner W.S.: Case -fi nding instruments
for depression. Two questions are as good as many. J Gen Intern
Med. 1997, 12 (7), 439–445.
Wieder J.A., Brackett N.L., Lynne C.M., Green J.T., Aballa T.C.: Anesthetic
block of the dorsal penile nerve inhibits vibratory -induced ejaculation in
men with spinal cord injuries. Urology. 2000, 55 (6), 915–917.
Williams S.B., Lei Y., Nguyen P.L., Gu X., Lipsitz S.R., Yu H.Y. i wsp.: Comparative
eff ectiveness of cryotherapy vs brachytherapy for localised prostate cancer.
BJU Int. 2012, 110 (2 Pt 2), E92–98.
Wilson S.K., Cleves M.A., Delk J.R.: Comparison of mechanical reliability
of original and enhanced Mentor Alpha I penile prosthesis. J Urol. 1999,
162 (3 Pt 1), 715–718.
World Health Organization, International Classifi cation of Diseases and
Related Health Problems. 10th edn. 1994, Geneva.
Wyllie M.G., Powell J.A.: Th e role of local anaesthetics in premature ejaculation.
BJU Int. 2012, 110 (11 Pt C), 943–948.
Yeager J., Beihn R.M.: Retention and migration of alprostadil cream applied
topically to the glans meatus for erectile dysfunction. Int J Impot Res.
2005, 17 (1), 91–95.
Yuan J., Hoang A.N., Romero C.A., Lin H., Dai Y., Wang R.: Vacuum therapy
in erectile dysfunction – science and clinical evidence. Int J Impot Res.
2010, 22 (4), 211–219.
Yuan J., Zhang R., Yang Z., Lee J., Liu Y., Tian J. i wsp.: Comparative eff ectiveness
and safety of oral phosphodiesterase type 5 inhibitors for erectile
dysfunction: a systematic review and network meta -analysis. Eur Urol.
2013, 63 (5), 902–912.
Zargaroff S., Sharma V., Berhanu D., Pearl J.A., Meeks J.J., Dupree J.M. i wsp.:
National trends in the treatment of penile prosthesis infections by explantation
alone vs. immediate salvage and reimplantation. J Sex Med. 2014,
11 (4), 1078–1085.
Zhang X.S., Wang Y.X., Huang X.Y., Leng J., Li Z., Han Y.F.: Comparison between
sildenafi l plus sertraline and sertraline alone in the treatment of premature
ejaculation. Zhonghua Nan Ke Xue. 2005, 11 (7), 520–525.
