3B.5.4. Pacjenci ze zidentyfikowanymi czynnikami ryzyka
3B.5.4.1. Bezobjawowy bakteriomocz
u kobiet w okresie pomenopauzalnym
Starsze kobiety mają zwiększoną częstość występowania
ABU. Sposób postępowania w tych przypadkach jest taki
sam jak dla kobiet przed menopauzą (rozdział 3B.5.2.)
(Mody i Juthani-Mehta, 2014).
3B.5.4.2. Cukrzyca
Cukrzyca, również dobrze kontrolowana, jest skorelowana
z wyższą częstotliwością ABU kobiet
(Turan i wsp.,2008;).
(Zhanel i wsp., 1991).
Eredykacja ABU nie zmniejsza
ryzyka wystąpienia pełnoobjawowego zakażenia dróg
moczowych i zakaźnych powikłań cukrzycy. Nieleczone
ABU nie koreluje z wyższą częstotliwością występowania
nefropatii cukrzycowej
(Harding i wsp., 2002).
Badania
przesiewowe i leczenie ABU w dobrze kontrolowanej
cukrzycy nie są zalecane (LE: 1B, GR: A), jednakże źle
prowadzona cukrzyca może być czynnikiem ryzyka
wystąpienia objawowego ZUM i powikłań infekcyjnych.
3B.5.4.3. Pacjenci zakładów opieki
(zinstytucjonalizowani)
Częstotliwość ABU jest wysoka (15–50%) u zinstytucjonalizowanych
pacjentów w podeszłym wieku
(Nicolle, 1997b).
Różnicowanie z objawowym ZUM jest trudne
u wielu chorych obciążonych chorobami internistycznymi
oraz neurologicznymi i prawdopodobnie jest wielokrotnie
przyczyną niepotrzebnej antybiotykoterapii
(Silver i wsp.,2009;).
( Trautner, 2011).
Wykazano, że leczenie ABU w tej
grupie pacjentów nie jest związane z korzystnymi efektami
(Nicolle, 2002).
Przed rozpoczęciem leczenia należy
wziąć pod uwagę możliwy efekt ochronny spontanicznego
ABU (rozdział 3.5.4.4.). Dlatego też badania przesiewowe
i leczenie ABU nie są zalecane w tej grupie pacjentów
(LE: 1b, GR: A).
3B.5.4.4. Pacjenci z dysfunkcją dolnych
dróg moczowych
Pacjenci z zaburzeniami czynnościowymi dolnych dróg
moczowych (LUTD, ang. lower urinary tract disfunction),
jak np. z pęcherzem neurogennym, stwardnieniem rozsianym,
uszkodzeniem rdzenia kręgowego, chorzy z niepełnym
opróżnianiem pęcherza moczowego, pacjenci
z zastępczym pęcherzem jelitowym, wstawką jelitową, po
ileo-cystoplastyce, pacjenci stosujący czyste przerywane
cewnikowanie (CIC, ang. clean intermittent catheterization),
z ortotopowym pęcherzem z jelita krętego, kontynentymi
zbiornikami często mają skolonizowane drogi
moczowe
(Nicolle, 2014b;).
(Wullt i wsp., 2004).
Badania
nie wykazały żadnych korzyści w leczeniu ABU w tych
grupach pacjentów
(Nicolle, 2014b;).
(Wullt i wsp., 2004).
Wykazano dobry efekt zabezpieczający celową kolonizację
szczepu ABU (E. coli 83972) przed nawrotowym,
klinicznie objawowym ZUM
(Darouiche i wsp., 2005;).
(Sunden i wsp., 2010).
u pacjentów z LUTD, u których nie
rozwinęło się spontaniczne ABU. Badania przesiewowe
i leczenie ABU w tych grupach pacjentów nie są zalecane
(LE: 2b, GR: B). Jeśli u pacjentów z tych grup rozwijają
się pełnoobjawowe, nawrotowe ZUM (rozdział 3B.5.2.),
należy wziąć pod uwagę potencjalny efekt ochronny
spontanicznie rozwiniętej ABU przed podjęciem decyzji
o leczeniu (LE: 4, GR: B).
3B.5.4.5. Pacjenci zacewnikowani
Pacjenci zacewnikowani, z wytworzoną cystostomią
lub nefrostomią, z czasem stają się nosicielami ABU.
Antybiotykoterapia u tych chorych nie przynosi żadnych
korzyści. Dotyczy to również pacjentów z ABU z założonymi
cewnikami moczowodowymi / szynujące moczowody
typu JJ
(Tenke i wsp., 2008),
których leczenie nie
jest zalecane – część 3F (LE: 4, GR: C).
3B.5.4.6. Pacjenci z bezobjawowym bakteriomoczem
poddawani implantacji/założeniu
lub wymianie cewnika
Uważa się, że ABU u chorych poddawanych prostej
implantacji lub wymianie cewników dopęcherzowych
nie jest czynnikiem ryzyka per se i nie ma potrzeby wykonywania
u tych chorych kontrolnych posiewów, jak też ich
leczenia (LE: 4, GR: C). U pacjentów poddanych implantacji
lub wymianie drenów nefrostomijnych i stentów
wewnętrznych (cewników typu JJ) ABU jest uważane za
czynnik ryzyka powikłań zakaźnych (procedura zanieczyszczona)
– zaleca się wykonywanie posiewów kontrolnych
i leczenie zakażeń przed zabiegiem (LE: 4, GR: C).
3B.5.4.7. Pacjenci z przeszczepioną nerką
Na podstawie wyniku retrospektywnego badania obserwacyjnego
nie stwierdzono krótko- i długoterminowych
korzyści wynikających z antybiotykoterapii ABU
u pacjentów nieobciążonych z przeszczepioną nerką
(Green i wsp., 2013).
W związku z tym nie zaleca się
leczenia ABU u tych chorych (LE: 3, GR: B). Niezbędne
są jednak prospektywne randomizowane badania porównawcze
w celu potwierdzenia tego zalecenia
(Nicolle,2014a).
3B.5.4.8. Pacjenci o obniżonej odporności
oraz ciężko chorzy z kandydurią
Te grupy pacjentów muszą być rozpatrywane indywidualnie,
a korzyści z badań przesiewowych i leczenia
ABU powinny być oddzielnie oceniane w każdym przypadku
(LE: 4, GR: C). Pacjenci z bezobjawową kandydurią
mogą, ale nie muszą mieć innych zaburzeń lub wady dróg
moczowych. Leczenie bezobjawowej kandydurii nie jest
zalecane u pacjentów nieobciążonych
(Sobel i wsp., 2000)
(LE 1b, GR: A).
3B.5.5. Przed zabiegiem operacyjnym
W przypadku podejmowania procedur diagnostycznych
i terapeutycznych poza drogami moczowymi, tzn. bez
naruszenia ich ciągłości (procedury czyste), ABU nie jest
ogólnie uważana za czynnik ryzyka ZUM, a badania przesiewowe
i leczenie ABU nie są konieczne (LE: 4, GR: C).
W procedurach, w których dochodzi do naruszenia ciągłości
dróg moczowych i uszkodzenia śluzówki, szczególnie
w endoskopii urologicznej, bakteriuria jest określana
jako czynnik ryzyka. W przypadku braku ABU
(jałowego posiewu moczu) procedury te są zazwyczaj
klasyfikowane jako czyste-skażone. Obecność bakteriomoczu,
cewników odprowadzających mocz i uropatii
zaporowej kwalifikuje te procedury jako skażone (zanieczyszczone
– poziom III A). Posiew moczu musi zostać
wykonany przed tego typu interwencjami, a w przypadku
ABU należy włączyć leczenie przedoperacyjne (LE: 3,
GR: B). Zalecenia dotyczące profilaktyki antybiotykowej
w różnych rodzajach zabiegów urologicznych są podane
w rozdziale 3N.
3B.5.6. Leczenie farmakologiczne
Jeżeli zostanie podjęta decyzja o eredykacji ABU, zaleca
się identyczny dobór i czas stosowania antybiotyków jak
w nieskomplikowanym (tabela 3 i 4) lub powikłanym
(tabela 7) ZUM – zależnie od płci, etiologii oraz obecności
czynników ryzyka. Leczenie powinno być celowane
i indywidualnie dostosowane. Jeśli wystąpi przykry
zapach moczu i łagodne objawy dyzuryczne, opcją wartą
rozważenia jest zastosowanie hipuranu methenaminy
w dawce 1 g 2–3 razy dziennie i/lub zwiększone spożycie
wody (LE: 4, GR: C).
3B.6. Kontrola po leczeniu
W przypadku podjęcia leczenia ABU o skuteczności
leczenia zapewni pobranie kontrolnego posiewu moczu
po zakończeniu leczenia.
3C. ZAPALENIE PĘCHERZA MOCZOWEGO I ODMIEDNICZKOWE ZAPALENIE NEREK U DOROSŁYCH
3C.1. Wstęp
Rozdział ten jest streszczeniem zaleceń EAU/ICUD na
temat infekcji układu moczowo-płciowego (rozdział 3. –
nieskomplikowane/niepowikłane ZUM, rozdział 4. –
nawrotowe ZUM u dorosłych i częściowo rozdział 7. –
nefropatie i niedobory odpornościowe)
(Naber i wsp., 2010).
Ostre, niepowikłane ZUM u dorosłych to sporadyczne
lub nawrotowe epizody nabytego ostrego zapalenia
pęcherza moczowego i ostrego odmiedniczkowego
zapalenia nerek u poza tym zdrowych osób, biorąc pod
uwagę indywidualne czynniki ryzyka O i R oraz częściowo
E w klasyfikacji ORENUC (tabela 1). Tego typu
ZUM są obserwowane głównie u kobiet nieobciążonych
nieprawidłowościami strukturalnymi i czynnościowymi
w obrębie dróg moczowych, chorobami nerek
lub chorobami współistniejącymi, które to obciążenia
mogą prowadzić do ciężkich powikłań i w związku z tym
wymagają dodatkowego leczenia
(Hooton i Stamm, 1997;).
(Wagenlehner i wsp., 2011b).
Dotyczy to tylko nielicznej
grupy mężczyzn.
3C.2. Epidemiologia, etiologia i patofizjologia
Prawie połowa wszystkich kobiet doświadcza co najmniej
jednego epizodu ZUM w ciągu życia. Prawie 1 na
3 kobiety będzie miała co najmniej jeden epizod ZUM
do 24. r.ż.
(Foxman, 2003).

Tylko niewielka liczba mężczyzn w wieku 15–50 lat
cierpi z powodu ostrego niepowikłanego zapalenia
pęcherza moczowego
(Stamm, 1997).
Według weryfikacji
przeprowadzonej przez
Fünfstück i wsp. (2012)
zakażenia
układu moczowego (zapalenie pęcherza moczowego
i odmiedniczkowe zapalenie nerek) występują częściej
u pacjentów z cukrzycą, która może stanowić niezależny
czynnik ryzyka. Trudne jest określenie wpływu samej
niewydolności nerek na epidemiologię ZUM z powodu
wpływu chorób leżących u jej podstaw
(Fünfstück i wsp.,2006).
Rola immunosupresji per se w rozwoju ZUM również
pozostaje nierozstrzygnięta
(Tolkoff-Rubin i Rubin, 1997).
U mężczyzn z ludzkim wirusem niedoboru odporności
(HIV, ang. human immunodeficiency virus) i zespołem
nabytego braku odporności (AIDS, ang. acquired immunodeficiency
syndrome) wykazano ścisły związek między
liczbą limfocytów z markerem powierzchniowym CD4
(ang. cluster of differentiation) a ryzykiem bakteriomoczu,
zwłaszcza u pacjentów, u których liczba limfocytów T CD4
wynosi <200/mL
(van Dooyeweert i wsp., 1997).
Około
40% chorych z bakteriomoczem nie wykazuje żadnych
objawów. Brak jest dowodów na to, aby leczenie ABU
w tej grupie pacjentów przynosiło jakiekolwiek korzyści
(Nicolle, 2014c).
Wachlarz patogenów etiologicznych jest podobny
w niepowikłanych ZUM górnej i dolnej części układu
moczowego. Wiodącą rolę pełni tu E. coli jako czynnik
chorobotwórczy w 70–95% przypadków i Staphylococcus
saprophyticus, odpowiedzialny za 5–10% przypadków.
Również inne Enterobacteriaceae są sporadycznie izolowane,
takie jak Proteus mirabilis i Klebsiella sp.
(Naber i wsp., 2008) (LE: 2a).
3C.3. Ostre zapalenie pęcherza moczowego
(zakażenie dolnych dróg moczowych)
u osób dorosłych
3A.3.1. Rozpoznanie/Diagnostyka
3C.3.1.1. Objawy kliniczne
Rozpoznanie ostrego niepowikłanego zapalenia pęcherza
moczowego można z dużym prawdopodobieństwem
postawić na podstawie wywiadu (objawy dyzuryczne,
częste oddawanie moczu, parcia naglące) i braku upławów
lub podrażnienia dróg rodnych u tych kobiet, które nie
mają innych czynników ryzyka charakterystycznych dla
powikłanego ZUM
(Stamm i Hooton, 1993;)
(Wagenlehner i wsp., 2011b)
(LE: 2a, GR: B). Dolegliwości z układu
moczowo-płciowego u starszych kobiet niekoniecznie
są wynikiem ZUM
(Foxman i wsp., 2001).
U chorych na cukrzycę ze stabilną glikemią sporadyczne,
a nawet nawracające zapalenie pęcherza
moczowego może być również uznane za niepowikłane.
Jednakże pacjenci z długotrwałą cukrzycą mogą mieć
zaburzenia oddawania moczu z powodu neuropatii,
co może być istotnym czynnikiem ryzyka powikłań
(Fünfstück i wsp., 2012).
U zdrowych pacjentów z łagodną i umiarkowaną niewydolnością
nerek bez innych istotnych strukturalnych i czynnościowych
zaburzeń w obrębie dróg moczowych i nerek
sporadyczne i nawracające zapalenie pęcherza moczowego
można również uznać za niepowikłane, ponieważ
nie należy spodziewać się poważniejszych powikłań.
3C.3.1.2. Diagnostyka różnicowa
Objawowe ZUM należy odróżnić od bezobjawowego bakteriomoczu,
którego nie uznaje się za zakażenie, a jest
jedynie kolonizacją komensalem, która zazwyczaj nie
powinna być leczona z wyjątkiem sytuacji, gdy kolonizacja
jest istotnym czynnikiem ryzyka w sytuacjach
szczególnych – część 3B.
3C.3.1.3. Diagnostyka laboratoryjna
Badanie testem paskowym moczu jest alternatywą do
posiewu moczu, uzasadnioną metodą w diagnostyce
ostrego niepowikłanego zapalenia pęcherza moczowego
(Bradbury, 1988;).
(Lifshitz i Kramer, 2000).
(LE: 2a, GR: B).
Zaleca się wykonanie posiewu moczu w sytuacji:
podejrzenia ostrego odmiedniczkowego zapalenia nerek,
nieustępujących lub ponownie występujących objawów
w ciągu 2–4 tyg. po zakończeniu leczenia,
u kobiet, które zgłaszają nietypowe objawy
(Fihn, 2003;).
(Foxman i Brown, 2003).
ciężarnych,
mężczyzn z podejrzeniem ZUM (LE: 4, GR: B).
Miano >10³ cfu/mL jest mikrobiologicznie diagnostyczne
u kobiet zgłaszających objawy ostrego niepowikłanego
zapalenia pęcherza moczowego (Kunin, 1997) (LE: 3, GR: B).
Kobiety z nietypowymi objawami ostrego niepowikłanego
zapalenia pęcherza moczowego albo ostrego niepowikłanego
odmiedniczkowego zapalenia nerek oraz
ci chorzy, którzy nie reagują na odpowiednią kurację
antybiotykową, powinni zostać poddani dodatkowym
badaniom diagnostycznym (LE: 4, GR: B).
U mężczyzn należy zawsze przeprowadzić pełną ocenę
urologiczną, w tym DRE, aby wykluczyć istotne czynniki
sprzyjające (LE: 4, GR: A).
3C.3.2. Postępowanie
Zalecana jest antybiotykoterapia, ponieważ sukces
kliniczny jest znacznie bardziej prawdopodobny u kobiet
leczonych antybiotykami w porównaniu z placebo
(Falagasi wsp., 2009)
(LE: 1a, GR:A). Dobierając antybiotyk, należy
kierować się
(Wagenlehner i wsp., 2011b):
spektrum jego działania i wrażliwością patogenów
etiologicznych,
skutecznością w odniesieniu do danego wskazania
wykazaną w badaniach klinicznych,
tolerancją i możliwymi działaniami niepożądanymi,
niekorzystnymi skutkami ekologicznymi,
kosztami,
dostępnością.
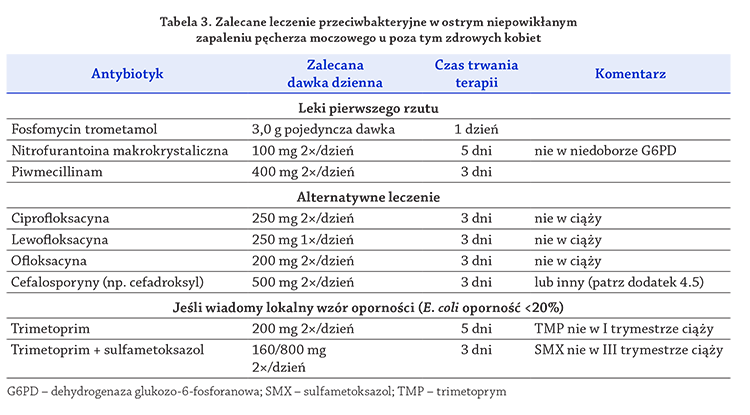
Zgodnie z tymi zasadami i dostępnymi wzorami wrażliwości
patogenów w Europie za leki pierwszego rzutu,
jeśli są dostępne, uważa się: trometamol fosfomycyny
3 g w pojedynczej dawce, pivmecillinam 400 mg 2 razy
dziennie przez 3 dni oraz nitrofurantoinę makrokrystaliczną
100 mg 2 razy dziennie przez 5 dni
(Gupta i wsp., 2007;):
(Lecomte i Allaert, 1997;):
(Nicolle, 2000):
(LE: 1a,
GR: A) (tabela 3). Zalecenia te są aktualne tylko dla kobiet.
Większość E. coli ESBL(+) jest wciąż wrażliwa na fosfomycynę.
Jednakże w Hiszpanii zaobserwowano równoległy
wzrost użycia fosfomycyny i odporności E. coli ESBL(+)
na fosfomycynę
(Oteo i wsp., 2010a).
Alternatywne antybiotyki to trimetoprim samodzielnie
lub w połączeniu z sulfonamidami i fluorochinolony.
Kotrimoksazol (160/800 mg 2 razy dziennie przez
3 dni) lub trimetoprim (200 mg przez 5 dni) powinny
być traktowane jako leki pierwszego rzutu w obszarach
o wiadomej <20% oporności E. coli
(Gupta i Stamm, 2002;).
(Warren i wsp., 1999).
(LE: 1b, GR: B). Pomimo nadal obserwowanych
na niektórych obszarach niskich oporności
patogenów w stosunku do fluorochinolonów ich stosowanie
jako leczenia pierwszego rzutu nie jest zalecane
ze względu na działania niepożądane, w tym negatywne
skutki ekologiczne i potencjalną możliwość wytworzenia
oporności bakteryjnej (tabela 3).
Aminopenicyliny nie nadają się do leczenia empirycznego
ze względu na wysoką oporność E. coli na ten antybiotyk
na całym świecie. Aminopenicyliny w połączeniu
z inhibitorami beta-laktamaz, takie jak: ampicylina/sulbaktam,
amoksycylina/kwas klawulanowy i cefalosporyny
doustne, są nieskuteczne w terapii krótkoterminowej
i nie są zalecane do leczenia empirycznego ze względu
na ekologiczne skutki uboczne, ale mogą być stosowane
w niektórych szczególnych przypadkach
(Hooton i wsp.,2005,).
(Hooton i wsp.2012).
Krótkotrwałe leczenie przeciwbakteryjne
może być również brane pod uwagę w terapii zapalenia
pęcherza moczowego w ciąży
(Vazquez i Villar, 2000)
(LE: 1a, GR: A), lecz nie wszystkie antybiotyki są dopuszczalne
w czasie ciąży. Ogólnie penicyliny, cefalosporyny,
fosfomycyna, nitrofurantoina (nie w przypadku niedoboru
dehydrogenazy glukozo-6-fosforanowej i w końcowym
okresie ciąży), trimetoprim (nie w pierwszym
trymestrze) oraz sulfonamidy (nie w ostatnim trymestrze)
mogą być brane pod uwagę.
U mężczyzn zaleca się leczenie przez co najmniej
7 dni, najlepiej trimetoprimem z ko-trimoksazolem
lub fluorochinolonami, jeśli jest to zgodne z wynikami
wrażliwości bakteryjnej (LE: 4, GR: B).
U pacjentów z niewydolnością nerek spowolnione
wydalanie nerkowe może mieć wpływ na wybór środków
przeciwdrobnoustrojowych. Większość antybiotyków
ma jednak szerokie spektrum terapeutyczne. Nie jest
konieczne dostosowanie dawki aż do współczynnika
przesączania
kłębuszkowego (GFR, ang. glomerular filtration
rate) <20 mL/min, z wyjątkiem antybiotyków
potencjalnie nefrotoksycznych (np. aminoglikozydów).
Połączenie diuretyków pętlowych (np. furosemidu) i cefalosporyny
jest nefrotoksyczne. Nitrofurantoina i tetracykliny
(ale nie doksycyklina) są przeciwwskazane.
3C.3.3. Kontrola po leczeniu
Rutynowe badanie ogólne moczu oraz posiewy moczu po
zakończeniu leczenia u pacjentów bezobjawowych nie są
wskazane
(Nicolle i wsp., 2005)
(LE: 2b, GR: B), z wyjątkiem
ciężarnych i tych przypadków, gdzie leczenie miało
na celu wyeliminowanie ABU (rozdział 3B.5.3.). U kobiet,
u których objawy nie ustępują po zakończeniu leczenia,
oraz tych, u których objawy ustępują, ale nawracają
w ciągu 2 tyg., należy wykonać posiew moczu z antybiogramem
(LE: 4, GR: B). W takiej sytuacji należy przyjąć, że
organizmy chorobotwórcze nie są podatne na pierwotnie
używane środki przeciwbakteryjne. Należy rozważyć
ponowne leczenie w schemacie 7-dniowym przy użyciu
innego środka (LE: 4, GR: C).
3C.4. Ostre niepowikłane odmiedniczkowe
zapalenie nerek u dorosłych
3C.4.1. Rozpoznanie/Diagnostyka
3C.4.1.1. Objawy kliniczne
Rozpoznanie ostrego odmiedniczkowego zapalenia
nerek mogą sugerować objawy takie jak: bóle w okolicy
lędźwiowej, nudności i wymioty, gorączka (>38°C) i/lub
tkliwość okolicy lędźwiowej/kąta żebrowo-kręgowego,
mogące występować przy jednoczesnym braku objawów
zapalenia pęcherza moczowego
(Scholes i wsp., 2005).
Szczególną uwagę należy poświęcić kobietom w ciąży
z ostrym odmiedniczkowym zapaleniem nerek, ponieważ
tego rodzaju infekcja może mieć nie tylko negatywny
wpływ na matkę z uwagi na niedokrwistość, niewydolność
nerek i niewydolność oddechową, ale także ma
wpływ na nienarodzone dziecko ze względu na zwiększone
ryzyko porodu przedwczesnego
(Hill i wsp., 2005).
Większość mężczyzn z ZUM przebiegającym
z gorączką ma jednocześnie zapalenie gruczołu krokowego
wywołujące przejściowe podwyższenie PSA i zwiększoną
objętość gruczołu
(Ulleryd, 2003).
Tak więc ocena
prostaty powinna być wykonywana rutynowo u mężczyzn
z gorączką w przebiegu ZUM, odmiedniczkowym
zapaleniem nerek lub nawracającym ZUM oraz występującymi
czynnikami komplikującymi (LE: 4, GR: A).
Ścisłego monitorowania wymagają pacjenci z cukrzy-
cą
– ostre odmiedniczkowe zapalenie nerek może wywoływać
zaburzenia metaboliczne, m.in. hipo- i hiperglikemię,
odwodnienie hiperosmolarne lub kwasicę ketonową
(Fünfstück i wsp., 2012).
U chorych z cukrzycą może
również dojść do progresji wysoce śmiertelnego zakażenia
miąższu nerek spowodowanego przez organizmy
gazotwórcze (rozedmowe odmiedniczkowe zapalenie
nerek), znamiennego histologicznie, przez ropną infiltrację
z tworzeniem mikroropni i rozwoju ostrej niewydolności
nerek
(Cattell, 1992).
Pochodzenie mikroorganizmów może być krwiopochodne.
Wewnątrznerkowe ropnie mogą pękać, prowadząc
do rozwoju ropni przynerkowych i okołonerkowych
oraz nacieku na mięśnie lędźwiowe. U chorych na
cukrzycę często dochodzi do martwicy brodawek nerkowych,
co szczególnie w połączeniu z ostrym odmiedniczkowym
zapaleniem nerek prowadzi do bliznowacenia
miąższu nerek, jednak trudno wykluczyć zatykanie kanalików
przez złuszczone brodawki nerkowe jako przyczynę
nefropatii.
Ryzyko przewlekłej choroby nerek i niewydolności
nerek wywołanej przez odmiedniczkowe zapalenie nerek
jest niskie. Należy obserwować wyjściowe zmiany chorobowe,
jak np. odpływy pęcherzowo-moczowodowe, nadużywanie
środków przeciwbólowych, kamicę nerkową
i niedrożność dróg moczowych. Jednak ostre zakażenia
bakteryjne, w tym odmiedniczkowe zapalenie nerek,
może znacząco wpłynąć na postęp przewlekłej choroby
nerek. Odwrotnie – przewlekła niewydolność nerek może
wpływać na ciężkość przebiegu zakażenia
(Fünfstück i wsp., 2006).
3C.4.1.2. Diagnostyka różnicowa
Ważne jest, aby za pomocą właściwego obrazowania
bardzo wcześnie różnicować ostre niepowikłane i powikłane,
głównie zaporowe, odmiedniczkowe zapalenie
nerek, ponieważ to ostatnie może bardzo szybko doprowadzić
do urosepsy.
3C.4.1.3. Diagnostyka laboratoryjna
Rutynowo zaleca się wykonanie badania ogólnego moczu
(np. przy użyciu metody paskowej) z oceną obecności
białych i czerwonych krwinek oraz azotynów
(Fulop,2012)
(LE: 4, GR: C). Miana bakterii >10⁴ cfu/mL wskazują
na klinicznie istotną bakteriurię
(Rubin i wsp., 1992)
(LE: 2b, GR: C).
Należy wykonać badanie ultrasonograficzne (USG, ang.
ultrasonography) górnych dróg moczowych celem wykluczenia
niedrożności dróg moczowych i kamicy nerek
(LE: 4, GR: C). Należy rozważyć dodatkowe badania, takie
jak spiralna TK, urografia lub scyntygrafia nerek z zastosowaniem
kwasu dimerkaptopurynowego znakowanego
izotopem technetu (99Tc-DMSA, kwas 2,3-dimerkaptobursztynowy,
ang. 2,3-dimercaptosuccinic acid) w przypadku
utrzymywania się gorączki przez 3 dni pomimo
leczenia (LE: 4, GR: C). Do rozpoznania czynników komplikujących
u kobiet w ciąży obrazowymi metodami preferencyjnymi
są USG i rezonans magnetyczny (MRI, ang.
magnetic resonance imaging), pozwalające na uniknięcie
ryzyka napromieniowania płodu (LE: 4, GR: B).
3C.4.2. Postępowanie
W wyniku braku odpowiednich badań kontrolnych
spektrum i wzory wrażliwości uropatogenów na danym
obszarze, które powodują niepowikłane zapalenia
pęcherza moczowego, mogą być stosowane jako przewodnik
do terapii empirycznej
(Naber i wsp., 2008)
(LE: 4,
GR: B). Jednakże wiadomo, że Staphylococcus saprophyticus
rzadziej wywołuje ostre odmiedniczkowe zapalenie nerek
w porównaniu do ostrego zapalenia pęcherza moczowego
(LE: 4, GR: B).
3C.4.2.1. Łagodne i umiarkowane przypadki
ostrego nieskomplikowanego
odmiedniczkowego zapalenia nerek
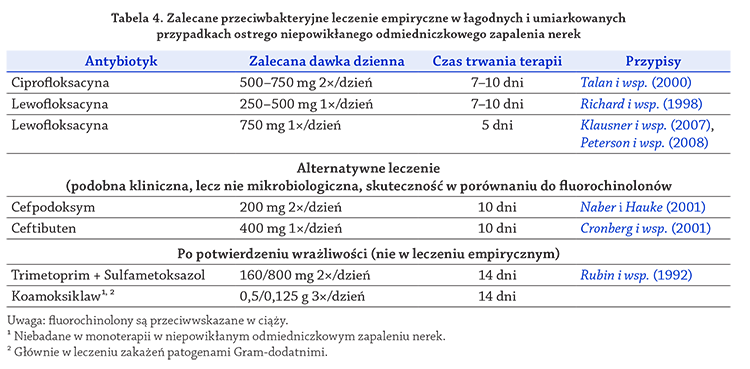
W łagodnych i umiarkowanych przypadkach ostrego
niepowikłanego odmiedniczkowego zapalenia nerek
(tabela 4) doustna 10–14-dniowa terapia jest najczęściej
wystarczająca (LE: 1b, GR: B). Fluorochinolony
stosowane przez 7–10 dni mogą być zalecane jako leki
pierwszego rzutu, jeśli współczynnik oporności E. coli
wynosi <10%
(Talan i wsp., 2000)
(LE: 1b, GR: A). Jeśli
dawka fluorochinolonów jest zwiększona, leczenie może
być prawdopodobnie zredukowane do 5 dni
(Klausner i wsp., 2007;)
(Peterson i wsp., 2008)
(LE: 1b, GR: B). Jednak
w populacjach niektórych części świata wykazano coraz
większą liczbę opornych na fluorochinolony E. coli, co
ogranicza empiryczne stosowanie fluorochinolonów.
Fluorochinolony są również przeciwwskazane w ciąży.
Alternatywą mogą być doustne cefalosporyny trzeciej
generacji, takie jak cefpodoksym lub ceftibuten
(Cronberg i wsp., 2001;)
(Naber i Hauke, 2001)
(LE: 1b, GR: B). Jednak
dostępne badania wykazały jedynie podobną kliniczną,
lecz nie mikrobiologiczną, skuteczność w porównaniu
do ciprofloksacyny.
W wyniku zwiększenia częstości występowania
oporności E. coli >10% kotrimoksazol nie nadaje się do
terapii empirycznej na większości obszarów, ale może być
wykorzystany po potwierdzeniu wrażliwości w posiewie
z antybiogramem
(Stamm i wsp., 1987)
(LE: 1b, GR: B).
Co-amoxiclav (amoksycylina z kwasem klawulanowym)
nie jest zalecany jako lek pierwszego rzutu dla
empirycznej terapii doustnej ostrego odmiedniczkowego
zapalenia nerek (LE: 4, GR: B). Zalecane jest jego stosowanie
po potwierdzeniu obecności wrażliwych bakterii
Gram-dodatnich (LE: 4, GR: C).
W populacjach o wysokim poziomie oporności E. coli
(>10%) na fluorochinolony i wytwarzających b-laktamazy
o rozszerzonym ESBL należy rozpatrywać wstępne
leczenie empiryczne aminoglikozydami i karbapenemami
do czasu uzyskania wyniku antybiotykowrażliwości
wskazującego na możliwość skorzystania z preparatów
doustnych (LE: 4, GR: B).
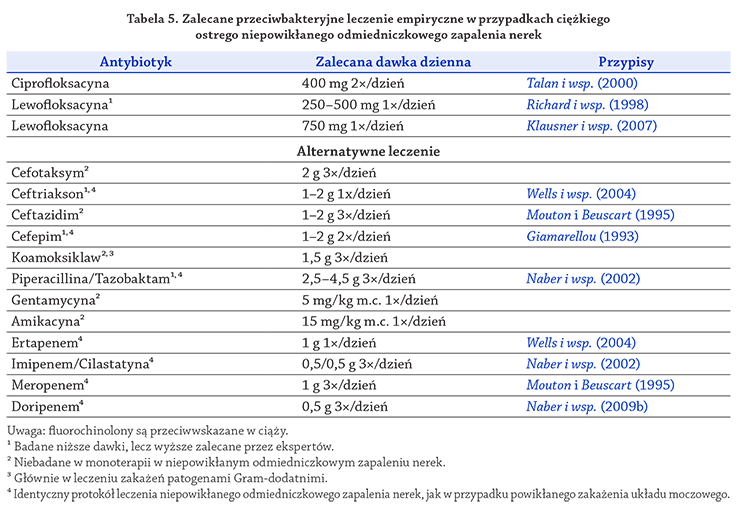
3C.4.2.2. Ciężkie przypadki ostrego niepowikłanego odmiedniczkowego zapalenia nerek
Pacjenci z ciężką postacią odmiedniczkowego zapalenia
nerek, którzy nie mogą przyjmować leków doustnie
z powodu objawów ogólnoustrojowych, takich jak
Tabela 4. Zalecane przeciwbakteryjne leczenie empiryczne w łagodnych i umiarkowanych
przypadkach ostrego niepowikłanego odmiedniczkowego zapalenia nerek
Antybiotyk Zalecana dawka dzienna Czas trwania terapii Przypisy
Ciprofloksacyna 500–750 mg 2×/dzień 7–10 dni Talan i wsp. (2000)
Lewofloksacyna 250–500 mg 1×/dzień 7–10 dni Richard i wsp. (1998)
Lewofloksacyna 750 mg 1×/dzień 5 dni Klausner i wsp. (2007),
Peterson i wsp. (2008)
Alternatywne leczenie
(podobna kliniczna, lecz nie mikrobiologiczna, skuteczność w porównaniu do fluorochinolonów
Cefpodoksym 200 mg 2×/dzień 10 dni Naber i Hauke (2001)
Ceftibuten 400 mg 1×/dzień 10 dni Cronberg i wsp. (2001)
Po potwierdzeniu wrażliwości (nie w leczeniu empirycznym)
Trimetoprim + Sulfametoksazol 160/800 mg 2×/dzień 14 dni Rubin i wsp. (1992)
Koamoksiklaw¹, ² 0,5/0,125 g 3×/dzień 14 dni
Uwaga: fluorochinolony są przeciwwskazane w ciąży.
¹ Niebadane w monoterapii w niepowikłanym odmiedniczkowym zapaleniu nerek.
² Głównie w leczeniu zakażeń patogenami Gram-dodatnimi.
nudności i wymioty, muszą być wstępnie leczeni jednym
z antybiotyków podawanych pozajelitowo (dożylnie)
(tabela 5).
Hospitalizację należy rozważyć, jeśli za pomocą
dostępnych procedur diagnostycznych nie można wykluczyć
czynników komplikujących i/lub gdy pacjent ma
kliniczne objawy posocznicy (LE: 4, GR: B).
Po osiągnięciu poprawy stanu ogólnego u pacjenta
można zastosować schemat leczenia doustnego za
pomocą jednego z wymienionych w tabeli 4 antybiotyków
aktywnych wobec patogenu, aż do ukończenia
1–2-tygodniowego kursu terapii (LE: 1b, GR: B).
U kobiet ciężarnych można również wziąć pod uwagę
ambulatoryjne leczenie odmiedniczkowego zapalenia
nerek odpowiednimi antybiotykami, pod warunkiem,
że objawy są łagodne oraz możliwa jest stała obserwacja
chorej
(Millar i wsp., 1995;)
(Wing i wsp., 1998)
(LE: 1b,
GR: A). W cięższych przypadkach odmiedniczkowego
zapalenia nerek niezbędna jest zazwyczaj hospitalizacja
i leczenie wspomagające. Po uzyskaniu poprawy
klinicznej terapia pozajelitowa może być zamieniona na
terapię doustną na łączny czas leczenia trwający 7–10
dni (LE: 4, GR: B).
U mężczyzn z ZUM przebiegającym z gorączką,
odmiedniczkowym zapaleniem nerek, nawrotowym zakażeniem
lub gdy podejrzewany jest czynnik komplikujący
minimalny czas trwania leczenia wynosi 2 tyg. Zaleca się
stosowanie fluorochinolonów z uwagi na częste współwystępowanie
zapalenia gruczołu krokowego
(Ulleryd i Sandberg, 2003)
(LE: 2a, GR: B).
3C.4.3. Kontrola po leczeniu
Rutynowe badanie ogólne moczu oraz posiewy moczu
po zakończeniu leczenia u pacjentów bezobjawowych
nie są konieczne (LE: 4, GR: C), z wyjątkiem ciężarnych,
u których leczenie miało na celu wyeliminowanie ABU
(rozdział 3B.5.3.).
U pacjentów, u których objawy odmiedniczkowego
zapalenia nerek nie ustępują w ciągu 3 dni od rozpoczęcia
leczenia lub nawracają w ciągu 2 tyg. od zakończenia
leczenia, należy wykonać posiewy moczu i odpowiednie
badania, takie jak USG, scyntygrafię nerek lub tomografię
komputerową (TK, ang. computed tomography) (LE: 4, GR: B).
U chorych nieobciążonych nieprawidłowościami
strukturalnymi i czynnościowymi w obrębie dróg moczowych
należy przyjąć, że organizmy chorobotwórcze nie
są wrażliwe na środki stosowane pierwotnie, i rozważyć
alternatywne leczenie w oparciu o wyniki posiewów
(LE: 4, GR: B).
Należy ponownie rozważyć rozpoznanie niepowikłanego
odmiedniczkowego zapalenia nerek u tych chorych,
u których nawrót choroby spowodowany jest tym samym
patogenem. Odpowiednie kroki diagnostyczne są niezbędne,
aby wykluczyć jakiekolwiek czynniki komplikujące/
ryzyka (LE: 4, GR: C).
3C.5. Nawracające niepowikłane zakażenie
układu moczowego u kobiet
3C.5.1. Ocena diagnostyczna
Nawrotowe ZUM są częste wśród młodych, zdrowych
kobiet, które nie są obciążone nieprawidłowościami anatomicznymi
i fizjologicznymi w zakresie dróg moczowych
(Hooton, 2001) (LE: 2a). W tabeli 2 wymieniono
powszechnie znane czynniki ryzyka.
Wykonanie posiewów moczu jest niezbędne w diagnostyce
nawrotowego ZUM (LE: 4, GR: A). Badania
obrazowe górnych dróg moczowych i cystoskopia nie
są rutynowo zalecane u kobiet z nawrotowym ZUM
(Fowler i Pulaski, 1981)
(LE: 1b, GR: B), lecz powinny być
wykonane w nietypowych przypadkach. Należy również
wykluczyć zaleganie moczu (LE: 4, GR: B).
Nawracające ZUM u mężczyzn nie są omawiane w tym
rozdziale, gdyż mogą być objawem zaostrzenia przewlekłego
bakteryjnego zapalenia gruczołu krokowego (rozdział
3I.). Również nie są omawiane nawracające ZUM
związane z występowaniem czynników komplikujących,
takich jak np. obecność cewników w drogach moczowych,
kamica dróg moczowych i pęcherz neurogenny.
3C.5.2. Postępowanie i kontrola po leczeniu
Zapobieganie nawrotowym ZUM obejmuje: 1) poradę
i zmianę zachowań, m.in. unikanie czynników ryzyka;
2) stosowanie środków o charakterze przeciwbakteryjnym
innych niż antybiotyki; 3) antybiotykową profilaktykę
przeciwbakteryjną, które powinny być stosowane
w tej kolejności. Wskazana jest diagnostyka i jeśli
to możliwe wyeliminowanie urologicznych czynników
komplikujących. Znaczne zaleganie moczu powinno być
leczone w sposób najbardziej optymalny, który obejmuje
również CIC, jeśli jest to konieczne.
3C.5.2.1. Czynniki ryzyka i zmiany zachowań
Wskazywano na szereg zachowań, takich jak pobór
płynów i zachowanie higieny osobistej (np. przyjmowanie
małych ilości płynów, nawykowe postkoitalne
opóźnione oddawanie moczu, podcieranie krocza od
tyłu do przodu po defekacji, rzadkie podmywanie krocza
i noszenie ciasnej bielizny), które mogą zwiększać ryzyko
ZUM. Jednak badania nad tymi czynnikami ryzyka
konsekwentnie negowały ich związek z nawracającymi
ZUM.
U młodych zdrowych kobiet stosunek płciowy jest
uznawany za czynnik ryzyka najczęściej związany
z nawrotowym ZUM. Inne czynniki ryzyka to stosowanie
środków plemnikobójczych, nowy partner seksualny,
dodatni wywiad ZUM u matki, dodatni wywiad
ZUM w dzieciństwie.
Najczęstsze czynniki ryzyka o kobiet w okresie postmenopauzalnym
zostały podane w tabeli 2. Dowody
wskazują na to, że ZUM u dzieci i dorosłych są związane
z mutacjami genetycznymi, które wpływają na układ
odpornościowy
(Hooton, 2010).
3C.5.2.2. Profilaktyka nieantybiotykowa
stnieje wiele przeciwdrobnoustrojowych środków zalecanych
w nawrotowym ZUM, lecz jedynie kilka z nich
jest wynikiem dobrze zaprojektowanych badań, mogących
spełnić wymogi rekomendacji opartych na faktach
(Beerepoot i wsp., 2013;).
(Wagenlehner i wsp., 2013b).
Hormonoterapia
U kobiet w okresie postmenopauzalnym dopochwowa,
lecz nie doustna suplementacja estrogenowa wykazała
korzystne działanie w zapobieganiu nawrotowym ZUM,
jakkolwiek podrażnienie pochwy wystąpiło u 6–20% poddanych
tej terapii
(Beerepoot i wsp., 2013; Raz i Stamm,1993)
(Beerepoot i wsp., 2013;).
(Raz i Stamm,1993).
(LE: 1b, GR: C).
Profilaktyka immunoaktywna
OM-89 (Uro-Vaxom®) jest środkiem wystarczająco dobrze
udokumentowanym, w przypadku którego wykazano
większą skuteczność od placebo w kilku randomizowanych
badaniach. Dlatego też może być zalecany do
immunoprofilaktyki u pacjentek z nawrotowym niepowikłanym
ZUM
(Bauer i wsp., 2002;).
(Beerepoot i wsp.,2013;).
(Naber i wsp., 2009a).
(LE: 1a, GR: B). Jego efektywność
w innych grupach pacjentów oraz skuteczność
w porównaniu do antybiotykowej profilaktyki przeciwdrobnoustrojowej
pozostaje do ustalenia. Szczepionka
dopochwowa Urovac® nieznacznie zmniejszyła częstość
epizodów nawrotowego ZUM. Zastosowanie szczepionki
podstawowej, po której stosuje się szczepionkę przypominającą,
wydłużyło odstęp czasu do ponownego zakażenia
(Beerepoot i wsp., 2013).
(LE: 1a, GR: C). Nadal brakuje
większych badań III fazy dla innych produktów immunoterapeutycznych
podawanych pozajelitowo. W mniejszym
badaniu II fazy StroVac® i Solco-Urovac® okazały
się być skuteczne, gdy podawane były z cyklem dawek
przypominających (LE: 1a, GR: C). W przypadku innych
produktów immunoterapeutycznych brak jest kontrolowanych
badań, dlatego też nie jest możliwe ustalenie
zaleceń co do ich stosowania.
Zastosowanie probiotyków (Lactobacillus spp.)
w profilaktyce
Dostępność probiotyków, których skuteczność w profilaktyce
ZUM została klinicznie udowodniona, obecnie
nie jest powszechna. W profilaktyce powinno stosować
się tylko i wyłącznie szczepy Lactobacillus, na których
przeprowadzono szczegółowe badania.
Uzasadnione jest zastosowanie dostępnych na rynku
probiotyków dopochwowych zawierających L. rhamnosus
GR-1 i L. reuteri RC-14, które można stosować raz lub
dwa razy w tygodniu, w celu zapobiegania nawrotowym
ZUM
(Anukam i wsp., 2006).
(LE: 4, GR: C). Zastosowanie
dopochwowe Lactobacillus crispatus zredukowało częstość
nawrotowych ZUM u kobiet w wieku przedmenopauzalnym
w jednym z badań
(Stapleton i wsp., 2011)
(LE: 1b,
GR: B).
Codzienne stosowanie doustnych produktów zawierających
szczepy Lactobacillus GR-1 i RC-14 jest dopuszczalne,
zważywszy, że mogą one przywrócić naturalną
mikroflorę pochwy, która konkuruje z patogenami wywołującymi
zakażenia układu moczowo-płciowego, a także
zapobiega bakteryjnemu zapaleniu pochwy. Jest to stan,
który znacznie zwiększa ryzyko ZUM
(Wagenlehner i wsp.,2013b).
Jednakże doustnie przyjmowana profilaktyka
probiotykami nie zmniejszyła częstości nawrotowych
ZUM
(Beerepoot i wsp., 2013).
Dlatego też nie jest możliwe
ustalenie zaleceń co do jej stosowania.
Podsumowując, dane zbiorcze z metaanaliz dostępnych
badań z randomizacją nie wykazują żadnych przekonujących
korzyści ze stosowania produktów Lactobacillus
w profilaktyce nawrotowych ZUM. Jednak różnice w skuteczności
pomiędzy dostępnymi preparatami sugerują
konieczność przeprowadzenia dalszych badań, zanim
jakiekolwiek zalecenie dotyczące ich stosowania mogą
być wydane. Rekomendacje: nie stosować poza badaniami
klinicznymi.
Zastosowanie żurawiny w profilaktyce
Poprzednie ograniczone badania sugerują, iż żurawina
(łac. Vaccinium macrocarpon) jest przydatna w zmniejszaniu
częstości ZUM u kobiet
(Kontiokari i wsp., 2001;).
(Stothers, 2002).
Ostatnia metaanaliza 24 badań obejmująca
4473 uczestników wykazała, że produkty żurawinowe
nie zmniejszają znacząco występowania objawowego
ZUM ogółem, ani też w każdej z następujących
podgrup: dzieci z nawracającymi ZUM, osób starszych
i kobiet z nawracającymi ZUM, kobiet w ciąży, chorych na
raka oraz osób z pęcherzem neurogennym lub uszkodzeniem
rdzenia kręgowego
(Jepson i wsp., 2012).
Ze względu
na te sprzeczne wyniki wszelkie zalecenia codziennego
spożycia produktów żurawiny nie mogą być wydane.
Zastosowanie D-mannozy w profilaktyce
W niedawno opublikowanym randomizowanym badaniu
klinicznym z grupą kontrolną otrzymującą placebo wykazano,
że dzienna dawka 2 g D-mannozy była znacznie
skuteczniejsza od placebo i równie skuteczna jak 50 mg
nitrofurantoiny w zapobieganiu nawrotowego ZUM
(Kranjcec i wsp., 2014).
Badanie wykazuje skuteczność
D-mannozy w profilaktyce, lecz jest niewystarczające do
stworzenia rekomendacji. Obecnie D-mannoza powinna
być stosowana wyłącznie w ramach wysokiej jakości
badań klinicznych.
Wlewki dopęcherzowe
Dopęcherzowe wlewki kwasu hialuronowego i siarczanu
chondroityny były używane celem odbudowy warstwy
glukozaminoglikanów w leczeniu śródmiąższowego zapalenia
pęcherza moczowego, pęcherza nadreaktywnego,
popromiennego zapalenia pęcherza moczowego oraz
w profilaktyce nawrotowego zapalenia układu moczowego.
Niedawny przegląd 27 badań klinicznych zakończony
został wnioskiem, że pilnie potrzebne są badania
na dużą skalę, aby podkreślić korzyści z tego typu terapii
(Madersbacher i wsp., 2013).
Dlatego też obecnie nie jest
możliwe ustalenie zaleceń co do ich stosowania.
3C.5.2.3. Profilaktyka antybiotykowa
Profilaktyka antybakteryjna może być podawana ciągle
(codziennie, raz w tygodniu) przez dłuższy czas (3–6 miesięcy)
lub w postaci pojedynczej dawki postkoitalnej.
Ciągła lub postkoitalna profilaktyka antybakteryjna
(Albert i wsp., 2004)
dla zapobiegania nawrotowym ZUM
powinna być rozważana dopiero po próbie doradztwa
i modyfikacji zachowań oraz gdy przedsięwzięte metody
były nieskuteczne (LE: 4, GR: B).
U kobiet z nawracającymi niepowikłanymi zapaleniami
pęcherza moczowego samokontrola i samodzielnie
podjęte leczenie w krótkim schemacie leczenia antybakteryjnego
mogą być brane pod uwagę
(Schaeffer i Stuppy, 1999)
(LE: 2b, GR: A). Wybór antybiotyku jest taki sam
jak w przypadku sporadycznego, niepowikłanego, ostrego
ZUM (tabela 3).
Należy rozważyć profilaktykę postkoitalną u kobiet
w ciąży z wywiadem częstych ZUM przed okresem ciąży,
aby zmniejszyć ryzyko zakażenia
(Pfau i Sacks, 1992)
(LE: 2b, GR: B).
Schematy ciągłej profilaktyki antybakteryjnej u kobiet
z nawracającymi ZUM obejmują np. nitrofurantoinę
makrokrystaliczną 50 mg lub 100 mg raz na dobę, fosfomycynę
3 g co 10 dni, a w trakcie ciąży np. cefaleksynę
125 mg lub 250 mg, alternatywnie cefaklor 250 mg raz
dziennie
(Hooton, 2001).
Wybór antybiotyków powinien być oparty na identyfikacji
mikroorganizmu wywołującego ZUM i jego wrażliwości,
na wywiadzie z chorym dotyczącym uczuleń na
leki oraz po wzięciu pod uwagę niekorzystnych efektów
ekologicznych, w tym potencjału wytworzenia oporności
na wybrany środek przeciwbakteryjny. Korzystając z tych
zasad, należy wziąć pod uwagę kilka kwestii:
yy występowanie ekologicznych efektów ubocznych
doprowadziło do tego, że doustne fluorochinolony
i cefalosporyny nie są już rutynowo zalecane, z wyjątkiem
szczególnych sytuacji klinicznych,
yy ogólnoświatowy wzrost oporności E. coli na trimetoprim
wzbudza duże wątpliwości co do zasadności
stosowania trimetoprimu z sulfonamidami lub bez
sulfonamidów jako skutecznego środka profilaktycznego,
yy niedawno pojawiły się ostrzeżenia agencji rządowych
co do długoterminowego profilaktycznego stosowania
nitrofurantoiny z powodu rzadkich, ale poważnych
płucnych i wątrobowych działań niepożądanych tego
leku
(ansm.sante.fr, 2011).
Ogólnie podkreśla się konieczność ponownego rozpatrzenia
zasadności stosowania długoterminowej profilaktyki
antybakteryjnej w nawrotowych ZUM. W każdym
indywidualnym przypadku należy wziąć pod uwagę alternatywne,
skuteczne środki zapobiegawcze.
3D. POWIKŁANE ZAKAŻENIA UKŁADU MOCZOWEGO Z UROLOGICZNYMI I NEFROLOGICZNYMI CZYNNIKAMI RYZYKA U DOROSŁYCH
3D.1. Wstęp
Rozdział ten jest streszczeniem zaleceń EAU/ICUD na
temat infekcji układu moczowo-płciowego (rozdział 7. –
ZUM u chorych z nefropatiami, po przeszczepie i niedoborami
odpornościowymi, rozdział 8. – ZUM u chorych
z zaburzeniami urologicznymi)
(Naber i wsp., 2010).
Powikłane ZUM są infekcjami powiązanymi ze strukturalnymi
i funkcjonalnymi nieprawidłowościami układu
moczowo-płciowego lub obecnością choroby podstawowej,
która zwiększa ryzyko pojawienia się komplikacji
i poważniejszego przebiegu choroby, niż można by się spodziewać
u chorego nieprezentującego czynników ryzyka
(rozdział 3C.), a także braku powodzenia w leczeniu.
Przykłady czynników ryzyka należących głównie do kategorii
N, U i C klasyfikacji ORENUC podano w tabeli 1.
Wiele rodzajów bakterii może spowodować powikłane
ZUM. To spektrum jest znacznie szersze niż w niepowikłanym
ZUM. Wrażliwość patogenów na środki przeciwdrobnoustrojowe
jest też dużo mniejsza, co jest jatrogennym
powikłaniem leczenia powikłanych ZUM.
Dominującymi patogenami na czele z E.coli są Enterobacteriaceae.
Jednakże niefermentujące (np. Pseudomonas
aeruginosa) i Gram-dodatnie ziarniaki (np. gronkowce
i enterokoki) mogą również odgrywać ważną, zależną
od warunków wyjściowych rolę.
Strategia leczenia uzależniona jest od nasilenia
choroby. Leczenie obejmuje trzy cele: wyeliminowanie
czynnościowych i anatomicznych przeszkód w odpływie
moczu, antybiotykoterapię oraz leczenie wspomagające.
Hospitalizacja chorego jest często nieodzowna. W celu
uniknięcia powstawania szczepów opornych w leczeniu
należy kierować się w miarę możliwości wynikami
posiewu moczu.
Miarą skuteczności terapii po zakończeniu leczenia
chirurgicznego zaburzeń urologicznych lub eliminacji
czynników ryzyka i związanego z nimi ZUM jest posiew
moczu wykonany po 1–2 tyg. po zakończeniu leczenia,
a następnie w zależności od potrzeb klinicznych lub
okresowej kontroli.
3D.2. Klasyfikacja
Czynniki ryzyka niepowikłanych (prostych) oraz powikłanych
(skomplikowanych) ZUM związane z organizmem
pacjenta wymieniono w tabeli 6. Powikłane ZUM
pojawiają się w niejednorodnych grupach pacjentów. Wiek
ani płeć pacjenta nie są częścią per se definicji powikłanego
ZUM. W odniesieniu do rokowania i badań klinicznych
zaleca się zastosowanie podziału pacjentów z powikłanym
ZUM z przyczyn urologicznych na co najmniej
dwie grupy
(Naber, 1999):
yy tych, u których czynniki ryzyka mogą zostać wyeliminowane
przez terapię, np. poprzez usunięcie złogu
lub założonego na stałe cewnika – odpowiednik kategorii
U w klasyfikacji ORENUC (tabela 1),
yy tych, u których czynniki ryzyka nie mogą zostać
wyeliminowane w sposób całkowity lub chociażby
zadowalający w czasie leczenia, np. założony na
stałe cewnik, kamica rezydualna lub pęcherz neurogenny
– odpowiednik kategorii C w klasyfikacji
ORENUC (tabela 1).

3D.3. Rozpoznanie/Diagnostyka
3D.3.1. Objawy kliniczne
Powikłane ZUM w przeciwieństwie do ABU związane
są z występowaniem objawów klinicznych (np. dyzuria,
parcia naglące, objaw Goldflama, ból okolicy nadłonowej
i gorączka). U niektórych chorych objawy mogą być nietypowe,
np. u pacjentów z pęcherzem neurogennym
i w zakażeniach związanych z obecnością cewnika.
Obraz kliniczny może być podobny zarówno do obrazu
ciężkiej postaci obturacyjnego ostrego odmiedniczkowego
zapalenia nerek z rychłą urosepsą, jak również do
pooperacyjnego ZUM związanego z obecnością cewnika,
które może ustąpić samoczynnie po usunięciu cewnika.
Należy również uznać, że objawy, a w szczególności
objawy ze strony dolnych dróg moczowych (LUTS, ang.
lower urinary tract symptoms), nie są spowodowane jedynie
ZUM, lecz również przez inne zaburzenia urologiczne,
takie jak łagodny przerost gruczołu krokowego (BPH, ang.
benign prostatic hyperplasia) lub przezcewkowa resekcja
gruczołu krokowego (TUR-P, ang. transurethral resection
of the prostate).
Niezależnie od zaburzeń urologicznych inne towarzyszące
schorzenia, takie jak cukrzyca (10%) i niewydolność
nerek, które same w sobie mogą być związane
z zaburzeniami urologicznymi
(Sharifi i wsp., 1996),
są
często czynnikami ryzyka powikłanego ZUM.
Znamienna bakteriuria w powikłanym ZUM to miano
≥10⁵ cfu/mL ze środkowego strumienia moczu dla
kobiet oraz ≥10⁴ cfu/mL ze środkowego strumienia
moczu dla mężczyzn
(Rubin i wsp., 1992, 1993).
Dla
moczu pobranego poprzez jednorazowe cewnikowanie
miano to wynosi ≥10⁴ cfu/mL. Ropomocz oznacza ≥10
białych krwinek w polu widzenia (powiększenie ×400)
w osadzie z odwirowanej porcji moczu lub na 1 mL nieodwirowanego
moczu. Do rutynowej oceny zastosowanie
znajduje również metoda paskowa, w tym test na
obecność esterazy leukocytarnej, hemoglobiny i reakcji
azotowej.
3D.3.3. Mikrobiologia
(spektrum i oporność na antybiotyki)
Chorzy z powikłanym ZUM, zarówno poza-, jak
i wewnątrzszpitalnym, zazwyczaj prezentują większą
różnorodność drobnoustrojów z częstszym występowaniem
oporności na środki przeciwdrobnoustrojowe
oraz wyższym wskaźnikiem niepowodzenia leczenia
w przypadku braku możliwości wyeliminowania czynników
ryzyka.
Sama obecność szczepu opornego nie wystarcza do
rozpoznania powikłanego ZUM. Do tego konieczna jest
również obecność nieprawidłowości w zakresie układu
moczowego (anatomicznych lub czynnościowych) lub
istniejąca choroba zasadnicza predysponująca do ZUM.
Wiele rodzajów bakterii może spowodować powikłane
ZUM. To spektrum jest znacznie szersze niż w niepowikłanym
ZUM. Wrażliwość patogenów na środki
przeciwdrobnoustrojowe jest też dużo mniejsza, co jest
jatrogennym powikłaniem leczenia powikłanych ZUM.
Najczęściej hodowanymi drobnoustrojami są E. coli,
Proteus, Klebsiella, Pseudomonas, Serratia spp. i enterokoki.
Dominującymi patogenami są Enterobacteriaceae
(60–75 %)
(Cox i wsp., 1995;).
(Frankenschmidt i wsp., 1997;).
(Nicolle, 1997a).
na czele z E.coli, szczególnie w pierwszorazowych
przypadkach ZUM. Jednakże spektrum może
zmieniać się w czasie oraz w zależności od przebywania
w różnych placówkach medycznych.
3D.3.4. Szczególne rodzaje powikłanych zakażeń
układu moczowego
Kamica moczowa: W podgrupie powikłanych ZUM związanych
z kamicą moczową zakażenia wywołane E. coli
i enterokokami wydają się być mniej istotnymi czynnikami
chorobotwórczymi od Proteus spp. i Pseudomonas
spp.
(Dobardzic i Dobardzic, 1997).
Wśród organizmów ureazo-dodatnich dominują
Proteus, Providencia i Morganella spp. oraz Corynebacterium
urealyticum. Ureazo-dodatnimi organizmami są też do
pewnego stopnia Klebsiella, Pseudomonas, Serratia spp.
oraz gronkowce.
88% pacjentów z kamicą struwitową ma infekcję
dróg moczowych w momencie rozpoznania, z czego 82%
pacjentów zakażonych jest organizmami produkującymi
ureazę
(Emori i Gaynes, 1993).
Enzym ureaza rozkłada
mocznik na dwutlenek węgla i amoniak. Powstały wzrost
stężenia amoniaku w moczu uszkadza warstwę glikozoaminoglikanu,
co z kolei zwiększa przyleganie bakterii
(Parsons i wsp., 1984)
i zwiększa powstawanie kryształów
struwitowych. Te skupiając się, tworzą złogi i inkrustacje
na cewnikach w drogach moczowych
(Dumanski i wsp.,1994).
Kontrowersyjnym pozostaje potencjał patogenny
gronkowców koagulazo-ujemnych oraz paciorkowców
spoza grupy D
(FDA, 1998; Stamm i Hooton, 1993).
W szczególnych warunkach, takich jak w obecności
kamicy lub ciał obcych, gronkowce mogą być istotnymi
czynnikami chorobotwórczymi. Zgodnie z opublikowanymi
raportami
(Frankenschmidt i wsp., 1997; Reid, 1999),
w pozostałych przypadkach gronkowce nie są
tak powszechne w powikłanych ZUM (0–11%).
Nefrektomia powinna być wykonywana tylko w ostateczności,
ponieważ nawet resztkowa czynność nerek
może mieć istotne znaczenie (GR: B).
Cewniki w drogach moczowych: W powikłanych ZUM
związanych z cewnikowaniem różnorodność patogenów
jest podobna
(Wells i wsp., 2004).
Należy też wziąć pod
uwagę obecność biofilmu. Terapia przeciwbakteryjna
może być skuteczna jedynie na wczesnych etapach zakażenia
(Reid, 1999).
Więcej szczegółów można znaleźć
w rozdziale 3F. na temat ZUM związanych z cewnikowaniem.
Wrodzona wielotorbielowatość nerek u dorosłych: Zakażenie
układu moczowego jest znanym powikłaniem
wrodzonej wielotorbielowatości nerek u dorosłych
(APCKD, ang. adult polycystic kidney disease). Objawowe
ZUM występuje u 23–42% pacjentów i są to zazwyczaj
kobiety
(Elzinga i Bennett, 1996).
Uzyskanie pozytywnych
posiewów na standardowych pożywkach laboratoryjnych
może być trudne. Powszechnie występuje ropomocz,
zwłaszcza w późniejszych stadiach choroby. Często
obserwuje się ostre odmiedniczkowe zapalenie nerek
jako powikłanie ropnego zakażenia torbieli
(Sklar i wsp.,1987)
(LE: 3). Przebicie/aspiracja zainfekowanego materiału
z zakażonej torbieli ma zarówno funkcję diagnostyczną
(mikrobiologiczną), jak i terapeutyczną (drenaż).
Nie należy mylić APCKD z nabytymi torbielami nerek
w schyłkowej niewydolności nerek, w której nie występują
predyspozycje do ZUM.
Nie należy mylić APCKD z nabytymi torbielami nerek
w schyłkowej niewydolności nerek, w której nie występują
predyspozycje do ZUM.
3D.3.5. Szczególne rodzaje zakażeń nerek
Bakteryjne ogniskowe zapalenie nerek: Jest ograniczone
do jednego lub kilku segmentów nerki i zwykle ustępuje
po odpowiednim leczeniu. W rzadkich sytuacjach,
zwłaszcza w połączeniu z jakąś przeszkodą, może się
upłynnić, tworząc ropień nerek wymagający drenażu.
Ropień nerki: Może pęknąć do dróg moczowych lub
spenetrować powięź nerki, tworząc ropień okołonerkowy.
Ropień okołonerkowy: Objawami klinicznymi są
dreszcze, gorączka, bóle pleców lub brzucha, tkliwość
okolicy kąta żebrowo-kręgowego, wyczuwalny guz
i zaczerwienienie, obrona z górnych mięśni lędźwiowych
i przykręgosłupowych. U pacjentów obłożnie chorych
ropnie okołonerkowe mogą dawać niewiele objawów.
Dominującymi objawami mogą być niewydolność oddechowa,
niestabilność hemodynamiczna oraz niedrożność
porażenna jelit.
Rozedmowe odmiedniczkowe zapalenie nerek: Jest spowodowane
przez tworzące gaz szczepy E. coli, K. pneumoniae,
E. cloacae w reakcji fermentacji glukozy. Często ma również
wpływ na przeciwległą nerkę. Histopatologicznymi objawami
są martwica brodawek nerkowych, wewnątrznerkowe
zakrzepy żylne i zawał nerki.
Żółtakoziarniniakowe odmiedniczkowe zapalenie nerek:
Charakteryzuje się przewlekłym ropnym zapaleniem
tkanki tłuszczowej torebki, szypuły i miedniczki nerki.
3D.3.6. Zakażenie układu moczowego jako
powikłanie po przeszczepie nerek
Zakażenie układu moczowego jest najczęstszym
zakaźnym powikłaniem po przeszczepie nerek
(Shoskes i Saad, 2010).
Analiza dużej bazy danych wykazała, że
skumulowana częstość występowania ZUM w ciągu
pierwszych 6 miesięcy po przeszczepieniu nerki wynosiła
17% dla obu płci, a po 3 latach – 60% u kobiet i 47%
u mężczyzn
(Abbott i wsp., 2004).
Wykazano sprzeczne
dowody na wpływ typu dawcy (żyjący vs. martwy) na
ryzyko ZUM.
Objawowe ZUM po przeszczepie ma szerokie spektrum
kliniczne od ostrego zapalenia pęcherza moczowego
do odmiedniczkowego zapalenia nerki wszczepionej
i odmiedniczkowego zapalenia pozostawionej nerki.
Czynniki ryzyka obejmują intensywną immunosupresję,
skrajności wieku pacjenta, cukrzycę, przedłużony okres
dializ, zaburzenia odpływu moczu lub zrekonstruowane
dolne drogi moczowe i długotrwałe stosowanie cewników
moczowych i stentów.
Typowe objawy podmiotowe i przedmiotowe ZUM
mogą być podobne do typowych stanów po przeszczepie,
włącznie z obkurczeniem pęcherza na cewniku, podrażnieniem
wywołanym przez cewniki typu JJ, małą
objętością dysfunkcyjnego pęcherza, wielomoczem
z powodu wczesnej utraty zdolności zagęszczania
moczu, zatrzymaniem moczu i gorączką oraz dolegliwościami
bólowymi graftu wywołanymi ostrym odrzucaniem
przeszczepu. Ponadto objawy ZUM mogą być
nietypowe. Immunosupresja może tłumić gorączkę
w mechanizmie blokowania interleukiny 1 (IL-1, ang.
interleukin 1) i czynnika martwicy nowotworu (TNF,
ang. tumor necrosis factor). Leukocytoza może nie występować
ze względu na zahamowanie czynności szpiku
kostnego. Przeszczepione nerki są odnerwione i mogą
nie być bolesne nawet w obliczu odmiedniczkowego zapalenia
nerek.
Za ZUM u chorych po przeszczepie odpowiadają najczęściej
typowe patogeny dróg moczowych. Należy jednak
również pamiętać, że wywołane mogą być także przez
komensale, grzyby, prątki i wirusy. Niektóre badania
sugerują, że wystąpienie ZUM po przeszczepieniu ma
negatywny wpływ na przeżycie i funkcję graftu, mimo
że związek przyczynowo-skutkowy nie został ustalony
(Abbott i wsp., 2004; ).
(Shoskes i Saad, 2010).
3D.4. Postępowanie
Strategia leczenia uzależniona jest od nasilenia choroby.
Odpowiednia terapia przeciwbakteryjna oraz eliminacja
zaburzeń urologicznych są niezbędne. Leczenie podtrzymujące
włączane jest w razie potrzeby. Hospitalizacja
jest często konieczna w zależności od stopnia nasilenia
choroby.
3D.4.1. Dobór antybiotyków
Empiryczne leczenie objawowe powikłanego ZUM
wymaga znajomości spektrum możliwych patogenów
oraz wzoru oporności i wrażliwości na antybiotyki na
danym obszarze, a także stopnia nasilenia zaburzeń urologicznych
(w tym czynności nerek).
Bakteriemia jest zazwyczaj zgłaszana zbyt późno,
aby mogła mieć wpływ na wybór antybiotyków. Jednak
podejrzenie bakteriemii musi wpływać na dobór odpowiedniego
leczenia empirycznego. Ciężkość choroby i wyjściowy
stan urologiczny mają podstawowe znaczenie
dla rokowania.
Opublikowano wiele badań na temat wykorzystania
specyficznych terapii przeciwdrobnoustrojowych w powikłanych
ZUM. Niestety większość doniesień ma jedynie
ograniczone zastosowanie w codziennej opiece nad
pacjentem, z takich powodów, jak:
yy słaba charakterystyka populacji pacjentów,
yy niejasna ocena stopnia nasilenia choroby,
yy brak precyzyjnego odróżnienia zakażeń szpitalnych
i pozaszpitalnych,
yy urologiczny wynik leczenia jest rzadko brany pod
uwagę.
Częste stosowanie antybiotyków, zwłaszcza gdy są stosowane
empirycznie w grupie chorych z wysokim prawdopodobieństwem
nawrotu zakażenia, doprowadza do
powstania opornych drobnoustrojów. Gdy jest to tylko
możliwe, leczenie empiryczne powinno zostać zastąpione
przez celowaną terapię skorygowaną zgodnie z wynikiem
posiewu moczu. Dlatego należy zabezpieczyć próbkę
moczu na posiew przed rozpoczęciem leczenia, a wybór
środka przeciwbakteryjnego powinien zostać poddany
ponownej ocenie po uzyskaniu wyniku posiewu
(Nicolle,1997a).
Do tej pory nie wykazano, aby jakiś środek lub
grupa środków była lepsza niż antybiotyk, na który jest
wrażliwy patogen.
U chorych z niewydolnością nerek niezależnie od etiologii
dawka leku powinna zostać skorygowana, a jego
stężenie w osoczu monitorowane.
Jeśli leczenie empiryczne jest konieczne, przeciwbakteryjne
spektrum antybiotyku powinno obejmować
najistotniejsze czynniki chorobotwórcze (GR: A). Zaleca
się użycie fluorochinolonów, które są głównie wydalane
z moczem, cefalosporyn z grupy 3a lub aminoglikozydów
(LE: 1b, GR: B). W przypadku niepowodzenia leczenia
początkowego lub w przypadku klinicznie ciężkiej infekcji
powinien zostać włączony antybiotyk o szerszym spektrum,
który jest również aktywny wobec Pseudomonas
(Carson i Naber, 2004)
(LE: 1b, GR: B), jak np. cefalosporyny
z grupy 3b, acylaminopenicyliny (piperacylina)
z inhibitorem β-laktamaz (BLI, ang. β-lactamase inhibotor)
lub karbapenemy w połączeniu z aminoglikozydami
lub bez (LE: 1b, GR: B). Należy wziąć pod uwagę
miejscowe wzory oporności, które mogą wpływać na
zalecenia dotyczące leczenia. Opcje leczenia antybakteryjnego
są przedstawione w tabeli 7 i w dodatku 4.3
(zalecenia leczenia przeciwbakteryjnego w urologii).
Pacjentów można na ogół leczyć ambulatoryjnie.
W cięższych przypadkach (hospitalizacja pacjentów)
antybiotyki należy podawać dożylnie. Po kilku dniach
leczenia pozajelitowego i uzyskaniu poprawy klinicznej
pacjenci mogą zostać przełączeni na terapię doustną.

Leczenie powinno zostać zrewidowane po identyfikacji
patogenów oraz uzyskaniu antybiogramu. Skuteczne
leczenie powikłanego ZUM zawsze powinno łączyć skuteczną
terapię przeciwbakteryjną, wyeliminowanie zaburzeń
urologicznych lub innych chorób oraz intensywną
opiekę medyczną.
3D.4.2. Czas trwania antybiotykoterapii
Zalecany okres leczenia wynosi 7–14 dni, lecz powinien
on być ściśle skorelowany z leczeniem podstawowej
choroby
(Rubin i wsp., 1992).
W zależności od sytuacji
klinicznej konieczne może być wydłużenie terapii do
21 dni
(Rubin i wsp., 1993).
3D.4.3. Leczenie w przypadkach szczególnych
3D.4.3.1. Wrodzona wielotorbielowatość nerek
u dorosłych
U pacjentów z APCKD może wystąpić ostre odmiedniczkowe
zapalenie nerek jako powikłanie ropnego zakażenia
torbieli w postaci nawrotowego odmiedniczkowego zapalenia
nerek, a nawet sepsy. Leczenie wymaga długiego
podawania wysokich dawek najlepiej fluorochinolonów,
a następnie terapii podtrzymującej. Drenaż może być
konieczny (rozdział 3D.3.4.). Po przeszczepie ogólne przeżycie
graftu i przeżycie pacjentów nie różnią się pomiędzy
grupami APCKD a grupami kontrolnymi
(Stiasny i wsp.,2002)
(LE: 2a). Jednak pomimo ścisłej kontroli ZUM
epizody posocznicy nadal są istotną przyczyną śmierci
w tej grupie chorych. Tak więc obustronna nefrektomia
może być jedynym rozwiązaniem.
3D.4.3.2. Szczególne rodzaje skomplikowanych
zakażeń układu moczowego
Kamica moczowa: Przyrost kamienia wystąpi w przypadku
stałej obecności czynników ryzyka kamicy oraz istnienia
zakażenia. Konieczne jest zarówno doszczętne usunięcie
złogów, jak i odpowiednia terapia przeciwbakteryjna.
Eradykacja infekcji prawdopodobnie wyeliminuje wzrost
złogów struwitowych
(Griffith i Osborne, 1987).
Należy
rozważyć długoterminową terapię przeciwdrobnoustrojową,
jeśli niemożliwe jest całkowite usunięcie złogów
(Beck i Riehle, 1991).
Cewniki w drogach moczowych: Aktualne dane nie
uzasadniają leczenia bezobjawowego bakteriomoczu,
zarówno podczas cewnikowania krótkoterminowego
(<30 dni), jak i podczas długotrwałego cewnikowania,
ponieważ będzie ono sprzyjać rozwojowi szczepów opornych
(Alling i wsp., 1975;).
( Warren i wsp., 1982a).
W przypadku
krótkoterminowego cewnikowania antybiotyki
mogą opóźnić wystąpienie bakteriomoczu, ale nie zmniejszają
powikłań
(Yoshikawa i wsp., 1996).
Objawowe powikłane ZUM związane z założonym na
stałe cewnikiem powinno być leczone antybiotykiem o jak
najwęższym spektrum aktywności w oparciu o wyniki
posiewu oraz antybiogramu. Optymalny czas trwania
nie został dotychczas ustalony. Zarówno zbyt krótki, jak
i zbyt długi czas leczenia może spowodować powstanie
szczepów opornych. 5–7-dniowe leczenie wydaje się rozsądnym
kompromisem.
Uraz rdzenia kręgowego: W przypadku przewlekłego
zakażenia z podejrzeniem zalegania moczu powinno
zostać przeprowadzone pełne badanie urodynamiczne
z oceną funkcji pęcherza. Priorytetem jest zapewnienie
prawidłowego drenażu pęcherza najlepiej poprzez CIC
w celu ochrony dróg moczowych
(NIDRR, 1992;).
(Stöhrer i wsp., 2009).
Powszechnie przyjmuje się, że nie powinno się leczyć
ABU u pacjentów z uszkodzeniem rdzenia kręgowego,
nawet w przypadkach stosowania CIC, ponieważ wydaje
się, że celowo wywołana ABU szczepami E. coli może zapobiegać
nawrotom ZUM
(Darouiche i wsp., 2005;).
(Sunden i wsp., 2010).
Zaledwie w kilku badaniach oceniano dobór
najbardziej odpowiedniego środka i czas trwania terapii
u pacjentów z uszkodzeniem rdzenia kręgowego i objawowymi
epizodami ZUM. Obecnie najczęściej stosowane
jest 7–10-dniowe leczenie. Nie stwierdzono przewagi
jednego środka lub klasy środków przeciwdrobnoustrojowych
w tej grupie chorych. Leczenie lub profilaktyka ABU
u pacjentów z urazem rdzenia kręgowego nie zmniejsza
częstotliwości późniejszych objawowych zakażeń.
3D.4.3.3. Szczególne rodzaje zakażeń nerek
Szczególne rodzaje zakażeń nerek z tworzeniem ropni
są rzadko spotykane. Leczenie przeciwdrobnoustrojowe
antybiotykiem o szerokim spektrum może być
skuteczne na początku infekcji lub w przypadku ropni
wielkości do 3 cm lub mniejszych (wielkość względna)
(rozdział 3D.3.5.). Większe ropnie zazwyczaj muszą być
zdrenowane. W rzadkich przypadkach koniecznością
jest nefrektomia.
3D.4.3.4. Zakażenia układu moczowego jako
powikłanie po przeszczepie nerek
Konieczność usunięcia przeszkody w drogach moczowych
lub usunięcia ewentualnego ogniska infekcji w końcowym
stadium choroby nerek jest większa u pacjentów zakwalifikowanych
do przeszczepu nerki. Mimo tego wyniki
nefrektomii nerek zbliznowaciałych lub z wodonerczem
są rozczarowujące. Istnieje niedostatek prospektywnych
kontrolowanych badań, które mogłyby dać podstawy do
określenia wytycznych co do profilaktyki i terapii ZUM
w kategoriach zastosowanej terapii lub czasu trwania
leczenia. Większość programów zaleca rutynowe stosowanie
profilaktyki ZUM przez co najmniej 6 miesięcy
(GR: B). Ryzyko ZUM po przeszczepie można zmniejszyć
poprzez wczesne usunięcie ciał obcych z dróg moczowych,
takich jak cewniki dopęcherzowe czy cewniki szynujące
moczowody (JJ) (GR: C).
Z wyboru powinno się podawać antybiotyki bakteriobójcze
w przeciwieństwie do bakteriostatycznych, gdyż
te mogą być niewystarczające do leczenia zakażeń, układ
odpornościowy nie jest bowiem w stanie wyeliminować
bakterii. Czynniki ryzyka powinny zostać usunięte na
tyle, na ile to możliwe (np. optymalna kontrola glikemii
w cukrzycy, usunięcie lub wymiana stentów i cewników,
zminimalizowanie immunosupresji w oparciu o osoczowe
stężenia leków i przebieg kliniczny). Znane są interakcje
między antybiotykami stosowanymi w leczeniu
ZUM po przeszczepie a lekami immunosupresyjnymi.
Cyprofloksacyna może podnieść stężenie inhibitora
kalcyneuryny (CNI, ang. calcineurin inhibitor), czego nie
wywoła lewofloksacyna i ofloksacyna
(Borras-Blasco i wsp.,2005).
Erytromycyna i środki przeciwgrzybicze hamują
cytochrom P450 i zwiększają poziom CNI. Ryfampicyna,
imipenem i cefalosporyny mogą zmniejszyć poziom CNI.
Nefrotoksyczne antybiotyki (np. aminoglikozydy, amfoterycyna)
mogą mieć działanie synergiczne z CNI, zwiększające
ryzyko uszkodzenia nerek.
Zakażenie układu moczowego może współistnieć
z chorobami wirusowymi powszechnymi po transplantacji
(np. wirus cytomegalii). Odmiedniczkowe zapalenie
nerek w nerce przeszczepionej może powodować
zwiększenie stężenia kreatyniny w surowicy, jednakże
infekcja może nie być jedyną przyczyną zmniejszonej
czynności nerek. Należy wykluczyć inne przyczyny (np.
przeszkody w drogach moczowych, odrzucenie przeszczepu,
toksyczność leków). Brak satysfakcjonującej
odpowiedzi na wdrożone leczenie powinien skłonić do
wykonania biopsji nerek celem wykluczenia odrzucenia
lub innych stanów patologicznych (np. nawrót choroby
podstawowej).
Bezobjawowa bakteriuria po przeszczepie nerki nie
wymaga leczenia wykraczającego poza ramy standardowej
profilaktyki (GR: C)
(Shoskes i Saad, 2010).
3D.5. Kontrola po leczeniu
Wzrost prawdopodobieństwa udziału drobnoustrojów
opornych w powikłanych ZUM jest kolejnym elementem
składowym tych zakażeń. Nie jest to bezpośrednio związane
z nieprawidłowościami dróg moczowych, lecz
z faktem, że pacjenci z powikłanym ZUM mają tendencje
do nawrotowych zakażeń
(Nicolle, 1997a).
Z tych
powodów powinno się zidentyfikować patogeny i określić
ich wrażliwość przed zakończeniem i po zakończeniu
leczenia przeciwbakteryjnego.
3E. SEPSA Z PUNKTEM WYJŚCIA Z UKŁADU MOCZOWEGO (UROSEPSA)
3E.1. Wstęp
Urosepsa powinna zostać zdiagnozowana na jak najwcześniejszym
etapie, zwłaszcza w przypadku powikłanych
ZUM. Zespół układowej odpowiedzi zapalnej
znany jako SIRS (ang. systemic inflammatory response syndrome)
– gorączka lub hipotermia, hiperleukocytoza lub
leukopenia, tachykardia, przyspieszony oddech – jest
uznawany za pierwsze zdarzenie w kaskadzie prowadzącej
do niewydolności wielonarządowej (rycina 1).
Śmiertelność znacząco wzrasta w ciężkiej sepsie lub we
wstrząsie septycznym, chociaż prognoza w urosepsie
ogółem jest lepsza niż w innych rodzajach sepsy.
Leczenie urosepsy wymaga kombinacji odpowiedniej
terapii wspomagającej funkcje życiowe, odpowiedniej
i szybkiej terapii antybiotykowej, działań pomocniczych
(jak np. aminy sympatykomimetyczne, hydrokortyzon,
kontrola glikemii) i optymalnego leczenia zaburzeń
dróg moczowych (LE: 1a, GR: A). Odbarczenie zastoju
w drogach moczowych jest niezbędne jako leczenie pierwszego
rzutu (LE: 1b, GR: A). Zaleca się leczenie wielospecjalistyczne
we współpracy ze specjalistami intensywnej
terapii i specjalistami chorób zakaźnych (LE: 2a, GR: B).
Urosepsa jest związana zarówno z zakażeniami
pozaszpitalnymi, jak i zakażeniami związanymi z opieką
zdrowotną. Większości wewnątrzszpitalnych przypadków
urosepsy można uniknąć za pomocą środków zapobiegania
zakażeniom szpitalnym, jak np. ograniczenia czasu
hospitalizacji, wczesnego usuwania założonych na stałe
cewników, unikania niepotrzebnego cewnikowania cewki
moczowej, poprawnego stosowanieaukładów zamkniętych
drenażu dróg moczowych oraz dbałości o nieskomplikowane
techniki codziennej aseptyki w celu uniknięcia
zakażeń krzyżowych (LE: 2a, GR: B).
Zakażenia układu moczowego mogą objawiać się jako
bakteriomocz z towarzyszącymi ograniczonymi objawami
klinicznymi, posocznica lub ciężka posocznica,
w zależności od rozległości zakażenia – miejscowego
lub ogólnoustrojowego. Sepsę rozpoznaje się, gdy kliniczne
objawy zakażenia towarzyszą objawom ogólnoustrojowym
stanu zapalnego (gorączka lub hipotermia,
tachykardia, tachypnoe, leukocyturia lub leukopenia).
Na ciężką sepsę wskazuje obecność objawów zaburzeń
czynności narządowej. Natomiast na wstrząs septyczny
wskazuje obecność utrzymującego się niedociśnienia
i związanego z nim niedotlenienia tkanek.
3E.2. Epidemiologia, etiologia i patofizjologia
Zakażenia układu moczowego mogą objawiać się jako
bakteriomocz z towarzyszącymi ograniczonymi objawami
klinicznymi, posocznica lub ciężka posocznica, w zależności
od rozległości zakażenia – miejscowego lub ogólnoustrojowego.
Należy jednak pamiętać, że stan pacjenta
może zmienić się od niegroźnego do zagrażającego życiu
stanu w bardzo krótkim czasie. Sepsę rozpoznaje się,
gdy kliniczne objawy zakażenia towarzyszą objawom
ogólnoustrojowym stanu zapalnego (gorączka lub hipotermia,
tachykardia, tachypnoe, leukocyturia lub leukopenia).
Ciężka sepsa jest określona poprzez obecność
objawów zaburzeń czynności narządowej. Natomiast
wstrząs septyczny poprzez obecność utrzymującego się
niedociśnienia i związanego z nim niedotlenienia tkanek.
Śmiertelność związana z ciężką sepsą jest różna
w zależności od źródła narządowego
(Martin i wsp., 2003),
W posocznicy wywodzącej się z układu moczowego
obserwuje się zazwyczaj niższą śmiertelność od
pochodzącej z innych narządów
(Hotchkiss i Karl, 2003).
Sepsa jest częstsza u mężczyzn niż u kobiet
(Rosser i wsp.,1999).
W ostatnich latach występowanie sepsy wzrasta
o ok. 8,7% rocznie
(Martin i wsp., 2003),
lecz związana
z nią śmiertelność spadła, co sugeruje lepsze wyniki
leczenia pacjentów (łącznie śmiertelność wśród hospitalizowanych
spadła z 27,8% do 17,9% od 1995 r. do 2000 r.)
(Brun-Buisson i wsp., 2004).
Chociaż liczba przypadków
posocznicy wywołanej przez grzyby wzrosła, to wciąż
jednak bakterie Gram‑dodatnie
są dominującymi patogenami
wywołującym posocznicę, a bakterie Gram‑ujemne
przeważają wśród czynników sprawczych urosepsy.
W urosepsie, podobnie jak w innych typach posocznicy,
ciężkość przebiegu choroby zależy przede wszystkim od
nasilenia reakcji organizmu pacjenta. Wśród najbardziej
narażonych na rozwój urosepsy są: pacjenci w wieku podeszłym;
chorzy na cukrzycę; pacjenci z obniżoną odpornością,
jak np. biorcy przeszczepów, pacjenci onkologiczni
otrzymujący chemioterapię lub otrzymujący kortykosteroidy
oraz chorzy z AIDS. Przebieg urosepsy zależy
również od czynników lokalnych, takich jak: kamica dróg
moczowych, niedrożność na jakimkolwiek poziomie dróg
moczowych, wrodzona uropatia, zaburzenia neurogenne
pęcherza lub zabiegi endoskopowe. Jednak u wszystkich
pacjentów wpływ może mieć rodzaj bakterii, które są
zdolne do wywołania zapalenia w obrębie dróg moczowych.
Ponadto obecnie uznaje się, że SIRS może występować
bez infekcji (np. w przypadku zapalenia trzustki,
oparzenia lub wstrząsu nieseptycznego)
(Bone i wsp., 1992).
3E.3. Klasyfikacja
Dla celów terapeutycznych kryteria diagnostyczne
posocznicy powinny identyfikować pacjentów we wczesnym
stadium choroby, co powinno skłonić urologów
i specjalistów anestezjologii i intensywnej terapii do rozpoznawania
i leczenia zakażeń, zastosowania odpowiedniej
terapii oraz monitorowania niewydolności narządowej
i innych powikłań.
3E.4. Diagnostyka
Zakażenia układu moczowego rozpoznaje się na podstawie
objawów, badania fizykalnego, badań ultrasonograficznych
i radiologicznych oraz wyników badań
laboratoryjnych, takich jak bakteriomocz i leukocyturia.
Stosuje się następujące definicje (tabela 8):
yy posocznica (sepsa) to ogólnoustrojowa odpowiedź na
zakażenie. Objawy SIRS, które dawniej były uważane
za „niezbędne” do rozpoznania posocznicy
(Bone i wsp., 1992).
są obecnie uważane za objawy alarmowe
(Levy i wsp., 2003). Uwzględnionych musi być
wiele innych objawów klinicznych i biologicznych,
yy ciężka sepsa związana jest z zaburzeniami czynności
narządów,
yy wstrząs septyczny to utrzymywanie się hipoperfuzji
lub hipotensji pomimo prowadzenia resuscytacji płynowej,
yy uporczywy wstrząs septyczny definiuje się brakiem
odpowiedzi na leczenie.
3E.4.1. Patofizjologia i markery biochemiczne
Mikroorganizmy docierają do dróg moczowych w drodze
wstępującej, krwiopochodnej lub naczyniami limfatycznymi.
Aby rozwinęła się urosepsa, patogeny muszą przedostać
się do krwiobiegu. Niebezpieczeństwo bakteriemii

wzrasta w ciężkich ZUM, takich jak odmiedniczkowe
zapalenie nerek czy ostre bakteryjne zapalenie gruczołu
krokowego, i jest zwiększone w obecności przeszkody
w drogach moczowych. E. coli jest nadal najczęstszym
czynnikiem sprawczym. W wielu krajach niektóre
szczepy bakterii mogą być oporne na działanie chinolonów
lub cefalosporyn trzeciej generacji. Niektóre
mikroorganizmy są wielolekooporne, tak jak oporny
na metycylinę Staphylococcus aureus, Pseudomonas aeruginosa
i Serratia spp., a zakażenia przez nie wywołane są
trudne do wyleczenia. Najczęściej posocznica rozwija
się u chorych obciążonych np. cukrzycą lub immunosupresją,
z typowymi objawami uogólnionej posocznicy
związanej z lokalnymi objawami zakażenia. Śmiertelność
wynosi 20–40%.
3E.4.1.1. Cytokiny jako markery reakcji septycznej
Cytokiny są zaangażowane w patogenezę sepsy. Są to
peptydy regulujące amplitudę i czas trwania reakcji
zapalnej gospodarza. Są uwalniane z różnych komórek,
w tym z monocytów, makrofagów i komórek śródbłonka
w odpowiedzi na różne bodźce zakaźne. Wiążąc się ze specyficznymi
receptorami na powierzchni innych komórek,
cytokiny zmieniają ich zachowania w reakcji odpowiedzi
zapalnej. Skomplikowana równowaga pomiędzy prozapalnymi
i przeciwzapalnymi reakcjami zmienia się w ciężkiej
sepsie. Po wstępnej fazie mechanizmów prozapalnych
następuje faza immunosupresyjna. Innymi cytokinami
związanymi z posocznicą są interleukiny (IL-1, -6, -8)
oraz czynnik martwicy nowotworów (TNF-α). Sepsa
może spowodować, że układ odpornościowy będzie
znacznie ograniczony i niezdolny do zwalczenia patogenów
lub poddany nadmiernej aktywacji reakcji zapalenia,
lub obu reakcjom naraz. Genetyczna predyspozycja
jest prawdopodobnym wyjaśnieniem posocznicy w niewielkiej
grupie pacjentów. Mechanizmy niewydolności
wielonarządowej i śmierci u pacjentów z posocznicą są
tylko częściowo poznane
(Hotchkiss i Karl, 2003).
3E.4.1.2. Prokalcytonina jako marker sepsy
Prokalcytonina jest propeptydem kalcytoniny pozbawionym
aktywności hormonalnej. Zwykle jej poziom
jest niewykrywalny u zdrowych ludzi. Podczas ciężkich
zakażeń uogólnionych (bakteryjne, grzybicze
i pasożytnicze) z manifestacjami ogólnoustrojowymi
poziom prokalcytoniny może wzrosnąć do >100 ng/mL.
W przeciwieństwie do tego podczas poważnych zakażeń
wirusowych lub reakcji zapalnych pochodzenia nieinfekcyjnego
stężenie prokalcytoniny wykazuje jedynie
umiarkowane zwiększenie lub jego brak. Dokładne
miejsce produkcji prokalcytoniny podczas sepsy nie
jest znane. Monitoring prokalcytoniny może być użyteczny
u pacjentów narażonych na rozwój SIRS pochodzenia
zakaźnego. Wysokie stężenie prokalcytoniny
lub nagłe zwiększenie jej stężenia u tych pacjentów
powinno skłaniać do poszukiwania źródła infekcji.
Prokalcytonina może być użyteczna w różnicowaniu
zakaźnych i niezakaźnych przyczyn ciężkiego stanu
zapalnego
(Brunkhorst i wsp., 2000;).
(Harbarth i wsp., 2001).
lecz obecnie nie może być rekomendowana jako narzędzie
diagnostyczne.
3E.5. Postępowanie
3E.5.1. Profilaktyka
Wstrząs septyczny jest najczęstszą przyczyną zgonów
u chorych hospitalizowanych z powodu zakażeń pozaszpitalnych
i wewnątrzszpitalnych (20–40%). Sepsa
zapoczątkowuje kaskadę zdarzeń, która rozwija się do
ciężkiej sepsy, a jej kontinuum jest wstrząs septyczny.
Leczenie urosepsy wymaga połączenia leczenia przyczyn
(niedrożność dróg moczowych), odpowiedniej
opieki wspomagającej funkcje życiowe i odpowiedniej
antybiotykoterapii
(Hotchkiss i Karl, 2003).
W celu osiągnięcia
jak najlepszego efektu leczniczego zaleca się, aby
urolodzy współpracowali ze specjalistami intensywnej
terapii i specjalistami chorób zakaźnych.
3E.5.1.1. Środki zapobiegawcze o skuteczności
potwierdzonej lub prawdopodobnej
Najbardziej skuteczne metody zapobiegania wewnątrzszpitalnych
przypadków urosepsy są takie same jak te stosowane
celem zapobiegania innym zakażeniom wewnątrzszpitalnym
(Carlet i wsp., 1994;):
( Riedl i wsp., 1999):
izolacja wszystkich pacjentów zakażonych organizmami
wielolekoopornymi, aby uniknąć krzyżowego
zakażenia,
racjonalne stosowanie środków przeciwbakteryjnych
w profilaktyce i leczeniu rozpoznanych zakażeń w celu
uniknięcia wytworzenia szczepów opornych; antybiotyki
powinny zawsze być dobrane zgodnie z występowaniem
dominujących patogenów w danym środowisku
szpitalnym,
zmniejszenie okresu hospitalizacji – powszechnie
wiadomo, że długie okresy hospitalizacji przed zabiegiem
mogą prowadzić do zwiększenia częstości występowania
zakażeń wewnątrzszpitalnych,
wczesne usunięcie cewnika z cewki moczowej, jeśli
tylko pozwala na to stan pacjenta. Ryzyko wewnątrzszpitalnych
zakażeń wzrasta u pacjentów zacewnikowanych
(dotyczy to również cewników moczowodowych
(DeGroot-Kosolcharoen i wsp., 1988).
Profilaktyka
antybiotykowa nie zapobiega kolonizacji cewnika
moczowodowego, która pojawia się u 100% pacjentów
z zainstalowanym na stałe cewnikiem moczowodowym
i u 70% tych z czasowo założonym cewnikiem,
zastosowanie zamkniętego systemu drenażu i minimalizacja
przerw w okresach szczelności systemu, np.
podczas pobierania próbki moczu i wymiany worka
zbiorczego,
zastosowanie metod jak najmniej inwazyjnych w celu
odbarczenia zastoju w drogach moczowych do czasu
stabilizacji stanu ogólnego pacjenta,
dbałość o nieskomplikowane codzienne techniki
zapewniające aseptykę, w tym rutynowe stosowanie
rękawiczek jednorazowych, częstą dezynfekcję rąk,
używanie środków zwalczania chorób zakaźnych
celem zapobiegnięcia infekcji krzyżowych.
3E.5.1.2. Odpowiednia okołooperacyjna profilaktyka
antybakteryjna
Temat okołooperacyjnej profilaktyki przeciwbakteryjnej
omówiono w rozdziale 3N. Potencjalne działania niepożądane
antybiotyków należy wziąć pod uwagę przed ich
podaniem w schemacie profilaktycznym.
3E.5.1.3. Środki zapobiegawcze o dyskusyjnej
skuteczności oraz przynoszące efekt
przeciwny
Do środków zapobiegawczych o dyskusyjnej skuteczności
oraz przynoszących efekt przeciwny należą:
wlewki antybiotyków lub środków antyseptycznych
do cewników i worków drenażowych,
stosowanie cewników moczowych pokrytych antybiotykami
(Pickard i wsp., 2012)1,
ciągłe lub okresowe irygacje pęcherza antybiotykami
lub środkami antyseptycznymi – zwiększające niebezpieczeństwo
zakażenia bakteriami opornymi
(Carlet i wsp., 1994; Persky i wsp., 1992),
rutynowe podawanie leków przeciwbakteryjnych
u pacjentów cewnikowanych, co zmniejsza częstość
występowania bakteriomoczu tylko na kilka dni,
lecz zwiększa ryzyko infekcji bakteriami wielolekoopornymi
(Carlet i wsp., 1994; Persky i wsp., 1992),
1 Cewniki powlekane lub impregnowane środkami przeciwdrobnoustrojowymi
mogą być skuteczne w redukcji bakteriomoczu, ale nie przekłada
się to na korzyści kliniczne pod względem wystąpienia objawowego ZUM.
Zastosowanie ich wskazane jest u pacjentów z obniżoną
odpornością.
3E.5.2. Leczenie

3E.5.2.1. Odbarczenie przeszkody w odpływie moczu
Drenaż przeszkody w drogach moczowych i usunięcie
ciał obcych, takich jak cewniki moczowe lub kamienie,
powinny prowadzić do ustąpienia objawów i wyzdrowienia.
Są to kluczowe elementy w strategii leczenia
urosepsy. Stan ten jest bezwzględnym wskazaniem do
natychmiastowego leczenia.

3E.5.2.2. Terapia przeciwdrobnoustrojowa
Początkowe przeciwbakteryjne leczenie empiryczne
powinno mieć szerokie spektrum działania i następnie
być dostosowane na podstawie wyników posiewów.
Dawkowanie antybiotyków ma zasadnicze znaczenie
u pacjentów z zespołem posocznicy i powinno być
wysokie, z wyjątkiem pacjentów z niewydolnością
nerek. Środki przeciwdrobnoustrojowe należy podawać
nie później niż w 1 godz. od postawienia klinicznego
podejrzenia sepsy (rycina 3). Opcje leczenia są zestawione
w załączniku 4.3. oraz 4.4.
3E.5.2.3. Leczenie uzupełniające
Leczenie równowagi wodno-elektrolitowej jest kluczowym
elementem opieki nad pacjentem z zespołem
sepsy, szczególnie gdy przebieg kliniczny komplikuje
wystąpienie wstrząsu
(Gluck i Opal, 2004;),
(Persky i wsp.,1992),
Zastosowanie ludzkiej albuminy jest kwestią
sporną. Wykazano, że wcześnie podjęta ukierunkowana
terapia ma istotny wpływ na zmniejszenie śmiertelności
(Rivers i wsp., 2001).
Zwiększenie objętości płynów
i leczenie wazokonstrykcyjne mają istotny wpływ na
wynik. Interwencja na wczesnym etapie przy zastosowaniu
odpowiednich środków w celu utrzymania odpowiedniej
perfuzji tkankowej i sprawnie funkcjonującej
wymiany gazowej poprzez wdrożenie terapii płynowej,
stabilizację ciśnienia tętniczego krwi i zapewnienie
wystarczającej zdolności transportu tlenu jest bardzo
skuteczna.
Hydrokortyzon (dawkowanie jest sprawą dyskusyjną)
jest przydatny u chorych z niewydolnością osi przysadka–
kora nadnerczy (test adrenokortykotropowy)
(Annane i wsp., 2002).
Ścisła kontrola glikemii we krwi poprzez podawanie
insuliny w dawce do 50 j./h wiąże się ze zmniejszeniem
śmiertelności
(van den Berghe i wsp., 2001).
Najlepsza strategia postępowania została podsumowana
i sklasyfikowana zgodnie z opartą na faktach
metodologią w niedawno opublikowanych „Wytycznych
przeżycia sepsy” (Surviving Sepsis Guidelines)
(Dellinger i wsp., 2004).
Zespół sepsy w urologii jest ciężkim stanem ze stosunkowo
wysoką śmiertelnością. Niedawno rozpoczęta
kampania „Wytyczne przeżycia sepsy” (Surviving Sepsis
Guidelines) ma na celu zmniejszenie śmiertelności o 25%
w ciągu najbliższych kilku lat
(Dellinger i wsp., 2004).
Wczesne rozpoznanie objawów może zmniejszyć śmiertelność
poprzez wcześniejsze leczenie chorób układu
moczowego, jak np. przeszkody w odpływie moczu
lub kamicy nerkowej. Odpowiednie środki podtrzymywania
funkcji życiowych i zastosowanie odpowiedniej
antybiotykoterapii zapewniają najlepsze warunki
do poprawy przeżycia pacjenta. Zapobieganie posocznicy
jest zależne od dobrych praktyk unikania zakażeń
wewnątrzszpitalnych i stosowania profilaktyki oraz
terapii antybiotykowej w rozsądny i rekomendowany
sposób.
Podziękowania
Autorzy są wdzięczni za pomoc, uwagi i przegląd niniejszego
manuskryptu na temat urosepsy Jean M. Carlet
kierownikowi intensywnej terapii (Hôspital Saint Joseph,
Paris, France).
3F. ZAKAŻENIA UKŁADU MOCZOWEGO ZWIĄZANE Z CEWNIKOWANIEM
3F.1. Wstęp
Następujący tekst opracowany na podstawie wytycznych
EAU opublikowanych w 2007 r. (ISBN-13: 978‑90‑
-70244‑59‑0)
zawiera wyniki kompleksowej aktualizacji
powstałej wspólnym wysiłkiem ESIU (pełna sekcja biura
EAU), Azjatyckiego Towarzystwa Urologicznego (ang.
Urological Association of Asia), Azjatyckiego Towarzystwa
Zakażeń Układu Moczowego / Chorób Przenoszonych
Drogą Płciową (ang. Asian Association of Urinary Tract
Infection / Sexually Transmitted Diseases), Towarzystwa
Chemioterapii Zachodniego Pacyfiku (ang. Western
Pacific Society for Chemotherapy), Federacji Europejskich
Towarzystw Chemioterapii i Infekcji (ang. Federation of
European Societies for Chemotherapy and Infection) oraz
Międzynarodowego Towarzystwa Chemioterapii Infekcji
i Nowotworów (ang. International Society of Chemotherapy
for Infection and Cancer). Tekst został niedawno opublikowany
w „Europejskich i Azjatyckich wytycznych dotyczących
leczenia i zapobiegania zakażeniom dróg moczowych
związanych z cewnikowaniem”
(Tenke i wsp., 2008).
Ponieważ kompletny dokument jest dostępny on-line,
przedstawione są tutaj tylko streszczenie i podsumowanie.
3F.2. Metody
Przegląd objął obszerną literaturę dotyczącą powstawania,
terapii i profilaktyki ZUM związaną z cewnikowaniem
(ang. catheter associated urinary tract infections).
Przeprowadzono systematyczne poszukiwania metaanaliz
randomizowanych badań klinicznych dostępnych
w Medline, ze szczególnym uwzględnieniem Centralnego
Rejestru Kontrolowanych Badań Cochrane (ang. Central
Register of Controlled Trials). Wzięto pod uwagę inne
odpowiednie publikacje, oceniając je na podstawie ich
jakości. Wyniki badań odnajdywano przez wyszukiwarkę
PubMed. Zalecenia i wnioski z tych badań, ocenione
zgodnie z modyfikacją amerykańskiego Departamentu
Zdrowia i Opieki Społecznej (ang. US Department of Health
and Human Services) z 1992 r., podają wytyczne z wszystkich
dyscyplin medycznych, ze szczególnym naciskiem na
urologię, gdzie opieka nad chorymi stosującymi cewniki
jest ważnym zagadnieniem.
3F.3. Klasyfikacja
Badanie wykazało, że drogi moczowe są najczęstszym
źródłem zakażeń wewnątrzszpitalnych, szczególnie gdy
zachodzi potrzeba cewnikowania pęcherza moczowego
(LE: 2a). Większość ZUM związanych z cewnikowaniem
wywołane jest własną florą okrężnicy pacjenta (LE: 2b),
a cewnik predysponuje do ZUM z kilku powodów.
Najważniejszym czynnikiem ryzyka dla rozwoju bakteriomoczu
związanego z cewnikowaniem jest czas jego utrzymywania
w drogach moczowych (LE: 2a). Znakomita
większość krótkotrwałych epizodów bakteriurii związanej
z cewnikowaniem jest bezobjawowa i wywołana
przez pojedynczy organizm (LE: 2a). Kolonizacja innymi
szczepami najczęściej następuje w przypadkach długotrwałego
>30-dniowego zacewnikowania.
3F.4. Diagnostyka
Lekarz powinien zawsze pamiętać o dwóch priorytetowych
kwestiach: układ drenujący cewnika powinien
pozostawać zamknięty, a czas utrzymywania cewnika
powinien być jak najkrótszy (GR: A). Wykorzystanie systemów
opartych na obsłudze pielęgniarskiej lub elektronicznych
przypomnieniach usunięcia cewnika może
skrócić czas zacewnikowania i zmniejszyć ryzyko ZUM
związanych z cewnikowaniem (LE: 2a). Worek drenażowy
powinien stale znajdować się poniżej poziomu
pęcherza i jego przewodu łączącego (GR: B). W przypadku
cewnikowania krótkotrwałego rutynowe zastosowanie
ogólnoustrojowej antybiotykoterapii profilaktycznej
nie jest zalecane (GR: B). Istnieją nieliczne dane
na temat profilaktyki antybiotykowej u pacjentów stosujących
długotrwałe cewnikowanie, w związku z czym nie
ma zaleceń w tych przypadkach (GR: C). Dla pacjentów
stosujących CIC rutynowa profilaktyka antybiotykowa
nie jest zalecana (GR: B). Irygacja cewnika i pęcherza
moczowego antybiotykiem nie przynosi korzyści (GR: A).
Pracownicy służby zdrowia powinni być świadomi ryzyka
infekcji krzyżowych między chorymi cewnikowanymi.
Powinni przestrzegać protokołów dotyczących mycia
rąk i koniecznie korzystać z rękawiczek jednorazowych
(GR: A).
3F.5. Postępowanie
Jedynie w ograniczonej grupie pacjentów dozwolone jest
stosowanie cewników z jednokierunkowymi zaworami
bez konieczności podłączenia do worka zbiorczego. Taka
wygoda drenażu moczu „na żądanie” zwiększa ryzyko
ZUM. Chorzy z utrzymywanym cewnikiem dopęcherzowym
przez ≥10 lat powinni być corocznie poddawani
badaniom przesiewowym w kierunku raka pęcherza
moczowego (GR: C). Należy zawsze rozważać rozwiązania
alternatywne wobec przezcewkowego cewnikowania,
wykazujące mniejsze ryzyko zakażeń objawowych.
W wybranej grupie pacjentów cewniki nadłonowe,
cewniki zewnętrzne oraz CIC są bardziej preferowane
od cewników dopęcherzowych (GR: B). Leczenie bezobjawowej
bakteriurii związanej z zainstalowanym cewnikiem,
poza przypadkami szczególnymi, nie jest rekomendowane
(GR: A). Ponieważ leczenie nie jest zazwyczaj
konieczne, nie zaleca się również rutynowego wykonywania
posiewów moczu u chorych cewnikowanych
(GR: C). Antybiotykoterapia jest zalecana tylko do leczenia
zakażeń objawowych (GR: B). Po rozpoczęciu leczenia
empirycznego, zwykle antybiotykami o szerokim spektrum
działania zgodnie z lokalnymi wzorami wrażliwości
patogenów (GR: C), dobór antybiotyku trzeba dostosować
do wyników posiewu moczu (GR: B). Długoterminowa
profilaktyka antybiotykowa jest nieefektywna (GR: A).
Podsumowanie zaleceń w aktualnych wytycznych
opiera się na tym szeroko zakrojonym przeglądzie
(Tenke i wsp., 2008).
zaktualizowanym danymi z rozdziału 9.
„Zakażenia urologiczne”
(Naber i wsp., 2010)
i ostatnich
badań na temat cewników
(Pickard i wsp., 2012).


3G. ZAKAŻENIA UKŁADU MOCZOWEGO U DZIECI
3G.1. Wstęp
Zakażenia układu moczowego u dzieci są częstym problemem
zdrowotnym występującym z częstością niewiele
rzadszą niż infekcje górnych dróg oddechowych i przewodu
pokarmowego. Częstość występowania zakażeń
układu moczowego jest zależna od wieku i płci. W pierwszym
roku życia, a szczególnie w pierwszych 3 miesiącach
życia, ZUM występuje częściej u chłopców (3,7%) niż
dziewcząt (2%). Po tym okresie zapadalność wynosi do
3% wśród dziewcząt i 1,1% wśród chłopców. Zakażenie
dróg moczowych jest najczęstszą przyczyną gorączki nieznanego
pochodzenia u chłopców <3. r.ż. Obraz kliniczny
ZUM u niemowląt i małych dzieci może obejmować
zarówno gorączkę, jak i objawy ze strony przewodu
pokarmowego oraz dolnych i górnych dróg moczowych.
Wnikliwe badania powinny zostać przeprowadzane po
dwóch epizodach ZUM u dziewcząt i jednym u chłopców
(GR: B). Celem jest wykluczenie występowania przeszkody
w odpływie moczu, odpływu (refluksu) pęcherzowo-moczowodowego
(OPM, łac. refluxus vesicoureteralis) i dysfunkcji
mikcji, np. powodowanych przez zaburzenia neuropatyczne.
Bliznowacenie nerek spowodowane przewlekłym
odmiedniczkowym zapaleniem nerek rozwija się
w bardzo młodym wieku ze względu na połączenie
ZUM, wewnątrznerkowych odpływów i OPM. Czasami
pojawia się już w wieku płodowym na podłożu dysplazji.
Bliznowacenie nerek może prowadzić do poważnych długotrwałych
powikłań, takich jak nadciśnienie i przewlekła
niewydolność nerek.
Odpływ pęcherzowo-moczowodowy powinien być
leczony poprzez przewlekłą profilaktykę antybiotykową
(GR: B). Przeszczepienie moczowodu lub endoskopowe
leczenie jest zarezerwowane dla niewielkiej, szczególnej
grupy dzieci z przełomową infekcją (GR: B).
W leczeniu ZUM u dzieci krótkotrwałe schematy antybiotykoterapii
nie są zalecane i dlatego leczenie powinno
być kontynuowane przez 5–7 dni, a nawet dłużej (GR: A).
Jeśli dziecko jest poważnie chore z współwystępującymi
wymiotami i odwodnieniem, niezbędna jest hospitalizacja
i pozajelitowe podanie antybiotyków (GR: A). Dalsze,
szczegółowe informacje dostępne są w wytycznych EAU
dotyczących urologii dziecięcej.
3G.2. Epidemiologia, etiologia i patofizjologia
Drogi moczowe są częstym źródłem infekcji u dzieci
i niemowląt. Jest to najczęstsze zakażenie bakteryjne
u dzieci <2. r.ż.
(Jodal, 1987)
(LE: 2a). Zakażenia układu
moczowego przebiegają zazwyczaj łagodnie, ale we wczesnym
etapie niemowlęctwa mogą prowadzić do bliznowacenia
nerek, zwłaszcza ze współwystępującymi wadami
wrodzonymi w obrębie dróg moczowych. Opóźnione
następstwa związane z bliznowaceniem nerek to m.in.
nadciśnienie, białkomocz, uszkodzenia nerek, a nawet
przewlekła niewydolność nerek wymagająca dializoterapii
u znacznej liczby dorosłych
(Jacobson, 1989)
(LE: 2a).
Ryzyko ZUM w pierwszej dekadzie życia wynosi 1%
u mężczyzn i 3% u kobiet
(Foxman, 2002).
Sugeruje się, że
podczas okresu szkolnego 5% uczennic i do 0,5% uczniów
przechodzi co najmniej jeden epizod ZUM. Częstość
występowania jest różna dla dzieci <3. miesiąca życia,
kiedy to jest bardziej powszechna u chłopców. Częstość
występowania bezobjawowego bakteriomoczu wśród
noworodków wynosi 0,7–3,4%, u niemowląt <3. miesiąca
życia 0,7–1,3% i 0,2–0,8% wśród chłopców i dziewcząt
w wieku przedszkolnym
(Foxman, 2002).
Częstość
występowania objawowego bakteriomoczu wynosi 0,14%
u noworodków i wzrasta do 0,7% u chłopców i 2,8%
u dziewcząt w wieku <6 miesięcy. Ogólny odsetek
nawrotów u noworodków według doniesień wynosi 25%
(Foxman, 2002).
( Schulman, 2004).
Częstym czynnikiem odpowiedzialnym za ZUM są
patogenne bakterie Gram‑ujemne,
a zwłaszcza bakterie
jelitowe. Spośród nich E. coli jest odpowiedzialna za ok.
90% epizodów ZUM
(Shapiro, 1992).
Bakterie Gram‑dodatnie
(a w szczególności enterokoki i gronkowce)
są przyczyną 5–7% przypadków. Zakażenia szpitalne
wykazują szerszy wachlarz bardziej agresywnych bakterii,
takich jak Klebsiella, Serratia i Pseudomonas spp.
Paciorkowce grupy A i B są stosunkowo częstą przyczyną
ZUM wśród noworodków
(Richards i wsp., 1999).
Istnieje
coraz silniejsza tendencja do wyizolowania Staphylococcus
saprophyticus w ZUM u dzieci, aczkolwiek rola tych bakterii
jest wciąż dyskusyjna
(Abrahamsson i wsp., 1993).
Drogi moczowe są jałową przestrzenią wyścieloną nieprzepuszczalną
powłoką. Najczęstszym mechanizmem
infekcji jest droga wstępująca. Zakażenia szpitalne oraz
droga krwiopochodna w przebiegu infekcji układowej
występują znacznie rzadziej
(Ma i Shortlife, 2004).
Przeszkoda w odpływie moczu i zaburzenia czynnościowe
należą do najczęstszych przyczyn infekcji dróg
moczowych. Stulejka predysponuje do ZUM
(Craig i wsp.,1996;).
(To i wsp., 1998).
(LE: 2a). Enterobacteriaceae pochodzące
z mikroflory jelitowej kolonizują worek napletkowy,
powierzchnię żołędzi i dystalny odcinek cewki moczowej.
Wśród tych bakterii obecne są szczepy E. coli, zaopatrzonych
w P fimbrie, które przywierają do wewnętrznej
blaszki napletka i komórek nabłonka uroepitelialnego
(Fussell i wsp., 1988).
Różnorodne wady wrodzone dróg moczowych
mogą powodować ZUM przez stanowienie przeszkody
w odpływie moczu, np. zastawki cewki moczowej, niedrożność
połączenia miedniczkowo-moczowodowego
lub obturacyjny zastój moczu (np. zespół niedorozwoju
mięśni brzucha zwany inaczej zespołem suszonej śliwki).
Bardziej prozaiczne, ale istotne przyczyny ZUM, to m.in.
sklejanie się warg sromowych i przewlekłe zaparcia
(Abrahamsson i wsp., 1993).
Dysfunkcjonalne mikcje u zdrowego dziecka mogą być
spowodowane rzadkim opróżnianiem pęcherza wspomaganym
przez różne sposoby mające opóźnić mikcję, np.
krzyżowanie nóg czy siedzenie na piętach
(Wan i wsp.,1995).
Neurogenne dysfunkcje pęcherza (jak np. rozszczep
kręgosłupa lub dyssynergia zwieraczowo-wypieraczowa)
może prowadzić do zalegania moczu po mikcji
i wtórnego OPM
(Schulman, 2004).
Związek między uszkodzeniem nerek i ZUM jest
kontrowersyjny. Mechanizm w nefropatii zaporowej
jest oczywisty, ale bardziej subtelne zmiany występują
w przypadku OPM. Niezbędnymi czynnikami są m.in.
OPM, refluks wewnątrznerkowy i ZUM. Muszą współistnieć
we wczesnym dzieciństwie, kiedy rosnąca nerka
może być podatna na infekcje miąższu. W późniejszym
okresie dzieciństwa obecność bakteriomoczu wydaje się
nieistotna dla postępu istniejących lub powstawania
nowych blizn. Kolejnym czynnikiem mylącym jest fakt,
że wiele tak zwanych blizn jest w rzeczywistości tkankami
dysplastycznymi nerek, które rozwijają się w okresie
życia płodowego
(Yeung i wsp., 1997).
Objawy są niespecyficzne i różnią się w zależności
od wieku dziecka i stopnia ciężkości choroby. Zapalenie
jądra i najądrza jest bardzo nietypowe. Przy pojawieniu
się bólu i objawów zapalenia moszny należy wykluczyć
skręt szypuły jądra.
Zakażenia układu moczowego u noworodków mogą
być niespecyficzne. U małych dzieci ZUM może ujawniać
się wraz z objawami ze strony układu pokarmowego,
takimi jak wymioty i biegunka. W ciągu pierwszych
tygodni życia 13,6% pacjentów z gorączką ma ZUM
(Lin i wsp., 2000).
Wstrząs septyczny rzadko jest pierwszym
objawem. Objawy ZUM mogą być niejasne u małych
dzieci, ale później, po przekroczeniu 2. r.ż. częste oddawanie
moczu, dyzuria i bóle nadłonowe, brzucha lub
lędźwiowe mogą występować z lub bez gorączki.
3G.3. Klasyfikacja
Zakażenia układu moczowego mogą być klasyfikowane
jako pierwszorazowe i nawrotowe lub według stopnia
ciężkości.
Nawrotowe ZUM można podzielić na trzy grupy
(Ma i Shortlife, 2004):
zakażenia niedoleczone: subterapeutyczna dawka
środka przeciwbakteryjnego, niezgodność z leczeniem,
złe wchłanianie antybiotyku, oporność patogenów,
bakteryjna uporczywość: może być związana z ogniskiem
przetrwałego zakażenia dróg moczowych.
Konieczna może być chirurgiczna lub farmakologiczna
korekcja zaburzeń dróg moczowych,
reinfekcja: każdy epizod jest nowo powstałym zakażeniem
nabytym z mikroflory okolicy okołocewkowej,
kroczowej lub okołoodbytniczej.
Z klinicznego punktu widzenia ciężkie i nieskomplikowane
postacie ZUM powinny być różnicowane, gdyż
stopień nasilenia objawów dyktuje pilność diagnostyki
i wdrożenia leczenia (tabela 11).
Ciężkie zakażenia układu moczowego: Ciężka postać
ZUM objawia się uporczywą gorączką >39°C, obniżeniem

samopoczucia, uporczywymi wymiotami oraz średnim
lub ciężkim odwodnieniem.
Niepowikłane zakażenia układu moczowego: Dziecko
z prostym ZUM może mieć łagodną gorączkę, ale jest
w stanie przyjmować płyny i leki doustnie. Dziecko jest
tylko nieznacznie odwodnione i prezentuje dobrą odpowiedź
na wdrożone leczenie. Jeśli oczekiwany poziom
odpowiedzi na leczenie spada, dziecko powinno być traktowane
jak w ciężkim ZUM.
3G.4. Diagnostyka
3G.4.1. Badanie fizykalne
Należy obowiązkowo wykluczyć stulejkę, sklejenie warg
sromowych, objawy odmiedniczkowego zapalenia nerek,
zapalenie jądra i najądrza oraz znamion kojarzonych
z rozszczepem kręgosłupa, jak np. nadmierne owłosienie
okolicy krzyżowej. Brak gorączki nie wyklucza obecności
stanu zapalnego.
3G.4.2. Diagnostyka laboratoryjna
Ostateczne rozpoznanie zakażenia u dzieci wymaga
uzyskania pozytywnego wyniku posiewu moczu
(Ma i Shortlife, 2004):
(Zorc i wsp., 2005):
Mocz należy pobrać
w bakteriologicznie wiarygodnych warunkach
(Cavagnaro i wsp., 2005).
Pozytywny wynik posiewu moczu jest zdefiniowany
jako obecność >100 000 cfu/mL patogenu
jednego gatunku. Próbka moczu może być trudna do
pobrania u dziecka <4. r.ż. Zaleca się wykorzystanie jednej
z kilku metod, ponieważ istnieje duże ryzyko zanieczyszczenia
próbki
(Koch i Zuccolotto, 2003; ).
(Watson, 2004).
3G.4.2.1. Pobranie próbki moczu
Aspiracja z nakłucia nadłonowego pęcherza: Nadłonowa
aspiracja pęcherza moczowego jest sposobem najbardziej
czułym, mimo iż mocz można uzyskać w 23–99%
przypadków
(Koch i Zuccolotto, 2003;).
(Ma i Shortlife, 2004).
Cewnikowanie pęcherza moczowego: Cewnikowanie
pęcherza moczowego jest także dość czułą metodą uzyskania
próbki moczu do posiewu, chociaż związane jest
z ryzykiem wprowadzenia patogenów odpowiedzialnych
za zakażenia wewnątrzszpitalne
(Hellerstein, 2002;).
(Ma i Shortlife, 2004).
Worek zbiorczy przylepiony na genitalia: Badania prospektywne
wykazały wysoką częstość występowania wyników
fałszywie dodatnich 85–99%
(Koch i Zuccolotto, 2003; ).
(Ma i Shortlife, 2004).
Metoda ta jest pomocna, gdy posiew jest
negatywny
(Koch i Zuccolotto, 2003; ).
(Ma i Shortlife, 2004).
i ma korzystną wartość predykcyjną ok. 15%
(Cavagnaro i wsp., 2005).
W celu uzyskania próbki moczu u dzieci <2
lat (dziewczynki oraz chłopcy nieobrzezani i niekontrolujący
zwieracza) najlepiej skorzystać z aspiracji nadłonowej
pęcherza moczowego lub cewnikowania pęcherza
moczowego. U starszych dzieci z kontrolą zwieracza
pobranie moczu ze środkowego strumienia jest możliwe
i jest metodą wiarygodną
(Koch i Zuccolotto, 2003).
3G.4.2.2. Kwantyfikacja bakteriomoczu
Końcowe stężenie bakterii w moczu jest bezpośrednio
związane ze sposobem pobrania próbki, diurezą oraz sposobem
przechowywania i transportu próbki
(Zorc i wsp.,2005).
Klasyczna definicja znaczącego bakteriomoczu –
>10⁵ cfu/mL jest nadal wykorzystywana i zależy od środowiska
klinicznego
(Watson, 2004;).
(Zorc i wsp., 2005;).
Obecność ropomoczu (>5 leukocytów w polu widzenia)
i bakteriomoczu w świeżej próbce moczu potwierdzają
diagnozę kliniczną ZUM
(Watson, 2004;).
W przypadku uzyskania próbki moczu u chłopców
poprzez cewnikowanie pęcherza posiew moczu jest
uważany za pozytywny, jeśli ilość bakterii wynosi
>10⁴ cfu/mL. Chociaż Hoberman
(Hoberman i Wald,1997)
określił rodzaj mikroorganizmów w 65% przypadków
posiewów ze wzrostem pomiędzy 10 000

a 50 000 cfu/mL, to mieszany wzorzec wzrostu sugerował
zanieczyszczenie. W takich przypadkach lepiej jest powtórzyć
posiew i przeanalizować obecność innych czynników,
takich jak ropomocz, azotyny lub inne markery biochemiczne
(Zorc i wsp., 2005).
Posiew uzyskany z moczu
pobranego ze środkowego strumienia lub worka zbiorczego
jest uważany za dodatni przy wzroście ≥10⁵ cfu/mL
(Cavagnaro i wsp., 2005) (tabela 12).
3G.4.2.3. Inne wskaźniki biochemiczne
Obecność innych markerów biochemicznych w próbce
moczu jest bardzo przydatna w diagnostyce ZUM
(Ma i Shortlife, 2004).(tabela 12).
Najczęstszymi markerami, zazwyczaj
połączonymi w teście paskowym, są azotyny i esteraza
leukocytarna.
Azotyny: Obecne w moczu azotyny powstają w wyniku
redukcji azotanów przez bakterie Gram-ujemne. Jeśli
zakażenie jest wywołane przez bakterie Gram-dodatnie,
wynik testu może być negatywny
(Cavagnaro i wsp., 2005).(tabela 12).
(Ma i Shortlife, 2004).(tabela 12).
Inne ograniczenia testu na obecność
azotynów:
yy nie wszystkie uropatogeny redukują azotany do azotynów
– np. Pseudomonas aeruginosa lub enterokoki,
yy nawet patogeny produkujące azotyny mogą wykazać
wynik negatywny ze względu na krótki czas tranzytu
moczu poprzez pęcherz moczowy w przypadku dużej
diurezy i rozcieńczenia moczu (jak np. u noworodków),
yy test na obecność azotynów ma czułość od 45–60%,
ale bardzo dobrą swoistość od 85–98%
(Deville i wsp.,2004; ).
(Ma i Shortlife, 2004).
(Watson, 2004.
Esteraza leukocytarna: Esteraza leukocytarna wytwarzana
jest przez granulocyty, w tym leukocyty. Test na
jej obecność ma czułość 48–86% i swoistość 17–93%
Deville i wsp., 2004;
Hoberman i Wald, 1997;
(Ma i Shortlife, 2004).
(Watson, 2004.
Połączenie testu na obecność azotynów i esterazy leukocytarnej
poprawia czułość i swoistość, ale niesie ryzyko
wyników fałszywie dodatnich
Deville i wsp., 2004;
Test paskowy stał się użyteczny do szybkiego i niezawodnego
wykluczenia obecności ZUM pod warunkiem,
że oba testy są negatywne. Jeśli wynik jest dodatni,
konieczne jest potwierdzenie wyników z objawami klinicznymi
i innymi badaniami
(Deville i wsp., 2004;Watson, 2004).
(Deville i wsp., 2004;)
(Watson, 2004).
Bakteriomocz bez ropomoczu może występować
w następujących przypadkach:
zanieczyszczenia bakteryjnego próbki,
kolonizacji (bezobjawowego bakteriomoczu),
pobrania próbki przed wystąpieniem reakcji zapalnej.
W takich przypadkach zaleca się powtórzenie badania
ogólnego moczu po 24 godz. Nawet u dzieci gorączkujących
z dodatnim posiewem moczu brak ropomoczu
może podważać rozpoznanie ZUM. Przeciwnie, bezobjawowy
bakteriomocz z jednoczesnym przebiegiem
septycznym odpowiedzialnym za wystąpienie gorączki
musi być brany pod uwagę.
Bakteriurię bez ropomoczu znajduje się w 0,5% próbek.
Odsetek ten dobrze koresponduje z szacowanym wskaźnikiem
bezobjawowego bakteriomoczu w dzieciństwie
(Hoberman i Wald, 1997;).
(Wettergren i Jodal, 1990).
(LE: 2a).
Ropomocz bez bakteriomoczu może występować
w następujących przypadkach:
niedokończonego leczenia przeciwbakteryjnego ZUM,
kamicy dróg moczowych i obecności ciał obcych,
zakażenia wywołanego przez Mycobacterium tuberculosis
i inne uciążliwe bakterie, jak np. Chlamydia
trachomatis.
Tak więc zarówno bakteriomocz, jak i ropomocz nie
mogą być uznane za wiarygodne parametry służące do
zdiagnozowania lub wykluczenia ZUM. Ich ocena może
być uzależniona od innych czynników, takich jak stopień
nawodnienia, metoda pobrania próbki moczu, tryb wirowania,
objętość, w jakiej zawieszają się osady i subiektywna
interpretacja wyników
(Stamm, 1983).
Jednakże
zgodnie z
Landau i wsp. (1994)
ropomocz u gorączkujących
dzieci wskazuje na ostre odmiedniczkowe zapalenie nerek.
Z tych wszystkich powodów u noworodków i dzieci
<6. miesiąca życia zarówno ropomocz, bakteriomocz, jak
i test na obecność azotynów oddzielnie mają minimalną
wartość predykcyjną dla ZUM
Hoberman i wsp., 1993;
Piercey i wsp., 1993
(LE: 3). W przeciwieństwie do tego
predykcyjna dodatnia wartość barwienia metodą Grama
w ropomoczu wynosi 85%
(Hoberman i Wald, 1997)
(LE: 2b).
U starszych dzieci ropomocz z dodatnim wynikiem testu
na obecność azotynów jest bardziej niezawodny w diagnostyce
ZUM z dodatnią wartością predykcyjną 98%.
Łączne występowanie bakteriomoczu i ropomoczu
u gorączkujących dzieci oraz wynik ≥10 w polu
widzenia/mm³ i miano bakterii ≥50 000 cfu/mL w próbce
pobranej przez cewnikowanie są znamienne dla ZUM
i wykluczają zanieczyszczenie próbki
(Hoberman i Wald, 1997)
(Hoberman i wsp., 1993)
Białko C-reaktywne: Mimo że niespecyficzne u gorączkujących
dzieci z bakteriomoczem białko C-reaktywne
(CRP, ang. C-reactive protein) wydaje się użyteczne w różnicowaniu
między ostrym odmiedniczkowym zapaleniem
nerek a innymi przyczynami bakteriurii. Za znamienne
CRP jest uznawane w stężeniach >20 μg/mL.
Moczowa N-acetylo-β-glukozaminidaza: Moczowa
N-acetylo-β-glukozaminidaza jest markerem uszkodzenia
cewkowego. Jest podwyższona w ZUM z gorączką
i może stać się niezawodnym markerem diagnostycznym
w ZUM, chociaż jest także podwyższona w OPM
(Jantausch i wsp., 1994).
Interleukina-6: Kliniczne zastosowanie stężenia IL-6
w ZUM (Benson i wsp., 1994) jest ciągle na etapie badań.
3G.4.3. Diagnostyka obrazowa dróg moczowych
Spełniająca kryteria „złotego standardu” technika obrazowania
musi być opłacalna, bezbolesna, bezpieczna i charakteryzować
się brakiem lub minimalnym narażeniem
na promieniowanie, jak również mieć zdolność wykrywania
znaczących anomalii strukturalnych. Obecne techniki
nie spełniają wszystkich powyższych wymagań.
3G.4.3.1. Ultrasonografia
Ultrasonografia stało się bardzo przydatną metodą obrazowania
u dzieci z uwagi na jej bezpieczeństwo, szybkość
i wysoką dokładność w identyfikowaniu anatomii i grubości
miąższu nerki oraz układu zbiorczego
(Kass i wsp.,1992).
Ultrasonografia narażona jest na ocenę subiektywną,
a więc zależną od operatora i nie daje żadnych
informacji na temat czynności nerek. Daje jednak możliwość
rozpoznawania blizn, chociaż nie tak dobrze jak
w przypadku scyntygrafii 99 m Tc DMSA
(Kass i wsp.,1992).
(Pickworth i wsp., 1995).
(LE: 2a). Technika ta wykazuje się
bardzo dużą czułością. Urografia wydzielnicza zarezerwowana
jest dla tych przypadków, gdy jej wyniki muszą
być poddane weryfikacji anatomicznej
(Kangarloo i wsp.,1985)
(LE: 2a).
3G.4.3.2. Badania radioizotopowe
99 m Tc DMSA jest radiofarmaceutykiem, który wiąże się
z komórkami błony podstawnej kanalików proksymalnych
nerek; połowa dawki pozostaje w korze nerek po
6 godz. Technika ta jest przydatna w ustalaniu funkcjonalnej
masy nerek i zapewnia dokładne rozpoznanie
korowego bliznowacenia, uwidaczniając obszary hipoaktywności,
co wskazuje na brak lub upośledzenie funkcji.
Zakażenia układu moczowego zakłóca wychwyt tego
radioizotopu przez komórki kanalika bliższego nerek
i może ukazywać obszary ogniskowego uszkodzenia
miąższu nerek. Ognisko w miąższu nerki o kształcie
gwiazdy może wskazywać na ostry epizod odmiedniczkowego
zapalenia nerek. Ogniskowa wada w korze nerek
zazwyczaj wskazuje na przewlekłe uszkodzenie i bliznowacenie
nerek
(Britton, 1998;)
(Kass, 1994;)
(Stutley i Gordon,1992)
(LE: 2a).
Ogniskowe bliznowacenie i jednolita utrata miąższu
nerek w badaniu 99 m Tc DMSA na ogół związane jest
z OPM (nefropatia refluksowa)
(Jakobsson i wsp., 1992;)
(Rosenberg i wsp., 1992)
(Rushton i wsp. (1992))
stwierdzili,
że znaczne zbliznowacenie nerek może rozwinąć się niezależnie
od istnienia lub braku OPM.
Ransley i Risdon(1975)
donoszą, że 99 m Tc DMSA wykazuje 100% swoistość
i czułość na poziomie 80% w diagnostyce bliznowacenia
nerek.
Technika scyntygrafii 99 m Tc DMSA może być przydatna
we wczesnej diagnostyce ostrego odmiedniczkowego
zapalenia nerek. Wyniki badań u ok. 50–85%
dzieci są dodatnie już w pierwszym tygodniu choroby.
Minimalne ubytki miąższu charakteryzujące się nieznacznymi
obszarami hipoaktywności mogą ulec
regresji dzięki antybiotykoterapii
Risdon, 1987;
Risdoni wsp., 1994
Jednak wady trwające >5 miesięcy uważane
są za bliznowacenie nerki
(Jakobsson i Svensson, 1997)
(LE: 2a).
Scyntygrafia 99 m Tc DMSA jest uważana za metodę
bardziej czułą niż urografia i USG w wykrywaniu bliznowacenia
nerki
(Bircan i wsp., 1995;)
(Elison i wsp., 1992;)
(MacKenzie i wsp., 1994;)
(Rushton i wsp., 1988)
Pozostaje
pytanie, czy scyntygrafia radioizotopowa może zastąpić
USG jako pierwszoplanowe badanie diagnostyczne
u dzieci z ZUM
(Mucci i Maquire, 1994;)
(Westwood i wsp.,2005)
3G.4.3.3. Cystouretrografia
Konwencjonalna/klasyczna cystouretrografia mikcyjna:
Cystouretrografia mikcyjna (VCU, ang. voiding cystourethrography)
jest najczęściej stosowanym badaniem radiologicznym
do oceny dolnych dróg moczowych, szczególnie
z OPM. Jest niezbędna w diagnostyce ZUM u dzieci
<1. r.ż. Jej głównymi wadami są: zwiększone ryzyko
infekcji, konieczność wstecznego napełnienia pęcherza
moczowego oraz narażenie na szkodliwe działanie promieniowania
(Haycock, 1991).
W ostatnich latach niskie
dawki dostosowane do VCU we fluoroskopii zostały wykorzystane
do oceny OPM u dziewcząt w celu zminimalizowania
narażenia radiologicznego
(Kleinman i wsp., 1994).
Cystouretrografia mikcyjna jest niezbędna w ocenie dziecięcych
ZUM przebiegających z gorączką nawet w obecności
prawidłowego obrazu USG. U nawet do 23% z tych
pacjentów można ujawnić OPM
(Kass i wsp., 2000).
Cystografia radioizotopowa: Badanie to jest wykonywane
przez przedłużenie okresu skanowania po podaniu
pentaoctanu dietylenowego triaminy (DTPA, ang. diethylene
triamine pentaacetic acid) 99 m Tc lub merkapto-acetylo-
triglicyny (MAG-3, ang. mercapto-acetyl-triglycine)
w ramach badania scyntygrafii dynamicznej nerek.
Reprezentuje atrakcyjną alternatywę dla tradycyjnej
cystografii, zwłaszcza u chorych z OPM z uwagi na jego
mniejszą dawkę promieniowania. Niedogodnościami są
słaba rozdzielczość obrazu i trudności w wykrywaniu
zaburzeń dolnych dróg moczowych
(DeSadeleer i wsp.,1994; ).
(Piaggio i wsp., 2003 ).
Cystosonografia: Do diagnostyki OPM wprowadzono
metodę obrazowania USG, wykorzystującą wzmocnienie
obrazu poprzez podanie kontrastu. Badanie za pomocą tej
metody eliminuje narażenie na promieniowanie
(Piaggio i wsp., 2003 ).
(Westwood i wsp., 2005).
Dalsze badania są
niezbędne do określenia roli tej nowej techniki obrazowania
w ZUM.
3G.4.3.4. Dodatkowe metody obrazowania
Urografia pozostaje cennym narzędziem w ocenie układu
moczowego u dzieci, ale jej wykorzystanie w ZUM jest
dyskusyjne, chyba że wstępne obrazowania wykazały
nieprawidłowości, które wymagają dalszej diagnostyki.
Główną wadą urografii u niemowląt jest ryzyko wystąpienia
skutków ubocznych związane z narażeniem na
promieniowanie i środki kontrastowe
(Vela Navarrete,1993)..
Należy też dodać, że rola urografii zmniejsza się
wraz ze wzrostem możliwości technicznych TK
(Huang i wsp., 1992)
i MRI. Jednak wskazania do ich zastosowania
są nadal ograniczone w ZUM.
3G.4.3.5. Badanie urodynamiczne
Przy podejrzeniu zaburzeń mikcji, jak np. nietrzymanie
moczu, zaleganie moczu po mikcji oraz zwiększona
grubość ściany pęcherza moczowego, należy rozważyć
wykonanie badania urodynamicznego z uroflowmetrią
(wideo), cystometrią, profilometrią cewkową i elektromiografią.
3G.4.4. Schemat postępowania diagnostycznego
Prawdopodobnie badania przesiewowe noworodków
w kierunku bezobjawowej bakteriurii nie zapobiegają bliznowaceniu
nerek w przebiegu odmiedniczkowego zapalenia
nerek, gdyż zmiany te zwykle pojawiają się w bardzo
wczesnym okresie niemowlęctwa. Tylko u niewielkiej
części dzieci ZUM ma podłoże wynikające z zaburzeń
urologicznych. Zaleca się więc przeprowadzenie głębszej
diagnostyki po dwóch epizodach ZUM u dziewczynek
i jednym u chłopców (rycina 4), lecz nie dotyczy to przypadków
ABU
(DeSadeleer i wsp., 1994;)
(Kass i wsp., 2000;)
(Majd i wsp., 1991;)
(Piaggio i wsp., 2003;)
(Smellie i Rigden,
1995;)
(Vela Navarrete, 1993)
Potrzeba wykonania scyntygrafii
DTPA/MAG-3 jest zależna od wyników USG,

szczególnie jeśli istnieje podejrzenie zmiany o charakterze
uropatii zaporowej.
3G.5. Postępowanie
Leczenie ma cztery zasadnicze cele:
eliminację objawów i wyeliminowanie bakteriomoczu
w ostrym epizodzie,
zapobieganie bliznowaceniu nerek,
profilaktykę nawrotowych ZUM,
korekcję towarzyszących wad urologicznych.
3G.5.1. Ciężkie zakażenia układu moczowego
Ciężkie ZUM wymagają odpowiedniego nawodnienia
oraz leczenia przeciwbakteryjnego, najkorzystniej
z użyciem cefalosporyn (trzeciej generacji). W przypadku
podejrzenia ZUM spowodowanego przez bakterie
Gram-dodatnie zaleca się podawanie aminoglikozydów
w połączeniu z ampicyliną lub amoksycyliną / kwasem
klawulanowym
(Broseta, 1999)
(LE: 2a). Leczenie przeciwdrobnoustrojowe
należy włączyć empirycznie z jak
najszybszą modyfikacją zależną od wyników posiewu.
U chorych uczulonych na cefalosporyny można stosować
aztreonam i gentamycynę. W przypadku konieczności
stosowania aminoglikozydów zaleca się monitorowanie
ich stężenia w surowicy celem dostosowania dawkowania.
Należy unikać stosowania chloramfenikolu, sulfonamidów,
tetracyklin, ryfampicyny, amfoterycyny B i fluorochinolonów.
Powinno się unikać stosowania ceftriaksonu
ze względu na jego niepożądane skutki uboczne,
jak np. żółtaczka.
Różnorodne środki przeciwbakteryjne mogą być
stosowane u starszych dzieci z wyjątkiem tetracyklin,
które mogą powodować przebarwienia szkliwa zębów.
Fluorochinolony mają toksyczne działanie na chrząstki
(Smellie i wsp., 1995),
ale jeśli jest to konieczne, mogą
być stosowane jako leczenie drugiego rzutu w poważnych
infekcjach, ponieważ skutki uboczne na układ
mięśniowo-szkieletowy są umiarkowane i przemijające
(Fluoroquinolone…, 2004;).
( Grady, 2003).
W okresie pierwszych
24–36 godz. należy włączyć terapię pozajelitową. Gdy
dziecko przestanie gorączkować i jest w stanie przyjmować
płyny, może być podawany środek doustny do zakończenia
10–14 dni leczenia, które może być kontynuowane
w warunkach ambulatoryjnych. Daje to pewne korzyści,
takie jak zmniejszenie niekorzystnego wpływu psychologicznego
na dziecko i większy komfort dla całej rodziny.
Leczenie ZUM w warunkach ambulatoryjnych jest
również tańsze, dobrze tolerowane i ostatecznie zapobiega
infekcjom oportunistycznym
(Hoberman i Wald,1997).
Preferowanymi doustnymi środkami przeciwbakteryjnymi
są: trimetoprim, kotrimoksazol (trimetoprim
z sulfametoksazolem), cefalosporyny doustne lub amoksycylina
z kwasem klawulanowym. Należy zwrócić jednak
uwagę, że wskazania do stosowania trimetoprimu są
wątpliwe na obszarach o zwiększonej oporności bakterii.
U dzieci <3. r.ż., które mają trudności z przyjmowaniem
leków doustnych, wydaje się uzasadnionym
włączenie leczenia pozajelitowego przez 7–10 dni –
wyniki takiego leczenia są podobne jak w terapii środkami
doustnymi
(Bloomfield i wsp., 2005).
W przypadku występowania nieprawidłowości
w obrębie dróg moczowych (np. OPM lub przeszkoda
w odpływie moczu) powinna być uwzględniona interwencja
urologiczna. W przypadku wykrycia bliznowacenia
nerek pacjent będzie musiał być poddany starannej
kontynuacji leczenia przez pediatrę z uwagi na przewidywane
następstwa kliniczne, takie jak nadciśnienie,
zaburzenia czynności nerek i nawracające ZUM.
Przegląd leczenia ZUM przebiegających z gorączką
u dzieci przedstawiono na rycinie 5. Dawkowanie środków
przeciwbakteryjnych przedstawiono w tabeli 13 (DGPI,
2003).
3G.5.2. Nieskomplikowane zakażenia
układu moczowego
Nieskomplikowane ZUM u dzieci są zakażeniami
o niskim stopniu ryzyka. Zalecane jest doustne leczenie
empiryczne trimetoprimem, cefalosporynami lub amoksycyliną
z kwasem klawulanowym zależnie od lokalnego
wzorca oporności patogenów. Czas leczenia niepowikłanego
ZUM lekami doustnymi powinien wynosić
5–7 dni
(Michael i wsp., 2003;).
(Tran i wsp., 2001).
(LE: 1b).
Pojedyncza dawka dożylna może zostać podana w przypadkach
wątpliwych, jeśli nie ma zaburzeń w obrębie dróg
moczowych
(Khan, 1994)
(LE: 2a). Jeśli odpowiedź na
leczenie jest słaba lub rozwijają się powikłania, dziecko
musi być hospitalizowane celem włączenia leczenia pozajelitowego
(Hellerstein, 1995).
3G.5.3. Profilaktyka
Jeśli istnieje zwiększone ryzyko odmiedniczkowego zapalenia
nerek przy współwystępowaniu np. OPM i nawracających
ZUM, zaleca się stosowanie profilaktyki z użyciem
niskich dawek antybiotyków
(Arant, 2001; )
( Smellie i wsp.,1988)
(LE: 2a). Taka profilaktyka może być również stosowana
po ostrym epizodzie ZUM do momentu zakończenia
badań diagnostycznych. Najbardziej skutecznymi
środkami przeciwbakteryjnymi są: nitrofurantoina, trimetoprim,
cefaleksyna i cefaclor
(Smellie i wsp., 1988).
Podziękowania
Rozdział o ZUM u dzieci został zaktualizowany przez
współautora Jorge’a Caffaratti Sfulcini (Paediatric
Urology, Fundació Puigvert, Barcelona, Hiszpania).
