3H. ZAPALENIE CEWKI MOCZOWEJ
3H.1. Wstęp
Zapalenie cewki moczowej (łac. urethritis) manifestuje
się zazwyczaj objawami o charakterze LUTS. W niniejszych
wytycznych przedstawiono zalecenia dotyczące
diagnostyki i antybiotykoterapii bakteryjnego zapalenia
cewki moczowej.
3H.2. Metody
Niniejsze zalecenia ustanowione zostały na podstawie
kilku wytycznych krajów europejskich i zgodnie z zaleceniami
Centrów Kontroli Chorób (CDC, ang. Centers
for Disease Control) dotyczących chorób przenoszonych
drogą płciową (STD, ang. sexually transmitted disease)
(Bremer i wsp., 2014;).
(del Rio i wsp., 2012; ).
(Plettenberg, 2014;).
(Workowski i Berman, 2010).
3H.3. Epidemiologia, etiologia i patogeneza
Z terapeutycznego i klinicznego punktu widzenia należy
odróżniać gonokokowe zapalenie cewki moczowej (łac.
gonorrhoeal urethritis) i niegonokokowe zapalenie cewki
(NGU, łac. Nongonococcal urethritis). W Europie Środkowej
nieswoiste zapalenia cewki moczowej występują znacznie


częściej niż zapalenia gonokokowe, lecz czynnik etiologiczny
pozostaje nieznany w nawet 50% przypadków
(Wetmore i wsp., 2011).
Istnieje ścisła korelacja między
rozwiązłością i statusem społeczno-ekonomicznym
a częstotliwością infekcji wywołanych przez Neisseria
gonorrhoeae i Chlamydia trachomatis. Infekcje te rozprzestrzeniają
się przez kontakt seksualny.
Do patogenów najczęściej wywołujących zapalenie
cewki moczowej należą Neisseria gonorrhoeae, Chlamydia
trachomatis, Mycoplasma genitalium, Trichomonas vaginalis
oraz Ureaplasma urealyticum. Częstość występowania
różnych gatunków waha się w różnych populacjach
(Borchardt i wsp., 1995;).
(Busolo i wsp., 1997;).
(Evans i wsp., 1998a,).
(Krieger, 1995;).
(Wetmore i wsp.,
2011).
(Evans i wsp.,1998b; ).
W badaniu amerykańskim czynnikami etiologicznymi
NGU były: Ureaplasma urealyticum w 24,0%,
Chlamydia trachomatis w 22,3%, Mycoplasma genitalium
w 12,5%, TV w 2,5%, wieloczynnikowe NGU wykryto
w 9,5% przypadków, natomiast w 12,5% nie ustalono
czynnika sprawczego
(Wetmore i wsp., 2011).
Mycoplasma
hominis prawdopodobnie nie powoduje zapalenia cewki
moczowej. W większości przypadków Mycoplasma
i Ureaplasma spp. wywołują bezobjawową kolonizację
dróg układu moczowo-płciowego.
Czynniki wywołujące zapalenie cewki moczowej
pozostają zewnątrzkomórkowo w warstwie nabłonkowej
lub wnikają w nabłonek (N. gonorrhoeae i C. trachomatis),
powodując zakażenia ropne. Będące przyczyną zapalenia
cewki moczowej chlamydie i gonokoki mogą rozprzestrzeniać
się dalej poprzez drogi układu moczowo-
-płciowego, wywołując zapalenia najądrza u mężczyzn
oraz szyjki macicy, błony śluzowej macicy i jajowodów
u kobiet. Najnowsze dane sugerują, że Mycoplasma
genitalium może również powodować zapalenie szyjki
macicy i choroby zapalne w obrębie miednicy u kobiet
(Haggerty, 2008)
(LE: 3). Wydzielina śluzowo-ropna lub
ropna, bolesne oddawanie moczu (objawy dyzuryczne)
i uczucie swędzenia w obrębie cewki moczowej są objawami
zapalenia cewki moczowej. Należy zaznaczyć, że
wiele przypadków infekcji cewki moczowej przebiega
bezobjawowo.
3H.4. Diagnostyka
Barwienie wydzieliny z cewki moczowej lub wymazu
z cewki moczowej metodą Grama, które ujawnia więcej
niż pięć leukocytów w polu widzenia (w powiększeniu
1000‑krotnym), ewentualnie także wewnątrzkomórkowe
gonokoki, takie jak Gram-ujemne dwoinki – wskazują
na ropne zapalenie cewki moczowej
(Swartz i wsp., 1978)
(LE: 3, GR: B). Barwienie metodą Grama jest preferowanym
szybkim testem diagnostycznym zapalenia cewki
moczowej. Laboratoria powinny stosować zatwierdzone
testy amplifikacji kwasu nukleinowego (NAAT, ang.
nucleic acid amplification test) do wykrywania chlamydii
i rzeżączki – są one najlepszymi dostępnymi testami
służącymi do diagnozy zakażenia chlamydiami i gonokokokami
w odniesieniu do ogólnej czułości, swoistości
i łatwości transportu próbki
(Papp i wsp., 2014).
Posiewy
w kierunku N. gonorrhoeae i chlamydii są przydatne
w przypadku niepowodzeń leczenia i monitorowania
oporności na aktualne leczenie.
U wszystkich pacjentów z zapaleniem cewki moczowej
i podejrzeniem transmisji seksualnej celowe jest określenie
mikroorganizmu chorobotwórczego. Jeśli do
identyfikacji patogenów stosowany jest NAAT, można
wykorzystać próbkę moczu z pierwszego strumienia
bez pobierania wymazu z cewki moczowej. Obecność
Trichomonas sp. udaje się zwykle potwierdzić w badaniu
mikroskopowym.
3H.5. Postępowanie
3H.5.1. Leczenie gonokokowego zapalenia
cewki moczowej
W wyniku ciągłego rozprzestrzenienia się szczepów
N. gonorrhoeae opornych na działanie fluorochinolonów
ta klasa antybiotyków nie jest już zalecana w leczeniu
rzeżączki – może być stosowana w przypadku potwierdzenia
wrażliwości zgodnie z wytycznymi krajowymi. Na
niektórych obszarach obserwuje się również zwiększenie
oporności wobec cefalosporyn, w związku z tym znajomość
lokalnych wzorców wrażliwości jest niezbędna dla
prawidłowego leczenia rzeżączkowego zapalenia cewki
moczowej. Rzeżączce często towarzyszy zakażenie chlamydiami,
w związku z czym zawsze zaleca się włączenie
leczenia przeciwko chlamydiom.

3H.5.3. Leczenie zapalenia cewki moczowej
wywołanego przez Mycoplasma genitalium
Standard: azitromycyna 500 mg p.o. w pierwszym dniu,
następnie 250 mg p.o. przez kolejne 2–5 dni.
Alternatywnie: moksifloksacyna 400 mg p.o. 1 raz/
dzień przez 5 dni2
3H.5.4. Leczenie zapalenia cewki moczowej
wywołanego przez Ureaplasma urealyticum
Standard: doksycyklina 100 mg 2 razy/dzień p.o. przez 7 dni.
Alternatywnie: azitromycyna 1,0–1,5 g p.o. w dawce
pojedynczej lub klaritromycyna 500 mg 2 razy/dzień p.o.
przez 7 dni (możliwa oporność na makrolidy).
3H.5.5. Leczenie zapalenia cewki moczowej
wywołanego przez Trichomonas vaginalis
Standard: metronidazol 2 g p.o. w dawce pojedynczej.
W razie nawrotów: 4 g/dzień przez 3–5 dni.
3H.5.6. Leczenie niegonokokowego zapalenia cewki
moczowej3
Standard: doksycyklina 100 mg 2 razy/dzień p.o. przez 7 dni.
Alternatywnie: azitromycyna 500 mg p.o. w pierwszym
dniu, następnie 250 mg p.o. przez kolejne 2–5 dni.
Doksycyklinę i azitromycynę uważa się za równie
skuteczne w leczeniu zakażeń wywołanych chlamydiami,
jednak zakażenia wywołane przez Mycoplasma genitalium
mogą lepiej reagować na azitromycynę
(Falk i wsp., 2003).
Erytromycyna jest mniej skuteczna i wywołuje więcej
działań ubocznych. Fluorochinolony i doksycyklina są
przeciwwskazane u kobiet ciężarnych. Dlatego oprócz
erytromycyny i azitromycyny zalecane jest stosowanie
amoksycyliny w dawce 500 mg 3 razy/dzień przez 7 dni.
W przypadku braku powodzenia leczenia należy
wziąć pod uwagę leczenie zakażeń wywoływanych przez
T. vaginalis i/lub Mycoplasma i włączyć terapię skojarzoną
z metronidazolem (2 g p.o. w pojedynczej dawce) oraz erytromycyną
(500 mg p.o. 4 razy/dzień przez 7 dni). Podobnie
jak w przypadku innych chorób przenoszonych drogą
płciową konieczne jest leczenie partnerów seksualnych.
3H.6. Kontrola po leczeniu i zapobieganie
Leczenie powinno zostać uzupełnione o badanie kontrolne
eradykacji zakażenia. Jeśli objawy utrzymują się
lub nawracają po zakończeniu terapii, należy ponownie
przeprowadzić diagnostykę. Pacjenci powinni zostać poinformowani
o konieczności zachowania abstynencji seksualnej
przez okres min. 7 dni od wdrożenia terapii pod
warunkiem, że ustąpiły objawy choroby, a ich partnerzy
seksualni zostali odpowiednio przeleczeni. Raportowanie
i śledzenie źródła zakażenia powinno zostać wykonane
zgodnie z procedurami krajowymi i we współpracy ze
specjalistami w dziedzinie wenerologii. Osoby, u których
2 Z uwagi na doniesienia o niepowodzeniu terapii, niektórzy eksperci
zalecają przedłużenie terapii do 10–14 dni.
3 W przypadku braku ustalenia czynnika etiologicznego.
zdiagnozowano STD, powinny być poddane badaniom
w kierunku HIV oraz kiły.
3I. BAKTERYJNE ZAPALENIA GRUCZOŁU KROKOWEGO
3I.1. Wstęp
Bakteryjne zapalenie gruczołu krokowego jest jednostką
chorobową rozpoznawalną na podstawie objawów klinicznych
oraz poprzez potwierdzenie zapalenia i zakażenia
zlokalizowanego w prostacie. W zależności od czasu
trwania objawów bakteryjne zapalenie gruczołu krokowego
może mieć formę ostrego lub przewlekłego, jeśli
objawy utrzymują się przez co najmniej 3 miesiące. Zaleca
się, aby urolodzy europejscy posługiwali się klasyfikacją
zaproponowaną przez Narodowy Instytut Cukrzycy
oraz Chorób Trawienia i Nerek (NIDDK, ang. National
Institute of Diabetes and Digestive and Kidney Diseases),
będący częścią Narodowego Instytutu Zdrowia (NIH, ang.
National Institute of Health), która rozróżnia bakteryjne
zapalenie gruczołu krokowego od zespołu bólowego miednicy
mniejszej (ZBMM, ang. chronic pelvic pain syndrome).
Ostre bakteryjne zapalenie gruczołu krokowego może
być poważną infekcją. Pozajelitowe podawanie wysokich
dawek antybiotyków jest zwykle niezbędne. Środki
te mogą obejmować penicylinę o szerokim spektrum
działania, cefalosporyny trzeciej generacji lub fluorochinolony.
Wszystkie one mogą być łączone z aminoglikozydami
w początkowej fazie terapii. Leczenie jest
konieczne do czasu ustąpienia objawów i normalizacji
parametrów zapalnych (LE: 3, GR: B). W łagodniejszych
przypadkach można podawać doustne fluorochinolony
przez okres 10 dni (LE: 3, GR: B).
W przewlekłym bakteryjnym zapaleniu gruczołu krokowego
z podejrzeniami ZBMM korzystne jest zastosowanie
fluorochinolów przez okres co najmniej 4 tyg.
W przypadku istnienia oporności na fluorochinolony lub
wystąpienia niekorzystnych skutków ubocznych można
podawać doustnie trimetoprim przez 4–12 tyg. Pacjenta
należy następnie poddać ponownej ocenie i kontynuować
antybiotykoterapię, jedynie jeśli posiewy z okresu
sprzed rozpoczęcia leczenia potwierdziły zakażenie i/
lub pacjent zgłosił pozytywne skutki leczenia. Zaleca się
łączny okres leczenia trwający 4–6 tyg. (LE: 3, GR: B).
Pacjenci z zespołem przewlekłego bólu miednicy mniejszej
są poddawani leczeniu empirycznemu z wykorzystaniem
wielu procedur medycznych i fizjoterapeutycznych.
Leczeniu bólu i innych dolegliwości z nim związanych
poświęcone są wytyczne EAU w rozdziale na temat na
przewlekłego bólu miednicy mniejszej
(Engeler i wsp.,2012).
3I.2. Epidemiologia, etiologia i patogeneza
Tradycyjnie termin zapalenie gruczołu krokowego obejmował
zarówno ostre, jak i przewlekłe bakteryjne zapalenie
gruczołu krokowego, o wyraźnie zakaźnym tle,
jak również zespół zapalenia gruczołu krokowego lub
inaczej ZBMM, w którym nie można potwierdzić czynnika
zakaźnego, a którego pochodzenie jest wieloczynnikowe
i w większości przypadków niejasne.
Zapalenie gruczołu krokowego i ZBMM są rozpoznawane
poprzez objawy oraz potwierdzenie zapalenia
i zakażenia zlokalizowanego w prostacie
(Meares i Stamey,1968).
Czynnik chorobotwórczy jest jednak wykrywany
z wykorzystaniem typowych metod jedynie w 5–10%
przypadków
(Weidner i wsp., 1991),
dla których terapia
przeciwbakteryjna ma racjonalne podstawy. Pozostałej
części pacjentów staramy się pomóc empirycznie, wykorzystując
liczne procedury medyczne i fizjoterapeutyczne.
Ostatnia modyfikacja klasyfikacji i zastosowanie nowoczesnych
metod, w tym biologii molekularnej, powinny
umożliwić właściwe usystematyzowanie leczenia
(Krieger i wsp., 1999; NIDDK, 1995;),
(Schaeffer, 1999),
Ten rozdział jest poświęcony przeglądowi potwierdzonych
lub podejrzewanych zakażeń bakteryjnych prostaty
(typ I i II w tabeli 15).

3I.3. Diagnostyka
3I.3.1. Wywiad i objawy
W zależności od czasu trwania bakteryjne zapalenie gruczołu
krokowego występuje w postaci ostrej lub przewlekłej,
które są określane poprzez objawy utrzymujące się
przez co najmniej 3 miesiące
(Krieger i wsp., 1999; NIDDK, 1995;),
(Schaeffer, 1999),
Dominującymi objawami są ból
o różnej lokalizacji i LUTS (tabela 16 i 17)
(Alexander i Trissel, 1996;),
(Alexander i wsp., 1998;),
(Zermann i wsp.,1999),
Przewlekłe bakteryjne zapalenie gruczołu krokowego
jest najczęstszą przyczyną nawracających ZUM
u mężczyzn
(Krieger, 1998).
3I.3.1.1. Kwestionariusze objawowe
Objawy wydają się być bardzo użytecznym parametrem
w klasyfikacji bakteryjnego zapalenia gruczołu krokowego
i ZBMM (Krieger i wsp., 1996). Kwestionariusze dotyczące

objawów związanych z zapaleniem gruczołu krokowego
opracowano celem kwantyfikacji dolegliwości
(Krieger i wsp., 1996;).
(Nickel, 1998).
Należy do nich wskaźnik
objawów przewlekłego zapalenia gruczołu krokowego
(CPSI, ang. Chronic Prostatitis Symptom Index), który niedawno
został opracowany przez Międzynarodową Sieć
Współpracy na temat Zapalenia Prostaty (IPCN, ang.
International Prostatitis Collaborative Network) zainicjowaną
przez NIH w USA
(Litwin i wsp., 1999).
Chociaż kwestionariusz CPSI został zweryfikowany
klinicznie i zatwierdzony jako użyteczne narzędzie, jego
użyteczność do badań klinicznych nie została potwierdzona.
Kwestionariusz składa się z czterech pytań dotyczących
bólu lub dyskomfortu, dwu dotyczących oddawania
moczu oraz trzech powiązanych z jakością życia
(materiały dostępne on-line – 4.6.)
3I.3.2. Badania kliniczne
W przypadku ostrego zapalenia prostata może być
obrzęknięta (często określana klinicznie jako galaretowata)
i tkliwa, a nawet bolesna podczas DRE. Masaż gruczołu
krokowego jest przeciwwskazany. Ważną częścią
oceny klinicznej jest wykluczenie ropnia prostaty.
W przypadku trwałych objawów (objawów przewlekłego
zapalenia gruczołu krokowego) należy wziąć pod
uwagę ZBMM oraz zaburzenia ze strony innych narządów
układu moczowo-płciowego i odbytnicy.
Objawy przewlekłego zapalenia gruczołu krokowego
lub ZBMM mogą maskować gruźlicę stercza. Pyospermia
i hematospermia u mężczyzn w regionach endemicznych
lub po przebytej gruźlicy powinny skłonić do dalszych
badań w kierunku gruźlicy układu moczowo-płciowego.
3I.3.3. Posiewy z moczu i z wydzieliny stercza
Najważniejszym badaniem w diagnostyce pacjenta
z ostrym zapaleniem gruczołu krokowego jest posiew
moczu ze środkowego strumienia. Jeśli podejrzewa się
zakażenie krwiopochodne, należy wykonać również
posiew z krwi. Ważnymi badaniami w przewlekłym
zapaleniu stercza są ilościowe hodowle bakterii z określonych
lokalizacji i mikroskopowa ocena porcjowanego
moczu oraz wydzieliny stercza w teście
Mearesa i Stameya(1968)
(materiały dostępne on-line – 4.7).

Enterobacteriaceae, zwłaszcza E. coli, są głównymi
patogenami odpowiedzialnymi za ostre bakteryjne
zapalenie gruczołu krokowego (tabela 18) (Schneider
i wsp., 2003). Spektrum szczepów w przewlekłym bakteryjnym
zapaleniu gruczołu krokowego jest szersze.
Znaczenie wewnątrzkomórkowych bakterii takich jak
C. trachomatis jest niepewne (Badalyan i wsp., 2003).
U pacjentów z niedoborem odporności lub zakażeniem
HIV zapalenie gruczołu krokowego może być spowodowane
takimi patogenami jak M. tuberculosis, Candida
spp. i nietypowo Coccidioides immitis, Blastomyces dermatitidis
i Histoplasma capsulatum (Naber i Weidner, 1999).
W przypadku podejrzenia gruźlicy stercza należy przeprowadzić
badanie moczu na obecność Mycobacterium
spp. z użyciem łańcuchowej reakcji polimerazy (PCR,
ang. polymerase chain reaction).
3I.3.4. Biopsja stercza
Biopsja przezkroczowa nie jest zalecana w rutynowym
postępowaniu diagnostycznym i powinna być zarezerwowana
tylko do celów badawczych. Biopsja przezodbytnicza
stercza nie jest zalecana w bakteryjnym zapaleniu
(LE: 4, GR: C).
3I.3.5. Inne badania
Ultrasonografia transrektalna (ang. transrectal ultrasonography)
może ujawnić wewnątrzsterczowe ropnie,
zwapnienia i poszerzenie pęcherzyków nasiennych, ale
jest zawodna i nie może być stosowana jako narzędzie
diagnostyczne w zapaleniu gruczołu krokowego
(Doble i Carter, 1989).
3I.3.6. Dodatkowe narzędzia diagnostyczne
3I.3.6.1. Badanie nasienia
Analiza mikrobiologiczna ejakulatu nie jest zalecana
z powodu niskiej czułości i specyficzności w porównaniu
z próbą 2 lub 3 szklanek. Analiza nasienia jest jednak
często wykorzystywanym narzędziem w diagnostyce
zakażenia męskich gruczołów dodatkowych (MAGI)
i dostarcza informacji na temat jakości nasienia. Grupa
robocza EAU uważa, że wytyczne dotyczące zapalenia
gruczołu krokowego nie powinny zawierać określonego
zestawu badań do diagnostyki różnicowej. Doświadczony
urolog powinien zdecydować, które badania są istotne
w procesie diagnostycznym indywidualnego pacjenta.
Zwężenia cewki moczowej i zaburzenia odpływu
z pęcherza moczowego należy zawsze brać pod uwagę
i wykluczyć poprzez wykonanie badania uroflowmetrii,
wstecznej uretrografii lub endoskopii.
3I.3.6.2. Antygen swoisty dla stercza
Stężenie PSA bardzo często wzrasta w ostrym bakteryjnym
zapaleniu gruczołu krokowego i innych ZUM.
Jeśli pacjent ma podwyższone PSA i objawy wskazujące
na zapalenie gruczołu krokowego, stężenie PSA w surowicy
powinno ulec normalizacji po leczeniu przeciwbakteryjnym
w ciągu 4 tyg. u ok. 50% pacjentów
(Bozeman i wsp., 2002).
Można założyć, że po okresie co najmniej
3 miesięcy zostanie osiągnięty stabilny poziom PSA.
Pomiar wolnego i całkowitego PSA nie daje praktycznych
informacji diagnostycznych w zapaleniu gruczołu
krokowego
(Polascik i wsp., 1999).
3I.4. Postępowanie
3I.4.1. Antybiotyki
Antybiotyki są środkami ratującymi życie w ostrym bakteryjnym
zapaleniu gruczołu krokowego i rekomendowanymi
w leczeniu przewlekłego bakteryjnego zapalenia
gruczołu krokowego.
Ostre bakteryjne zapalenie gruczołu krokowego jest
poważną infekcją przebiegającą z gorączką, intensywnymi
dolegliwościami bólowymi i objawami ogólnymi. Zaleca
się dożylne podawanie wysokich dawek antybiotyków
o szerokim spektrum działania, takich jak penicylina
o szerokim spektrum, cefalosporyny trzeciej generacji
lub fluorochinolony. Na etapie leczenia początkowego
którykolwiek z tych antybiotyków może być stosowany
w połączeniu z aminoglikozydami. Po ustaniu lub złagodzeniu
objawów i normalizacji parametrów stanu zapalnego
chory może zostać przestawiony na leczenie doustne
przez łączny okres 2–4 tyg.
(Schaeffer i wsp., 2003).
Zalecane antybiotyki w przewlekłym bakteryjnym
zapaleniu prostaty łącznie z ich zaletami i wadami są
wymienione w tabeli 19
(Bjerklund Johansen i wsp., 1998).
Fluorochinolony, takie jak ciprofloksacyna i lewofloksacyna,
są uznanymi lekami z wyboru ze względu na ich
korzystne właściwości farmakokinetyczne
(Bjerklund Johansen i wsp., 1998).
(LE: 2b, GR: B), ich ogólnie dobry
profil bezpieczeństwa oraz działanie przeciwko bakteriom
Gram-ujemnym, włącznie z P. aeruginosa. Ponadto lewofloksacyna
jest aktywna wobec Gram-dodatnich i atypowych
patogenów, takich jak C. trachomatis i Mycoplasma
(LE: 2b, GR: B).
Łączny czas trwania antybiotykoterapii wynika
z doświadczenia, ekspertyz i wsparty jest licznymi
badaniami klinicznymi
(Naber, 2003).
W przewlekłym
bakteryjnym zapaleniu gruczołu krokowego antybiotyki
należy podawać przez okres 4–6 tyg. od wstępnego
rozpoznania. Konieczne są stosunkowo wysokie dawki
i preferowana jest terapia doustna
(Bjerklund Johansen i wsp., 1998).
(Naber, 2003).
(LE: 3, GR: B). Jeśli wykryto
lub podejrzewa się występowanie bakterii wewnątrzkomórkowych,
należy podawać tetracykliny lub erytromycynę
(Bjerklund Johansen i wsp., 1998).
(Ohkawa i wsp., 1993).
(LE: 2b, GR: B).
3I.4.2. Dosterczowe injekcje antybiotyków
Ta metoda leczenia nie została oceniona w kontrolowanych
badaniach klinicznych i nie powinna być stosowana
(Jimenez-Cruz i wsp., 1988;).
(Mayersak, 1998).
3I.4.3. Drenaż i zabiegi operacyjne
Ok. 10% mężczyzn z ostrym zapaleniem gruczołu krokowego
doświadcza zatrzymania moczu
(Hua i wsp.,2005),
które wymaga wytworzenia cystostomii, cewnikowania
przerywanego bądź stałego zacewnikowania.
Wytworzenie cystostomii nadłonowej jest ogólnie zalecaną
metodą odprowadzenia moczu w zapaleniu gruczołu
krokowego. Niepotrzebne zastosowanie cewnika
przy braku zalegania moczu może zwiększać ryzyko progresji
do przewlekłego zapalenia gruczołu krokowego
(Yoon i wsp., 2012).
Leczenie alfa-blokerami jest również
zalecane, ale kliniczne dowody na ich korzystne działanie
są słabe.
W przypadku ropnia gruczołu krokowego zarówno
drenaż, jak i konserwatywne strategie leczenia wydają się
być zasadne
(Ludwig i wsp., 1999).
Znaczenie ma wielkość
ropnia. W jednym z badań leczenie zachowawcze było
skuteczne, jeśli ropień był mniejszy niż 1 cm, podczas
gdy większe ropnie były drenowane przez jednorazowe
nakłucie i aspirację lub ciągły drenaż
(Chou i wsp., 2004).
Należy unikać chirurgicznego leczenia bakteryjnego zapalenia
gruczołu krokowego.
3J. ZAPALENIE JĄDRA I NAJĄDRZA
3J.1. Wstęp
Zapalenie jąder (łac. orchitis) i najądrzy (łac. epidydimitis)
ze względu na objawy początkowe oraz przebieg kliniczny
klasyfikuje się jako ostre lub przewlekłe. Najczęstszym
rodzajem zapalenia jąder jest poświnkowe zapalenie
jąder, które rozwija się u 20–30% pacjentów z zakażeniem
wirusem świnki po okresie dojrzewania. Jeśli
podejrzewa się świnkowe zapalenie jąder, dodatni wywiad
zapalenia ślinianek przyusznych i obecność przeciwciał
IgM w surowicy potwierdzają rozpoznanie.

Zapalenie najądrza jest prawie zawsze jednostronne
i o stosunkowo nagłym początku. U młodych mężczyzn
jest związane z aktywnością seksualną i infekcją partnerki/
partnera (LE: 3). U większości aktywnych seksualnie
mężczyzn w wieku <35 lat jest wywołane przez
mikroorganizmy przenoszone drogą płciową, podczas
gdy u pacjentów w podeszłym wieku zazwyczaj przez
powszechne patogeny dróg moczowych (LE: 3). Zapalenie
najądrza powoduje ból i obrzęk, który rozpoczyna się
w ogonie najądrza i może rozprzestrzeniać się na pozostałą,
dystalną część najądrzy oraz na tkanki jądra.
Powrózek nasienny jest zwykle tkliwy lub bolesny
i obrzęknięty. Konieczne jest, aby lekarz potrafił różnicować
zapalenie najądrzy od skrętu szypuły jądra tak
szybko, jak tylko jest to możliwe na podstawie wszystkich
dostępnych informacji.
Mikrobiologiczna etiologia zapalenia najądrza może
być zwykle określona przez barwienie metodą Grama
wymazu z cewki moczowej i/lub moczu ze środkowego
strumienia celem wykazania obecności bakterii Gram‑ujemnych
(LE: 3). Pobranie wymazu z cewki moczowej
czy też próbki moczu ze środkowego strumienia należy
wykonać przed włączeniem antybiotykoterapii (GR: C).
Środki przeciwdrobnoustrojowe powinny być wybierane
na podstawie danych empirycznych przemawiających
za tym, że u młodych, aktywnych seksualnie mężczyzn
czynnikiem wywołującym jest zwykle Chlamydia trachomatis,
natomiast u starszych mężczyzn czynnikiem
sprawczym są powszechnie występujące uropatogeny.
Fluorochinolony aktywne wobec C. trachomatis (np.
ofloksacyna i lewofloksacyna) powinny być lekami pierwszego
rzutu. Jeśli wykryto C. trachomatis, leczenie może
być kontynuowane doksycykliną w dawce 200 mg/dobę
przez co najmniej 2 tyg. Makrolidy mogą być stosowane
alternatywnie (GR: C). Terapia wspomagająca obejmuje
odpoczynek – reżim łóżkowy, elewację jąder oraz środki
przeciwzapalne. W przypadku wykrycia zapalenia najądrzy
C. trachomatis zaleca się również leczenie osoby
współżyjącej płciowo (partnerki/partnera seksualnego)
(GR: C). Powstałe ropnie w przebiegu zapalenia najądrza
lub jąder wymagają leczenia chirurgicznego. Przewlekłe
zapalenie najądrza czasami może być pierwszą kliniczną
manifestacją gruźlicy układu moczowo-płciowego.
3J.2. Epidemiologia, etiologia i patofizjologia
Brak jest nowych danych dotyczących chorobowości
i zapadalności na zapalenie najądrza. Według starszych
analiz ostre zapalenie najądrza było główną przyczyną
hospitalizacji personelu wojskowego
(Berger, 1984)
(LE: 3).
Ostre zapalenie najądrza u młodych ludzi związane jest
z aktywnością seksualną i zakażeniem partnerki/partnera
(Robinson i wsp., 1990)
(LE: 3).
Najczęstszym rodzajem zapalenia jąder jest poświnkowe
zapalenie jąder, które rozwija się u 20–30%
pacjentów z zakażeniem wirusem świnki po okresie dojrzewania.
Częstość jego występowania zależy od rozpowszechnienia
w populacji
(Rüther i wsp., 1995).
Pierwotne
przewlekłe zapalenie jąder jest chorobą ziarniniakową,
bardzo rzadką i o niejasnej etiologii – w literaturze zostało
opisanych ok. 100 przypadków
(Aitchison i wsp., 1990).
Powikłaniami zapalenia jądra i najądrza są ropnie,
niedokrwienie lub zawał jądra, zanik jądra, rozwój przewlekłego
stwardnienia najądrzy oraz niepłodność
(Berger,1984).
Zapalenie najądrza wywołane przez mikroorganizmy
przenoszone drogą płciową występuje głównie u aktywnych
seksualnie mężczyzn w wieku <35 lat
(Berger, 1984;)
(Weidner i wsp., 1987)
(LE: 3). Większość przypadków
zapalenia najądrzy jest wywołana przez powszechnie
występujące patogeny układu moczowego, które również
są najczęstszą przyczyną bakteriomoczu
(Berger, 1984;)
(Weidner i wsp., 1987)
(LE: 3). Przeszkoda podpęcherzowa
i wady układu moczowo-płciowego są również czynnikami
ryzyka dla tego typu infekcji.
Zazwyczaj zapalenie najądrza rozprzestrzenia się
drogą wstępującą z cewki moczowej lub zstępującą
z pęcherza moczowego. W niespecyficznym zapaleniu
ziarniniakowym jądra zakłada się, że za wywołanie przewlekłego
stanu zapalnego odpowiedzialne są mechanizmy
autoimmunologiczne
(Aitchison i wsp., 1990; ).
(Nistal, 1984).
Zapalenie jąder u dzieci i świnkowe zapalenie są pochodzenia
krwiopochodnego
(Nistal, 1984).
Zapalenie jądra i najądrza jest obserwowane w zakażeniach
ogólnoustrojowych takich jak gruźlica, kiła, bruceloza
i zakażeniach kryptokokowych.
3J.3. Klasyfikacja
Zapalenie najądrza powoduje ból i obrzęk, który jest
prawie zawsze jednostronny i o stosunkowo ostrym
początku. W niektórych tylko przypadkach w proces
zapalny zaangażowane są jądra. Z drugiej strony procesy
zapalne jąder, a zwłaszcza te wywołane przez wirusy,
często obejmują też najądrza.
Zapalenie jąder i najądrzy klasyfikuje się jako ostre lub
przewlekłe – zależnie od wystąpienia objawów początkowych
i przebiegu klinicznego. Przewlekła choroba ze
stwardnieniem rozwija się w 15% przypadków ostrego
zapalenia najądrza. W przypadku współwystępowania
zapalenia jąder przewlekłe zapalenie może spowodować
zanik jąder i zaburzenie spermatogenezy
(Berger, 1984; ).
(Naber i Weidner, 1999 ).
3J.4. Diagnostyka
W przypadku ostrego zapalenia najądrza objawy zapalne
i obrzęk zwykle zaczynają się w obrębie ogona najądrza
i mogą przemieszczać się w kierunku dystalnej
części najądrza oraz tkanek jądra. Powrózek nasienny
jest zwykle tkliwy lub bolesny i obrzęknięty. Wszyscy
chorzy z zapaleniem najądrza, które jest spowodowane
przez mikroorganizmy przenoszone drogą płciową, mają
dodatni wywiad ekspozycji seksualnej, a do zakażenia
patogenami mogło dojść na wiele miesięcy poprzedzających
wystąpienie objawów. Jeżeli pacjent jest badany bezpośrednio
po oddaniu moczu, wyciek z cewki moczowej
może być niezauważony, ponieważ krwinki białe i bakterie
mogły zostać wypłukane z cewki moczowej podczas
oddawania moczu.
Etiologia zapalenia najądrzy może być zwykle określona
przez barwienie metodą Grama wymazu z cewki
moczowej i/lub próbki moczu ze środkowego strumienia
celem wykazania obecności bakterii Gram-ujemnych.
Obecność wewnątrzkomórkowych dwoinek gram-
-ujemnych w rozmazie wskazuje na zakażenie N. gonorrhoeae.
Obecność samych leukocytów w wymazie z cewki
moczowej wskazuje na niegonokokowe zapalenie cewki
moczowej. C. trachomatis jest izolowana u ok. 2/3 pacjentów
(Berger, 1984; ).
(Weidner i wsp., 1987 ).
(LE: 3).
Analiza ejakulatu według kryteriów WHO wykazująca
obecność leukocytów wskazuje na trwały proces zapalny.
W wielu przypadkach obecne jest przemijające zmniejszenie
liczby plemników i ich ruchliwości. Azoospermia
spowodowana całkowitą niedrożnością obu najądrzy jest
rzadkim powikłaniem. Jeśli podejrzewa się świnkowe
zapalenie jąder, dodatni wywiad w kierunku zapalenia
ślinianek przyusznych i obecność przeciwciał IgM w surowicy
wskazują na trafność rozpoznania. W ok. 20% przypadków
zapalenia jąder wywołanego wirusem świnki
u mężczyzn po okresie dojrzewania choroba występuje
obustronnie ze znacznym ryzykiem atrofii jąder i azoospermii
(Robinson i wsp., 1990).
(LE: 3).
3J.4.1. Diagnostyka różnicowa
Konieczne jest przeprowadzenie diagnostyki różnicowej
między zapaleniem najądrzy a skrętem powrózka nasiennego
najszybciej, jak to tylko możliwe, przy wykorzystaniu
wszystkich dostępnych metod i informacji, w tym
wieku pacjenta, wywiadu w kierunku zapalenia cewki
moczowej, oceny klinicznej i badania USG z oceną przepływu
krwi z wykorzystaniem funkcji Dopplera (duplex).
3J.5. Postępowanie
Tylko kilka badań dotyczyło pomiaru penetracji leków
przeciwdrobnoustrojowych do najądrza i jądra u ludzi.
Spośród nich fluorochinolony wykazały najkorzystniejsze
właściwości
(Kulchavenya i Chul-sung, 2010; ).
(Ludwig i wsp.,1997).
(LE: 2a).
Środki przeciwbakteryjne powinny być dobrane empirycznie
na podstawie danych wskazujących, że u większości
aktywnych seksualnie mężczyzn w wieku <35 lat
zapalenie jądra i/lub najądrza jest wywołane przez C. trachomatis,
podczas gdy u pacjentów w starszym wieku
z LUTS o etiologii BPH lub innymi zaburzeniami mikcji
zazwyczaj przez powszechne patogeny dróg moczowych.
Badania, które porównywały wyniki mikrobiologiczne
z nakłucia najądrza i wymazów z cewki moczowej oraz
moczu, wykazały bardzo dobrą korelację. Dlatego też zanim
włączona zostanie antybiotykoterapia, należy pobrać
wymaz z cewki moczowej oraz próbkę moczu ze środkowego
strumienia do badań mikrobiologicznych (GR: C).
Lekami pierwszego rzutu powinny być fluorochinolony,
najlepiej te o aktywności wobec C. trachomatis (np.
ofloksacyna i lewofloksacyna), ze względu na ich szerokie
spektrum przeciwbakteryjne i ich dobrą penetrację do
tkanek dróg moczowo-płciowych. Jeśli potwierdzonym
czynnikiem sprawczym jest C. trachomatis, leczenie może
być kontynuowane doksycykliną w dawce 200 mg/dobę
przez co najmniej 2 tyg. Makrolidy mogą być stosowane
jako środki alternatywne (GR: C).
Terapia wspomagająca obejmuje reżim łóżkowy, elewację
jąder i terapię przeciwzapalną. U młodych mężczyzn
zapalenie najądrzy może prowadzić do trwałej
niedrożności przewodów najądrza, a tym samym do
niepłodności. W związku z tym powinno się rozważyć
terapię przeciwobrzękową metyloprednizolonem w dawce
początkowej 40 mg/dobę, zmniejszając dawkę o połowę
co drugi dzień (GR: C).
W przypadku zapalenia najądrzy wywołanego przez
C. trachomatis leczenie powinno również objąć partnerkę/
partnera seksualną (GR: C). Jeśli czynnikiem sprawczym
są powszechnie występujące uropatogeny, należy przeprowadzić
dokładną diagnostykę zaburzeń oddawania
moczu w celu zapobieżenia nawrotom (GR: C). Ropnie
powstałe w wyniku zapalenia najądrzy lub zapalenia jąder
wymagają leczenia chirurgicznego. Przewlekłe zapalenie
najądrzy może być pierwszym klinicznym objawem gruźlicy
układu moczowo-płciowego.
3K. ZGORZEL (GANGRENA) FOURNIERA
3K.1. Wstęp
Całkowite, powtarzane oczyszczenie chirurgiczne
należy rozpocząć w ciągu 24 godz. od rozpoznania
(LE: 3: GR: B).yy Leczenie antybiotykami o szerokim spektrum
działania należy rozpocząć od chwili rozpoznania,
z następczą modyfikacją zgodną z wynikami posiewu
i stanem klinicznym (LE: 3, GR: B).
yy Leczenie wspomagające takimi środkami jak immunoglobuliny
czy użycie komory hiperbarycznej nie jest
zalecane, z wyjątkiem wykorzystania w badaniach
klinicznych (LE: 3, GR: C).
Zgorzel Fourniera jest agresywnym i często śmiertelnym,
wielobakteryjnym zakażeniem tkanek miękkich
krocza, okolicy okołoodbytniczej i zewnętrznych
narządów płciowych. Jest to anatomiczna podkategoria
martwiczego zapalenia powięzi. Zalecenia dotyczące rozpoznania
i leczenia pochodzą głównie z obserwacji serii
przypadków oraz ekspertyz biegłych (LE: 3/4).
3K.2. Rozpoznanie/Diagnostyka
Zgorzel Fourniera występuje dość rzadko, lecz jej występowanie
wzrasta wraz ze starzeniem się populacji, coraz
częstszym występowaniem cukrzycy oraz pojawianiem
się wielolekoopornych patogenów. Zazwyczaj obecny jest
bolesny obrzęk moszny i krocza z ciężką sepsą. Badanie
przedmiotowe wykazuje obecność małych obszarów
martwicy skóry z okalającym rumieniem i obrzękiem.
Trzeszczenie podczas badania palpacyjnego i obecność
cuchnącego wysięku występuje w bardziej zaawansowanych
stadiach choroby. Czynniki ryzyka obejmują
pacjentów o obniżonej odporności, chorych z cukrzycą
lub niedożywieniem oraz po niedawno przebytym cewnikowaniu,
instrumentacji lub zabiegu w okolicy krocza.
W ponad 40% przypadków początek choroby jest bardzo
podstępny – objawem mogą być jedynie dolegliwości
bólowe, co często prowadzi do opóźnienia leczenia.
Należy wykazywać dużą podejrzliwość i skrupulatność
w trakcie badania fizykalnego, zwłaszcza u pacjentów
otyłych.
3K.2.1. Mikrobiologia
Zgorzel Fourniera jest zwykle martwiczym zapaleniem
powięzi typu 1 wywołanym florą mieszaną, w tym przez
Staphylococcus aureus, Streptococcus sp, Klebsiella sp., E. coli
i bakterie beztlenowe. Udział Clostridium sp. jest coraz
rzadszy. Organizmy te wydzielają endotoksyny powodujące
martwicę tkanek i poważne zaburzenia układu
sercowo-naczyniowego. Późniejsza reakcja zapalna gospodarza
przyczynia się do niewydolności wielonarządowej
i śmierci
3K.3. Postępowanie
Stopień martwicy wewnętrznej jest zazwyczaj znacznie
większy, niż wynikałoby to z objawów zewnętrznych,
a tym samym odpowiednie całkowite i powtarzane chirurgiczne
oczyszczenie jest konieczne do uratowania życia
pacjenta (LE: 3, GR: B). Specyficzne dla choroby systemy
punktacji ciężkości nie wydają się być lepsze od ogólnych
systemów klasyfikacyjnych stosowanych w stanach
krytycznych i dlatego nie zaleca się ich do rutynowego
stosowania (LE: 3, GR: C). TK lub MRI mogą pomóc
zidentyfikować zaburzenia okołoodbytnicze sugerujące
potrzebę wyłonienia kolostomii (LE: 3, GR: C). Wnioski
z serii przypadków wskazują, że oczyszczenie chirurgiczne
powinno być wczesne (<24 godz.) i kompletne,
ponieważ opóźnione i/lub niewystarczające leczenie
chirurgiczne skutkuje większą śmiertelnością (LE: 3,
GR: B). Jednocześnie należy włączyć antybiotykoterapię
dożylną o szerokim spektrum działania (LE: 3, GR: B).
Po uzyskaniu wyników posiewów z rany można zmodyfikować
leczenie zgodnie z antybiogramem. Korzyści
z leczenia immunoglobulinami i hiperbarycznym tlenem
są niepewne i dlatego nie powinny być rutynowo stosowane
(LE, 3: GR: C). Odpowiednie wczesne leczenie chirurgiczne
i farmakologiczne zapewnia przeżycie >70%
w zależności od grupy pacjentów i dostępności intensywnej
opieki (LE: 3). Po ustąpieniu objawów niezbędna
jest plastyczna rekonstrukcja z użyciem przeszczepów
skóry
(Erol i wsp., 2010; Ozturk i wsp., 2011; Roghmann i wsp., 2012; Sarani i wsp., 2009).
(Erol i wsp., 2010;).
(Ozturk i wsp., 2011;).
(Roghmann i wsp., 2012;).
(Sarani i wsp., 2009).
być przez >30 czynników chorobotwórczych. Jednak
nie wszystkie patogeny, które mogą być przenoszone
drogą płciową, manifestują się objawami z narządów
płciowych, a nie wszystkie zakażenia narządów płciowych
są przenoszone wyłącznie drogą płciową. Odsyłamy
czytelnika do wytycznych leczenia STD opublikowanych
przez CDC w 2010 r. i ich późniejszych aktualizacji
(Workowski i Berman, 2010).
Wirus HIV powoduje choroby układu odpornościowego,
prowadząc do szerokiego spektrum powikłań
i skomplikowanych schorzeń znanych jako AIDS. Rzadko
daje on objawy ze strony układu moczowo-płciowego. Ten
temat wychodzi poza zakres niniejszych wytycznych.
3M. ZAKAŻENIA SPECYFICZNE
Gruźlica układu moczowo-płciowego oraz bilharcjoza
są dwoma infekcjami, które mogą przebiegać z zajęciem
układu moczowo-płciowego. Chociaż w Europie
nie ma endemicznych ognisk, przypadki gruźlicy układu
moczowo-płciowego są czasami rozpoznawane we wszystkich
społecznościach. W świecie globalizacji podróżujący
regularnie stykają się z sytuacjami, w których może dojść
do zakażenia. Wytyczne dotyczące diagnostyki i postępowania
w tego rodzaju infekcjach zostały opublikowane
(Çek i wsp., 2005;).
(Kulchavenya i Chul-sung, 2010;).
(Lenki Yasuda, 2010;).
(Schneede i wsp., 2003).
3M.1. Gruźlica urogenitalna
Szacuje się, że prawie 1/3 światowej populacji jest zakażona
M. tuberculosis. Gruźlica jest najczęstszym zakażeniem

oportunistycznym u pacjentów z AIDS. Gruźlica układu
moczowo-płciowego nie jest bardzo powszechna, ale
jest uważana za ciężką postać gruźlicy pozapłucnej.
Rozpoznanie gruźlicy układu moczowo-płciowego jest
oparte na posiewach wyodrębniających patogeny wywołujące
zakażenie; jednakże czasami może być konieczna
biopsja z pobraniem materiału na tradycyjny nośnik
stały. Leki są terapią pierwszego rzutu w grużlicy układu
moczowo-płciowego. 6-miesięczne schematy leczenia są
skuteczne u większości pacjentów. Mimo że farmakoterapia
jest podstawową formą leczenia, postępowanie chirurgiczne
w postaci ablacji lub rekonstrukcji może być niezbędne.
Zarówno zabiegi radykalne, jak i rekonstrukcyjne
powinny być przeprowadzane w ciągu pierwszych 2 miesięcy
intensywnej farmakoterapii. Leczenie powinno być
prowadzone przez specjalistę zajmującego się gruźlicą lub
w bezpośredniej z nim współpracy
(Kulchavenya i Chulsung,2010;).
(Lenk i Yasuda, 2010;).
(Schneede i wsp., 2003).
3M.2. Bilharcjoza (schistosomatoza) urogenitalna
Ponad 200 mln ludzi na świecie dotkniętych jest bilharcjozą,
która wywołana jest przez przywry Schistosoma
haematobium. Podróżujący powinni podjąć środki ostrożności.
Dla ludności na terenach endemicznych konieczne
jest zintegrowane podejście, w tym edukacja zdrowotna.
Skuteczne leczenie farmakologiczne jest dostępne
(Çek i wsp., 2005).
3N.1. Wstęp
Celem profilaktyki antybakteryjnej w chirurgii urologicznej
jest zmniejszenie liczby mikroorganizmów w polu
operacyjnym w czasie operacji aby zapobiec zakaźnym
komplikacjom wynikającym z procedur diagnostyczno-
-leczniczych. Zbyt ograniczone są dowody, by można
było wskazać najkorzystniejsze antybiotyki i schematy
profilaktyczne (tabela 20).
Przed zabiegiem konieczne jest sklasyfikowanie
pacjentów w odniesieniu do:
ogólnego stanu zdrowia zgodnie z wytycznymi
Amerykańskiego Towarzystwa Anestezjologii (ASA,
ang. American Society of Anesthesiology), wynik P1–P5,
obecności ogólnych czynników ryzyka, takich jak
podeszły wiek, cukrzyca, zaburzenia układu immunologicznego,
niedożywienie lub otyłość,
obecności endogennych lub egzogennych specyficznych
czynników ryzyka, takich jak ZUM lub infekcje
układu moczowo-płciowego, stałe cewnikowanie,
nadmiar bakterii, wcześniejsze zabiegi lub czynniki
genetyczne,
rodzaju zabiegu chirurgicznego i zanieczyszczenia
pola operacyjnego,
oczekiwanego poziomu inwazyjności chirurgicznej,
czasu trwania i aspektów technicznych zabiegu.
Dobrze udokumentowane są jedynie: przezodbytnicza
biopsja rdzeniowa prostaty (LE: 1b, GR: A) i TUR-P
(LE: 1a, GR: A). Brak jest dowodów na istnienie jakichkolwiek
korzyści ze stosowania okołozabiegowej profilaktyki
antybiotykowej w standardowych, nieskomplikowanych
procedurach endoskopowych oraz pozaustrojowej litotrypsji,
chociaż zaleca się korzystanie z niej w skomplikowanych
procedurach i u pacjentów ze zidentyfikowanymi
czynnikami ryzyka.
Nie zaleca się stosowania profilaktyki antybiotykowej
przy czystych operacjach, podczas gdy pojedyncza lub jednodniowa
antybiotykoterapia zalecana jest w operacjach
czystych-skażonych. Podejście w operacjach skażonych
zależy od rodzaju procedury, stopnia zanieczyszczenia
pola operacyjnego i poziomu trudności. Otwarcie dróg
moczowych uznać można za zabieg czysty-skażony.
Zaleca się wykonanie posiewu moczu przed każdą
interwencją zabiegową, a obecność bakterii kontroluje
się poprzez zastosowanie ukierunkowanej przedzabiegowej
antybiotykoterapii (LE: 1b, GR: A).
Pojedyncza dawka lub krótkotrwały cykl antybiotykoterapii
może być podawany pozajelitowo lub doustnie.
Droga podania antybiotyku zależy od rodzaju interwencji
i charakterystyki pacjenta. Podanie doustne dotyczy
leków, które mają dobrą biodostępność. W przypadku
ciągłego odprowadzania moczu przedłużona okołooperacyjna
profilaktyka antybiotykowa nie jest zalecana.
Wiele antybiotyków nadaje się do profilaktyki okołooperacyjnej,
jak np. kotrimoksazol, cefalosporyny drugiej
generacji, fluorochinolony, aminopenicyliny z inhibitorem
beta-laktamazy i aminoglikozydy. Antybiotyki z szerszym
spektrum, w tym fluorochinolony i karbapenemy,
powinny być stosowane ostrożnie i być zarezerwowane
do wyjątkowych przypadków. Dotyczy to również stosowania
wankomycyny.
Stosowanie antybiotyków powinno opierać się na
wiedzy o lokalnym profilu wrażliwości antybiotykowej
patogenów. Najlepszą praktyką jest nadzór i kontrola
powikłań infekcyjnych.
Niniejszy rozdział ma na celu wyjaśnienie aktualnego
stanu wiedzy oraz zaproponowanie praktycznych zaleceń
w oparciu o kilka istniejących przeglądów systematycznych
(Alsaywid i Smith, 2013; ),
( Bootsma i wsp., 2008),
badań
klinicznych, ekspertyz i konsensusu ekspertów. Rozdział
również bierze po uwagę zalecenia towarzystw, takich jak
Towarzystwo Chemioterapii Paula Ehrlicha, odpowiednich
grup roboczych Niemieckiego Towarzystwa Urologicznego
(Naber i wsp., 2001b),
Francuskiego Towarzystwa Urologicznego
(SFAR, 1999),
Szwedzkiej Rady ds. Oceny
Technologii Medycznych – Swedish Council on Health
Technology Assessment (SBU, 2010), Międzyuczelnianej
Szkockiej Sieci ds. Wytycznych – Scottish Intercollegiate
Guidelines Network (SIGN, 2014) i konsensus międzynarodowej
grupy roboczej
(Naber i wsp., 2010).
Zespół Panelu Wytycznych EAU ds. urologicznych
infekcji przedstawił dodatkowo próbną klasyfikację
urologicznych procedur w stosunku do poziomu

zanieczyszczenia w miejscu zabiegu chirurgicznego w celu
ułatwienia podejmowania decyzji zastosowania profilaktyki
antybiotykowej w przypadkach braku dowodów
(Grabe i wsp., 2012).
Badania GPIU wykazały, że ok. 10% pacjentów urologicznych
przechodziło szpitalne ZUM
(Bjerklund Johansen i wsp., 2007).
Ponadto przegląd wykazał duże rozbieżności
w stosowaniu profilaktyki antybiotykowej we
wszystkich rodzajach procedur oraz duże różnice między
krajami i niską zgodność z wytycznymi
(Çek i wsp., 2013)
Znaczny wzrost rozwoju oporności bakterii podkreśla
potrzebę rygorystycznej polityki antybiotykowej w całej
Europie i stosowania procedur zgodnych z zaleceniami
(Wagenlehner i wsp., 2013a).
3N.1.1. Cele okołooperacyjnej profilaktyki
przeciwbakteryjnej
Profilaktyka antybiotykowa i terapia to dwie różne
kwestie. Profilaktyka antybiotykowa ma na celu zapobieganie
zakażeniom związanym z opieką zdrowotną wynikających
z procedur diagnostycznych i terapeutycznych.
Profilaktyka antybiotykowa jest tylko jednym z kilku
środków zapobiegania zakażeniom i nie może zrekompensować
niedostatecznego poziomu higieny i stosowania
nieodpowiednich technik operacyjnych. W przeciwieństwie
do tego antybiotykoterapia terapeutyczna jest leczeniem
klinicznie podejrzewanych lub mikrobiologicznie
potwierdzonych infekcji.
Centrum Kontroli Chorób przedstawiło definicje,
które są obecnie najbardziej wszechstronne i zalecane
do oceny powikłań infekcyjnych
(Horan i Gaynes, 2004).
Definicje te również zostały wykorzystane w badaniu
GPIU
(Bjerklund Johansen i wsp., 2007).
Zmiana definicji
i rekomendacji jest brana pod uwagę
(rozdział 2. w Naber i wsp., 2010).
Tabela 21 przedstawia różne rodzaje powikłań
infekcyjnych spotykanych w chirurgii urologicznej.
Punktami końcowymi okołooperacyjnej profilaktyki
w urologii są powikłania infekcyjne bezpośrednio
związane z procedurą zabiegową (tabela 21). Może być
nim także kolonizacja bakteriami, a nawet drobne
infekcje ran. Bezobjawowy bakteriomocz po TUR-P lub
innych zabiegach endourologicznych może zaniknąć
samoistnie i zwykle pozostaje bez znaczenia klinicznego.
3N.2. Czynniki ryzyka
Czynniki ryzyka (tabela 1 i 22) są niedoceniane w większości
badań. Są jednak ważne w przedoperacyjnej
ocenie pacjenta
(Grabe i wsp., 2012).
Są one związane z:
yy ogólnym stanem zdrowia pacjenta wg ASA P1–P5,
yy występowaniem ogólnych czynników ryzyka takich
jak: podeszły wiek, cukrzyca, zaburzenia układu
immunologicznego, niedożywienie, skrajne masy ciała,
yy obecnością endogennych lub egzogennych specyficznych
czynników ryzyka, takich jak: przebieg infekcji
dróg moczowych lub układu moczowo-płciowego,
stałe zacewnikowanie, bakteriemia, wcześniejsze
zabiegi w zakresie układu moczowo-płciowego, czynniki
genetyczne,
yy rodzajem zabiegu chirurgicznego i skażenia w polu
operacyjnym,
yy oczekiwanym poziomem inwazyjności chirurgicznej,
czasem trwania zabiegu i jego aspektami technicznymi.
Tradycyjna klasyfikacja procedur chirurgicznych
według
Cruse i Foord (1980)
na zabiegi czyste, czyste-
-skażone/skażone, skażone i brudne dotyczy operacji
otwartych – nie dotyczy interwencji endourologicznych.
Obecne wytyczne kwalifikują procedury z wejściem do
układu moczowego i naruszeniem ciągłości błony śluzowej
jako czyste-skażone, gdyż posiew moczu nie zawsze
jest wskaźnikiem obecności bakterii. Należy pamiętać,
że dolne drogi układu moczowo-płciowego są skolonizowane
przez mikroflorę – nawet w obecności jałowego
wyniku posiewu moczem
Grabe, 2004;
Grabe i wsp.,2012
Obecność bakteriomoczu u pacjentów bez innych
objawów wykazana w przedoperacyjnie wykonanym


posiewie moczu jest wskażnikiem poziomu skażenia
(tabela 24).
Ryzyko zakażenia zależy od rodzaju interwencji zabiegowej.
Szeroki wachlarz rodzajów interwencji i aktualne
postępy w chirurgii małoinwazyjnej jeszcze bardziej komplikują
wyznaczenie jednoznacznych zaleceń i rekomendacji.
Ponadto narażenie na obecność patogenów, czas
trwania zabiegu i komplikacje w jego trakcie, umiejętności
chirurga oraz krwawienie okołooperacyjne mogą
również wpływać na ryzyko infekcji
Cruse i Foord, 1980;
Grabe, 2004;
Horan i Gaynes, 2004
Ogólne oraz szczególne
czynniki ryzyka związane z drogami moczowymi
muszą być brane pod uwagę (tj. bakteriuria, uropatie
zaporowe) przed każdym planowym zabiegiem.
3N.3. Zasady profilaktyki antybiotykowej
Profilaktyka antybiotykowa ma na celu ochronę chorego,
lecz nie kosztem propagowania lekooporności. Istnieją
jednak dowody na to, że umiejętne wykorzystanie profilaktyki
może obniżyć ogólne zużycie antybiotyków
Grabe i wsp., 1987;
Wagenlehner i wsp., 2005
Istotne jest, aby
zindywidualizować stosowaną profilaktykę antybiotykową
w zależności od skumulowania czynników ryzyka
u konkretnego chorego
(Grabe i wsp., 2001).
Zdecydowanie
zalecane jest wykonanie posiewów moczu przed każdą
planową operacją lub zabiegiem. Antybiotyki nie mogą
zastąpić innych, podstawowych środków mających na
celu zmniejszenie ryzyka infekcji
(Adam i Daschner, 1993;).
(Blumenberg i Abrutyn, 1997;).
(Mignard, 2004).
3N.3.1. Ramy czasowe
Istnieją ścisłe ramy czasowe stosowania profilaktyki antybiotykowej.
Mimo że niniejsze wytyczne bazują na badaniach
nad ranami skóry
(Burke, 1961)
oraz czystymi-skażonymi
i skażonymi ranami w chirurgii jelita grubego,
to wydaje się zasadne, że te same wnioski odnoszą się
do chirurgii urologicznej. Optymalny okres stosowania
profilaktyki antybiotykowej to 1–2 godz. przed instrumentacją.
Niektóre badania dotyczące chirurgii jelita
wskazują na podobne wyniki w okresie do 3 godz. od
momentu rozpoczęciu interwencji
(Bates i wsp., 1989;
Classen i wsp., 1992).
Ze względów praktycznych doustna profilaktyka
antybiotykowa powinna być zastosowana na ok. 1 godz.
przed interwencją. Profilaktyka antybiotykowa dożylna
powinna być podawana w czasie ok. 30 min przed wykonaniem
pierwszego cięcia, np. przy indukcji znieczulenia.
Niniejsze ramy czasowe umożliwiają stosowanie profilaktyki
antybiotykowej celem osiągnięcia maksymalnego
stężenia w osoczu w chwili najwyższego ryzyka zakażenia
w trakcie postępowania i efektywnego stężenie wkrótce
po
Bergamini i Polk, 1989;
Koch i wsp., 2013
3N.3.2. Droga podania
Podanie doustne jest równie skuteczne jak dożylne
w przypadku antybiotyków o odpowiedniej biodostępności.
Jest to zalecane dla większości interwencji,
w których pacjent może przyjąć lek na 1 godz. przed
zabiegiem. W pozostałych przypadkach zalecane jest
podanie dożylne. Irygacja pola operacyjnego roztworem
antybiotyku nie jest zalecana.
3N.3.3. Czas trwania
W przypadku większości zabiegów czasokres profilaktyki
antybiotykowej nie został jeszcze w odpowiedni
sposób określony – zatem nie istnieje jasno zdefiniowany
schemat. W zasadzie czas profilaktyki okołooperacyjnej
powinien być zminimalizowany; najlepiej do pojedynczej,
przedoperacyjnej dawki antybiotyku. Profilaktykę
okołooperacyjną należy przedłużyć tylko gdy istnieją
istotne czynniki ryzyka (rozdział 3N.2.).
3N.3.4. Wybór antybiotyku
Brak jednoznacznych zaleceń wynika ze znacznych różnic
w spektrum bakterii i ich wrażliwości na różne antybiotyki
w Europie. Oporność na środki przeciwdrobnoustrojowe
jest zazwyczaj wyższa w krajach z basenu Morza
Śródziemnego w porównaniu do krajów Europy Północnej.
Oporność ta koreluje z nawet czterokrotną różnicą
w podaży/sprzedaży antybiotyków
(Kahlmeter, 2003).
Tak
więc znajomość lokalnego profilu patogenów, ich wrażliwości
i zjadliwości jest obowiązkowa przy ustalaniu
lokalnych wytycznych antybiotykoterapii. Istotne jest
również, aby określić dominujące czynniki chorobotwórcze
specyficzne dla każdego rodzaju procedury. Przy wyborze
środka przeciwdrobnoustrojowego konieczne jest rozważenie
czynników ryzyka charakterystycznych dla określonej
procedury zabiegowej, ładunku zanieczyszczenia,
narządów docelowych oraz roli lokalnego stanu zapalnego.
Wiele antybiotyków doskonale nadaje się do przeciwbakteryjnej
profilaktyki okołooperacyjnej, np. co-trimoxazol,
cefalosporyny drugiej generacji, aminopenicyliny
z inhibitorami beta-laktamaz, aminoglikozydy i fluorochinolony.
Antybiotyki o szerszym spektrum działania,
takie jak fluorochinolony, cefalosporyny trzeciej generacji
i karbapenemy, powinny być stosowane z umiarem i zarezerwowane
do leczenia. W profilaktyce należy unikać
stosowania wankomycyny, jeśli tylko jest to możliwe.
3N.3.5. Schematy profilaktyki antybiotykowej
w określonych procedurach urologicznych
Wszystkie procedury różnią się od siebie. Istnieje duże
zróżnicowanie w inwazyjności i ryzyku dla identycznych
interwencji. Niniejsze wytyczne sugerują rozkład różnych
diagnostycznych i terapeutycznych zabiegów urologicznych
w odniesieniu do kategorii skażenia miejsca operowanego
po adaptacji do kontekstu urologicznego
(Cruse i Foord, 1980; ).
(Grabe i wsp., 2012).
Zalecenia dotyczące
profilaktyki antybiotykowej w typowych zabiegach urologicznych
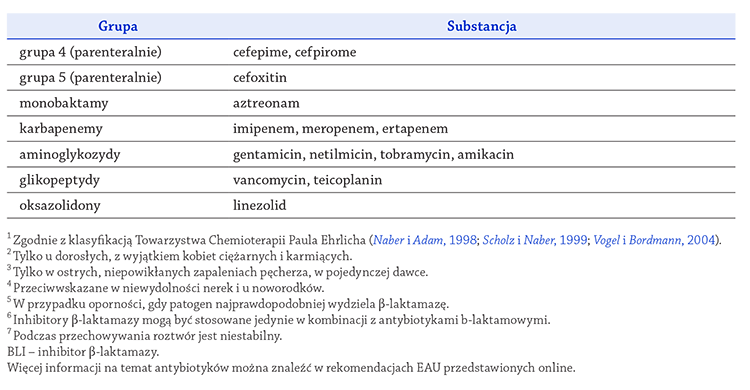
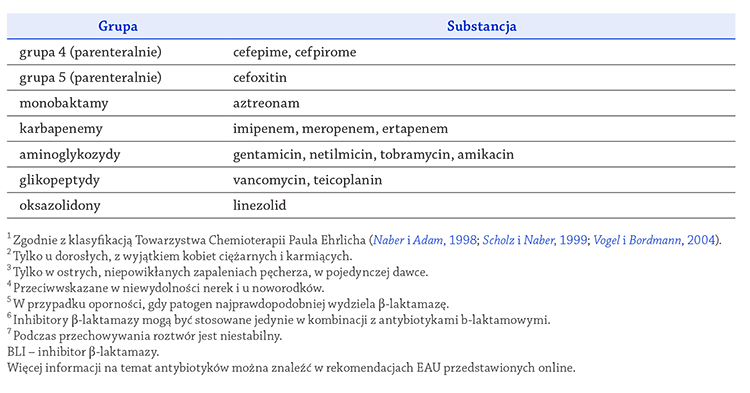
zestawiono w tabelach 23 i 24
(Grabe, 2011;).
(Magistro i wsp., 2014;).
(Wagenlehner i wsp., 2011a).
3N.4. Profilaktyka antybiotykowa w określonych
procedurach urologicznych
3N.4.1. Procedury diagnostyczne
3N.4.1.1. Przezodbytnicza biopsja gruboigłowa stercza
Zaleca się stosowanie profilaktyki przeciwdrobnoustrojowej
w biopsji gruczołu krokowego (LE: 1b, GR: A), niemniej
jednak wybór schematów pozostaje dyskusyjny.
Większość stosowanych schematów jest skuteczna –
ostatnie badania sugerują, że jednodniowa, a nawet pojedyncza
dawka jest wystarczająca u pacjentów niskiego
ryzyka
(Aron i wsp., 2000; ).
(Briffaux i wsp., 2009; ).
(Crawfordi wsp., 1982;).
(Enlund i Varenhorst, 1997;).
(Griffith i wsp., 2002;).
(Isen i wsp., 1999; ).
(Kapoor i wsp., 1998; ).
(Larsson i wsp., 1999;).
(Lindstedt i wsp., 2006;).
(Melekos, 1990; ).
(Puig i wsp., 2006;).
(Sabbagh i wsp., 2004; ).
(Schaeffer i wsp., 2007;).
(Shandera i wsp.,1998; ).
( Webb i Woo, 2002;).
( Webb i Woo, 2002; Yamamoto i wsp., 2008).
(LE: 1b,
GR: A). Wzrost oporności na fluorochinolony w kale flory


podniósł kwestię stosowności obecnych zaleceń
(Taylor
i wsp., 2012; ).
(Wagenlehner i wsp., 2013c).
Nie ma jednoznacznych
alternatyw opartych na dowodach. W niedawnym
przeglądzie zaleca się, aby mężczyźni ze zwiększonym
ryzykiem kolonizacji szczepami opornymi na
fluorochinolony otrzymywali profilaktykę antybiotykową
ukierunkowaną – ustaloną na podstawie wymazu
z odbytu
(Wagenlehner i wsp., 2014).
Bierze się pod uwagę
również kilka form przygotowania jelita grubego i odbytnicy,
choć w żadnej nie wykazano jeszcze znaczącego
zmniejszenia częstość infekcji
(Wagenlehner i wsp., 2014).
Należy również rozważyć konieczność biopsji gruczołu
krokowego w stosunku do ryzyka, biorąc pod uwagę ocenę
indywidualnych czynników ryzyka i wytworzenia wielolekoopornych
bakterii (np. ESBL) oraz konieczność wykonania
wymazu z odbytu
(Tukenmez Tigen i wsp., 2014).
3N.4.1.2. Cystoskopia
Częstość powikłań infekcyjnych po cystoskopii, badaniu
urodynamicznym i nieskomplikowanej ureteroskopii
diagnostycznej jest niska
(Alsaywid i Smith, 2013;).
(Garcia‑Perdomo
i wsp., 2013; ).
(Herr, 2014)).
W kontekście bardzo
dużej liczby badań cystoskopowych niskie ryzyko
zakażeń i potencjalny niekorzystny wpływ na wrażliwość
bakterii stosowanie profilaktyki antybiotykowej
w standardowych przypadkach nie jest zalecane (LE: 1a,
GR: A). Należy jednak uwzględnić bakteriurię, stałe cewnikowanie,
zaburzenia neurogenne dolnych dróg moczowych
oraz historię przebytych zakażeń układu moczowo-
-płciowego jako czynniki ryzyka
(Almallah i wsp., 2000;).
(Burke i wsp., 2002;).
(Clark i Higgs, 1990; ).
(Cundiff i wsp.,
1999;).
(Jimenez Cruz i wsp., 1993;).
(Johnson i wsp., 2007;).
(Karmouni i wsp., 2001;).
(Latthe i wsp., 2008; ).
( Logadottiri wsp., 2001;).
( MacDermott i wsp., 1988; .
(Manson, 1988;).
(Rane i wsp., 2001;).
(Tsugawa i wsp., 1998; ).
( Wilson i wsp.,2005).
(LE: 1b, GR: A).
3N.4.2. Zabiegi endourologiczne
(wejście do dróg moczowych)
3N.4.2.1. Przezcewkowe usunięcie
pęcherza moczowego
Nie ma dowodów na jakąkolwiek korzyść ze stosowania
profilaktyki antybiotykowej w przypadku przezcewkowego
usunięcie pęcherza moczowego (TUR-BT, ang. transurethral
resection of the bladder tumour). Badania nie wskazują
na różnice pomiędzy drobną koagulacją podczas
cystoskopii a elektroresekcją dużych i/lub licznych guzów
z obecnością zmian martwiczych. Niniejsze wytyczne
zalecają zróżnicowanie typu nowotworu (tabela 24)
i odpowiedni zależny od tego czynnika dobór profilaktyki
antybiotykowej
( Alsaywid i Smith, 2013;).
( Berry
i Barratt, 2002; ).
( Qiang i wsp., 2005; ).
( Wagenlehner i wsp.,2005).
(LE: 2b, GR: C).
3N.4.2.2. Przezcewkowa resekcja gruczołu krokowego
Przezcewkowa elektroresekcja gruczołu krokowego jest
jedną z najlepiej badanych urologicznych interwencji.
Co najmniej dwie metaanalizy licznych prospektywnych,
randomizowanych i kontrolowanych badań klinicznych
z udziałem kilku tysięcy pacjentów wykazały
korzyści płynące z zastosowania profilaktyki antybiotykowej
w zmniejszeniu ryzyka względnego o 65% i 77%
odpowiednio dla bakteriurii i posocznicy
( Alsaywid i Smith, 2013;).
( Berry
i Barratt, 2002; ).
( Qiang i wsp., 2005; ).
( Wagenlehner i wsp.,2005).
(LE: 1a, GR: A).
3N.4.2.3. Ureteroskopia
Brakuje dobrze kontrolowanych badań prospektywnych
dotyczących ureteroskopii. Uzasadnionym jest jednak,
aby rozróżnić procedury niskiego ryzyka, takie jak uretoneskopia
(URS, ang. ureterorenoscopy) diagnostyczna
i litotrypsja uretonerkowa (URSL, ang. ureterorenoscopic
lithotripsy) dystalnego odcinka moczowodu u poza tym
zdrowych osób od procedur podwyższonego ryzyka,
takich jak URSL proksymalnego odcinka moczowodu
ze współistniejącą przeszkodą. Wytyczne te zalecają
więc zróżnicowanie stopnia nasilenia, zlokalizowania
złogu i indywidualnych czynników ryzyka związanych
z pacjentem (tabela 24), co jest poparte dużą bazą danych
procedury URS
(Martov i wsp., 2015).
3N.4.2.4. Przezskórna nefrolitotrypsja
Ryzyko nabycia zakażenia w przezskórnej nefrolitotrypsji
(PNL, ang. percutaneous nephrolithotripsy) jest wysokie –
wykazano, że zastosowanie profilaktyki antybiotykowej
wpływa na znaczne zmniejszenie ryzyka powikłań
zakażnych
(Charton i wsp., 1986;).
(Dasgupta i Grabe,
2009;).
(Dogan i wsp., 2002;).
(Fourcade, 1990;).
(Hendrikx i wsp.,1999; ).
(Knopf i wsp., 2003; ).
(Mariappan i wsp., 2005; ).
( Osman i wsp., 2005; ).
(Rao i wsp., 1991).
(LE: 1b, GR: A). Pojedyncza
dawka antybiotyku jest zazwyczaj wystarczająca
Można spodziewać się, że ureterorenotrypsja
kamieni nerkowych ma podobny profil ryzyka
(Martov i wsp., 2015).
3N.4.2.5. Litotrypsja zewnątrzustrojową
falą uderzeniową
W przypadku litotrypsji zewnątrzustrojową falą uderzeniową
(ESWL, ang. extracorporeal shock wave lithotripsy)
nie ma standardowej profilaktyki antybiotykowej. Jednak
zaleca się kontrolę bakteriomoczu i wdrożenie profilaktyki
w przypadku szynowania moczowodu, zwiększonego
obciążenia bakteryjnego (np. cewnik, dren nefrostomijny
lub zakażone kamienie)
(Bierkens i wsp., 1997; ).
(Charton i wsp., 1990; ).
(Claes i wsp., 1989;).
(Deliveliotis i wsp., 1997;).
(Dincel i wsp., 1998;).
( Gattegno i wsp., 1988; ).
(Knipper i wsp.,1989;).
(Lu i wsp., 2012;).
( Pearle i Roehrborn, 1997;).
(Pettersson i Tiselius, 1989).
(LE: 1a-1b, GR: A) (tabela 24).
Oceniono większość grup antybiotyków takich jak
fluorochinolony, inhibitory beta-laktamaz, w tym cefalosporyny
i kotrimoksazol, ale porównawcze badania są
ograniczone. Zaleca się, aby dobierać profilaktykę antybiotykową
na podstawie wyników posiewu moczu.
3N.4.3. Zabiegi laparoskopowe
Brak jest wystarczających badań dotyczących laparoskopowej
chirurgii urologicznej. Jednakże wydaje się uzasadnione
traktowanie zabiegów laparoskopowych w taki
sam sposób jak odpowiadające im procedury otwarte
(LE: 4, GR: C).
3N.4.4. Operacje otwarte lub laparoskopowe
bez otwarcia dróg moczowych
(czyste procedury)
Nie zaleca się stosowania standardowej profilaktyki antybiotykowej
w operacjach czystych
(
(Kiddoo i wsp., 2004;).
(Montgomery i wsp., 2005;).
(Pessaux i wsp., 2005;).
(Steiner i wsp., 2003; ).
(Swartz i wsp., 2007).
(LE: 3, GR: C).
3N.4.5. Operacje otwarte lub laparoskopowe
z otwarciem dróg moczowych
(procedury czyste-skażone)
W przypadku otwarcia dróg moczowych zaleca się
podanie pojedynczej, pozajelitowej dawki antybiotyków
w okresie okołooperacyjnym (LE: 3, GR: C). Wskazane
jest to dla standardowych procedur, takich jak radykalna
prostatektomia
(Sakura i wsp., 2008;).
(Stranne i wsp., 2004;).
(Takeyama i wsp., 2007;).
(Terai i wsp., 2006).
W przypadku
otwartej adenomektomii ryzyko zakażenia pooperacyjnego
jest szczególnie wysokie
(Richter i wsp., 1991)
(LE: 2b, GR: B).
3N.4.6. Otwarte operacje urologiczne
z użyciem segmentu jelita
(procedury czyste-skażone lub skażone)
Zaleca się stosowanie profilaktyki antybiotykowej
podobnie jak w procedurach czystych-skażonych
w chirurgii ogólnej. Wystarczająca jest pojedyncza lub
jednodniowa dawka, choć przedłużony czas zabiegu i inne
czynniki ryzyka mogą uzasadniać stosowanie przedłużonego
okresu podawania, który powinien być krótszy
niż 72 godz. Wybrany antybiotyk powinien być celowany
na patogeny tlenowe i beztlenowe. Dowody oparte są na
zabiegach w zakresie okrężnicy (LE: 1a, GR: A), a ograniczone
są doświadczenia z konkretnych interwencji
urologicznych
Mangram i wsp., 1999;
(Studer i wsp., 1995; )
(Studer i wsp., 1995;)
(Takeyama i wsp., 2005)
(LE: 2a, GR: B).
3N.4.7. Pooperacyjny drenaż dróg moczowych
W przypadku pozostawienia ciągłego drenażu dróg
moczowych po operacji wydłużenie okołooperacyjnej
profilaktyki przeciwbakteryjnej nie jest zalecane, chyba że
podejrzewamy skomplikowane zakażenie, które wymaga
leczenia. Bezobjawowa bakteriuria (kolonizacja) powinna
być leczona po usunięciu drenów (LE: 3, GR: B).
3N.4.8. Implantacja protez
Powikłania zakaźne występujące po zabiegu implantacji
urządzeń protetycznych w obrębie dróg moczowych
często zmuszają do usunięcia protezy. Cukrzyca
jest specyficznym czynnikiem ryzyka zakażenia związanego
z tym rodzajem zabiegów. Gronkowce zasiedlające
skórę są odpowiedzialne za większość zakażeń.
Stosowane antybiotyki muszą być dobrane do celowanej
terapii dla tych szczepów bakterii
(Carson, 2003; )
(Kabalin i Kessler, 1988;)
(Mould i Carson, 1989;)
(Radomski i Herschorn,1992)
(LE: 2a, GR: B).
4. DODATEK






5. PIŚMIENNICTWO
Abbott K.C., Swanson S.J., Richter E.R., Bohen E.M., Agodoa L.Y., Peters T.G. i
wsp.: Late urinary tract infection after renal transplantation in the United
States. Am J Kidney Dis. 2004, 44 (2), 353–362. PMID: 15264195.
Abrahamsson K., Hansson S., Jodal U., Lincoln K.: Staphylococcus saprophyticus
urinary tract infections in children. Eur J Pediatr. 1993, 152 (1), 69–71.
Adam D., Daschner F.: [Prevention of infection in surgery: hygienic measurements
and antibiotic prophylaxis]. Wissenschaftliche Verlagsgesellschaft,
Stuttgart 1993.
Aitchison M., Mufti G.R., Farrell J., Paterson P.J., Scott R.: Granulomatous orchitis.
Review of 15 cases. Br J Urol. 1990, 66 (3), 312–314. PMID: 2207549.
Albert X., Huertas I., Pereiró I.I., Sanfélix J., Gosalbes V., Perrota C.: Antibiotics
for preventing recurrent urinary tract infection in non-pregnant women.
Cochrane Database Syst Rev. 2004 (3), Cd001209. PMID: 15266443. DOI:
10.1002/14651858.CD001209.pub2.
Alexander R.B., Ponniah S., Hasday J., Hebel J.R.: Elevated levels of proinflammatory
cytokines in the semen of patients with chronic prostatitis/chronic
pelvic pain syndrome. Urology. 1998, 52 (5), 744–749. PMID: 9801092.
Alexander R.B., Trissel D.: Chronic prostatitis: results of an Internet survey.
Urology. 1996, 48 (4), 568–574. PMID: 8886062.
Alling B., Brandberg A., Seeberg S., Svanborg A.: Effect of consecutive antibacterial
therapy on bacteriuria in hospitalized geriatric patients. Scand J
Infect Dis. 1975, 7 (3), 201–207. PMID: 809837.
Almallah Y.Z., Rennie C.D., Stone J., Lancashire M.J.: Urinary tract infection
and patient satisfaction after flexible cystoscopy and urodynamic evaluation.
Urology. 2000, 56 (1), 37–39. PMID: 10869618.
Alsaywid B.S., Smith G.H.: Antibiotic prophylaxis for transurethral urological
surgeries: Systematic review. Urol Ann. 2013, 5 (2), 61–74. PMID: 23798859.
PMCID: PMC3685747. DOI: 10.4103/0974-7796.109993.
Annane D., Sébille V., Bellissant E.: Effect of treatment with low doses of
hydrocortisone and fludrocortisone on mortality in patients with septic
shock. JAMA. 2002, 288 (7), 862–871. PMID: 16374152.
ansm.sante.fr: Nitrofurantoïne et risque de survenue d’effets indésirables
indésirables hépatiques et pulmonaires lors de traitements prolongés,
11.03.2011. http://ansm.sante.fr/S-informer/Informations-de-securite-
Lettres-aux-professionnels-de-sante/Nitrofurantoine-et-risque-de-survenued-
effets-indesirables-hepatiques-et-pulmonaires-lors-de-traitementsprolonges-
Lettre-aux-professionnels-de-sante.
Anukam K.C., Osazuwa E., Osemene G.I., Ehigiagbe F., Bruce A.W., Reid G.:
Clinical study comparing probiotic Lactobacillus GR-1 and RC-14 with metronidazole
vaginal gel to treat symptomatic bacterial vaginosis. Microbes
Infect. 2006, 8 (12-13), 2772–2776. PMID: 17045832.
DOI: 10.1016/j.
micinf.2006.08.008.
Arant B.S.: Vesicoureteral reflux and evidence-based management. J Pediatr.
2001, 139 (5), 620–621. PMID: 11713435. DOI: 10.1067/mpd.2001.119451.
Aron M., Rajeev T.P., Gupta N.P.: Antibiotic prophylaxis for transrectal needle
biopsy of the prostate: a randomized controlled study. BJU Int. 2000,
85 (6), 682–685. PMID: 10759665.
Badalyan R.R., Fanarjyan S.V., Aghajanyan I.G.: Chlamydial and ureaplasmal
infections in patients with nonbacterial chronic prostatitis. Andrologia.
2003, 35 (5), 263–265. PMID: 14535852.
Bates T., Siller G., Crathern B.C., Bradley S.P., Zlotnik R.D., Couch C.: Timing of
prophylactic antibiotics in abdominal surgery: trial of a pre-operative versus
an intraoperative first dose. Br J Surg. 1989, 76 (1), 52–56. PMID: 2645013.
Bauer H.W., Rahlfs V.W., Lauener P.A., Blessmann G.S.: Prevention of recurrent
urinary tract infections with immuno-active E. coli fractions: a metaanalysis
of five placebo-controlled double-blind studies. Int J Antimicrob Agents.
2002, 19 (6), 451–466. PMID: 12135831.
Beck E.M., Riehle R.A. Jr.: The fate of residual fragments after extracorporeal
shock wave lithotripsy monotherapy of infection stones. J Urol. 1991,
145 (1), 6–9, discussion 9–10. PMID: 1984100.
Beerepoot M.A., Geerlings S.E., van Haarst E.P., van Charante N.M., ter Riet G.:
Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic
review and meta-analysis of randomized controlled trials. J Urol. 2013,
190 (6), 1981–1989. PMID: 23867306. DOI: 10.1016/j.juro.2013.04.142.
Benson M., Jodal U., Andreasson A., Karlsson A., Rydberg J., Svanborg C.:
Interleukin 6 response to urinary tract infection in childhood. Pediatr
Infect Dis J. 1994, 13 (7), 612–616. PMID: 7970949.
Bergamini T.M., Polk H.C. Jr.: The importance of tissue antibiotic activity
in the prevention of operative wound infection. J Antimicrob Chemother.
1989, 23 (3), 301–313. PMID: 2659564.
Berger R.E.: Epididymitis. W: Sexually transmitted diseases. Red. K.K.
Holmes, P.F. Sparling, W.E. Stamm, P. Piot, J.N. Wasserheit, L. Corey i
wsp. McGraw-Hill, New York 1984, 650–662.
Berry A., Barratt A.: Prophylactic antibiotic use in transurethral prostatic resection:
a meta-analysis. J Urol. 2002, 167 (2 Pt 1), 571–577. PMID: 11792921.
Bichler K.H., Savatovsky I.: EAU guidelines for the management of urogenital
schistosomiasis. Eur Urol. 2006, 49 (6), 998–1003. PMID: 16519990.
DOI: 10.1016/j.eururo.2006.02.022.
Bierkens A.F., Hendrikx A.J., Ezz el Din K.E., de la Rosette J.J., Horrevorts A.,
Doesburg W. i wsp.: The value of antibiotic prophylaxis during extracorporeal
shock wave lithotripsy in the prevention of urinary tract infections in
patients with urine proven sterile prior to treatment. Eur Urol. 1997, 31
(1), 30–35. PMID: 9032531.
Bircan Z.E., Buyan N., Hasanoğlu E., Oztürk E., Bayhan H., Işik S.: Radiologic
evaluation of urinary tract infection. Int Urol Nephrol. 1995, 27 (1), 27–32.
PMID: 7615367.
Bjerklund Johansen T.E., Botto H., Cek M., Grabe M., Tenke P., Wagenlehner F.M. i
wsp.: Critical review of current definitions of urinary tract infections and proposal
of an EAU/ESIU classification system. Int J Antimicrob Agents. 2011,
38 Suppl., 64–70. PMID: 22018988. DOI: 10.1016/j.ijantimicag.2011.09.009.
Bjerklund Johansen T.E., Cek M., Naber K., Stratchounski L., Svendsen M.V.,
Tenke P.: Prevalence of hospital-acquired urinary tract infections in urology
departments. Eur Urol. 2007, 51 (4), 1100–1111. PMID: 17049419.
DOI: 10.1016/j.eururo.2006.08.012.
Bjerklund Johansen T.E., Grüneberg R.N., Guibert J., Hofstetter A., Lobel B.,
Naber K.G.: The role of antibiotics in the treatment of chronic prostatitis:
a consensus statement. Eur Urol. 1998, 34 (6), 457–466. PMID: 9831786.
Bloomfield P., Hodson E.M., Craig J.C.: Antibiotics for acute pyelonephritis
in children. Cochrane Database Syst Rev. 2005, 1, p. Cd003772. PMID:
15674914.
DOI: 10.1002/14651858.CD003772.pub2.
Blumenberg E.A., Abrutyn E.: Methods for reduction of UTI. Curr Opin Urol
1997, 7, 47–51.
Bone R.C., Balk R.A., Cerra F.B., Dellinger R.P., Fein A.M., Knaus W.A. i wsp.:
Definitions for sepsis and organ failure and guidelines for the use of innovative
therapies in sepsis. The ACCP/SCCM Consensus Conference Committee.
American College of Chest Physicians/Society of Critical Care Medicine.
Chest. 1992, 101 (6), 1644–1655. PMID: 1303622.
Bootsma A.M., Laguna Pes M.P., Geerlings S.E., Goossens A.: Antibiotic prophylaxis
in urologic procedures: a systematic review. Eur Urol. 2008, 54 (6),
1270–1286. PMID: 18423974. DOI: 10.1016/j.eururo.2008.03.033.
Borchardt K.A., al-Haraci S., Maida N.: Prevalence of Trichomonas vaginalis
in a male sexually transmitted disease clinic population by interview, wet
mount microscopy, and the InPouch TV test. Genitourin Med. 1995, 71
(6), 405–406. PMID: 8566985. PMCID: PMC1196116.
Borras-Blasco J., Conesa-García V., Navarro-Ruiz A., Marín-Jiménez F., González-
Delgado M., Gomez-Corrons A.: Ciprofloxacin, but not levofloxacin, affects
cyclosporine blood levels in a patient with pure red blood cell aplasia. Am
J Med Sci. 2005, 330 (3), 144–146. PMID: 16174999.
Bozeman C.B., Carver B.S., Eastham J.A., Venable D.D.: Treatment of chronic
prostatitis lowers serum prostate specific antigen. J Urol. 2002, 167 (4),
1723–1726. PMID: 11912396.
Bradbury S.M.: Collection of urine specimens in general practice: to clean or
not to clean? J R Coll Gen Pract. 1988, 38 (313), 363–365. PMID: 3256648.
PMCID: PMC1711498.
Bremer V., Brockmeyer N.H., Buder S., Eigentler A., Esser S., Hagedorn H.J. i
wsp.: Gonorrhoea in adults and adolescents. GMS Infect Dis, 2014, 2, 1–17.
DOI: 10.3205/id000010, URN: urn:nbn:de:0183-id0000103.
Briffaux R., Merlet B., Normand G., Coloby P., Leremboure H., Bruyère F. i wsp.:
[Short or long schemes of antibiotic prophylaxis for prostate biopsy. A multicentre
prospective randomised study]. Prog Urol. 2009, 19 (1), 39–46.
PMID: 19135641. DOI: 10.1016/j.purol.2008.08.003
Britton K.E.: Renal radionuclide studies. W: Textbook of genitourinary surgery.
Red. H.N. Whitfield, W.F. Hendry, R.S. Kirby, J.W. Duckett. Blackwell
Science, Oxford 1998, 76–103.
Broseta E.: Urinary tract infection in children. W: Infeccion urinaria. Red.
E. Broseta, J.F. Jimenez-Cruz. Ed Aula Medica, Madrid 1999, 185–194.
Brun-Buisson C., Meshaka P., Pinton P., Vallet B.: EPISEPSIS: a reappraisal of
the epidemiology and outcome of severe sepsis in French intensive care
units. Intensive Care Med. 2004, 30 (4), 580–588. PMID: 14997295. DOI:
10.1007/s00134-003-2121-4.
Brunkhorst F.M., Wegscheider K., Forycki Z.F., Brunkhorst R.: Procalcitonin for
early diagnosis and differentiation of SIRS, sepsis, severe sepsis, and septic
shock. Intensive Care Med. 2000, 26 Suppl 2, S148–52. PMID: 18470710.
DOI: 10.1007/BF02900728.
Burke D.M., Shackley D.C., O’Reilly P.H.: The community-based morbidity
of flexible cystoscopy. BJU Int. 2002, 89 (4), 347–349. PMID: 11872022.
Burke J.F.: The effective period of preventive antibiotic action in experimental
incisions and dermal lesions. Surgery. 1961, 50, 161–168. PMID: 16722001.
Busolo F., Camposampiero D., Bordignon G., Bertollo G.: Detection of Mycoplasma
genitalium and Chlamydia trachomatis DNAs in male patients with urethritis
using the polymerase chain reaction. New Microbiol. 1997, 20 (4),
325–332. PMID: 9385602.
Cai T., Mazzoli S., Mondaini N., Meacci F., Nesi G., D’Elia C. i wsp.: The role of
asymptomatic bacteriuria in young women with recurrent urinary tract
infections: to treat or not to treat? Clin Infect Dis. 2012, 55 (6), 771–777.
PMID: 22677710. DOI: 10.1093/cid/cis534.
Carlet J., Collignon P., Goldmann D., Goossens H., Gyssens I.C., Harbarth S. i
wsp.: Society’s failure to protect a precious resource: antibiotics. Lancet.
2011, 378 (9788), 369–371. PMID: 21477855. DOI: 10.1016/S0140-6736
(11)60401-7.
Carlet J., Dumay M.F., Gottot S., Gouin F., Pappo M.: Guideliness for prevention
of nosocomial infections in intensive care unit. Arnette Ed, Paris
1994, 41–53.
Carson C.C.: Diagnosis, treatment and prevention of penile prosthesis infection.
Int J Impot Res. 2003, 15 Suppl 5, S139–146. PMID: 14551594. DOI:
10.1038/sj.ijir.3901091.
Carson C.C., Naber K.G.: Role of fluoroquinolones in the treatment of serious
bacterial urinary tract infections. Drugs. 2004, 64 (12), 1359–1373.
PMID: 15200349.
Cassier P., Lallechère S., Aho S., Astruc K., Neuwirth C., Piroth L. i wsp.:
Cephalosporin and fluoroquinolone combinations are highly associated
with CTX-M betalactamase-producing Escherichia coli: a case-control study
in a French teaching hospital. Clin Microbiol Infect. 2011, 17 (11), 1746–
1751. PMID: 20840333.
DOI: 10.1111/j.1469-0691.2010.03349.x.
Cattell W.R.: Urinary tract infection and acute renal failure. W: Advanced renal
medicine. Red. A.E. Raine. Oxford University Press, Oxford 1992, 302–313.
Cavagnaro F.: Urinary tract infection in childhood. Rev Chilena Infectol.
2005, 22 (2), 161–168. PMID: 15891797.
DOI: /S0716-10182005000200007.
Çek M., Lenk S., Naber K.G., Bishop M.C., Johansen T.E., Botto H. i wsp.: EAU
guidelines for the management of genitourinary tuberculosis. Eur Urol. 2005,
48 (3), 353–362. PMID: 15982799.
DOI: 10.1016/j.eururo.2005.03.008.
Çek M., Tandoğdu Z., Naber K., Tenke P., Wagenlehner F., van Oostrum E. i wsp.:
Antibiotic prophylaxis in urology departments, 2005–2010. Eur Urol. 2013,
63 (2), 386–394. PMID: 23031676.
DOI: 10.1016/j.eururo.2012.09.038.
Charton M., Vallancien G., Veillon B., Brisset J.M.: Urinary tract infection
in percutaneous surgery for renal calculi. J Urol. 1986, 135 (1), 15–17.
PMID: 3510316.
Charton M., Vallancien G., Veillon B., Prapotnich D., Mombet A., Brisset J.M.:
Use of antibiotics in the conjunction with extracorporeal lithotripsy. Eur
Urol. 1990, 17 (2), 134–138. PMID: 2178940.
Chou Y.H., Tiu C.M., Liu J.Y., Chen J.D., Chiou H.J., Chiou S.Y. i wsp.: Prostatic
abscess: transrectal color Doppler ultrasonic diagnosis and minimally invasive
therapeutic management. Ultrasound Med Biol. 2004, 30 (6), 719–724.
PMID: 15219951.
DOI: 10.1016/j.ultrasmedbio.2004.03.014.
Claes H., Vandeursen R., Baert L.: Amoxycillin/clavulanate prophylaxis for
extracorporeal shock wave lithotripsy – a comparative study. J Antimicrob
Chemother. 1989, 24 Suppl B, 217–220. PMID: 2691484.
Clark K.R., Higgs M.J.: Urinary infection following out-patient flexible cystoscopy.
Br J Urol. 1990, 66 (5), 503–505. PMID: 2249120.
Classen D.C., Evans R.S., Pestotnik S.L., Horn S.D., Menlove R.L., Burke J.P.:
The timing of prophylactic administration of antibiotics and the risk of
surgical-wound infection. N Engl J Med. 1992, 326 (5), 281–286.
Cox C.E., Holloway W.J., Geckler R.W.: A multicenter comparative study of
meropenem and imipenem/cilastatin in the treatment of complicated urinary
tract infections in hospitalized patients. Clin Infect Dis. 1995, 21 (1),
86–92. PMID: 7578765.
Craig J.C., Knight J.F., Sureshkumar P., Mantz E., Roy L.P.: Effect of circumcision
on incidence of urinary tract infection in preschool boys. J Pediatr.
1996, 128 (1), 23–27. PMID: 8551417.
Crawford E.D., Haynes A.L. Jr, Story M.W., Borden T.A.: Prevention of urinary
tract infection and sepsis following transrectal prostatic biopsy. J Urol.
1982, 127 (3), 449–451. PMID: 6895918.
Cronberg S., Banke S., Bergman B., Boman H., Eilard T., Elbel E. i wsp.: Fewer
bacterial relapses after oral treatment with norfloxacin than with ceftibuten
in acute pyelonephritis initially treated with intravenous cefuroxime.
Scand J Infect Dis. 2001, 33 (5), 339–343. PMID: 11440218.
Cruse P.J., Foord R.: The epidemiology of wound infection. A 10-year prospective
study of 62,939 wounds. Surg Clin North Am. 1980, 60 (1), 27–40.
PMID: 7361226.
Cundiff G.W., McLennan M.T., Bent A.E.: Randomized trial of antibiotic prophylaxis
for combined urodynamics and cystourethroscopy. Obstet Gynecol.
1999, 93 (5 Pt 1), 749–752. PMID: 10912979.
Darouiche R.O., Thornby J.I., Cerra-Stewart C., Donovan W.H., Hull R.A.:
Bacterial interference for prevention of urinary tract infection: a prospective,
randomized, placebo-controlled, double-blind pilot trial. Clin Infect
Dis. 2005, 41 (10), 1531–1534. PMID: 16231269. DOI: 10.1086/497272.
Dasgupta R., Grabe M.: Preoperative antibiotics before endourologic surgery:
current recommendations. J Endourol. 2009, 23 (10), 1567–1570. PMID:
19785548. DOI: 10.1089/end.2009.1520.
DeSadeleer C., De Boe V., Keuppens F., Desprechins B., Verboven M., Piepsz A.:
How good is technetium-99m mercaptoacetyltriglycine indirect cystography?
Eur J Nucl Med. 1994, 21 (3), 223–237. PMID: 8200390.
DeGroot-Kosolcharoen J., Guse R., Jones J.M.: Evaluation of a urinary catheter
with a preconnected closed drainage bag. Infect Control Hosp Epidemiol.
1988, 9 (2), 72–76. PMID: 3343502.
del Rio C., Hall G., Holmes K., Hook E.W., Kirkcaldy R.D., Workowski K.A. i wsp.:
Update to CDC’s Sexually Transmitted Diseases Treatment Guidelines, 2010:
Oral cephalosporins no longer a recommended treatment for gonococcal
infections. MMWR. 2012, 61, 590–594. https://www.cdc.gov/mmwr/preview/
mmwrhtml/mm6131a3.htm.
Deliveliotis C., Giftopoulos A., Koutsokalis G., Raptidis G., Kostakopoulos A.: The
necessity of prophylactic antibiotics during extracorporeal shock wave lithotripsy.
Int Urol Nephrol. 1997, 29 (5), 517–521. PMID: 9413755.
Dellinger R.P., Carlet J.M., Masur H., Gerlach H., Calandra T., Cohen J.: Surviving
Sepsis Campaign guidelines for management of severe sepsis and septic shock.
Crit Care Med. 2004, 32 (3), 858–873. PMID: 15090974. PMID: 3333655.
Deville W.L., Yzermans J.C., van Duijn N.P., Bezemer P.D., van der Windt D.A.,
Bouter L.M. i wsp.: The urine dipstick test useful to rule out infections. A
meta-analysis of the accuracy. BMC Urol. 2004, 4, 4. PMID: 15175113.
PMCID: PMC434513. DOI: 10.1186/1471-2490-4-4.
DGPI: Textbook for infections in children and adolescents. Futuramed,
Munich 2003, 148–157.
Dincel C., Ozdiler E., Ozenci H., Tazici N., Koşar A.: Incidence of urinary tract
infection in patients without bacteriuria undergoing SWL: comparison of
stone types. J Endourol. 1998, 12 (1), 1–3. PMID: 9531141.
Dobardzic A.M., Dobardzic R.: Epidemiological features of complicated UTI
in a district hospital of Kuwait. Eur J Epidemiol. 1997, 13 (4), 465–470.
PMID: 9258554.
Doble A., Carter S.S.: Ultrasonographic findings in prostatitis. Urol Clin
North Am. 1989, 16 (4), 763–772. PMID: 2683305.
Dogan H.S., Sahin A., Cetinkaya Y., Akdoğan B., Ozden E., Kendi S.: Antibiotic
prophylaxis in percutaneous nephrolithotomy: prospective study in 81
patients. J Endourol. 2002, 16 (9), 649–653. PMID: 12490017. DOI:
10.1089/089277902761402989.
Dumanski A.J., Hedelin H., Edin-Liljegren A., Beauchemin D., McLean R.J.:
Unique ability of the Proteus mirabilis capsule to enhance mineral growth
in infectious urinary calculi. Infect Immun. 1994, 62 (7), 2998–3003. PMID:
8005688. PMCID: PMC302911.
Elison B.S., Taylor D., Van der Wall H., Pereira J.K., Cahill S., Rosenberg A.R. i
wsp.: Comparison of DMSA scintigraphy with intravenous urography for
the detection of renal scarring and its correlation with vesicoureteric reflux.
Br J Urol. 1992, 69 (3), 294–302. PMID: 1314684.
Elzinga L.W., Bennett W.M.: Miscellaneous renal and systemic complications
of autosomal dominant polycystic kidney disease including infection.
W: Polycystic kidney disease. Oxford Clinical Nephrology series. Red.
M.L. Watson, V.E. Torres. Oxford University Press, Oxford 1996, 483–499.
Emori T.G., Gaynes R.P.: An overview of nosocomial infections, including
the role of the microbiology laboratory. Clin Microbiol Rev. 1993, 6 (4),
428–442. PMID: 8269394. PMCID: PMC358296.
Engeler D., Baranowski A.P., Borovicka J., Dinis-Oliveira P., Elneil S., Hughes
J., Messelink E.J. i wsp.: EAU Guidelines on chronic pelvic pain. 27th EAU
Annual Congress, Paris 2012.
Enlund A.L., Varenhorst E.: Morbidity of ultrasound-guided transrectal core
biopsy of the prostate without prophylactic antibiotic therapy. A prospective
study in 415 cases. Br J Urol. 1997, 79 (5), 777–780. PMID: 9158518.
Erol B., Tuncel A., Hanci V., Tokgoz H., Yildiz A., Akduman B. i wsp.: Fournier’s
gangrene: overview of prognostic factors and definition of new prognostic
parameter. Urology. 2010, 75 (5), 1193–1198. PMID: 20451745. DOI:
10.1016/j.urology.2009.08.090.
EUCAST Definitive Document E.Def 1.2, May 2000: Terminology relating
to methods for the determination of susceptibility of bacteria to antimicrobial
agents. Clin Microbiol Infect. 2000a, 6 (9), 503–508. PMID: 11168186.
EUCAST Definitive Document E.DEF 3.1, June 2000: Determination of
minimum inhibitory concentrations (MICs) of antibacterial agents by agar
dilution. Clin Microbiol Infect. 2000b, 6 (9), 509–515. PMID: 11168187.
Evans B.A., Bond R.A., MacRae K.D.: Racial origin, sexual behaviour, and
genital infection among heterosexual men attending a genitourinary medicine
clinic in London (1993-4). Sex Transm Infect. 1998a, 74 (1), 40–44.
PMID: 9634302. PMCID: PMC1758075.
Evans B.A., Kell P.D., Bond R.A., MacRae K.D.: Racial origin, sexual lifestyle,
and genital infection among women attending a genitourinary medicine
clinic in London (1992). Sex Transm Infect. 1998b, 74 (1), 45–49. PMID:
9634303. PMCID: PMC1758086.
Falagas M.E., Kotsantis I.K., Vouloumanou E.K., Rafailidis P.I.: Antibiotics
versus placebo in the treatment of women with uncomplicated cystitis: a
metaanalysis of randomized controlled trials. J Infect. 2009, 58 (2), 91–102.
PMID: 19195714. DOI: 10.1016/j.jinf.2008.12.009.
Falk L., Fredlund H., Jensen J.S.: Tetracycline treatment does not eradicate
Mycoplasma genitalium. Sex Transm Infect. 2003, 79 (4), 318–319. PMID:
12902584. PMCID: PMC1744713.
FDA: Complicated urinary tract infections and pyelonephritis-developing antimicrobial
drugs for treatment. US Department of Health and Human Services
Food and Drug Administration Centre for Drug Evaluation and Research,
Rockville 1998. http://www.fda.gov/ohrms/dockets/98fr/2559dft.pdf.
Fihn S.D.: Clinical practice. Acute uncomplicated urinary tract infection
in women. N Engl J Med. 2003, 349 (3), 259–266. PMID: 12867610. DOI:
10.1056/NEJMcp030027.
Fluoroquinolones in children: poorly defined risk of joint damage. Prescrire
Int. 2004, 13 (73), 184–186. PMID: 15499700.
Fourcade R.O.: Antibiotic prophylaxis with cefotaxime in endoscopic extraction
of upper urinary tract stones: a randomized study. The Cefotaxime Cooperative
Group. J Antimicrob Chemother. 1990, 26 Suppl A, 77–83. PMID: 2228847.
Fowler J.E., Pulaski E.T.: Excretory urography, cystography, and cystoscopy
in the evaluation of women with urinarytract infection: a prospective study.
N Engl J Med. 1981, 304 (8), 462–465. PMID: 7453771. DOI: 10.1056/
NEJM198102193040805.
Foxman B.: Epidemiology of urinary tract infections: incidence, morbidity,
and economic costs. Am J Med. 2002, 113 Suppl. 1A, 5–13. PMID: 12113866.
Foxman B.: Epidemiology of urinary tract infections: incidence, morbidity,
and economic costs. Dis Mon. 2003, 49 (2), 53–70. PMID: 12601337. DOI:
10.1067/mda.2003.7.
Foxman B., Brown P.: Epidemiology of urinary tract infections: transmission
and risk factors, incidence, and costs. Infect Dis Clin North Am. 2003, 17
(2), 227–241. PMID: 12848468.
Foxman B., Somsel P., Tallman P., Gillespie B., Raz R., Colodner R. i wsp.: Urinary
tract infection among women aged 40 to 65: behavioral and sexual risk factors.
J Clin Epidemiol. 2001, 54 (7), 710–718. PMID: 11438412.
Frankenschmidt A., Naber K.G., Bischoff W., Kullmann K.: Once-daily fleroxacin
versus twice-daily ciprofloxacin in the treatment of complicated urinary
tract infections. J Urol. 1997, 158 (4), 1494–1499. PMID: 9302150
Fulop T.: Acute Pyelonephritis Workup. 2012 http://emedicine.medscape.
com/article/245559-workup#aw2aab6b5b3.
Fünfstück R., Nicolle L.E., Hanefeld M., Naber K.G.: Urinary tract infection in
patients with diabetes mellitus. Clin Nephrol. 2012, 77 (1), 40–48. PMID:
22185967.
Fünfstück R., Ott U., Naber K.G.: The interaction of urinary tract infection
and renal insufficiency. Int J Antimicrob Agents. 2006, 28 Suppl 1, S72–77.
PMID: 16844355. DOI: 10.1016/j.ijantimicag.2006.05.004.
Fussell E.N., Kaack M.B., Cherry R., Roberts J.A.: Adherence of bacteria to
human foreskins. J Urol. 1988, 140 (5), 997–1001. PMID: 2902235.
Garcia-Perdomo H.A., López H., Carbonell J., Castillo D., Cataño J.G., Serón
P.: Efficacy of antibiotic prophylaxis in patients undergoing cystoscopy:
a randomized clinical trial. World J Urol. 2013, 31 (6), 1433–1439. PMID:
23412704. DOI: 10.1007/s00345-013-1034-2.
Gattegno B., Sicard F., Alcaidinho D., Arnaud E., Thibault P.: [Extracorporeal
lithotripsy and prophylactic antibiotic therapy]. Ann Urol (Paris). 1988, 22
(2), 101–102. PMID: 3382159.
Giamarellou H.: Low-dosage cefepime as treatment for serious bacterial infections.
J Antimicrob Chemother. 1993, 32 Suppl B, 123–132. PMID: 8150755.
Gleckman R., Esposito A., Crowley M., Natsios G.A.: Reliability of a single urine
culture in establishing diagnosis of asymptomatic bacteriuria in adult males.
J Clin Microbiol. 1979, 9 (5), 596–597. PMID: 383746. PMCID: PMC275354.
Gluck T., Opal S.M.: Advances in sepsis therapy. Drugs. 2004, 64 (8), 837–
859. PMID: 15059039.
Grabe M., Botto H., Cek M., Tenke P., Wagenlehner F.M., Naber K.G. i wsp.:
Preoperative assessment of the patient and risk factors for infectious complications
and tentative classification of surgical field contamination of urological
procedures. World J Urol. 2012, 30 (1), 39–50. PMID: 21779836.
DOI: 10.1007/s00345-011-0722-z.
Grabe M., Forsgren A., Björk T., Hellsten S.: Controlled trial of a short and a
prolonged course with ciprofloxacin in patients undergoing transurethral
prostatic surgery. Eur J Clin Microbiol. 1987, 6 (1), 11–17. PMID: 3569248.
Grabe M., Shortliffe L., Lobel B.: Risk factors. W: Nosocomial and health care
associated infections in urology. Red. K.G. Naber, J.C. Pechere, J. Kumazawa,
S. Khoury, J.L. Gerbedering, A.J. Schaeffer. Health Publications, London
2001, 35–57.
Grabe M.: Antibiotic prophylaxis in urological surgery, a European viewpoint.
Int J Antimicrob Agents. 2011, 38 Suppl, 58–63. PMID: 21996404.
DOI: 10.1016/j.ijantimicag.2011.09.008.
Grabe M.: Controversies in antibiotic prophylaxis in urology. Int J Antimicrob
Agents. 2004, 23 Suppl 1: p. S17–23. PMID: 15037324. DOI: 10.1016/j.
ijantimicag.2003.09.005.
Grady R.: Safety profile of quinolone antibiotics in the pediatric population.
Pediatr Infect Dis J. 2003, 22 (12), 1128–1132. PMID: 14688586.
DOI: 10.1097/01.inf.0000101994.25947.12.
Green H., Rahamimov R., Goldberg E., Leibovici L., Gafter U., Bishara J. i wsp.:
Consequences of treated versus untreated asymptomatic bacteriuria in the
first year following kidney transplantation: retrospective observational study.
Eur J Clin Microbiol Infect Dis. 2013, 32 (1), 127–131. PMID: 22918514.
DOI: 10.1007/s10096-012-1727-2.
Griffith B.C., Morey A.F., Ali-Khan M.M., Canby-Hagino E., Foley J.P., Rozanski
T.A.: Single dose levofloxacin prophylaxis for prostate biopsy in patients at low
risk. J Urol. 2002, 168 (3), 1021–1023. PMID: 12187213. DOI: 10.1097/01.
ju.0000025794.38251.84.
Griffith D.P., Osborne C.A.: Infection (urease) stones. Miner Electrolyte Metab.
1987, 13 (4), 278–285. PMID: 3306321.
Gupta K., Hooton T.M., Roberts P.L., Stamm W.E.: Short-course nitrofurantoin
for the treatment of acute uncomplicated cystitis in women. Arch
Intern Med. 2007, 167 (20), 2207–2212. PMID: 17998493 DOI: 10.1001/
archinte.167.20.2207.
Gupta K., Stamm W.E.: Outcomes associated with trimethoprim/sulphamethoxazole
(TMP/SMX) therapy in TMP/SMX resistant community-acquired
UTI. Int J Antimicrob Agents. 2002, 19 (6), 554–556. PMID: 12135847.
Gyssens I.C.: Antibiotic policy. Int J Antimicrob Agents. 2011, 38 Suppl.,
11–20. PMID: 22018989. DOI: 10.1016/j.ijantimicag.2011.09.002.
Haggerty C.L.: Evidence for a role of Mycoplasma genitalium in pelvic inflammatory
disease. Curr Opin Infect Dis. 2008, 21 (1), 65–69. PMID: 18192788.
DOI: 10.1097/QCO.0b013e3282f3d9ac.
Hansson S., Jodal U., Lincoln K., Svanborg-Edén C.: Untreated asymptomatic
bacteriuria in girls: II – Effect of phenoxymethylpenicillin and erythromycin
given for intercurrent infections. BMJ. 1989, 298 (6677), 856–859. PMID:
2497823 PMCID: PMC1836159.
Hara N., Kitamura Y., Saito T., Komatsubara S., Nishiyama T., Takahashi K.:
Perioperative antibiotics in radical cystectomy with ileal conduit urinary
diversion: efficacy and risk of antimicrobial prophylaxis on the operation
day alone. Int J Urol. 2008, 15 (6), 511–515. PMID: 18422576. DOI:
10.1111/j.1442-2042.2008.02050.x.
Harbarth S., Holeckova K., Froidevaux C., Pittet D., Ricou B., Grau G.E. i wsp.:
Diagnostic value of procalcitonin, interleukin-6, and interleukin-8 in
critically ill patients admitted with suspected sepsis. Am J Respir Crit
Care Med. 2001, 164 (3), 396–402. PMID: 11500339. DOI: 10.1164/ajrccm.164.3.2009052.
Harding G.K., Zhanel G.G., Nicolle L.E., Cheang M.: Antimicrobial treatment
in diabetic women with asymptomatic bacteriuria. N Engl J Med. 2002,
347 (20), 1576–1583. PMID: 12432044. DOI: 10.1056/NEJMoa021042.
Haycock G.B.: A practical approach to evaluating urinary tract infection in
children. Pediatr Nephrol. 1991, 5 (4), 401–442; discussion 403. PMID:
1654977.
Hellerstein S.: Urinary tract infection in children: pathophysiology, risk factors
and management. Infect Med. 2002, 19, 554–560.
Hellerstein S.: Urinary tract infections. Old and new concepts. Pediatr Clin
North Am. 1995, 42 (6), 1433–1457. PMID: 8614594.
Hendrikx A.J., Strijbos W.E., de Knijff D.W., Kums J.J., Doesburg W.H., Lemmens
W.A.: Treatment for extended-mid and distal ureteral stones: SWL or ureteroscopy?
Results of a multicenter study. J Endourol. 1999, 13 (10), 727–
733. PMID: 10646679.
DOI: 10.1089/end.1999.13.727.
Herr H.W.: Should antibiotics be given prior to outpatient cystoscopy? A
plea to urologists to practice antibiotic stewardship. Eur Urol. 2014, 65 (4),
839–842. PMID: 24012206.
DOI: 10.1016/j.eururo.2013.08.054.
Hill J.B., Sheffield J.S., McIntire D.D., Wendel G.D.: Acute pyelonephritis in
pregnancy. Obstet Gynecol. 2005, 105 (1), 18–23.
Hoberman A., Chao H.P., Keller D.M., Hickey R., Davis H.W., Ellis D.: Prevalence
of urinary tract infection in febrile infants. J Pediatr. 1993, 123 (1), 17–23.
PMID: 8320616.
Hoberman A., Wald E.R.: Urinary tract infections in young febrile children.
Pediatr Infect Dis J. 1997, 16 (1), 11–17. PMID: 9002094.
Hooton T.M.: Prevention of recurrent urogenital tract infections in adult
women. W: Urogenital Infections. Red. K.G. Naber, A.J. Scaeffer, C.F. Heyns,
T. Matsumoto, D.A. Shoskes, T.E. Bjerklund Johansen. European Association
of Urology, Arnhem 2010, 236–239. http://www.icud.info/urogenitalinfections.
html.
Hooton T.M.: Recurrent urinary tract infection in women. Int J Antimicrob
Agents. 2001, 17 (4), 259–268. PMID: 11295405.
Hooton T.M., Roberts P.L., Cox M.E., Stapleton A.E.: Voided midstream urine
culture and acute cystitis in premenopausal women. N Engl J Med. 2013, 369
(20), 1883–1891. PMID: 24224622. PMCID: PMC4041367. DOI: 10.1056/
NEJMoa1302186
Hooton T.M., Roberts P.L., Stapleton A.E.: Cefpodoxime vs ciprofloxacin for
short-course treatment of acute uncomplicated cystitis: a randomized trial.
JAMA. 2012, 307 (6), 583–589. PMID: 22318279. PMCID: PMC3736973.
DOI: 10.1001/jama.2012.80.
Hooton T.M., Scholes D., Gupta K., Stapleton A.E., Roberts P.L., Stamm W.E.:
Amoxicillin-clavulanate vs ciprofloxacin for the treatment of uncomplicated
cystitis in women: a randomized trial. JAMA. 2005, 293 (8), 949–
955. PMID: 15728165. DOI: 10.1001/jama.293.8.949.
Hooton T.M., Stamm W.E.: Diagnosis and treatment of uncomplicated urinary
tract infection. Infect Dis Clin North Am. 1997, 11 (3), 551–181.
PMID: 9378923.
Horan T.C., Gaynes R.P.: Surveillance of nosocomial infections. W: Hospital
epidemiology and infection control. Red. C.G. Mayhall. Lippincott, Williams
& Wilkins, Philadelphia 2004, 1659–1702.
Hotchkiss R.S., Karl I.E.: The pathophysiology and treatment of sepsis. N
Engl J Med. 2003, 348 (2), 138–150. PMID: 12519925. DOI: 10.1056/
NEJMra021333.
Hua L.X., Zhang J.X., Wu H.F., Zhang W., Qian L.X., Xia G.W. i wsp.: [The diagnosis
and treatment of acute prostatitis: report of 35 cases]. Zhonghua Nan
Ke Xue. 2005, 11 (12), 897–899. PMID: 16398358.
Huang J.J., Sung J.M., Chen K.W., Ruaan M.K., Shu G.H., Chuang Y.C.: Acute
bacterial nephritis: a clinicoradiologic correlation based on computed tomography.
Am J Med. 1992, 93 (3), 289–298. PMID: 1524081.
Isen K., Küpeli B., Sinik Z., Sözen S., Bozkirli I.: Antibiotic prophylaxis for transrectal
biopsy of the prostate: a prospective randomized study of the prophylactic
use of single dose oral fluoroquinolone versus trimethoprim-sulfamethoxazole.
Int Urol Nephrol. 1999, 31 (4), 491–495. PMID: 10668944.
Jacobson S.H., Eklöf O., Eriksson C.G., Lins L.E., Tidgren B., Winberg J.:
Development of hypertension and uraemia after pyelonephritis in childhood:
27 year follow up. BMJ. 1989, 299 (6701), 703–706.
Jakobsson B., Söderlundh S., Berg U.: Diagnostic significance of 99mTc-dimercaptosuccinic
acid (DMSA) scintigraphy in urinary tract infection. Arch Dis
Child. 1992, 67 (11), 1338–1342. PMID: 1335226. PMCID: PMC1793761.
Jakobsson B., Svensson L.: Transient pyelonephritic changes on 99mTechnetium-
dimercaptosuccinic acid scan for at least five months after infection.
Acta Paediatr. 1997, 86 (8), 803–807. PMID: 9307157.
Jantausch B.A., Rifai N., Getson P., Akram S., Majd M., Wiedermann B.L.: Urinary
N-acetyl-beta-glucosaminidase and beta-2-microglobulin in the diagnosis
of urinary tract infection in febrile infants. Pediatr Infect Dis J. 1994, 13
(4), 294–299. PMID: 8036046.
Jepson R.G., Williams G., Craig J.C.: Cranberries for preventing urinary tract
infections. Cochrane Database Syst Rev. 2012, 10, p. Cd001321. MID:
23076891. DOI: 10.1002/14651858.CD001321.pub5.
Jimenez Cruz J.F., Sanz Chinesta S., Otero G., Díaz González R., Alvarez Ruiz F.,
Flores N. i wsp.: Antimicrobial prophylaxis in urethrocystoscopy. Comparative
study. Actas Urol Esp. 1993, 17 (3), 172–175. PMID: 8506770.
Jimenez-Cruz J.F., Tormo F.B., Gómez J.G.: Treatment of chronic prostatitis:
intraprostatic antibiotic injections under echography control. J Urol. 1988,
139 (5), 967–970. PMID: 3283385.
Jodal U.: The natural history of bacteriuria in childhood. Infect Dis Clin
North Am. 1987, 1 (4), 713–729. PMID: 3333655.
Johnson M.I., Merrilees D., Robson W.A., Lennon T., Masters J., Orr K.E. i
wsp.: Oral ciprofloxacin or trimethoprim reduces bacteriuria after flexible
cystoscopy. BJU Int. 2007, 100 (4), 826–829. PMID: 17822463. DOI:
10.1111/j.1464-410X.2007.07093.x.
Kabalin J.N., Kessler R.: Infectious complications of penile prosthesis surgery.
J Urol. 1988, 139 (5), 953–955. PMID: 3361672.
Kahlmeter G.: Prevalence and antimicrobial susceptibility of pathogens in
uncomplicated cystitis in Europe. The ECO.SENS study. Int J Antimicrob
Agents. 2003, 22 Suppl 2, 49–52. PMID: 14527771.
Kangarloo H., Gold R.H., Fine R.N., Diament M.J., Boechat M.I.: Urinary tract
infection in infants and children evaluated by ultrasound. Radiology. 1985,
154 (2), 367–373. PMID: 3880909. DOI: 10.1148/radiology.154.2.3880909.
Kapoor D.A., Klimberg I.W., Malek G.H., Wegenke J.D., Cox C.E., Patterson A.L.
i wsp.: Single-dose oral ciprofloxacin versus placebo for prophylaxis during
transrectal prostate biopsy. Urology. 1998, 52 (4), 552–558. PMID: 9763070.
Karmouni T., Bensalah K., Alva A., Patard J.J., Lobel B., Guillé F.: [Role of antibiotic
prophylaxis in ambulatory cystoscopy]. Prog Urol. 2001, 11 (6), 1239–
1241. PMID: 11859658.
Kass E.H.: Asymptomatic infections of the urinary tract. Trans Assoc Am
Physicians. 1956, 69, 56–64. PMID: 13380946.
Kass E.H.: Bacteriuria and pyelonephritis of pregnancy. Arch Intern Med.
1960, 105, 194–198. PMID: 14404662.
Kass E.J.: Imaging in acute pyelonephritis. Curr Opin Urol. 1994, 4, 39–44.
Kass E.J., Fink-Bennett D., Cacciarelli A.A., Balon H., Pavlock S.: The sensitivity
of renal scintigraphy and sonography in detecting nonobstructive
acute pyelonephritis. J Urol. 1992, 148 (2 Pt 2), 606–608. PMID: 1640534.
Kass E.J., Kernen K.M., Carey J.M.: Paediatric urinary tract infection and
the necessity of complete urological imaging. BJU Int. 2000, 86 (1), 94–96.
PMID: 10886091
Kazemier B., Koningstein F.N., Schneeberger C., Ott A., Bossuyt P.M., de Miranda
E. i wsp.: Maternal and neonatal consequences of (un)treated asymptomatic
bacteriuria in pregnancy; tha ASB study. ICAAC 2014.
Khan A.J.: Efficacy of single-dose therapy of urinary tract infection in infants
and children: a review. J Natl Med Assoc. 1994, 86 (9), 690–696. PMID:
7966433. PMCID: PMC2607573.
Kiddoo D.A., Wollin T.A., Mador D.R.: A population based assessment of complications
following outpatient hydrocelectomy and spermatocelectomy.
J Urol. 2004, 171 (2 Pt 1), 746–748. PMID: 14713801. DOI: 10.1097/01.
ju.0000103636.61790.43.
Klausner H.A., Brown P., Peterson J., Kaul S., Khashab M., Fisher A.C. i wsp.: A
trial of levofloxacin 750 mg once daily for 5 days versus ciprofloxacin 400
mg and/or 500 mg twice daily for 10 days in the treatment of acute pyelonephritis.
Curr Med Res Opin. 2007, 23 (11), 2637–2645. PMID: 17880755.
DOI: 10.1185/030079907X233340.
Kleinman P.K., Diamond D.A., Karellas A., Spevak M.R., Nimkin K., Belanger P.:
Tailored low-dose fluoroscopic voiding cystourethrography for the reevaluation
of vesicoureteral reflux in girls. AJR Am J Roentgenol. 1994, 162
(5), 1151–1154; discussion 1155–1156. PMID: 8166001. DOI: 10.2214/
ajr.162.5.8166001.
Knipper A., Böhle A., Pensel J., Hofstetter A.G.: Antibiotic prophylaxis with
enoxacin in extracorporeal shockwave lithotripsy. Infection. 1989, 17 Suppl
1, S37–38. PMID: 2807562.
Knopf H.J., Graff H.J., Schulze H.: Perioperative antibiotic prophylaxis in ureteroscopic
stone removal. Eur Urol. 2003, 44 (1), 115–118. PMID: 12814685.
Koch C.G., Li L., Hixson E., Tang A., Gordon S., Longworth D. i wsp.: Is it time
to refine? An exploration and simulation of optimal antibiotic timing in
general surgery. J Am Coll Surg. 2013, 217 (4), 628–635. PMID: 23849901.
DOI: 10.1016/j.jamcollsurg.2013.05.024.
Koch V.H., Zuccolotto S.M.: [Urinary tract infection: a search for evidence]. J
Pediatr (Rio J). 2003, 79, Suppl 1, S97–106. PMID: 14506522.
Kontiokari T., Sundqvist K., Nuutinen M., Pokka T., Koskela M., Uhari M.:
Randomised trial of cranberry-lingonberry juice and Lactobacillus GG drink
for the prevention of urinary tract infections in women. BMJ. 2001, 322
(7302). 1571, PMID: 11431298. PMCID: PMC33514.
Kranjcec B., Papeš D., Altarac S.: D-mannose powder for prophylaxis of
recurrent urinary tract infections in women: a randomized clinical trial.
World J Urol. 2014, 32 (1), 79–84. PMID: 23633128. DOI: 10.1007/
s00345-013-1091-6.
Krieger J.N.: Recurrent lower urinary tract infections in men. J New Rem
Clin. 1998, 47, 4–15.
Krieger J.N.: Trichomoniasis in men: old issues and new data. Sex Transm
Dis. 1995, 22 (2), 83–96. PMID: 7624817.
Krieger J.N., Egan K.J., Ross S.O., Jacobs R., Berger R.E.: Chronic pelvic pains
represent the most prominent urogenital symptoms of “chronic prostatitis”.
Urology. 1996, 48 (5), 715–721. PMID: 8911515. DOI: 10.1016/
S0090-4295(96)00421-9.
Krieger J.N., Nyberg L., Nickel J.C.: NIH consensus definition and classification
of prostatitis. JAMA. 1999, 282 (3), 236–237. PMID: 10422990.
Kulchavenya E., Chul-sung K.: Male genital tuberculosis. W: Urogenital
Infections. Red. K.G. Naber, A.J. Scaeffer, C.F. Heyns, T. Matsumoto, D.A.
Shoskes, T.E. Bjerklund Johansen. European Association of Urology, Arnhem
2010, 877–891. http://www.icud.info/urogenitalinfections.html.
Kunin C.M.: Urinary tract infections: detection, prevention and management.
Williams and Wilkins, Baltimore 1997.
Landau D., Turner M.E., Brennan J., Majd M.: The value of urinalysis in differentiating
acute pyelonephritis from lower urinary tract infection in febrile
infants. Pediatr Infect Dis J. 1994, 13 (9), 77–81. PMID: 7808845.
Larsson P., Norming U., Törnblom M., Gustafsson O.: Antibiotic prophylaxis
for prostate biopsy: benefits and costs. Prostate Cancer Prostatic Dis. 1999,
2 (2), 88–90. PMID: 12496844. DOI: 10.1038/sj.pcan.4500294.
Latthe P.M., Foon R., Toozs-Hobson P.: Prophylactic antibiotics in urodynamics:
a systematic review of effectiveness and safety. Neurourol Urodyn. 2008,
27 (3), 167–173. PMID: 17849482. DOI: 10.1002/nau.20501.
Lecomte F., Allaert F.A.: Single-dose treatment of cystitis with fosfomycin
trometamol (Monuril): analysis of 15 comparative trials on 2,048 patients.
Giorn It Ost Gin. 1997, 19, 399–404.
Lenk S., Yasuda M.: Urinary tuberculosis. W: Urogenital Infections. Red.
K.G. Naber, A.J. Scaeffer, C.F. Heyns, T. Matsumoto, D.A. Shoskes, T.E.
Bjerklund Johansen. European Association of Urology, Arnhem 2010, 864–
876. http://www.icud.info/urogenitalinfections.html.
Levy M.M., Fink M.P., Marshall J.C., Abraham E., Angus D., Cook D. i wsp.: 2001
SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference.
Crit Care Med. 2003, 31 (4), 1250–1256. PMID: 12682500. DOI: 10.1097/01.
CCM.0000050454.01978.3B.
Lifshitz E., Kramer L.: Outpatient urine culture: does collection technique
matter? Arch Intern Med. 2000, 160 (16), 2537–2340. PMID: 10979067.
Lin D.S., Huang S.H., Lin C.C., Tung Y.C., Huang T.T., Chiu N.C. i wsp.: Urinary
tract infection in febrile infants younger than eight weeks of Age. Pediatrics.
2000, 105 (2), E20. PMID: 10654980.
Lindstedt S., Lindström U., Ljunggren E., Wullt B., Grabe M.: Single-dose antibiotic
prophylaxis in core prostate biopsy: Impact of timing and identification
of risk factors. Eur Urol. 2006, 50 (4), 832–837. PMID: 16750292.
DOI: 10.1016/j.eururo.2006.05.003.
Litwin M.S., McNaughton-Collins M., Fowler F.J. Jr, Nickel J.C., Calhoun E.A.,
Pontari M.A i wsp.: The National Institutes of Health chronic prostatitis
symptom index: development and validation of a new outcome measure.
Chronic Prostatitis Collaborative Research Network. J Urol. 1999, 162 (2),
369–375. PMID: 10411041.
Logadottir Y., Dahlstrand C., Fall M., Knutson T., Peeker R.: Invasive urodynamic
studies are well tolerated by the patients and associated with a low
risk of urinary tract infection. Scand J Urol Nephrol. 2001, 35 (6), 459–
462. PMID: 11848424.
Lu Y., Tianyong F., Ping H., Liangren L., Haichao Y., Qiang W.: Antibiotic prophylaxis
for shock wave lithotripsy in patients with sterile urine before treatment
may be unnecessary: a systematic review and meta-analysis. J Urol.
2012, 188 (2), 441–448. PMID: 22704118. DOI: 10.1016/j.juro.2012.04.014.
Ludwig M., Jantos C.A., Wolf S., Bergmann M., Failing K., Schiefer H.G. i wsp.:
Tissue penetration of sparfloxacin in a rat model of experimental Escherichia
coli epididymitis. Infection. 1997, 25 (3), 178–184. PMID: 9181388.
Ludwig M., Schroeder-Printzen I., Schiefer H.G., Weidner W.: Diagnosis and
therapeutic management of 18 patients with prostatic abscess. Urology.
1999, 53 (2), 340–345. PMID: 9933051.
Lutay N., Ambite I., Grönberg Hernandez J., Rydström G., Ragnarsdóttir B.,
Puthia M. i wsp.: Bacterial control of host gene expression through RNA
polymerase II. J Clin Invest. 2013, 123 (6), 2366–2379. PMID: 23728172.
PMCID: PMC3668848. DOI: 10.1172/JCI66451.
Ma J.F., Shortliffe L.M.: Urinary tract infection in children: etiology and epidemiology.
Urol Clin North Am. 2004, 31 (3), p. 517-26, ix–x.
MacDermott J.P., Ewing R.E., Somerville J.F., Gray B.K.: Cephradine prophylaxis
in transurethral procedures for carcinoma of the bladder. Br J Urol.
1988, 62 (2), 136–139. PMID: 3044484.
MacKenzie J.R., Fowler K., Hollman A.S., Tappin D., Murphy A.V., Beattie T.J. i
wsp.: The value of ultrasound in the child with an acute urinary tract infection.
Br J Urol. 1994, 74 (2), 240–244. PMID: 7921944.
Madersbacher H., van Ophoven A., van Kerrebroeck P.E.: GAG layer replenishment
therapy for chronic forms of cystitis with intravesical glycosaminogly
cans – a review. Neurourol Urodyn. 2013, 32 (1), 9–18. PMID: 22782909.
DOI: 10.1002/nau.22256.
Magistro G., Stief C.G., Gratzke C.: [Perioperative antibiotic prophylaxis for
major urological interventions]. Urologe A. 2014, 53 (10), 1482–1488. PMID:
25230809. DOI: 10.1007/s00120-014-3572-7.
Majd M., Rushton H.G., Jantausch B., Wiedermann B.L.: Relationship among
vesicoureteral reflux, P-fimbriated Escherichia coli, and acute pyelonephritis
in children with febrile urinary tract infection. J Pediatr. 1991, 119 (4),
578–585. PMID: 1681043.
Maki D.G., Tambyah P.A.: Engineering out the risk for infection with urinary
catheters. Emerg Infect Dis. 2001, 7 (2), 342–347. PMID: 11294737.
PMCID: PMC2631699. DOI: 10.3201/eid0702.700342.
Mangram A.J., Horan T.C., Pearson M.L., Silver L.C., Jarvis W.R.: Guideline for
Prevention of Surgical Site Infection. 1999, Centers for Disease Control and
Prevention (CDC) Hospital Infection Control Practices Advisory Committee.
Am J Infect Control. 1999, 27 (2), 97–132. PMID: 10196487.
Manson A.L.: Is antibiotic administration indicated after outpatient cystoscopy.
J Urol. 1988, 140 (2), 316–317. PMID: 3398127.
Mariappan P., Smith G., Bariol S.V., Moussa S.A., Tolley D.A.: Stone and pelvic
urine culture and sensitivity are better than bladder urine as predictors
of urosepsis following percutaneous nephrolithotomy: a prospective
clinical study. J Urol. 2005, 173 (5), 1610–1614. PMID: 15821509. DOI:
10.1097/01.ju.0000154350.78826.96.
Martin G.S., Mannino D.M., Eaton S., Moss M.: The epidemiology of sepsis in
the United States from 1979 through 2000. N Engl J Med. 2003, 348 (16),
1546–1554. PMID: 12700374. DOI: 10.1056/NEJMoa022139.
Martov A., Gravas S., Etemadian M., Unsal A., Barusso G., D’Addessi A. i wsp.:
Postoperative infection rates in patients with a negative baseline urine culture
undergoing ureteroscopic stone removal: a matched case-control analysis
on antibiotic prophylaxis from the CROES URS global study. J Endourol.
2015, 29 (2), 171–180. PMID: 25072350.
DOI: 10.1089/end.2014.0470.
Mayersak J.S.: Transrectal ultrasonography directed intraprostatic injection
of gentamycin-xylocaine in the management of the benign painful
prostate syndrome. A report of a 5 year clinical study of 75 patients. Int
Surg. 1998, 83 (4), 347–349.
Mazzulli T.: Resistance trends in urinary tract pathogens and impact on
management. J Urol. 2002, 168 (4 Pt 2), 1720–1722. PMID: 12352343.
DOI: 10.1097/01.ju.0000028385.10311.c9.
Meares E.M., Stamey T.A.: Bacteriologic localization patterns in bacterial
prostatitis and urethritis. Invest Urol. 1968, 5 (5), 492–518. PMID: 4870505.
Melekos M.D.: Efficacy of prophylactic antimicrobial regimens in preventing
infectious complications after transrectal biopsy of the prostate. Int Urol
Nephrol. 1990, 22 (3), 257–262. PMID: 2210982.
Michael M., Hodson E.M., Craig J.C., Martin S., Moyer V.A.: Short versus standard
duration oral antibiotic therapy for acute urinary tract infection in children.
Cochrane Database Syst Rev. 2003, 1, Cd003966. PMID: 12535494.
DOI: 10.1002/14651858.CD003966.
Mignard J.P.: [Sterilisation and disinfection of instruments]. Prog Urol.
2004, 14 (1), 1049–1092.
Millar L.K., Wing D.A., Paul R.H., Grimes D.A.: Outpatient treatment of pyelonephritis
in pregnancy: a randomized controlled trial. Obstet Gynecol.
1995, 86 (4 Pt 1), 560–564. PMID: 7675380.
Mody L., Juthani-Mehta M.: Urinary tract infections in older women: a clinical
review. JAMA. 2014, 311 (8), 844–854. PMID: 24570248. PMCID:
PMC4194886. DOI: 10.1001/jama.2014.303.
Montgomery J.S., Johnston W.K., Wolf J.S.: Wound complications after hand
assisted laparoscopic surgery. J Urol. 2005, 174 (6), 2226–2230. PMID:
16280775.
DOI: 10.1097/01.ju.0000181805.30826.fa.
Mould J.W., Carson C.C.: Infectious complications of penile prostheses. Infect
Urol. 1989, 139, 50–52.
Mouton Y.J., Beuscart C.: Empirical monotherapy with meropenem in serious
bacterial infections. Meropenem Study Group. J Antimicrob Chemother.
1995, 36 Suppl A, 145–156. PMID: 8543490.
Mucci B., Maguire B.: Does routine ultrasound have a role in the investigation
of children with urinary tract infection? Clin Radiol. 1994, 49 (5),
324–325. PMID: 8013196.
Naber K.G.: Antimicrobial Treatment of Bacterial Prostatitis. European
Urology Supplements. 2003, 2 (2), 23–26.
Naber K.G.: Experience with the new guidelines on evaluation of new antiinfective
drugs for the treatment of urinary tract infections. Int J Antimicrob
Agents. 1999, 11 (3-4), 189–196; discussion 213–216. PMID: 10394969.
Naber K.G., Adam D.: Classification of fluoroquinolones. Chemother J. 1998,
7, 66–68.
Naber K.G., Bergman B., Bishop M.C., Bjerklund-Johansen T.E., Botto H., Lobel
B. i wsp.: EAU guidelines for the management of urinary and male genital
tract infections. Urinary Tract Infection (UTI) Working Group of the Health
Care Office (HCO) of the European Association of Urology (EAU). Eur Urol.
2001a, 40 (5), 576–588. PMID: 11752870.
Naber K.G., Cho Y.H., Matsumoto T., Schaeffer A.J.: Immunoactive prophylaxis
of recurrent urinary tract infections: a meta-analysis. Int J Antimicrob
Agents. 2009a, 33 (2), 111–119. PMID: 18963856.
DOI: 10.1016/j.
ijantimicag.2008.08.011.
Naber K.G., Hauke S.S.: Cefpodoxime proxetil in patients with acute uncomplicated
pyelonephritis. International, prospective, randomized comparative
study versus ciprofloxacin in general practice. Chemother J. 2001. 10, 29–34.
Naber K.G., Hofstetter A.G., Brühl P., Bichler K., Lebert C.: Guidelines for the
perioperative prophylaxis in urological interventions of the urinary and
male genital tract. Int J Antimicrob Agents. 2001b, 17 (4), 321–326. PMID:
11295416
Naber K.G., Llorens L., Kaniga K., Kotey P., Hedrich D., Redman R.: Intravenous
doripenem at 500 milligrams versus levofloxacin at 250 milligrams, with
an option to switch to oral therapy, for treatment of complicated lower urinary
tract infection and pyelonephritis. Antimicrob Agents Chemother.
2009b, 53 (9), 3782–3792. PMID: 19581455. PMCID: PMC2737884. DOI:
10.1128/AAC.00837-08.
Naber K.G., Savov O., Salmen H.C.: Piperacillin 2 g/tazobactam 0.5 g is as
effective as imipenem 0.5 g/cilastatin 0.5 g for the treatment of acute
uncomplicated pyelonephritis and complicated urinary tract infections.
Int J Antimicrob Agents. 2002, 19 (2), 95–103. PMID: 11850161.
Naber K.G., Scaeffer A.J., Heyns C.F., Matsumoto T., Shoskes D.A., Bjerklund
Johansen T.E. (red.): Urogenital infections – International consultations on
urological diseases. European Association of Urology, Arnhem 2010. http://
www.icud.info/urogenitalinfections.html.
Naber K.G., Schito G., Botto H., Palou J., Mazzei T.: Surveillance study in Europe
and Brazil on clinical aspects and Antimicrobial Resistance Epidemiology
in Females with Cystitis (ARESC): implications for empiric therapy. Eur
Urol. 2008, 54 (5), 1164–1175. PMID: 18511178. DOI: 10.1016/j.eururo.
2008.05.010.
Naber K.G., Weidner W.: Prostatitits, epididymitis and orchitis. W: Infectious
diseases. Red. D. Armstrong, J. Cohen. Mosby, London 1999.
NIDRR: The prevention and management of urinary tract infections
among people with spinal cord injuries. National Institute on Disability
and Rehabilitation Research Consensus Statement. January 27–29. 1992,
J Am Paraplegia Soc. 1992, 15 (3), 194–204. PMID: 1500945.
NCCLS: Methods for dilution antimicrobial susceptibility tests for bacteria
that grow aerobically. Approved Standard 4th Edition M7-A5 (2002)
and M100-S12. National Committee for Clinical Laboratory Standards,
Wayne 2004.
Nickel J.C.: Effective office management of chronic prostatitis. Urol Clin
North Am. 1998, 25 (4), 677–684. PMID: 10026774.
Nicolle L.E.: A practical guide to the management of complicated urinary
tract infection. Drugs. 1997a, 53 (4), 583–592. PMID: 9098661.
Nicolle L.E.: Asymptomatic bacteriuria in the elderly. Infect Dis Clin North
Am. 1997b, 11 (3), 647–662. PMID: 9378928.
Nicolle L.E.: Asymptomatic bacteriuria. Curr Opin Infect Dis. 2014a, 27
(1), 90–96. PMID: 24275697. DOI: 10.1097/QCO.0000000000000019.
Nicolle L.E.: Pivmecillinam in the treatment of urinary tract infections. J
Antimicrob Chemother. 2000, 46 Suppl 1: 35–39; discussion 63–65. PMID:
11051622.
Nicolle L.E.: Urinary tract infection in geriatric and institutionalized patients.
Curr Opin Urol. 2002, 12 (1), 51–55. PMID: 11753134.
Nicolle L.E.: Urinary tract infections in patients with spinal injuries.
Curr Infect Dis Rep. 2014b, 16 (1), 390. PMID: 24445675. DOI: 10.1007/
s11908-013-0390-9.
Nicolle L.E.: Urinary tract infections in special populations: diabetes, renal
transplant, HIV infection, and spinal cord injury. Infect Dis Clin North Am.
2014c, 28 (1), 91–104. PMID: 24484577.
DOI: 10.1016/j.idc.2013.09.006.
Nicolle L.E., Bradley S., Colgan R., Rice J.C., Schaeffer A., Hooton T.M.: Infectious
Diseases Society of America guidelines for the diagnosis and treatment of
asymptomatic bacteriuria in adults. Clin Infect Dis. 2005, 40 (5), 643–654.
PMID: 15714408.
DOI: 10.1086/427507.
NIDDK: Workshop Committee of the National Institute of Diabetes and
Digestive and Kidney Disease. Chronic prostatitis workshop. 7–8.12.1995.
Bethesda, Maryland.
Nistal M.: Testicular and epididymal pathology. Thieme, Stuttgart 1984.
Ohkawa M., Yamaguchi K., Tokunaga S., Nakashima T., Shoda R.: Antimicrobial
treatment for chronic prostatitis as a means of defining the role of Ureaplasma
urealyticum. Urol Int. 1993, 51 (3), 129–132. PMID: 8249222.
Osman M., Wendt-Nordahl G., Heger K., Michel M.S., Alken P., Knoll T.:
Percutaneous nephrolithotomy with ultrasonography-guided renal access:
experience from over 300 cases. BJU Int. 2005, 96 (6), 875–878. MID:
16153221. DOI: 10.1111/j.1464-410X.2005.05749.x.
Oteo J., Bautista V., Lara N., Cuevas O., Arroyo M., Fernández S. i wsp.: Parallel
increase in community use of fosfomycin and resistance to fosfomycin
in extendedspectrum beta-lactamase (ESBL)-producing Escherichia coli.
J Antimicrob Chemother. 2010a, 65 (11), 2459–2463. PMID: 20851815.
DOI: 10.1093/jac/dkq346.
Oteo J., Pérez-Vázquez M., Campos J.: Extended-spectrum β-lactamase producing
Escherichia coli: changing epidemiology and clinical impact. Curr
Opin Infect Dis. 2010b, 23 (4), 320–326. PMID: 20614578.
Ozturk E., Sonmez Y., Yilmazlar T.: What are the indications for a stoma
in Fournier’s gangrene? Colorectal Dis. 2011, 13 (9), 1044–1107. PMID:
20579084. DOI: 10.1111/j.1463-1318.2010.02353.x.
Papp J.R., Schachter J., Gaydos C.A., van der Pol B.: Recommendations for the
laboratory-based detection of Chlamydia trachomatis and Neisseria gonorrhoeae
– 2014. MMWR Reccom Rep. 2014, 63, 1–19. PMCID: PMC4047970.
Parsons C.L., Stauffer C., Mulholland S.G., Griffith D.P.: Effect of ammonium
on bacterial adherence to bladder transitional epithelium. J Urol. 1984,
132 (2), 365–366. PMID: 6376829.
Pearle M.S., Roehrborn C.G.: Antimicrobial prophylaxis prior to shock wave
lithotripsy in patients with sterile urine before treatment: a meta-analysis
and cost-effectiveness analysis. Urology. 1997, 49 (5), 679–686. PMID:
9145970. DOI: 10.1016/S0090-4295(96)00626-7.
Persky L., Liesen D., Yangco B.: Reduced urosepsis in a veterans’ hospital.
Urology. 1992, 39 (5), 443–445. PMID: 1580035.
Pessaux P., Atallah D., Lermite E., Msika S., Hay J.M., Flamant Y. i wsp.: Risk
factors for prediction of surgical site infections in “clean surgery”. Am J
Infect Control. 2005, 33 (5), 292–298. PMID: 15947746. DOI: 10.1016/j.
ajic.2004.12.005.
Peterson J., Kaul S., Khashab M., Fisher A.C., Kahn J.B.: A double-blind, randomized
comparison of levofloxacin 750 mg once – daily for five days with
ciprofloxacin 400/500 mg twice-daily for 10 days for the treatment of complicated
urinary tract infections and acute pyelonephritis. Urology. 2008,
71 (1), 17–22. PMID: 18242357.
DOI: 10.1016/j.urology.2007.09.002.
Pettersson B., Tiselius H.G.: Are prophylactic antibiotics necessary during
extracorporeal shockwave lithotripsy? Br J Urol. 1989, 63 (5), 449–452.
PMID: 2659132.
Pfau A., Sacks T.G.: Effective prophylaxis for recurrent urinary tract infections
during pregnancy. Clin Infect Dis. 1992, 14 (4), 810–814. PMID: 1576275.
Phillips B., Ball C., Sackett D., Badenoch D., Straus S., Haynes B. i wsp.: Oxford
Centre for Evidence-Based Medicine Levels of Evidence. http://www.cebm.
net/oxford-centre-evidence-based-medicine-levels-evidence-march-2009/.
Piaggio G., Degl’Innocenti M.L., Tomà P., Calevo M.G., Perfumo F.:
Cystosonography and voiding cystourethrography in the diagnosis of vesicoureteral
reflux. Pediatr Nephrol. 2003, 18 (1), 18–22. PMID: 12488985.
DOI: 10.1007/s00467-002-0974-3.
Pickard R., Lam T., MacLennan G., Starr K., Kilonzo M., McPherson G. i wsp.:
Antimicrobial catheters for reduction of symptomatic urinary tract infection
in adults requiring short-term catheterisation in hospital: a multicentre
randomised controlled trial. Lancet. 2012, 380 (9857), 1927–1935. PMID:
23134837.
DOI: 10.1016/S0140-6736 (12)61380-4.
Pickworth F.E., Carlin J.B., Ditchfield M.R., de Campo M.P., de Campo J.F., Cook
D.J i wsp.: Sonographic measurement of renal enlargement in children with
acute pyelonephritis and time needed for resolution: implications for renal
growth assessment. AJR Am J Roentgenol. 1995, 165 (2), 405–408. PMID:
7618567.
DOI: 10.2214/ajr.165.2.7618567.
Piercey K.R., Khoury A.E., McLorie G.A., Churchill B.M.: Diagnosis and management
of urinary tract infections. Curr Opin Urol. 1993, 3, 25–29.
Plettenberg A.: STI – Sexually transmitted infections Ifi-Card, 2nd edition,
June 2014. http://app.ifi-medizin.de/sti/.
Polascik T.J., Oesterling J.E., Partin A.W.: Prostate specific antigen: a decade
of discovery – what we have learned and where we are going. J Urol. 1999,
162 (2), 293–306. PMID: 10411025.
Puig J., Darnell A., Bermúdez P., Malet A., Serrate G., Baré M. i wsp.: Transrectal
ultrasound-guided prostate biopsy: is antibiotic prophylaxis necessary?
Eur Radiol. 2006, 16 (4), 939–943. PMID: 16391904
DOI: 10.1007/
s00330-005-0076-2.
Qiang W., Jianchen W., MacDonald R., Monga M., Wilt T.J.: Antibiotic prophylaxis
for transurethral prostatic resection in men with preoperative urine
containing less than 100,000 bacteria per ml: a systematic review. J Urol.
2005, 173 (4), 1175–1181. PMID: 15758736.
Radomski S.B., Herschorn S.: Risk factors associated with penile prosthesis
infection. J Urol. 1992, 147 (2), 383–385. PMID: 1732599.
Rane A., Cahill D., Saleemi A., Montgomery B., Palfrey E.: The issue of prophylactic
antibiotics prior to flexible cystoscopy. Eur Urol. 2001, 39 (2), 212–
214. PMID: 11223682.
DOI: 52438.
Ransley P.G., Risdon R.A.: Renal papillary morphology in infants and young
children. Urol Res. 1975, 3 (3), 111–113. 10.1007/BF00256031.
Rao P.N., Dube D.A., Weightman N.C., Oppenheim B.A., Morris J.: Prediction of
septicemia following endourological manipulation for stones in the upper
urinary tract. J Urol. 1991, 146 (4), 955–960. PMID: 1895450.
Raz R., Stamm W.E.: A controlled trial of intravaginal estriol in postmenopausal
women with recurrent urinary tract infections. N Engl J Med. 1993, 329
(11), 753–756. PMID: 8350884. DOI: 10.1056/NEJM199309093291102.
Reid G.: Biofilms in infectious disease and on medical devices. Int J
Antimicrob Agents. 1999, 11 (3-4), 223–226. PMID: 10394974.
Richard G.A., Klimberg I.N., Fowler C.L., Callery-D’Amico S., Kim S.S.:
Levofloxacin versus ciprofloxacin versus lomefloxacin in acute pyelonephritis.
Urology. 1998, 52 (1), 51–55. PMID: 9671870.
Richards M.J., Edwards J.R., Culver D.H., Gaynes R.P.: Nosocomial infections
in pediatric intensive care units in the United States. National Nosocomial
Infections Surveillance System. Pediatrics. 1999, 103 (4), e39. PMID: 10103331.
Richter S., Lang R., Zur F., Nissenkorn I.: Infected urine as a risk factor for
postprostatectomy wound infection. Infect Control Hosp Epidemiol. 1991,
12 (3), 147–149. PMID: 2022859.
Riedl C.R., Plas E., Hübner W.A., Zimmerl H., Ulrich W., Pflüger H. i wsp.:
Bacterial colonization of ureteral stents. Eur Urol. 1999, 36 (1), 53–59.
PMID: 10364656.
DOI: 19927.
Risdon R.A.: The small scarred kidney of childhood. A congenital or an
acquired lesion? Pediatr Nephrol. 1987, 1 (4), 632–627. PMID: 3153344.
Risdon R.A., Godley M.L., Parkhouse H.F., Gordon I., Ransley P.G.: Renal pathology
and the 99mTc-DMSA image during the evolution of the early pyelonephritic
scar: an experimental study. J Urol. 1994, 151 (3), 767–773. PMID: 8309003.
Rivers E., Nguyen B., Havstad S., Ressler J., Muzzin A., Knoblich B. i wsp.: Early
goal-directed therapy in the treatment of severe sepsis and septic shock. N
Engl J Med. 2001, 345 (19), 1368–1377. PMID: 11794169. DOI: 10.1056/
NEJMoa010307.
Robinson A.J., Grant J.B., Spencer R.C., Potter C., Kinghorn G.R.: Acute
epididymitis: why patient and consort must be investigated. Br J Urol.
1990, 66 (6), 642–645. PMID: 2265337.
Roghmann F., von Bodman C., Löppenberg B., Hinkel A., Palisaar J., Noldus J.:
Is there a need for the Fournier’s gangrene severity index? Comparison
of scoring systems for outcome prediction in patients with Fournier’s
gangrene. BJU Int. 2012, 110 (9), 1359–1365. PMID: 22494217.
DOI:
10.1111/j.1464-410X.2012.11082.x.
Rosenberg A.R., Rossleigh M.A., Brydon M.P., Bass S.J., Leighton D.M.,
Farnsworth R.H.: Evaluation of acute urinary tract infection in children by
dimercaptosuccinic acid scintigraphy: a prospective study. J Urol. 1992,
148 (5 Pt 2), 1746–1749. PMID: 1331546.
Rosser C.J., Bare R.L., Meredith J.W.: Urinary tract infections in the critically
ill patient with a urinary catheter. Am J Surg. 1999, 177 (4), 287–290.
PMID: 10326844.
Rubin R.H., Shapiro E.D., Andriole V.T., Davis R.J., Stamm W.E.: Evaluation
of new anti-infective drugs for the treatment of urinary tract infection.
Infectious Diseases Society of America and the Food and Drug
Administration. Clin Infect Dis. 1992, 15 Suppl 1, S216–27. PMID: 1477233.
Rubin U.H., Andriole V.T., Davis R.J., Stamm W.E.: General guidelines for the evaluation
of new anti-infective drugs for the treatment of UTI. The European Society
of Clinical Microbiology and Infectious Diseases, Taufkirchen 1993, 240–310.
Rüden H., Gastmeier P., Daschner F.D., Schumacher M.: Nosocomial and community
– acquired infections in Germany. Summary of the results of the
First National Prevalence Study (NIDEP). Infection. 1997, 25 (4), 199–202.
PMID: 9266256.
Rushton H.G., Majd M., Chandra R., Yim D.: Evaluation of 99mtechnetiumdimercapto-
succinic acid renal scans in experimental acute pyelonephritis
in piglets. J Urol. 1988, 140 (5 Pt 2), 1169–1174. PMID: 2846898.
Rushton H.G., Majd M., Jantausch B., Wiedermann B.L., Belman A.B.: Renal
scarring following reflux and nonreflux pyelonephritis in children: evaluation
with 99mtechnetium-dimercaptosuccinic acid scintigraphy. J Urol.
1992, 147 (5), 1327–1332. PMID: 1314912.
Rüther U., Stilz S., Röhl E., Nunnensiek C., Rassweiler J., Dörr U. i wsp.: Successful
interferon-alpha 2 a therapy for a patient with acute mumps orchitis. Eur
Urol. 1995, 27 (2), 174–176. PMID: 7744163.
Sabbagh R., McCormack M., Péloquin F., Faucher R., Perreault J.P., Perrotte P.
i wsp.: A prospective randomized trial of 1-day versus 3-day antibiotic prophylaxis
for transrectal ultrasound guided prostate biopsy. Can J Urol. 2004,
11 (2), 2216–2219. PMID: 15182413.
Sakura M., Kawakami S., Yoshida S., Masuda H., Kobayashi T., Kihara K.:
Prospective comparative study of single dose versus 3-day administration
of antimicrobial prophylaxis in minimum incision endoscopic radical
prostatectomy. Int J Urol. 2008, 15 (4), 328–331. PMID: 18380822. DOI:
10.1111/j.1442-2042.2008.02001.x.
Sarani B., Strong M., Pascual J., Schwab C.W.: Necrotizing fasciitis: current
concepts and review of the literature. J Am Coll Surg. 2009, 208 (2), 279–
288. PMID: 19228540. DOI: 10.1016/j.jamcollsurg.2008.10.032.
SBU Swedish Council on Health Technology Assessment. Antibiotic prophylaxis
for surgical procedures (in Swedish). 2010.
Schaeffer A.J.: Prostatitis: US perspective. Int J Antimicrob Agents. 1999,
11 (3-4), 205–211; discussion 213–216. PMID: 10394972.
Schaeffer A.J., Datta N.S., Fowler J.E. Jr, Krieger J.N., Litwin M.S., Nadler
R.B. i wsp.: Summary consensus statement: diagnosis and management of
chronic prostatitis/chronic pelvic pain syndrome. Eur Urol. 2003, 43 (2),
1–4. PMID: 12521576.
Schaeffer A.J., Montorsi F., Scattoni V., Perroncel R., Song J., Haverstock D.C. i
wsp.: Comparison of a 3-day with a 1-day regimen of an extended-release formulation
of ciprofloxacin as antimicrobial prophylaxis for patients undergoing
transrectal needle biopsy of the prostate. BJU Int. 2007, 100 (1), 51–57.
PMID: 17552953. DOI: 10.1111/j.1464-410X.2007.06848.x.
Schaeffer A.J., Stuppy B.A.: Efficacy and safety of self-start therapy in women
with recurrent urinary tract infections. J Urol. 1999, 161 (1), 207–211.
PMID: 10037399.
Schneede P., Tenke P., Hofstetter A.G.: Sexually transmitted diseases (STDs) –
a synoptic overview for urologists. Eur Urol. 2003, 44 (1), 1–7. PMID:
12814668.
Schneider H., Ludwig M., Hossain H.M., Diemer T., Weidner W.: The 2001 Giessen
Cohort Study on patients with prostatitis syndrome – an evaluation of
inflammatory status and search for microorganisms 10 years after a first
analysis. Andrologia. 2003, 35 (5), 258–262. PMID: 14535851.
Scholes D., Hooton T.M., Roberts P.L., Gupta K., Stapleton A.E., Stamm W.E.:
Risk factors associated with acute pyelonephritis in healthy women. Ann
Intern Med. 2005, 142 (1), 20–27. PMID: 15630106. PMCID: PMC3722605.
Scholz H., Naber K.G.: Classification of oral cephalosporins. Chemother J.
1999, 8, 227–229.
Schulman S.L.: Voiding dysfunction in children. Urol Clin North Am. 2004,
31 (3), 481–90. PMID: 15313057. DOI: 10.1016/j.ucl.2004.04.019.
Seyrek M., Binbay M., Yuruk E., Akman T., Aslan R., Yazici O. i wsp.: Perioperative
prophylaxis for percutaneous nephrolithotomy: randomized study concerning
the drug and dosage. J Endourol. 2012, 26 (11), 1431–1436. PMID:
22612061.
DOI: 10.1089/end.2012.0242.
SFAR Societé Francais d’Anesthésie et de Réanimation. Recommendations for
antibacterial prophylaxis in surgery. Actualisation 1999. Pyrexie. 1999,
3, 21–30.
Shandera K.C., Thibault G.P., Deshon G.E. Jr.: Efficacy of one dose fluoroquinolone
before prostate biopsy. Urology. 1998, 52 (4), 641–643. PMID: 9763085.
Shapiro E.D.: Infections of the urinary tract. Pediatr Infect Dis J. 1992, 11
(2), 165–168. PMID: 1741197.
Sharifi R., Geckler R., Childs S.: Treatment of urinary tract infections: selecting
an appropriate broad-spectrum antibiotic for nosocomial infections.
Am J Med. 1996, 100 (6a), 76s–82s. PMID: 8678101.
Shoskes D.A., Saad R.S.: Urogenital infections in renal transplant patients –
causes and consequences. W: Urogenital Infections. Red. K.G. Naber, A.J.
Scaeffer, C.F. Heyns, T. Matsumoto, D.A. Shoskes, T.E. Bjerklund Johansen.
European Association of Urology, Arnhem 2010, 438–447. http://www.
icud.info/urogenitalinfections.html.
SIGN: Antibiotic prophylaxis in surgery. Scottish Intercollegiate Guidelines
Network (update 2014). 2014.
Silver S.A., Baillie L., Simor A.E.: Positive urine cultures: A major cause of inappropriate
antimicrobial use in hospitals? Can J Infect Dis Med Microbiol.
2009, 20 (4), 107–111. PMID: 21119801.
PMCID: PMC2807252.
Sklar A.H., Caruana R.J., Lammers J.E., Strauser G.D.: Renal infections in
autosomal dominant polycystic kidney disease. Am J Kidney Dis. 1987,
10 (2), 81–88. PMID: 3300296.
Smaill F.: Antibiotics for asymptomatic bacteriuria in pregnancy. Cochrane
Database Syst Rev. 2007 (2), p. Cd000490. PMID: 11405965. DOI:
10.1002/14651858.CD000490.
Smellie J.M., Grüneberg R.N., Bantock H.M., Prescod N.: Prophylactic co-trimoxazole
and trimethoprim in the management of urinary tract infection
in children. Pediatr Nephrol. 1988, 2 (1), 12–17. PMID: 3152984.
Smellie J.M., Rigden S.P., Prescod N.P.: Urinary tract infection: a comparison
of four methods of investigation. Arch Dis Child. 1995, 72 (3), 247–250.
PMID: 7741578.
PMCID: PMC1511059.
Smellie J.M., Rigden S.P.: Pitfalls in the investigation of children with urinary
tract infection. Arch Dis Child. 1995, 72 (3), 251–255. PMID: 7741579.
PMCID: PMC1511070.
Sobel J.D., Kauffman C.A., McKinsey D., Zervos M., Vazquez J.A., Karchmer
A.W. i wsp.: Candiduria: a randomized, double-blind study of treatment with
fluconazole and placebo. The National Institute of Allergy and Infectious
Diseases (NIAID) Mycoses Study Group. Clin Infect Dis. 2000, 30 (1), 19–24.
PMID: 10619727. DOI: 10.1086/313580.
Stamm W.E.: Measurement of pyuria and its relation to bacteriuria. Am J
Med. 1983, 75 (1b), 53–58. PMID: 6349345.
Stamm W.E.: Urinary tract infections in young men. W: Urinary tract infections.
Red. T. Bergan. Karger, Basel 1997, 46–47. DOI:10.1159/000061389.
Stamm W.E., Hooton T.M.: Management of urinary tract infections in adults.
N Engl J Med. 1993, 329 (18), 1328–1334. PMID: 8413414.
DOI: 10.1056/
NEJM199310283291808.
Stamm W.E., McKevitt M., Counts G.W.: Acute renal infection in women:
treatment with trimethoprim-sulfamethoxazole or ampicillin for two or
six weeks. A randomized trial. Ann Intern Med. 1987, 106 (3), 341–345.
PMID: 3492950.
Stapleton A.E., Au-Yeung M., Hooton T.M., Fredricks D.N., Roberts P.L., Czaja C.A.
i wsp.: Randomized, placebo-controlled phase 2 trial of a Lactobacillus crispatus
probiotic given intravaginally for prevention of recurrent urinary tract
infection. Clin Infect Dis. 2011, 52 (10), 1212–1217. PMID: 21498386.
PMCID: PMC3079401. DOI: 10.1093/cid/cir183.
Steiner T., Traue C., Schubert J.: [Perioperative antibiotic prophylaxis in transperitoneal
tumor nephrectomy: does it lower the rate of clinically significant
postoperative infections?]. Urologe A. 2003, 42 (1), 34–37. PMID:
12574881. DOI: 10.1007/s00120-002-0263-6.
Stiasny B., Ziebell D., Graf S., Hauser I.A., Schulze B.D.: Clinical aspects of
renal transplantation in polycystic kidney disease. Clin Nephrol. 2002, 58
(1), 16–24. PMID: 12141402.
Stöhrer M., Blok B., Castro-Diaz D., Chartier-Kastler E., Del Popolo G.,
Kramer G. i wsp.: EAU guidelines on neurogenic lower urinary tract dysfunction.
Eur Urol. 2009, 56 (1), 81–88. PMID: 19403235. DOI: 10.1016/j.
eururo.2009.04.028.
Stothers L.: A randomized trial to evaluate effectiveness and cost effectiveness
of naturopathic cranberry products as prophylaxis against urinary tract
infection in women. Can J Urol. 2002, 9 (3), 1558–1562. PMID: 12121581.
Stranne J., Aus G., Hansson C., Lodding P., Pileblad E., Hugosson J.: Single-dose
orally administered quinolone appears to be sufficient antibiotic prophylaxis
for radical retropubic prostatectomy. Scand J Urol Nephrol. 2004,
38 (2), 143–147. PMID: 15204401. DOI: 10.1080/00365590310022590.
Studer U.E., Danuser H., Merz V.W., Springer J.P., Zingg E.J.: Experience in
100 patients with an ileal low pressure bladder substitute combined with
an afferent tubular isoperistaltic segment. J Urol. 1995, 154 (1), 49–56.
PMID: 7776455.
Stutley J.E., Gordon I.: Vesico-ureteric reflux in the damaged non-scarred
kidney. Pediatr Nephrol. 1992, 6 (1), 25–29. PMID: 1311185.
Sunden F., Håkansson L., Ljunggren E., Wullt B.: Escherichia coli 83972 bacteriuria
protects against recurrent lower urinary tract infections in patients
with incomplete bladder emptying. J Urol. 2010, 184 (1), 179–185. PMID:
20483149. DOI: 10.1016/j.juro.2010.03.024.
Swartz M.A., Morgan T.M., Krieger J.N.: Complications of scrotal surgery for
benign conditions. Urology. 2007, 69 (4), 616–619. PMID: 17445635. DOI:
10.1016/j.urology.2007.01.004.
Swartz S.L., Kraus S.J., Herrmann K.L., Stargel M.D., Brown W.J., Allen S.D.:
Diagnosis and etiology of nongonococcal urethritis. J Infect Dis. 1978, 138
(4), 445–454. PMID: 213495.
Takeyama K., Matsukawa M., Kunishima Y., Takahashi S., Hotta H., Nishiyama
N. i wsp.: Incidence of and risk factors for surgical site infection in patients
with radical cystectomy with urinary diversion. J Infect Chemother. 2005,
11 (4), 177–181. PMID: 16133708. DOI: 10.1007/s10156-005-0391-1.
Takeyama K., Takahashi S., Maeda T., Mutoh M., Kunishima Y., Matsukawa M.
i wsp.: Comparison of 1-day, 2-day, and 3-day administration of antimicrobial
prophylaxis in radical prostatectomy. J Infect Chemother. 2007, 13 (5),
320–323. PMID: 17982721. DOI: 10.1007/s10156-007-0540-9.
Talan D.A., Stamm W.E., Hooton T.M., Moran G.J., Burke T., Iravani A. i wsp.:
Comparison of ciprofloxacin (7 days) and trimethoprim-sulfamethoxazole
(14 days) for acute uncomplicated pyelonephritis pyelonephritis in women:
a randomized trial. JAMA. 2000, 283 (12), 1583–1590. PMID: 10735395.
Tambyah P., Olyszyna D.P., Tenke P., Koves B.: Urinary catheters and drainage
systems: definition, epidemiology and risk factors. W: Urogenital Infections.
Red. K.G. Naber, A.J. Scaeffer, C.F. Heyns, T. Matsumoto, D.A. Shoskes,
T.E. Bjerklund Johansen. European Association of Urology, Arnhem 2010,
523–531. http://www.icud.info/urogenitalinfections.html.
Taylor A.K., Zembower T.R., Nadler R.B., Scheetz M.H., Cashy J.P., Bowen D.
i wsp.: Targeted antimicrobial prophylaxis using rectal swab cultures in
men undergoing transrectal ultrasound guided prostate biopsy is associated
with reduced incidence of postoperative infectious complications and
cost of care. J Urol. 2012, 187 (4), 1275–1279. PMID: 22341272. DOI:
10.1016/j.juro.2011.11.115.
Tencer J.: Asymptomatic bacteriuria – a long-term study. Scand J Urol
Nephrol. 1988, 22 (1), 31–34. PMID: 3387908.
Tenke P., Kovacs B., Bjerklund Johansen T.E., Matsumoto T., Tambyah P.A., Naber
K.G.: European and Asian guidelines on management and prevention of catheter-
associated urinary tract infections. Int J Antimicrob Agents. 2008, 31
Suppl. 1, S68–78. PMID: 18006279. DOI: 10.1016/j.ijantimicag.2007.07.033.
Terai A., Ichioka K., Kohei N., Ueda N., Utsunomiya N., Inoue K.: Antibiotic
prophylaxis in radical prostatectomy: 1-day versus 4-day treatments.
Int J Urol. 2006, 13 (12), 1488–1493. PMID: 17118023. DOI:
10.1111/j.1442-2042.2006.01597.x.
To T., Agha M., Dick P.T., Feldman W.: Cohort study on circumcision of newborn
boys and subsequent risk of urinary-tract infection. Lancet. 1998, 352
(9143), 1813–1816. PMID: 9851381. DOI: 10.1016/S0140-6736 (98)02392-7.
Tolkoff-Rubin N.E., Rubin R.H.: Urinary tract infection in the immunocompromised
host. Lessons from kidney transplantation and the
AIDS epidemic. Infect Dis Clin North Am. 1997, 11 (3), 707–717.
PMID: 9378931.
Tran D., Muchant D.G., Aronoff S.C.: Short-course versus conventional length
antimicrobial therapy for uncomplicated lower urinary tract infections in
children: a meta-analysis of 1279 patients. J Pediatr. 2001, 139 (1), 93–99.
PMID: 11445800. DOI: 10.1067/mpd.2001.114698.
Trautner B.W.: Asymptomatic bacteriuria: when the treatment is worse
than the disease. Nat Rev Urol. 2011, 9 (2), 85–93. PMID: 22143416. DOI:
10.1038/nrurol.2011.192.
Tsugawa M., Monden K., Nasu Y., Kumon H., Ohmori H.: Prospective randomized
comparative study of antibiotic prophylaxis in urethrocystoscopy
and urethrocystography. Int J Urol. 1998, 5 (5), 441–443. PMID: 9781431.
Tukenmez Tigen E., Tandogdu Z., Ergonul O., Altinkanat G., Gunaydin B., Ozgen
M. i wsp.: Outcomes of fecal carriage of extended-spectrum beta-lactamase
after transrectal ultrasound-guided biopsy of the prostate. Urology. 2014,
84 (5), 1008–1015. PMID: 25239255.
DOI: 10.1016/j.urology.2014.04.060.
Turan H., Serefhanoglu K., Torun A.N., Kulaksizoglu S., Kulaksizoglu M., Pamuk
B. i wsp.: Frequency, risk factors, and responsible pathogenic microorganisms
of asymptomatic bacteriuria in patients with type 2 diabetes mellitus.
Jpn J Infect Dis. 2008, 61 (3), 236–238. PMID: 18503181.
Ulleryd P.: Febrile urinary tract infection in men. Int J Antimicrob Agents.
2003, 22 Suppl 2, 89–93. PMID: 14527778.
Ulleryd P., Sandberg T.: Ciprofloxacin for 2 or 4 weeks in the treatment of
febrile urinary tract infection in men: a randomized trial with a 1 year follow-
up. Scand J Infect Dis. 2003, 35 (1), 34–39. PMID: 12685882.
UVI – nedre urinvägsinfektioner hos kvinnor.UTI – lower urinary tract
infections in females. The Medical Products Agency. 2007, 18 (2).
van den Berghe G., Wouters P., Weekers F., Verwaest C., Bruyninckx F., Schetz M.
i wsp.: Intensive insulin therapy in critically ill patients. N Engl J Med. 2001,
345 (19), 1359–1367. PMID: 11794168.
DOI: 10.1056/NEJMoa011300.
van Dooyeweert D.A.,·Schneider M.M.E., Borleffs J.C.C., Hoepelman A.I.M.:
Bacteriuria in male patients infected with human immunodeficiency virus
type 1. W: Urinary tract infections. Red. T. Bergan. Karger, Basel 1997,
37–45. DOI:10.1159/000061395.
Vazquez J.C., Villar J.: Treatments for symptomatic urinary tract infections
during pregnancy. Cochrane Database Syst Rev. 2000, 3, CD002256. PMID:
10908537. DOI: 10.1002/14651858.CD002256.
Vela Navarrete R.: Urinary tract infections in children. W: Tratado de urología
tomo I. Red. J.F. Jiménez Cruz, L.A. Rioja. Ed Prous, Barcelona 1993, 499–507.
Vogel F., Bordmann K.F.: Recommendations for empiric parenteral initial
therapy of bacterial infections in adults. Chemother J. 2004, 13, 46–105.
Wagenlehner F.M., Bartoletti R., Cek M., Grabe M., Kahlmeter G., Pickard R. i wsp.:
Antibiotic stewardship: a call for action by the urologic community. Eur Urol.
2013a, 64 (3), 358–360.
PMID: 23746854. DOI: 10.1016/j.eururo.2013.05.044.
Wagenlehner F.M., Grabe M., Naber K.G, Bjerklund Johansen T.E., Naber C.K.,
Weidner W.: [Antibiotic prophylaxis in urology]. Urologe A. 2011a, 50 (11),
1469–1478. PMID: 21997660.
DOI: 10.1007/s00120-011-2661-0.
Wagenlehner F.M., Hoyme U., Kaase M., Fünfstück R., Naber K.G., Schmiemann
G.: Uncomplicated urinary tract infections. Dtsch Arztebl Int. 2011b, 108
(24), 415–423. PMID: 21776311.
PMCID: PMC3132618. DOI: 10.3238/
arztebl.2011.0415.
Wagenlehner F.M., Pilatz A., Waliszewski P., Weidner W., Johansen T.E.: Reducing
infection rates after prostate biopsy. Nat Rev Urol. 2014, 11 (2), 80–86.
PMID: 24418806. DOI: 10.1038/nrurol.2013.322.
Wagenlehner F.M., Vahlensieck W., Bauer H.W., Weidner W., Piechota H.J., Naber
K.G.: Prevention of recurrent urinary tract infections. Minerva Urol Nefrol.
2013b, 65 (1), 9–20. PMID: 23538307.
Wagenlehner F.M., van Oostrum E., Tenke P., Tandogdu Z., Çek M., Grabe M. i
wsp.: Infective complications after prostate biopsy: outcome of the Global
Prevalence Study of Infections in Urology (GPIU) 2010 and 2011, a prospective
multinational multicentre prostate biopsy study. Eur Urol. 2013c,
63 (3), 521–527. PMID: 22704727.
DOI: 10.1016/j.eururo.2012.06.003.
Wagenlehner F.M., Wagenlehner C., Schinzel S., Naber K.G.: Prospective, randomized,
multicentric, open, comparative study on the efficacy of a prophylactic
single dose of 500 mg levofloxacin versus 1920 mg trimethoprim/sulfamethoxazole
versus a control group in patients undergoing TUR of the prostate. Eur Urol.
2005, 47 (4), 549–556. PMID: 15774257.
DOI: 10.1016/j.eururo.2005.01.004.
Wan J., Kaplinsky R., Greenfield S.: Toilet habits of children evaluated for urinary
tract infection. J Urol. 1995, 154 (2 Pt 2), 797–799. PMID: 7609183.
Warren J.W., Abrutyn E., Hebel J.R., Johnson J.R., Schaeffer A.J., Stamm W.E.:
Guidelines for antimicrobial treatment of uncomplicated acute bacterial
cystitis and acute pyelonephritis in women. Infectious Diseases Society of
America (IDSA). Clin Infect Dis. 1999, 29 (4), 745–758. PMID: 10589881.
DOI: 10.1086/520427.
Warren J.W., Anthony W.C., Hoopes J.M., Muncie H.L. Jr.: Cephalexin for susceptible
bacteriuria in afebrile, long-term catheterized patients. JAMA.
1982a, 248 (4), 454–458. PMID: 7045440.
Warren J.W., Tenney J.H., Hoopes J.M., Muncie H.L., Anthony W.C.: A prospective
microbiologic study of bacteriuria in patients with chronic indwelling
urethral catheters. J Infect Dis. 1982b, 146 (6), 719–723. PMID: 6815281.
Watson A.R.: Pediatric Urinary Tract Infection. EAU Update Series. 2004,
2 (3), 94–100.
Webb N.R., Woo H.H.: Antibiotic prophylaxis for prostate biopsy. BJU Int.
2002, 89 (8), 824–828. PMID: 11972504.
Weidner W., Schiefer H.G., Garbe C.: Acute nongonococcal epididymitis.
Aetiological and therapeutic aspects. Drugs. 1987, 34 Suppl 1, 111–117.
PMID: 3481311.
Weidner W., Schiefer H.G., Krauss H., Jantos C., Friedrich H.J., Altmannsberger M.:
Chronic prostatitis: a thorough search for etiologically involved microorganisms
in 1,461 patients. Infection. 1991, 19 Suppl 3, 119–1125. PMID: 2055646.
Wells W.G., Woods G.L., Jiang Q., Gesser R.M.: Treatment of complicated urinary
tract infection in adults: combined analysis of two randomized, doubleblind,
multicentre trials comparing ertapenem and ceftriaxone followed
by appropriate oral therapy. J Antimicrob Chemother. 2004, 53 Suppl 2,
67–74. PMID: 15150185.
DOI: 10.1093/jac/dkh208.
Westwood M.E., Whiting P.F., Cooper J., Watt I.S., Kleijnen J.: Further investigation
of confirmed urinary tract infection (UTI) in children under five
years: a systematic review. BMC Pediatr. 2005, 5 (1), 2. PMID: 15769296.
PMCID: PMC1079875. DOI: 10.1186/1471-2431-5-2.
Wetmore C.M., Manhart L.E., Lowens M.S., Golden M.R., Whittington W.L.,
Xet-Mull A.M.: Demographic, behavioral, and clinical characteristics of
men with nongonococcal urethritis differ by etiology: a case-comparison
study. Sex Transm Dis. 2011, 38 (3), 180–186. MID: 21285914. PMCID:
PMC4024216. DOI: 10.1097/OLQ.0b013e3182040de9.
Wettergren B., Jodal U.: Spontaneous clearance of asymptomatic bacteriuria
in infants. Acta Paediatr Scand. 1990, 79 (3), 300–304. PMID: 2333743.
Wilson L., Ryan J., Thelning C., Masters J., Tuckey J.: Is antibiotic prophylaxis
required for flexible cystoscopy? A truncated randomized double-blind controlled
trial. J Endourol. 2005, 19 (8), 1006–1008. PMID: 16253070. DOI:
10.1089/end.2005.19.1006.
Wing D.A., Hendershott C.M., Debuque L., Millar L.K.: A randomized trial of
three antibiotic regimens for the treatment of pyelonephritis in pregnancy.
Obstet Gynecol. 1998, 92 (2), 249–253. PMID: 9699761.
Workowski K.A., Berman S.: Sexually Transmitted Diseaseas Treatment
Guidelines, 2010. MMWR. 2010, 59 (RR-12). https://www.cdc.gov/std/
treatment/2010/default.htm.
Wullt B., Agace W., Mansson W.: Bladder, bowel and bugs – bacteriuria in
patients with intestinal urinary diversion. World J Urol. 2004, 22 (3), 186–
195. PMID: 15309491. DOI: 10.1007/s00345-004-0432-x.
Yamamoto S., Ishitoya S., Segawa T., Kamoto T., Okumura K., Ogawa O.: Antibiotic
prophylaxis for transrectal prostate biopsy: a prospective randomized study
of tosufloxacin versus levofloxacin. Int J Urol. 2008, 15 (7), 604–606. PMID:
18462354. DOI: 10.1111/j.1442-2042.2008.02056.x.
Yeung C.K., Godley M.L., Dhillon H.K., Gordon I., Duffy P.G., Ransley P.G.: The
characteristics of primary vesico-ureteric reflux in male and female infants
with pre-natal hydronephrosis. Br J Urol. 1997, 80 (2), 319–327. PMID:
9284209.
Yoon B.I., Kim S., Han D.S., Ha U.S., Lee S.J., Kim H.W. i wsp.: Acute bacterial
prostatitis: how to prevent and manage chronic infection? J Infect Chemother.
2012, 18 (4), 444–450. PMID: 22215226.
DOI: 10.1007/s10156-011-0350-y.
Yoshikawa T.T., Nicolle L.E., Norman D.C.: Management of complicated urinary
tract infection in older patients. J Am Geriatr Soc. 1996, 44 (10),
1235–1241. PMID: 8856005.
Zermann D.H., Ishigooka M., Doggweiler R., Schmidt R.A.: Neurourological
insights into the etiology of genitourinary pain in men. J Urol. 1999, 161
(3), 903–908. PMID: 10022711.
Zhanel G.G., Harding G.K., Nicolle L.E.: Asymptomatic bacteriuria in patients
with diabetes mellitus. Rev Infect Dis. 1991, 13 (1), 150–154. PMID: 2017615.
Zorc J.J., Kiddoo D.A., Shaw K.N.: Diagnosis and management of pediatric
urinary tract infections. Clin Microbiol Rev. 2005, 18 (2), 417–422. PMID:
15831830. PMCID: PMC1082801. DOI: 10.1128/CMR.18.2.417-422.2005.
Justus‑LiebigMIĘDZYNARODOWY KONGRES ANDROLOGICZNY Kopenhaga 06.05–09.05.2017, http://www.ica2017.dk/
INTERNATIONAL CONGRESS OF ANDROLOGY
Copenhagen 06.05–09.05.2017, http://www.ica2017.dk/
Sprawozdanie / Report
W dniach 6. maja do 9. maja 2017 r. w Kopenhadze odbył się
11. Międzynarodowy Kongres Andrologiczny. Przewodniczącym
Komitetu Organizacyjnego był dr Niels Jörgensen
(Department of Growth and Reproduction, Rigshospitalet,
Copenhagen), Prezes Duńskiego Towarzystwa Andrologicznego.
W Konferencji uczestniczyło ok. 300 osób z całego świata,
w tym z Polski 16.
Konferencję poprzedziły dwa niezwykle interesujące
kursy: 1) Niepłodność męska: aspekty podstawowe
i kliniczne, oraz 2) Czynniki środowiskowe zaburzające
gospodarkę hormonalną a zdrowie reprodukcyjne mężczyzn.
Tematyka konferencji dotyczyła różnych aspektów
zdrowia mężczyzny: problemów związanych z męską
płodnością, hipogonadyzmem i zaburzeniami seksualnymi.
Niezwykle ciekawe były wykłady poświęcone
najnowszym wynikom badań podstawowych m.in. wskazujące
na rolę najądrzy i plazmy nasienia w ochronie
immunologicznej plemników, zapłodnieniu komórki
jajowej i rozwoju zarodka, a także pokazujące możliwości
wyhodowania plemników in vitro. Jednym z wykładowców
była dr hab. n. med. Monika Frączek z Zakładu
Biologii Rozrodu i Komórek Macierzystych Instytutu
Genetyki Człowieka Polskiej Akademii Nauk w Poznaniu,
której praca pt. „The role of subcellular sperm structures in
determining the fertilizing potential of male gametes” została
wyróżniona prezentacją ustną.
Podczas Konferencji odbyły się wybory nowego
Zarządu Międzynarodowego Towarzystwa Andrologicznego
(ISA, ang. International Society of Andrology).
Przewodniczącym został prof. Andreas Meinchardt
(Department of Anatomy and Cell Biology Justus‑LiebigMIĘDZYNARODOWY
University, Giessen), a w składzie Zarządu znaleźli
się także prof. Peter Y. Liu (Division of Endocrinology,
Department of Internal Medicine David Geffen School of
Medicine at UCLA, Harbor UCLA Medical Center and Los
Angeles BioMedical Research Institute) i prof. Andrea M.
Isidori (Department of Experimental Medicine, Sapienza
University, Rome).Kolejny 12.

Międzynarodowy Kongres Andrologiczny
odbędzie się w 2020 r. w Münster w Niemczech, a przewodniczącym
Komitetu Organizacyjnego będzie prof.
Stefan Schlatt (Department of Reproductive Medicine and
Andrology Uniwersytetu, Münster).
Jolanta Słowikowska‑Hilczer
INSTRUKCJE DLA AUTORÓW
INSTRUCTIONS FOR AUTHORS
Informacje ogólne
Czasopismo „Postępy Andrologii Online” jest periodykiem
ukazującym się co 6 miesięcy (półrocznik) w wersji elektronicznej.
Czasopismo publikuje prace z zakresu fizjologii
i patologii męskiego układu płciowego. Tematyka
obejmuje zarówno zagadnienia kliniczne (etiopatogeneza,
diagnostyka i terapia zaburzeń), jak i wyniki
badań doświadczalnych. Czasopismo przyjmuje prace
oryginalne, poglądowe oraz kazuistyczne. Ponadto będą
zamieszczane listy do Redakcji, streszczenia i tłumaczenia
publikacji anglojęzycznych, informacje o działalności
Polskiego Towarzystwa Andrologicznego,
komunikaty informujące o konferencjach naukowych
oraz sprawozdania i streszczenia prezentacji z kongresów
i konferencji naukowych w Polsce i zagranicą.
Zasady recenzowania prac
Nadsyłane manuskrypty wstępnie ocenia Komitet
Redakcyjny czasopisma. Manuskrypty niekompletne
lub przygotowane w stylu niezgodnym z zasadami
podanymi poniżej Redakcja odsyła Autorom bez oceny
merytorycznej. Pozostałe artykuły zostają zarejestrowane
i są następnie przekazywane do oceny dwóm niezależnym
recenzentom, z zachowaniem anonimowości
autorów pracy i recenzentów. Przyjęcie pracy odbywa
się na podstawie pozytywnych opinii obydwóch recenzentów.
W przypadku rozbieżnych opinii Redakcja prosi
o opinię trzeciego recenzenta. Autorzy zobowiązani
są odnieść się do uwag recenzentów w ciągu 3 tygodni
od daty otrzymania recenzji. Wszelka korespondencja
z Autorami odbywa się drogą e‑mailową.
Konflikt interesów
W pracy powinny być ujawnione wszelkie zobowiązania
finansowe między Autorami i firmą, której produkt ma
istotne znaczenie w nadesłanej pracy. Informacje te nie
będą ujawniane recenzentom i nie wpłyną na decyzję
o opublikowaniu pracy. Po akceptacji manuskryptu
informacje o źródłach finansowania powinny być umieszczone
w stopce na pierwszej stronie manuskryptu.
Informacje o prawach autorskich
Autor/autorzy przesyłając manuskrypt wraz z ilustracjami
i tabelami, automatycznie i nieodpłatnie przenosi/
przenoszą na „Postępy Andrologii Online” i Polskie
Towarzystwo Andrologiczne wszelkie prawa autorskie
do wydawania oraz rozpowszechniania nadesłanych
materiałów we wszystkich znanych formach i na wszystkich
znanych polach eksploatacji, bez ograniczeń terytorialnych
i językowych, pod warunkiem, że materiały
te zostaną zaakceptowane do publikacji. Publikacja
w całości ani żadna z jej części nie może być powielana,
ani upowszechniana w jakikolwiek mechaniczny lub
elektroniczny sposób bez pisemnej zgody Redaktora
Naczelnego.
Ochrona danych osobowych
Nazwiska i adresy e‑mail
wprowadzane do serwisu czasopisma
„Postępy Andrologii Online” będą wykorzystywane
wyłącznie do celów publikacji ich prac i nie będą
udostępniane do żadnych innych celów.
Sposób przygotowania manuskryptu
Nadsyłane prace mogą być pisane w języku polskim
lub angielskim.
Wszystkie prace odnoszące się do badań na ludziach
lub zwierzętach muszą być zaakceptowane przez odpowiednią
Komisję Etyczną. Informacja o zgodzie właściwej
Komisji Etycznej na przeprowadzenie badania i świadomej
zgodzie pacjentów na udział w badaniu powinna
znaleźć się w rozdziale „Materiał i metody” w każdej
pracy. Autorzy opisów przypadków są zobowiązani
do nieujawniania personaliów opisywanych pacjentów,
a w przypadku fotografii umożliwiających identyfikację
pacjenta zawsze należy uzyskać pisemną zgodę pacjenta
na publikację jego wizerunku.
Liczbowe wartości i symbole wszystkich wielkości
winny być podane wg międzynarodowego układu jednostek
SI.
W manuskrypcie należy używać 12‑punktowego
fontu
Times New Roman, z zachowaniem 1,5‑punktowego
odstępu między wierszami i marginesami 2,5 cm
z każdej strony. Strony należy numerować kolejno,
zaczynając od tytułowej. Numery stron należy umieszczać
w dolnym, prawym rogu każdej strony. Należy
zachować następujący układ: strona tytułowa (osobna
strona), stosowane skróty (osobna strona), streszczenie
i słowa kluczowe (do 5) w języku polskim i angielskim
(osobna strona), tekst podstawowy, piśmiennictwo,
podpisy rycin i tabel, materiał ilustracyjny.
Strona tytułowa powinna zawierać: stopień
naukowy, imię i nazwisko autora (autorów) wraz z afiliacją,
adres e‑mail,
kontaktowy numer telefonu każdego
autora (należy podkreślić nazwisko autora do korespondencji),
tytuł artykułu i skróconą wersję tytułu (w języku
polskim i angielskim) (40 znaków ze spacjami).
Spis skrótów należy podać w języku polskim
i angielskim w jednym akapicie, według kolejności alfabetycznej
np.:
hESC – ludzkie embrionalne komórki macierzyste
(ang. human embryonic stem cells); RFT – reaktywne
formy tlenu (ang. reactive oxygen species); RT‑PCR
–
łańcuchowa reakcja polimerazy z wykorzystaniem
odwrotnej transkryptazy (ang. reverse transcription
polymerase chain reaction); itd.
Skróty użyte w tekście podstawowym po raz pierwszy
należy podać w pełnym brzmieniu. Nie należy rozpoczynać
zdania od skrótu.
Streszczenie powinno zawierać najistotniejsze
informacje wprowadzające czytelnika w publikowaną
tematykę oraz wnioski końcowe (do 250 wyrazów). Nie
należy używać skrótów.
Tekst podstawowy
Artykuł poglądowy powinien zawierać przegląd informacji
z danej tematyki. Zaleca się uwzględnienie prac
publikowanych w ostatnich 5–10 latach (ok. 60%) oraz
w latach wcześniejszych (ok. 40%). Dopuszczalna liczba
pozycji piśmiennictwa to 70. W manuskrypcie autorzy
powinni zawrzeć własne przemyślenia, opinie i wnioski,
a istotne informacje przedstawić w postaci schematów,
tabel i rycin. Ponadto, artykuł mogą wzbogacić wyniki
badań autorskich. Liczba stron manuskryptu łącznie
z tabelami i rycinami nie powinna być większa niż 20.
Artykuł oryginalny powinien zawierać opis własnych
badań klinicznych lub doświadczalnych Autorów.
Powinien składać się z takich podrozdziałów jak: Wstęp,
Materiał i Metody, Wyniki, Dyskusja, Podsumowanie.
Dopuszczalna liczba pozycji piśmiennictwa to 70. Liczba
stron manuskryptu łącznie z tabelami i rycinami nie
powinna być większa niż 20.
Praca kazuistyczna to krótka forma publikacji prezentująca
ciekawe przypadki kliniczne i ich omówienie
oparte na własnych doświadczeniach praktyka klinicysty
i doświadczeniach innych autorów. Streszczenie
nie powinno przekraczać 150 wyrazów, Wstęp powinien
zawierać nie więcej niż dwa krótkie akapity, Materiał
i Metody nie powinny być podzielone na podrozdziały,
a Wyniki, Dyskusja i Podsumowanie powinny stanowić
jeden rozdział. Liczba rycin i tabel ograniczona do 2–3,
piśmiennictwa do 10. Liczba stron manuskryptu nie
powinna być większa niż 10.
Komunikat to krótka praca oryginalna zawierająca
wstępne, ale istotne wyniki badań. W tego typu publikacjach
streszczenie nie powinno przekraczać 150 wyrazów,
Wstęp powinien zawierać nie więcej niż dwa krótkie
akapity, Materiał i Metody nie powinny być podzielone
na podrozdziały, a Wyniki, Dyskusja i Podsumowanie
powinny stanowić jeden rozdział. Liczba rycin i tabel
ograniczona do 2–3, piśmiennictwa do 10. Liczba stron
manuskryptu nie powinna być większa niż 10.
Artykuł będący tłumaczeniem publikacji z języka
angielskiego powinien dotyczyć najnowszych i istotnych
pozycji piśmiennictwa anglojęzycznego. Należy dołączyć
zgodę redaktora naczelnego czasopisma, w którym
artykuł został opublikowany i autora na tłumaczenie
artykułu. Streszczenie artykułu powinno zawierać treść
istotną do przekazania dla czytelników polskich (do 250
wyrazów).
List do Redakcji jest formą wyrażenia swojej opinii,
a jednocześnie głosem w dyskusji na temat współczesnych
zjawisk w świecie medycyny i nauki. Dopuszczalna liczba
stron manuskryptu nie większa niż 3.
Piśmiennictwo należy podać w kolejności alfabetycznej,
nie wprowadzając kolejnych numerów. Każdą
pozycję piśmiennictwa należy zapisywać od nowej
linii. Należy podać nazwisko autora (autorów) pisane
kursywą z inicjałami imion, po których stawiana jest
kropka. Jeśli jest do sześciu autorów, należy przytoczyć
wszystkich. Powyżej tej liczby należy podać pierwszych
sześciu autorów z dopiskiem i wsp. Tytuły periodyków
powinny być skracane zgodnie ze sposobem przyjętym
w Index Medicus (Medline).
Oto przykłady, jak należy cytować książkę: 1)
w całości, 2) fragment konkretnego rozdziału wraz
z podaniem numerów stron, 3) oryginalną pracę naukową,
4) oryginalną pracę naukową w czasopiśmie elektronicznymi
(data przeglądania i adres URL) i 5) stronę internetową
(nazwa strony – materiału źródłowego, adres
URL i datę wejścia na stronę):
1. Semczuk M., Kurpisz M. (red.): Andrologia. Wyd.
Lek. PZWL, Warszawa 2006.
2. Woźniak W., Bruska M., Kromer P.: Pęcherzyki nasienne,
gruczoł krokowy i gruczoły cewkowo‑opuszkowe.
W: Andrologia. Red. M. Semczuk, M. Kurpisz.
Wyd. Lek. PZWL, Warszawa 2006, 94–89.
3. Kobori Y., Suzuki K., Iwahata T., Shin T., Sadaoka Y.,
Sato R. i wsp.: Improvement of seminal quality and
sexual function of men with oligoasthenoteratozoospermia
syndrome following supplementation
with L-arginine and Pycnogenol®. Arch Ital
Urol Androl. 2015, 87, 190–193. doi: 10.4081/
aiua.2015.3.190. PMID: 26428638
4. Walczak-Jędrzejowska R.: Stres oksydacyjny a niepłodność
męska. Część I: czynniki wywołujące
stres oksydacyjny w nasieniu / Oxidative stress
and male infertility. Part I: factors causing oxidative
stress in semen. Postępy Androl Online. 2015,
2, 5–15. [przeglądany: 07.10.2015 r.]. Dostępny
w: http://www.postepyandrologii.pl
5. Wiley Online Library http://onlinelibrary.wiley.
com/enhanced/doi/10.1111/andr.12051/, data
wejścia 07.10.2015 r.
Cytowane w tekście piśmiennictwo należy podać alfabetycznie
w okrągłych nawiasach, wymieniając pierwszego
autora i podając rok publikacji, np. (Bungum
i wsp., 2011; Cheng i wsp., 2011).
Nazwiska autorów prac wprowadzone w tekście
powinny być napisane kursywą, np.
„Według Bungum i wsp. (2011) należy wprowadzić
określony algorytm leczenia niepłodności męskiej
w zależności od standardowych parametrów seminologicznych
i wyników otrzymanych na podstawie testu
z wykorzystaniem oranżu akrydyny ujawniającego zaburzenia
kondensacji chromatyny plemników (SCSA)…”
Materiał ilustracyjny obejmuje ryciny (wykresy,
diagramy, zdjęcia, schematy) oraz tabele opatrzone tytułami
i podpisami. W przypadku rycin zarówno tytuł, jak
i opis powinny być umieszczone pod rycinami, a w przypadku
tabel nad tabelami. Tytuł tabeli należy wytłuścić.
Podpisy rycin i tabel oraz ich tytuły, a także informacje
wewnętrzne na rycinach i w tabelach należy podać
w języku polskim i angielskim (dotyczy prac w języku
polskim). Ryciny i tabele powinny być opatrzone numerami
zgodnie z kolejnością odniesień w tekście. Osobną
numerację posiadają ryciny i osobną tabele (numery arabskie).
Skrót Ryc. (pisany kursywą) wprowadzamy w podpisie
pod rycinami, natomiast w tytule tabeli nie stosujemy
skrótu Tab., lecz Tabela. Nie stosujemy w tekście
podstawowym skrótów ryc. lub tab., lecz rycina lub tabela.
Mikrofotografie mikroskopowe powinny posiadać
wewnętrzną skalę, a stosowane symbole, strzałki lub
litery muszą być wyraźnie uwidocznione na tle. Zdolność
rozdzielcza mikrofotografii nie powinna być mniejsza niż
300 dpi. Stosowane znaki do opisu danej ryciny powinny
być ujednolicone w całym artykule.
Stosowane oznaczenia i skróty na rycinach i w tabelach
powinny być wyjaśnione w opisie rycin i tabel, niezależnie
do ich rozwinięcia w tekście podstawowym.
Uwaga: pojedyncze ryciny bądź ryciny złożone z kilku
zdjęć, wykresów, diagramów lub schematów należy zintegrować
z wewnętrznymi oznaczeniami.
Rozmiary rycin i tabel: szerokość rycin i tabel
powinna wynosić 17,3 cm lub 8,3 cm, natomiast ich
długość nie powinna przekraczać 24,5 cm. Tekst będzie
składany dwułamowo, dlatego też szerokość rycin i tabel
nie może przekraczać szerokości jednego lub dwóch
łamów, z kolei długość może być dowolna, ale nie większa
niż długość łamu; wielkość powierzchni zadrukowanej
na stronie formatu A4 będzie wynosiła 24,7 cm/17,5 cm.
Przesyłanie prac do Redakcji
Prace należy przesłać elektronicznie na adres redaktora
naczelnego: mpiasecka@ipartner.com.pl
Tekst podstawowy, piśmiennictwo oraz podpisy
rycin i tabel powinny być umieszczone w jednym pliku
(Word), natomiast każda rycina (format CDR, TIF, JPG)
i tabele (Word) w osobnych plikach. Tytuł pliku zawierający
tekst manuskryptu powinien zawierać nazwisko
autora do korespondencji oraz pierwsze słowa tytułu
artykułu, natomiast tytuły plików zawierające ryciny
i tabele, obok nazwiska autora, powinny zawierać numery
rycin i tabel.
Do pracy należy dołączyć oświadczenie, że m.n. praca
nie została opublikowana lub skierowana do publikacji
w innym czasopiśmie, została zaaprobowana przez
wszystkich współautorów (wymagane są podpisy
wszystkich autorów) oraz zostały ujawnione wszelkie
źródła finansowania (oświadczenie dostępne na stronie
internetowej
http://www.postepyandrologii.pl).
Inne uwagi
Prace będą publikowane w kolejności otrzymywania,
jednak redakcja zastrzega sobie prawo zmian uzasadnionych
treścią drukowanego numeru. Ponadto zastrzega
sobie prawo wprowadzenia poprawek stylistycznych
i dotyczących mianownictwa oraz stosowanych skrótów
bez uzgodnienia z autorem.
General information
The journal “Advances in Andrology Online” is a periodical
appearing every 6 months (half-yearly) in the electronic
version. The journal publishes papers in the field
of physiology and pathology of the male reproductive
system. Topics include both clinical issues (pathogenesis,
diagnosis and treatment of disorders), as well as
the experimental results. The journal accepts original
papers, review articles and case reports. In addition there
will be published letters to the editor, abstracts, and
translations of English-language information about the
activities of the Polish Society of Andrology, announcements
about scientific conferences and reports and summaries
of presentations from congresses and conferences
in Poland and abroad.
Peer review process
Submitted manuscripts are initially examined by the
Editorial Committee of the journal. The manuscripts
that are incomplete or not prepared according to the
rules below will be sent back to authors without further
review. Other articles are registered and then sent to two
independent reviewers for evaluation, maintaining the
anonymity of authors and reviewers. The manuscript is
accepted for publication on the basis of positive opinions
of both reviewers. In case of disagreement, the Editorial
Board asks the third reviewer for an opinion. The authors
are obliged to refer to the reviewers’ comments within
three weeks of the receipt of the review. All correspondence
with the authors is carried out via e-mail.
Conflict of interest
Authors are obliged to disclose any financial arrangements
between authors and a company, whose product
has the significant impact on the submitted paper. This
information will not be shared with the reviewers and
will not affect the decision to publish the paper. After the
manuscript is accepted information about the sources
of financing should be placed in the footer on the first
page of the manuscript.
Copyright information
By submitting the manuscript electronically, along with
illustrations and tables, the Author/ authors confirm that
they automatically, free of charge, transfer to “Advances
in Andrology Online” and the Polish Society of Andrology
any copyright allowing publication and dissemination
of the submitted materials, in all available forms and
fields of exploitation, without territorial and language
restrictions, if the materials are accepted for publication.
Neither the manuscript as a whole, nor any part of it, will
be published or disseminated elsewhere in any mechanical
or electronic means without the written consent of
the Editor-in-Chief.
Privacy statement
The names and email addresses entered in the “Advances
in Andrology Online” service will be used exclusively for
publication purposes and will not be made available for
any other purpose.
Manuscript preparation
Submitted manuscripts may be written in Polish or
English. All manuscripts related to the research involving
human subjects or animal experimentation must be
approved by the relevant Ethics Committee. Information
about the consent of the relevant Ethics Committee to
conduct the research and a statement that all subjects
have given informed consent to participate in it, should
be included in the chapter “Materials and methods” in
every manuscript. The authors agree not to publish any
personal details of presented patients, and in case of
photographs enabling to identify the patient, there is
always a written consent of the patient needed for the
publication of his/her image.
Numerical values and symbols of all sizes should
be given by the international system of units SI.
The manuscript should use 12-point Times New
Roman font, while maintaining 1.5-point line spacing
and margins of 2.5 cm on each side. Pages should be
numbered consecutively, starting with the title. The page
numbers should be placed in the lower right corner of
each page. Keep the following layout: title page (separate
page), abbreviations (separate page), abstract and keywords
(up to 5) in Polish and English (separate page), body
text, references, captions, figures and tables, illustrations.
The title page should contain: a degree, the name of
the author (authors) and affiliation, email address, each
authors’ contact phone number (name of the author for
correspondence should be stressed), article title and an
abbreviated version of the title (in Polish and English)
(40 characters with spaces).
List of abbreviations should be given in Polish and
English in one paragraph, in alphabetical order, e.g.:
hESC – human embryonic stem cells; ROS – reactive
oxygen species; RT‑PCR – reverse transcription polymerase
chain reaction; etc. The abbreviations used in
the main file for the first time should be given in full.
Do not begin a sentence with an abbreviation.
The abstract should contain the most important
information introducing the reader to the published
topic and its conclusions (up to 250 words). Do not use
abbreviations
Main file
Review article should include an overview of the subject
published in the last 5–10 years (60%) and in the previous
years (40%). The permissible number of references
is 70. In the manuscript authors should conclude their
own thoughts, opinions and conclusions, and the relevant
information should be presented in the form of
diagrams, tables and figures. Moreover the article may
be enriched with the results of author’s own research.
Number of pages of the manuscript, including tables
and figures, should not be more than 20.
Original research papers should include a description
of authors’ own clinical or experimental studies.
It should consist of subsections such as: Introduction,
Material and Methods, Results, Discussion, Summary.
The permissible number of references is 70. The number
of pages of the manuscript, including tables and figures
should not be more than 20.
Case report is a short form of publication that presents
interesting clinical cases and discussion based on
clinician’s practice own experience and experience of
other authors. The abstract should not exceed 150 words,
Introduction should contain no more than two short paragraphs,
Material and Methods should not be divided into
sections, and Results, Discussion and Conclusion should
be in one chapter. The number of figures and tables should
be reduced to 2–3 and references to 10. The number of
pages of the manuscript should not be more than 10.
Communication article is a short original paper containing
preliminary but important results. In this type
of publications summary should not exceed 150 words,
Introduction should contain no more than two short
paragraphs, Material and Methods should not be divided
into sections, and Results, Discussion and Conclusion
should be in one chapter. The number of figures and
tables is reduced to 2–3, references to 10. The number
of pages of the manuscript should not be more than 10.
Article which is the translation of English language
publication should concern the most recent and
significant items in the English-speaking literature. It
should be accompanied by a consent of the editor-in-chief
of the journal in which the article was published and the
authors of the translation of the article. The summary
of the article should include content which is important
to provide for Polish readers (up to 250 words).
Letter to the Editor is a form of expressing one’s
opinion, which is at the same time a voice in the discussion
on contemporary phenomena in the world of
medicine and science. The permissible number of pages
of the manuscript is no more than 3.
References should be given in the alphabetical order,
not by entering the serial numbers. Each reference shall
be entered on a new line. Please provide the name of the
author (s) in italics with initials, after which there is the
dot. If there are up to six authors, please cite all. Above
this number the first six authors should be given with
a note et al. The titles of journals should be abbreviated
in accordance with the Index Medicus (Medline).
Here are examples of how to cite the book: 1) as a
whole, 2) a fragment of a specific chapter, together with
the page numbers, 3) the original scientific paper, 4) original
scientific paper in the electronic journal (data viewing
and URL) and 5) website (page name – the source material,
the URL and date of entry to the site):
1. Semczuk M., Kurpisz M. (ed.): Andrologia. Wyd.
Lek. PZWL, Warszawa 2006.
2. Woźniak W., Bruska M., Kromer P.: Pęcherzyki nasienne,
gruczoł krokowy i gruczoły cewkowo‑opuszkowe.
In: Andrologia. Ed. M. Semczuk, M. Kurpisz.
Wyd. Lek. PZWL, Warszawa 2006, 94–89.
3. Kobori Y., Suzuki K., Iwahata T., Shin T., Sadaoka Y.,
Sato R. et al.: Improvement of seminal quality and
sexual function of men with oligoasthenoteratozoospermia
syndrome following supplementation
with L-arginine and Pycnogenol®. Arch Ital
Urol Androl. 2015, 87, 190–193. doi: 10.4081/
aiua.2015.3.190. PMID: 26428638
4. Walczak-Jędrzejowska R.: Stres oksydacyjny a
niepłodność męska. Część I: czynniki wywołujące
stres oksydacyjny w nasieniu / Oxidative stress
and male infertility. Part I: factors causing oxidative
stress in semen. Postępy Androl Online. 2015,
2, 5–15. [viewed: 07.10.2015]. Available: http://
www.postepyandrologii.pl
5. Wiley Online Library http://onlinelibrary.wiley.
com/enhanced/doi/10.1111/andr.12051/, date of
entry: 07.10.2015
References quoted in the text should be given alphabetically
in parentheses, listing the first author and
giving the year of publication, for example. (Bungum
et al., 2011; Cheng et al., 2011). The names of the authors
of articles entered in the text should be written in italics,
for example. “According to Bungum et al. (2011) to enter
a specific algorithm for the treatment of male infertility,
depending on the standard seminological parameters and
the results obtained on the basis of a test using Acridine
Orange revealing abnormal chromatin condensation in
sperm (SCSA)…”
Illustrative material includes figures (graphs, diagrams,
pictures, outlines) and tables provided with the
titles and captions. In the case of figures both the title and
description should be placed under the drawings, in the
case of tables above the tables. The title of the table should
be bolded. Captions of figures and tables and their titles,
as well as inside information on figures and in tables
should be given in Polish and English (for work in Polish).
Figures and tables should be numbered consecutively
according to the order in which they are mentioned in
the text. Figures and tables should be provided separately
(Arabic numbers). Shortcut Fig. (in italics) is entered in the
caption under the figures, while the title of the table does
not use a shortcut Tab. but Table. We do not use in the
main text abbreviations fig. or tab., but the figure or table.
Photomicrographs should have internal microscopic
scale and used symbols, arrows, or letters must be clearly
visible against the background. Capability of photomicrographs
resolution should not be less than 300 dpi.
Characters used to describe the given figure should be
harmonized throughout the article.
Symbols and abbreviations used in figures and tables
should be explained in the description of figures and
tables, regardless of their development in the main text.
Note: the individual figures or figures made from several
images, charts, graphs or diagrams should be integrated
with internal markings.
Size of figures and tables: the width of figures and
tables should be 17.3 cm or 8.3 cm, and their lengthshould not exceed 24.5 cm. The text will be set in two
columns, and therefore the width of figures and tables
should not exceed the width of one or two columns, in
turn it can be of any length, but not more than the length
of the column; the size of the surface of the printed
page A4 will amount to 24.7 cm / 17.5 cm.
Sending the manuscript to the editorial
office
The manuscripts should be sent electronically to the
editor-in-chief’s email address:
mpiasecka@ipartner.com.pl
Main text, writings and signatures of figures and
tables should be placed in a single file (Word), and each
figure (CDR, TIF, JPG format) and tables (Word) in separate
files. The title of the file containing the text of the
manuscript should contain the name of the author for
correspondence, and the first words of the article’s title.
The titles of the files containing figures and tables, next
to the author’s name, should include the numbers of
figures and tables.
The manuscript must be accompanied by a statement
that among other things work has not been published or
directed for publication in another journal, it has been
approved by all co-authors (signatures of all the authors
are required), and that all funding sources have been
disclosed (statement available on the website:
http://www.postepyandrologii.pl).
Other comments
Papers will be published in the order they are received,
but the Editorial Board reserves the right to change the
content of the printed number. In addition, it reserves
the right to make stylistic corrections and those concerning
nomenclature and abbreviations used without
the consent of the author.
