Tom 4 • Numer 1 • Czerwiec 2017
Volumin 4 • Number 1 • June 2017

KOMITET REDAKCYJNY
Redaktor naczelny:
dr hab. n. med., prof. nadzw. PUM Małgorzata Piasecka, Szczecin
Zastępca redaktora naczelnego:
prof. dr hab. n. med. Jolanta Słowikowska-Hilczer, Łódź
Redaktor pomocniczy:
dr n. med. Kamil Gill, Szczecin
Sekretarz redakcji:
dr n. med. Agnieszka Kolasa-Wołosiuk, Szczecin
Skarbnik redakcji:
dr hab. n. med. Renata Walczak-Jędrzejowska, Łódź
Członkowie komitetu redakcyjnego:
dr n. med. Szymon Bakalczuk, Lublin
dr n. med. Leszek Bergier, Kraków
prof. dr hab. n. biol. Barbara Bilińska, Kraków
prof. dr hab. n. med. Barbara Darewicz, Białystok
Prof., MD, PhD Aleksander Giwercman, Malmö, Sweden
PhD Yvonne Lundberg Giwercman, Malmö, Sweden
Prof., PhD (UPE/NMMU) and PhD (US) Gerhard Van der Horst, Republika Południowej Afryki
(Bellville, Republic of South Africa)
prof. dr hab. n. med. Grzegorz Jakiel, Warszawa
prof. dr hab. n. med. Piotr Jędrzejczak, Poznań
dr hab. n. med., prof. UMK Roman Kotzbach, Bydgoszcz
prof. dr hab. n. med. Krzysztof Kula, Łódź
lek. med. Robert Kulik, Warszawa
prof. dr hab. n. med. Maria Laszczyńska, Szczecin
dr hab. n. med. Grzegorz Ludwikowski, Bydgoszcz
prof. dr hab. n. med. Marek Mędraś, Wrocław
MD, PhD, DMSc Ewa Rajpert-De Meyts, Kopenhaga, Dania (Copenhagen, Denmark
)
dr n. med. Aleksandra Robacha, Łódź
dr n. med. Maria Szarras-Czapnik, Warszawa
Adres redakcji:
Katedra i Zakład Histologii i Biologii Rozwoju
Wydział Nauk o Zdrowiu
Pomorski Uniwersytet Medyczny w Szczecinie
71-210 Szczecin ul. Żołnierska 48
tel. 91 48 00 917, 91 48 00 908
e-mail: mpiasecka@ipartner.com.pl
Projekt graficzny:
Agnieszka Hilczer
Waldemar Jachimczak
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Korekta języka polskiego:
Wojciech Markowski
Korekta języka angielskiego:
Małgorzata Piasecka
Jolanta Słowikowska-Hilczer
Kamil Gill
Skład i łamanie:
Waldemar Jachimczak
SPIS TREŚCI
O czasopiśmie / About Journal 4
Artykuły poglądowe / Review
Gerhard van der Horst, Stefan S du Plessis
Not just the marriage of Figaro: but the marriage of WHO/ESHRE semen analysis
criteria with sperm functionality .... 6
Agnieszka Cegłowska, Jolanta Słowikowska-Hilczer
Azoospermia – przyczyny, diagnostyka, leczenie
Azoospermia – causes, diagnostics, treatment .... 22
Rekomendacje medyczne
Medical recommendation – Jolanta Słowikowska-Hilczer .... 34
Komentarz do rekomendacji EAU dotyczących postępowania
w zakażeniach układu moczowego
Comment to the EAU guidelines on urological infections – Marcin Radko .... 35
Sprawozdanie i streszczenia wykładów z Konferencji
M. Grabe (przewodniczący), R. Bartoletti, T.E. Bjerklund Johansen, T. Cai, M. Çek,
B. Köves, K.G. Naber, R.S. Pickard, P. Tenke, F. Wagenlehner, B. Wullt
Rekomendacje dotyczące postępowania w zakażeniach układu moczowego
Guidelines on Urological Infections
Tłumaczenie i przygotowanie wersji polskiej
Translation and eblaboration of Polish version:
Marcin Radko, Katarzyna Marchlewska, Jolanta Słowikowska-Hilczer .... 36
Sprawozdanie z Międzynarodowego Kongresu Andrologicznego
Report form International Congress of Andrology – Jolanta Słowikowska-Hilczer .... 109
Instrukcje dla autorów / Instructions for authors .... 111
O CZASOPIŚMIE ABOUT THE JOURNAL
Wersja elektroniczna czasopisma jest wersją pierwotną. Informacje zawarte w czasopiśmie są udostępniane na zasadzie Open
Access – dostęp do informacji naukowej jest bezpłatny i nieograniczony.
The electronic version of the journal is a original version. Access to scientific information published in the journal is free and
unlimited (Open Access).
Zaburzenia męskiego układu płciowego dotyczą osób
w różnym wieku i w większości przypadków prowadzą
do niepłodności, która nabrała już rangi choroby cywilizacyjnej.
Najczęściej identyfikowanymi nieprawidłowościami
są hipogonadyzm, zaburzenia seksualne, wady
rozwojowe narządów płciowych, nowotwory jąder i prostaty.
Ze względu na specyficzne i coraz bardziej zanieczyszczone
środowisko antropogeniczne dotyczą one
głównie społeczeństw rozwiniętych, w tym również
Polski, i stanowią istotny oraz narastający problem
medyczny, społeczny, demograficzny, a także zdrowia
publicznego. Nauka, która zajmuje się fizjologią i zaburzeniami
męskiego układu płciowego w aspekcie nauk
podstawowych i klinicznych, to andrologia. Ponieważ
jest to młoda dziedzina nauki, jeszcze do niedawna niezadowalający
stan wiedzy ograniczał możliwości diagnostyki
oraz leczenia zaburzeń męskiego układu płciowego.
Jednak w ostatnich latach obserwuje się niezwykle dynamiczny
rozwój andrologii, szczególnie molekularnej, spowodowany
wprowadzeniem nowych metod badawczych
z zakresu biochemii, biologii i genetyki molekularnej.
Andrologia staje się dziedziną interdyscyplinarną integrującą
wiedzę z różnych dyscyplin medycznych i naukowych.
Informacje związane z tymi zagadnieniami z trudem
docierają do lekarzy i osób zainteresowanych w naszym
kraju, ponieważ jest niewiele literatury w języku polskim,
a wykłady wygłaszane podczas konferencji nie zawsze
wyczerpująco wyjaśniają wątpliwości dotyczące m.in.
postępowania diagnostycznego, terapeutycznego, rekomendacji
czy też proponowanych algorytmów. Stąd też
potrzeba stworzenia czasopisma prezentującego wiedzę
andrologiczną lekarzom różnych specjalności, diagnostom
laboratoryjnym i przedstawicielom nauk podstawowych.
Czasopismo „Postępy Andrologii Online” powstało
z inicjatywy Polskiego Towarzystwa Andrologicznego,
które zainteresowane jest integracją środowiska osób
zajmujących się różnymi aspektami męskiego układu
płciowego, uzupełnieniem i poszerzeniem ich wiedzy,
a także poprawą opieki zdrowotnej nad mężczyznami
w naszym kraju.
Celem czasopisma jest: 1) dostarczenie istotnych
informacji na temat fizjologii i patologii męskiego układu
płciowego, 2) propagowanie praktycznej wiedzy andrologicznej
kierowanej do szerokich kręgów odbiorców,
3) wymiana poglądów i opinii na temat zagadnień klinicznych
oraz wyników badań doświadczalnych oraz
4) przekazywanie informacji dotyczących konferencji
i kursów o tematyce andrologicznej.
Proponowana tematyka czasopisma to: 1) andrologia
kliniczna z uwzględnieniem etiopatogenezy, diagnostyki
i leczenia m.in. zaburzeń rozwojowych, niepłodności
i procesów starzenia mężczyzn, 2) nowatorskie
metody diagnostyczne, 3) andrologia doświadczalna
rozwijająca się w oparciu o nauki podstawowe oraz
4) inne interdyscyplinarne tematy związane z dziedziną
andrologii.
Czasopismo kierowane jest do lekarzy specjalności
bezpośrednio lub pośrednio związanych z andrologią,
m.in. urologów, endokrynologów, ginekologów, pediatrów,
ale także do lekarzy rodzinnych spotykających się
z coraz częstszym problemem niepłodności partnerskiej
i problemami starzejących się mężczyzn. Ponadto naszą
intencją jest zdobycie zainteresowania diagnostów laboratoryjnych
odgrywających istotną rolę w prawidłowym
postępowaniu terapeutycznym opartym na szerokim
panelu testów i badań, których wdrożenie wciąż wymaga
odpowiednich i wyczerpujących szkoleń z diagnostyki
andrologicznej, w tym seminologicznej. Mamy nadzieję,
że nasze czasopismo wzbudzi również zainteresowanie
biologów zajmujących się czynnością męskiego układu
płciowego w ramach nauk podstawowych, a także lekarzy
weterynarii oraz innych osób, które znajdą informacje
poszerzające ich wiedzę i kształtujące opinię z zakresu
szeroko pojętych nauk andrologicznych.
Zachęcamy Państwa do publikowania prac oryginalnych,
kazuistycznych i krótkich komunikatów, jak
również prac poglądowych, opracowanych w kondensacyjnej,
dydaktycznej i przystępnej formie. W pracach
tych autorzy powinni przedstawiać aktualny stan wiedzy
światowej oraz swoje opinie. Chcemy, aby czasopismo
spełniało rolę informatora i przewodnika w dziedzinie
andrologii oraz stanowiło forum dyskusyjne. Ponadto,
zapraszamy do publikowania artykułów będących
tłumaczeniem publikacji ukazujących się w języku angielskim,
które przedstawiają istotne postępy w andrologii.
http://www.postepyandrologii.pl
Małgorzata Piasecka
redaktor naczelny
Jolanta Słowikowska-Hilczer
przewodnicząca
Polskiego Towarzystwa Andrologicznego
ABOUT THE JOURNAL
Disorders of the male reproductive system relate to
people of different ages and in most cases lead to infertility,
which has already acquired a rank of a disease
associated with the progress of civilization. The most
frequently identified irregularities are hypogonadism,
sexual dysfunction, genital malformations, testicular or
prostate cancer. Due to the specific and increasingly polluted
anthropogenic environment they concern mainly
developed societies, including Poland, and are an important
and growing medical, social, demographic and public
health problem. A science that deals with the physiology
and with disorders of the male reproductive system in
terms of the basic and clinical science is andrology. As
this is a young field of science, until recently an unsatisfactory
state of knowledge limited the possibilities of the
diagnostics and treatment of the disorders of the male
reproductive system. However, in recent years there has
been a very dynamic development of andrology, especially
in the molecular aspect, due to the introduction
of new methods of research in the field of biochemistry,
biology and molecular genetics. Andrology is becoming an
interdisciplinary field which integrates knowledge from
various medical and scientific disciplines. Information
related to these issues reach doctors and interested people
in our country with difficulty, because there is few publications
in Polish. Lectures given during conferences also
do not always fully explain the doubts concerning diagnostic
and therapeutic proceedings, recommendations
or proposed algorithms. Hence, the need for a journal
presenting the knowledge of andrology to the doctors of
various specialties, laboratory diagnosticians and representatives
of the basic science. The journal „Progress in
Andrology Online” is an initiative of the Polish Society
of Andrology, which is interested in the integration of
people involved in different aspects of the male reproductive
system, supplement and broadening their knowledge,
as well as the improvement of health care for men
in our country.
The aim of the journal is: 1) to provide relevant
information about the physiology and pathology of the
male reproductive system, 2) the promotion of practical
andrological knowledge directed to broad audiences, 3) to
exchange views and opinions on issues of clinical and
experimental results, and 4) to provide information on
conferences and courses on the subject of andrology.
The proposed themes of the journal are: 1) clinical
andrology including etiopathogenesis, diagnostics and
treatment of developmental disorders, infertility and
men’s aging, 2) innovative diagnostic methods, 3) experimental
andrology developing on the basis of the basic
sciences and 4) other interdisciplinary topics related to
the field of andrology.
The journal is directed to physicians with specialty
directly or indirectly related to andrology, including
urologists, endocrinologists, gynecologists, pediatricians,
but also to family doctors facing the increasingly
common problem of couple infertility and problems of
aging men. Moreover, our intention is to get the interest
of laboratory diagnosticians playing an important role
in keeping the correct therapeutic proceedings, based
on a broad panel of tests and studies. Their implementation
still requires proper and comprehensive training in
andrological diagnostics, including seminological one.
We hope that our magazine will also raise the interest
of biologists dealing with the functions of the male reproductive
system in the framework of basic sciences, as
well as veterinarians and others who will find information
expanding their knowledge and shaping opinion in
the range of broad sciences of andrology. We encourage
you to publish original papers, case reports and short
announcements, as well as review papers, worked out in
the concentrated, didactic and accessible form. In these
articles authors should present the current state of the
global knowledge as well as their own opinions. We want
the journal to act as an informer and a guide in the field
of andrology and become a forum for discussion. In addition,
we invite you to publish articles that are translations
of publications appearing in the English language,
which present significant progress in andrology.
Małgorzata Piasecka
Editor in chief
Jolanta Słowikowska‑Hilczer
President
of Polish Society of Andrology
NOT JUST THE MARRIAGE OF FIGARO: BUT THE MARRIAGE OF WHO/ESHRE SEMEN ANALYSIS CRITERIA WITH SPERM FUNCTIONALITY
Gerhard van der Horst1,2, Stefan S du Plessis2
1Department of Medical Bioscience, University of the Western Cape, Belville, South Africa, 2Division of Medical Physiology,
Faculty of Medicine and Health Sciences, Stellenbosch University, Tygerberg, South Africa
Corresponding author: Gerhard van der Horst, Department of Medical Bioscience, University of the Western Cape, Belville,
South Africa; Tel: +27 21 959 2183 (gvdhorst7@gmail.com)
Received: 23.04.2017 r. Accepted: 21.06.2017 r.
Gerhard van der Horst – graduated from the University of Port Elizabeth/NMMU – PhD in
Zoology and University of Stellenbosch – PhD in Human and Animal Physiology in South Africa.
Founder member of the “Andrology Workshop” and later the Reproductive Biology Society of
South Africa. Gerhard van der Horst served two terms as the President of the Physiology Society
of South Africa. The author is currently an Emeritus Professor of Physiology at the University of
the Western Cape, an Extra-Ordinary Professor of Physiology, Division of Medical Physiology,
University of Stellenbosch. He is a research associate at the National Zoological Gardens in
Pretoria and Senior consultant to Microptic SL, Spain, involved in new developments in Computer-Aided Sperm
Analysis (CASA). The Professor is a National Research Foundation (NRF)-rated scientist and published more than
100 research articles and 250 conference presentations. His main research interest is comparative spermatology,
CASA (from invertebrates to vertebrates including primates) and sperm competition.
Stefan S du Plessis – MSc, PhD, MBA graduated from Stellenbosch University in South Africa,
where he is the Professor and Head of the Division of Medical Physiology at the Faculty of
Medicine and Health Sciences (SU). He is responsible for undergraduate teaching and postgraduate
training. Under his leadership the Stellenbosch University Reproductive Research Group (SURRG)
was founded and he has supervised numerous postgraduate students. As an National Research
Foundation (NRF)-rated scientist he has published more than 75 articles, 30 book chapters and
4 books. Currently he serves on the executive committee of the Physiology Society of Southern
Africa (PSSA) and the editorial board of BioMed Central (BMC) Urology, while he is also a former recipient of
a Fulbright Fellowship. His research interest is specifically related to the impact of non-communicable diseases
as well as lifestyle factors on sperm physiology.
Abstract
The authors present a critical review of the WHO5 (2010) manual of semen analysis and what it should be used for: The analysis of
sperm quality and not analysis to predict fertility outcome per se. We show the strengths and shortcoming of WHO5 and then ask for
a better “marriage” among these parameters and the outcome of sperm functionality and fertilization/live birth outcome. For many
decades the basis of the WHO manual for semen analysis has not changed and we emphasize that sperm functionality testing has not
really been considered/performed in the routine andrology laboratory. There is a need to first develop more objective and quantitative methodology such as computer-aided sperm analysis, to analyse sperm quality and sperm functionality that relates in many instances
to fertilization/live birth outcome: 1) sperm cervical mucous penetration using computer aided sperm analysis (CASA), 2) endpoint
of capacitation, hyperactivation as measured accurately by CASA, 3) acrosome reaction quantitatively, 4) chromatin maturity and
DNA fragmentation quantitatively, 4) where possible oocyte binding tests (hemizona), 5) relationships of vitality and hypo-osmotic
swelling test using modern technology 6) measurement of oxidative stress, 7) analysis of semen using proteomics (proteins that are
importantly functionally expressed in seminal plasma) as well as 8) metabolomics representing a systematic study of the unique
metabolic fingerprints (chemical) that specific cellular processes leave behind and inform us about function/dysfunction, 9) patient
profile (obesity, smoking, age, stress, female cryptic choice, environment and many other patient characteristics) as important determinants
in fertility outcome. We believe we can intelligently in the end construct a matrix which combine all these factors and others
in the future that inform us about potential fertility outcome. But then realize WHO5/ESHRE current guidelines are not particularly
informative in the above context.
Key words: semen, sperm, WHO5, sperm functionality
Abbreviations
AB – aniline blue staining, ALH – amplitude of lateral head displacement, AO – acridine orange test, AR – acrosome reaction, ART – assisted
reproductive techniques, CASA – computer-aided sperm analysis, CE-MS – capillary electrophoresis-mass spectrometry, CMA3 – chromomycin
A3, DAF-2DA – 4,5-diaminofluorescein diacetate, DCF – 2,7-dichlorofluorescein, DHE – dihydroethidium, ESHRE – European
Society of Human Reproduction and Embryology, FISH – fluorescent in situ hybridization, GC-MS – gas chromatography coupled to
mass spectrometry, HA –hyperactivation, Ha – hyaluronic acid, HBA – hyaluronan binding assay, HOS test – hypo-osmotic swelling
test, HPLC – high-performance liquid chromatography, HspA2 – heat shock protein A2, HZA – hemizona assay, HZI – hemizona index,
ICSI – intracytoplasmic sperm injection, IUI – intrauterine insemination, IVF – in vitro fertilization, LIN – linearity, MAI – multiple anamolies
index, MS – mass spectrometry, NMR – nuclear magnetic resonance, ORP – oxidation reduction potential, ROS – reactive oxygen
species, SCD/Halo – sperm chromatin dispersion test, SCA – Sperm Class Analyzer, SCMPT – sperm cervical mucous penetration test,
SCSA – sperm chromatin structure assay, SDF – sperm DNA fragmentation, STR – straightness, PCR – polymerase chain reaction, PNA –
Arachis hypogaea agglutinin, PSA – Pisum sativum agglutinin, QPCR – quantitative PCR, TAC – total antioxidant capacity, TB – toluidine
blue, TUNEL – terminal deoxynucleotidyl transferase-mediated dUTP nick end labelling, TZI – teratozoospermic index, WHO – World
Health Organization, WHO4 – WHO Laboratory Manual for the Examination of Human Semen and Sperm-Cervical Mucus Interaction 4th
ed. (1999), WHO5 – WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th ed. (2010), VAP – average path
velocity, VCL – curvilinear velocity, ZP – zona pellucida
Introduction
Just like in The Marriage of Figaro, the second play in
a trilogy of operas (following The Barber of Seville),
Sperm Functionality Testing should become an integral
part of testing potential male fertility and as part
of manuals of guidance bodies such as the World Health
Organization /European Society of Human Reproduction
and Embryology (WHO/ESHRE).
In essence there should be a matrimonial bond
between Sperm Functionality and the existing Basic
Semen Analysis. However, such a bond will come with
various challenges similar to those faced in The Marriage
of Figaro. Our title suggests that a great deal more is
needed than just standardized semen analysis and
our basic aim is to suggest a more holistic approach to
better understand male fertility as related to semen
analysis, sperm functional testing and associated
molecular biology. This should include the marriage of
many complimentary analyses and approaches as well
as proper investigation of the patient and the couple;
but not exclude any new developments as we envision
that emerging technologies will continue to be included
as “new plays” in this evolving field of male fertility
diagnostics.
Historical background on standardization
of semen analysis
The first WHO semen analysis manual was published in
1980, and it was updated in 1987, 1992, 1999 (so called
WHO4) and then lastly in 2010 (WHO5). In all these
editions there were concerted efforts to standardize and
improve methodology and technology to evaluate semen
quality. It was particularly the first three editions that came
under scrutiny for the lack of detailed descriptions, procedures
and standardization for the various semen analyses
procedures. Improved methodology and standardization
required internal and external quality control and resulted
in cut-off values for semen quality to be modified (table 1
after Esteves, 2014).. It was only in the 1999 (WHO4) and
2010 (WHO5) editions that more progress was made;
emphasis in the WHO4 was based on new scientific
information, while with WHO5 was more based on clinical
outcomes, but certainly not without some criticisms.
Basic semen analysis (WHO5)
Is basic semen evaluation useful in predicting fertility?
It is believed that many users of the WHO5 manual are
 under the wrong impression that it predicts human fertility
outcome. This is incorrect for many reasons, but
at the same time it does not imply that it is of limited
or no use
(Jequier, 2010)..
It certainly supports defining
the general quality of a semen sample as poor, medium
or good, but cannot predict fertility per se. It certainly
points in the direction of potential fertility particularly
in view of the ranges of cut-off values as proposed by
Cooper et al. (2010) .
(table 2) and provide a much better
basis for measuring sperm quality rather than a single
cut-off value for each parameter. This has fortunately
been incorporated in WHO5 as an Appendix. Apart from
predicting the quality of a semen sample it may also
indicate the general reproductive health of the donor
and it is important from a general Andrology point of
view of understanding the patient.
under the wrong impression that it predicts human fertility
outcome. This is incorrect for many reasons, but
at the same time it does not imply that it is of limited
or no use
(Jequier, 2010)..
It certainly supports defining
the general quality of a semen sample as poor, medium
or good, but cannot predict fertility per se. It certainly
points in the direction of potential fertility particularly
in view of the ranges of cut-off values as proposed by
Cooper et al. (2010) .
(table 2) and provide a much better
basis for measuring sperm quality rather than a single
cut-off value for each parameter. This has fortunately
been incorporated in WHO5 as an Appendix. Apart from
predicting the quality of a semen sample it may also
indicate the general reproductive health of the donor
and it is important from a general Andrology point of
view of understanding the patient.
Limitations of conventional semen analysis
and factors that can affect the evaluation
Semen quality is commonly taken as a surrogate indicator
of male fertility. However, there is little consensus as to
the power of conventional semen analysis in predicting
future fertility. Nonetheless, a multitude of studies proclaim
significant correlations between individual parameters
and fertilization, pregnancy and birth rate after
both natural conception or assisted reproductive techniques
(ART) interventions.For the first time the reference values for semen analysis
as included in WHO5 are based on controlled studies
comprising fathers with a known time to pregnancy. The
goal of WHO5 was therefore to provide evidence-based
thresholds through the lower reference limits to help
clinicians approximate a patient’s fertility. What needs
to be kept in mind is that meeting the lower reference
values does not ensure fertility or vice versa. Basic semen
analysis merely acts as a tool to quantify semen quality
and we should not place excessive expectations on it.
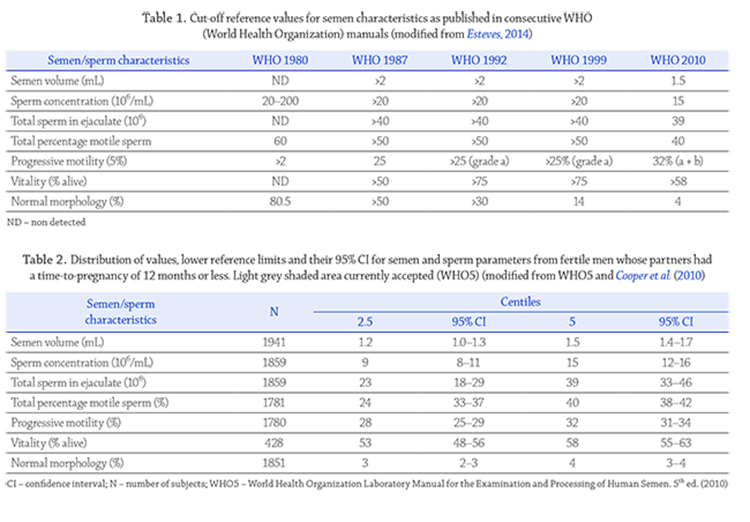
Conventional semen analysis including the use of the
WHO5 manual provide very good guidelines for standardization
in determining important semen characteristics
such as semen volume, agglutination, viscosity, sperm
concentration, sperm motility, sperm morphology, vitality
and many other facets such as immunological tests and
biochemistry of seminal plasma such as fructose, citric acid
and zinc (figure 1). It is sometimes ignored that the WHO5
manual has a subtitle, “examination and processing of human
semen”, and should be used in this context and not as an
absolute reference to what is fertile or sub-fertile or infertile.
As with any predictive formulae, the WHO5 guidelines
have some limitations and caveats
(Bonde, 2010;).
(Boyd, 2010).
( Esteves et al., 2012).
We would like to highlight
a few limitations of the original design and study
that led to establishing the new WHO5 lower reference
values for semen analysis:
yy the studies and data used were not sufficiently representative.
Only 10% of the study population came
from the Southern hemisphere (Australia), while 55%
of data originated from four European cities and 30%
from the USA. A large proportion of studies have overlapping
authorship or collaboration among authors,
yy only a single semen sample was collected to represent
each man, which is problematic due to the heterogeneity
of semen,
yy different evaluation criteria were used for morphology
analysis (Tygerberg “strict” vs. David’s).
A further limitation of basic semen analysis is that it
cannot predict and diagnose idiopathic or unexplained
infertility as ± 30% of men with difficulty of fathering
a child display no demonstrable abnormalities; yet again
pointing towards inclusion of functional assays to test
the impact of sperm dysfunction.
While the manual has been put together by experts
with very good consequence
(Jequier, 2010) .
there are
shortcomings relating to both the manual itself, but
more so to the use and application of the manual globally
(Handelsman and Cooper, .
(J2010a) .
(J2010b) .
( Lu and Gu, 2010) .
The main shortcoming relates to the fact that many
of the central tests such as sperm motility, sperm morphology
and vitality rely on subjective manual observations
and according to Eliasson are not outcome-based
as the WHO5 claims
(Eliasson, 2010).
Handelsman and Cooper (2010b)
provide an excellent
summary on the major objections to WHO5. Both
Eliasson (2010)
and
Björndahl (2010)
raise valid objections
to WHO5 combining “a” and “b” motility ratings for fast
progressive sperm.
Handelsman and Cooper (2010b)
furthermore
quote
Eliasson
stating his serious objections
to strict criteria for many reasons.
Auger (2010)
states:
“… whether the actual sperm morphology of 4% per se is
useful is questionable: the likely more relevant parameter
is the total number of morphologically normal spermatozoa
in the ejaculate and men with even lower percentages
of normal forms than fathers may well have
far fewer total spermatozoa as well”
(JHandelsman and
Cooper 2010a) .
(Handelsman and
Cooper (2010b).
Sadeghi (2010)
in an editorial raises
similar objections.
Moreover, a diagnosis for fertility cannot be based on
one semen parameter alone. Various factors can affect
basic semen analysis, as described in WHO5, and thus
impact on the clinical utility thereof. These issues can
render the results obsolete or difficult to interpret if not
placed in perspective; therefore, physicians should exercise
caution when making inferences. This can include
factors such as, but not limited to: intra-patient variability
of semen parameters with repeat testing, ethnic and
geographical variations in semen parameters, declining
sperm quality, incorrect laboratory handling of sperm,
inter-technician variability, lack of standardization and
consensus on appropriate techniques.
It is well known that there is inherent variability from
one ejaculate to the next due to pre-analytic influences
(e.g. environmental exposures, abstinence duration) as
well as intrinsic biological variation. Within-patient coefficient
of variation for all semen parameters between
two routinely performed semen analyses were reported
to be between 28–34%
(Leushuis et al., 2010).
Similarly,
other studies demonstrated significant changes in volume
(decrease), concentration (decrease) as well as motility
(increase) with shorter abstinence periods
(Mayorga-Torreset al., 2015).
Similarly, variations in semen parameters
have also been shown based on ethnicity and geographical
location, e.g. a significant proportion of Asian men
had values below that of the WHO reference values or
their European counterparts
(Barazani et al., 2014).
It is tempting to suggest that semen quality (specifically
sperm count) is on the decline
(Sengupta et al., 2017),
(Sengupta et al., 2017),
however, there are many critics negating this hypothesis.
In contrast, it is fair to say that male reproductive
health does appear to be under threat (testicular
dysgenesis syndrome) due to environmental exposure,
which could ultimately impact sperm quality
(Bay et al.,2006;).
(Bay et al.,2006; Lewis, 2007).
As mentioned previously incorrect handling of the
semen sample and spermatozoa in the laboratory can also
affect the outcome of semen analysis. Excessive centrifugation
can lead to reactive oxygen species (ROS) generation,
whilst removal of the seminal plasma also leads to
removal of important antioxidants, rendering the spermatozoa
even more vulnerable to oxidative stress in the short
term. Exposing the gametes to, type/intensity of light
sources, temperature fluctuations and inconsistencies with
regards to the time before analysis occurs are additional
factors that can cause variation in results
(Lewis, 2007).
Despite the improvement in training there still
remains paucity in continuous proficiency testing of technicians
(Franken and Oehninger, 2012).
Due to human
subjectivity inter- and intra-technician inconsistency
regularly leads to discrepancies when evaluating the
same specimen
(Alvarez et al., 2005; Riddel et al., 2005).
Many studies have shown that the coefficient of variation
for technicians in evaluating sperm morphology
range from 10 to 80%, thus questioning the usefulness of
these parameters for measuring sperm quality and leave
alone fertility
(Handelsman and Cooper, 2010b).
Other
studies also proved manual analysis to be subjective
and accordingly variable
(Esteves, 2014; Pacey, 2006).
and
that as much as 12% of errors surround the diagnostic
process and actually impact on patient care (Goldschmidt and Lent, 1995).
The lack of standardization within and between laboratories
as well as the dearth in consensus on specific
tests and analysis methods are also causes of concern.
In a study conducted on more than 500 laboratories
in the USA it became evident that nearly 40% did not
report abstinence length or the specific criteria used for
morphology analysis, while more than half of them did
not perform quality control for any of the commonly
assessed parameters
(Keel et al., 2002).
These findings
were corroborated by surveys on laboratory practices
conducted in the UK (Riddel et al., 2005) as well as shortcomings
related to standardized methodology and problems
associated with subjective sperm evaluations in
many laboratories globally
(Esteves et al., 2012;
(Lu et al.,2010; )
(Walczak-Jedrzejowska et al., 2013).)
It
is therefore vital that quality assurance must form an
integral part of any laboratory, whilst appropriate record
keeping will also help with proper clinical diagnosis and
management of the infertile male. The importance of
specialised Andrology laboratories with expertize from
embryologists to clinicians (Urologists) can therefore
not be underestimated.
One of the authors (Gerhard van der Horst) visited
40 “sperm analysis laboratories” in 30 countries (mainly
Europe and Russia) during the past five years and
observed the following typical deviations from WHO5/
ESHRE guidelines that may affect the outcome of basic
semen analysis:
non-standardization of temperature control of semen
sample, consumables and temperature stage,
inconsistent timing related to determination of sperm
motility and sperm vitality after collection,
inaccurate semen volume determination through
measuring in a graduated tube instead of weighing
the semen sample on a sensitive balance,
not using positive displacement pipettes when determining
sperm concentration,
sub-optimal microscope settings, because of incorrect
setting of Köhler illumination and critical illumination,
essential for meeting optical resolution
requirements,
incorrect methods for making sperm morphology
and vitality smears,
not adhering to WHO5 guidelines for re-assessing
concentration, motility and morphology when differences
between replicate counts are not acceptable.
The informative paper of
Walczak-Jedrzejowska et al.(2013)
reported similar and additional shortcomings in
a recent survey of Polish laboratories evaluating semen
quality. In ESHRE accredited facilities well defined
internal and external quality assurance is performed
by qualified embryologists, spermatologists and andrologists.
This is also supported through guidelines and subsequent
training courses
(Björndahl et al., 2002; Pacey,2010).
(Pacey,2010).
On the other hand,
Jequier (2005)
is of strong
opinion that quality assurance in semen analysis is not
essential because the results generated do not adequately
predict fertility. Pacey (2006) contests both aspects and
makes a case based on the paper by
Bonde et al. (1998)
that some aspects of semen analysis do relate to fertilization
outcome. In contrast,
Jequier (2005)
makes such
an important statement and point about semen analysis
and infertility: “What the clinician needs for the
correct management of infertility in the male is a diagnosis.
Infertility is not a diagnosis: it is only a symptom.
The analysis of semen only occasionally gives the clinician
a diagnosis, as for the most part, the changes that
take place in semen are largely non-specific”. It brings
us back to the point that we need different strategies
for evaluating semen quality and what it means versus
what is regarded as a fertile male versus what is needed
in assisted reproductive strategies.
As long as the three critical aspects of basic semen
analysis as well as other facets such as semen viscosity
are not analysed objectively and/or with automated
proven technology, there will always be discrepancies
that are simply unscientific, leave alone outcome-based
and may be to the disadvantage of the patient. There is
a paucity by WHO5 to update the importance of newer
computer-aided sperm analysis (CASA) technology in
measuring most of the semen/sperm parameters objectively
and reliably (despite shortcomings; see section on
CASA). Also the use of CASA in the objective quantification
of sperm functionality is very much under played
(See section under sperm functionality relating to CASA)
(Mortimer et al., 2015).
Handelsman and Cooper (2010b)
At least make some positive comments as to how CASA
could be used to predict progressive motility more accurately
and objectively for a potential WHO6 manual.
Very few semen analysis laboratories make use of any
sperm functional tests as suggested in the WHO5 manual
and this is surprising as most of these tests are listed
under the heading Research and thus not considered as
a core part of the analysis. Many important and existing
sperm functional tests actually relate to the challenges
that sperm experience in the female reproductive tract
and are merely mentioned or not even included in WHO5
despite their ability to shed light on fertilization outcome
(see later). There is accordingly a great need to make these
shortcomings more widely known and develop measures
that will decrease the misuse of clearly prescribed and
standardized conditions and analysis of semen parameters.
Sperm functional testing and beyond: the role
of computer-aided sperm analysis (CASA)
CASA has developed remarkably fast during the past 30
years. Initially it was predominantly used for measuring
sperm concentration and sperm motility and later also
used for sperm morphology assessment
(van der Horst and Maree, 2009;)
(Maree et al., 2010,)
( Maree and van der Horst, 2013;)
(Mortimer et al., 2015).
While the early developmental
stages of CASA introduced a new era of objective
analysis, it was not commonly used in semen evaluation
in the clinical setting and even currently there is
some scepticism about its role in clinical spermatology
(Talarczyk-Desole et al.).
( 2017; WHO, 2010).
In contrast
many clinics across the globe use CASA systems because
of more objective analysis and despite the shortcomings
in clinical practise support its use as a consistent clinical
tool
(Talarczyk-Desole et al.).
and in a Urology setting it has proved to be invaluable in
varicocelectomy
(Ariagno et al., 2017)
showing decreased
sperm motility.
Mortimer et al. (2015)
alluded to the problems of CASA
in routine semen analysis and indicated that ideally it
should be used for sperm functional studies. Earlier in
this review it was indicated that more attention should
be devoted to sperm functionality and its relationship to
fertility. Particularly in the last decade much attention
has been devoted to relate sperm functional techniques
to fertility outcome but also develop CASA techniques/
modules that can measure some of these functional
aspects automatically, objectively and quantitatively
(see aspects below).
Sperm cervical mucous penetration test
The sperm cervical mucous penetration test (SCMPT)
has its origins in 1866 when Sims
(quoted by van der Horst, 2016)
showed that fertile males had many sperm
passing through the cervical mucous. More recently, two
versions of the test namely vanguard distance and actual
swim-up sperm count or decrease of sperm count along
a capillary tube has been used and it was established that
the sperm count provided a better outcome in relation to
sperm motility
((Ola et al., 2003).)
However, this test was
adopted only much later, but in a more detailed form.
The WHO5 provided detailed instructions to the sampling,
storage (freezing) of cervical mucous and subjective
evaluation of this test. Apart from the fact that it is
difficult for most andrology/fertility centres to routinely
sample/obtain cervical mucous of similar or a particular
quality (close to ovulation), it can be conceived that the
characteristics of the cervical mucous vary from female
to female. It is accordingly most difficult to standardize
SCMPT in any setting including establishing accurately
on a subjective basis which sperm pass the SCMPT assay.
Mortimer and Mortimer (2013)
have come forward with
a technique to measure a subpopulation of sperm with
specific kinematics to penetrate through seminal plasma
(surrogate to cervical mucous). Instead of exposing sperm
in semen to cervical mucous or similar medium, it is
exposed to its own seminal plasma. Two main advantages
of this approach is that seminal plasma share some viscosity
characteristics of cervical mucous, and, secondly,
sperm is challenged by the viscosity of its own seminal
plasma and makes more physiological sense since the
seminal plasma actually represents the first barrier for
sperm to cross. Kinematic cut-off points (average path
velocity – VAP>25um/s; straightness – STR>80%; amplitude
of lateral head displacement – ALH>2.5) are then
used to determine the number of sperm in the ejaculate
that pass these criteria (ideally >5 million sperm/ejaculate).
In view of the common current use of CASA in the
clinical setting this surrogate of SCMPT could be valuable
as a further adjunct to sperm functionality. Many studies,
even in the past, have in principle shown that ability
for sperm to pass through cervical mucous are of prognostic
value
(Aitken et al., 1985;).
( Eggert-Kruse et al., 1989).
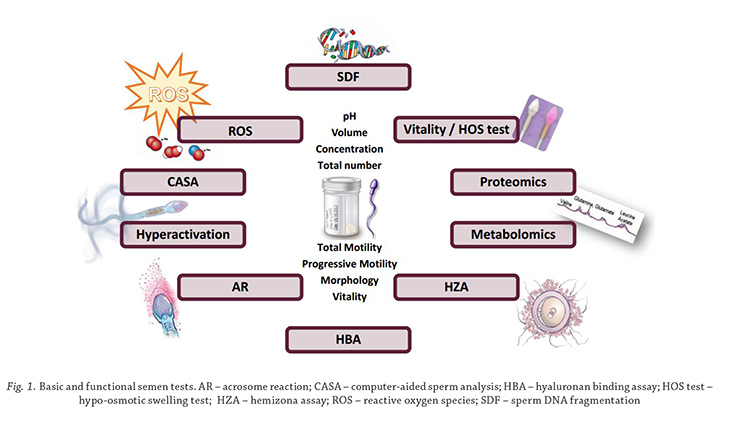
Vitality and hypo-osmotic swelling
The eosin-nigrosin test or dye exclusion test is universally
accepted for determining the percentage live sperm in
a sperm sample. The WHO5 manual suggests an eosinnigrosin
combination dye made up in 0.9% saline and
evaluation should include the use of an × 100 objective
lens. The basic rationale and validity of the eosinnigrosin
test is undisputable. However, there are three
major disadvantages to this technique as described in
WHO5; in low concentration samples it may take very
 long to count 100 to 200 cells; it is in several instances
difficult on a subjective basis to distinguish between live
and dead; because of the background noise it cannot be
used in CASA analysis.
A modified eosin-nigrosin stain, BrightVit, has since
been developed by Microptic SL (2016) that is also hypoosmotic
and amenable to CASA analysis using the 20×
objective. Accordingly, at low magnification it is faster
since more cells are captured per field and as many as
500 cells can be captured in less than 5 minutes and it is
objective using the relevant SCA (Sperm Class Analyser)
CASA module. The same slides can also be used for the
determination of hypo-osmotic swelling (HOS test) and
this is almost equivalent to the percentage live cells. In
both instances vitality should not be less than the percentage
sperm motility and be higher than 58% to qualify
for a good semen sample (figure 2).
A more accurate method to determine vitality is
by using a fluorescent technique involving Sybr-14 or
Hoechst in combination with propidium iodide and a fluorescent
microscope
(Garner and Johnson, 1995).
CASA
systems such as the SCA (Microptic SL, Barcelona) has
automated this and vitality measurement is objective
and very fast.
The vitality tests discussed above are particularly
useful in cases of asthenozoospermia (very low sperm
motility), and when to decide in the in vitro fertilization
(IVF) laboratory on the best strategy when there is only
10% motility but 60% vitality for example. The cut-off
point for good quality sperm for the HOS test is similar
than for vitality (>58%).
long to count 100 to 200 cells; it is in several instances
difficult on a subjective basis to distinguish between live
and dead; because of the background noise it cannot be
used in CASA analysis.
A modified eosin-nigrosin stain, BrightVit, has since
been developed by Microptic SL (2016) that is also hypoosmotic
and amenable to CASA analysis using the 20×
objective. Accordingly, at low magnification it is faster
since more cells are captured per field and as many as
500 cells can be captured in less than 5 minutes and it is
objective using the relevant SCA (Sperm Class Analyser)
CASA module. The same slides can also be used for the
determination of hypo-osmotic swelling (HOS test) and
this is almost equivalent to the percentage live cells. In
both instances vitality should not be less than the percentage
sperm motility and be higher than 58% to qualify
for a good semen sample (figure 2).
A more accurate method to determine vitality is
by using a fluorescent technique involving Sybr-14 or
Hoechst in combination with propidium iodide and a fluorescent
microscope
(Garner and Johnson, 1995).
CASA
systems such as the SCA (Microptic SL, Barcelona) has
automated this and vitality measurement is objective
and very fast.
The vitality tests discussed above are particularly
useful in cases of asthenozoospermia (very low sperm
motility), and when to decide in the in vitro fertilization
(IVF) laboratory on the best strategy when there is only
10% motility but 60% vitality for example. The cut-off
point for good quality sperm for the HOS test is similar
than for vitality (>58%).
Hyperactivation
Hyperactivation (HA) was first described independently
by Yanagimachi (1969) as well as Gwatkin and Andersen
(1969)
in the hamster. Hyperactivation of sperm is
associated with vigorous motility
(Yanagimachi, 1969),
including rapid speed and large high amplitude flagellar
waves (whiplash tail movements) with a large space
gain compared to non HA sperm
(Mortimer et al., 2015).
It was soon established that HA is an important endpoint
of capacitation required for the acrosome reaction
and eventual fertilization. HA is typically associated
with various Ca2+ signals
(Alasmari et al., 2013)
and particularly Ca2+ moving into sperm and involving
CatSper 11 directly or indirectly
(Tamburrino et al., 2015).
Progesterone is among several chemicals that seem to
play an important role in priming sperm to become
hyperactivated.
It was only in 1984 that
Burkman et al.
showed by
means of CASA the relationship of HA with fertile and
oligozoospermic groups in humans, while
Mortimer(1997),
and
Mortimer et al. (2015)
confirmed the importance
of HA in sperm functional testing and its relationship
with fertility. It is currently accepted that HA >20%
relates to a high quality sperm and fertilization success
in humans and animals
Burkman et al., 1984;
McPartlin
et al., 2009;
Mortimer et al., 2015
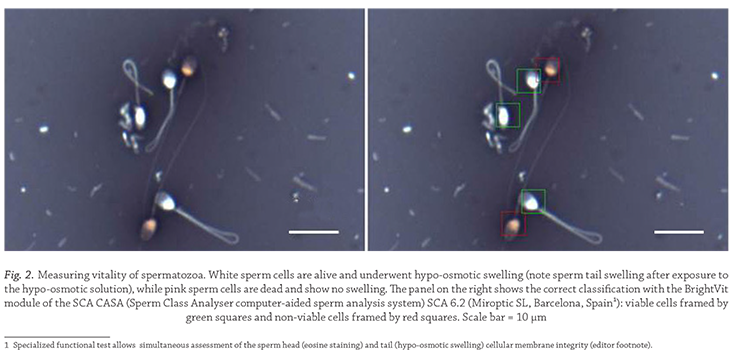
Different modern CASA systems such as the
HT2-IVOS II and the SCA versions 5 and 6 are programmed
to measure sperm hyperactivation routinely
in capacitation medium using Boolean arguments for
different kinematic parameters such as curvilinear
velocity (VCL), linearity (LIN) and ALH and or the D
fractal
(Mortimer et al., 2015).
If performed under standardized
conditions this provides an objective assessment
to potential fertility outcome (figure 3).
Acrosome reaction
Acrosome reaction
HA and acrosome reaction (AR) are intimately related. AR
cannot occur if sperm capacitation has not taken place
with HA as a central capacitation landmark. Many of the
mechanisms associated with HA, such as an increase in
intra cellular calcium and Ca2+ signalling also relates to
the acrosome reaction and progesterone also appears to
be important in the AR.
Two important facets are required when considering
the acrosome reaction. Firstly, it is important to establish
that most sperm are acrosome intact. Secondly,
sperm need to be able to undergo the acrosome reaction
(Cummins et al., 1991).
The most commonly accepted techniques
also prescribed by WHO5 is the use of the agglutinins
from Pisum sativum (PSA) and Arachis hypogaea (PNA)
among others but a brightfield microscopic technique
using a tri-stain combination have been used in the past
with success
(Henkel et al., 1993; ).
( Talbot and Chacon, 1981).
In this latter case solubilized zonae have been used to
induce the acrosome reaction and have been found to
be of prognostic value.
(Jamil and White (1981) ).
established the principle of
the acrosome induced reaction test using Ca2+ ionophore.
(Mortimer (1994) ).
described a very detailed modified technique
for AR based on the principles of and a combination
of PNA and Hoechst for the evaluation of live and dead
acrosome intact/reacted sperm followed by exposure to
Ca2+ ionophore to induce the acrosome reaction. WHO5
(2010) cautioned that the concentration of Ca2+ ionophore
may be too high and needs to be reduced to what may
be more physiological. It was demonstrated by several
researchers that 5 μmol/L Ca2+ ionophore can be used
to induce the acrosome reaction and that it may have
a potential in the clinical laboratory and relate to fertilization
outcome
(Pampiglione et al., 1993; ).
(Zeginiadou et al., 2000).
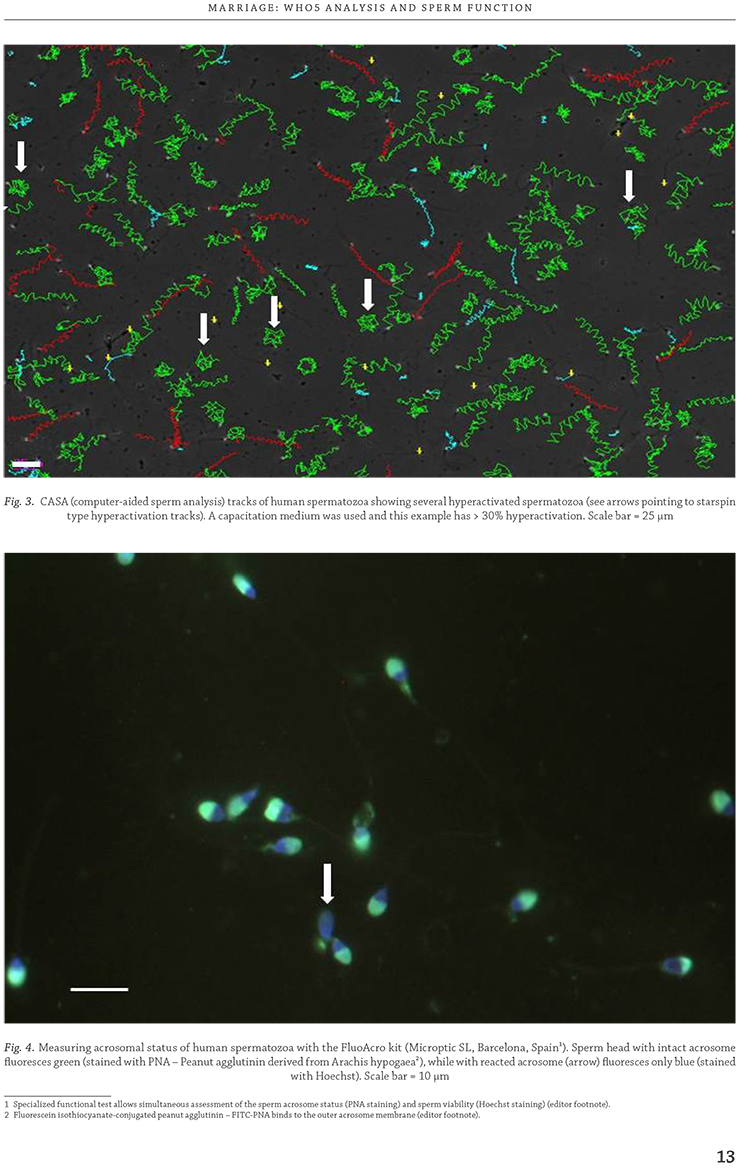
Figure 4 depicts intact acrosomes using PNA and
Hoechst staining showing acrosomes in green (intact) and
one sperm stained by Hoechst only (acrosome reacted)
(van der Horst, unpublished using Microptic FluoAcro kit).
We have also established that a 1 μmol/L Ca2+ ionophore
concentration is ideal for inducing the acrosome reaction
and is in line with previous suggestions to lower Ca2+ ionophore
concentrations to acceptable (physiological?)
levels.
Oxidative stress
The concept that excessive production of ROS is
related to abnormal semen parameters, sperm damage
and impaired sperm function has been generally accepted.
ROS, such as hydrogen peroxide, superoxide anions, and
hydroxyl radicals are formed as by-products of oxygen
metabolism and in semen it can originate from either
intrinsic production by the spermatozoa themselves or
from external sources such as leukocytes that are mostly
omnipresent in the ejaculate
(Lackner et al., 2010).
Physiological levels of ROS are vital for a number of
critical sperm functions such as capacitation and the
acrosome reaction
(reviewed in du Plessis et al., 2015).
However, when excessive amounts of ROS are produced
and the enzymatic (e.g. catalase, superoxide dismutase,
glutathione peroxidase) and non-enzymatic antioxidants
(e.g. Vitamin C, glutathione, albumin) are unable to eradicate
it, oxidative stress develops with damaging consequences
to the spermatozoa
(Kothari et al., 2010).
Due to
their inability to repair damage and high levels of polyunsaturated
fatty acids sperm are particularly susceptible to
ROS-mediated damage (e.g. lipid peroxidation of plasma
membrane, impaired motility, nuclear and mitochondrial
DNA fragmentation)
(du Plessis et al., 2010).
Several
studies have reported that 25–40% of infertile men show
elevated ROS levels and reduced total antioxidant capacity
(TAC) in their semen compared to fertile counterparts
(Agarwal et al., 2014;).
(Barazani et al., 2014;).
(Mayorga‑Torres
et al., 2017; ).
(du Plessis et al., 2008;).
(Tremellen, 2008).
Tests to determine potential oxidative injury include
assessment of ROS generation as well as antioxidant
capacity analysis
(Lewis, 2007).
For various reasons these
tests are not routinely included during the screening
and evaluation of men with fertility problems, despite
their superior diagnostic and prognostic properties.
Multiple assays to measure ROS exist and the most
commonly performed analysis are chemiluminescent
based. This includes the use of probes such as luminol,
lucigenin, dihydroethidium (DHE), 2,7-dichlorofluorescein
(DCF) and 4,5-diaminofluorescein diacetate
(DAF-2DA) of which the illumination can be detected
by a chemiluminometer, flow cytometer or fluorescent
microscope
(Hamada et al., 2013;).
( Lampiao et al., 2006a,
2006b;).
(Mahfouz et al., 2010).
Total antioxidant capacity (TAC) of the seminal
plasma can be measured colorometrically and together
with the ROS results a ROS-TAC score can be calculated.
Unfortunately, these methods have limitations to be used
routinely for diagnostic purposes as they require large
volumes of semen and are cumbersome, costly and time
consuming. Recently it has been shown that oxidation
reduction potential (ORP), which is a direct measurement
of oxidative stress or redox potential can be determined
with great success in small volumes of semen in real time
(Agarwal et al., 2016b). ).
This relatively inexpensive test
provides boundless research and clinical opportunities.
The extent of ROS induced oxidative stress damage
can also be assessed indirectly by measuring the levels of
lipid peroxidation and DNA damage sustained by spermatozoa.
Despite the use of ROS testing by certain andrology
laboratories as an advanced test in the evaluation and
diagnosis of unexplained male infertility, universally
acceptable and standardized seminal ROS, ROS-TAC
and ORP assays as well as cut-off ranges remains to
be established in order to successfully predict fertility
outcomes and guide treatment options (ART and antioxidant
therapy).
Sperm DNA fragmentation
Sperm DNA fragmentation (SDF) has been linked to
various pathologies (e.g. varicocele) and abnormal sperm
parameters. However, impaired sperm chromatin is also
found in men displaying semen parameters within the
normal ranges
(Agarwal et al., 2016a;).
( Esteves, 2016).
During spermatogenesis histones are replaced by protamines
which help to compact and protect the DNA
during transit. Within limits, a certain amount of SDF
can be repaired by the oocyte’s cytoplasm; if this damage
exceeds the repair threshold it can cause infertility issues
(Agarwal et al., 2016a).
Various assays have been developed to measure
SDF and chromatin abnormalities ranging from rather
sophisticated to relatively simple cytochemical assays,
with some relating to DNA maturity/compaction, while
others measure the levels of SDF directly or indirectly
(table 3). Of these assays the terminal deoxynucleotidyl
transferase-mediated dUTP nick end labelling (TUNEL),
the sperm chromatin structure assay (SCSA) and the
sperm chromatin dispersion test (SCD) are the most
routinely used and cut-off levels have been defined in
the literature. As these tests measure different expressions
of sperm DNA damage the results are not necessarily
interchangeable
(Esteves, 2016).
Fluorescence in situ hybridization analysis (FISH)
of sperm is another useful test related to DNA and
chromosomes. This cytogenetic technique is able to
detect sperm aneuploidy and helps to quantify complex
chromosomal rearrangements, such as translocations
and inversions. FISH analysis of sperm can be successfully
used as a screening tool for men with severe male
factor infertility, especially in cases of prior repeated
IVF/intracytoplasmic sperm injection (ICSI) failure or
recurrent pregnancy loss
(Hwang et al., 2010).
Defective protamination and abortive apoptosis can
possibly explain the generation of DNA fragmentation
within the testis, while outside of the testis oxidative
stress is the major cause of SDF during transit through
the epididymis and post-ejaculation
(Esteves, 2016).
It
has been well documented that SDF correlates significantly
with impaired reproductive outcomes (in vivo and
in vitro conception, pregnancy loss, health of offspring),
however, some controversy regarding the validity and
clinical significance of these techniques still exist. It is
commonly accepted that consensus should be reached
regarding standardization, clinical significance and
establishing of recognized reference ranges. Despite
recently conceding that SDF results might be clinically
informative w.r.t. intrauterine insemination (IUI), IVF
and ICSI, the
Practice Committee of the American Society
for Reproductive Medicine’s (2013; )
Practice Committee of the American Society
for Reproductive Medicine’s ( 2015)
practice guidelines
currently still recommend against the routine use
of sperm DNA testing; however, it should be noted that
SDF testing is not a replacement for the standard semen
 analysis, but should rather be seen as an adjunct
(Agarwalet al., 2013).
(Agarwalet al., 2013).
analysis, but should rather be seen as an adjunct
(Agarwalet al., 2013).
(Agarwalet al., 2013).
Sperm zona pellucida binding testing
During sperm-egg interaction the zona pellucida (ZP),
which consists of various glycoproteins (ZP1, ZP2, ZP3)
and surrounds the oocyte, is responsible for species
specific sperm recognition. However, it also serves as
a binding site for sperm and acts as a natural ligand to
induce the acrosome reaction
(Aitken, 2006; ).
(Oehninger et al., 2014).
The interaction between spermatozoa
and the ZP is a critical event leading to fertilization
and reflects multiple sperm functions
(Vasan, 2011).
Quantification of sperm-ZP binding led to the development
of the hemizona assay (HZA)
(Burkman et al., 1988).
The HZA is a highly significant internally controlled
functional bioassay and is one of only a few spermoocyte
interaction tests.
The HZA is performed by incubating matching halves
of a ZP with sperm from a patient and fertile donor
(control) respectively. Binding capacity is expressed as
a hemizona index (HZI) and calculated by expressing
the number of tightly bound patient sperm as a percentage
of the number of tightly bound control sperm.
However, as the binding is species specific it limits the
usefulness of this assay as only human zona can be used
(Vasan, 2011).
It is well documented that the HZI relate to spermatozoal
events leading to fertilization as only capacitated
and acrosome reacted sperm (thus normal functioning
spermatozoa) can bind to the ZP
(Franken and Oehninger,2012).
The HZA is also highly predictive of IVF (Oehninger
et al., 2000) and IUI fertilization and pregnancy outcomes
(Arslan et al., 2006).
Results from this functional assay help to determine
the clinical management of men for whom conventional
IUI and IVF therapy is likely to be unsuccessful and
whom should rather be referred to ICSI
(Aitken, 2006;).
(Oehninger et al., 2014).
Hyaluronian binding assay
Sperm plasma membrane remodelling occurs during the
maturational steps of spermiogenesis. This promotes
the formation of ZP-binding sites and the expression
of Hyaluronic acid (Ha) receptors which are localised
on the acrosome membrane
(Cayli et al., 2003).
These
membrane changes are further accompanied by cytoplasmic
extrusion and synthesis HspA2, another cellular
marker of maturity.
Ha-binding has been shown to correlate significantly
with viability, acrosome intactness and sperm maturity
(Huszar et al., 2003).
Not all sperm binds to Ha and
various experiments have shown that those able to bind
Ha have completed cytoplasmic extrusion and membrane
remodelling, as well as the replacement of histones with
protamines
(Huszar et al., 2006).
Sperm motility and viability
is a prerequisite for Ha-binding ability, while only
sperm with an intact or slightly reacted acrosomal cap
are able to bind. Furthermore, enrichment of morphologically
normal sperm, as evaluated by Tygerberg Strict
Criteria, was also observed in Ha-bound spermatozoa.
Interestingly, it is estimated that the selection power of
Ha for normal spermatozoa are relatively similar to that
of ZP
(Prinosilova et al., 2009;).
( Ye et al., 2006).
Positive correlations were found between the hyaluronian
binding assay (HBA) test and total motile sperm
count, progressive motility and sperm concentration,
thereby proving to be a useful tool in verifying sperm
quality
(Yildirim et al., 2015).
The HBA also selects for
sperm with less DNA fragmentation and low frequency of
chromosomal abnormalities
((Nasr-Esfahani et al., 2008).
HBA binding has diagnostic and prognostic utilities.
Huszar et al. (2006)
were able to identify and classify three
sperm populations based on Ha-binding, i.e. (i) sperm
that bind permanently (mature), sperm that continuously
bind and release (intermediate maturity) as well
as those that exhibit no binding (immature). These HBA
results can assist clinicians in the therapeutic approach
to ART as it is a convenient and reproducible laboratory
test for identifying and assigning patients for either IVF
or ICSI treatment
(Oehninger et al., 2014).
HBA scores are
not only significantly associated with fertilization rates
and biochemical pregnancies
(Worrilow et al., 2013),
but
Ha selected sperm will also ameliorate the risks related
to ICSI fertilization with sperm of diminished maturity
(Huszar et al., 2006).
Proteomics
Proteomics allows for the characterisation of the semen
profile at a molecular level as it offers a comprehensive
analysis of all the proteins expressed by the spermatozoon
or those present in the seminal plasma
(Kashou et al., 2011; ).
( du Plessis et al., 2011).
Sperm proteomics are
evolving rapidly and researchers belief that identification
of proteins expressed differentially between normal and
diseased state holds the key to better diagnosing and
understanding of phenotypical and functional aberrations
leading to male infertility
(Barazani et al., 2014).
Human sperm and seminal plasma are particularly
suited for non-invasive proteomic analysis as it is easily
obtained, isolated and purified. Several methods have
been developed to separate and digest the proteins where
after the peptides are subjected to liquid chromatography
and mass spectrometry. This helps to identify the proteins
by mapping peptide mass as well as by sequencing
the peptides by fragmentation characteristics according
to mass-to-charge ratio of ions. The data acquired are
analysed via bioinformatics through submitting the
amino acid sequences into various data basis (e.g. Mascot,
SEQUEST) to search for matching peptide sequences
in order to identify the most likely protein(s). Pathway
analysis can also be performed (using e.g. Reactome)
to reveal the cellular, metabolic and regulatory roles of
these proteins.
By comparing findings from studies on proteins from
spermatozoa or seminal plasma, from infertile men with
those from normozoospermic fertile men, putative biomarkers
have already been identified that will aid in
clinical application for functional diagnosis of e.g. idiopathic
infertility. A number of studies have characterized
irregularities in proteins from asthenozoospermic
(Zhao et al., 2007),
oligozoospermic
(Hosseinifar et al., 2013)
and immature samples
(Sharma et al., 2013c).
Proteomics
also exposed reduced protamine content in infertile men,
which relates to DNA fragmentation
(De Mateo et al.,2007; ),
(Intasqui et al., 2013),
Pathological conditions such
as varicocele
(Hosseinifar et al., 2013)
and elevated ROS
(Hamada et al., 2013;)
( Sharma et al., 2013a,)
(Sharma et al.,2013b)
levels
displayed differentially expressed protein profiles.
The groundwork of ascertaining and cataloguing
seminal protein profiles has already been laid. Many of
the proteins differentially expressed between control
and pathological sperm and seminal plasma samples
represents potential novel proteomic biomarkers for
diagnosing male infertility with prognostic abilities of
identifying the best treatments (e.g. therapeutic, surgical,
ART)
(Barazani et al., 2014).
Metabolomics
Metabolomics is a systematic approach to study the
metabolites within cells or fluids as small-molecule
biomarkers which represent chemical phenotyping.
Identifying the metabolome and its dynamic changes
can subsequently be associated with the physiological
or pathological state
(Courant et al., 2013; Deepinder et al., 2007; Egea et al., 2014).
(Courant et al., 2013; ).
( Deepinder et al., 2007;).
( Egea et al., 2014).
This can be performed through
various techniques including e.g. nuclear magnetic resonance
(NMR) spectroscopy, mass spectrometry (MS), gas
chromatography coupled to mass spectrometry (GC‑MS),
high-performance liquid chromatography (HPLC), capillary
electrophoresis-mass spectrometry (CE-MS), and
optical spectroscopy.
Recent studies have demonstrated the potential role
of this rapid, noninvasive analysis in the investigation
of infertile men. To date a total of 69 metabolites have
been identified in spermatozoa
(Paiva et al., 2015),
while
metabolomic profiling of seminal plasma is also explored
as an approach for acceptable diagnosis in the evaluation
and characterization of male fertility/infertility
such as idiopathic infertility, testicular failure, azoospermia
and ductal obstruction (e.g. differences in citrate,
lactate, glutamate, cholesterol glycerylphosphorylcholine
and glycerylphosphorylethanolamine)
(Deepinder et al.,
2007; Hamamah et al., 1998; Zhang et al., 2015; Zhou et al.,
2016). Gupta et al., (2011)
(Deepinder et al.,
2007;),
(Hamamah et al., 1998;),
(Zhang et al., 2015;),
(Zhou et al.,
2016).,
(Gupta et al., (2011),
was able to identify 10 seminal
plasma metabolites of which 5 could possibly be used
as biomarkers of infertility.
Zhou et al. (2016)
also concluded in their novel study
that plasma metabolomics has a diagnostic future as
they were able to discriminate with very high sensitivity
and specificity between controls, men with seminal
plasma abnormalities and those with erectile dysfunction.
However, more studies are necessary to identify
the complete sperm and seminal plasma metabolome in
order to recognise infertility biomarkers with certainty
(Egea et al., 2014).
Concluding remarks
It is clear that there are many conflicts in this Marriage
of Figaro. It is not only a conflict of manual versus more
objective analysis of basic semen parameters or actually
adhering to the WHO5 guidelines or the importance
of using sperm functional tests. It is of importance to
realize what each of these aspects is intended for, their
strengths, and weaknesses and how they can be combined
in good matrimony to advise us better about male
fertility.
Firstly, the WHO5 manual and similar guidelines
for ESHRE are intended to provide basic guidelines and
standard methodology for semen and sperm quality
determination and in this respect remains a cornerstone.
It is not a manual to be used for evaluating fertilization
success or live birth outcome. One of the major
problems is that in many (most?) andrology, embryology
and fertility laboratories or centres the WHO5 is used
to provide some kind of fertility outcome. The authors
are in agreement that several facets of the WHO5 semen
analysis are “outcome-based”, but then a single or two
or three parameters cannot be used to predict fertilization
success or live birth outcome or determine a specific
assisted reproductive technique. In this context much
work is needed to develop mathematical models that
will use various sperm parameters and sperm functional
aspects to construct a greater likelihood for fertilization
success than before.
Secondly, the unfaithful Figaro Marriage continues
despite the fact that methodology is abused in many
semen analysis laboratories. Thirdly, the very good intention
of including sperm functionality in WHO5 is almost
never used/clinically applied but reserved for research
only. There are many sperm functional techniques that
have been simplified and particular in view of the fact
that CASA will/should become more common many of
these aspects can be incorporated as routine tests.
The question remains “So how will these conflicts
be resolved in order to routinely assess male fertility
potential better in the laboratory?” The following provide
some guidelines and are not rules or absolute endpoints:the WHO5 manual for semen analysis should be
used for what it is intended for, i.e. to evaluate semen
quality according to very specific consensus methodologies.
However, this will only be realized if laboratories
follow these procedures correctly and this is
not currently the case,
yy more objective technologies such as CASA should be
used to replace manual methods, but only if these
new technologies have proven to be more consistent.
The CASA technologies should include at least fully
automated analysis of sperm concentration, sperm
motility, sperm morphology including the multiple
anamolies index (MAI) and the teratozoospermic
index (TZI), sperm vitality and HOS test and sperm
fragmentation,
yy sperm functionality as outlined should be seriously
addressed and incorporated; especially those functional
aspects relating to challenges in the female
reproductive tract and actually relate to fertility
(SCMPT, capacitation with HA as endpoint, acrosome
reaction and sperm zona binding). Most of these
aspects can be objectively determined using various
CASA systems while several can also be performed
manually (acrosome reaction),
yy one of the reasons why there may have been “resistance”
to apply sperm functional analysis in the routine
laboratory is because they are too tedious, too complex
and takes too much time. But many of these tests
have been simplified and fully automated for CASA
such as sperm mucous penetration, HA and some
chromatin assays,
yy a real problem is what happens from one WHO edition
to the next? Several years lapse, despite development
of newer and sometimes better technologies which
unfortunately do not receive WHO/ESHRE accreditation/
approval in the interim. Thus are they now by
default disqualified despite that they may represent
new information for improvement or often new innovations?
While WHO/ESHRE guidelines must serve
as a “watchdog” for standardization of semen analysis,
it must not exclude new/alternative developments
and different views based on good scientific/patient
outcome basis particularly if they can be defended.,
yy the marriage requires that we systematically establish
a matrix where sperm functional tests, sperm quality
parameters and many other factors such as female
cryptic choice and psychological factors including stress,
as well as the total patient/couple is considered as well
as combined in models that assist us to predict better,
yy the challenge then is: “Does all of this strengthen the
marriage or might it lead to matrimonial problems
and ultimately a divorce?” It is strongly suggested
that we accept this challenge and in future provide
simple, but more comprehensive semen/sperm analysis,
including many complimentary techniques providing
us with a better understanding of male fertility/
infertility instead of just qualifying the semen by
quality mainly as has been done for four decades.
It is perhaps useful to quote
Aitken (2010)
on commenting
on WHO5 and pointing to future needs: “Clearly,
laboratory seminology is still very much in its infancy. In
as much as the creation of a conventional semen profile
will always represent the foundations of male fertility
evaluation, the 5th edition of the WHO manual is a definitive
statement on how such assessments should be carried
out and how the quality should be controlled. However,
future editions of the WHO manual will inevitably move
beyond the provision of consensus protocols for the conventional
semen profile and into the assessment of biochemical
criteria, which will shed light on the underlying
pathophysiology of the infertile condition and suggest
strategies for its effective management and prevention”.
The average andrology laboratory needs to be accommodated
in this respect and also in terms of sperm functionality
in the broadest sense with techniques that are
simple to perform, provided they are objective and move
away from the current subjectivity. In this context the
WHO/ESHRE guidelines need to move faster, more boldly,
steer clear of subjective methods and adopt fresher ones.
Hopefully a new edition will soon adopt more quantitative
sperm functional aspects with hopefully better
fertility prediction.
References
Agarwal A., Majzoub A., Esteves SC., Ko E., Ramasamy R., Zini A.: Clinical
utility of sperm DNA fragmentation testing: practice recommendations
based on clinical scenarios. Transl Androl Urol. 2016a, 5, 935–950. DOI:
10.21037/tau.2016.10.03. PMID: 28078226.
Agarwal A., Sharma R., Roychoudhury S.,du Plessis S.S., Sabanegh E.: MiOXSYS –
A novel method of measuring oxidation reduction potential in semen and
seminal plasma. Fertil Steril. 2016b, 106, 566–573. DOI: 10.1016/j.fertnstert.
2016.05.013. PMID: 27260688.
Agarwal A., Virk G., Ong C., du Plessis S.S.: The Effect of oxidative stress on
male reproduction. World J Men’s Health. 2014, 32, 1–17. DOI: 10.5534/
wjmh.2014.32.1.1. PMID: 24872947.
Agarwal A., Zini A., Sigman M.: Is sperm DNA integrity assessment useful?
J Urol. 2013, 190, 1645–1647. DOI: 10.1016/j.juro.2013.08.004. PMID:
23933459.
Aitken R.J.: Sperm function tests and fertility. Int J Androl. 2006, 29, 69–75.
DOI: 10.1111/j.1365–2605.2005.00630.x. PMID: 16466526.
Aitken R.J.: Whither must spermatozoa wander? The future of laboratory
seminology. Asian J Androl. 2010, 12, 99–103. DOI: 10.1038/aja.2008.42.
PMID: 20111089.
Aitken R.J., Sutton M., Warner P., Richardson D.W.: Relationship between
the movement characteristics of human spermatozoa and their ability to
penetrate cervical mucus and zona-free hamster oocytes. J Reprod Fertil.
1985, 73, 441–449. PMID: 3989795.
Alasmari W., Barratt C.L.R., Publicover S.J., Whalley K.M., Foster E., Kay V.
et al.: The clinical significance of calcium signalling pathways mediating
human sperm hyperactivation. Human Reprod. 2013, 28, 866–876. DOI:
10.1093/humrep/des467. PMCID: PMC3600839.
Alvarez C., Castilla J.A., Ramirez J.P., Vergara F., Yoldi A., Fernandez A. et al.:
External quality control program for semen analysis: Spanish experience.
J Assist Reprod Genet. 2005, 22, 379–387. DOI: 10.1007/s10815-005-7461-2.
PMID: 16331534.
Ariagno J.I., Mendeluk G.R., Furlan M.J., Sardi M, Chenlo P., Curi S.M. et al.:
Computer-Aided Sperm Analysis: A Useful Tool to Evaluate Patient’s
Response to Varicocelectomy. Asian J Androl 2017, 19, 449–452. DOI:
10.4103/1008-682X.173441.
Arslan M., Moshedi M., Arslan E.O., Taylor S., Kanik A., Duran H.E. et al.:
Predictive value of the hemizona assay for pregnancy outcome in patients
undergoing controlled ovarian hyperstimulation with intrauterine
insemination. Fertil Steril. 2006, 85, 1697–1707. DOI: 10.1016/j.fertnstert.
2005.11.054. PMID: 16682031.
Auger J.: Assessing human sperm morphology: top models, underdogs or
biometrics? Asian J Androl. 2010, 12, 36–46. DOI: 10.1038/aja.2009.8.
PMID: 20111080.
Barazani Y., Agarwal A., Sabanegh E.: Functional testing and the role of proteomics
in the evaluation of male infertility. J Urol. 2014, 84, 255–266.
DOI: 10.1016/j.urology.2014.04.043. PMID: 25065986.
Bay K., Aslund C., Skakkebaek N.E., Andersson A.M.: Testicular dysgenesis
syndrome: possible role of endocrinedisrupters: Best Pract Res Clin
Endocrinol Metab. 2006, 20, 77–90. DOI: 10.1016/j.beem.2005.09.004.
PMID: 16522521.
Bonde J.P.: Semen analysis from an epidemiologic perspective. Asian J Androl.
2010, 12, 91–94. DOI: 10.1038/aja.2008.49. PMID: 20111087.
Bonde J.P., Ernst E., Jensen T.K., Hjollund N.H., Kolstad H., Henriksen T.B.
et al.: Relation between semen quality and fertility: a population-based
study of 430 first pregnancy planners. Lancet. 1998, 352, 1172–1177. DOI:
10.1016/S0140-6736(97)10514-1. PMID: 9777833.
Björndahl L.: The usefulness and significance of assessing rapidly progressive
spermatozoa. Asian J Androl. 2010, 12, 33–35. DOI: 10.1038/aja.2008.50.
PMID: 20111079.
Bjorndahl L., Barratt C.L., Fraser L.R., Kvist U., Mortimer D.: ESHRE basic
semen analysis courses 1995–1999: immediate beneficial of standardized
training. Hum Reprod. 2002, 17, 1299–1305. PMID: 11980755.
Boyd J.C.: Defining laboratory reference values and decision limits: populations,
intervals, and interpretations. Asian J Androl. 2010, 12, 83–90.
DOI: 10.1038/aja.2009.9. PMID: 20111086.
Burkman L.J.: Characterization of hyperactivated motility by human
spermatozoa during capacitation: comparison of fertile and oligozoospermic
sperm populations. Arch Androl. 1984, 13, 153–165. DOI:
org/10.3109/01485018408987514.
Burkman L.J., Coddington C.C., Franken D.R., Kruger T.F., Rosenwaks Z.,
Hog G.D.: The hemizona assay (HZA): development of a diagnostic test for
the binding of human spermatozoa to the human zona pellucida to predict
fertilization potential. Fertil Steril. 1988, 49, 688–697. PMID: 3350165.
Cayli S., Jakab A., Ovari L., Delpiano E., Celik-Ozenci C., Sakkas D. et al.:
Biochemical markers of sperm function: male fertility and sperm selection
for ICSI. Reprod Biomed Online. 2003, 7, 462–470. PMID: 14656409.
Cooper T.G., Noonan E., von Eckardstein S., Auger J., Baker H.W., Behre H.M.,
et al.: World Health Organization reference values for human semen characteristics.
Hum Reprod Update. 2010, 16, 231–245. DOI: 10.1093/humupd/
dmp048. PMID: 19934213.
Courant F., Antignac J.P., Monteau F., Le Bizec B.: Metabolomics as a potential
new approach for investigating human reproductive disorders. J Proteome
Res. 2013, 12, 2914–2934. DOI: 10.1021/pr400204q. PMID: 2365142.
Cummins J.M., Pember S.M., Jequier A.M., Yovich J.L.: PEA test of the human
sperm acrosome reaction following ionophore challenge. Relationship to
fertility and other seminal parameters. J Androl. 1991, 12, 98–103. PMID:
2050585.
Deepinder F., Chowdary H.T., Agarwal A.: Role of metabolomic analysis of
biomarkers in the management of male infertility. Expert Rev Mol Diagn.
2007, 7, 351–359. DOI: 10.1586/14737159.7.4.351. PMID: 17620044.
Egea R.R., Puchalt N.G., Escrivá M.M.,Varghese A.C.: OMICS: Current and
future perspectives in reproductive medicine and technology, J Hum Reprod
Sci. 2014, 7, 73–92. DOI: 10.4103/0974-1208.138857. PMID: 25191020.
Eggert-Kruse W., Leinhos G., Gerhard I., Tilgen W., Runnebaum B.: Prognostic
value of in vitro sperm penetration into hormonally standardized human
cervical mucus. Fertil Steril. 1989, 51, 317–323. PMID: 2912776.
Eliasson R.: Semen analysis with regard to sperm number, sperm morphology
and functional aspects Asian J Androl. 2010, 12, 26–32. DOI: 10.1038/
aja.2008.58. PMID: 20111078.
Esteves S.C.: Clinical relevance of routine semen analysis and controversies
surrounding the 2010 World Health Organization criteria for semen examination.
Int Braz J Urol. 2014, 40, 443–453. DOI: 10.1590/S1677-5538.
PMID: 25254609.
Esteves S.C.: Novel concepts in male factor infertility: clinical and laboratory
perspectives. J Assist Reprod Gen. 2016, 33, 1319–1335. DOI: 10.1007/
s10815-016-0763-8.
Esteves S.C., Zini A., Aziz N., Alvarez J.G., Sabanegh E.S., Agarwal A.: Critical
appraisal of World Health Organization’s new reference values for human
semen characteristics and effect on diagnosis and treatment of subfertile
men. Urology. 2012, 79, 16–22. DOI: 10.1016/j.urology.2011.08.003.
PMID: 22070891.
Franken D.R., Oehninger S.: Semen analysis and sperm function testing. Asian
J Androl. 2012, 14, 6–13. DOI: 10.1038/aja.2011.58. PMID: 22179512.
Garner D.L, Johnson L.A.: Viability assessment of mammalian sperm using
SYBR-14 and propidium iodide. Biol Reprod. 1995, 53, 276–284. PMID:
7492679.
Goldschmidt H.M.J., Lent R.W.: Gross errors and work flow analysis in the
clinical laboratory. Klin Biochem Metab. 1995, 3, 131–140.
Gupta A., Mahdi A.A., Ahmad M.K., Shukla K.K., Jaiswer S.P., Shankwai S.N.:
1H NMR spectroscopic studies on human seminal plasma: A probative discriminant
function analysis classification model. J Pharm Biomed. 2011,
54, 106–113. DOI: 10.1016/j.jpba.2010.07.021. PMID: 20719458.
Gwatkin R., Andersen O.: Capacitation of hamster spermatozoa by bovine
follicular fluid. Nature. 1969, 224, 1111–1112. PMID: 5353721.
Hamada A., Sharma R., du Plessis S.S., Willard B., Yadav S.P., Sabanegh E. et al.:
Two-dimensional differential in-gel electrophoresis-based proteomics of
male gametes in relation to oxidative stress. Fertil Steril. 2013, 99, 1216–
1226. DOI: 10.1016/j.fertnstert.2012.11.046. PMID:23312230.
Hamamah S., Seguin F., Bujan L., Barthelemy C., Mieusset R., Lansac J.:
Quantification by magnetic resonance spectroscopy of metabolites in seminal
plasma able to differentiate different forms of azoospermia. Hum Reprod.
1998, 13, 132–135. PMID: 9512244.
Handelsman D.J., Cooper T.G.: Foreword to semen analysis in 21st century
medicine special issue in Asian Journal of Andrology. 2010. Asian J Androl.
2010a, 12, 7–10. DOI: 10.1038/aja.2009.49. PMID: 20111074.
Handelsman D.J., Cooper T.G.: Afterword to semen analysis in 21st century
medicine special issue in Asian Journal of Andrology. 2010. Asian J Androl.
2010b, 12, 118–123. DOI: 10.1038/aja.2009.50. PMID: 20111092.
Henkel R., Müller C., Miska W., Gips H., Schill W.B.: Determination of the
acrosome reaction in human spermatozoa is predictive of fertilization in
vitro. Hum Reprod. 1993, 8, 2128–2132. PMID: 8150915.
Hosseinifar H., Gourabi H., Salekdeh G.H., Alikhani M, Mirshavaladi S.,
Sabbaghian M. et al.: Study of sperm protein profile in men with and without
varicocele using two-dimensional gel electrophoresis. Urology. 2013, 81,
296–300. DOI: 10.1016/j.urology.2012.06.027. PMID: 23374786.
Huszar G., Celik-Ozenci C., Cayli S., Zavaczki Z., Hansch E., Vigue L.: Hyaluronic
acid binding by human sperm indicates cellular maturity: viability and unreacted
acrosomal status. Fertil Steril. 2003, 79, 1616–1624. PMID: 12801568.
Huszar G., Ozkavukcu S., Jakab A., Celik-Ozenci C., Sati G.L., Cayli S.: Hyaluronic
acid binding ability of human sperm reflects cellular maturity and fertilizing
potential: selection of sperm for intracytoplasmic sperm injection.
Curr Opin Obstet Gynecol. 2006, 18, 260–267. DOI: 10.1097/01.
gco.0000193018.98061.2f. PMID: 16735824.
Hwang K., Weedin J.W., Lamb D.J.: The use of fluorescent in situ hybridization
in male infertility. Ther Adv Urol. 2010, 2(4), 157–169. DOI:
10.1177/1756287210373758. PMID: 21789092.
Intasqui P., Camargo M., Del Giudice P.R., Spaine DM., Carvalho V.M.,
Cardozo K.H. et al.: Unraveleing sperm proteome and post genomic pathways
associated with sperm nuclear DNA fragmentation. J Assist Genet.
2013, 30, 1187–1202. DOI: 10.1007/s10815-013-0054-6. PMID: 23893156.
Jamil K., White G.: Induction of the acrosome reaction with ionophore A23187
and calcium. Arch Androl. 1981, 7, 283–292. PMID: 6797354.
Jequier A.M.: Is quality assurance in semen analysis still really necessary? A
clinician’s viewpoint. Hum Reprod. 2005, 20, 2039–2042. PMID: 15845596.
Jequier A.M.: Semen analysis: a new manual and its application to the understanding
of semen and its pathology. Asian J Androl. 2010, 12, 11–13. DOI:
10.1038/aja.2009.12. PMID: 20111075.
Kashou A.H., Benjamin D.J., Agarwal A., du Plessis S.S.: The advent of sperm proteomics
has arrived. TORSJ, 2011, 4. DOI: 10.2174/1874255601103010092.
Keel B.A., Sternbridge T.W., Pineda G., Serafy N.T.Sr.: Lack of standardization
in performance of the semen analysis among laboratories in the United
States. Fertil Steril. 2002, 78, 603–608. PMID: 12215340.
Kothari S., Thompson A., Agarwal A., du Plessis S.S.: Free radicals: their beneficial
and detrimental effects on sperm function. Indian J Exp Biol. 2010,
48, 425–435. PMID: 20795359.
Lackner J.E., Agarwal A., Mahfouz R., du Plessis S.S., Schatzl G.: The association
between leukocytes and sperm quality is concentration dependent.
Reprod Biol Endocrinol. 2010, 8, 12. DOI: 10.1186/1477-7827-8-12.
PMID: 20137070.
Lampiao F., Strijdom H., du Plessis S.S.: Direct nitric oxide measurement in
human spermatozoa: flow cytometric analysis using the fluorescent probe,
diaminofluorescein. Int J Androl. 2006a, 29, 564–567. DOI: 10.1111/j.1365-
2605.2006.00695.x. PMID: 16968498
Lampiao F., Strijdom H., du Plessis S.S.: Reactive oxygen species measurement
in human spermatozoa by flow cytometry using the fluorescent probe,
2,7-dichlorofluorescein-diacetate (DCFH-DA). Med Tech SA. 2006b, 20, 7–8.
Leushuis E., van der Steeg J.W., Steures P., Repping S., Bossuyt P.M.,
Blankenstein M.A. et al.: Reproducibility and reliability of repeated semen
analysis in male partners of subfertile couples. Fertil Steril. 2010, 94, 2631–
2635. PMID: 20434148.
DOI: 10.1016/j.fertnstert.2010.03.021.
Lewis S.E.M.: Is sperm evaluation useful in predicting human fertility?
Reprod. 2007, 134, 31–40. DOI: 10.1530/REP-07-0152. PMID: 17641086.
Lu J.C., Zhang H.Y., Hu Y.A., Huang Y.F., Lü N.Q.: A survey on the status
of semen analysis in 118 laboratories in China. Asian J Androl. 2010, 12,
104–110. PMID: 19234484.
DOI: 10.1038/aja.2008.41.
Lu W.H, Gu I.Q.: Insights into semen analysis: a Chinese perspective on
the fifth edition of the WHO laboratory manual for the examination and
processing of human semen. Asian J Androl. 2010, 12, 605–606. DOI:
10.1038/aja.2010.36. PMID: 20543855.
Mahfouz R.Z., du Plessis S.S., Aziz N., Sharma R., Sabanegh E., Agarwal A.:
Sperm viability, apoptosis, and intracellular reactive oxygen species levels
in human spermatozoa before and after induction of oxidative stress.
Fertil Steril. 2010, 93, 814–821. DOI: 10.1016/j.fertnstert.2008.10.068.
PMID: 19100530.
Maree L., du Plessis S.S., Menkveld R., van der Horst G.: Morphometric
dimensions of the human sperm head depend on the staining method
used. Hum. Reprod. 2010, 25, 1369–1382 DOI: 10.1093/humrep/deq075.
PMID: 20400771.
Maree L., van der Horst G.: Quantification and identification of sperm subpopulations
using computer-aided sperm analysis and species-specific cutoff
values for swimming speed. Biotechnic & Histochem. 2013, 88, 181–193.
DOI: 10.3109/10520295.2012.757366. PMID: 23331185.
de Mateo S., Martines-Heredia J., Estanyol J.M., Dominguez-Fandos D., Vidal-
Taboada J.M., Ballesca J.L. et al.: Marked correlations in protein expression
identified by proteomic analysis of human spermatozoa. Proteomics. 2007,
7, 4264–4277. DOI: 10.1002/pmic.200700521. PMID: 18040982.
Mayorga-Torres B.J., Camargo M., Agarwal A., du Plessis S.S., Cadavid Á.P.,
Cardona Maya W.D.: Influence of ejaculation frequency on seminal parameters.
Reprod Biol Endocrinol. 2015, 13, 1–7. DOI: 10.1186/s12958-015-
0045-9. PMID: 25994017.
Mayorga-Torres B.J., Camargo M., Cadavid A.P., du Plessis S.S., Cardona Maya
W.D.: Are oxidative stress markers associated with unexplained male infertility.
Andrologia. 2017, 49. DOI: 10.1111/and.12659. PMID: 27506165.
McPartlin L.A., Suarez S.S., Czaya C.A., Hinrichs K., Bedford-Guaus S.J.:
Hyperactivation of stallion sperm is required for successful in vitro fertilization
of equine oocytes. Biol Reprod. 2009, 81, 199–206. DOI: 10.1095/
biolreprod.108.074880. PMID: 19208544.
Mortimer D.: Practical Laboratory Andrology. Oxford University Press,
Oxfords, 1994. DNLM/DLC for Library of Congress 92-48921
Mortimer S.T.: A critical review of the physiological importance and analysis
of sperm movement in mammals. Hum Reprod Update. 1997, 3, 403–
439. PMID: 9528908.
Mortimer D., Mortimer S.: Computer-Aided Sperm Analysis (CASA) of Sperm
Motility and Hyperactivation. Douglas T. Carrell and Kenneth I. Aston (eds.)
Springer, Spermatogenesis: Methods and Protocols, Methods in Molecular
Biology. 2013, 927, 77–88. DOI: 10.1007/978-1-62703-038-0_8.
Mortimer S.T., van der Horst G., Mortimer D.: The future of computer-aided
sperm analysis. Asian J Androl. 2015, 17, 545–553. DOI: 10.4103/1008-
682X.154312. PMID: 25926614.
Nasr-Esfahani M.H., Razavi S., Tavalaee M.: Failed fertilization after ICSI
and spermiogenic defects. Fertil Steril. 2008, 89, 892–900. DOI: 10.1016/j.
fertnstert.2007.04.012. PMID: 17583699.
Oehninger S., Franken D.R., Ombelet W.: Sperm functional tests. Fertil Steril.
2014, 102, 1528–1561. DOI: 10.1016/j.fertnstert.2014.09.044. PMID:
25450304.
Oehninger S., Franken D.R., Sayed E.M., Barosso G., Kohm P.: Sperm function and
assays and their predictive value for fertilization outcome in IVF therapy: a
meta analysis. Hum Reprod Update. 2000, 6, 1160–1168. PMID: 10782574.
Ola B., Afnan M., Papaioannou S., Sharif K., Bjorndahl L., Coomarasamy A.:
Accuracy of sperm–cervical mucus penetration tests in evaluating sperm
motility in semen: a systematic quantitative review. Hum Reprod. 2003,
18, 1037–1046. DOI: 10.1093/humrep/deg209.
Pacey A.A.: Is quality assurance in semen analysis still really necessary?
A view from the andrology laboratory. Hum Reprod. 2006, 21, 1105–1109.
DOI: 10.1093/humrep/dei460. PMID: 16396933.
Pacey A.A.: Quality assurance and quality control in laboratory andrology.
Asian J Androl. 2010, 12, 21–25. DOI: 10.1038/aja.2009.16. PMID: 20111077.
Paiva C., Amaral A., Rodriguez M., Canyellas N., Correig X., Ballescà J.L. et al.:
Identification of endogenous metabolites in human sperm cells using proton
nuclear magnetic resonance (H-NMR) spectroscopy and gas chromatography-
mass spectrometry (GC-MS). Androl. 2015, 3, 496–505. DOI:
10.1111/andr.12027. PMID: 25854681.
Pampiglione J.S., Tan S.L., Campbell S.: The use of the stimulated acrosome
reaction test as a test of fertilizing ability in human spermatozoa. Fertil
Steril. 1993, 59, 1280–1284. PMID: 8495778.
du Plessis S.S., Agarwal A., Halabi J., Tvrda E.: Contemporary evidence on the
physiological role of reactive oxygen species in human J Assist Reprod Genet.
2015, 32, 509–520. DOI: 10.1007/s10815-014-0425-7. PMID: 25646893.
du Plessis S.S., Kashou A.H., Benjamin D.J., Yadav S.P., Agarwal A.: Proteomics:
a subcellular look at spermatozoa. Reprod Biol Endocrinol. 2011, 9, 36–48.
DOI: 10.1186/1477-7827-9-36. PMID: 21426553.
du Plessis S.S., Makker K., Desai N.R., Agarwal A.: Impact of oxidative
stress on IVF. Expert Rev Obstet Gynecol. 2008, 3, 539–554. DOI:
10.1586/17474108.3.4.53.
du Plessis S.S., McAllister D.A., Luu A., Savia J., Agarwal A., Lampiao F.: Effects
of H2O2 exposure on human sperm motility parameters, reactive oxygen
species levels and nitric oxide levels. Andrologia. 2010, 42, 206–210. DOI:
10.1111/j.1439-0272.2009.00980.x
Practice Committee of the American Society for Reproductive Medicine: The clinical
utility of sperm DNA integrity testing: a guideline. Fertil Steril. 2013,
99(3), 673–677. DOI: 10.1016/j.fertnstert.2012.12.049. PMID: 23391408.
Practice Committee of the American Society for Reproductive Medicine: Diagnostic
evaluation of the infertile male: a committee opinion. Fertil Steril. 2015,
103, 18–25. DOI: 10.1016/j.fertnstert.2014.12.103. PMID: 25597249.
Prinosilova P., Kruger T., Sati L., Ozkavukcu S., Vigue L., Kovanci E. et al.:
Selectivity of hyaluronic acid binding for spermatozoa with normal
Tygerberg strict morphology. Reprod Biomed Online. 2009, 18, 177–260.
PMID: 19192336.
Riddel D., Pacey A., Whittington K.: Lack of compliance by UK andrology laboratories
with World Health Organization recommendations for sperm morphology
assessment. Hum Reprod. 2005, 20, 3441–3446. DOI: 10.1093/humrep/dei230. PMID: 16055460.
Sengupta P., Borges E Jr., Dutta S., Krajewska-Kulak E.: Decline in sperm count
in European men during the past 50 years. Hum Exp Toxicol. 2017. DOI:
10.1177/0960327117703690. PMID: 28413887.
Sharma R., Agarwal A., Mohanty G., du Plessis S.S., Gopalan B., Willard B. et al.:
Proteomic analysis of seminal fluid from men exhibiting oxidative stress.
Reprod Biol Endocrinol. 2013a, 11, 85–105. DOI: 10.1186/1477-7827-11-
85. PMID: 24004880.
Sharma R., Agarwal A., Mohanty G., Hamada AJ., Gopalan B., Wilard B., et al.:
Proteomic analysis of human spermatozoa proteins with oxidative stress.
Reprod. Biol. Endocrinol. 2013b, 11, 48–66. DOI: 10.1186/1477-7827-11-
48. PMID: 23688036.
Sharma R., Agarwal A., Mohanty G., Jesudasan R., Gopalan B., Willard B., et al.:
Functional proteomics of seminal plasma proteins in men with various semen
parameters. Reprod Biol Endocrinol. 2013c, 11, 38–58. PMID: 23663294.
DOI: 10.1186/1477-7827-11-38.
Sadeghi M.R.: The New 2010 WHO Manual and the Need to Address some
Related Dilemmas (Editorial). J Reprod Infertil. 2010, 11, 159. PMCID:
PMC3719300. PMID: 23926483.
Talbot P., Chacon R.: A triple-stain technique for evaluating normal acrosome
reactions of human sperm. J. Exp Zool. 1981, 218, 201–208. DOI:10.1002/
jez.1402150210. PMID: 6168732.
Tamburrino L., Marchiani S., Vicini E., Muciaccia B., Cambi M., Pellegrini S.,
Forti G., Muratori M., Baldi E.: Quantification of CatSper1 expression in
human spermatozoa and relation to functional parameters. Hum Reprod.
2015, 30, 1532–1544. DOI: 10.1093/humrep/dev103. PMID: 25983333.
Tremellen K.: Oxidative stress and male infertility – a clinical perspective.
Hum Reprod. Update. 2008, 14, 243–258. DOI: 10.1093/humupd/dmn004.
PMID: 18281241.
Talarczyk-Desole J., Berger A., Taszarek-Hauke G., Hauke J., Pawelczyk L.,
Jedrzejczak P.: Manual vs. Computer-Assisted Sperm Analysis: can CASA
replace manual assessment of human semen in clinical practice? Ginekologia
Polska. 2017, 88, 52–56. DOI: 10.5603/GP.a2017.0012. PMID: 28326513.
van der Horst G., Maree L.: SpermBlue®: a new universal stain for human
and animal sperm which is also amenable to sperm morphology analysis.
Biotech Histochem. 2009, 84, 299–308. DOI: 10.3109/10520290902984274.
PMID: 19488904.
van der Horst G.: Standardization of semen analysis for humans. http://
www.micropticsl.com/standardization-of-semen-analysis-for-humans/
2016 (Visited 10 April 2017).
Vasan S.S.: Semen analysis and sperm function tests: How much to test? Indian
J Urol. 2011, 27, 41–48. DOI:10.4103/0970-1591.78424. PMID:21716889.
Walczak-Jedrzejowska R., Marchlewska K., Oszukowska E., Filipiak E., Bergier L.,
Slowikowska-Hilczer J.: Semen analysis standardization: is there any problem
in Polish laboratories? Asian J Androl. 2013, 15, 616–621. DOI: 10.1038/
aja.2013.48. Epub 2013 Jul 1. PMID: 23817502
World Health Organization. WHO Laboratory Manual for the Examination of
Human Semen and Sperm-cervical Mucus Interaction, 3rd ed. Cambridge, UK:
Cambridge University Press; 1992.
World Health Organization. WHO Laboratory Manual for the Examination of
Human Semen and Sperm-cervical Mucus Interaction, 4th ed. Cambridge, UK:
Cambridge University Press; 1999.
World Health Organization. WHO Laboratory Manual for the Examination and
Processing of Human Semen, 5th ed. Geneva: World Health Organization; 2010.
Worrilow K.C., Eid S., Woodhouse D., Perloe M., Smith S., Witmyer J. et al.:
Use of hyaluronan in the selection of sperm for intracytoplasmic sperm
injection (ICSI): significant improvement in clinical outcomes-multicenter,
double-blinded and randomized controlled trial. Hum Reprod. 2013, 28,
306–320. DOI: 10.1093/humrep/des417.
Ye H., Huang G.N., Gao Y., Liu D.Y.: Relationship between human spermhyaluronan
binding assay and fertilization rate in conventional in vitro
fertilization. Hum Reprod. 2006, 21, 1545–1550. DOI:10.1093/humrep/
del008. PMID: 16595551.
Yanagimachi R.: In vitro capacitation of hamster spermatozoa by follicular
fluid. J Reprod Fert. 1969, 18, 275–286. PMID: 5815307.
Yildirim M., Duvan C.I., Pekel A., Ayrim A., Kafali H.: Can Hyaluronan Binding
Assay Predict the Outcome of Intrauterine Insemination in Couples with
Unexplained or Mild Male Factor Infertility? J Reprod Infertil. 2015, 16,
18–23. PMID: 25717431.
Zeginiadou T., Papadimas J., Mantalenakis S.: Acrosome reaction: methods
for detection and clinical significance Andrologia, 2000, 32, 6, 335–343.
PMID: 11131842.
Zhang X., Diao R., Zhu X., Li Z., Cai Z.: Metabolic characterization of asthenozoospermia
using nontargeted seminal plasma metabolomics. Clin
Chim Acta. 2015, 450, 254–261. DOI: 10.1016/j.cca.2015.09.001. PMID:
26342261.
Zhao C., Huo R., Wang F.Q., Lin M., Zhou ZM., Sha J.H.: Identification of several
proteins involved in regulation of sperm motility by proteomic analysis.
Fertil Steril. 2007, 87, 436–438. DOI: 10.1016/j.fertnstert.2006.06.057.
PMID: 17074334.
Zhou X., Wang Y., Yun Y., Xia Z., Lu H., Luo J., Liang Y.: A potential tool for diagnosis
of male infertility: Plasma metabolomics based on GC-MS. Talanta.
2016, 147, 82–91. DOI: 10.1016/j.talanta.2015.09.040. PMID: 26592580.
AZOOSPERMIA – PRZYCZYNY, DIAGNOSTYKA, LECZENIE AZOOSPERMIA – CAUSES, DIAGNOSTICS, TREATMENT
Agnieszka Cegłowska1, Jolanta Słowikowska-Hilczer2
1Klinika Endokrynologii Ginekologicznej, Szpital Kliniczny im. Ks. Anny Mazowieckiej, ul. Karowa 2, 00-315 Warszawa
2Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi,
ul. S. Sterlinga 5, 91-425 Łódź
Autor do korespondencji/corresponding author: Jolanta Słowikowska-Hilczer, Zakład Endokrynologii Płodności, Katedra
Andrologii i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. S. Sterlinga 5, 91-425 Łódź;
jolanta.slowikowska-hilczer@umed.lodz.pl
Otrzymano/received: 21.12.2016 r. Zaakceptowano/accepted: 15.03.2017 r.
Agnieszka Cegłowska – dr n. med., absolwentka Akademii Medycznej w Łodzi, lekarz specjalista
ginekologii i położnictwa, w trakcie specjalizacji z endokrynologii i szkolenia andrologicznego,
lekarz Kliniki Endokrynologii Ginekologicznej Klinicznego Szpitala im. Ks. Anny Mazowieckiej
w Warszawie; członek Europejskiego Towarzystwa Medycyny Rozrodu i Embriologii, Polskiego
Towarzystwa Medycyny Rozrodu i Embriologii oraz Polskiego Towarzystwa Andrologicznego;
pierwszy autor i współautor 10 cytowanych publikacji naukowych z zakresu ginekologii, położnictwa
i endokrynologii. Praca zawodowa i naukowa autorki związana jest z badaniami nad kobiecą i męską
niepłodnością.
Agnieszka Cegłowska – MD, graduate of the Medical University of Lodz, specialist of gynecology and obstetrics, in
the course of specialization of endocynology and andrology; works in Department of Gynacological Endocrynology
in Clinical Hospital of Duchess of Mazovia in Warsow; fellow of European Society of Human Reproduction and
Embryology, Polish Society of Reproduction Medicine and Embryology and Polish Society of Andrology; the first author
and co-author of 10 quoted publications in the field of gynecology, obstetrics and endocrinology. Her professional
and scientific work is associated with female and male infertility.
Streszczenie
Azoospermia to brak plemników w ejakulacie, również w osadzie pozostałym po jego odwirowaniu. Jest istotną przyczyną męskiej niepłodności.
Pod względem przyczyn, diagnostyki i sposobu leczenia wyróżnia się azoospermię nieobturacyjną (60%) oraz azoospermię
obturacyjną (40%). Leczenie operacyjne azoospermii obturacyjnej daje dużą szansę na uzyskanie ciąży, a w przypadku nieskuteczności
tego postępowania pozyskuje się plemniki z najądrza lub jądra w celu przeprowadzenia zapłodnienia pozaustrojowego. Leczenie
hormonalne w azoospermii nieobturacyjnej jest często nieskuteczne, a jedyną szansą na uzyskanie własnego biologicznie potomstwa
może być pozyskanie plemników dla procedury in vitro. Duże nadzieje wiąże się z wykorzystaniem nowych testów genetycznych w diagnostyce
przedkoncepcyjnej męskiej niepłodności oraz ocenie dziedziczenia zaburzeń u potomstwa.
Słowa kluczowe: jądra, nasienie, plemniki, niepłodność męska
Abstract
Azoospermia is the absence of sperm cells in the ejaculate, also in the sediment after spinning. It is a key reason of male infertility. In
terms of reasons, diagnostics and treatment methods obstructive azoospermia (40%) and nonobstructive azoospermia (60%) are recognized.
The operative treatment of obstructive azoospermia gives a big chance of pregnancy, but if it is non efficient the sperm cells
are aspirated from epididymis or testis for in vitro fertilization. The hormonal treatment in nonobstructive azoospermia is often ineffective,
but the only chance to have biologically own offspring may be sperm retrieval for in vitro fertilization. Hopefully new genetic
tests can help in preconceptional diagnostics of male infertility and in assessment of inheritance of these abnormalities in offspring.
Key words: testes, ejaculate, spermatozoa, male infertility
Skróty / Abbreviations
ART – metoda rozrodu wspomaganego medycznie (ang. assisted reproductive technique), AZF – czynnik ulegający delecji w azoospermii
(ang. azoospermia factor), CBAVD – wrodzony obustronny brak nasieniowodów (ang. congenital bilateral absence of the vas deferens), CFTR –
regulator przewodnictwa przezbłonowego w zwłóknieniu torbielowatym (ang. cystic fibrosis transmembrane conductance regulator), CGH –
porównawcza hybrydyzacja genomowa (ang. comparative genomic hybridization), CNV – warianty liczby kopii genów (ang. copy number
variation), CIS – rak in situ (łac. carcinoma in situ), CUAVD – wrodzony jednostronny brak nasieniowodów (ang. congenital uniateral absence
of the vas deferens), EDO – niedrożność przewodu wytryskowego (ang. ejaculatory duct obstruction), FGF8 – gen kodujący czynnik wzrostu
fibroblastów 8 (ang. fibroblast growth factor 8 gene), FGFR1 – gen kodujący receptor typu 1 dla czynnika wzrostu fibroblastów (ang. fibroblast
growth factor receptor 1 gene), FSH – hormon folikulotropowy (ang. follicle-stimulating hormone), GCNIS – nowotwór z komórek płciowych
in situ (ang. germ cell neoplasia in situ), GCT – inwazyjny nowotwór z komórek płciowych (ang. germ cell tumor), hCG – ludzka gonadotropina
kosmówkowa (ang. human chorionic gonadotropin), hMG – ludzka gonadotropina menopauzalna (ang. human menopausal gonadotropin),
ICSI – wstrzyknięcie plemnika do cytoplazmy komórki jajowej (ang. intracytoplasmic sperm injection), IHH – idiopatyczny hipogonadyzm
hipogonadotropowy (ang. idiopathic hypogonadotropic hypogonadism), IVF – zapłodnienie pozaustrojowe (ang. in vitro fertilization), KAL1 –
gen kodujący białko anosminę 1 (ang. anosmin-1 gene), LH – hormon luteinizujący (ang. luteinizing hormone), MESA – mikrochirurgiczna
aspiracja plemników z najądrzy (ang. microsurgical epididymal sperm aspiration), mRNA – matrycowy RNA (ang. messenger RNA), miRNA –
mikroRNA (ang. microRNA), NAG – obojętna α-glukozydaza (ang. neutral α-glucosidase), NOA – azoospermia nieobturacyjna (ang. nonobstructive
azoospermia), OA – azoospermia obturacyjna (ang. obstructive azoospermia), PESA – przezskórna aspiracja plemników z najądrzy
(ang. percutaneous epididymal sperm aspiration), piRNA – niekodujące cząsteczki RNA tworzące kompleksy z białkami piwi (ang. piwi-interacting
RNA), SNP – polimorfizm pojedynczego nukleotydu (ang. single nucleotide polymorphism), SCO – zespół samych komórek Sertolego
(ang. Sertoli cell only syndrome), sncRNA – małe niekodujące RNA (ang. small non-coding RNA), T – testosterone, TESA – przezskórna
aspiracja
plemników z jąder i najądrzy (ang. testicular epididymal sperm aspiration), TESE – pobranie plemników z jąder (ang. testicular sperm extraction),
TRUS – ultrasonografia przezodbytnicza (ang. transrectal ultrasound), TURED – przezcewkowe wycięcie ujść przewodów wytryskowych
(ang. transurethral resection of the ejaculatory ducts), USG – ultrasonografia (ang. ultrasonography), WHO – Światowa Organizacja Zdrowia
(ang. World Health Organization), YCMD – mikrodelecje chromosomu Y (ang. Y chromosome microdeletions)
Definicja.
Według nomenklatury Światowej Organizacji
Zdrowia (WHO, ang. World Health Organization) terminem
„azoospermia” określa się brak plemników w ejakulacie,
również w osadzie pozostałym po jego odwirowaniu
(15 min, 3000 g)
(WHO, 2010).
Inne podobne
określenie nomenklaturowe to „aspermia”, które dotyczy
braku ejakulatu np. z powodu braku ejakulacji, ejakulacji
wstecznej, zablokowania dróg wyprowadzających
nasienie. Z kolei „kryptozoospermia” oznacza brak plemników
w preparatach bezpośrednich z nasienia, dopiero
po odwirowaniu ejakulatu, stwierdza się ich obecność.
Klasyfikacja.
Klasyfikacja
przyczyn męskiej niepłodności
na przedjądrowe, jądrowe i pozajądrowe odzwierciedla
także przyczyny azoospermii
(Kula i Słowikowska- Hilczer, 2016).
Jako bardziej praktyczny przyjęto podział
azoospermii na dwie grupy różniące się etiologią, diagnostyką
i sposobem leczenia
(Adamopoulos i wsp., 2010;).
(Tüttelmann i Nieschlag, 2010;).
(Wosnitzer i wsp., 2014).
yy azoospermię obturacyjną – związaną z niedrożnością
przewodów wyprowadzających plemniki (OA,
ang. obstructive azoospermia),
yy azoospermię nieobturacyjną, zwaną także sekrecyjną
– niezwiązaną z niedrożnością przewodów
wyprowadzających plemniki (NOA, ang. nonobstructive
azoospermia).
Azoospermia obturacyjna
Etiologia. Azoospermia obturacyjna stanowi 7–51% przypadków
azoospermii i jest spowodowana niedrożnością
dróg wyprowadzających plemniki od sieci jądra do cewki
moczowej
(Jarvi i wsp., 2010; Oszukowska i wsp., 2016).
(Jarvi i wsp., 2010;).
(Oszukowska i wsp., 2016).
Najczęstszymi przyczynami są jatrogenne następstwa
zabiegów operacyjnych lub diagnostycznych na nasieniowodach
(wazektomia, operacje przepukliny pachwinowej,
niepoprawnie wykonana wazografia) lub najądrzu,
np. mikrochirurgiczna aspiracja plemników z najądrzy
(MESA, ang. microsurgical epididymal sperm aspiration),
przezskórna aspiracja plemników z najądrzy (PESA, ang.
percutaneous epididymal sperm aspiration) i hydrocelektomia.
Rzadszymi przyczynami są wady genetyczne,
np. wrodzony obustronny brak nasieniowodów (CBAVD,
ang. congenital bilateral absence of the vas deferens), będący
następstwem mutacji genu odpowiedzialnego za przewodnictwo
przezbłonowe w zwłóknieniu torbielowatym
(CFTR, ang. cystic fibrosis transmembrane conductance regulator),
na długim ramieniu chromosomu 7, całkowity
lub częściowy brak najądrzy, niedrożność przewodu
wytryskowego (EDO, ang. ejaculatory duct obstruction).
Czynnikiem powodującym OA może być również zapalenie
narządów męskiego układu moczowo-płciowego
o różnej etiologii
(Filipiak i wsp., 2015;).
(Weidner i wsp., 2010).
Diagnostyka. Badaniem fizykalnym stwierdza się prawidłowej
wielkości i konsystencji jądra oraz często twarde,
tkliwe najądrza. Diagnostyka endokrynologiczna wskazuje
na prawidłowe stężenia gonadotropin: hormonu
folikulotropowego (FSH, ang. follicle-stimulating hormone,
hormon folikulotropowy, folikulina) i luteinizującego
(LH, ang. luteinizing hormone, hormon luteotropowy),
testosteronu i inhibiny B, co potwierdza niezakłóconą
aktywność osi sprzężenia zwrotnego podwzgórze-przysadka-
jądra
(Andersson i wsp., 2004).
(Behre i wsp., 2010;).
( Simoni i Nieschlag, 2010;).
(Sochaj, 2015).
(tabela 1). Ważnym badaniem jest ocena aktywności obojętnej
α-glukozydazy (NAG, ang. neutral α-glucosidase)
w plazmie nasienia (norma ≥20 IU/ejakulat)
(Cooper i wsp., 2010;).
(Dohle, 2010;).
(Yeung i Cooper, 2010;).
(WHO,2010).
Obniżenie aktywności NAG może wskazywać
na niedrożność przewodów najądrza i nasieniowodów.
Rozpoznanie CBAVD wymaga uzupełnienia diagnostyki
o ocenę mutacji genu CFTR
(Celep i wsp., 2006;).
(Krausz, 2010;).
(Simoni i Wieacker, 2010;).
(Song i wsp., 2016).
(rycina 1,
tabela 2). Uzupełnienie diagnostyki o badanie ultrasonograficzne
(USG, ang. ultrasonography) przezmosznowe lub
przezodbytnicze (TRUS, ang. transrectal ultrasonography)

 pozwoli ocenić budowę anatomiczną najądrzy, prostaty
i pęcherzyków nasiennych
(Behre i Zitzmann, 2010;).
(Fisch i wsp., 2006;).
(Isidori i Lenzi, 2008). ).
Biopsja jądra chirurgiczna
(otwarta) lub gruboigłowa (przezskórna) i badanie
histopatologiczne wycinka to najlepsze, ale ostateczne
metody oceny struktury jądra i stanu nabłonka plemnikotwórczego.
Jest ona polecana w przypadku możliwej
obecności plemników w jądrach i akceptacji ich
wykorzystania do metod rozrodu wspomaganego
medycznie (ART, ang. assisted reproductive technique)
przez niepłodną parę
(Deja, 2009;). ).
(Dohle i wsp., 2012). ).
Terapia.
pozwoli ocenić budowę anatomiczną najądrzy, prostaty
i pęcherzyków nasiennych
(Behre i Zitzmann, 2010;).
(Fisch i wsp., 2006;).
(Isidori i Lenzi, 2008). ).
Biopsja jądra chirurgiczna
(otwarta) lub gruboigłowa (przezskórna) i badanie
histopatologiczne wycinka to najlepsze, ale ostateczne
metody oceny struktury jądra i stanu nabłonka plemnikotwórczego.
Jest ona polecana w przypadku możliwej
obecności plemników w jądrach i akceptacji ich
wykorzystania do metod rozrodu wspomaganego
medycznie (ART, ang. assisted reproductive technique)
przez niepłodną parę
(Deja, 2009;). ).
(Dohle i wsp., 2012). ).
Terapia.
Leczenie OA jest zwykle leczeniem operacyjnym
obejmującym mikrochirurgiczną rekonstrukcję przewodów
wyprowadzających plemniki (vasovasostomia
lub vasoepididymostomia) z możliwym pozyskaniem
plemników do zapłodnienie pozaustrojowego (IVF, ang.
in vitro fertilization), również na wypadek nieskutecznej
operacji. Efektywność operacji rekonstrukcyjnych szacowana
jest obecnie dla vasovasostomii na 70–95,5% uzyskania
drożności i 36–92% uzyskania ciąży, a dla vasoepididymostomii
na 30–90% uzyskania drożności i 20–50%
uzyskania ciąży
(Engelmann i Gralla, 2010; ).
(Wostnizer i wsp., 2014 ).
Inna technika operacyjna stosowana w przypadku
EDO polega na przezcewkowym wycięciu ujść przewodów
wytryskowych (resekcja wzgórka nasiennego) (TURED,
ang. transurethral resection of the ejaculatory ducts), która
może być uzupełniona pozyskaniem plemników do IVF.
U pacjentów z CBAVD lub takich, u których nie udaje
się przywrócić drożności przewodów wyprowadzających
plemniki, leczeniem z wyboru jest MESA lub przezskórna
aspiracja plemników z jąder i najądrzy (TESA,
ang. testicular epididymal sperm aspiration) w celu przeprowadzenia
procedury zapłodnienia pozaustrojowego:
IVF lub wstrzyknięcie plemnika do cytoplazmy komórki
jajowej (ICSI, ang. intracytoplasmic sperm injection). Wyniki
uzyskania ciąż po zastosowaniu plemników świeżych lub
mrożonych pobranych z najądrza lub jądra są porównywalne
(van Wely i wsp., 2015).
Azoospermia nieobturacyjna
Etiologia. Azoospermia nieobstrukcyjna stanowi 60%
przyczyn azoospermii i jest spowodowana pierwotnym
lub wtórnym uszkodzeniem czynności jąder
(Kula i Słowikowska-Hilczer, 2016).
Przyczyny NOA dzieli się na:
yy przedjądrowe – genetyczne, np. zespół Kallmana, wrodzona
niedoczynność przysadki, i nabyte, np. nowotwory
okolicy podwzgórzowo-przysadkowej, zapalenia,
urazy, naświetlania ośrodkowego układu nerwowego,
hiperprolaktynemia,
yy jądrowe – genetyczne, np. zespół Klinefeltera, dysgenezja
jąder, mikrodelecje regionu AZF (ang. azoospermic
factor) chromosomu Y, niewrażliwość na
androgeny, i nabyte będące następstwem działania
chorób, np. nowotwory, zapalenia, urazy jąder, oraz
czynników fizycznych i chemicznych uszkadzających
jądra, np. zwiększona temperatura, radio- i chemioterapia,
niektóre leki, ksenoestrogeny.
Diagnostyka.
Dla różnicowania przyczyn NOA istotne
są wyniki badań hormonalnych oraz pomiarów wielkości
jąder. W uszkodzeniu pierwotnym jąder podwyższone
są stężenia FSH i LH (>8 IU/L) i obniżone stężenie
inhibiny B (<100 ng/mL) we krwi, a wielkość jąder jest
poniżej dolnej granicy normy (<12 mL) (tabela 1). We
wtórnym zaburzeniu czynności jąder niskie stężenia FSH
i LH (<1 IU/L) oraz małe jądra. W postaci niekompletnej
można stwierdzić zwiększone stężenie FSH z prawidłową
objętością jąder lub prawidłowe stężenie FSH z małymi
jądrami albo prawidłowe FSH z prawidłową objętością
jąder
(Andersson i wsp., 2004;).
(Behre i wsp., 2010; ).
(Kula i Słowikowska-Hilczer, 2016;).
(Simoni i Nieschlag,
2010; ).
(Sochaj, 2015;).
(Wosnitzer i wsp., 2014).
(Forti i wsp., 2010;).
W badaniu histopatologicznym bioptatów z jąder
z NOA stwierdza się:
yy hipospermatogenezę – znacznie zmniejszona liczebność
komórek spermatogenezy i pojedyncze plemniki,
yy zatrzymanie dojrzewania komórek spermatogenezy
(ang. spermatogenesis maturation arrest) na różnych
etapach rozwoju (spermatogonii, spermatocytów,
spermatyd) (rycina 2),
yy zespół samych komórek Sertolego (SCO, ang. Sertoli
cell only syndrome) – brak jest komórek płciowych
(rycina 3),
yy niedojrzałość struktury jądra – kanaliki plemnikotwórcze
o zmniejszonej średnicy, bez światła, zawierające
komórki początkowych etapów spermatogenezy
i niedojrzałe komórki Sertolego, przestrzenie międzykanalikowe
są małe, brak jest komórek Leydiga
(rycina 4),
yy dysgenezję struktury jądra – kanaliki plemnikotwórcze
o zmniejszonej średnicy, w obrębie światła
częste są tzw. ciała hialinowe, płodowe komórki
płciowe i spermatogonie oraz niedojrzałe komórki
Sertolego, przestrzenie międzykanalikowe są znacznie
poszerzone (rycina 5),
yy zanik kanalików plemnikotwórczych – zwłóknienie
błony kanalikowej, zanik nabłonka plemnikotwórczego,
a w ostatnim stadium całkowity brak nabłonka
i światła kanalików (tzw. cienie kanalikowe) (rycina 6),
yy nowotwór z komórek płciowych in situ (GCNIS, ang.
germ cell neoplasia in situ) – przetrwałe płodowe
komórki płciowe (tzw. gonocyty) zmienione nowotworowo
w kanalikach o zmniejszonej średnicy,
a w sąsiedztwie mogą się znajdować kanaliki o większej
średnicy z pełną spermatogenezą (rycina 7),
yy inwazyjny nowotwór z komórek płciowych (GCT,
ang. germ cell tumour) – nasieniaki (łac. seminoma),
raki zarodkowe (łac. carcinoma embryonale), kosmówczaki
(łac. choriocarcinoma), potworniaki (łac. teratoma)
(rycina 8),
yy hipoplazję komórek Leydiga – w przestrzeniach międzykanalikowych
obecne tylko komórki fibroblastopodobne,
które są prekursorami komórek Leydiga,
yy hiperplazję komórek Leydiga – zwiększona liczebność
komórek Leydiga, miejscami mogą powstawać
mikrogruczolaki,
yy nowotwór z komórek Leydiga (łac. leydigioma) –
zwykle nowotwór łagodny,
yy mieszany obraz histologiczny.
Diagnostyka genetyczna NOA obejmuje najczęściej
wykonanie kariotypu i oceny mikrodelecji w długim
ramieniu chromosomu Y u pacjentów z niepłodnością
pierwotną, bez podejrzenia niedrożności dróg wyprowadzających
nasienie lub toksycznego uszkodzenia.
Ocena kariotypu pozwala na określenie liczbowych
i strukturalnych nieprawidłowości chromosomalnych,
które w NOA szacuje się na 19%
(Alhalabi i wsp., 2015)
(rycina 1, tabela 2). Najczęstszym zaburzeniem genetycznym
jest zespół Klinefeltera (w 80% z kariotypem
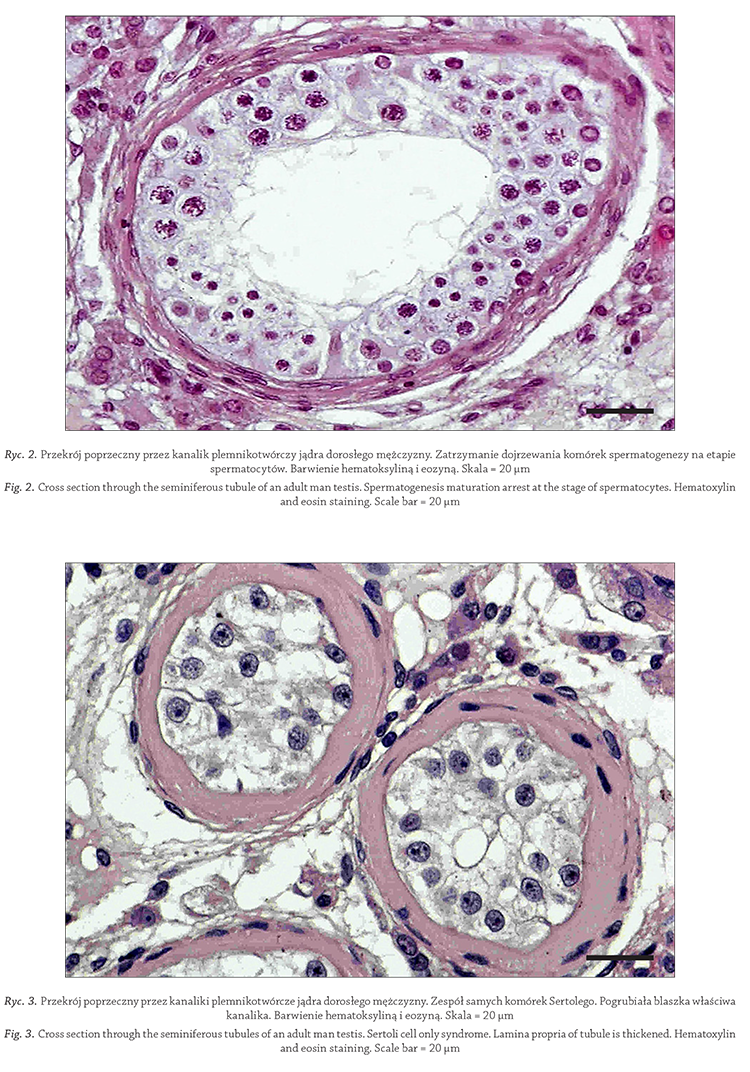



 47,XXY). Częstość występowania tego schorzenia określa
się na 1/500–1000 mężczyzn
(Nieschlag, 2013;)
(Purwin i Słowikowska-Hilczer, 2015)
Mutacje w regionie AZF na
długim ramieniu chromosomu Y stwierdzono u 10–20%
mężczyzn z azoospermią
(Fu i wsp., 2015;)
(Miyamoto i wsp., 2015;)
(Liu i wsp., 2016;)
(Wosnitzer, 2014)
Umiejscowienie
mutacji w określonym regionie AZF determinuje skuteczność
pozyskania plemników z biopsji oraz efektywność
uzyskania ciąż przy użyciu tak pobranych gamet
(Choi i wsp., 2004;)
(Liu i wsp., 2016)
Najlepsze wyniki uzyskuje
się u pacjentów z mikrodelecjami w rejonie AZFc. Męskie
potomstwo tych pacjentów dziedziczy te same nieprawidłowości
genetyczne co ich ojcowie i wykazuje podobne
zaburzenia płodności.
Trwają intensywne prace nad poszukiwaniem testów
genetycznych, które usprawniłyby diagnostykę i leczenie
NOA oraz ciężkiej oligozoospermii (rycina 1). Biorąc
pod uwagę fakt, iż spermatogeneza jest złożonym procesem
sterowanym wielogenowo (ponad 2000 genów)
oraz zależnym od działania czynników środowiskowych,
wydaje się, że zastosowanie w praktyce testów
genetycznych może mieć duże znaczenie w algorytmie
diagnostyczno-terapeutycznym. Duże nadzieje wiąże
się z wprowadzeniem do praktyki testów molekularnych
nasienia, takich jak:
yy analiza małych niekodujących RNA (sncRNA, ang.
small non-coding RNA), matrycowych RNA (mRNA,
ang. messenger RNA), mikro RNA (miRNA, ang. micro
RNA), niekodujących cząsteczek RNA tworzących
kompleksy z białkami piwi (piRNA, ang. piwi-interacting
RNA),
yy analiza modyfikacji epigenetycznych (modyfikacje
chemiczne w obrębie histonów i/lub protamin),
yy analiza produktów potranslacyjnej modyfikacji genów
i genów naprawy DNA (ang. DNA damage repair genes),
yy analiza polimorfizmów pojedynczego nukleotydu
(SNP, ang. single nucleotide polymorphism),
yy identyfikacja innych czynników zaburzających spermatogenezę.
Wymienione powyżej analizy różnią się rodzajem
i złożonością przekazywanej informacji oraz kosztami
(Bieniek i wsp., 2016; )
(2016; Hong i wsp.,2016;)
(Song i wsp., 2016)
(tabela 2).
Wstępne badania nowych testów diagnostyki
genetycznej prowadzone na modelu zwierzęcym napotykają
trudności w sytuacji ekstrapolowania ich zastosowania
u ludzi. Są jednak nadal niezbędnym i cennym
źródłem wiedzy
(Massart i wsp., 2012)
Terapia. Wydaje się, iż brak jest istotnej skuteczności
w leczeniu hormonalnym wszystkich pacjentów z NOA.
Próby podawania preparatów o działaniu antyestrogennym
(klomifen, tamoksyfen, inhibitory aromatazy)
i słabo działających androgenów (undecylenian testosteronu)
oraz preparatów ludzkiej gonadotropiny kosmówkowej
(hCG, ang. human chorionic gonadotropin) lub menopauzalnej
(hMG, ang. human menopausal gonadotropin),
a także preparatów czystego FSH i LH tylko w niektórych
przypadkach prowadzą do pojawienia się plemników
w nasieniu lub do zwiększenia liczebności dojrzałych
spermatyd w jądrach
(Ramasamy i wsp., 2009;)
(Reifsnyder
i wsp., 2012; )
( Rohayem i wsp., 2015)
Mechanizm działania
preparatów o działaniu antyestrogennym polega
na wyeliminowaniu hamującego wpływu estradiolu
na przysadkę, co powoduje zwiększenie wydzielania
gonadotropin pod warunkiem, że przysadka nie jest
uszkodzona. Podwyższone stężenia FSH i LH stymulują
spermatogenezę i biosyntezę testosteronu w jądrach.
Jednak zbyt mało jest badań klinicznych przeprowadzonych
na większych grupach pacjentów z NOA, aby
określić jednoznacznie wskazania do podawania tych
preparatów
(Anawalt, 2013; Chua i wsp., 2013; Koukkou i wsp., 2012).
(Anawalt, 2013; )
(Chua i wsp., 2013; )
(Koukkou i wsp., 2012)
Są one stosowane na razie poza zarejestrowanymi
wskazaniami (ang. off-label). Jedynym zarejestrowanym
wskazaniem do stosowania gonadotropin
u pacjentów z NOA jest hipogonadyzm hipogonadotropowy.
Substytucyjne podawanie jedynie preparatów
testosteronu prowadzi do zablokowania wydzielania
gonadotropin przez przysadkę, a tym samym do zatrzymania
czynności plemnikotwórczej i hormonalnej jąder,
nie poprawia więc płodności.
Leczenie operacyjne żylaków powrózków nasiennych
u pacjentów z NOA może usprawnić spermatogenezę
na drodze poprawy krążenia w obrębie jąder, obniżenia
stresu oksydacyjnego i zmniejszenia temperatury
w jądrach. Skuteczność tej metody ocenianej pojawieniem
się plemników w ejakulacje wynosi 22–55%
((Wostnitzer i wsp., 2014).)
Szacuje się, iż ogranicza ona wykonanie
zabiegu TESA i pobrania plemników z jąder (TESE, ang.
testicular sperm extraction) oraz procedury ICSI u 10–40%
mężczyzn
((Wostnitzer i wsp., 2014).)
Pozyskiwanie plemników lub spermatyd z jąder
i wykorzystanie ich do ICSI jest często jedynym możliwym
sposobem uzyskania własnego biologicznie
potomstwa przez pacjentów z NOA
(Świniarski, 2015)
(tabela 3). U mężczyzn z zespołem Klinefeltera plemniki
w nasieniu znajduje się w 10–50% przypadków
(Aksglaede i Juul, 2013; Ramasamy i wsp. 2009; Rohayem i wsp., 2015).
(Aksglaede i Juul, 2013;)
(Ramasamy i wsp. 2009; )
(Rohayem i wsp., 2015)
Zespół Klinefeltera jest najczęstszą genetyczną przyczyną
męskiej niepłodności i występuje u 11% mężczyzn z NOA
(Nieschlag, 2013).
Skuteczne naturalne zapłodnienie
plemnikami mężczyzny z kariotypem 47,XXY opisano
w 1982 roku
(Laron i wsp., 1982),
a za pomocą ICSI w 1997
roku
(Bourne i wsp., 1997).
U chłopców w okresie dojrzewania
płciowego lub młodych mężczyzn szansa na uzyskanie
plemników z jąder wydaje się największa, gdyż
wraz z wiekiem postępuje degeneracja kanalików jądra
i zanik nabłonka plemnikotwórczego
(Aksglaede i Juul,2013; ).
(Bryson i wsp., 2014; ).
(Damani i wsp., 2001).
(Ramasamy
i wsp., 2009;).
(Rohayem i wsp., 2015;).
(Scuriano i wsp., 2009).
Większość potomstwa mężczyzn z zespołem Klinefeltera
ma prawidłowy kariotyp
(Lanfranco i wsp., 2004;).
(Morel i wsp., 2003).
, ale ze względu na zwiększone ryzyko autosomalnych
aneuploidii w plemnikach (głównie trisomii
13, 18 i 21 pary chromosomów) istotna jest przedkoncepcyjna
i przedimlantacyjna diagnostyka genetyczna
(Nieschlag, 2013;).
(Purwin i Słowikowska-Hilczer, 2015).
Dysgenezja jąder może być różnie zaawansowana:
od całkowitego braku struktury jąder do nieznacznych
zaburzeń rozwoju kanalików plemnikotwórczych. Im
większy stopień zaburzenia, tym mniejsza szansa na istnienie
prawidłowej spermatogenezy, za to duże ryzyko
występowania GCT
(Rajpert-DeMeyts, 2006; ).
(Skakkebaek
i wsp., 2001; ).
(Słowikowska-Hilczer i wsp., 2007).
W przypadku
podejrzenia dysgenezji jąder takie gonady są
zwykle usuwane w okresie przeddojrzewaniowym jako
prewencja nowotworowa. Pozbawia się jednak te osoby
szansy na płodność, gdyż nie wykluczone, że plemniki
(zwykle pojedyncze) mogą się pojawić w gonadach dorosłych
osób. W ostatnich latach coraz więcej jest zwolenników
pozostawiania gonad dysgenetycznych oraz
wykonania biopsji i oceny histopatologicznej bioptatu
w kierunku ryzyka zmian nowotworowych
(Dieckmann i wsp., 2011;).
(Słowikowska-Hilczer i wsp., 2015).
47,XXY). Częstość występowania tego schorzenia określa
się na 1/500–1000 mężczyzn
(Nieschlag, 2013;)
(Purwin i Słowikowska-Hilczer, 2015)
Mutacje w regionie AZF na
długim ramieniu chromosomu Y stwierdzono u 10–20%
mężczyzn z azoospermią
(Fu i wsp., 2015;)
(Miyamoto i wsp., 2015;)
(Liu i wsp., 2016;)
(Wosnitzer, 2014)
Umiejscowienie
mutacji w określonym regionie AZF determinuje skuteczność
pozyskania plemników z biopsji oraz efektywność
uzyskania ciąż przy użyciu tak pobranych gamet
(Choi i wsp., 2004;)
(Liu i wsp., 2016)
Najlepsze wyniki uzyskuje
się u pacjentów z mikrodelecjami w rejonie AZFc. Męskie
potomstwo tych pacjentów dziedziczy te same nieprawidłowości
genetyczne co ich ojcowie i wykazuje podobne
zaburzenia płodności.
Trwają intensywne prace nad poszukiwaniem testów
genetycznych, które usprawniłyby diagnostykę i leczenie
NOA oraz ciężkiej oligozoospermii (rycina 1). Biorąc
pod uwagę fakt, iż spermatogeneza jest złożonym procesem
sterowanym wielogenowo (ponad 2000 genów)
oraz zależnym od działania czynników środowiskowych,
wydaje się, że zastosowanie w praktyce testów
genetycznych może mieć duże znaczenie w algorytmie
diagnostyczno-terapeutycznym. Duże nadzieje wiąże
się z wprowadzeniem do praktyki testów molekularnych
nasienia, takich jak:
yy analiza małych niekodujących RNA (sncRNA, ang.
small non-coding RNA), matrycowych RNA (mRNA,
ang. messenger RNA), mikro RNA (miRNA, ang. micro
RNA), niekodujących cząsteczek RNA tworzących
kompleksy z białkami piwi (piRNA, ang. piwi-interacting
RNA),
yy analiza modyfikacji epigenetycznych (modyfikacje
chemiczne w obrębie histonów i/lub protamin),
yy analiza produktów potranslacyjnej modyfikacji genów
i genów naprawy DNA (ang. DNA damage repair genes),
yy analiza polimorfizmów pojedynczego nukleotydu
(SNP, ang. single nucleotide polymorphism),
yy identyfikacja innych czynników zaburzających spermatogenezę.
Wymienione powyżej analizy różnią się rodzajem
i złożonością przekazywanej informacji oraz kosztami
(Bieniek i wsp., 2016; )
(2016; Hong i wsp.,2016;)
(Song i wsp., 2016)
(tabela 2).
Wstępne badania nowych testów diagnostyki
genetycznej prowadzone na modelu zwierzęcym napotykają
trudności w sytuacji ekstrapolowania ich zastosowania
u ludzi. Są jednak nadal niezbędnym i cennym
źródłem wiedzy
(Massart i wsp., 2012)
Terapia. Wydaje się, iż brak jest istotnej skuteczności
w leczeniu hormonalnym wszystkich pacjentów z NOA.
Próby podawania preparatów o działaniu antyestrogennym
(klomifen, tamoksyfen, inhibitory aromatazy)
i słabo działających androgenów (undecylenian testosteronu)
oraz preparatów ludzkiej gonadotropiny kosmówkowej
(hCG, ang. human chorionic gonadotropin) lub menopauzalnej
(hMG, ang. human menopausal gonadotropin),
a także preparatów czystego FSH i LH tylko w niektórych
przypadkach prowadzą do pojawienia się plemników
w nasieniu lub do zwiększenia liczebności dojrzałych
spermatyd w jądrach
(Ramasamy i wsp., 2009;)
(Reifsnyder
i wsp., 2012; )
( Rohayem i wsp., 2015)
Mechanizm działania
preparatów o działaniu antyestrogennym polega
na wyeliminowaniu hamującego wpływu estradiolu
na przysadkę, co powoduje zwiększenie wydzielania
gonadotropin pod warunkiem, że przysadka nie jest
uszkodzona. Podwyższone stężenia FSH i LH stymulują
spermatogenezę i biosyntezę testosteronu w jądrach.
Jednak zbyt mało jest badań klinicznych przeprowadzonych
na większych grupach pacjentów z NOA, aby
określić jednoznacznie wskazania do podawania tych
preparatów
(Anawalt, 2013; Chua i wsp., 2013; Koukkou i wsp., 2012).
(Anawalt, 2013; )
(Chua i wsp., 2013; )
(Koukkou i wsp., 2012)
Są one stosowane na razie poza zarejestrowanymi
wskazaniami (ang. off-label). Jedynym zarejestrowanym
wskazaniem do stosowania gonadotropin
u pacjentów z NOA jest hipogonadyzm hipogonadotropowy.
Substytucyjne podawanie jedynie preparatów
testosteronu prowadzi do zablokowania wydzielania
gonadotropin przez przysadkę, a tym samym do zatrzymania
czynności plemnikotwórczej i hormonalnej jąder,
nie poprawia więc płodności.
Leczenie operacyjne żylaków powrózków nasiennych
u pacjentów z NOA może usprawnić spermatogenezę
na drodze poprawy krążenia w obrębie jąder, obniżenia
stresu oksydacyjnego i zmniejszenia temperatury
w jądrach. Skuteczność tej metody ocenianej pojawieniem
się plemników w ejakulacje wynosi 22–55%
((Wostnitzer i wsp., 2014).)
Szacuje się, iż ogranicza ona wykonanie
zabiegu TESA i pobrania plemników z jąder (TESE, ang.
testicular sperm extraction) oraz procedury ICSI u 10–40%
mężczyzn
((Wostnitzer i wsp., 2014).)
Pozyskiwanie plemników lub spermatyd z jąder
i wykorzystanie ich do ICSI jest często jedynym możliwym
sposobem uzyskania własnego biologicznie
potomstwa przez pacjentów z NOA
(Świniarski, 2015)
(tabela 3). U mężczyzn z zespołem Klinefeltera plemniki
w nasieniu znajduje się w 10–50% przypadków
(Aksglaede i Juul, 2013; Ramasamy i wsp. 2009; Rohayem i wsp., 2015).
(Aksglaede i Juul, 2013;)
(Ramasamy i wsp. 2009; )
(Rohayem i wsp., 2015)
Zespół Klinefeltera jest najczęstszą genetyczną przyczyną
męskiej niepłodności i występuje u 11% mężczyzn z NOA
(Nieschlag, 2013).
Skuteczne naturalne zapłodnienie
plemnikami mężczyzny z kariotypem 47,XXY opisano
w 1982 roku
(Laron i wsp., 1982),
a za pomocą ICSI w 1997
roku
(Bourne i wsp., 1997).
U chłopców w okresie dojrzewania
płciowego lub młodych mężczyzn szansa na uzyskanie
plemników z jąder wydaje się największa, gdyż
wraz z wiekiem postępuje degeneracja kanalików jądra
i zanik nabłonka plemnikotwórczego
(Aksglaede i Juul,2013; ).
(Bryson i wsp., 2014; ).
(Damani i wsp., 2001).
(Ramasamy
i wsp., 2009;).
(Rohayem i wsp., 2015;).
(Scuriano i wsp., 2009).
Większość potomstwa mężczyzn z zespołem Klinefeltera
ma prawidłowy kariotyp
(Lanfranco i wsp., 2004;).
(Morel i wsp., 2003).
, ale ze względu na zwiększone ryzyko autosomalnych
aneuploidii w plemnikach (głównie trisomii
13, 18 i 21 pary chromosomów) istotna jest przedkoncepcyjna
i przedimlantacyjna diagnostyka genetyczna
(Nieschlag, 2013;).
(Purwin i Słowikowska-Hilczer, 2015).
Dysgenezja jąder może być różnie zaawansowana:
od całkowitego braku struktury jąder do nieznacznych
zaburzeń rozwoju kanalików plemnikotwórczych. Im
większy stopień zaburzenia, tym mniejsza szansa na istnienie
prawidłowej spermatogenezy, za to duże ryzyko
występowania GCT
(Rajpert-DeMeyts, 2006; ).
(Skakkebaek
i wsp., 2001; ).
(Słowikowska-Hilczer i wsp., 2007).
W przypadku
podejrzenia dysgenezji jąder takie gonady są
zwykle usuwane w okresie przeddojrzewaniowym jako
prewencja nowotworowa. Pozbawia się jednak te osoby
szansy na płodność, gdyż nie wykluczone, że plemniki
(zwykle pojedyncze) mogą się pojawić w gonadach dorosłych
osób. W ostatnich latach coraz więcej jest zwolenników
pozostawiania gonad dysgenetycznych oraz
wykonania biopsji i oceny histopatologicznej bioptatu
w kierunku ryzyka zmian nowotworowych
(Dieckmann i wsp., 2011;).
(Słowikowska-Hilczer i wsp., 2015).

Piśmiennictwo
Adamopoulos D., Mitios G., Nicopolou S.: Defining male factor infertility. W:
Clinical Andrology. EAU/ESAU course guidelines. Red. L. Bjorndahl, A.
Giwercman, H. Tournaye, W. Weidner. Informa Health, 2010, 293–300.
Aksglaede L., Juul A.: Testicular function and fertility in men with Klinefelter
syndrome: a review. Eur J Endocrinol. 2013, 168 (4), 67–76. doi: 10.1530/
EJE-12-0934. PMID: 23504510.
Alhalabi M., Kenj M., Monem F., Mahayri Z., Abou Alchamat G., Madania A.:
High prevalence of genetic abnormalities in Middle Eastern patients with
idiopathic non-obstructive azoospermia. J Assist Reprod Genet. 2015, 30 (6),
799–805. doi: 10.1007/s10815-013-9995-z. PMID: 23615726.
Anawalt B.D.: Approach to male infertility and induction of spermatogenesis.
J Clin Endocrinol Metab. 2013, 98 (9), 3532–3542. doi:10.1210/jc.2012-
2400. PMID: 24014811.
Andersson A-M., Petersen J.H., Jorgensen N., Jensen T.K., Skakkebaek N.E.:
Serum inhibin B and follicle-stimulating hormone levels as tools in the
evaluation of infertile men: significance of adequate reference values from
proven fertile men. J Clin Endocrinol Metab. 2004, 89, 2873–2879. doi:
10.1210/jc.2003-032148. PMID: 15181071.
Behre H.M., Nieschlag E., Weidner W., Wieacker P.: Diseases of seminal ducts.
W: Andrology. Male reproductive health and dysfunction. E. Nieschlag, H.M.
Behre, S. Nieschlag. Springer-Verlag, Heidelberg, Berlin, 2010, 273–288.
Behre H., Zitzmann M.: Imaging diagnostics. W: Andrology. Male reproductive
health and dysfunction. Red. E. Nieschlag, H.M. Behre, S. Nieschlag.
Springer-Verlag, Heidelberg–Berlin 2010, 101–107.
Bieniek J.M., Drabovich A.P., Lo K.C.: Seminal biomarkers for the evaluation of
male infertility. Asian J Androl. 2016, 18(3), 426–433. doi: 10.4103/1008-
682X.175781. PMID: 26975492.
Bourne H., Stern K., Clarke G., Pertile M., Speirs A., Baker H.W.: Delivery of normal
twins following the intracytoplasmic injection of spermatozoa from a
patient with 47,XXY Klinefelter’s syndrome. Hum Reprod. 1997, 12, 2447–
2450. doi: 10.1093/humrep/ 12.11.2447. PMID: 9436682.
Bryson C.F., Ramasamy R., Sheehan M., Palermo G.D., Rosenwaks Z., Schlegel P. N.:
Severe testicaular atrophy does not affect the success of microdissection
testicular sperm extraction. J Urol. 2014, 191 (1), 175–178. doi: 10.1016/j.
juro.2013.07.065. PMID: 23911635.
Celep F., Karaguzel A., Ozeren M., Bozkaya H.: The frequency of chromosomal
abnormalities in patients with reproductive failure. Eur J Obstet Gynecol
Reprod Biol. 2006, 127, 106–109. doi: 10.1016/j.ejogrb.2005.12.019. PMID:
16443317.
Choi J.M., Chung P., Veeck L., Mielnik A., Palermo G.D., Schlegel P.N.: AZF
microdeletions of the Y chromosome and in vitro fertilization outcome.
Fertil Steril. 2004, 81(2), 337–341. doi: 10.1016/j.fertnstert.2003.06.030.
PMID: 14967370.
Chua M.E., Escusa K.G., Luna S., Tapia L.C., Dofitas B., Morales M.: Revisiting
oestrogen antagonists (clomiphene or tamoxifen) as medical empiric therapy
for idiopathic male infertility: a meta-analysis. Andrology. 2013, 1 (5),
749–757. doi: 10.1111/j.2047-927.2013.00107.x. PMID: 23970453.
Cooper T.G., Noonan E., von Eckardstein S., Auger J., Baker H.W., Behre H.M.
i wsp.: World Health Organization reference values for human semen characteristics.
Hum Reprod Update. 2010, 16 (3), 231–245. doi: 10.1093/humupd/
dmp048. PMID: 19934213.
Damani M.N., Mittal R., Oates R.D.: Testicular tissue extraction in a young
male with 47,XXY Klinefelter’s syndrome: potential strategy for preservation
of fertility. Fertil Steril. 2001, 76, 1054–1056. doi: 10.1016/S0015-
0281(01)02837-0. PMID: 11704135.
Deja T.: Pozyskiwanie plemników u pacjentów z azoospermią. Przegl Urol
2009, 6 (58), 49–52.
Dieckmann K.P., Kulejewski M., Heinemann V., Loy V.: Testicular biopsy for
early cancer detection – objectives, technique and controversies. Int J Androl.
2011, 34, e7–13. doi: 10.1111/j.1365-2605.2011.01152.x. PMID: 21615417.
Dohle G.R.: Clinical investigation of the infertile man. W: Clinical andrology.
EAU/ESAU course guidelines. Red. L. Bjorndahl, A. Giwercman, H.
Tournaye, W. Weidner. Informa Health, 2010, 293–300. doi: 10.1038/
aja.2011.57. PMID: 22157985.
Dohle G.R., Elzanaty S., van Casteren N.J.: Testicular biopsy: clinical practice
and interpretation. Asian J Androl. 2012, 14 (1), 88–93. doi: 10.1038/
aja.2011.57. PMID: 22157985.
Engelmann U., Gralla O.: Vasectomy and refertilization. W: Andrology. Male
reproductive health and dysfunction. Red. E. Nieschlag, H.M. Behre, S.
Nieschlag. Springer-Verlag, Heidelberg–Berlin, 2010, 565–576.
Filipiak E., Marchlewska K., Oszukowska E., Walczak-Jedrzejowska R.,
Swierczynska-Cieplucha A., Kula K. i wsp.: Presence of aerobic microorganisms
and their influence on basic semen parameters in infertile men. Andrologia.
2015, 47 (7), 826–831. doi: 10.1111/and.12338. PMID: 25209133.
Fisch H., Lambert S.M., Goluboff E.T.: Management of ejaculatory duct obstruction:
etiology, diagnosis, and treatment. World J Urol. 2006, 24 (6), 604–610.
doi:10.1007/s00345-006-0129-4. PMID: 17077974.
Forti G., Corona G., Maggi M.: Clinical investigation and laboratory analyses
in male hypogonadism. EAU/ESAU course guidelines. Red. L. Bjorndahl,
A. Giwercman, H. Tournaye, W. Weidner. Informa Health, 2010, 245–259.
Fu L., Mao X., Chen S., Zhang H., Wang M., Huang G. i wsp.: Analysis of microdeletions
of azoospermia factor genes on Y chromosome in infertile males.
Zhonghua Yi Xua Yi Chuan Xue Za Zhi. 2015, 32 (1), 85–88. doi: 10.3760/
cma.j.issn.1003-9406.2015.01.019. PMID: 25636108.
Hong Y., Wang Ch., Fu Z., Liang H., Zhang S., Lu M. i wsp.: Systematic characterization
of seminal plasma piRNAs as molecular biomarkers for male infertility.
Sci Rep. 2016, 6, 224–229. doi: 10.1038/srep24229. PMID: 27068805.
Isidori A.M., Lenzi A.: Scrotal ultrasound: morphological and functional
atlas. Forum Service Editore s.r.l., Genua, 2008.
Jarvi K., Lo K., Fischer A., Grantmyre J., Zini A., Chow V. i wsp.: CUA Guideline:
The workup of azoospermic males. Can Urol Assoc J. 2010, 4, 3, 163–167.
doi:10.5489/cuaj.10050. PMID 20514278
Koukkou E., Billa E., Kapolla N., Pappa A., Venaki E., Andreou L. i wsp.: An
empiric treatment for idiopathic oligozoospermia revisited: a 20-year investigative
saga. Andrologia. 2012, 44 (5), 337–342. doi: 10.1111/j.1439-
0272.2012.01286.x. PMID: 22946848.
Krausz C.: Genetic causes of male infertility and their impact on future generations.
W: Clinical andrology. EAU/ESAU course guidelines. Red. L. Bjorndahl,
A. Giwercman, H. Tournaye, W. Weidner. Informa Health, 2010, 39–48.
Kula K., Słowikowska-Hilczer J.: Choroby jąder. W: Interna Szczeklika.
Podręcznik chorób wewnętrznych 2016. Red. P. Gajewski. Medycyna
Praktyczna, Kraków 2016, 1371–1380.
Lanfranco F., Kamischke A., Zitzmann M., Nieschlag E.: Klinefelter’s syndrome.
Lancet. 2004, 364, 273–283. doi: 10.1016/S0140-6736(04)16678-6. PMID:
15262106.
Laron Z., Dickerman Z., Zamir R., Galatzer A.: Paternity in Klinefelter’s
syndrome: a case report. Arch Androl. 1982, 8, 149–151. doi: 10.3109/
01485018208987032. PMID: 6803694.
Liu X.G., Hu H.Y., Guo Y.H., Sun Y.P.: Correlation between Y chromosome
microdeletion and male infertility. Genet Mol Res. 2016, 15 (2). doi: 10.4238/
gmr.15028426. PMID: 27313142.
Massart A., Lissens W., Tournaye H., Stouffs K.: Genetic causes of spermatogenic
failure. Asian J Androl. 2012, 14, 40–48. doi: 10.1038/aja.2011.67.
PMID:22138898.
Miyamoto T., Minase G., Okabe K., Ueda H., Sengoku K.: Male infertility and
its genetic causes. J Obstet Gynaecol Res. 2015, 41 (10), 1501–1505. doi:
10.1111/jog.12765. PMID: 26178295.
Morel F., Bernicot I., Herry A., Le Bris M.J., Amice V., De Braekeleer M.: An
inceased incidence of autosomal aneuploidies in spermatozoa from a patient
with Klinefelter’s syndrome. Fertil Steril. 2003, 79, 1644–1646. doi: 10.1016/
S0015-0282(03)00343-1. PMID: 12801572.
Nieschlag E.: Klinefelter’s syndrome: the commonest form of hypogonadism,
but of ten overlooked or untreated. Dtsch Arztebl Int. 2013, 110 (20), 347–
353. doi: 10.3238/arztebl.2013.0347. PMID: 2382548.
Oszukowska E., Walczak‑Jędrzejowska R., Marchlewska K., Lipiński M., Różański
W., Słowikowsk-Hilczer J.: Niedrożność dróg wyprowadzających plemniki jako
przyczyna niepłodności u mężczyzn. Postepy Androl Online, 2016, 3(2), 6–15.
[przeglądany: 15.12.2016 r.]. Dostępny w: http://www.postepyandrologii.pl
Purwin T., Słowikowska-Hilczer J.: Zespól Klinefeltera – aktulane zalecenia
odnośnie postępowania medycznego. Postępy Andrologii Online, 2015,
2(2), 12-24. [przeglądany: 10.04.2015 r.]. Dostępny w: http://www.postepyandrologii.
pl
Rajpert-DeMeyts E.: Developmental model for the pathogenesis of testicular
carcinoma in situ: genetic and environmental aspects. Hum Reprod Update.
2006, 12, 303–323. doi: 10.1093/humupd/dmk006. PMID: 16540528.
Ramasamy R., Ricci J.A., Palermo G.D., Gosden L.V., Rosenwaks Z., Schlegel
P.N.: Successful fertility treatment for Klinefelter’s syndrome. J Urol. 2009,
182(3), 1108–1113. doi: 10.1016/j. juro. 2009.05.019. PMID: 19616796.
Reifsnyder J.E., Ramasamy R., Husseini J., Schlegel P.N.: Role of optimizing
testosterone before microdissection testicular sperm extraction in men
with nonobstructive azoospermia. J Urol. 2012, 188 (2), 532–536. doi:
10.1016/j. juro. 2012.04.002. PMID: 22704105.
Rohayem J., Fricke R., Czeloth K., Mallidis C., Wistuba J., Krallmann C. i wsp.: Age
and markers of Leydig cell function, but not of Sertoli cell function predict the
success of sperm retrieval in adolescents and adults with Klinefelter’s syndrome.
Andrology 2015, 3 (5), 868–875. doi: 10.1111/andr.12067. PMID: 26235799.
Scuriano R.B., Luna Hisano C.V., Rahn M.I., Brugo Olmedo S., Rey Valzacchi G.,
Coco R. i wsp.: Focal sprmatogenesis originates in euploid germ cells in classical
Klinefelter patients. Hum Reprod. 2009, 24, 2353–2361. doi: 10.1093/
humpred/dep.180. PMID: 19443454.
Simoni M., Nieschlag E.: Endocrine laboratory diagnosis. W: Andrology. Male
reproductive health and dysfunction. Red. E. Nieschlag, H.M. Behre, S.
Nieschlag. Springer-Verlag, Heidelberg–Berlin 2010, 109–118.
Simoni M., Wieacker P.: Cytogenetic and molecular genetic investigations. W:
Andrology. Male reproductive health and dysfunction. Red. E. Nieschlag,
H.M. Behre, S. Nieschlag. Springer-Verlag, Heidelberg–Berlin 2010, 131–136.
Skakkebaek N.E., Rajpert-DeMeyts E., Main K.M.: Testicular dysgenesis syndrome:
an increasingly common developmental disorder with environmental
aspects. Hum Reprod. 2001, 16, 972–978. PMID: 11331648.
Słowikowska-Hilczer J., Gumińska A., Kula K.: Pathogenesis and active prevention
of testicular germ cell neoplasia. J Reprod Med Endocrinol. 2007,
4, 313–321.
Słowikowska-Hilczer J., Szarras-Czapnik M., Wolski J.K., Oszukowska E.,
Hilczer M., Jakubowski L. i wsp.: The risk of neoplasm associated with dysgenetic
testes in prepubertal and pubertal/adult patients. Folia Histochem Cytobiol.
2015, 53 (3), 218–226. doi: 10.5603/FHC.a2015.0021. PMID: 26314751.
Sochaj M.: Diagnostyka niepłodnego mężczyzny. Przegl Urol. 2015, 5 (93),
43–48.
Song S.H., Chiba K., Ramasamy R., Lamb D.J.: Recent advances in the genetics of
testicular failure. Asian J Androl. 2016, 18 (3), 350–355. doi:10.4103/1008-
682X.178857. PMID: 27048782.
Świniarski P.P.: Plemniki w rozrodzie wspomaganym oraz transplantacja
komórek rozrodczych. Przegl Urol. 2015, 5 (93), 49–51.
Tüttelmann F., Nieschlag E.: Classification of andrological disorders. W:
Andrology. Male reproductive health and dysfunction. Red. E. Nieschlag,
H.M. Behre, S. Nieschlag. Springer-Verlag, Heidelberg–Berlin 2010, 100–105.
Weidner W., Diemer T., Wagenlehner F.M.: Male infertility in chronic urogenital
infections and inflammation with special reference to ejaculate findings.
W: Clinical andrology. EAU/ESAU course guidelines. L. Bjorndahl, A.
Giwercman, H. Tournaye, W. Weidner. Informa Health, 2010, 293–300.
van Wely M., Barbey N., Meissner A., Repping S., Silber S.J.: Live birth rates
after MESA or TESE in men with obstructive azoospermia: is there a difference?
Hum Reprod. 2015, 30 (4), 761–766. 015. doi: 10.1093/humrep/
dev032. PMID: 25740877.
WHO: Laboratory manual for the examination and processing of human
semen. 5th edition. WHO Press, 2010.
Wosnitzer M.: Genetic evaluation of male infertility. Transl Androl Urol.
2014, 3 (1), 17–26. doi: 10.3978/j.issn.2223-4683.2014.02.04. PMID:
26813518.
Wosnitzer M., Goldstein M., Hardy M.P.: Review of azoospermia.
Spermatogenesis. 2014, 4, e28218. eCollection 2014. doi:10.4161/
spmg.28218 PMID: 25105055.
Yeung C., Cooper T.: Sperm quality and function tests. W: Andrology. Male
reproductive health and dysfunction. Red. E. Nieschlag, H.M. Behre, S.
Nieschlag. Springer-Verlag, Heidelberg–Berlin 2010, 151–166.
REKOMENDACJE MEDYCZNE MEDICAL RECOMMENDATION
Rekomendacje medyczne (zwane inaczej wytycznymi
lub zaleceniami) są dokumentem, który tworzony jest
w celu zapewnienia jednolitego postępowania diagnostycznego
i terapeutycznego w danej dziedzinie medycyny.
Takie dokumenty stosowane były w medycynie podczas
całej jej historii. Jednak w przeciwieństwie do wcześniejszych
zaleceń, które oparte były często na tradycyjnych
praktykach, niesprawdzonych teoriach i irracjonalnych
wierzeniach, nowoczesne wytyczne medyczne oparte
są na aktualnych danych uzyskanych w badaniach naukowych,
co nazywane jest medycyną opartą na dowodach
(EBM, ang. evidence based medicine). Rekomendacje są formułowane
przez uznanych specjalistów z danej dziedziny
i powstają jako konsensus ich opinii na dany temat.
Andrologia jest dziedziną medycyny, która powstała
na pograniczu endokrynologii, urologii, medycyny
rozrodu, seksuologii i pediatrii, dlatego rekomendacje
odnośnie postępowania w zaburzeniach andrologicznych
są często tworzone w ramach różnych specjalizacji.
Europejska Akademia Andrologii (EAA, ang. European
Academy of Andrology), której zadaniem jest m.in. kształcenie
w dziedzinie andrologii, poleca lekarzom andrologom
oraz kandydatom do zdobycia tytułu androloga
klinicznego zapoznanie się z Rekomendacjami
Europejskiego Towarzystwa Urologicznego (EAU, ang.
European Association of Urology). Przedstawiciele EAA
i EAU wypracowali bowiem wspólny program nauczania
tematyki andrologicznej.
W 2015 r. ukazało się nowe, zaktualizowane wydanie
Rekomendacji EAU. Aby ułatwić polskim lekarzom zapoznanie
się z tymi Rekomendacjami, Polskie Towarzystwo
Andrologiczne (PTA) podjęło się ich tłumaczenia na język
polski. Dotychczas zostały przetłumaczone rekomendacje
odnośnie postępowania w męskim hipogonadyzmie,
zaburzeniach seksualnych u mężczyzn i w męskiej niepłodności
oraz postępowania w zakażeniach układu płciowego.
Polskie wersje Rekomendacji EAU będą się ukazywały
w częściach w czasopiśmie „Postępy Andrologii
Online”, a także będą umieszczone na stronie internetowej
PTA. Mamy nadzieję, że Rekomendacje podniosą
wiedzę i umiejętności lekarzy zajmujących się problemami
andrologicznymi w Polsce, a także będą pomocne
w wyjaśnieniu często kontrowersyjnych zagadnień.
Prof. dr hab. n. med. Jolanta Słowikowska‑Hilczer
Przewodnicząca
Polskiego Towarzystwa Andrologicznego
KOMENTARZ DO REKOMENDACJI EUROPEJSKIEGO TOWARZYSTWA ANDROLOGICZNEGO DOTYCZĄCYCH POSTĘPOWANIA W ZAKAŻENIACH UKŁADU MOCZOWEGO
COMMENT TO THE EUROPEAN ASSOCIATION OF
UROLOGY GUIDELINES ON UROLOGICAL INFECTIONS
Od 2016 r. przez kolejne 3 lata powstają aktualizowane
podrozdziały wytycznych, które po zakończeniu będą stanowiły
zupełnie nowe rekomendacje. Dla podrozdziałów
wytycznych dotyczących postępowania w zakażeniach
układu moczowego, które nie są objęte aktualizacjami
z 2016 r. i 2017 r. nadal obowiązującymi są rekomendacje
z 2015 r. Są one dostępne w wersji angielskiej na stronie
internetowej Europejskiego Towarzystwa Urologicznego
(EAU, ang. European Association of Urology) Uroweb (http://
uroweb.org/guideline/urological-infections/).
Rekomendacje dotyczące zakażeń układu moczowego
z 2017 r. są scaleniem wytycznych z 2015 r. i 2016 r.
W kolejnych latach zgodnie z założeniem EAU powstać
ma zbiór nowych wytycznych pokrywających całą tematykę
związaną z zakażeniami w urologii. Ustalając
wytyczne dotyczące postępowania w zakażeniach urologicznych
z 2016 r. zestawiono nowe i istotne dowody,
które uzyskano poprzez wnikliwą ocenę piśmiennictwa
naukowego. Wszystkie rozdziały zostały napisane
w oparciu o metodyczne przeglądy priorytetowych
tematów i pytań nadawanych przez panel wytycznych.
Opinie te wydawano w oparciu o systematyczny przegląd
bazy Cochranea (http://www.cochranelibrary.com/
about/about-cochrane-systematicreviews).
W wytycznych z 2016 r. wzięto pod uwagę nurtującą
problematykę związaną z zakażeniami w urologii:
1. Jaka jest dokładność diagnostyczna alternatywnych
badań moczu w porównaniu ze standardowymi
posiewami moczu w diagnostyce bakteriurii
u dorosłych pacjentów poddawanych interwencjom
urologicznym?
2. Jaka jest najlepsza i najskuteczniejsza strategia
postępowania antybakteryjnego u mężczyzn z ostrym
zapaleniem najądrza?
3. Jakie strategie techniczne lub proceduralne są
skuteczne w celu zmniejszenia powikłań zakaźnych
po biopsji gruczołu krokowego?
W roku 2017 pod uwagę wzięte zostały i zaktualizowane
kolejne tematy i pytania:
1. Jakie jest najskuteczniejsze postępowanie u dorosłych
z bezobjawową bakteriurią?
2. Jaka jest najlepsza strategia profilaktyki przeciwbakteryjnej
w celu zmniejszenia ryzyka powikłań zakaźnych
po biopsji gruczołu krokowego?
Dodatkowo bardzo wyraźny nacisk jest kładziony
na racjonalną antybiotykoterapię, mającą na celu zmniejszenie
powikłań związanych z ich nadużywaniem. W najnowszych
wytycznych poświęcono również znacznie
więcej uwagi postępowania w bezobjawowej bakteriurii
u ciężarnych. Najważniejszy wniosek z analizy przeglądu
bazy Cochranea to rekomendacja aby leczyć bezobjawową
bakteriurię poprzez 2–7 dniowy schemat terapii przeciwbakteryjnej.
Rekomendacje dotyczące postępowania w zakażeniach
układu moczowego z 2015 r. są nadal obowiązującymi
wytycznymi z niewielkimi zmianami systematycznie
wprowadzanymi od 2016 r.
Dr n. med. Marcin Radko
REKOMENDACJE DOTYCZĄCE POSTĘPOWANIA W ZAKAŻENIACH UKŁADU MOCZOWEGO
REKOMENDACJE DOTYCZĄCE
POSTĘPOWANIA W ZAKAŻENIACH
UKŁADU MOCZOWEGO
GUIDELINES ON UROLOGICAL INFECTIONS
M. Grabe (przewodniczący), R. Bartoletti, T.E. Bjerklund Johansen, T. Cai, M. Çek, B. Köves, K.G. Naber,
R.S. Pickard, P. Tenke, F. Wagenlehner, B. Wullt
Tłumaczenie i przygotowanie wersji polskiej/Translation and elaboration of Polish version:
Marcin Radko1, Katarzyna Marchlewska2, Jolanta Słowikowska-Hilczer2
Klinika Urologii Ogólnej, Czynnościowej i Onkologicznej, Wojskowy Instytut Medyczny, Centralny Szpital Kliniczny Ministerstwa
Obrony Narodowej (MON) w Warszawie 2 Zakład Endokrynologii Płodności, Katedra Andrologii i Endokrynologii Płodności, Uniwersytet
Medyczny w Łodzi
Autor do korespondecji/corresponding author: Jolanta Słowikowska-Hilczer, Zakład Endokrynologii Płodności, Katedra Andrologii
i Endokrynologii Płodności, Uniwersytet Medyczny w Łodzi, ul. Sterlinga 5, 91-425 Łódź, tel.: 42 633 07 05, jolanta.slowikowskahilczer@
umed.lodz.pl
Otrzymano/received: 23.08.2016 r. Zaakceptowano/accepted: 22.03.2017 r.
Skróty / Abbreviations
ABU – bezobjawowy bakteriomocz (ang. asymptomatic bacteriuria); AIDS – zespół nabytego braku odporności (ang. acquired immunodeficiency
syndrome); APCKD – wrodzona wielotorbielowatość nerek u dorosłych (ang. adult polycystic kidney disease); BLI – inhibitor β-laktamaz (ang.
β-lactamase inhibotor); BOO – niedrożność ujścia pęcherza moczowego (ang. bladder outlet obstruction); BPH – łagodny przerost gruczołu
krokowego (ang. benign prostatic hyperplasia); CD – marker powierzchniowy (ang. cluster of differentiation); CDC – Centra Kontroli Chorób
(ang. Centers for Disease Control); cfu – jednostka tworząca kolonię (ang. colony forming unit); CIC – czyste przerywane cewnikowanie (ang.
clean intermittent catheterization); CNI – inhibitor kalcyneuryny (ang. calcineurin inhibitor); CRP – białko C-reaktywne (ang. C-reactive protein);
CPSI – wskaźnik objawów przewlekłego zapalenia gruczołu krokowego (ang. Chronic Prostatitis Symptom Index); CVO2 – ośrodkowe żylne
stężenie tlenu (ang. central venous oxygen); CVP – ośrodkowe ciśnienie żylne (ang. central venous pressure); CY – zapalenie pęcherza moczowego
(łac. cystitis); DMSA – kwas 2,3-dimerkaptobursztynowy (ang. 2,3-dimercaptosuccinic acid); DRE – badanie przezodbytnicze (ang. digital
rectal examination); DTPA – pentaoctan dietylenowy triaminy (ang. iethylene triamine pentaacetic acid); EAU – Europejskie Towarzystwo
Urologiczne (ang. European Association of Urology); EBM – medycyna oparta na dowodach naukowych (ang. evidence based medicine); EPS –
wydzielina gruczołu krokowego (ang. expressed prostatic secretion); ESBL – rozszerzone spektrum β-laktamaz (ang. extended-spectrum
beta-lactamases); ESWL – litotrypsja zewnątrzustrojową falą uderzeniową (ang. extracorporeal shock wave lithotripsy); EUCAST – Europejski
Komitet Wrażliwości na Środki Przeciwdrobnoustrojowe (ang. European Committee for Antimicrobial Susceptibility Testing); GFR – współczynnik
przesączania kłębuszkowego (ang. glomerular filtration rate); GPIU – globalne występowania zakażeń urologicznych (ang. global
prevalence infection in urology); GR – stopień rekomendacji (ang. grade of recommendation); HD – hemodializa (ang. hemodialysis); HIV – ludzki
wirus niedoboru odporności (ang. human immunodeficiency virus); ICUD – międzynarodowe konsultacje chorób urologicznych (ang. international
consultation on urological diseases); IL – interleukina (ang. interleukin); i.m. – domięśniowo (łac. intramusculare); i.v. – dożylnie (łac. in
vene); LE – poziom wiarygodności dowodu naukowego (ang. level of evidence); LUTD – zaburzenia czynnościowe dolnych dróg moczowych
(ang. lower urinary tract dysfunction); LUTS – objawy z dolnych dróg moczowych (ang. lower urinary tract symptoms); MAG-3 – merkapto-
-acetylo-triglicyna (ang. mercapto-acetyl-triglycine); MAGI – zakażenie męskich dodatkowych gruczołów płciowych (ang. male accessory
gland infection); MRI – rezonans magnetyczny (ang. magnetic resonance imaging); MSU – próbka moczu ze środkowego strumienia (ang.
mid-stream sample of urine); NAAT – testy amplifikacji kwasu nukleinowego (ang. nucleic acid amplification test); NGU – niegonokokowe
zapalenie cewki moczowej (łac. nongonococcal urethritis); OPM – odpływ pęcherzowo-moczowodowy (łac. refluxus vesicoureteralis); PCNL –
przezskórna nefrolitotomia (ang. percutaneous nephrolithotomy); PCR – łańcuchowa reakcja polimerazy (ang. polymerase chain reaction); PN –
odmiedniczkowe zapalenie nerek (łac. pyelonephritis); p.o. – doustnie (łac. per os); PNL – przezskórna nefrolitotrypsja (ang. percutaneous
nephrolithotripsy); PSA – antygen specyficzny dla prostaty (ang. prostate specific antigen); RIRS – zabieg giętkiej nefroskopii (ang. retrograde
intrarenal surgery); SIRS – zespół zapalnej odpowiedzi układowej (ang. systemic inflammatory response syndrome); SMX – sulfametoksazol
(łac. sulfamethoxazolum); STD – choroby przenoszone progą płciową (ang. sexually transmitted diseases); TK – tomografia komputerowa (ang.
computed tomography); TMP – trimetoprym (ang. trimetoprim); TUR-BT – przezcewkowe usunięcie pęcherza moczowego (ang. transurethral
resection of the bladder tumour); TUR-P – przezcewkowa resekcja gruczołu krokowego (ang. transurethral resection of the prostate); USG – ultrasonografia
(ang. ultrasonography); URS – uretoneskopia (ang. ureterorenoscopy); URSL – litotrypsja ureteronerkowa (ang. ureterorenoscopic
lithotripsy); US – urosepsja (łac. urosepsis); VCU – cystouretrografia mikcyjna (ang. voiding cystourethrography); WBC – krwinki białe (ang.
white blood cells); ZBMM – zespół bólowy miednicy mniejszej (ang. chronic pelvic pain syndrome); ZUM – zakażenia układu moczowego (ang.
urinary tract infections)
Spis treści
1. WSTĘP . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
1.1. Cel . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
1.2. Historia publikacji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
1.3. Skład panelu specjalistów opracowujących rekomendacje . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
1.4. Podstawowe informacje . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
1.4.1. Rozwój oporności bakteryjnej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42
1.4.2. Patogeneza zakażenia układu moczowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
1.4.3. Badania laboratoryjne i mikrobiologiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 43
2. METODOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44
3. WYTYCZNE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A. KLASYFIKACJA ZAKAŻEŃ UKŁADU MOCZOWEGO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A.1.1. Podział anatomiczny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A.1.2. Stopień ciężkości zakażenia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A.2. Patogeny . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3A.3. Systemy klasyfikacji zakażeń układu moczowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45
3B. BEZOBJAWOWY BAKTERIOMOCZ (BAKTERIURIA) U DOROSŁYCH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.2. Metody . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.3. Epidemiologia, etiologia i patofizjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.4. Badania diagnostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.5. Sposoby postępowania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.5.1. Pacjenci bez zidentyfikowanych czynników ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47
3B.5.2. Pacjenci z bezobjawowym bakteriomoczem i nawrotowymi zakażeniami układu moczowego,
poza tym zdrowi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.3. Kobiety ciężarne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4. Pacjenci ze zidentyfikowanymi czynnikami ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.1. Bezobjawowy bakteriomocz u kobiet w okresie pomenopauzalnym . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.2. Cukrzyca . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.3. Pacjenci zakładów opieki (zinstytucjonalizowani) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.4. Pacjenci z dysfunkcją dolnych dróg moczowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.5. Pacjenci zacewnikowani . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.6. Pacjenci z bezobjawowym bakteriomoczem poddawani implantacji/założeniu
lub wymianie cewnika . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 48
3B.5.4.7. Pacjenci z przeszczepioną nerką . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3B.5.4.8. Pacjenci o obniżonej odporności oraz ciężko chorzy z kandydurią . . . . . . . . . . . . . . . . . . . . 49
3B.5.5. Przed zabiegiem operacyjnym . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3B.5.6. Leczenie farmakologiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3B.6. Kontrola po leczeniu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3C. ZAPALENIE PĘCHERZA MOCZOWEGO I ODMIEDNICZKOWE ZAPALENIE NEREK U DOROSŁYCH . . . . . . . . . . . . 49
3C.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3C.2. Epidemiologia, etiologia i patofizjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
3C.3. Ostre zapalenie pęcherza moczowego (zakażenie dolnych dróg moczowych) u osób dorosłych . . . . . . . . . . . . . . . 50
3C.3.1. Rozpoznanie/Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3C.3.1.1. Objawy kliniczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3C.3.1.2. Diagnostyka różnicowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3C.3.1.3. Diagnostyka laboratoryjna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3C.3.2. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50
3C.3.3. Kontrola po leczeniu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 51
3C.4. Ostre niepowikłane odmiedniczkowe zapalenie nerek u dorosłych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.1. Rozpoznanie/Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.1.1. Objawy kliniczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.1.2. Diagnostyka różnicowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.1.3. Diagnostyka laboratoryjna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.1.4. Diagnostyka obrazowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.2. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.2.1. Łagodne i umiarkowane przypadki ostrego nieskomplikowanego
odmiedniczkowego zapalenia nerek . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 52
3C.4.2.2. Ciężkie przypadki ostrego niepowikłanego odmiedniczkowego zapalenia nerek . . . . . . . . . . . . 53
3C.4.3. Kontrola po leczeniu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53
3C.5. Nawracające niepowikłane zakażenie układu moczowego u kobiet . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3C.5.1. Ocena diagnostyczna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3C.5.2. Postępowanie i kontrola po leczeniu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3C.5.2.1. Czynniki ryzyka i zmiany zachowań . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54
3C.5.2.2. Profilaktyka nieantybiotykowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
3C.5.2.3. Profilaktyka antybiotykowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
3D. POWIKŁANE ZAKAŻENIA UKŁADU MOCZOWEGO Z UROLOGICZNYMI I NEFROLOGICZNYMI
CZYNNIKAMI RYZYKA U DOROSŁYCH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
3D.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 56
3D.2. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3D.3. Rozpoznanie/Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3D.3.1. Objawy kliniczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3D.3.2. Posiewy moczu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3D.3.3. Mikrobiologia (spektrum i oporność na antybiotyki) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 57
3D.3.4. Szczególne rodzaje powikłanych zakażeń układu moczowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3D.3.5. Szczególne rodzaje zakażeń nerek . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58
3D.3.6. Zakażenie układu moczowego jako powikłanie po przeszczepie nerek . . . . . . . . . . . . . . . . . . . . . . . . 58
3D.4. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
3D.4.1. Dobór antybiotyków . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 59
3D.4.2. Czas trwania antybiotykoterapii . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3D.4.3. Leczenie w przypadkach szczególnych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3D.4.3.1. Wrodzona wielotorbielowatość nerek u dorosłych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3D.4.3.2. Szczególne rodzaje skomplikowanych zakażeń układu moczowego . . . . . . . . . . . . . . . . . . . . 60
3D.4.3.3. Szczególne rodzaje zakażeń nerek . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60
3D.4.3.4. Zakażenia układu moczowego jako powikłanie po przeszczepie nerek . . . . . . . . . . . . . . . . . . 60
3D.5. Kontrola po leczeniu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3E. SEPSA Z PUNKTEM WYJŚCIA Z UKŁADU MOCZOWEGO (UROSEPSA) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3E.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3E.2. Epidemiologia, etiologia i patofizjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61
3E.3. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
3E.4. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
3E.4.1. Patofizjologia i markery biochemiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62
3E.4.1.1. Cytokiny jako markery reakcji septycznej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3E.4.1.2. Prokalcytonina jako marker sepsy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3E.5. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3E.5.1. Profilaktyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63
3E.5.1.1. Środki zapobiegawcze o skuteczności potwierdzonej lub prawdopodobnej . . . . . . . . . . . . . . . . 63
3E.5.1.2. Odpowiednia okołooperacyjna profilaktyka antybakteryjna . . . . . . . . . . . . . . . . . . . . . . . 64
3E.5.1.3. Środki zapobiegawcze o dyskusyjnej skuteczności oraz przynoszące efekt przeciwny . . . . . . . . . 64
3E.5.2. Leczenie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3E.5.2.1. Odbarczenie przeszkody w odpływie moczu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 64
3E.5.2.2. Terapia przeciwdrobnoustrojowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3E.5.2.3. Leczenie uzupełniające . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3F. ZAKAŻENIA UKŁADU MOCZOWEGO ZWIĄZANE Z CEWNIKOWANIEM . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3F.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3F.2. Metody . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3F.3. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65
3F.4. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
3F.5. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
3F.6. Podsumowanie rekomendacji . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66
3G. ZAKAŻENIA UKŁADU MOCZOWEGO U DZIECI . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
3G.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67
3G.2. Epidemiologia, etiologia i patofizjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68
3G.3. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
3G.4. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
3G.4.1. Badanie fizykalne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
3G.4.2. Diagnostyka laboratoryjna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
3G.4.2.1. Pobranie próbki moczu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
3G.4.2.2. Kwantyfikacja bakteriomoczu . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 69
3G.4.2.3. Inne wskaźniki biochemiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 70
3G.4.3. Diagnostyka obrazowa dróg moczowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
3G.4.3.1. Ultrasonografia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
3G.4.3.2. Badania radioizotopowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
3G.4.3.3. Cystouretrografia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71
3G.4.3.4. Dodatkowe metody obrazowania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
3G.4.3.5. Badanie urodynamiczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
3G.4.4. Schemat postępowania diagnostycznego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
3G.5. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
3G.5.1. Ciężkie zakażenia układu moczowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 72
3G.5.2. Nieskomplikowane zakażenia układu moczowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
3G.5.3. Profilaktyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
3H. ZAPALENIE CEWKI MOCZOWEJ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
3H.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
3H.2. Metody . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
3H.3. Epidemiologia, etiologia i patogeneza . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73
3H.4. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 74
3H.5. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75
3H.5.1. Leczenie gonokokowego zapalenia cewki moczowej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75
3H.5.2. Leczenie zapalenia cewki moczowej wywołanego chlamydiami . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75
3H.5.3. Leczenie zapalenia cewki moczowej wywołanego przez Mycoplasma genitalium . . . . . . . . . . . . . . . . . . . 75
3H.5.4. Leczenie zapalenia cewki moczowej wywołanego przez Ureaplasma urealyticum . . . . . . . . . . . . . . . . . . . 75
3H.5.5. Leczenie zapalenia cewki moczowej wywołanego przez Trichomonas vaginalis . . . . . . . . . . . . . . . . . . . . 75
3H.5.6. Leczenie niegonokokowego zapalenia cewki moczowej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75
3H.6. Kontrola po leczeniu i zapobieganie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75
3I. BAKTERYJNE ZAPALENIA GRUCZOŁU KROKOWEGO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3I.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3I.2. Epidemiologia, etiologia i patogeneza . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3I.3. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3I.3.1. Wywiad i objawy . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3I.3.1.1. Kwestionariusze objawowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76
3I.3.2. Badania kliniczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 77
3I.3.3. Posiewy z moczu i z wydzieliny stercza . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 77
3I.3.4. Biopsja stercza . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 77
3I.3.5. Inne badania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 77
3I.3.6. Dodatkowe narzędzia diagnostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3I.3.6.1. Badanie nasienia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3I.3.6.2. Antygen swoisty dla stercza . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3I.4. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3I.4.1. Antybiotyki . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3I.4.2. Dosterczowe injekcje antybiotyków . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3I.4.3. Drenaż i zabiegi operacyjne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3J. ZAPALENIE JĄDRA I NAJĄDRZA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3J.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78
3J.2. Epidemiologia, etiologia i patofizjologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80
3J.3. Klasyfikacja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80
3J.4. Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80
3J.4.1. Diagnostyka różnicowa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80
3J.5. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
3K. ZGORZEL (GANGRENA) FOURNIERA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
3K.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
3K.2. Rozpoznanie/Diagnostyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
3K.2.1. Mikrobiologia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
3K.3. Postępowanie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81
3L. CHOROBY PRZENOSZONE DROGĄ PŁCIOWĄ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82
3M. ZAKAŻENIA SPECYFICZNE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82
3M.1. Gruźlica urogenitalna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 82
3M.2. Bilharcjoza (schistosomatoza) urogenitalna . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 83
3N. OKOŁOOPERACYJNA PROFILAKTYKA ANTYBIOTYKOWA
W ZABIEGACH UROLOGICZNYCH . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 83
3N.1. Wstęp . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 83
3N.1.1. Cele okołooperacyjnej profilaktyki przeciwbakteryjnej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85
3N.2. Czynniki ryzyka . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 85
3N.3. Zasady profilaktyki antybiotykowej . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86
3N.3.1. Ramy czasowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86
3N.3.2. Droga podania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86
3N.3.3. Czas trwania . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86
3N.3.4. Wybór antybiotyku . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86
3N.3.5. Schematy profilaktyki antybiotykowej w określonych procedurach urologicznych . . . . . . . . . . . . . . . . . 87
3N.4. Profilaktyka antybiotykowa w określonych procedurach urologicznych . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87
3N.4.1. Procedury diagnostyczne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87
3N.4.1.1. Przezodbytnicza biopsja gruboigłowa stercza . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87
3N.4.1.2. Cystoskopia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 89
3N.4.2. Zabiegi endourologiczne (wejście do dróg moczowych) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.2.1. Przezcewkowe usunięcie pęcherza moczowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.2.2. Przezcewkowa resekcja gruczołu krokowego . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.2.3. Ureteroskopia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.2.4. Przezskórna nefrolitotrypsja . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.2.5. Litotrypsja zewnątrzustrojową falą uderzeniową . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.3. Zabiegi laparoskopowe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 90
3N.4.4. Operacje otwarte lub laparoskopowe bez otwarcia dróg moczowych (czyste procedury) . . . . . . . . . . . . . . 90
3N.4.5. Operacje otwarte lub laparoskopowe z otwarciem dróg moczowych (procedury czyste-skażone) . . . . . . . . . 90
3N.4.6. Otwarte operacje urologiczne z użyciem segmentu jelita (procedury czyste-skażone lub skażone) . . . . . . . . 90
3N.4.7. Pooperacyjny drenaż dróg moczowych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 91
3N.4.8. Implantacja protez . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 91
4. DODATEK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 91
4.1. Kryteria diagnostyczne zakażeń układu moczowego zmodyfikowane zgodnie z zaleceniami
Amerykańskiego Towarzystwa Chorób Zakaźnych i Europejskiego Towarzystwa Mikrobiologii Klinicznej
i Chorób Zakaźnych (Naber i Adam, 1998; Scholz i Naber, 1999; Vogel i Bordmann, 2004) . . . . . . . . . . . . . . . . . . . . 91
4.2. Bakterie w zakażeniach urologicznych . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 92
4.3. Podsumowanie rekomendacji dotyczących terapii przeciwbakteryjnej w urologii . . . . . . . . . . . . . . . . . . . . . . . . 93
4.4. Rekomendacje dotyczące leczenia przeciwbakteryjnego w niewydolności nerek . . . . . . . . . . . . . . . . . . . . . . . . . 94
4.5. Substancje antybakteryjne . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 96
5. PIŚMIENNICTWO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 97
6. KONFLIKT INTERESÓW . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 108
WSTĘP
1.1. Cel
Celem „Rekomendacji dotyczących postępowania w zakażeniach
układu moczowego” jest dostarczenie zarówno
urologom, jak i lekarzom innych specjalności wytycznych
medycyny opartej na dowodach naukowych (EBM,
ang. evidence based medicine) dotyczących leczenia i profilaktyki
zakażeń układu moczowego (ZUM, ang. urinary
tract infections). Wytyczne te obejmują zakażenia męskich
i żeńskich dróg moczowych, infekcje męskich narządów
płciowych oraz tematy takie jak ZUM w urologii pediatrycznej
i czynniki ryzyka (np. immunosupresja, niewydolność
nerek i cukrzyca). Dużo uwagi poświęca się
okołozabiegowej profilaktyce antybiotykowej, dążąc do
zmniejszenia nadużywania antybiotyków. Zachęcamy do
prowadzenia wysokiej jakości badań klinicznych według
ścisłych uznanych międzynarodowo definicji i klasyfikacji
przedstawionych w niniejszych rekomendacjach
1.2. Historia publikacji
PPierwotne wytyczne dotyczące zakażeń układu moczowego
i infekcji męskiego układu rozrodczego po raz
pierwszy opublikowane zostały w Rekomendacjach
Europejskiego Towarzystwa Urologicznego (EAU, ang.
European Association of Urology) w 2001 r. oraz w czasopiśmie
„European Urology”
(Naber i wsp., 2001a).
(Naber i wsp., 2001a).
Druga zaktualizowana
wersja została włączona do Rekomendacji
EAU w 2006 r. Podręcznik EAU/ICUD (Europejskie
Towarzystwo Urologiczne / Międzynarodowe konsultacje
chorób urologicznych, ang. European Association of Urology
/ International Consultation on Urological Diseases) na temat
infekcji układu moczowo-płciowego
(Naber i wsp., 2010),
który zgromadził prace światowych ekspertów w tej dziedzinie,
został opublikowany w 2010 r. i stał się publikacją
referencyjną dla obecnych wytycznych. Niektóre
rozdziały zostały następnie ponownie napisane i zaktualizowane
w latach 2011–2013 (np. klasyfikacja ZUM,
nieskomplikowane ZUM, sepsa/posocznica, bakteryjne
zapalenie gruczołu krokowego i profilaktyka antybiotykowa).
Wytyczne obejmujące szczególne schorzenia
układu moczowo-płciowego były również kilkukrotnie
publikowane i wielokrotnie cytowane
(Bichler i Savatovsky,2006; ).
( Çek i wsp., 2005;).
(Schneede i wsp., 2003).
Zmodyfikowana klasyfikacja ZUM była wprowadzana
stopniowo i w obecnych wytycznych określenie poziomu
anatomicznego i stopnia ciężkości zakażenia, zaprezentowane
poglądowo na rycinie 1, służą jako podstawa
struktury tego rozdziału. Został wprowadzony nowy
rozdział (rozdział 3B.) na temat bezobjawowego bakteriomoczu
(ABU, ang. asymptomatic bacteriuria), w celu
podkreślenia znaczenia unikania nadmiernego leczenia
przeciwbakteryjnego w przypadku kolonizacji komensalem.
Czynniki ryzyka i czynniki komplikujące ZUM
zostały przedstawione w rozdziale 3C. poświęconym
zapaleniom pęcherza moczowego i odmiedniczkowemu
zapaleniu nerek. Tekst został znacząco skrócony, tak aby
pozostały tylko kluczowe informacje, a także ponownie
sformatowany według wzoru rekomendacji EAU dotyczących
wytycznych nieonkologicznych, tak aby wszystkie
wytyczne pozostawały w podobnym formacie. Dokument
ten został poddany weryfikacji przed publikacją.
Standardowa procedura w przypadku wytycznych
EAU obejmuje roczną ocenę nowo opublikowanej literatury
w zakresie urologii, która prowadzi do przyszłych
aktualizacji. Krótszy dokument „Pocket Guidelines” jest
również dostępny zarówno w formie drukowanej, jak
i w postaci aplikacji dla urządzeń mobilnych. Wersje
te są skrócone i dlatego mogą wymagać porównania
z pełną wersją Rekomendacji. Wszystkie rekomendacje
są dostępne na stronie internetowej EAU:
http://www.uroweb.org/guidelines/online-guidelines/.
1.3. Skład panelu specjalistów opracowujących
rekomendacje
Panel specjalistów opracowujących rekomendacje składa
się z grupy urologów specjalizujących się w leczeniu ZUM
i infekcjach męskich narządów płciowych.
1.4. Podstawowe informacje
Zakażenia układu moczowego należą do jednych z najczęściej
występujących chorób zakaźnych, znacznie obciążających
społeczeństwo finansowo. W USA zakażenia
układu moczowego są powodem ponad 7 mln wizyt lekarskich
rocznie
(Foxman, 2002).
W celu ich leczenia przepisywanych
jest ok. 15% z wszystkich zaordynowanych
antybiotyków
(Mazzulli, 2002).
Dane z niektórych krajów
europejskich wskazują na podobny współczynnik
(UVI,2007).
W USA ZUM stanowią więcej niż 100 000 hospitalizacji
rocznie, najczęściej z powodu odmiedniczkowego
zapalenia nerek
(Foxman, 2002).
Dane te nie uwzględniają
powikłanego ZUM związanego z pacjentami urologicznymi,
których częstość występowania nie jest znana.
Zakażenia układu moczowego stanowią co najmniej
40% wszystkich nabytych zakażeń szpitalnych i w większości
przypadków są związane z cewnikowaniem
(Rüden i wsp., 1997).
(Rüden i wsp., 1997).
Bakteriuria rozwija się u do 25% pacjentów,
u których wymagane jest utrzymywanie cewnika dopęcherzowego
przez tydzień lub więcej z dobowym ryzykiem
na poziomie 5–7%
(Maki i Tambyah, 2001; ).
(Tambyach i wsp., 2010).
W ostatnim czasie badania na temat globalnego
występowania zakażeń urologicznych (GPIU,
ang. global prevalence infection in urology) wykazały, że
10–12% pacjentów hospitalizowanych na oddziałach
urologicznych nabywa infekcje związane z opieką zdrowotną.
Szczepy wyhodowane od tych pacjentów są jeszcze
bardziej lekooporne
((Bjerklund Johansen i wsp., 2007).).
1.4.1. Rozwój oporności bakteryjnej
Obecny stan rozwoju oporności drobnoustrojów na antybiotyki
jest alarmujący
(Carlet i wsp., 2011).
Stosowanie
antybiotyków w różnych krajach europejskich odzwierciedla
globalny wzrost szczepów opornych
(Gyssens,2011).
Obecność bakterii wytwarzających rozszerzone
spektrum β-laktamaz (ESBL, ang. extended-spectrum betalactamases),
wykazujących odporność na większość antybiotyków
z wyjątkiem karbapenemów, stale wzrasta
(Oteo i wsp., 2010b).
Jeszcze bardziej niepokojące są ostatnie
doniesienia z wszystkich kontynentów na temat pojawiania
się i wzrostu częstotliwości występowania różnych
organizmów wytwarzających karbapenemazy, co czyni
je opornymi nawet na tę grupę antybiotyków.
Szczególnie kłopotliwe jest zwiększenie oporności
na antybiotyki o szerokim spektrum działania, takie jak
fluorochinolony
i cefalosporyny, ze względu na nadmierne
stosowanie tych dwóch grup antybiotyków oraz równoległy
rozwój krzyżowej oporności na inne antybiotyki
(Cassier i wsp., 2011).
Jest to szczególnym zagrożeniem
dla pacjentów poddawanych zabiegom urologicznym,
a w szczególności dla mężczyzn poddawanych biopsji
gruczołu krokowego.
Dlatego konieczne jest zwrócenie bacznej uwagi na tę
groźbę. W najbliższych 5–10 latach oczekiwać możemy
tylko kilku nowych antybiotyków. Racjonalne stosowanie
już dostępnych antybiotyków jest jedyną opcją opóźniania
rozwoju oporności bakteryjnej
(Gyssens, 2011)
–
społeczność urologiczna ma obowiązek uczestniczyć w tej
walce. Istotne jest, aby wziąć pod uwagę lokalne środowisko
mikrobiologiczne i wzór oporności, a także czynniki
ryzyka wyhodowania opornych bakterii u poszczególnych
pacjentów.
Rozwój oporności bakteryjnej jest zagrożeniem dla:
yy leczenia zakażeń układu moczowego,
yy profilaktyki okołooperacyjnej w chirurgii
urologicznej.
Istnieje bezpośredni związek pomiędzy stosowaniem
antybiotyków i rozwojem oporności bakteryjnej.
Istnieje pilna potrzeba zwalczania rozwoju oporności
bakteryjnej poprzez racjonalne stosowanie dostępnych
antybiotyków.
1.4.2. Patogeneza zakażenia układu moczowego
Mikroorganizmy mogą dotrzeć do dróg moczowych
drogą krwiopochodną lub limfatyczną, ale są liczne kliniczne
i eksperymentalne dowody na to, że najczęstszym
szlakiem jest wstępowanie mikroorganizmów z cewki
moczowej, co prowadzi do zakażenia dróg moczowych,
zwłaszcza bakteriami pochodzenia jelitowego (np.
Escherichia coli i inne Enterobacteriacae). Zapewnia to
logiczne wytłumaczenie większej częstości ZUM u kobiet
niż u mężczyzn oraz zwiększonego ryzyka zakażenia po
cewnikowaniu lub instrumentacji pęcherza moczowego.
Jednorazowa instalacja cewnika do pęcherza moczowego
u pacjentów ambulatoryjnych powoduje ZUM w 1–2%
przypadków. Stała obecność cewnika z systemem otwartego
drenowania powoduje bakteriomocz w prawie 100%
przypadków w ciągu 3–4 dni. Zastosowanie systemów
zamkniętego drenowania, takich jak zastawka zapobiegająca
przepływowi wstecznemu, opóźnia wystąpienie
infekcji, ale ostatecznie jej nie zapobiega. Uważa się, że
migracja bakterii w przestrzeni między cewką moczową
a cewnikiem prowadzi do rozwoju bakteriomoczu
u prawie wszystkich pacjentów w ciągu ok. 4 tyg.
Krwiopochodne ZUM jest ograniczone do kilku stosunkowo
rzadko występujących mikroorganizmów, takich
jak Staphylococcus aureus, Candida spp., Salmonella Sp.
i Mycobacterium tuberculosis, które powodują pierwotne
zakażenia w innych częściach ciała. Candida albicans
często powoduje klinicznie objawowe ZUM poprzez
drogę krwiopochodną, jakkolwiek również jest rzadką
przyczyną infekcji wstępującej, przy obecnym cewniku
lub po antybiotykoterapii.
Pojęcie zjadliwości bakteryjnej lub patogeniczności
w drogach moczowych odnosi się do faktu, że
nie wszystkie gatunki bakterii są jednakowo zdolne do
wywoływania infekcji. Im bardziej zagrożone są naturalne
mechanizmy obronne (przeszkoda w drogach
moczowych lub cewnikowanie pęcherza moczowego),
tym mniejszy poziom wirulencji szczepu bakteryjnego
jest konieczny do wywołania infekcji. Potwierdzeniem
tego jest dobrze udokumentowana obserwacja in vitro
wskazująca, że bakterie izolowane od pacjentów z powikłanym
ZUM często nie wykazują wysokiej wirulencji.
Koncepcja wirulencji sugeruje także, że niektóre szczepy
bakterii w obrębie gatunku są wyjątkowo wyposażone
w wyspecjalizowane czynniki wirulencji, np. różne
rodzaje fimbrii i pilii, które umożliwiają wstępowanie
bakterii z flory kału, przedsionka pochwy lub okolic
ujścia zewnętrznego cewki moczowej do pęcherza, skąd
mogą też osiągnąć nerki i wywołać zapalenie ogólnoustrojowe.
1.4.3. Badania laboratoryjne i mikrobiologiczne
Istotnym do rozpoznania ZUM jest miano bakterii. Kass
(1960) opracował koncepcję znamiennej bakteriurii – >10⁵
jednostek tworzących kolonie (cfu, ang. colony forming
unit) w 1 mL – w kontekście odmiedniczkowego zapalenia
nerek w ciąży. Pojęcie to wprowadziło mikrobiologię
ilościową w diagnostyce chorób zakaźnych. Dopiero od
niedawna stało się jasne, że nie ma sztywnie ustalonego
miana bakterii wskazującego na znaczącą bakteriurię,
które może być zastosowane do wszystkich rodzajów
ZUM i we wszystkich przypadkach
(Hooton i wsp., 2013).
Jak opisano w dodatku 4.1., następujące miana bakterii
są klinicznie istotne:
≥10³ cfu/mL uropatogenów w próbce moczu ze środkowego
strumienia (MSU, ang mid-stream sample of
urine) w niepowikłanym ostrym zapaleniu pęcherza
moczowego u kobiet,
≥10⁴ cfu/mL uropatogenów w MSU w ostrym niepowikłanym
odmiedniczkowym zapaleniu nerek
u kobiet,
≥10⁵ cfu/mL uropatogenów w MSU u kobiet lub
≥10⁴ cfu/mL uropatogenów w MSU u mężczyzn lub
w próbce moczu z cewnika u kobiet w powikłanym
ZUM.
W próbce moczu pobranej z nakłucia nadłonowego
każde miano bakterii jest istotne. Problemy pojawiające
się przy znikomej bakteriurii muszą być jednak brane
pod uwagę. Jeśli korzystamy z dawki zakażającej (ang.
inoculum) w ilości 0,1 mL moczu i 10 identycznych kolonii
jest niezbędnych dla znamienności statystycznej, to przy
tych parametrach najniższe miano uropatogenów będzie
wynosiło 100 cfu/mL. Bakteriurię bezobjawową rozpoznajemy,
gdy dwukrotnie wyhodowano ten sam szczep
bakterii (w większości przypadków jedynie gatunki są
rozpoznane) w mianie ≥10⁵ cfu/mL w 2 próbkach pobranych
w odstępie >24 godz.
Oczywistym jest, że mogą występować różnice wynikające
ze sposobu pobierania próbki moczu, hodowli drobnoustrojów
i jakości badań laboratoryjnych. Należy zatem
stosować dwa poziomy standardów. Standard podstawowy
jest niezbędny do rutynowej oceny, podczas gdy
standardy podwyższone są wymagane do oceny naukowej
oraz w okolicznościach szczególnych, np. gorączka niewiadomego
pochodzenia u pacjentów z obniżoną odpornością.
W badaniach naukowych niezbędne jest doprecyzowanie
metod pobierania próbek, takich jak np. okres
utrzymywania moczu w pęcherzu – parametry te muszą
być brane pod uwagę i dokładnie rejestrowane.
W rutynowej ocenie klinicznej kilka podstawowych
kryteriów musi być branych pod uwagę przed postawieniem
zasadniczego rozpoznania, w tym:
objawy kliniczne,
wyniki wybranych badań laboratoryjnych: krwi,
moczu, wydzieliny gruczołu krokowego (EPS, ang.
expressed prostatic secretion),
dowody obecności mikroorganizmów uzyskane
poprzez posiewy lub w wyniku innych specyficznych
testów.
Większość z tych badań może być wykonana
w każdym laboratorium. Należy jednak pamiętać, że
stosowane metody badań mikrobiologicznych i definicje
muszą przestrzegać akceptowanych norm w odniesieniu
do transportu próbki, identyfikacji patogenu oraz
lekowrażliwości. Metody i definicje mikrobiologiczne
mogą się różnić między krajami i instytucjami. Jednym
z takich przykładów jest klasyfikacja granicznej wrażliwości
na patogeny. Ważne jest, aby zgłosić nie tylko
wyniki, ale także zastosowane metody i standardy, takie
jak wyznaczone przez Europejski Komitet Wrażliwości na
Środki Przeciwdrobnoustrojowe (EUCAST, ang. European
Committee for Antimicrobial Susceptibility Testing)
(EUCAST,2000a)
(EUCAST, 2000b)
lub Narodowy Komitet Standardów
Klinicznych dla Badań Laboratoryjnych (NCCLS, ang.
National Committee for Clinical Laboratory Standards)
(NCCLS, 2004).
Mieszanie wyników uzyskanych za
pomocą różnych metod (np. różnice oporności bakterii)
może być problematyczne i wymagać dokładnej interpretacji.
Badania histopatologiczne wykazują czasem
obecność nieswoistego stanu zapalnego. Tylko w niektórych
przypadkach – np. zapalenie gruczołu krokowego
u pacjentów, którzy mają podwyższony poziom antygenu specyficznego dla prostaty (PSA, ang. prostate
specific antigen) – takie wyniki badań mogą pomóc w ustaleniu
odpowiedniego leczenia. Natomiast w wybranych
stanach zapalnych, takich jak gruźlica czy promienica,
wyniki badania histopatologicznego mogą być niezbędne
do postawienia rozpoznania. Na ogół jednak badania
histologiczne są niezbyt przydatne do podejmowania
decyzji terapeutycznych
METODOLOGIA
Podręcznik EAU/ICUD na temat ZUM
(Naber i wsp.,2010),
o którym mowa w rozdziale 1.2., powstał w oparciu
o usystematyzowany przegląd literatury. Każdy rozdział
powstał pod przewodnictwem jednego eksperta i kilku
współautorów. Dostępne przeglądy systematyczne, metaanalizy
oraz wysokiej jakości artykuły przeglądowe i kontrolowane
badania służyły jako odniesienia w każdym
rozdziale, a rekomendacje przeszły przez wnikliwe konsultacje.
Kryteria dowodów i zalecenia dostosowano do
stosowanych w innych wytycznych EAU i zawartych
w kolejnych aktualizacjach niniejszych rekomendacji
w latach 2011–2013. Następnie zalecenia zostały dostosowane
na podstawie rocznej oceny nowo opublikowanej
literatury w tej dziedzinie urologii.
Nowe wytyczne na temat ABU (rozdział 3B.) oparte
są na usystematyzowanym przeszukiwaniu baz artykułów
naukowych przy użyciu określenia „bezobjawowa
bakteriuria”. Panel wybrał opinie, metaanalizy i badania
z randomizacją (ang. randomised controlled trial) i przypisał
do odpowiednich grup pacjentów.
Należy podkreślić, że wytyczne przedstawiają najlepsze
dostępne dane. Oczekuje się, że postępowanie
zgodne z tymi wytycznymi doprowadzi do najkorzystniejszego
rezultatu. Jednakże wytyczne nie zastępują
doświadczenia klinicznego, gdy podejmowane są decyzje
co do leczenia indywidualnego pacjenta. Wytyczne
jedynie pomagają podejmować te decyzje. Przy podejmowaniu
decyzji trzeba również brać pod uwagę wartości
i preferencje uznawane przez pacjentów oraz indywidualne
okoliczności.
Referencje użyte w tekście zostały ocenione zgodnie
z ich poziomem wiarygodności dowodu naukowego (LE,
ang. level of evidence), a zalecenia zostały sklasyfikowane
według stopni rekomendacji (GR, ang. grade of recommendation),
zgodnie z systemem klasyfikacji zaadoptowanym
z Oksfordzkiego Centrum ds. oceny poziomu
dowodów naukowych w medycynie (ang. Oxford Centre
for Evidence‑Based
Medicine Levels of Evidence) (Phillips
i wsp., 2009). Celem klasyfikacji według GR jest zapewnienie
przejrzystości między dowodami i podanymi
zaleceniami.
W rekomendacjach EAU z 2015 r. wszystkie standardowe
informacje o LE i GR zostały wycofane z poszczególnych
rozdziałów wytycznych w celu uzyskania ich
zwięzłości.

WYTYCZNE
3A. KLASYFIKACJA ZAKAŻEŃ
UKŁADU MOCZOWEGO
3A.1. Wstęp
Poniższe wytyczne obejmują ZUM oraz zakażenia
męskich dodatkowych gruczołów płciowych (MAGI,
ang. male accessory gland infection) – oba rodzaje infekcji
są ściśle ze sobą związane u mężczyzn. Rozdziały 3A–H
dotyczą ZUM, a rozdziały 3I–K odnoszą się do MAGI.
Tradycyjnie ZUM są klasyfikowane na podstawie objawów
klinicznych, badań laboratoryjnych i wyników mikrobiologicznych.
W celach praktycznych ZUM podzielono
na niepowikłane i powikłane oraz zespół uogólnionej
reakcji zapalnej (urosepsa). Ten model klasyfikacji jest
instrumentem przydatnym w codziennej praktyce lekarskiej,
jak również w badaniach klinicznych. Krytyczny
przegląd obecnych klasyfikacji przeprowadzono z inicjatywy
EAU/ICUD
(Bjerklund Johansen i wsp., 2011)
– dodatek 4.1. Ogólnym celem jest zapewnienie klinicyście
i badaczowi standaryzowanych narzędzi i nomenklatury
ZUM. Niniejsze wytyczne dają krótkie podsumowanie
wstępnego udoskonalenia systemu klasyfikacji ZUM na
podstawie:
yy podziału anatomicznego,
yy stopnia ciężkości zakażenia,
yy czynników ryzyka,
yy wyników badań mikrobiologicznych.
Objawy kliniczne i wyniki badań laboratoryjnych
koncentrują się na poziomie anatomicznym i stopniu
nasilenia infekcji. Analiza czynników ryzyka przyczynia
się do określenia możliwości zastosowania dodatkowego
środka terapeutycznego (np. drenażu).
3A.1.1. Podział anatomiczny
Objawy (dodatek 4.1.) koncentrują się na anatomicznym
poziomie infekcji:
yy cewka moczowa: zapalenie cewki moczowej (UR, łac.
urethritis),
yy pęcherz moczowy: zapalenie pęcherza moczowego
(CY, łac. cystitis),
yy nerka: odmiedniczkowe zapalenie nerek (PN, łac.
pyelonephritis),
yy krew: urosepsa (US – łac. urosepsis).
Rycina 1 ilustruje podstawową strategię diagnostyki
i leczenia ZUM. Zapalenie cewki moczowej jako słabo
poznane nie zostało obecnie wzięte pod uwagę. Również
MAGI, zapalenie jąder, zapalenie najądrza oraz zapalenie
gruczołu krokowego nie zostały ocenione.
Bezobjawowy bakteriomocz powinien być brany pod
uwagę jako szczególna jednostka, ponieważ może mieć
swoje źródło zarówno w dolnych, jak i górnych drogach
moczowych i nie wymaga leczenia, dopóki pacjent nie
jest poddawany urologicznej interwencji chirurgicznej
lub jest w ciąży.
3A.1.2. Stopień ciężkości zakażenia
Stopień ciężkości zakażenia wyrażony jest w skali 1–6
i jest związany z różnym ryzykiem zgonu (rycina 1).
3A.2. Patogeny
Posiew moczu zazwyczaj pozwala zidentyfikować czynnik
chorobotwórczy (>10⁴ cfu/mL) i jego wrażliwość. Obie
cechy mogą być wprowadzone do końcowej klasyfikacji
klinicznej fazy zakażenia. Stopień wrażliwości jest zdefiniowany
od klasy a (wrażliwy) do c (oporny). Lista najczęstszych
patogenów znajduje się w dodatku 4.2.
3A.3. Systemy klasyfikacji zakażeń
układu moczowego
Na rycinie 2 zestawiono parametry, które tworzą poszczególne
klasy ZUM.
Poprzez zebranie różnych parametrów ZUM można
podzielić w następujący sposób
(Bjerklund Johansen i wsp.,2011)
(przykłady):
yy CY-1R: Escherichia coli: nieskomplikowane zapalenie
pęcherza moczowego z powtarzającą się wrażliwością
na standardowe antybiotyki,
.png)
 PN-3U: Klebsiella pneumoniae: ciężkie odmiedniczkowe
zapalenie nerek (z wysoką gorączką i wymiotami)
związane z chorobą urologiczną (np. kamica lub niedrożność)
wywołane przez Klebsiella sp. o umiarkowanym
profilu oporności,
PN-3U: Klebsiella pneumoniae: ciężkie odmiedniczkowe
zapalenie nerek (z wysoką gorączką i wymiotami)
związane z chorobą urologiczną (np. kamica lub niedrożność)
wywołane przez Klebsiella sp. o umiarkowanym
profilu oporności,
US-5C: Enterococcus sp.: ciężka urosepsa wywołana
wrażliwym na antybiotyki Enterococcus sp. u pacjenta
z założonym na stałe cewnikiem.
3B. BEZOBJAWOWY BAKTERIOMOCZ (BAKTERIURIA) U DOROSŁYCH
3B.1. Wstęp
Obecność ABU jest powszechna i odpowiada kolonizacji
komensalicznej
(Lutay i wsp., 2013).
Badania kliniczne
wykazały, że ABU może chronić przed nadkażeniem
objawowym ZUM. Tak więc leczenie ABU powinno być
wdrażane tylko w przypadku udowodnionej korzyści dla
pacjenta, unikając ryzyka wyselekcjonowania szczepu
opornego na środki przeciwdrobnoustrojowe i zwalczenia
potencjalnie ochronnego szczepu ABU
(Cai i wsp., 2012;).
Hansson i wsp., 1989
Celem tych wytycznych jest pomoc
lekarzom w podjęciu decyzji, czy ABU należy leczyć, czy nie.
3B.2. Metody
Wytyczne w sprawie ABU są oparte na usystematyzowanym
przeszukiwaniu artykułów naukowych z użyciem
terminu „bezobjawowa bakteriuria”. Panel specjalistów
wybrał opinie, metaanalizy i badania kliniczne z randomizacją,
przypisane do różnych grup pacjentów omówionych
w wytycznych.
3B.3. Epidemiologia, etiologia i patofizjologia
Bezobjawowy bakteriomocz występuje u ok. 1–5% zdrowych
kobiet w okresie przedmenopauzalnym, zwiększa
się do 4–19% u zdrowych starszych kobiet i mężczyzn,
0,7–27% u pacjentów z cukrzycą, 2–10% u kobiet w ciąży,
15–50% w populacji zinstytucjonalizowanych osób starszych
i 23–89% u pacjentów z urazami rdzenia kręgowego
(Nicolle i wsp., 2005).
U młodszych mężczyzn ABU występuje
rzadko, a po jego wykryciu należy brać pod uwagę
przewlekłe bakteryjne zapalenie gruczołu krokowego.
Spektrum bakterii ABU jest podobne do gatunków wywołujących
zarówno niepowikłane, jak i złożone/powikłane
ZUM, zależnie od obecności innych czynników ryzyka
(rozdział 3A., C. i D.)
3B.4. Badania diagnostyczne
Bezobjawowy bakteriomocz, w którym wykazano obecność
bakterii w mianie >105 cfu/mL w dwóch kolejnych
próbkach moczu pobranych ze środkowego strumienia
u kobiet
(Kass, 1956),
a w jednej próbce u mężczyzn bez
występowania objawów ze strony układu moczowego
(Gleckman i wsp., 1979).
Obecność bakterii o mianie
102 cfu/mL w moczu pobranym podczas jednorazowego
cewnikowania jest również wystarczająca do
rozpoznania ABU
(Nicolle i wsp., 2005; ).
(Warren i wsp., 1982b).
Postępowanie diagnostyczne powinno obejmować
określenie objętości zalegającego moczu po
mikcji w cystoskopii i/lub poprzez obrazowanie dolnych
dróg moczowych, lecz nie jest postępowaniem obowiązkowym
w przypadku ujemnego wywiadu (LE: 4,
GR: A). Wykazanie stałej obecności bakterii wytwarzających
ureazę, takich jak Proteus mirabilis, jest wskazaniem
do wykluczenia kamicy dróg moczowych (Kunin,
1997). U mężczyzn należy wykonać badanie przezodbytnicze
(DRE, ang. digital rectal examination) prostaty
celem wykluczenia chorób gruczołu krokowego, w tym
przewlekłego bakteryjnego zapalenia gruczołu krokowego
(rozdział 3I.).
3B.5. Sposoby postępowania
3B.5.1. Pacjenci bez zidentyfikowanych
czynników ryzyka
Bezobjawowy bakteriomocz nie powoduje chorób nerek
lub ich uszkodzenia
(Tencer, 1988).
Retrospektywne
badania populacji dzieci i kobiet wykazały, że leczenie
ABU zwiększa ryzyko późniejszego objawowego ZUM
w porównaniu do nieleczonych grup kontrolnych (Cai
i wsp., 2012; Hansson i wsp., 1989). Reasumując – badania
przesiewowe i leczenie ABU nie jest zalecane u pacjentów
(kobiety i młodzi mężczyźni) bez czynników ryzyka
(LE: 1B, GR: A).
3B.5.2. Pacjenci z bezobjawowym bakteriomoczem
i nawrotowymi zakażeniami układu
moczowego, poza tym zdrowi
Wykazano działanie ochronne spontanicznie występującego
ABU u kobiet z nawracającymi, objawowymi
ZUM i bez zidentyfikowanych czynników ryzyka
(Cai i wsp., 2012).
Dlatego leczenie ABU u kobiet z nawracającym,
objawowym ZUM nie jest zalecane (LE: 1b,
GR: A). Jednakże okresowa likwidacja szczepu będącego
czynnikiem sprawczym nawracających epizodów
ZUM może być uzasadniona (LE: 4, GR: C). U mężczyzn
z nawracającymi, objawowymi ZUM i ABU należy wziąć
pod uwagę przewlekłe bakteryjne zapalenie gruczołu
krokowego, a w przypadku potwierdzenia rozpoznania
należy włączyć leczenie (rozdział 3I.).
3B.5.3. Kobiety ciężarne
Bezobjawowy bakteriomocz jest częstym zjawiskiem
podczas ciąży (2–10%) i koreluje ze zwiększonym ryzykiem
wystąpienia objawowego ZUM i odmiedniczkowego
zapalenia nerek
(Nicolle i wsp., 2005).
Dowody na istnienie
związku pomiędzy ABU a porodami przedwczesnymi/
niską wagą urodzeniową są jednak słabe
(Smaill, 2007).
Badania przesiewowe i leczenie ABU u kobiet w ciąży są
zalecane przez wiele wytycznych, ale dowody na poprawę
wyników są nikłe (Kazemier i wsp., 2014). Dlatego ogólne
zalecenia nie są wdrażane, a w razie wątpliwości zaleca
się konfrontację z krajowymi wytycznymi dotyczącymi
kobiet ciężarnych.
